Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Проникновение лейкоцитов мышц кремастеров в мышах, оцениваемых внутривиталовой микроскопией
В этой статье
Резюме
Здесь мы покажем, как выполнять интравитальной микроскопии на пост-капиллярных венулей мыши кремастер мышцы. Обычно применяется к различным моделям воспаления и сепсиса, особенно те, вызванные хемокины и цитокины, мы подчеркиваем его актуальность в изучении мусколопатии с участием преувеличенных мышечных инфильтрации лейкоцитов.
Аннотация
Интравитальной микроскопии (IVM) широко используется для мониторинга физиологических и патофизиологических процессов в каскаде набора лейкоцитов in vivo. Текущий протокол представляет собой практический и воспроизводимый метод визуализации лейкоцитов эндотелия взаимодействия, ведущие к лейкоцитов вербовки в скелетных мышц производных тканей в нетронутом организме мыши. Модель применима ко всем областям исследований, которые сосредоточены на активации гранулоцитов и их роли в болезни.
Мы предоставляем пошагу протокол, чтобы провести метод и выделить потенциальные подводные камни и технические трудности. Протокол охватывает следующие аспекты: экспериментальные настройки и необходимый материал, анестезия мыши, вскрытие мышц кремастеров, а также трахеальная и сонная канистру, записи IVM и автономный анализ. Форматы данных, такие как лейкоциты адептов, подвижного потока (RF) и фракция подвижного потока (RFF), подробно разъясняются и обсуждаются соответствующие приложения. Представитель результаты от дистрофин дефицитных мышей mdx приведены в разделе результатов.
IVM является мощным инструментом для оценки набора лейкоцитов в условиях in vivo; однако, разграничение, например, эндотелиальной и лейкоцитной функции может потребовать сяковики с ex vivo установки, как поток камеры экспериментов. Кроме того, генетическое происхождение интересующих животных может значительно повлиять на базовый набор, требуя индивидуальной тонкой настройки предусмотренного протокола. Несмотря на свои ограничения, IVM может служить платформой для легкого перевода в пробирке выводы в живой позвоночный организм.
Введение
Интравитальной микроскопии (IVM) является широко применяется инструмент в области биологии лейкоцитов. Leukocyte вербовки следует каскад четко определенных событий, инициированных лейкоцитов захвата, прокатки и прилипания к эндотелиальной стенки, и, наконец, трансмиграции и экстравазации лейкоцитов на фактическое место воспаления1. Каждый шаг опосредовано и контролируется различными хемокинами (например, IL-8/CXCL8), рецепторами (например, LFA-1, Mac-1) и соответствующими молекулами эндотелиальных клеток (например, ICAM-1, VCAM-1 и E-Selectin)2,3. Взаимодействие различных регуляторных сайтов, контролирующих факторов и посредников каскада набора лейкоцитов, таких как рецептор передовых гликовых конечных продуктов (RAGE), межклеточная молекула адгезии 1 (ICAM-1), C-X-C мотив лиганд (CXCL)1/2 и их рецептор CXCR2 были обнаружены с помощью IVM4,,6,77,89.
Метод IVM был описан для многих различных органов и тканей, таких как кишечник10, кожа11,лимфатические узлы12, эмбриональный желток мешок13 и другие. Однако наиболее широко изученным методом IVM является модель кремастерства, впервые описанная у крыс14. Хотя до сих пор используется в крысах15, метод в настоящее время в основном применяется у мышей из-за высокого изобилия различных трансгенных линий. Наша группа недавно подчеркнул потенциальную роль крематер IVM в области воспалительных muscolopathies как мышечная дистрофия Дюшенна (DMD) изучения дистрофии дефицита mdx мышей16. Из-за своей тонкой переплетенной и легко доступной волоконной композиции, мышца кремастеров представляет собой идеальную мышцу кандидата, которая будет изучена в целом с помощью легкой или флуоресцентной микроскопии. Leukocyte вербовки и экстравазации в основном происходят в пост-капиллярных венцев, которые могут быть легко определены на непрерывном мышечном слое в мышце кремастера.
Преимуществом in vivo изображений по сравнению с другими анализами in vitro является ее биологический контекст в живом организме. В то же время, разграничение клеток конкретных взносов на измененный набор лейкоцитов может потребовать дополнительных моделей в пробирке, как поток камер или эндотелиальных анализов. Сочетание нескольких методов даст наиболее убедительные данные. Ученые должны знать об ограничениях модели кремастеров, так как любые хирургические манипуляции приведут к увеличению торговли лейкоцитами и вербовке. Таким образом, базовый набор трудно оценить с помощью этого метода. Несмотря на широкое применение, IVM кремастер может быть сложной задачей и новая установка может занять время и ресурсы, чтобы установить. Теперь мы предоставляем простой протокол, который поможет избежать некоторых распространенных ошибок в IVM. Кроме того, ограничения будут обсуждаться и бесплатные методы будут выделены, где это применимо.
IVM кремастера представляет собой идеальный подход, который должен быть реализован в области воспалительных и инфекционных исследований. В частности, модель кремастеров может представлять большой интерес для ученых, изучающих биологию скелетных мышц в контексте воспалительных заболеваний.
протокол
В IBF (Interfakult're Biomedizinische Forschungseinrichtung), Гейдельберге, животные размещались в контролируемых и специфических условиях без патогенов. Все описанные здесь процедуры были одобрены местным iRB и Regierungspraesidium Karlsruhe, Баден-Вюртемберг, Германия.
1. Администрация анестезии
- Анестезия мыши путем интраперитонеальной (т.п.) инъекции болиса 125 мг/кг кетамина и 12,5 мг/кг ксилазина.
- Поместите и зафиксите мышь в царском положении на грелке для поддержания температуры тела мыши (36,5-38 градусов по Цельсию). Используйте неабсорбируемый стерильный шов (6/0), чтобы обматыть простую петлю вокруг лобных зубов и засутять соединительные концы шва на грелку. Эта фиксация направлена на держать рот открытым, чтобы избежать нарушения дыхания.
- Проверьте мышь на наличие соответствующей глубины анестезии по межцифровой щепоткой ног (снятие не должно рассматриваться).
- После достижения достаточной анестезии переходите к хирургической подготовке. Неоднократно подтверждать анестезию вдоль текущего эксперимента каждые 30 минут. Повторное введение препаратов, как описано выше, если это необходимо.
- Равновесие физиологического солевого раствора (PSS, состав: 132 ммоль/l NaCl, 4,7 ммоль/л KCl, 1,2 ммоль/L MgS04, 2.0 ммоль/L CaCl2, 18 ммоль/L NaHCO3) с 5% CO2/95% N2 в течение 15 минут. Непрерывно пузырь PSS с 5% CO2/95% N2 на протяжении всего эксперимента и держать на 37 градусов по Цельсию.
2. Хирургическая подготовка трахеи и сонной артерии (по желанию)
- Вскрыть кожу из области шеи, осторожно потянув кожу с пинцетом в средней линии. Используйте ножницы для нанесения кругового разреза диаметром 1-2 см, чтобы дать достаточно места для хирургической подготовки.
- Тщательно вскрыть окружающие мышцы, жир и соединительные ткани с помощью пинцета.
- Сделайте поперечный разрез (1,3 мм) в трахею с помощью небольших хирургических ножниц и введите полиэтиленовую трубку (I.D x O.D. 0.034" x 0.050") внутри каудального конца трахеи, чтобы обеспечить верхние дыхательные пути.
- Зафиксировать трубку, расположенную в трахеее, одним круглым узлом шов (6/0 USP).
- Найдите сонную артерию вдоль правой стороны трахеи и вскрыть окружающие ткани от стенки сонной артерии. Кроме того, яремная или также хвостовая вена может быть использована для i.v. доступа. Старайтесь избегать травмы нерва, так как он расположен близко.
- Пройдите два куска шва (6/0) под сонную артерию. Поместите первый черепный шов проксимальной, близко к бифуркации сонных артерий и связать его постоянно. Второй шов будет расположен примерно на 5-8 мм дистальота от первого, а затем будет использоваться для обеспечения трубки в сонной артерии. Не связывайте его еще.
- Приготовьте полиэтиленовую трубку (I.D x O.D. 0.011" x 0.024) длиной 30 см, сгибая конечную часть к игле шприца 1 мл, наполненной солевой (0,9% NaCl). Строгий промывка важно для предотвращения эмболизации воздуха во время подготовки.
- Используйте 7-мм зажим для зажима сонной артерии, дистаждеющее второго шва.
- Выполните небольшой поперечный разрез (0,5 мм) в сонной артерии и введите стерильную полиэтиленовую трубку. Закрепите трубку в артерии, используя второй шов, подготовленный ранее.
- Снимите сосуд и аккуратно нанесите небольшое напряжение на шприц, подключенный к полиэтиленовой трубке. Этот сонотидный катетер теперь может быть использован для введения наркотиков или взять образцы крови, если это необходимо, даже мониторинг артериального давления или частоты пульса возможно с соответствующими устройствами.
3. Хирургическая подготовка кремастряторской мышцы
- Перенесите мышь на грелку (вместе с грелкой) в специально изготовленную пластиковую раму, удерживающую сцену для последующей микроскопии. Ориентируй мышь с мошонкой, обращенной к стадии микроскопа.
- Переоценка глубины анестезии перед началом; повторно вводить от четверти до половины дозы анестезии, если это необходимо.
- Локализуйте мошонку, удерживая ее в самой дистальной части с помощью пинцета, осторожно вытяните ее и отрежьте круговую секцию мошонки диаметром около 5 мм. Убедитесь в том, чтобы не повредить основные структуры, такие как мышцы кремастеров. Убедитесь в том, чтобы держать открытую ткань хорошо увлажненной с сольным раствором.
- Вскрыть свободную соединительную ткань с помощью двух пинцетов и локализовать оба яичка.
- Держите один тестис дистально и осторожно начать потянув его, удаление окружающих соединительной ткани шаг за шагом.
- Как только яичка экстерьеризирована, прикрепите его дистальный конец к резивому кольцу, окружающему сцену. После экстерьеризации, увлажнить ткань сольным раствором в течение всего процесса.
- Критический шаг: Тщательно удалите соединительную ткань, не нанося вреда основной мышце крематера. Избыточная соединительная ткань может препятствовать зрению в более поздней микроскопии и может производить размытые изображения.
- Прикрепите дистальную часть яичка вниз и откройте мышцу кремара небольшим поперечным разрезом (около 1 мм), за которым следует продольное разрез от самого дистального до проксимального конца. В результате кремамастерская мышца должна открываться сферически. Макроскопически видимый сосуд не должен быть разорван, так как это может повлиять на гемодинамику.
- Аккуратно распределите мышцу над стеклянной сценой и прикрепите к резивому кольцу. Убедитесь в том, чтобы не трогать или вредить центральной области, так как микроскопия будет проводиться здесь.
Внимание: Избыток растяжения может препятствовать кровотоку. - Прикрепите оставшиеся тесты в сторону, чтобы дать доступ к интересующей области. Убедитесь в том, чтобы смочить с PSS неоднократно, чтобы предотвратить сушки. Смонтированная мышца теперь готова к микроскопии.
4. Интравитальной микроскопии
- Поместите смонтированную мышцу кремастеров в вертикальном микроскопе и выполните микроскопию с использованием 40-x цели.
- Приобретение данных и экспорт с использованием высокой пропускной возможности спектрографии изображений.
- Выполняйте записи под непрерывным переливасом с разогретой (35-37 градусов по Цельсию) PSS17. Применить суперфузии небольшой трубки, которая была приклеена к вертикальной цели микроскопа, чтобы непрерывное капает PSS наряду с целью вниз на мышечную ткань.
- Определите посткапиллярные венули (слияние двух меньших сосудов) и измерьте микроциркуляцию на венах диаметром 20-40 мкм.
- Запись изображений микроциркуляции с высокой разрешения из мышцы кремастеров в диапазоне времени 30 с. Как может быть небольшое сокращение и расслабление мышечной ткани во время записи, убедитесь, что постоянно корректировать фокус. Как правило, мышь, как правило, демонстрируют стабильную циркуляцию в течение примерно 2 часов. Можно приобрести несколько записей различных судов из разных регионов. Один или оба яичка могут быть использованы впоследствии.
ПРИМЕЧАНИЕ: Поскольку это модель воспаления, распространенными способами индукции являются: системное применение или локальная инъекция мошонки про воспалительных посредников, а также переливание с, например, N-Formylmethionyl-leucyl-фенилаланин (fMLP). Местная стимуляция ТНФ-я обычно используется для запуска набора лейкоцитов; LPS-индуцированная эндотоксемия является моделью тяжелого системного воспаления SIRS.
5. Визуализация лейкоцитов
ПРИМЕЧАНИЕ: Приверженцы и подвижного лейкоцитов можно легко увидеть без дальнейшей визуализации. Для определения центральной линии скорости свободно движущихся лейкоцитов, выполняйте дифференциальное окрашивание.
- Если используются мыши с маркировкой eGFP, непосредственно проанализируйте их с помощью флуоресценции.
- Для не-eGFP помечены мыши штаммов, использование родеамина окрашивания.
- Администрирование родамина 6G при весе тела 0,2 мг/кг. Повторные дозы могут потребоваться для достижения достаточной интенсивности окрашивания. Убедитесь в том, чтобы сохранить небольшие объемы, так как большие объемы могут повлиять на гемодинамические параметры.
- Для мгновенного окрашивания лейкоцитов, управлять пятно через сонную артерию. Если вскрытие сонной артерии не выполнено, достаточное окрашивание может быть достигнуто путем применения i.p. с использованием той же дозы18. В качестве альтернативы катетеризации сонной артерии может быть выполнена любая другая венозная катетеризация.
ПРИМЕЧАНИЕ: Имейте в виду, что окрашивание родамина, в отличие от маркировки eGFP, показывает распад времени интенсивности флуоресценции, а также общее окрашивание максимум около 80% лейкоцитов при более высоких концентрациях. - Визуализируйте свободно движущиеся родаминовые окрашенные лейкоциты с помощью флуоресценции микроскопии.
6. Конец эксперимента
ПРИМЕЧАНИЕ: Общее расчетное время выполнения этого протокола должно составить 90 - 150 минут.
- Окончание эксперимента с эвтаназии путем вывиха шейки матки.
- Для дальнейшего анализа, таких как трансмиграция, исправить кремалист мышцы в ПФА в то время как еще растягивается на сцене и окрашенных для гистологии по мере необходимости.
7. Офлайн-анализ
- Проанализируйте следующие параметры по мере простого подсчета во время воспроизведения видео.
- Рассчитайте подвижной поток «число/мин»: количество катящихся ячеек, проходящих мнимую линию/мин
- Рассчитайте схватку «число/мм2»:количество клеток, прилипающих к стенке2сосуда в поле зрения, 30 с/сосудистой поверхности.
- Измерьте следующие гемодинамические и микрососудистые параметры, измеряемые с помощью ImageJ.
- Рассчитайте диаметр сосуда (мкм) в виде диаметра внутренней стены.
- Рассчитайте длину судна в качестве центральной линии длины судна.
- Рассчитайте
 скорость центральной линии, полученную от видеоанализа от кадра к кадру свободно движущихся лейкоцитов в центральной линии.
скорость центральной линии, полученную от видеоанализа от кадра к кадру свободно движущихся лейкоцитов в центральной линии.
- Используйте следующие уравнения в качестве оценки.
- Рассчитайте сосудистую поверхность в «мм2»:длина сосуда (мкм) х диаметр омов (мкм) х х 10-6.
- Рассчитайте
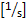 скорость сдвига стены : 4.9 x (8 x скорость линии центра
скорость сдвига стены : 4.9 x (8 x скорость линии центра  x 0.625/диаметр сосуда).
x 0.625/диаметр сосуда). - Рассчитайте среднее скорость
 кровотока : скорость центральной линии
кровотока : скорость центральной линии  x 0.625.
x 0.625. - Рассчитайте общий поток
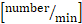 лейкоцитов :
лейкоцитов : 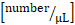 системный отсчет лейкоцитов x (средняя скорость кровотока
системный отсчет лейкоцитов x (средняя скорость кровотока  x 60/1000) x x
x 60/1000) x x 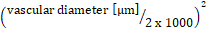 .
. - Рассчитайте фракцию подвижного потока (%): подвижной поток/общий поток лейкоцитов x 100.
Результаты
IVM в соответствии с предоставленным протоколом даст уникальную информацию о каскаде набора лейкоцитов в скелетных мышцах. В разделе результатов основное внимание будет уделено типичным результатам, полученным IVM, и выделены потенциальные проблемы, с которыми могут столкнуться.
Обсуждение
IVM как метод был широко использован для изучения различных типов клеток в различных органах и был широко описан и обсужден19. Основная цель этого исследования заключается в обеспечении эффективного подхода к настройке и выполнению IVM в мышцах кремастера. Практика метода да?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Это исследование было поддержано Федеральным министерством образования и исследований Германии (BMBF) 01GL1746E в рамках консорциума PRIMAL. Авторы признают Бритту Хекманн и Сильвию Пезер за умелую техническую помощь.
Материалы
| Name | Company | Catalog Number | Comments |
| Material | |||
| Ketanest S | Pfizer Pharma GmbH | PZN: 08509909 | anesthesia. Generic / IUPAC Name: ketamine |
| Xylazine | CP-Pharma GmbH | Article-nr.: 1205 | anesthesia. Generic / IUPAC Name: xylazine (as hidrochloride) |
| Saline Solution | B. Braun Melsungen | PZN 02737756 | surgical preparation. Generic / IUPAC Name: sodium chloride |
| Syringe needle Omnican F | B. Braun Melsungen | REF 9161502 | surgical preparation |
| Suture 6/0 USP | Resorba | REF 4217 | surgical preparation |
| Polyethylene tube #10 | BD GmbH | Supplier No. 427401 | surgical preparation |
| Polyethylene tube #90 | BD GmbH | Supplier No. 427421 | surgical preparation |
| Rhodamine 6G | Sigma-Aldrich Chemie GmbH | CAS Number 989-38-8 | leukocyte staining. Generic / IUPAC Name: ethyl 2-[3-(ethylamino)-6-ethylimino-2,7-dimethylxanthen-9-yl]benzoate |
| Setup Equipment | |||
| Upright microscope | Olympus | BX51W1 | microscopy |
| 40-fold objective | Zeiss | Achroplan 40 × /0.80 W | microscopy |
| ImSpector software | Lavision Biotec GmbH | ver. 4.0.469 | software |
| ImageJ | National Institute of Health, USA | ver. 1.51j8 | software |
Ссылки
- Ley, K., Laudanna, C., Cybulsky, M. I., Nourshargh, S. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nature Reviews. Immunology. 7 (9), 678-689 (2007).
- Zanardo, R. C. O., et al. A down-regulatable E-selectin ligand is functionally important for PSGL-1-independent leukocyte-endothelial cell interactions. Blood. 104 (12), 3766-3773 (2004).
- Woodfin, A., et al. ICAM-1-expressing neutrophils exhibit enhanced effector functions in murine models of endotoxemia. Blood. 127 (7), 898-907 (2016).
- Frommhold, D., et al. RAGE and ICAM-1 cooperate in mediating leukocyte recruitment during acute inflammation in vivo. Blood. 116 (5), 841-849 (2010).
- Braach, N., et al. RAGE controls activation and anti-inflammatory signalling of protein C. PloS One. 9 (2), 89422 (2014).
- Frommhold, D., et al. RAGE and ICAM-1 differentially control leukocyte recruitment during acute inflammation in a stimulus-dependent manner. BMC Immunology. 12 (1), 56 (2011).
- Braach, N., et al. Anti-inflammatory functions of protein C require RAGE and ICAM-1 in a stimulus-dependent manner. Mediators of Inflammation. 2014, 743678 (2014).
- Girbl, T., et al. Distinct Compartmentalization of the Chemokines CXCL1 and CXCL2 and the Atypical Receptor ACKR1 Determine Discrete Stages of Neutrophil Diapedesis. Immunity. 49 (6), 1062-1076 (2018).
- Smith, M. L., Olson, T. S., Ley, K. CXCR2- and E-selectin-induced neutrophil arrest during inflammation in vivo. The Journal of Experimental Medicine. 200 (7), 935-939 (2004).
- Emre, Y., Jemelin, S., Imhof, B. A. Imaging Neutrophils and Monocytes in Mesenteric Veins by Intravital Microscopy on Anaesthetized Mice in Real Time. Journal of Visualized Experiments. (105), (2015).
- Eriksson, E., Boykin, J. V., Pittman, R. N. Method for in vivo microscopy of the cutaneous microcirculation of the hairless mouse ear. Microvascular Research. 19 (3), 374-379 (1980).
- von Andrian, U. H. Intravital microscopy of the peripheral lymph node microcirculation in mice. Microcirculation. 3 (3), 287-300 (1996).
- Hudalla, H., et al. LPS-induced maternal inflammation promotes fetal leukocyte recruitment and prenatal organ infiltration in mice. Pediatric Research. 84 (5), 757-764 (2018).
- Grant, R. T. Direct observation ok skeletal muscle blood vessels (rat cremaster). The Journal of Physiology. 172 (1), 123-137 (1964).
- Thiele, J. R., Goerendt, K., Stark, G. B., Eisenhardt, S. U. Real-time digital imaging of leukocyte-endothelial interaction in ischemia-reperfusion injury (IRI) of the rat cremaster muscle. Journal of Visualized Experiments. (66), e3973 (2012).
- Kranig, S. A., et al. Dystrophin deficiency promotes leukocyte recruitment in mdx mice. Pediatric Research. 11, 4457 (2019).
- Bagher, P., Segal, S. S. The mouse cremaster muscle preparation for intravital imaging of the microcirculation. Journal of Visualized Experiments. (52), e2874 (2011).
- Reichenbach, Z. W., Li, H., Gaughan, J. P., Elliott, M., Tuma, R. IV and IP administration of rhodamine in visualization of WBC-BBB interactions in cerebral vessels. Microscopy Research and Technique. 78 (10), 894-899 (2015).
- Secklehner, J., Lo Celso, C., Carlin, L. M. Intravital microscopy in historic and contemporary immunology. Immunology and Cell Biology. 95 (6), 506-513 (2017).
- Nussbaum, C., et al. Neutrophil and endothelial adhesive function during human fetal ontogeny. Journal of Leukocyte Biology. 93 (2), 175-184 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены