Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Infiltration de Leukocyte de Cremaster Muscle chez les souris évaluées par microscopie intravitale
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ici, nous montrons comment effectuer la microscopie intravitale sur les venules post-capillaires du muscle de cremaster de souris. Communément appliqués à différents modèles d’inflammation et de septicémie, en particulier ceux induits par les chimiothérapeutiques et les cytokines, nous soulignons sa pertinence dans l’étude des muscolopathies impliquant l’infiltration musculaire exagérée de leucocyte.
Résumé
La microscopie intravitale (IVM) est largement utilisée pour surveiller les processus physiologiques et pathophysiologiques dans la cascade de recrutement de leucocytes in vivo. Le protocole actuel représente une méthode pratique et reproductible pour visualiser l’interaction endothélium leucocyte menant au recrutement de leucocytes dans le tissu dérivé du muscle squelettique dans l’organisme intact de la souris. Le modèle s’applique à tous les domaines de recherche qui mettent l’accent sur l’activation des granulocytes et leur rôle dans la maladie.
Nous fournissons un protocole étape par étape pour guider à travers la méthode et pour mettre en évidence les pièges potentiels et les difficultés techniques. Le protocole couvre les aspects suivants : réglages expérimentaux et matériel requis, anesthésie de la souris, dissection du muscle cremaster ainsi que cannulation trachéale et carotide, enregistrements IVM et analyse hors ligne. Les formats de données comme les leucocytes adhérents, le flux roulant (RF) et la fraction de flux roulant (RFF) sont expliqués en détail et les applications appropriées sont discutées. Les résultats représentatifs des souris de mdx déficientes de dystrophine sont fournis dans la section des résultats.
IVM est un outil puissant pour évaluer le recrutement de leucocytes dans un cadre in vivo; cependant, la délimitation par exemple la fonction endothéliale et leucocyte peut nécessiter une combinaison avec des configurations ex vivo comme des expériences de chambre de flux. En outre, le contexte génétique des animaux d’intérêt peut grandement influencer le recrutement de base, nécessitant un réglage individuel du protocole fourni. Malgré ses limites, IVM peut servir de plate-forme pour traduire facilement les résultats in vitro en un organisme vertébré vivant.
Introduction
La microscopie intravitale (IVM) est un outil couramment appliqué dans le domaine de la biologie du leucocyte. Le recrutement de leukocyte suit une cascade d’événements bien définis initiés par la capture de leucocyte, le roulement et l’adhésion au mur endothélial, et enfin la transmigration et l’extravasation des leucocytes au site réel de l’inflammation1. Chaque étape est médiatisée et contrôlée par diverses chimiothéines (p. ex., IL-8/CXCL8), les récepteurs (p. ex., LFA-1, Mac-1) et les molécules correspondantes d’adhérence cellulaire endothéliale (p. ex., ICAM-1, VCAM-1 et E-Selectin)2,,3. L’interaction de différents sites de régulation, les facteurs de contrôle et les médiateurs de la cascade de recrutement de leucocytes comme le récepteur des produits finaux avancés de glycation (RAGE), la molécule d’adhérence intercellulaire 1 (ICAM-1), C-X-C motif ligand (CXCL)1/2 et leur récepteur CXCR2 ont été découverts en utilisant IVM4,5,6,7,8,9.
La méthode de la MIV a été décrite pour de nombreux organes et tissus différents tels que l’intestin10, la peau11, les ganglions lymphatiques12, le sac de jaune embryonnaire13 et d’autres. Cependant, la méthode la plus largement étudiée de la MIV est le modèle de cremaster, décrit pour la première fois chez les rats14. Bien qu’elle soit encore utilisée chez les rats15,la méthode est aujourd’hui principalement appliquée chez la souris en raison de la forte abondance de différentes lignées transgéniques. Notre groupe a récemment mis en évidence le rôle potentiel de cremaster IVM dans le domaine des muscolopathies inflammatoires comme la dystrophie musculaire de Duchenne (DMD) étudiant les souris mdx dystrophine-déficientes16. En raison de sa composition fine de fibre entrelacée et facilement accessible, le muscle de cremaster représente le muscle candidat idéal pour être étudié dans son ensemble de montage utilisant la microscopie légère ou fluorescente. Le recrutement et l’extravasation de Leukocyte ont principalement lieu dans les venules post-capillaires, qui peuvent facilement être identifiés sur une couche musculaire continue dans le muscle de cremaster.
L’avantage de l’imagerie in vivo par rapport à d’autres essais in vitro est son contexte biologique dans un organisme vivant. Dans le même temps, la délimitation des contributions spécifiques aux cellules à l’analyse altérée du leucocyte peut nécessiter des modèles in vitro supplémentaires comme les chambres de débit ou les essais endothéliaux. La combinaison de plusieurs méthodes donnera des données les plus convaincantes. Les scientifiques doivent être conscients des limites du modèle de crémaster car toute manipulation chirurgicale conduira à une augmentation du trafic et du recrutement de leucocytes. Par conséquent, le recrutement de base est difficile à estimer avec cette méthode. Malgré son application large, IVM du cremaster peut être difficile et une configuration nouvelle peut prendre du temps et des ressources à établir. Nous fournissons maintenant un protocole facile qui aidera à éviter certaines des erreurs courantes dans IVM. En outre, les limitations seront discutées et des méthodes complémentaires seront mises en évidence le cas échéant.
L’IVM du cremaster représente une approche idéale à mettre en œuvre dans le domaine des études inflammatoires et infectieuses. Plus précisément, le modèle de cremaster peut être d’un grand intérêt pour les scientifiques qui étudient la biologie du muscle squelettique dans le contexte de la maladie inflammatoire.
Protocole
Des animaux ont été logés dans des conditions contrôlées et spécifiques exemptes d’agents pathogènes à l’IBF (Interfakultàre Biomedizinische Forschungseinrichtung), Heidelberg. Toutes les procédures décrites ici ont été approuvées par la CISR locale et le Regierungspraesidium Karlsruhe, Bade-Wurtemberg, Allemagne.
1. Administration d’anesthésie
- Anesthésiez la souris par injection intraperitoneal (c.-à-d.) de 125 mg/kg de kétamine et de 12,5 mg/kg de xylazine.
- Placer et fixer la souris dans une position couchée dorsale sur un coussin chauffant pour maintenir la température corporelle de la souris (36,5-38 oC). Utilisez une suture stérile non absorbable (6/0) pour enrouler une boucle simple autour des dents frontales et ruban adhésif les extrémités de jointure de la suture à la garniture de chauffage. Cette fixation vise à garder la bouche ouverte afin d’éviter les perturbations de la respiration.
- Vérifiez la souris pour la profondeur appropriée de l’anesthésie par pincement interdigital d’ateil (retrait ne doit pas être vu).
- Une fois qu’une anesthésie suffisante est atteinte procéder à la préparation chirurgicale. Confirmer à plusieurs reprises l’anesthésie le long de l’expérience en cours tous les 30 min. Réutilisez les médicaments décrits ci-dessus si nécessaire.
- Solution de sel physiologique d’équilibre (PSS, composition : 132 mmol/L NaCl, 4.7 mmol/L KCl, 1.2 mmol/L MgS04, 2.0 mmol/L CaCl2, 18 mmol/L NaHCO3) avec 5% DE CO2/95% N2 pendant 15 minutes. Bulle continue PSS avec 5% de CO2/95% N2 tout au long de l’expérience et de garder à 37 oC.
2. Préparation chirurgicale de la trachée et de l’artère carotide (facultatif)
- Disséquer la peau de la région du cou en tirant doucement la peau avec des pincettes dans la ligne médiane. Utilisez des ciseaux pour appliquer une coupe circulaire de 1 à 2 cm de diamètre pour donner suffisamment d’espace pour la préparation chirurgicale.
- Disséquez soigneusement les tissus musculaires, graisseux et conjonctifs environnants à l’aide de pinces à épiles.
- Faire une coupe transversale (1,3 mm) dans la trachée à l’aide de petits ciseaux chirurgicaux et introduire un tube de polyéthylène (I.D x O.D. 0.034" x 0.050") à l’intérieur de l’extrémité caudale de la trachée pour sécuriser les voies respiratoires supérieures.
- Fixer le tube situé dans la trachée par une seule suture circulaire de noeud (6/0 USP).
- Localiser l’artère carotide le long du côté droit de la trachée et disséquer le tissu environnant de la paroi de l’artère carotide. Alternativement, la jugulaire ou aussi la veine de queue pourrait être employée pour l’accès d’i.v. Essayez d’éviter les blessures au nerf vagal, car il est situé de près.
- Passer deux morceaux de suture (6/0) sous l’artère carotide. Placez la première suture crânienne proximal, près de la bifurcation des artères carotides et attachez-la définitivement. La deuxième suture sera située à environ 5-8 mm distal de la première et plus tard être utilisé pour sécuriser le tube dans l’artère carotide. Ne l’attachez pas encore.
- Préparer un tube de polyéthylène (I.D x O.D. 0.011" x 0.024") d’une longueur de 30 cm en pliant la partie de fin à une aiguille de seringue de 1 mL remplie de saline (0,9% NaCl). Le rinçage rigoureux est important pour prévenir l’embolisation de l’air pendant la préparation.
- Utilisez un clip de navire de 7 mm pour serrer l’artère carotide de la deuxième suture.
- Effectuer une petite coupe transversale (0,5 mm) dans l’artère carotide et introduire le tube de polyéthylène stérile. Fixez le tube dans l’artère à l’aide de la deuxième suture préparée auparavant.
- Retirez le clip du navire et appliquez doucement un peu de tension sur la seringue reliée au tube de polyéthylène. Ce cathéter carotide peut maintenant être utilisé pour administrer des médicaments ou prélever des échantillons de sang si nécessaire, même la surveillance de la pression artérielle ou le pouls est possible avec les dispositifs respectifs.
3. Préparation chirurgicale du muscle de cremaster
- Transférer la souris sur le coussin chauffant (avec le coussin chauffant) dans le cadre en plastique sur mesure tenant la scène pour une microscopie ultérieure. Orientez la souris avec son scrotum face à l’étape du microscope.
- Réévaluer la profondeur de l’anesthésie avant de procéder; ré-administrer un quart à la demi-dose d’anesthésie si nécessaire.
- Localiser le scrotum, le tenant à sa partie la plus distale à l’aide de pincettes, tirez-le doucement et coupez une section circulaire de peau scrotale d’environ 5 mm de diamètre. Assurez-vous de ne pas nuire aux structures sous-jacentes telles que le muscle cremaster. Assurez-vous de garder le tissu ouvert bien hydraté avec une solution saline.
- Disséquez le tissu conjonctif lâche à l’aide de deux pincettes et localisez les deux testicules.
- Tenez un testicule distally et commencez doucement à le retirer, en enlevant le tissu conjonctif environnant étape par étape.
- Une fois que le testicule est extériorisé, épinglez son extrémité distale à l’anneau en caoutchouc entourant la scène. Lors de l’extériorisation, hydrater le tissu avec une solution saline pendant tout le processus.
- Étape critique : Enlevez soigneusement le tissu conjonctif sans nuire au muscle de cremaster sous-jacent. L’excès de tissu conjonctif peut obstruer la vision dans la microscopie ultérieure et peut produire des images floues.
- Épingler la partie la plus détale des testicules vers le bas et ouvrir le muscle de cremaster par une petite coupe transversale (environ 1 mm), suivie d’une incision longitudinale de l’extrémité très distale à l’extrémité proximal. En conséquence, le muscle cremaster devrait s’ouvrir sphériquement. Le vaisseau macroscopiquement visible ne doit pas être coupé, car cela peut avoir un impact sur l’hémodynamique.
- Étendre soigneusement le muscle sur le stade de verre et l’épingler à l’anneau en caoutchouc. Assurez-vous de ne pas toucher ou nuire à la région centrale, car la microscopie sera effectuée ici.
Attention : L’excès d’étirement peut obstruer le flux sanguin. - Épinglez les testicules restants de côté pour donner accès à la région d’intérêt. Assurez-vous d’humidifier avec PSS à plusieurs reprises pour éviter le séchage. Le muscle monté est maintenant prêt pour la microscopie.
4. Microscopie intravitale
- Placez le muscle de cremaster monté dans le microscope droit et effectuez la microscopie à l’aide d’un objectif 40x.
- Acquérir des données et exporter à l’aide d’une spectrographie d’imagerie à haut débit.
- Effectuez des enregistrements sous superfusion continue avec PSS17préchauffé (35-37 oC). Appliquer la superfusion par un petit tube qui a été scotché à l’objectif droit du microscope pour permettre un dégoulinement continu de PSS à côté de l’objectif vers le bas sur le tissu musculaire.
- Identifiez les venusles post-capillaires (confluence de deux petits vaisseaux) et mesurez la microcirculation sur les venusles d’un diamètre de 20-40 m.
- Enregistrez des images haute résolution de la microcirculation du muscle cremaster dans une plage temporelle de 30 s. Comme il peut y avoir une légère contraction et la relaxation du tissu musculaire pendant l’enregistrement, assurez-vous d’ajuster continuellement la mise au point. En général, la souris a tendance à afficher une circulation stable pendant environ 2 heures. Il est possible d’acquérir plusieurs enregistrements de différents navires de différentes régions. Un ou les deux testicules peuvent être utilisés par la suite.
REMARQUE : Comme il s’agit d’un modèle d’inflammation, les moyens communs d’induction sont : l’application systémique ou l’injection scrotale locale des médiateurs pro-inflammatoires aussi bien que la superfusion avec par exemple N-Formylmethionyl-leucyl-phénylalanine (fMLP). N La stimulation locale de TNF-MD est couramment utilisée pour déclencher le recrutement de leucocytes ; LPS-induit endotoxemia est un modèle de l’inflammation systémique grave SIRS.
5. Visualisation de Leukocyte
REMARQUE : Les leucocytes adhérents et roulants peuvent facilement être vus sans autre visualisation. Pour déterminer la vitesse de la ligne centrale des leucocytes en mouvement libre, effectuez des taches différentielles.
- Si des souris étiquetées eGFP sont utilisées, analysez-les directement par microscopie à fluorescence.
- Pour les souches de souris non étiquetées par eGFP, utilisez la coloration de rhodamine.
- Administrer la rhodamine 6G à 0,2 mg/kg de poids corporel. Des doses répétées peuvent être nécessaires pour atteindre des intensités de coloration suffisantes. Assurez-vous de conserver de petits volumes, car de plus grands volumes peuvent affecter les paramètres hémodynamiques.
- Pour la coloration instantanée des leucocytes, administrer la tache par l’artère carotide. Si la dissection carotide d’artère n’a pas été exécutée, la coloration suffisante peut être réalisée par application d’i.p. utilisant la même dose18. Comme alternative au cathétérisme carotide, tout autre cathétérisme veineux peut être effectué.
REMARQUE : Gardez à l’esprit que la coloration de rhodamine, contrairement à l’étiquetage eGFP, montre la carie temporelle de l’intensité de fluorescence ainsi qu’un maximum global de coloration d’environ 80% des leucocytes à des concentrations plus élevées. - Visualisez les leucocytes tachés de rhodamine en mouvement libre par microscopie fluorescence.
6. Fin de l’expérience
REMARQUE : Le temps total estimé pour exécuter ce protocole devrait être de 90 à 150 minutes.
- Mettre fin à l’expérience avec l’euthanasie par dislocation cervicale.
- Pour d’autres analyses, telles que la transmigration, fixer le muscle cremaster en PFA tout en restant étiré sur la scène et taché pour l’histologie au besoin.
7. Analyse hors ligne
- Analyser les paramètres suivants comme des comptes simples lors de la lecture vidéo.
- Calculer le flux roulant [nombre/min] : nombre de cellules roulantes passant une ligne imaginaire/min
- Calculer l’adhérence [nombre/mm2]:nombre de cellules adhésives à la paroi du navire dans le champ de vision de 30 s/surface vasculaire [mm2].
- Mesurer les paramètres hémodynamiques et microvasculaires suivants sont mesurés à l’aide d’ImageJ.
- Calculer le diamètre du navire [m] comme diamètre de la paroi interne.
- Calculer la longueur du navire [m] comme longueur de ligne centrale du navire.
- Calculez la
 vitesse de la ligne centrale obtenue à partir de l’analyse vidéo image à cadre des leucocytes en mouvement libre dans la ligne centrale.
vitesse de la ligne centrale obtenue à partir de l’analyse vidéo image à cadre des leucocytes en mouvement libre dans la ligne centrale.
- Utilisez les équations suivantes comme estimation.
- Calculer la surface vasculaire en [mm2]:longueur du navire [m] x diamètre du navire [m] x x x 10-6.
- Calculez le
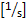 taux de cisaillement mural : 4,9 x (8 x vitesse de ligne centrale
taux de cisaillement mural : 4,9 x (8 x vitesse de ligne centrale  x 0,625/diamètre du navire [m]).
x 0,625/diamètre du navire [m]). - Calculer la vitesse
 moyenne de flux
moyenne de flux  sanguin : vitesse de ligne centrale x 0.625.
sanguin : vitesse de ligne centrale x 0.625. - Calculer le
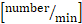 flux total de leucocytes : compte
flux total de leucocytes : compte 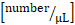 de
de  leucocyte systémique x (vitesse moyenne
leucocyte systémique x (vitesse moyenne 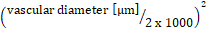 de flux sanguin x 60/1000) x x .
de flux sanguin x 60/1000) x x . - Calculez la fraction de flux roulant [%] : flux roulant/flux total de leucocyte x 100.
Résultats
IVM selon le protocole fourni donnera un aperçu unique de la cascade de recrutement de leucocytes dans le muscle squelettique. La section des résultats se concentrera sur les résultats typiques obtenus par IVM et mettra en évidence les problèmes potentiels qui peuvent rencontrer.
La configuration expérimentale de la microscopie intravitale est décrite dans la figure 1. La préparation du muscle de cremaster et l’ablation du tissu conjonctif sont cruciales...
Discussion
IVM comme méthode a été largement utilisé pour étudier différents types de cellules dans différents organes et a été largement décrit et discuté19. L’objectif principal de cette étude est de fournir une approche efficace pour mettre en place et effectuer IVM dans le muscle cremaster. La pratique de la méthode produira des résultats fiables et reproductibles. Ainsi, la planification et la normalisation sont des facteurs clés pour maîtriser la technique. Par-dessus tout, la techniq...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette étude a été soutenue par le Ministère fédéral allemand de l’éducation et de la recherche (BMBF) 01GL1746E dans le cadre du Consortium PRIMAL. Les auteurs reconnaissent Britta Heckmann et Silvia Pezer pour leur assistance technique habile.
matériels
| Name | Company | Catalog Number | Comments |
| Material | |||
| Ketanest S | Pfizer Pharma GmbH | PZN: 08509909 | anesthesia. Generic / IUPAC Name: ketamine |
| Xylazine | CP-Pharma GmbH | Article-nr.: 1205 | anesthesia. Generic / IUPAC Name: xylazine (as hidrochloride) |
| Saline Solution | B. Braun Melsungen | PZN 02737756 | surgical preparation. Generic / IUPAC Name: sodium chloride |
| Syringe needle Omnican F | B. Braun Melsungen | REF 9161502 | surgical preparation |
| Suture 6/0 USP | Resorba | REF 4217 | surgical preparation |
| Polyethylene tube #10 | BD GmbH | Supplier No. 427401 | surgical preparation |
| Polyethylene tube #90 | BD GmbH | Supplier No. 427421 | surgical preparation |
| Rhodamine 6G | Sigma-Aldrich Chemie GmbH | CAS Number 989-38-8 | leukocyte staining. Generic / IUPAC Name: ethyl 2-[3-(ethylamino)-6-ethylimino-2,7-dimethylxanthen-9-yl]benzoate |
| Setup Equipment | |||
| Upright microscope | Olympus | BX51W1 | microscopy |
| 40-fold objective | Zeiss | Achroplan 40 × /0.80 W | microscopy |
| ImSpector software | Lavision Biotec GmbH | ver. 4.0.469 | software |
| ImageJ | National Institute of Health, USA | ver. 1.51j8 | software |
Références
- Ley, K., Laudanna, C., Cybulsky, M. I., Nourshargh, S. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nature Reviews. Immunology. 7 (9), 678-689 (2007).
- Zanardo, R. C. O., et al. A down-regulatable E-selectin ligand is functionally important for PSGL-1-independent leukocyte-endothelial cell interactions. Blood. 104 (12), 3766-3773 (2004).
- Woodfin, A., et al. ICAM-1-expressing neutrophils exhibit enhanced effector functions in murine models of endotoxemia. Blood. 127 (7), 898-907 (2016).
- Frommhold, D., et al. RAGE and ICAM-1 cooperate in mediating leukocyte recruitment during acute inflammation in vivo. Blood. 116 (5), 841-849 (2010).
- Braach, N., et al. RAGE controls activation and anti-inflammatory signalling of protein C. PloS One. 9 (2), 89422 (2014).
- Frommhold, D., et al. RAGE and ICAM-1 differentially control leukocyte recruitment during acute inflammation in a stimulus-dependent manner. BMC Immunology. 12 (1), 56 (2011).
- Braach, N., et al. Anti-inflammatory functions of protein C require RAGE and ICAM-1 in a stimulus-dependent manner. Mediators of Inflammation. 2014, 743678 (2014).
- Girbl, T., et al. Distinct Compartmentalization of the Chemokines CXCL1 and CXCL2 and the Atypical Receptor ACKR1 Determine Discrete Stages of Neutrophil Diapedesis. Immunity. 49 (6), 1062-1076 (2018).
- Smith, M. L., Olson, T. S., Ley, K. CXCR2- and E-selectin-induced neutrophil arrest during inflammation in vivo. The Journal of Experimental Medicine. 200 (7), 935-939 (2004).
- Emre, Y., Jemelin, S., Imhof, B. A. Imaging Neutrophils and Monocytes in Mesenteric Veins by Intravital Microscopy on Anaesthetized Mice in Real Time. Journal of Visualized Experiments. (105), (2015).
- Eriksson, E., Boykin, J. V., Pittman, R. N. Method for in vivo microscopy of the cutaneous microcirculation of the hairless mouse ear. Microvascular Research. 19 (3), 374-379 (1980).
- von Andrian, U. H. Intravital microscopy of the peripheral lymph node microcirculation in mice. Microcirculation. 3 (3), 287-300 (1996).
- Hudalla, H., et al. LPS-induced maternal inflammation promotes fetal leukocyte recruitment and prenatal organ infiltration in mice. Pediatric Research. 84 (5), 757-764 (2018).
- Grant, R. T. Direct observation ok skeletal muscle blood vessels (rat cremaster). The Journal of Physiology. 172 (1), 123-137 (1964).
- Thiele, J. R., Goerendt, K., Stark, G. B., Eisenhardt, S. U. Real-time digital imaging of leukocyte-endothelial interaction in ischemia-reperfusion injury (IRI) of the rat cremaster muscle. Journal of Visualized Experiments. (66), e3973 (2012).
- Kranig, S. A., et al. Dystrophin deficiency promotes leukocyte recruitment in mdx mice. Pediatric Research. 11, 4457 (2019).
- Bagher, P., Segal, S. S. The mouse cremaster muscle preparation for intravital imaging of the microcirculation. Journal of Visualized Experiments. (52), e2874 (2011).
- Reichenbach, Z. W., Li, H., Gaughan, J. P., Elliott, M., Tuma, R. IV and IP administration of rhodamine in visualization of WBC-BBB interactions in cerebral vessels. Microscopy Research and Technique. 78 (10), 894-899 (2015).
- Secklehner, J., Lo Celso, C., Carlin, L. M. Intravital microscopy in historic and contemporary immunology. Immunology and Cell Biology. 95 (6), 506-513 (2017).
- Nussbaum, C., et al. Neutrophil and endothelial adhesive function during human fetal ontogeny. Journal of Leukocyte Biology. 93 (2), 175-184 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon