Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Leukozyten-Infiltration von Cremaster-Muskeln bei Mäusen bewertet durch Intravital-Mikroskopie
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier zeigen wir, wie man eine intravitale Mikroskopie auf postkapillaren Venulen des Maus-Cremaster-Muskels durchführt. Häufig angewendet auf verschiedene Modelle von Entzündungen und Sepsis, insbesondere solche, die durch Chemokine und Zytokine induziert werden, heben wir ihre Relevanz in der Untersuchung von Muskopathien mit übertriebener Muskel-Leukozyten-Infiltration hervor.
Zusammenfassung
Intravital-Mikroskopie (IVM) ist weit verbreitet, um physiologische und pathophysiologische Prozesse innerhalb der Leukozyten-Rekrutierungskaskade in vivo zu überwachen. Das aktuelle Protokoll stellt eine praktische und reproduzierbare Methode dar, um die Leukozyten-Endothel-Wechselwirkung zu visualisieren, die zu einer Leukozytenrekrutierung im skelettierten Muskelgewebe innerhalb des intakten Organismus der Maus führt. Das Modell gilt für alle Forschungsbereiche, die sich auf die Granulozytenaktivierung und ihre Rolle bei Krankheiten konzentrieren.
Wir bieten ein Schritt-für-Schritt-Protokoll, um die Methode zu durchführen und mögliche Fallstricke und technische Schwierigkeiten aufzuzeigen. Das Protokoll behandelt folgende Aspekte: experimentelle Einstellungen und benötigtes Material, Anästhesie der Maus, Zerlegung des Cremastermuskels sowie Tracheal- und Karotiskannulation, IVM-Aufnahmen und Offline-Analyse. Datenformate wie haftende Leukozyten, Rolling Flux (RF) und Rolling Flux Fraction (RFF) werden ausführlich erläutert und entsprechende Anwendungen diskutiert. Repräsentative Ergebnisse von Dystrophin-Mangel mdx Mäuse nd werden im Ergebnisbereich zur Verfügung gestellt.
IVM ist ein leistungsfähiges Instrument zur Bewertung der Leukozytenrekrutierung in einem In-vivo-Umfeld; Die Abgrenzung z.B. der Endothel- und Leukozytenfunktion kann jedoch eine Kombination mit ex vivo-Setups wie Strömungskammerexperimenten erfordern. Darüber hinaus kann der genetische Hintergrund von Tieren von Interesse die Einstellung von Baselinen stark beeinflussen, was eine individuelle Feinabstimmung des vorgelegten Protokolls erfordert. Trotz seiner Einschränkungen kann IVM als Plattform dienen, um In-vitro-Befunde leicht in einen lebenden Wirbeltierorganismus zu übersetzen.
Einleitung
Intravital-Mikroskopie (IVM) ist ein häufig angewandtes Werkzeug auf dem Gebiet der Leukozytenbiologie. Leukozyten Rekrutierung folgt einer Kaskade von genau definierten Ereignissen durch Leukozyten-Capture, Rollen und Adhäsion an der Endothelwand initiiert, und schließlich Transmigration und Extravasation von Leukozyten an die tatsächliche Stelle der Entzündung1. Jeder Schritt wird durch verschiedene Chemokine (z.B. IL-8/CXCL8), Rezeptoren (z.B. LFA-1, Mac-1) und entsprechenden Endothelzelladhäsionsmolekülen (z.B. ICAM-1, VCAM-1 und E-Selectin)2,3. Die Wechselwirkung verschiedener regulatorischer Standorte, Steuerungsfaktoren und Mediatoren der Leukozytenrekrutierungskaskade wie Rezeptor fortschrittlicher Glykationsendprodukte (RAGE), interzelluläres Adhäsionsmolekül 1 (ICAM-1), C-X-C-Motivliganden (CXCL)1/2 und deren Rezeptor CXCR2 wurden mit IVM4,5,6,7,8,9.
Die Methode der IVM wurde für viele verschiedene Organe und Gewebe wie der Darm10, Haut11, Lymphknoten12, der embryonale Dottersack13 und andere beschrieben. Die am weitesten untersuchte Methode von IVM ist jedoch das Cremaster-Modell, das zuerst in Ratten14beschrieben wurde. Während noch bei Ratten15verwendet, wird die Methode heutzutage vor allem bei Mäusen aufgrund der hohen Fülle von verschiedenen transgenen Linien angewendet. Unsere Gruppe hat vor kurzem die mögliche Rolle von Cremaster IVM auf dem Gebiet der entzündlichen Muscolopathien wie Duchenne Muskeldystrophie (DMD) Untersuchung dystrophin-deficient mdx Mäuse16hervorgehoben. Aufgrund seiner dünnen verwobenen und leicht zugänglichen Faserzusammensetzung stellt der Cremaster-Muskel den idealen Kandidatenmuskel dar, der als Gesamtberg mittels Licht- oder Fluoreszenzmikroskopie untersucht werden kann. Leukozytenrekrutierung und Extravasation finden hauptsächlich in postkapillaren Venulen statt, die leicht auf einer kontinuierlichen Muskelschicht im Cremaster-Muskel identifiziert werden können.
Der Vorteil der In-vivo-Bildgebung im Vergleich zu anderen In-vitro-Assays ist ihr biologischer Kontext in einem lebenden Organismus. Gleichzeitig kann die Abgrenzung zellspezifischer Beiträge zur veränderten Leukozytenrekrutierung zusätzliche In-vitro-Modelle wie Strömungskammern oder endotheliale Assays erfordern. Die Kombination mehrerer Methoden liefert überzeugende Daten. Wissenschaftler sollten sich der Einschränkungen des Cremaster-Modells bewusst sein, da jede chirurgische Manipulation zu einem verstärkten Leukozytenhandel und Rekrutierung führen wird. Daher ist die Einstellung von Baselinen mit dieser Methode schwer abzuschätzen. Trotz seiner breiten Anwendung kann IVM des Cremasters eine Herausforderung sein und ein neuartiges Setup kann Zeit und Ressourcen in Anspruch nehmen. Wir stellen jetzt ein einfaches Protokoll zur Verfügung, das dazu beitragen wird, einige der häufigsten Fehler in IVM zu vermeiden. Außerdem werden Einschränkungen diskutiert und gegebenenfalls kostenlose Methoden hervorgehoben.
IVM des Cremasters stellt einen idealen Ansatz dar, der im Bereich der entzündlichen und infektiösen Studien umgesetzt werden kann. Genauer gesagt, kann das Cremaster-Modell von hohem Interesse für Wissenschaftler sein, die Skelettmuskelbiologie im Kontext von entzündlichen Erkrankungen studieren.
Protokoll
Die Tiere wurden in der IBF (Interfakultäre Biomedizinische Forschungseinrichtung) in Heidelberg unter kontrollierten und spezifischen pathogenfreien Bedingungen untergebracht. Alle hier beschriebenen Verfahren wurden vom örtlichen IRB und dem Regierungspraesidium Karlsruhe, Baden-Württemberg, Deutschland genehmigt.
1. Anästhesie-Verwaltung
- Anästhesisieren Sie die Maus durch intraperitoneale (i.p.) Bolusinjektion von 125 mg/kg Ketamin und 12,5 mg/kg Xylazin.
- Platzieren und fixieren Sie die Maus in einer dorsalen Liegeposition auf einem Heizkissen, um die Körpertemperatur der Maus (36,5-38 °C) aufrechtzuerhalten. Verwenden Sie eine nicht resorbierbare sterile Naht (6/0), um eine einfache Schlaufe um die Stirnzähne zu wickeln und die Verbindungsenden der Naht an das Heizkissen zu kleben. Diese Fixierung zielt darauf ab, den Mund offen zu halten, um Störungen in der Atmung zu vermeiden.
- Überprüfen Sie die Maus auf angemessene Tiefe der Anästhesie durch interdigitale Zehenklemme (Entzug sollte nicht gesehen werden).
- Sobald eine ausreichende Anästhesie erreicht ist, gehen Sie zur chirurgischen Vorbereitung. Bestätigen Sie wiederholt die Anästhesie entlang des laufenden Experiments alle 30 min. Bei Bedarf erneut Medikamente wie oben beschrieben.
- Gleichgewichtsphysiologische Salzlösung (PSS, Zusammensetzung: 132 mmol/L NaCl, 4,7 mmol/L KCl, 1,2 mmol/L MgS04, 2,0 mmol/L CaCl2, 18 mmol/L NaHCO3) mit 5% CO2/95% N2 für 15 Minuten. Kontinuierlich Blasen PSS mit 5% CO2/95%N2 während des gesamten Experiments und halten sie bei 37 °C.
2. Chirurgische Vorbereitung der Luftröhre und Halsschlagader (optional)
- Sezieren Sie die Haut aus dem Nackenbereich, indem Sie die Haut sanft mit einer Pinzette in der Mittellinie ziehen. Verwenden Sie eine Schere, um einen kreisförmigen Schnitt von 1-2 cm Durchmesser aufzutragen, um genügend Platz für die chirurgische Vorbereitung zu geben.
- Sezieren Sie vorsichtig die umgebenden Muskel-, Fett- und Bindegewebe mit einer Pinzette.
- Machen Sie einen Querschnitt (ca. 1,3 mm) mit einer kleinen chirurgischen Schere in die Luftröhre und führen Sie ein Polyethylenrohr (I.D x O.D. 0,034" x 0,050") in das kaudale Ende der Luftröhre ein, um die oberen Atemwege zu sichern.
- Befestigen Sie das Rohr in der Luftröhre durch eine einzige kreisförmige Knotennaht (6/0 USP).
- Suchen Sie die Halsschlagader entlang der rechten Seite der Luftröhre und sezieren Sie das umgebende Gewebe von der Halsschlagaderwand. Alternativ könnte die Jugular- oder auch die Schwanzvene für den i.v. Zugang verwendet werden. Versuchen Sie, Verletzungen des Vagalnervs zu vermeiden, da er sich in der Nähe befindet.
- Passieren Sie zwei Stücke der Naht (6/0) unter der Halsschlagader. Platzieren Sie die erste Schädelnaht proximal, in der Nähe der Bifurkation der Karotisarterien und binden Sie sie dauerhaft. Die zweite Naht wird etwa 5-8 mm distal von der ersten befinden und später verwendet werden, um das Rohr in der Halsschlagader zu sichern. Binden Sie es noch nicht.
- Bereiten Sie ein Polyethylenrohr (I.D x O.D. 0.011" x 0.024") mit einer Länge von 30 cm vor, indem Sie das Endteil auf eine 1 ml Spritzennadel biegen, die mit Salin (0,9% NaCl) gefüllt ist. Strenge Spülung ist wichtig, um Luftembolisation während der Vorbereitung zu verhindern.
- Verwenden Sie einen 7 mm Gefäßclip, um die Halsschlagader distal der zweiten Naht zu klemmen.
- Führen Sie einen kleinen Querschnitt (ca. 0,5 mm) in der Halsschlagader durch und führen Sie das sterile Polyethylenrohr ein. Sichern Sie die Röhre in der Arterie mit der zweiten Naht zuvor vorbereitet.
- Entfernen Sie den Gefäßclip und tragen Sie vorsichtig eine kleine Spannung auf die Spritze auf, die mit dem Polyethylenrohr verbunden ist. Dieser Karotiskatheter kann nun zur Verabreichung von Medikamenten oder zur Entnahme von Blutproben verwendet werden, bei Bedarf ist sogar eine Überwachung des Blutdrucks oder der Pulsfrequenz mit entsprechenden Geräten möglich.
3. Chirurgische Vorbereitung des Cremaster-Muskels
- Übertragen Sie die Maus auf dem Heizkissen (zusammen mit dem Heizkissen) auf den maßgeschneiderten Kunststoffrahmen, der die Bühne für die spätere Mikroskopie hält. Richten Sie die Maus mit ihrem Hodensack zur Mikroskopstufe.
- Die Tiefe der Anästhesie neu bewerten, bevor Sie fortfahren; bei Bedarf eine Viertel- bis halber Anästhesiedosis erneut verabreichen.
- Lokalisieren Sie den Hodensack, halten Sie ihn an seinem distalsten Teil mit einer Pinzette, ziehen Sie ihn sanft und schneiden Sie einen kreisförmigen Abschnitt der scrotalen Haut mit einem Durchmesser von etwa 5 mm ab. Achten Sie darauf, die zugrunde liegenden Strukturen wie den Cremaster-Muskel nicht zu beschädigen. Achten Sie darauf, das offene Gewebe gut hydratisiert mit Einer Saline-Lösung zu halten.
- Sezieren Sie loses Bindegewebe mit zwei Pinzetten und lokalisieren Sie beide Hoden.
- Halten Sie einen Hoden distally und sanft beginnen, es herauszuziehen, entfernen Umgebendes Bindegewebe Schritt für Schritt.
- Sobald der Hoden aussenisiert ist, fixieren Sie sein distales Ende an den Gummiring, der die Bühne umgibt. Bei der Exteriorisation das Gewebe während des gesamten Prozesses mit einer Salinelösung hydratisieren.
- Kritischer Schritt: Entfernen Sie vorsichtig Bindegewebe, ohne den darunter liegenden Cremaster-Muskel zu schädigen. Überschüssiges Bindegewebe kann das Sehvermögen in der späteren Mikroskopie behindern und verschwommene Bilder erzeugen.
- Pin den distalen Teil des Hodens nach unten und öffnen Sie den Cremaster-Muskel durch einen kleinen Querschnitt (ca. 1 mm), gefolgt von Längsschnitt vom sehr distalen bis zum proximalen Ende. Dadurch sollte sich der Cremaster-Muskel sphärisch öffnen. Makroskopisch sichtbares Gefäß sollte nicht abgetrennt werden, da dies die Hämodynamik beeinträchtigen kann.
- Den Muskel vorsichtig über die Glasbühne verteilen und an den Gummiring heften. Achten Sie darauf, den zentralen Bereich nicht zu berühren oder zu beschädigen, da hier die Mikroskopie durchgeführt wird.
Achtung: Überschüssige Dehnung kann den Blutfluss behindern. - Pin die restlichen Hoden beiseite, um den Zugang zu der Region von Interesse zu geben. Achten Sie darauf, mit PSS wiederholt zu befeuchten, um ein Trocknen zu verhindern. Der montierte Muskel ist nun für die Mikroskopie bereit.
4. Intravitale Mikroskopie
- Legen Sie den montierten Cremaster-Muskel in das aufrechte Mikroskop und führen Sie die Mikroskopie mit einem 40-fachen Objektiv durch.
- Erfassen Sie Daten und exportieren Sie sie mithilfe der Bildspektrographie mit hohem Durchsatz.
- Führen Sie Aufnahmen unter kontinuierlicher Überfusion mit vorgewärmten (35-37 °C) PSS17durch. Tragen Sie die Superfusion durch einen kleinen Schlauch auf, der auf das aufrechte Ziel des Mikroskops geklebt wurde, um ein kontinuierliches Abtropfen von PSS neben dem Objektiv auf das Muskelgewebe zu ermöglichen.
- Identifizieren Sie postkapillare Venulen (Zusammenfluss von zwei kleineren Gefäßen) und messen Sie die Mikrozirkulation an Venulen mit einem Durchmesser von 20-40 m.
- Zeichnen Sie hochauflösende Bilder der Mikrozirkulation aus dem Cremaster-Muskel in einem Zeitbereich von 30 s auf. Da es während der Aufnahme zu einer leichten Kontraktion und Entspannung des Muskelgewebes sein kann, stellen Sie sicher, dass Sie den Fokus kontinuierlich anpassen. In der Regel neigt die Maus dazu, eine stabile Zirkulation für etwa 2 Stunden zu zeigen. Es ist möglich, mehrere Aufnahmen von verschiedenen Schiffen aus verschiedenen Regionen zu erwerben. Ein oder beide Hoden können nachträglich verwendet werden.
HINWEIS: Da dies ein Modell der Entzündung ist, sind häufige Wege der Induktion: systemische Anwendung Noder lokale skrotale Injektion von pro-inflammatorischen Mediatoren sowie Superfusion mit zum Beispiel N-Formylmethionyl-Leucyl-Phenylalanin (fMLP). Lokale TNF-A-Stimulation wird häufig verwendet, um Leukozytenrekrutierung auszulösen; LPS-induzierte Endotoxämie ist ein Modell der schweren systemischen Entzündung von SIRS.
5. Leukozyten-Visualisierung
HINWEIS: Haftende und rollende Leukozyten sind ohne weitere Visualisierung leicht zu sehen. Um die Mittelliniengeschwindigkeit frei beweglicher Leukozyten zu bestimmen, führen Sie Differentialfärbungen durch.
- Wenn eGFP-gekennzeichnete Mäuse verwendet werden, analysieren Sie sie direkt durch Fluoreszenzmikroskopie.
- Für nicht-eGFP beschriftete Mausstämme, verwenden Sie Rhodamine Färbung.
- Rhodam in 6G bei 0,2 mg/kg Körpergewicht verabreichen. Wiederholte Dosen können erforderlich sein, um ausreichende Färbeintensitäten zu erreichen. Achten Sie darauf, kleine Volumes beizubehalten, da größere Volumes hämodynamische Parameter beeinflussen können.
- Für die sofortige Färbung von Leukozyten, verabreichen Sie den Fleck über die Halsschlagader. Wenn keine Karotisarteriensektion durchgeführt wurde, kann eine ausreichende Färbung durch i.p. Anwendung mit der gleichen Dosis18erreicht werden. Als Alternative zur Karotisarterienkatheterisierung kann jede andere venöse Katheterisierung durchgeführt werden.
HINWEIS: Beachten Sie, dass die Rhodamine-Färbung im Gegensatz zur eGFP-Kennzeichnung den Zeitlichenzerfall der Fluoreszenzintensität sowie ein Gesamtfärbemaximum von etwa 80 % der Leukozyten in höheren Konzentrationen aufweist. - Visualisieren Sie frei bewegliche Rhodamine-gefärbte Leukozyten durch Fluoreszenzmikroskopie.
6. Ende des Experiments
HINWEIS: Die geschätzte Gesamtzeit für die Ausführung dieses Protokolls sollte 90 – 150 Minuten betragen.
- Beenden Sie das Experiment mit Euthanasie durch zervikale Dislokation.
- Für weitere Analysen, wie z.B. Transmigration, fixieren Sie den Cremaster-Muskel in PFA, während sie noch auf der Bühne gestreckt und für die Histologie nach Bedarf gefärbt sind.
7. Offline-Analyse
- Analysieren Sie die folgenden Parameter als einfache Zählungen während der Videowiedergabe.
- Berechnen des Rollflusses [Zahl/min]: Anzahl der Rollzellen, die eine imaginäre Linie/min passieren
- Berechnung der Haftung [Anzahl/mm2]: Anzahl der Zellen, die innerhalb des Sichtfeldes an der Gefäßwand kleben [ mm2].
- Messen Sie die folgenden hämodynamischen und mikrovaskulären Parameter werden mit ImageJ gemessen.
- Berechnen Sie den Gefäßdurchmesser [m] als Innenwanddurchmesser.
- Berechnen Sie die Gefäßlänge [m] als mittlere Linienlänge des Schiffes.
- Berechnen Sie
 die Mittelliniengeschwindigkeit, die aus der Frame-to-Frame-Videoanalyse frei beweglicher Leukozyten in der Mittellinie ermittelt wird.
die Mittelliniengeschwindigkeit, die aus der Frame-to-Frame-Videoanalyse frei beweglicher Leukozyten in der Mittellinie ermittelt wird.
- Verwenden Sie die folgenden Gleichungen als Schätzung.
- Berechnen Sie die Gefäßoberfläche in [mm2]: Gefäßlänge [m] x Gefäßdurchmesser [m] x x 10-6.
- Berechnen Sie die
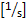 Wandscherrate : 4,9
Wandscherrate : 4,9  x (8 x Mittelliniengeschwindigkeit x 0,625/Gefäßdurchmesser [m]).
x (8 x Mittelliniengeschwindigkeit x 0,625/Gefäßdurchmesser [m]). - Berechnen Sie die
 mittlere Durchblutungsgeschwindigkeit : Mittelliniengeschwindigkeit
mittlere Durchblutungsgeschwindigkeit : Mittelliniengeschwindigkeit  x 0,625.
x 0,625. - Berechnen Sie den gesamten
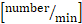 Leukozytenfluss
Leukozytenfluss 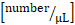 : systemische Leukozytenzahl x (mittlere Durchblutungsgeschwindigkeit
: systemische Leukozytenzahl x (mittlere Durchblutungsgeschwindigkeit  x 60/1000) x x
x 60/1000) x x 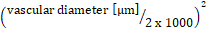 .
. - Berechnen Sie die Walzstromfraktion [%]: Rollfluss/Gesamt-Leukozytenfluss x 100.
Ergebnisse
IVM nach dem bereitgestellten Protokoll liefert einzigartige Einblicke in die Kaskade der Leukozytenrekrutierung im Skelettmuskel. Der Ergebnisabschnitt konzentriert sich auf typische Ergebnisse von IVM und hebt potenzielle Probleme auf, die auftreten können.
Der Versuchsaufbau für die intravitale Mikroskopie ist in Abbildung 1dargestellt. Die Vorbereitung des Cremaster-Muskels und die Entfernung des Bindegewebes ist entscheidend, um fokussierte mikroskopische B...
Diskussion
IVM als Methode wurde weit verbreitet verwendet, um verschiedene Zelltypen in verschiedenen Organen zu studieren und wurde ausführlich beschrieben und diskutiert19. Das Hauptziel dieser Studie ist es, einen effizienten Ansatz zu bieten, um IVM im Cremaster-Muskel einzurichten und durchzuführen. Das Üben der Methode führt zu zuverlässigen und reproduzierbaren Ergebnissen. Daher sind Planung und Standardisierung Schlüsselfaktoren, um die Technik zu beherrschen. Vor allem ist die Technik sehr a...
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Studie wurde vom Bundesministerium für Bildung und Forschung (BMBF) 01GL1746E im Rahmen des PRIMAL-Konsortiums unterstützt. Die Autoren würdigen Britta Heckmann und Silvia Pezer für geschickte technische Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| Material | |||
| Ketanest S | Pfizer Pharma GmbH | PZN: 08509909 | anesthesia. Generic / IUPAC Name: ketamine |
| Xylazine | CP-Pharma GmbH | Article-nr.: 1205 | anesthesia. Generic / IUPAC Name: xylazine (as hidrochloride) |
| Saline Solution | B. Braun Melsungen | PZN 02737756 | surgical preparation. Generic / IUPAC Name: sodium chloride |
| Syringe needle Omnican F | B. Braun Melsungen | REF 9161502 | surgical preparation |
| Suture 6/0 USP | Resorba | REF 4217 | surgical preparation |
| Polyethylene tube #10 | BD GmbH | Supplier No. 427401 | surgical preparation |
| Polyethylene tube #90 | BD GmbH | Supplier No. 427421 | surgical preparation |
| Rhodamine 6G | Sigma-Aldrich Chemie GmbH | CAS Number 989-38-8 | leukocyte staining. Generic / IUPAC Name: ethyl 2-[3-(ethylamino)-6-ethylimino-2,7-dimethylxanthen-9-yl]benzoate |
| Setup Equipment | |||
| Upright microscope | Olympus | BX51W1 | microscopy |
| 40-fold objective | Zeiss | Achroplan 40 × /0.80 W | microscopy |
| ImSpector software | Lavision Biotec GmbH | ver. 4.0.469 | software |
| ImageJ | National Institute of Health, USA | ver. 1.51j8 | software |
Referenzen
- Ley, K., Laudanna, C., Cybulsky, M. I., Nourshargh, S. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nature Reviews. Immunology. 7 (9), 678-689 (2007).
- Zanardo, R. C. O., et al. A down-regulatable E-selectin ligand is functionally important for PSGL-1-independent leukocyte-endothelial cell interactions. Blood. 104 (12), 3766-3773 (2004).
- Woodfin, A., et al. ICAM-1-expressing neutrophils exhibit enhanced effector functions in murine models of endotoxemia. Blood. 127 (7), 898-907 (2016).
- Frommhold, D., et al. RAGE and ICAM-1 cooperate in mediating leukocyte recruitment during acute inflammation in vivo. Blood. 116 (5), 841-849 (2010).
- Braach, N., et al. RAGE controls activation and anti-inflammatory signalling of protein C. PloS One. 9 (2), 89422 (2014).
- Frommhold, D., et al. RAGE and ICAM-1 differentially control leukocyte recruitment during acute inflammation in a stimulus-dependent manner. BMC Immunology. 12 (1), 56 (2011).
- Braach, N., et al. Anti-inflammatory functions of protein C require RAGE and ICAM-1 in a stimulus-dependent manner. Mediators of Inflammation. 2014, 743678 (2014).
- Girbl, T., et al. Distinct Compartmentalization of the Chemokines CXCL1 and CXCL2 and the Atypical Receptor ACKR1 Determine Discrete Stages of Neutrophil Diapedesis. Immunity. 49 (6), 1062-1076 (2018).
- Smith, M. L., Olson, T. S., Ley, K. CXCR2- and E-selectin-induced neutrophil arrest during inflammation in vivo. The Journal of Experimental Medicine. 200 (7), 935-939 (2004).
- Emre, Y., Jemelin, S., Imhof, B. A. Imaging Neutrophils and Monocytes in Mesenteric Veins by Intravital Microscopy on Anaesthetized Mice in Real Time. Journal of Visualized Experiments. (105), (2015).
- Eriksson, E., Boykin, J. V., Pittman, R. N. Method for in vivo microscopy of the cutaneous microcirculation of the hairless mouse ear. Microvascular Research. 19 (3), 374-379 (1980).
- von Andrian, U. H. Intravital microscopy of the peripheral lymph node microcirculation in mice. Microcirculation. 3 (3), 287-300 (1996).
- Hudalla, H., et al. LPS-induced maternal inflammation promotes fetal leukocyte recruitment and prenatal organ infiltration in mice. Pediatric Research. 84 (5), 757-764 (2018).
- Grant, R. T. Direct observation ok skeletal muscle blood vessels (rat cremaster). The Journal of Physiology. 172 (1), 123-137 (1964).
- Thiele, J. R., Goerendt, K., Stark, G. B., Eisenhardt, S. U. Real-time digital imaging of leukocyte-endothelial interaction in ischemia-reperfusion injury (IRI) of the rat cremaster muscle. Journal of Visualized Experiments. (66), e3973 (2012).
- Kranig, S. A., et al. Dystrophin deficiency promotes leukocyte recruitment in mdx mice. Pediatric Research. 11, 4457 (2019).
- Bagher, P., Segal, S. S. The mouse cremaster muscle preparation for intravital imaging of the microcirculation. Journal of Visualized Experiments. (52), e2874 (2011).
- Reichenbach, Z. W., Li, H., Gaughan, J. P., Elliott, M., Tuma, R. IV and IP administration of rhodamine in visualization of WBC-BBB interactions in cerebral vessels. Microscopy Research and Technique. 78 (10), 894-899 (2015).
- Secklehner, J., Lo Celso, C., Carlin, L. M. Intravital microscopy in historic and contemporary immunology. Immunology and Cell Biology. 95 (6), 506-513 (2017).
- Nussbaum, C., et al. Neutrophil and endothelial adhesive function during human fetal ontogeny. Journal of Leukocyte Biology. 93 (2), 175-184 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten