A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הסתננות לאוציט של שריר Cremaster בעכברים המוערך על ידי מיקרוסקופ אינטרטל
In This Article
Summary
כאן, אנו מראים כיצד לבצע מיקרוסקופ לאחר הנימי של השריר הראשי של העכבר. בדרך כלל מיושם מודלים שונים של דלקת אלח דם, במיוחד אלה המושרה על ידי נוגדנים ו ציטוקינים, אנו להדגיש את הרלוונטיות שלה במחקר של מוסקולופאאס מעורבים חדירה מוגזמת שרירי לוקיציט.
Abstract
מיקרוסקופ אינטרטל (IVM) משמש רבות לניטור תהליכים פיזיולוגיים ופתופיזילוגיים בתוך הדירוג הvivo של הגיוס הלוקואני. הפרוטוקול הנוכחי מייצג שיטה מעשית ומנויית כדי להמחיש את האינטראקציה האנדוקובית לוקיציט המובילה לגיוס לוקיציט ברקמת שריר השלד בתוך האורגניזם השלם של העכבר. המודל ישים לכל תחומי המחקר המתמקדים בהפעלת גרנולוציט ותפקידם במחלות.
אנו מספקים צעד אחר צעד פרוטוקול להנחות דרך השיטה ולהדגיש מלכודות פוטנציאליות וקשיים טכניים. הפרוטוקול מכסה את ההיבטים הבאים: הגדרות ניסיוני וחומר נדרש, הרדמה של העכבר, חיתוך של שריר cremaster, כמו גם הקנה הנשימה והעורק הראשי, הקלטות IVM וניתוח לא מקוון. תבניות נתונים כמו לוקיציטים מדומה, שטף מתגלגל (RF) ושבר שטף מתגלגל (RFF) מוסברים בפירוט ויישומים מתאימים נדונים. תוצאות הנציג מעכברים mdx לקוי הדיסטרופין מסופקים בסעיף התוצאות.
IVM הוא כלי רב עוצמה כדי להעריך גיוס לוקיציט ב vivo הגדרה; עם זאת, התיחום למשל לפונקציה אנדותל ולוקיציט עשוי לדרוש שילוב עם הגדרות vivo ex כמו ניסויים בתאי הזרימה. יתרה מזאת, הרקע הגנטי של בעלי העניין עשוי להשפיע במידה ניכרת על גיוס בסיסי, המחייב כוונון משובח של הפרוטוקול המסופק. למרות המגבלות שלה, IVM עשוי לשמש פלטפורמה לתרגם בקלות ממצאים בעלי מבחנה מחוץ לאורגניזם חי בעלי חוליות.
Introduction
מיקרוסקופ אינטרטל (IVM) הוא כלי מיושם נפוץ בתחום הביולוגיה הלוקוציט. גיוס לוקיציט מלווה במפל של אירועים מוגדרים היטב, שיזמו לכידת הלוקוציט, גלגול והדבקה לקיר האנדותל, ולבסוף העברת הגירה והעברה של לוקיציטים לאתר בפועל של דלקת1. כל צעד מתווך ונשלט על ידי נוגדנים שונים (למשל, IL-8/CXCL8), קולטנים (g., lfa-1, Mac-1) ומולקולות הדבקה של תא אנדותל המקביל (g., icam-1, vcam-1 ו-e-selectin)2,3. האינטראקציה של אתרים רגולאטורים שונים, מקדמי שליטה ומגשרים של גיוס לוקיציט מדורגים כמו קולטן של מוצרים מתקדמים לסוף גליקטיון (זעם), מולקולה הדבקה משולבת 1 (icam -1), c-X-c מוטיב ליגנד (cxcl) 1/2 והקולטן שלהם CXCR2 נחשפו באמצעות ivm4,5,6,7,8,9
השיטה של IVM תוארה עבור איברים ורקמות שונים רבים כגון המעי10, עור11, בלוטות הלימפה12, שק החלמון העובריים13 ואחרים. עם זאת, שיטת המחקר הנרחב ביותר של IVM הוא מודל cremaster, המתואר לראשונה חולדות14. בעוד שימוש עדיין בחולדות15, השיטה מיושמת כיום בעיקר בעכברים בשל שפע גבוה של קווים טרנסגניים שונים. הקבוצה שלנו הדגישה לאחרונה את התפקיד הפוטנציאלי של מאסטר cremaster בתחום של מוסקולוטים דלקתיים כמו Duchenne ניוון שרירים (DMD) ללמוד הדיסטרופין לקויה עכברים16. בשל שזור דק ונגיש בקלות הרכב סיבים, שריר cremaster מייצג את השריר האידיאלי המועמד ללמוד כמו הר שלם באמצעות מיקרוסקופ אור או פלורסנט. גיוס לוקיציט ומיון מתמשך מתקיימים בעיקר בעזרת שכבות פוסט-קפיריות, שיכולות להיות מזוהות על שכבת שרירים רציפה בשריר הקרמאסטר.
היתרון של הדמיה vivo לעומת אחרים מחוץ לבית הספר הוא ההקשר הביולוגי שלה באורגניזם חי. במקביל, מציינת תרומות ספציפיות לתאים לגיוס לוקמיה משתנה עשויה לדרוש תוספת של מודלים להפריה חוץ-גופית כגון תאי זרימה או אנדותל אסמאל. השילוב בין שיטות מרובות יניב את הנתונים המששכנעים ביותר. מדענים צריכים להיות מודעים למגבלות של מודל cremaster כמו כל מניפולציה כירורגית יוביל להגדלת הסחר בסמים וגיוס. מכאן, הגיוס הבסיסי קשה להעריך עם שיטה זו. למרות היישום הרחב שלה, IVM של cremaster יכול להיות מאתגר וכיוונון הרומן עשוי לקחת זמן ומשאבים כדי להקים. כעת אנו מספקים פרוטוקול קל אשר יסייע להימנע כמה טעויות נפוצות ב-IVM. כמו כן, יידונו מגבלות ושיטות מסוימות יהיו מודגשות במידת הצורך.
האגודה מייצגת גישה אידיאלית ליישום בתחום של מחקרים דלקתיים וזיהומיות. באופן ספציפי יותר, מודל cremaster עשוי להיות עניין גבוה למדענים לימוד ביולוגיה שריר השלד בהקשר של מחלות דלקתיות.
Protocol
בעלי חיים היו תחת מבוקרת וספציפי התנאים ללא הפתוגן בבית IBF (ביופקולטציזיסיאיסמליסספיאדיבאיזשיונגאבריסגריסיוריסיימאנטאינטונג), חאידלברג. כל ההליכים המתוארים כאן אושרו על-ידי ה-IRB המקומי והרגראשיפראססרוסיה קרלסרוהה, באדן-Wuerttemberg, גרמניה.
1. מינהל הרדמה
- מורדם העכבר על ידי הזרקת הצפק (כיתה) הזרקה של 125 מ"ג/ק"ג ו 12.5 מ"ג/ק"ג xylazine.
- מקום ולתקן את העכבר בתנוחה שכיבה על גבי משטח חימום כדי לשמור על טמפרטורת הגוף של העכבר (36.5-38 ° c). השתמש בתפר סטרילי שאינו נספג (6/0) לרוח לולאה פשוטה סביב השיניים המצח והקלטת את החיבור של התפר למשטח החימום. קיבעון זה נועד לשמור על הפה פתוח כדי למנוע הפרעה בנשימה.
- בדוק את העכבר לעומק המתאים של ההרדמה על ידי קמצוץ הבוהן interdigital (נסיגה לא צריך להיראות).
- לאחר הרדמה מספקת הוא הגיע להמשיך להכנה כירורגית. לאשר שוב ושוב הרדמה לאורך הניסוי המתמשך כל 30 דקות. לנהל מחדש תרופות כפי שמתואר לעיל אם יש צורך.
- תמיסת מלח פיסיולוגית (PSS, הרכב: 132 מ מול/L הפקודה, 4.7 ממול/L KCl, 1.2 ממול/L MgS04, 2.0 Mmol/l ק1, 18 מ מול/l נחקו3) עם 5% CO2/95% N2 עבור 15 דקות. בועה רציפה PSS עם 5% CO2/95% N2 במהלך הניסוי ולשמור ב 37 ° c.
2. הכנת כירורגי לעורק הנשימה והעורק הראשי (אופציונלי)
- לנתח את העור מאזור הצוואר על ידי משיכת בעדינות את העור עם מלקחיים באמצע הדרך. השתמש במספריים כדי להחיל חתך מעגלי של 1-2 ס מ בקוטר כדי לתת מספיק מקום להכנה כירורגית.
- בזהירות לנתח את השריר שמסביב, רקמות שומן וחיבור באמצעות מספריים.
- לעשות חתך רוחבי (~ 1.3 מ"מ) לתוך קנה הנשימה באמצעות מספריים כירורגי קטן ולהציג צינור פוליאתילן (I. D x מנת משכל 0.034" x 0.050 ") בתוך הקצה caudal של קנה הנשימה כדי לאבטח את נתיבי הנשימה העליונים.
- תקן את הצינורית הממוקמת בקנה הנשימה על ידי תפר מעגלי בודד (6/0 USP).
- ולנתח את הרקמה המקיפה. מהקיר העורק הראשי לחילופין, הוריד הצוואר או גם הזנב יכול לשמש לגישה לעירוי. נסו להימנע מפציעה בעצב התועה, כפי שהוא נמצא מקרוב.
- העבירו שתי פרוסות תפר (6/0) מתחת לעורק הראשי. מניחים את תפר הגולגולת הראשון הקרוב ביותר, בקרבת הבייון של עורקים העורק ולקשור אותו לצמיתות. תפר השני יהיה ממוקם על 5-8 מ"מ מ מ הראשון ומאוחר יותר לשמש כדי לאבטח את הצינור בעורק הראש. . אל תקשור את זה עדיין
- להכין צינור פוליאתילן (I. D x מנת יתר 0.011 "x 0.024") עם אורך של 30 ס מ על ידי כיפוף חלק בסוף מחט מזרק 1 mL מלא תמיסת מלח (0.9% הנאל). שטיפה קפדנית חשוב כדי למנוע סתימת האוויר במהלך ההכנה.
- השתמש בקליפ של 7 מ"מ כדי להדק את עורק העורק הראשי של התפר השני.
- בצעו חתך רוחבי קטן (~ 0.5 מ"מ) בעורק הראש והציגו את צינור הפוליאתילן הסטרילי. אבטח את הצינור בעורק בעזרת התפר השני שהוכן לפני.
- הסר את הקליפ והחל בעדינות מעט מתח על המזרק המחובר לצינור הפוליאתילן. קטטר זה העורק יכול כעת לשמש לניהול תרופות או לקחת דגימות דם אם נדרש, אפילו ניטור של לחץ דם או שיעור הדופק אפשרי עם התקנים בהתאמה.
3. הכנת כירורגי של השריר cremaster
- העבר את העכבר על משטח החימום (יחד עם משטח החימום) למסגרת הפלסטיק המותאמת אישית המחזיקה את הבמה למיקרוסקופיה מאוחרת יותר. כוון את העכבר עם כיס האשכים שלו מול הבמה המיקרוסקופ.
- מהעריך מראש עומק של הרדמה לפני שתמשיך; מחדש רבע עד חצי מנה של הרדמה במידת הצורך.
- להתאים את כיס האשכים, להחזיק אותו בחלקו המרוחק ביותר באמצעות מלקחיים, למשוך אותו בעדינות ולחתוך קטע עגול של עור האשכים עם כ 5 מ"מ קוטר. הקפד לא לפגוע במבנים הבסיסיים כגון שריר cremaster. הקפידו לשמור את הרקמה הפתוחה היטב מהתייבשות עם תמיסת מלח.
- לנתח רקמת חיבור רופף באמצעות שתי מלקחיים ולוקליזציה שתי האשכים.
- החזק את האחד בדרך בעדינות ולהתחיל למשוך אותו החוצה, הסרת רקמת החיבור שמסביב צעד אחר צעד.
- , ברגע שהוא מתחת למים. ממסמר את הקצה המרוחק שלו לטבעת הגומי המקיפה את הבמה מימה את הרקמה עם תמיסת מלח במהלך כל התהליך.
- שלב קריטי: הסר בזהירות את רקמת החיבור מבלי לפגוע שריר cremaster הבסיסי. רקמת חיבור עודפת עלולה לשבש את הראייה במיקרוסקופיה מאוחרת יותר ועלולה לגרום לדימויים מטושטשים.
- להצמיד את החלק המרוחק של הראש למטה ולפתוח את השריר cremaster ידי חתך רוחבי קטן (על 1 מ"מ), ואחריו חתך האורך מן המרוחק מאוד לסוף הקרוב ביותר. כתוצאה מכך השריר הקרמסטר צריך להיפתח בצורה ספרוונית. אין לנתק את כלי הקיבול המקסקובי באופן מאקרואני, מאחר שפעולה זו עלולה להשפיע על הומודינמיקה.
- הפיצו בזהירות את השריר מעל לשלב הזכוכית והצמד אותו לטבעת הגומי. הקפידו לא לגעת או לפגוע באזור המרכזי, משום שמיקרוסקופיה תתבצע כאן.
זהירות: מתיחה עודפת עלולה לשבש את זרימת הדם. - הצמד את הראש הנותר הצידה כדי להעניק גישה לאזור העניין. ודא כי מויסטן עם PSS שוב ושוב כדי למנוע ייבוש. השריר שנטען מוכן כעת למיקרוסקופ.
4. מיקרוסקופ אינטרטל
- מניחים את שריר cremaster רכוב במיקרוסקופ זקוף לבצע מיקרוסקופ באמצעות מטרה 40x.
- רכישת נתונים וייצוא באמצעות ספקטרוגרפיה של הדמיה באמצעות תפוקה גבוהה.
- בצע הקלטות תחת היתוך מתמשך עם חימום מראש (35-37 ° c) PSS17. להחיל על ידי אבובים קטן כי כבר מודבק למטרה זקופה של המיקרוסקופ כדי לאפשר טפטוף רציף של PSS לצד המטרה למטה על רקמת השריר.
- לזהות וכלי לאחר הנימים (המפגש של שני כלי קטן יותר) ולמדוד את מחזור המיקרו על כונדו עם קוטר של 20-40 μm.
- הקלטת תמונות ברזולוציה גבוהה של מיקרו מחזור מן השריר cremaster בטווח זמן של 30 s. כפי שיכול להיות כיווץ והרפיה קלה של רקמת השריר במהלך ההקלטה, הקפד ברציפות להתאים את המוקד. באופן כללי, העכבר נוטה להפגין מחזור יציב במשך כ 2 שעות. ניתן לרכוש מספר הקלטות של אוניות שונות מאזורים שונים. לאחר מכן ניתן להשתמש באחת או בשתיהן.
הערה: מכיוון שזה מודל של דלקת, דרכים נפוצות של אינדוקציה הם: יישום מערכתי או הזרקת לועטל מקומי של מגשרים דלקתיים pro, כמו גם superfusion עם למשל N-formylמתיונין-לleucyl-פנילאלנין (fMLP). גירוי מקומי TNF-α משמש בדרך כלל כדי להפעיל גיוס לוקיציט; LPS-המושרה אנדוטוקסין הוא מודל של נכבדיידלקת מערכתית חמורה.
5. הדמיה לוקיציט
הערה: ניתן לראות בקלות מחסיד ומתגלגל לוקיציטים ללא הדמיה נוספת. כדי לקבוע את מהירות הקו המרכזי של הזזת הלוקוציטים בחופשיות, בצע כתמים דיפרנציאלים.
- אם נעשה שימוש בעכברים המסומנים ב-eGFP, יש לנתח אותם ישירות על-ידי מיקרוסקופ פלואורסצנטית.
- עבור שאינם eGFP המסומנים זנים העכבר, השתמש כתמים rhodamine.
- מנהל הרדאמטין 6G ב 0.2 מ"ג/ק"ג משקל גוף. ניתן לדרוש מינונים חוזרים כדי להשיג עוצמות מספיקות. הקפד לשמור על אמצעי אחסון קטנים, כאמצעי אחסון גדולים יותר עשויים להשפיע על פרמטרים של הומודינמיקה.
- , לצביעת מיידי של לוקיציטים. מנהל את הכתם דרך עורק הראש אם ניתוח עורק הראש לא בוצע, כתמים מספיקים ניתן להשיג על ידי האפליקציה כאשר באמצעות אותה מנה18. כחלופה לצנתור העורק הראשי, ניתן לבצע כל צנתור ורידים אחר.
הערה: זכור כי כתמים rhodamine, בניגוד התיוג eGFP, מראה ריקבון הזמן של עוצמת הקרינה, כמו גם הכולל מכתים מקסימום של כ 80% של לוקיציטים בריכוזים גבוהים. - המחש את הלוקוציטים המוכתמים בחופשיות על ידי המיקרוסקופיה פלואורסצנטית.
6. סוף הניסוי
הערה: הזמן הכולל המשוער לביצוע פרוטוקול זה אמור להיות 90 – 150 דקות.
- סיים את הניסוי עם המתת חסד. על ידי פריקת צוואר הרחם
- לניתוחים נוספים, כגון transmigration גירה, לתקן את השריר cremaster בתוך הלסת עדיין נמתח על הבמה ומוכתם עבור היסטולוגיה כנדרש.
7. ניתוח לא מקוון
- נתח את הפרמטרים הבאים כספירות פשוטות במהלך הפעלת וידאו.
- חישוב שטף מתגלגל [מספר/מזערי]: מספר התאים הרולינג העוברים קו דמיוני/דקה
- לחשב הדבקה [מספר/mm2]: מספר התאים דבק לקיר כלי בתוך שדה התצוגה ≥ 30 s/משטח כלי דם [מ"מ2].
- מדידת הפרמטרים הבאים של הומודינמיקה ומיקרוכלי דם נמדדים באמצעות ImageJ.
- חשב את קוטר הספינה [μm] כקוטר הקיר הפנימי.
- חישוב אורך כלי הקיבול [μm] כאורך הקו המרכזי של כלי הקיבול.
- לחשב מהירות
 קו מרכז המתקבל ניתוח וידאו מסגרת למסגרת של לוקיציטים בחופשיות במרכז קו.
קו מרכז המתקבל ניתוח וידאו מסגרת למסגרת של לוקיציטים בחופשיות במרכז קו.
- השתמש במשוואות הבאות כהערכה.
- חישוב משטח כלי דם ב [mm2]: אורך הספינה [μm] x בקוטר כלי הקיבול [μm] x π x 10-6.
- חשב את קצב
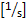 ההטיה של הקיר: 4.9 x (8
ההטיה של הקיר: 4.9 x (8  x מרכז קו מהירות x 0.625/בקוטר הספינה [μm]).
x מרכז קו מהירות x 0.625/בקוטר הספינה [μm]). - חישוב מהירות
 זרימת הדם הממוצע: קו
זרימת הדם הממוצע: קו  מרכז מהירות x 0.625.
מרכז מהירות x 0.625. - חישוב השטף
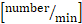 הכולל של לוקמיה מערכתית
הכולל של לוקמיה מערכתית 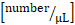 x (משמעות זרימת הדם מהירות
x (משמעות זרימת הדם מהירות  x 60/1000) x π x
x 60/1000) x π x 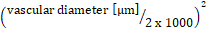 .
. - חישוב שבר שטף הגלגול [%]: השטף הגלגול/השטף הכולל לוקיציט x 100.
תוצאות
IVM לפי הפרוטוקול המסופק תניב תובנות ייחודיות לתוך המפל של גיוס לוקיציט שריר השלד. סעיף התוצאות יתמקד בתוצאות אופייניות המתקבלות על-ידי IVM וידגיש בעיות פוטנציאליות שעלולות להיתקל בהן.
התוכנית הניסיונית למיקרוסקופיה הינה מחולקת באיור 1. הכנת שריר cremaster והסרת ?...
Discussion
IVM כשיטה נעשה שימוש נרחב כדי ללמוד סוגים שונים של תאים באיברים שונים ותיאר בהרחבה ודנו19. המטרה העיקרית של מחקר זה היא לספק גישה יעילה להגדיר ולבצע IVM בשריר cremaster. תרגול השיטה יפיק תוצאות אמינות ומיוצרות. לפיכך, תכנון וסטנדרטיזציה הם גורמי מפתח לשלוט בטכניקה. מעל לכל, הטכניקה תלו...
Disclosures
. למחברים אין מה לגלות
Acknowledgements
מחקר זה היה נתמך על ידי הממשלה הפדרלית הגרמני של החינוך והמחקר (BMBF) 01GL1746E כחלק הקונסורציום הראשוני. המחברים מכירים ברטה הירמן וסילביה Pezer לקבלת סיוע טכני מיומן.
Materials
| Name | Company | Catalog Number | Comments |
| Material | |||
| Ketanest S | Pfizer Pharma GmbH | PZN: 08509909 | anesthesia. Generic / IUPAC Name: ketamine |
| Xylazine | CP-Pharma GmbH | Article-nr.: 1205 | anesthesia. Generic / IUPAC Name: xylazine (as hidrochloride) |
| Saline Solution | B. Braun Melsungen | PZN 02737756 | surgical preparation. Generic / IUPAC Name: sodium chloride |
| Syringe needle Omnican F | B. Braun Melsungen | REF 9161502 | surgical preparation |
| Suture 6/0 USP | Resorba | REF 4217 | surgical preparation |
| Polyethylene tube #10 | BD GmbH | Supplier No. 427401 | surgical preparation |
| Polyethylene tube #90 | BD GmbH | Supplier No. 427421 | surgical preparation |
| Rhodamine 6G | Sigma-Aldrich Chemie GmbH | CAS Number 989-38-8 | leukocyte staining. Generic / IUPAC Name: ethyl 2-[3-(ethylamino)-6-ethylimino-2,7-dimethylxanthen-9-yl]benzoate |
| Setup Equipment | |||
| Upright microscope | Olympus | BX51W1 | microscopy |
| 40-fold objective | Zeiss | Achroplan 40 × /0.80 W | microscopy |
| ImSpector software | Lavision Biotec GmbH | ver. 4.0.469 | software |
| ImageJ | National Institute of Health, USA | ver. 1.51j8 | software |
References
- Ley, K., Laudanna, C., Cybulsky, M. I., Nourshargh, S. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nature Reviews. Immunology. 7 (9), 678-689 (2007).
- Zanardo, R. C. O., et al. A down-regulatable E-selectin ligand is functionally important for PSGL-1-independent leukocyte-endothelial cell interactions. Blood. 104 (12), 3766-3773 (2004).
- Woodfin, A., et al. ICAM-1-expressing neutrophils exhibit enhanced effector functions in murine models of endotoxemia. Blood. 127 (7), 898-907 (2016).
- Frommhold, D., et al. RAGE and ICAM-1 cooperate in mediating leukocyte recruitment during acute inflammation in vivo. Blood. 116 (5), 841-849 (2010).
- Braach, N., et al. RAGE controls activation and anti-inflammatory signalling of protein C. PloS One. 9 (2), 89422 (2014).
- Frommhold, D., et al. RAGE and ICAM-1 differentially control leukocyte recruitment during acute inflammation in a stimulus-dependent manner. BMC Immunology. 12 (1), 56 (2011).
- Braach, N., et al. Anti-inflammatory functions of protein C require RAGE and ICAM-1 in a stimulus-dependent manner. Mediators of Inflammation. 2014, 743678 (2014).
- Girbl, T., et al. Distinct Compartmentalization of the Chemokines CXCL1 and CXCL2 and the Atypical Receptor ACKR1 Determine Discrete Stages of Neutrophil Diapedesis. Immunity. 49 (6), 1062-1076 (2018).
- Smith, M. L., Olson, T. S., Ley, K. CXCR2- and E-selectin-induced neutrophil arrest during inflammation in vivo. The Journal of Experimental Medicine. 200 (7), 935-939 (2004).
- Emre, Y., Jemelin, S., Imhof, B. A. Imaging Neutrophils and Monocytes in Mesenteric Veins by Intravital Microscopy on Anaesthetized Mice in Real Time. Journal of Visualized Experiments. (105), (2015).
- Eriksson, E., Boykin, J. V., Pittman, R. N. Method for in vivo microscopy of the cutaneous microcirculation of the hairless mouse ear. Microvascular Research. 19 (3), 374-379 (1980).
- von Andrian, U. H. Intravital microscopy of the peripheral lymph node microcirculation in mice. Microcirculation. 3 (3), 287-300 (1996).
- Hudalla, H., et al. LPS-induced maternal inflammation promotes fetal leukocyte recruitment and prenatal organ infiltration in mice. Pediatric Research. 84 (5), 757-764 (2018).
- Grant, R. T. Direct observation ok skeletal muscle blood vessels (rat cremaster). The Journal of Physiology. 172 (1), 123-137 (1964).
- Thiele, J. R., Goerendt, K., Stark, G. B., Eisenhardt, S. U. Real-time digital imaging of leukocyte-endothelial interaction in ischemia-reperfusion injury (IRI) of the rat cremaster muscle. Journal of Visualized Experiments. (66), e3973 (2012).
- Kranig, S. A., et al. Dystrophin deficiency promotes leukocyte recruitment in mdx mice. Pediatric Research. 11, 4457 (2019).
- Bagher, P., Segal, S. S. The mouse cremaster muscle preparation for intravital imaging of the microcirculation. Journal of Visualized Experiments. (52), e2874 (2011).
- Reichenbach, Z. W., Li, H., Gaughan, J. P., Elliott, M., Tuma, R. IV and IP administration of rhodamine in visualization of WBC-BBB interactions in cerebral vessels. Microscopy Research and Technique. 78 (10), 894-899 (2015).
- Secklehner, J., Lo Celso, C., Carlin, L. M. Intravital microscopy in historic and contemporary immunology. Immunology and Cell Biology. 95 (6), 506-513 (2017).
- Nussbaum, C., et al. Neutrophil and endothelial adhesive function during human fetal ontogeny. Journal of Leukocyte Biology. 93 (2), 175-184 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved