Method Article
العلاج الكيميائي الكهربائي في كرويات الورم الميلانيني العيني ثلاثي الأبعاد باستخدام قطب كهربائي مخصص
In This Article
Summary
هنا ، نقدم بروتوكولا لتطوير كرويات الورم الميلانيني ثلاثية الأبعاد والملتحمة والعنبية واستخدام أقطاب كهربائية مخصصة محمولة باليد للعلاج الكيميائي الكهربائي في المختبر للكرويات ثلاثية الأبعاد في ثقافة جيدة. يقدم هذا وجهات نظر جديدة في استخدام العلاج الكيميائي الكهربائي في علاج الورم الميلانيني العيني.
Abstract
العلاج الكيميائي الكهربائي (ECT) هو مزيج من تكوين المسام العابرة بعد تطبيق النبض الكهربائي مع إعطاء الأدوية السامة للخلايا ، مما يعزز التأثير السام للخلايا للعامل المطبق بسبب تغيرات الغشاء. تحاكي أنظمة الثقافة ثلاثية الأبعاد في المختبر نمو الورم في الجسم الحي وتحافظ على الخصائص البيولوجية للأورام بشكل أكثر دقة من مزارع الخلايا أحادية الطبقة التقليدية. نصف بروتوكولا لتطوير عضيات الورم ثلاثية الأبعاد باستخدام خطوط خلايا الورم الميلانيني الملتحمة (CM) والورم الميلانيني العنبي (UM) بالإضافة إلى استخدام أقطاب كهربائية مخصصة محمولة باليد ، ومناسبة للصدمات الكهربائية في المختبر في الثقافة بشكل جيد دون تدمير بيئة الورم. يحلل هذا البروتوكول ثقافة ونمو الكرويات ثلاثية الأبعاد CM و UM ورد فعلها على البليومايسين (2.5 ميكروغرام / مل) وحده ، والتثقيب الكهربائي (EP) (750 فولت / سم ، 8 نبضات ، 100 ميكرو ثانية ، 5 هرتز) وحده ، و ECT كمزيج من EP و bleomycin. تم تحديد تركيز الدواء وإعدادات EP المستخدمة في هذا البروتوكول كظروف مفضلة للصدمات الكهربائية وفقا للتجارب السابقة. تم إجراء الفحص المستخدم لتحديد الجدوى الكروية بعد 3-7 أيام من العلاج. كان التأثير على جدوى ونمو الورم ثلاثي الأبعاد كبيرا فقط بعد العلاج بالصدمات الكهربائية. يتم وصف الأقطاب الكهربائية المخصصة بالتفصيل من أجل تسهيل تطبيق النبضات في الثقافة جيدا. يضع هذا العلاج الجديد للكبوتات الكروية ثلاثية الأبعاد UM و CM نقطة انطلاق للتطبيق السريري في المستقبل.
Introduction
الورم الميلانيني اللاتيني (UM) هو الورم الأولي الأكثر شيوعا داخل العين لدى البالغين ، بينما يمثل الورم الميلانيني الملتحمة (CM) 2٪ من جميع الأورام الميلانينية العينية1،2،3،4،5،6. المعالجة الكثبية والعلاج الإشعاعي بشعاع البروتون والعلاج بالضوء هي علاجات الخط الأول في UM ، في حين أن استئصال الكرة الأرضية قد يكون ضروريا1،2،3. يختلف علاج CM بين مراكز أورام العين. الخزعة الاستئصالية متبوعة بالعلاج الكيميائي الموضعي و / أو العلاج الإشعاعي هي نهج العلاج الأكثر شيوعا4. على الرغم من العلاج ، يرتبط CM بمعدل وفيات يتراوح بين 25٪ و 30٪ 5.
هناك ندرة في الأدبيات حول تكوين الكرويات CM و UM وتطبيق العلاج بالصدمات الكهربائية في الورم الميلانيني العيني6،7،8. تتمتع كرويات الورم بخصائص بيولوجية أفضل من مزارع الخلايا ثنائية الأبعاد التقليدية وقد تم اقتراحها كأداة مفيدة لتقليد بيئة الورم في الجسم الحي9. يجمع العلاج الكيميائي الكهربائي (ECT) بين استخدام الأدوية السامة للخلايا غير المنفذة مع التثقيب الكهربائي (EP) 10. EP هو التطبيق المحلي للنبضات الكهربائية القصيرة والمكثفة التي تتخلل الخلايا بشكل عابر لزيادة موضعية في امتصاص الأدوية المضادة للسرطان في الخلايا السرطانية وتؤدي إلى زيادة موتالخلايا 11. تضع هذه الدراسة بروتوكولا يصف تطور كرويات CM و UM وتبحث في النتائج بعد العلاج بالصدمات الكهربائية مع البليومايسين. يمكن أن يساعد هذا البروتوكول الباحثين في مجال أورام العين باستخدام طرائق علاجية أخرى على الكرويات أو دراسة المزيد من الآثار للصدمات الكهربائية. نظرا للاستخدام المحدود للصدمات الكهربائية في طب العيون ، هناك القليل من المعرفة فيما يتعلق بتأثير وعملية هذه الطريقة. وبالتالي ، قد توسع هذه التجربة نطاق خيارات العلاج في المستقبل. نقترح إعدادا جديدا مخصصا لقطب اللوحة المحمول باليد ، والذي يسمح بالصدمات الكهربائية للكروي في آبار الاستزراع دون أي تدمير لبيئة الورم.
Protocol
1. تشكيل كروي
- استخدم خطوط الخلايا السرطانية المتنامية بشكل ملتصق لتكوين كروي.
- توفير جميع الخطوات المرتبطة بزراعة الخلايا في ظل ظروف مقاعد البدلاء المعقمة.
- قم بإعداد وسط الثقافة الكامل القياسي على النحو الموصى به لخطوط الخلايا ذات الأهمية وقم بتسخينه إلى 37 درجة مئوية باستخدام حمام مائي.
ملاحظة: هنا ، تم استخدام خطوط خلايا الملتحمة البشرية CM2005.1 و CRMM1 و CRMM2 بالإضافة إلى خطوط خلايا الورم الميلانيني العنبي 92.1 و OMM1 و OMM2 وزراعتها في وسط Ham F-12 الذي يحتوي على 10٪ مصل بقري جنيني و RPMI يحتوي على 10٪ مصل بقري جنيني ، على التوالي. - افصل الخلايا ذات الأهمية باستخدام طرق الهضم الأنزيمية القياسية (على سبيل المثال ، محلول التربسين-EDTA).
- لتحديد عدد الخلايا الحيوية ، أعد تعليق 10 ميكرولتر من تعليق الخلية في 10 ميكرولتر من محلول تريبان الأزرق (1: 1) وعد الخلايا باستخدام غرفة (مقياس كثافة الدم أو عداد الخلايا الآلي) في غضون 5 دقائق. يجب أن تكون الخلايا <90٪ من التقاء وفي حالة جيدة.
- لتشكيل كرويات ، قم بزرع 5 × 103 خلايا لكل بئر بحجم إجمالي قدره 200 ميكرولتر من وسط الثقافة الكامل في 96 بئرا من ألواح التثبيت المنخفضة للغاية. احتضان اللوحة عند 37 درجة مئوية في جو مرطب يحتوي على 5٪ ثاني أكسيد الكربون2.
ملاحظة: لتثبيط الارتباط الخلوي بشكل فعال ، استخدم ألواح تثبيت منخفضة للغاية مع هيدروجيل محب للماء وغير أيوني ومشحون بشكل محايد على السطح. يمنع هذا الهيدروجيل تخليد الخلايا ويجبرها على الاستمرار في حالة تعليق لبناء كرويات ثلاثية الأبعاد. - تحقق من تكوين كروي باستخدام المجهر.
ملاحظة: لا تشكل بعض خطوط الخلايا كرويات ورم ثلاثية الأبعاد مستديرة في المقطع الأول. قم بتمرير ثقافة كرة الورم قبل أن تبدأ في تطوير مركز مظلم. فصل كتل الورم اعتمادا على خط الخلية بعد 4-10 أيام عن طريق التربسين. بعد ذلك ، قم بزرع الخلايا المفردة في 96 لوحة تثبيت جديدة منخفضة للغاية. من خلال تكرار هذا الإجراء لعدة مقاطع ، ستتكيف الخلايا مع ثقافة 3D.
2. العلاج الكيميائي الكهربائي للورم الكروي
- كعنصر تحكم في الفحص ، استخدم الكرات الكروية والكروية غير المعالجة المعالجة فقط باستخدام EP أو البليومايسين وحده.
- اضبط إعدادات المثقور الكهربائي (عدد النبضات وتردد النبضة والوقت المدة والجهد ؛ انظر جدول المواد). بالنسبة لخلايا الورم الميلانيني ، استخدم 8 نبضات كهربائية ذات موجة مربعة بقوة 750 فولت / سم ، ومدة نبضة 100 ميكرو ثانية ، وتردد تكرار 5 هرتز.
- في اليوم 3 من الثقافة الكروية ، قم بإعداد محلول كبريتات البليومايسين الطازج في PBS معقم بتركيز 5 ميكروغرام / مل في أنبوب سعة 15 مل.
- تبادل وسط زراعة الخلايا للفيريات عن طريق إزالة 200 ميكرولتر من وسط الاستزراع وإعادة التعبئة ب 100 ميكرولتر من وسط الاستزراع الكامل الطازج لكل بئر.
- أضف 100 ميكرولتر من محلول كبريتات البليومايسين إلى كل بئر (التركيز النهائي 2.5 ميكروغرام / مل). أضف 100 ميكرولتر من الوسط الطازج إلى أدوات التحكم غير المعالجة والفيريات المعالجة فقط بمحلول كبريتات البليومايسين.
- إجراء التثقيب الكهربائي.
ملاحظة: تم إنتاج الأقطاب الكهربائية الموضحة في الشكل 1 في ورشة العمل البحثية لجامعة هاله فيتنبرغ. إنها مصنوعة من الفولاذ المقاوم للصدأ وتناسب قبضة المثقاب الكهربائي. تم تصميم الأقطاب الكهربائية للاستخدام في 96 لوحة تثبيت منخفضة للغاية. يمكن تصنيع أقطاب كهربائية مماثلة من الفولاذ المقاوم للصدأ بسهولة للتطبيقات البديلة أيضا.- تعقيم الأقطاب الكهربائية بنسبة 70٪ من الإيثانول واترك الأقطاب الكهربائية تجف. يبلغ قطر الأقطاب الكهربائية 1 مم ، والفجوة بين القطبين 4 مم ، وطول كل قطب كهربائي 8 مم (الشكل 1 أ).
- ضع الأقطاب الكهربائية في قاع البئر ، مع وجود الكرويات بين الأقطاب الكهربائية. هذا يسمح بالوضع المثالي للكرة الكروية بين القطبين (الشكل 1 ب).
- رج اللوحة للسماح للكرات بالتحرك من قاع البئر ووضعها بين الأقطاب الكهربائية. سيكون الكروي بين الأقطاب الكهربائية لبضع ثوان فقط.
- ابدأ التثقيب الكهربائي بالإعدادات المفضلة.
- استبدل محلول كبريتات البليومايسين في البئر باستبدال 150 ميكرولتر من الوسط ب 150 ميكرولتر من الوسط الطازج.
- احتضان الخلايا لمدة تصل إلى 10 أيام عند 37 درجة مئوية في جو مرطب يحتوي على 5٪ ثاني أكسيد الكربون2. إذا بدأت الكرويات غير المعالجة في تطوير مركز مظلم ، فقم بإنهاء التجربة. تبادل 150 ميكرولتر من وسط زراعة الخلية كل 2-3 أيام. وبالتالي، تجنب الاضطراب الكروي عن طريق وضع طرف الماصة في منطقة حافة البئر، وإمالة اللوحة وسحب العينة ببطء.
3. تحديد حجم كروي
- قم بقياس الحجم الكروي في يوم العلاج (نقطة البداية) و3-7 أيام بعد العلاج باستخدام الفحص المجهري للمجال الساطع عن طريق حساب مساحة المقطع العرضي للكرات باستخدام ImageJ Fiji11.
- التقط صورة للأشكال الكروية المفردة باستخدام شريط المقياس. استخدم تكبيرا يكون من خلاله الكروي بأكمله مرئيا. على سبيل المثال، تم استخدام تكبير 5x ل CM2005.1. احفظ الصورة بتنسيق JPEG.
- قم بتحليل الحجم الكروي عن طريق حساب مساحة المقطع العرضي باستخدام ImageJ / Fiji.
- قم بتثبيت البرنامج (https://imagej.net/Fiji/Downloads).
- ابدأ ImageJ / Fiji. استيراد الصورة الكروية: > فتح الملف.
- لتعيين المقياس، اختر زر الخط في شريط الأدوات وحدد خط شريط المقياس في الصورة بنقرة الماوس: تحليل > تعيين المقياس. باستخدام مسافة معروفة ، املأ مسافة شريط المقياس. قم بتغيير وحدة الطول إلى ميكرومتر. انقر فوق الحقل العمومي لتعيين الإعدادات لجميع الصور التي لها نفس عامل التكبير.
- تحويل الصورة إلى 8 بت: > الصورة اكتب > 8 بت.
- اختر Image > Adjust > Auto Threshold (حدد > عدم إعادة تعيين النطاق). يتم تمييز الكروي باللون الأحمر أو الأسود اعتمادا على علامة العتبة المختارة. اضبط أشرطة التمرير بحيث تتحول وحدات البكسل الكروية إلى اللون الأحمر ، لكن وحدات البكسل غير الكروية لا تغير لونها. أغلق نافذة الحوار Threshold دون النقر فوق أي من الأزرار.
- لحساب مساحة المقطع العرضي للكبوي، اختر تحليل > تعيين القياسات وانقر فوق المنطقة والحد إلى العتبة وعرض التسمية. أغلق نافذة الحوار Set Measurements بالنقر فوق OK.
- لإظهار النتائج، اختر تحليل > تحليل الجسيمات وقم بتغيير الحجم (ميكرومتر2) = 10000 إلى ما لا نهاية لإزالة الضوضاء. انقر فوق الزر عرض النتائج وأغلق النافذة بالنقر فوق موافق. في النتائج، يتم عرض الكرات الكروية مع التسمية والمنطقة. من خلال تكرار تحليلات العديد من الكرات ، يتم سرد النتائج في نافذة النتائج .
- لتحديد استجابة العلاج النسبية للكفيريات المعالجة بالصدمات الكهربائية مقارنة بالضوابط غير المعالجة والمفردة ، احسب النسبة المئوية للتغيرات في مساحة المقطع العرضي.
4. تحديد الجدوى الكروية
- قم بقياس الجدوى الكروية بعد 3-7 أيام من العلاج باستخدام مقايسة بقاء الخلية المناسبة لمزارع الخلايا ثلاثية الأبعاد وفقا لتعليمات الشركة المصنعة. يحتاج الاختبار إلى اختراق الكرات الكبيرة وتحللها للسماح باكتشاف الجدوى عن طريق تحديد كمية ATP ، مما يشير إلى وجود خلايا نشطة أيضيا.
ملاحظة: في هذه التجربة ، تم استخدام اختبار قائم على التلألؤ كطريقة قراءة. تمت مقارنة صلاحية الكرات المعالجة بالصدمات الكهربائية مع الضوابط بعد سبعة أيام من العلاج.
النتائج
أجريت التجارب باستخدام أقطاب كهربائية محمولة باليد مخصصة ، والتي تتكون من الفولاذ المقاوم للصدأ عالي الجودة. سمك الأقطاب الكهربائية 1 مم ، والعرض 4 مم ، والفجوة بين القطبين 4 مم وطول كل قطب كهربائي 8 مم (الشكل 1). EP والبليومايسين وحدهما ليس لهما تأثير كبير على بقاء ونمو كل من الفيرودات الكروية UM و CM. يظهر العلاج بالصدمات الكهربائية انخفاضا كبيرا في قابلية بقاء الورم وفي الحجم الكروي. لوحظ فقدان الهندسة الكروية مع شظايا الخلايا المفككة حول الكرويات والنخر في المنطقة الوسطى والمحيطية لجميع الكرويات المختبرة بعد العلاج بالصدمات الكهربائية مع البليومايسين. يوضح الشكل 2 نتائج خطوط الخلايا CM2005.1. أظهرت خطوط خلايا UM النقيلية استجابة أعلى مقارنة بخطوط الخلايا الأولية بعد ECT8.

الشكل 1: أقطاب كهربائية محمولة باليد. الأقطاب الكهربائية مصنوعة من الفولاذ المقاوم للصدأ عالي الجودة. يتم توفير مقبض الأقطاب الكهربائية مع المثقاب الكهربائي. سمك الأقطاب الكهربائية 1 مم ، والعرض 4 مم ، والفجوة بين القطبين 4 مم وطول كل قطب 8 مم (أ) ؛ التثقيب الكهربائي للكفيريات بتنسيق 96 بئر (ب). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
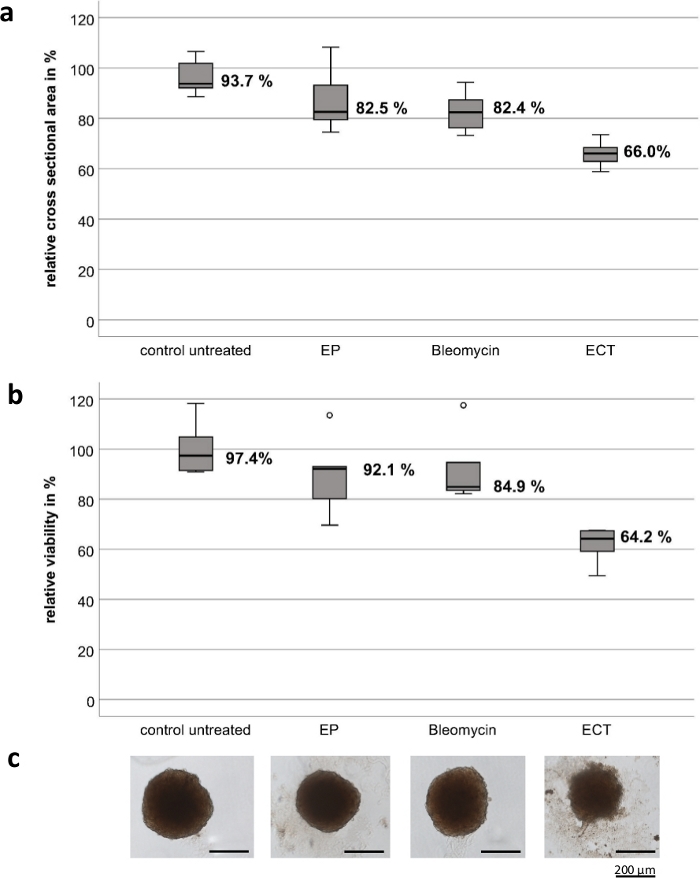
الشكل 2: التأثير السام للخلايا للعلاج الكيميائي الكهربائي على كرويات الورم في خط خلايا الورم الميلانيني الملتحمة CM2005.1. تسبب العلاج الكيميائي الكهربائي (ECT، 750 فولت/سم بعد تطبيق 2.5 ميكروغرام/مل من البليومايسين) في تأثيرات سامة للخلايا أقوى في الكرويات مقارنة بالتثقيب الكهربائي وحده أو العلاج الكيميائي باستخدام البليومايسين (2.5 غ/مل) وحده. تم قياس التأثير السام للخلايا عن طريق حساب كل من مساحة المقطع العرضي ومقايسة الجدوى كنسبة مئوية من السيطرة غير المعالجة بعد سبعة أيام من العلاج. تظهر المخططات الصندوقية متوسط مساحة المقطع العرضي للكرويات (أ) ؛ متوسط صلاحية الأجسام الكروية (ب) ؛ صور تمثيلية للكرات ، شريط المقياس = 200 ميكرومتر (C). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يستخدم EP في العديد من التطبيقات التكنولوجية الحيوية والسريرية12. قد تساعد التطورات التكنولوجية الجديدة ، مثل الأقطاب الكهربائية المصممة خصيصا ذات الخصوصية العالية لكل خلية وموقع مستهدف ، على استهداف الأنسجة بالصدمات الكهربائية في أي مكان في الجسم12. يجب أن يسمح تصميم الأقطاب الكهربائية وموضعها بالوصول الكامل للورم والتأكد من أن الأنسجة السليمة تتأثر بالحد الأدنى فقط أو لا تتلف من العلاج13.
أظهرت المنشورات السابقة تأثير العلاج بالصدمات الكهربائية في معلقات خلايا الورم الميلانيني البشري في المختبر7،8. الأدبيات التي تشير إلى تطبيق العلاج بالصدمات الكهربائية في نماذج خلايا العين ثلاثية الأبعاد أو غيرها من البيئات المماثلة في الجسم الحي ، مما يتيح استخداما علاجيا أكثر أمانا ، محدودة. يفترض Brun et al. أن الخلايا ثلاثية الأبعاد في السقالة أثناء التحليل المورفولوجي لها شكل دائري مختلف عن الشكل الممدود الموضح في الثقافات ثنائية الأبعاد ولكنها تشبه إلى حد كبير الخلايا من خزعات المرضى9. قد يؤدي تحسين إعدادات العلاج والأدوات المستخدمة في الثقافات ثلاثية الأبعاد إلى تحسين معلمات العلاج بالصدمات الكهربائية ، مما يسمح بنهج سريري أكثر دقة9.
نصف تطورا تقنيا فيما يتعلق بأقطاب كهربائية جديدة لتطبيق العلاج بالصدمات الكهربائية في مزارع الخلايا ثلاثية الأبعاد. Bleomycin هو العامل السام للخلايا الأكثر شيوعا بالاشتراك مع ECT11. أظهرت الدراسات السابقة لمجموعتنا أن إعدادات EP المطبقة (750 فولت / سم ، 8 نبضات ، 100 مللي ثانية ، 5 هرتز) كانت مناسبة لعلاج أورام العين في المختبر. تشمل الخطوات الحاسمة لهذه التقنية الوقت القصير اللازم لإجراء العلاج بالصدمات الكهربائية أثناء غرق الكرة الكروية بعد التعبئة بالإضافة إلى البعد الدقيق للأقطاب الكهربائية. كانت الحاجة إلى الأقطاب الكهربائية المخصصة بسبب الصعوبات في إجراء العلاج بالصدمات الكهربائية في الآبار باستخدام الأدوات المتاحة. أظهرت البيانات غير المنشورة من مجموعتنا زيادة في الضرر الكروي عند نقل الكرويات إلى بئر أكبر أو إلى كوفيت لإعدادها للعلاج ثم العودة إلى بئر المزرعة. تتمثل إحدى ميزات التقنية الموصوفة في عدم وجود معالجة كروية لإجراء العلاج ، لأن العضيات لا يتم نقلها إلى ألواح أو آبار أكبر. لذلك ، تحتفظ جميع الكرات بشكلها. ميزة أخرى هي استخدام فحوصات الجدوى ثلاثية الأبعاد أكثر قوة لتحديد السمية الخلوية للصدمات الكهربائية مقارنة بمقايسات الجدوى القياسية ، مثل اختبار MTT. وبالتالي ، يتم تحلل جميع خلايا الكرة الكروية ويلزم غسل الخلايا الإضافي وإزالة خطوات الماصة المتوسطة والمتعددة.
قيود الطرق الموصوفة هي العمر القصير للكرويات ، مما يؤثر على حجم الورم وكذلك نخر الخلية ، كما هو موضح في مركز العضوية الورمية. يتطلب معدل الوفيات المرتفع المرتبط في كل من CM و UM والخيارات العلاجية المحدودة إثراء الإمكانيات العلاجية الموجودة. قد يوفر العلاج بالصدمات الكهربائية طريقة مساعدة لتحسين نوعية حياة المريض وإطالة عمر المريض. تحاكي هذه الظروف المختبرية الإعداد في الجسم الحي بدقة أعلى ، مما يوفر نتائج واعدة لمزيد من التطبيقات البشرية. يمكن للدراسات المستقبلية باستخدام الكرويات المحضرة من الثقافات الأولية أن تقدم نتائج أكثر تمثيلا لتحسين إعدادات العلاج بالصدمات الكهربائية للعلاج المستهدف.
Disclosures
لم يتلق هذا التقرير أي منحة محددة من أي وكالة تمويل في القطاعات العامة أو التجارية أو غير الهادفة للربح.
Acknowledgements
تم دعم هذه الدراسة من قبل الدكتور رولف م. Schwiete-Stiftung. يشكر المؤلفون مارتين جيه جاغر (مختبر طب العيون في LUMC ، ليدن ، هولندا) وهيلين كاليراي (مجموعة أبحاث أورام العين في ليفربول ، طب السرطان الجزيئي والسريري ، جامعة ليفربول ، المملكة المتحدة) لتوفير خطوط خلايا UM. نود أيضا أن نشكر سابين هيشت (قسم طب العيون، مستشفى جامعة هالي (سالي)، ألمانيا) على المساعدة الفنية.
Materials
| Name | Company | Catalog Number | Comments |
| Bleomycin sulfate | Enzo | BML-AP302-0010 | 10 mg |
| Cell culture flask 75 cm | TPP | TPP90076 | |
| Cell culture flask TC175 cm | Sarstedt | 83,39,12,002 | Standard with Filter |
| Cliniporator | IGEA | EPS01 | Electroporator |
| Corning Costar Ultra-Low Attachment Multiple Well Plate, 96 well, round bottom | Corning | 7007 | 96Well clear round Bottom, Ultra low attachment plates |
| EGF 1MG | Sigma-Aldrich | E4127-.1MG | |
| F-12 K Nut Mix (1x) | Gibco | 21127-022 | |
| Fetal Bovine Serum, South American | Corning | 35-079-CV | LOT Nr. 35079010, Reservierungsnummer: EU00478541 |
| FKS | |||
| KGM-2 | Lonza | CC-3103 | |
| PBS w/o. CaCl und MgCl | PromoCell | C-40232 | 500 ml |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333-100ml | |
| RPMI 1640 | Gibco | 11504566 | ATCC modification, HEPES, liquid, 500 ml |
| Tecan Infinity M Plex | Tecan | ||
| Trypsin-EDTA 1x Solution | Sigma-Aldrich | 59430C-100ml |
References
- Kaliki, S., Shields, C. L. Uveal melanoma: relatively rare but deadly cancer. Eye (Lond). 31 (2), 241-257 (2017).
- Chang, A. E., Karnell, L. H., Menck, H. R. The National Cancer Data Base report on cutaneous and noncutaneous melanoma: a summary of 84,836 cases from the past decade. The American College of Surgeons Commission on Cancer and the American Cancer Society. Cancer. 83 (8), 1664-1678 (1998).
- Dogrusoz, M., Jager, M. J., Damato, B. Uveal Melanoma Treatment and Prognostication. Asia-Pacific Journal of Ophthalmology. 6 (2), 186-196 (2017).
- Damato, B., Coupland, S. E. Management of conjunctival melanoma. Expert Review of Anticancer Therapy. 9 (9), 1227-1239 (2009).
- Norregaard, J. C., Gerner, N., Jensen, O. A., Prause, J. U. Malignant melanoma of the conjunctiva: occurrence and survival following surgery and radiotherapy in a Danish population. Graefe's Archive for Clinical and Experimental Ophthalmology. 234 (9), 569-572 (1996).
- Fiorentzis, M., et al. Electrochemotherapy with bleomycin and cisplatin enhances cytotoxicity in primary and metastatic uveal melanoma cell lines in vitro. Neoplasma. 65 (2), 210-215 (2018).
- Fiorentzis, M., et al. Conjunctival melanoma and electrochemotherapy: preliminary results using 2D and 3D cell culture models in vitro. Acta Ophthalmologica. 97 (4), 632-640 (2019).
- Fiorentzis, M., et al. The Potential Use of Electrochemotherapy in the Treatment of Uveal Melanoma: In vitro Results in 3D Tumor Cultures and In vivo Results in a Chick Embryo Model. Cancers (Basel). 11 (9), (2019).
- Brun, P., et al. Cell-seeded 3D scaffolds as in vitro models for electroporation. Bioelectrochemistry. 125, 15-24 (2019).
- Sersa, G., et al. Electrochemotherapy in treatment of tumours. European Journal of Surgical Oncology. 34 (2), 232-240 (2008).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529(2017).
- Miklavcic, D., et al. Electrochemotherapy: technological advancements for efficient electroporation-based treatment of internal tumors. Medical & Biological Engineering & Computing. 50 (12), 1213-1225 (2012).
- Miklavcic, D., Corovic, S., Pucihar, G., Pavselj, N. Importance of tumour coverage by sufficiently high local electric field for effective electrochemotherapy. EJC Supplements. 4 (11), 45-51 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved