Method Article
使用定制电极对 3D 眼黑色素瘤球体进行电化学疗法
摘要
在这里,我们提出了一种开发 3D 结膜和葡萄膜黑色素瘤球体的方案,以及使用手持式定制电极在培养孔中对 3D 球体进行体外电化学。这为电化学疗法在眼部黑色素瘤治疗中的应用提供了新的视角。
摘要
电化学疗法 (ECT) 是电脉冲应用后瞬时孔形成与细胞毒性药物给药的结合,由于膜变化,它增强了所施用药物的细胞毒性作用。体外 3D 培养系统模拟体内肿瘤生长,比传统的单层细胞培养更准确地保留肿瘤的生物学特性。我们描述了一种使用结膜黑色素瘤 (CM) 和葡萄膜黑色素瘤 (UM) 细胞系以及使用手持式定制电极开发 3D 肿瘤类器官的方案,适用于在培养孔中进行体外 ECT,而不会破坏肿瘤环境。该方案分析 3D CM 和 UM 球体的培养和生长以及它们对单独博来霉素 (2.5 μg/mL)、单独电穿孔 (EP)(750 伏/厘米,8 个脉冲,100 μs,5 Hz)和 ECT 的反应作为 EP 和博来霉素的组合。根据先前的实验,该方案中使用的药物浓度和 EP 设置被确定为首选的 ECT 条件。用于确定球状体活力的测定在治疗后 3-7 天进行。仅在 ECT 后对 3D 肿瘤球体活力和生长的影响才显著。详细描述了定制的电极,以便于脉冲在培养孔中的应用。这种 3D UM 和 CM 球体的新疗法为未来的临床应用奠定了基础。
引言
葡萄膜黑色素瘤 (UM) 是成人最常见的原发性眼内肿瘤,而结膜黑色素瘤 (CM) 占所有眼部黑色素瘤的 2% 1,2,3,4,5,6。近距离放射治疗、质子束放疗和光疗是 UM 的一线治疗方法,而眼球摘除术可能是必要的 1,2,3。CM 的治疗因眼肿瘤学中心而异;切除活检后进行局部化疗和/或放疗是最常见的治疗方法4。尽管接受了治疗,但 CM 的死亡率为 25%-30%5。
关于 CM 和 UM 球体的形成以及 ECT 在眼部黑色素瘤中的应用的文献很少 6,7,8。肿瘤球体比传统的 2D 细胞培养物具有更好的生物学特征,并已被提议作为模拟体内肿瘤环境的有用工具9。电化学疗法 (ECT) 将非渗透性细胞毒性药物的使用与电穿孔 (EP) 相结合10。EP 是短而强电脉冲的局部应用,可瞬时透化细胞,从而局部增加癌细胞中抗癌药物的摄取,并导致细胞死亡增加11。本研究建立了描述 CM 和 UM 球体发育的方案,并调查了博来霉素 ECT 后的结果。该协议可以帮助眼肿瘤学领域的研究人员对球体使用其他治疗方式或研究 ECT 的进一步影响。由于 ECT 在眼科中的使用有限,因此对这种方式的效果和过程知之甚少;因此,该实验可能会扩大未来的治疗选择范围。我们提出了一种新颖的定制手持式板电极设置,它允许在培养孔中对球体进行 ECT,而不会破坏肿瘤环境。
研究方案
1. 球体形成
- 使用贴壁生长的癌细胞系形成球状体。
- 在无菌工作台条件下提供所有细胞培养相关步骤。
- 按照目标细胞系的推荐制备标准完全培养基,并使用水浴加热至 37 °C。
注:在这里,使用人结膜细胞系 CM2005.1、CRMM1、CRMM2 以及葡萄膜黑色素瘤细胞系 92.1、OMM1 和 OMM2,并在分别含有 10% 胎牛血清和含有 10% 胎牛血清的 RPMI 的 Ham F-12 培养基中培养。 - 使用标准酶消化方法(例如,胰蛋白酶-EDTA 溶液)分离目标细胞。
- 为了确定重要细胞的数量,将 10 μL 细胞悬液重悬于 10 μL 台盼蓝溶液 (1:1) 中,并在 5 分钟内使用腔室(血细胞计数器或自动细胞计数器)对细胞进行计数。细胞应达到 <90% 的汇合度并处于良好状态。
- 为了形成球状体,在 96 孔超低附着板中接种每孔 5 x 103 个细胞,总体积为 200 μL 的完全培养基。将板在 37 °C 下在含有 5% CO2 的潮湿环境中孵育。
注:为了有效抑制细胞附着,请使用表面带有共价结合的亲水性、非离子、中性电荷水凝胶的超低附着板。这种水凝胶抑制细胞永生化,迫使它们进入悬浮状态以构建 3D 球状体。 - 使用显微镜检查球状体的形成。
注意:一些细胞系在第一次传代时不形成圆形 3D 肿瘤球体。在肿瘤球培养物开始形成暗中心之前传代。4-10 天后,通过胰蛋白酶消化根据细胞系解离肿瘤块。然后,将单细胞接种在新鲜的 96 超低贴壁板中。通过重复此过程进行多次传代,细胞将适应 3D 培养。
2. 肿瘤球体的电化学
- 作为测定对照,使用未处理的球体和仅用 EP 或博来霉素处理的球体。
- 调整电穿孔仪的设置(脉冲计数、脉冲频率、持续时间和电压;参见材料表)。对于黑色素瘤细胞,使用 8 个强度为 750 V/cm、100 μs 脉冲持续时间、5 Hz 重复频率的方波电脉冲。
- 在球状体培养的第 3 天,在 15 mL 试管中,在无菌 PBS 中制备浓度为 5 μg/mL 的新鲜博来霉素硫酸盐溶液。
- 通过去除 200 μL 培养基并重新填充每个孔的 100 μL 新鲜完全培养基来更换球状体的细胞培养基。
- 向每个孔中加入 100 μL 硫酸博来霉素溶液(终浓度 2.5 μg/mL)。将 100 μL 新鲜培养基添加到未处理的对照和仅用 EP 而不是硫酸博来霉素溶液处理的球状体中。
- 进行电穿孔。
注: 图 1 所示的电极是在哈勒-维滕贝格大学的研究车间生产的。它们由不锈钢制成,适合电穿孔仪的手柄。电极设计用于 96 孔超低连接板。类似的不锈钢电极也可以很容易地制造用于其他应用。- 用 70% 乙醇对电极进行消毒,并让电极干燥。电极的直径为 1 mm,两个电极之间的间隙为 4 mm,每个电极的长度为 8 mm(图 1a)。
- 将电极放在孔的底部,球体位于电极之间。这允许球体在两个电极之间实现理想定位(图 1b)。
- 摇动板,让球体从孔底部移动并放置在电极之间。球体只会在电极之间停留几秒钟。
- 使用首选设置开始电穿孔。
- 用 150 μL 新鲜培养基交换 150 μL 培养基,更换孔中的硫酸博来霉素溶液。
- 将细胞在 37 °C 下在含有 5% CO2 的潮湿环境中孵育长达 10 天。如果未处理的球体开始形成暗中心,请终止实验。每 2-3 天更换 150 μL 细胞培养基。因此,通过将移液器吸头定位在孔的边缘区域,倾斜板并缓慢移液来避免球状体破坏。
3. 球体大小的测定
- 通过使用 ImageJ Fiji11 计算球体的横截面积,使用明场显微镜测量治疗当天(起点)和治疗后 3-7 天的球体大小。
- 使用比例尺拍摄单个椭球体的图像。使用使整个椭球体可见的放大倍数。例如,CM2005.1 使用 5 倍放大倍率。将图像另存为 JPEG。
- 通过使用 ImageJ/Fiji 计算横截面积来分析球体大小。
- 安装软件 (https://imagej.net/Fiji/Downloads)。
- 启动 ImageJ/Fiji。导入 spheroid-image: File > Open。
- 要设置比例,请选择工具栏的线条按钮,然后通过鼠标单击在图像中标记比例尺的线条: Analyze > Set Scale。使用已知距离,填写比例尺的距离。将 Unit of length (长度单位) 更改为 μm。单击字段 global 可为具有相同放大系数的所有图像分配设置。
- 将图像转换为 8 位: 图像 > 类型 > 8 位。
- 选择 Image > Adjust > Auto Threshold(选择>不重置范围) Adjust Auto Threshold)中进行选择。旋转椭球体标记为红色或黑色,具体取决于所选的阈值标记。调整滑块,使球状体像素变为红色,但非球状体像素不会改变颜色。关闭 Threshold 对话框窗口,而不单击任何按钮。
- 要计算椭球体的横截面积,请选择 Analyze > Set Measurements,然后单击 Area (面积)、Limit to Threshold (限制为阈值) 和 Display label(显示标签)。单击 OK 关闭 Set Measurements 对话框窗口。
- 要显示结果,请选择 Analyze > Analyze Particles 并更改大小 (μm2) = 10000-infinity 以去除噪声。单击按钮 Display results ,然后单击 OK 关闭窗口。在 Results (结果) 中,将显示带有标签和面积的椭球体。通过重复对多个椭球体的分析,结果将列在 结果 窗口中。
- 为了确定 ECT 处理的球体与未处理和单一处理的对照相比的相对处理反应,计算横截面积的百分比变化。
4. 球状体活力的测定
- 根据制造商的说明,使用适用于3D细胞培养物的细胞活力测定法,在处理后3-7天测量球体活力。该检测需要穿透并裂解大球状体,以便通过定量 ATP 来检测活力,ATP 表明存在代谢活性细胞。
注意:在本实验中,使用基于发光的测定作为读数方法。将 ECT 处理的球体的活力与治疗后 7 天与对照组进行比较。
结果
实验是使用定制的手持式电极进行的,这些电极由高级不锈钢制成。电极的厚度为 1 mm,宽度为 4 mm,两个电极之间的间隙为 4 mm,每个电极的长度为 8 mm(图 1)。单独的 EP 和博来霉素对 UM 和 CM 肿瘤球体的活力和生长没有显着影响。ECT 显示肿瘤活力和球体大小的显着降低。在用博来霉素进行 ECT 后,观察到球状体结构丢失,球状体周围解构的细胞碎片,以及所有测试球状体的中央和外围区域坏死。 图 2 显示了 CM2005.1 细胞系的结果。与 ECT8 后的原代细胞系相比,转移性 UM 细胞系显示出更高的反应。

图 1:定制的手持式电极。 电极由高级不锈钢制成。电极的手柄配有电穿孔仪。电极的厚度为 1 mm,宽度为 4 mm,两个电极之间的间隙为 4 mm,每个电极的长度为 8 mm (a);在 96 孔规格中对球体进行电穿孔 (B)。 请单击此处查看此图的较大版本。
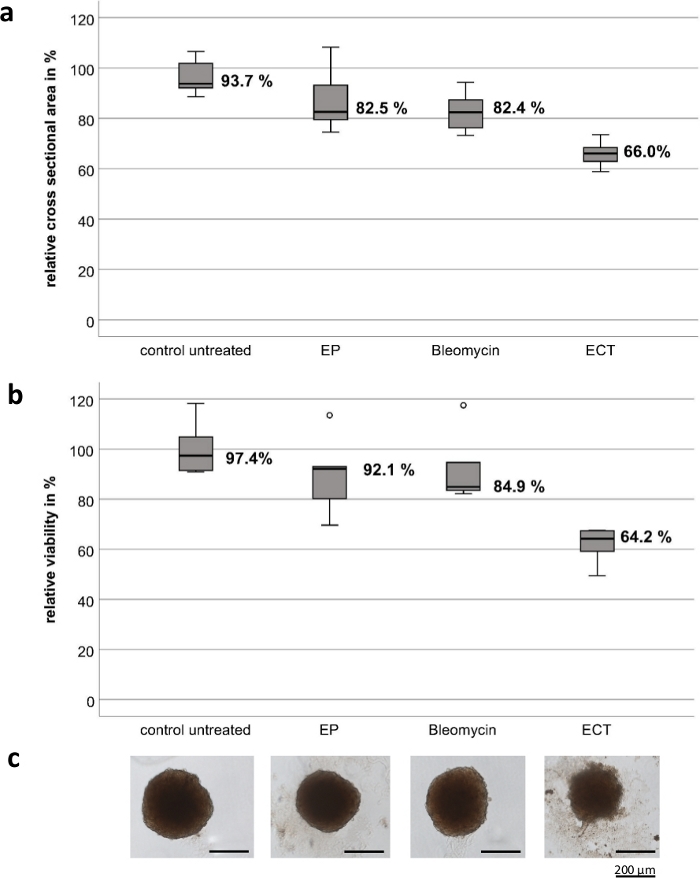
图 2:电化学疗法对结膜黑色素瘤细胞系 CM2005.1 肿瘤球体的细胞毒作用。 与单独电穿孔 (EP) 或单独使用博来霉素 (2.5 g/mL) 的化疗相比,电化学疗法 (ECT,应用博来霉素后 750 V/cm) 对球体产生更强的细胞毒作用。通过计算横截面积和活力测定作为治疗后 7 天未处理对照的百分比来测量细胞毒作用。箱形图显示椭球体的平均横截面积 (a);球体的平均活力 (b);球体的代表性图像,比例尺 = 200 μm (C)。 请单击此处查看此图的较大版本。
讨论
EP 用于各种生物技术和临床应用12。新技术的发展,例如针对每个靶细胞和部位具有高度特异性的专门设计的电极,可能有助于 ECT 靶向身体任何部位的组织12。电极的设计和位置必须允许肿瘤完全可及,并确保健康组织仅受到治疗的最小影响或损伤13。
以前的出版物显示了 ECT 在体外对人黑色素瘤细胞悬液的影响 7,8。提及 ECT 在 3D 眼细胞模型或其他类似体内环境中应用的文献是有限的,以实现更安全的治疗利用。Brun 等人假设,在形态学分析过程中,支架中的 3D 细胞具有圆形,与 2D 培养物中显示的细长形状不同,但与患者活检的细胞极为相似9。3D 培养中使用的治疗设置和仪器的改进可能会导致 ECT 参数的优化,从而允许更准确的临床方法9。
我们描述了一种关于在 3D 细胞培养中应用 ECT 的新电极的技术发展。博来霉素是与 ECT11 联合使用最常用的细胞毒性药物。我们小组以前的研究表明,应用的 EP 设置(750 伏/厘米,8 个脉冲,100 毫秒,5 赫兹)适用于体外治疗眼部肿瘤。该技术的关键步骤包括在球体动员后下沉时执行 ECT 所需的时间短,以及电极的精确尺寸。定制电极的必要性是由于使用现有仪器在孔中进行 ECT 的困难。我们小组未发表的数据显示,当将球体转移到更大的孔或比色皿中以准备处理,然后返回培养孔时,球体损伤增加。所述技术的一个优点是无需球体作来执行处理,因为类器官不会转移到更大的板或孔中。因此,所有椭球体都保持其形状。另一个优点是与标准活力检测(如 MTT 检测)相比,使用更稳定的 3D 活力检测来确定 ECT 的细胞毒性。因此,球状体的所有细胞都被裂解,并且需要额外的细胞洗涤、去除培养基和多个移液步骤。
所描述方法的局限性是球体的寿命短,这会影响肿瘤的大小以及细胞坏死,如肿瘤类器官中心所示。CM 和 UM 相关的高死亡率和有限的治疗选择需要丰富现有的治疗可能性。ECT 可能为改善患者的生活质量和延长患者的生存期提供辅助治疗。这些体外条件以更高的精度模拟体内设置,为进一步的人类应用提供了有希望的结果。使用原代培养物制备的球状体的未来研究可以为优化靶向治疗的 ECT 设置提供更具有代表性的结果。
披露声明
本报告未收到来自公共、商业或非营利部门的任何资助机构的专项资助。
致谢
这项研究得到了 Rolf M. Schwiete-Stiftung 博士的支持。作者感谢 Martine J. Jager(荷兰莱顿 LUMC 眼科实验室)和 Helen Kalirai(英国利物浦大学分子和临床癌症医学利物浦眼肿瘤学研究小组)提供 UM 细胞系。我们还要感谢 Sabine Hecht(德国哈勒大学医院(萨勒河)眼科)提供的技术帮助。
材料
| Name | Company | Catalog Number | Comments |
| Bleomycin sulfate | Enzo | BML-AP302-0010 | 10 mg |
| Cell culture flask 75 cm | TPP | TPP90076 | |
| Cell culture flask TC175 cm | Sarstedt | 83,39,12,002 | Standard with Filter |
| Cliniporator | IGEA | EPS01 | Electroporator |
| Corning Costar Ultra-Low Attachment Multiple Well Plate, 96 well, round bottom | Corning | 7007 | 96Well clear round Bottom, Ultra low attachment plates |
| EGF 1MG | Sigma-Aldrich | E4127-.1MG | |
| F-12 K Nut Mix (1x) | Gibco | 21127-022 | |
| Fetal Bovine Serum, South American | Corning | 35-079-CV | LOT Nr. 35079010, Reservierungsnummer: EU00478541 |
| FKS | |||
| KGM-2 | Lonza | CC-3103 | |
| PBS w/o. CaCl und MgCl | PromoCell | C-40232 | 500 ml |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333-100ml | |
| RPMI 1640 | Gibco | 11504566 | ATCC modification, HEPES, liquid, 500 ml |
| Tecan Infinity M Plex | Tecan | ||
| Trypsin-EDTA 1x Solution | Sigma-Aldrich | 59430C-100ml |
参考文献
- Kaliki, S., Shields, C. L. Uveal melanoma: relatively rare but deadly cancer. Eye (Lond). 31 (2), 241-257 (2017).
- Chang, A. E., Karnell, L. H., Menck, H. R. The National Cancer Data Base report on cutaneous and noncutaneous melanoma: a summary of 84,836 cases from the past decade. The American College of Surgeons Commission on Cancer and the American Cancer Society. Cancer. 83 (8), 1664-1678 (1998).
- Dogrusoz, M., Jager, M. J., Damato, B. Uveal Melanoma Treatment and Prognostication. Asia-Pacific Journal of Ophthalmology. 6 (2), 186-196 (2017).
- Damato, B., Coupland, S. E. Management of conjunctival melanoma. Expert Review of Anticancer Therapy. 9 (9), 1227-1239 (2009).
- Norregaard, J. C., Gerner, N., Jensen, O. A., Prause, J. U. Malignant melanoma of the conjunctiva: occurrence and survival following surgery and radiotherapy in a Danish population. Graefe's Archive for Clinical and Experimental Ophthalmology. 234 (9), 569-572 (1996).
- Fiorentzis, M., et al. Electrochemotherapy with bleomycin and cisplatin enhances cytotoxicity in primary and metastatic uveal melanoma cell lines in vitro. Neoplasma. 65 (2), 210-215 (2018).
- Fiorentzis, M., et al. Conjunctival melanoma and electrochemotherapy: preliminary results using 2D and 3D cell culture models in vitro. Acta Ophthalmologica. 97 (4), 632-640 (2019).
- Fiorentzis, M., et al. The Potential Use of Electrochemotherapy in the Treatment of Uveal Melanoma: In vitro Results in 3D Tumor Cultures and In vivo Results in a Chick Embryo Model. Cancers (Basel). 11 (9), (2019).
- Brun, P., et al. Cell-seeded 3D scaffolds as in vitro models for electroporation. Bioelectrochemistry. 125, 15-24 (2019).
- Sersa, G., et al. Electrochemotherapy in treatment of tumours. European Journal of Surgical Oncology. 34 (2), 232-240 (2008).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529(2017).
- Miklavcic, D., et al. Electrochemotherapy: technological advancements for efficient electroporation-based treatment of internal tumors. Medical & Biological Engineering & Computing. 50 (12), 1213-1225 (2012).
- Miklavcic, D., Corovic, S., Pucihar, G., Pavselj, N. Importance of tumour coverage by sufficiently high local electric field for effective electrochemotherapy. EJC Supplements. 4 (11), 45-51 (2006).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。