Method Article
Eletroquimioterapia em Esferoides de Melanoma Ocular 3D utilizando Eletrodo Customizado
Neste Artigo
Resumo
Aqui, apresentamos um protocolo para o desenvolvimento de esferoides de melanoma conjuntival e uveal 3D e o uso de eletrodos customizados portáteis para eletroquimioterapia in vitro de esferoides 3D em um poço de cultura. Isso oferece novas perspectivas no uso da eletroquimioterapia no tratamento do melanoma ocular.
Resumo
A eletroquimioterapia (ECT) é a combinação da formação transitória de poros após a aplicação de pulso elétrico com a administração de drogas citotóxicas, o que aumenta o efeito citotóxico do agente aplicado devido a alterações na membrana. Os sistemas de cultura 3D in vitro simulam o crescimento tumoral in vivo e preservam as características biológicas dos tumores com mais precisão do que as culturas de células monocamada convencionais. Descrevemos um protocolo para o desenvolvimento de organoides tumorais 3D usando linhagens celulares de melanoma conjuntival (CM) e melanoma uveal (UM), bem como o uso de eletrodos personalizados portáteis, adequados para ECT in vitro no poço de cultura sem destruição do ambiente tumoral. Este protocolo analisa a cultura e o crescimento de esferoides 3D CM e UM e sua reação à bleomicina (2,5 μg/mL) isoladamente, eletroporação (EP) (750 Volts/cm, 8 pulsos, 100 μs, 5 Hz) isoladamente e ECT como uma combinação de EP e bleomicina. A concentração do medicamento e as configurações de EP usadas neste protocolo foram estabelecidas como condições preferidas de ECT de acordo com experimentos anteriores. O ensaio usado para determinar a viabilidade esferóide foi realizado 3-7 dias após o tratamento. O efeito sobre a viabilidade e o crescimento dos esferoides tumorais 3D foi significativo somente após a ECT. Os eletrodos personalizados são descritos em detalhes para facilitar a aplicação de pulsos no poço de cultura. Este novo tratamento de esferoides 3D UM e CM estabelece um trampolim para futuras aplicações clínicas.
Introdução
O melanoma uveal (UM) é o tumor intraocular primário mais comum em adultos, enquanto o melanoma conjuntival (MC) representa 2% de todos os melanomas oculares 1,2,3,4,5,6. A braquiterapia, a radioterapia com feixe de prótons e a fototerapia são os tratamentos de primeira linha na UM, enquanto a enucleação do globo ocular pode ser necessária 1,2,3. O tratamento do MC varia entre os centros de oncologia ocular; A biópsia excisional seguida de quimioterapia local e/ou radioterapia é a abordagem de tratamento mais frequente4. Apesar do tratamento, o MC está associado a uma mortalidade de 25% a 30%5.
Há escassez de literatura sobre a formação de esferoides CM e UM e a aplicação da ECT no melanoma ocular 6,7,8. Os esferoides tumorais têm melhores características biológicas do que as culturas de células 2D convencionais e foram propostos como uma ferramenta útil para imitar o ambiente tumoral in vivo9. A eletroquimioterapia (ECT) combina o uso de drogas citotóxicas não permeáveis com a eletroporação (EP)10. PE é a aplicação local de pulsos elétricos curtos e intensos que permeabilizam transitoriamente as células para um aumento localizado da captação de drogas anticâncer nas células cancerígenas e resulta em aumento da morte celular11. Este estudo estabelece um protocolo descrevendo o desenvolvimento de esferoides CM e UM e investiga os resultados após ECT com bleomicina. Este protocolo pode ajudar os investigadores no campo da oncologia ocular usando outras modalidades terapêuticas em esferoides ou estudar outros efeitos da ECT. Devido ao uso limitado da ECT em oftalmologia, há pouco conhecimento sobre o efeito e o processo dessa modalidade; Assim, este experimento pode ampliar o espectro de opções de tratamento no futuro. Propomos uma nova configuração de eletrodo de placa portátil personalizada, que permite a ECT do esferóide nos poços de cultura sem qualquer destruição do ambiente tumoral.
Protocolo
1. Formação de esferóides
- Use linhas de células cancerígenas de crescimento aderente para a formação de esferoides.
- Forneça todas as etapas associadas à cultura de células em condições de bancada estéreis.
- Preparar o meio de cultura completo padrão, conforme recomendado para as linhas celulares em causa, e aquecer a 37 °C em banho-maria.
NOTA: Aqui, as linhagens celulares conjuntivais humanas CM2005.1, CRMM1, CRMM2, bem como as linhagens celulares de melanoma uveal 92.1, OMM1 e OMM2 foram utilizadas e cultivadas em meio Ham F-12 contendo 10% de soro fetal bovino e RPMI contendo 10% de soro fetal bovino, respectivamente. - Separe as células de interesse usando métodos de digestão enzimática padrão (por exemplo, solução de tripsina-EDTA).
- Para determinar o número de células vitais, ressuspenda 10 μL da suspensão celular em 10 μL de solução de azul de tripano (1:1) e conte as células usando uma câmara (hemocitômetro ou contador de células automatizado) em 5 minutos. As células devem estar <90% de confluência e em boas condições.
- Para formar esferoides, semeie 5 x 103 células por poço com um volume total de 200 μL de meio de cultura completo em placas de fixação ultrabaixa de 96 poços. Incubar a placa a 37 °C numa atmosfera humidificada contendo 5% de CO2.
NOTA: Para uma inibição eficaz da ligação celular, use placas de fixação ultrabaixas com um hidrogel hidrofílico, não iônico e carregado de forma neutra ligado covalentemente na superfície. Este hidrogel inibe a imortalização das células e as força a um estado suspenso para construir esferóides 3D. - Verifique a formação do esferóide usando um microscópio.
NOTA: Algumas linhagens celulares não formam esferóides tumorais redondos 3D na primeira passagem. Passe a cultura da esfera tumoral antes que eles comecem a desenvolver um centro escuro. Dissociar as massas tumorais dependendo da linhagem celular após 4-10 dias por tripsinização. Em seguida, semeie as células individuais em uma nova placa de fixação ultrabaixa 96. Ao repetir esse procedimento por várias passagens, as células se adaptarão à cultura 3D.
2. Eletroquimioterapia dos esferóides tumorais
- Como controle de ensaio, use esferóides não tratados e esferóides tratados apenas com EP ou bleomicina.
- Ajuste as configurações do eletroporador (contagem de pulsos, frequência de pulsos, tempo de duração e voltage; consulte a Tabela de Materiais). Para células de melanoma, use 8 pulsos elétricos de onda quadrada de 750 Volts/cm de força, duração de pulso de 100 μs, frequência de repetição de 5 Hz.
- No dia 3 da cultura esferóide, prepare uma solução fresca de sulfato de bleomicina em PBS estéril a uma concentração de 5 μg/mL em um tubo de 15 mL.
- Troque o meio de cultura celular dos esferóides removendo 200 μL de meio de cultura e reabastecendo com 100 μL de meio de cultura completo fresco para cada poço.
- Adicione 100 μL de solução de sulfato de bleomicina a cada poço (concentração final de 2,5 μg/mL). Adicione 100 μL de meio fresco a controles não tratados e esferóides tratados apenas com EP em vez de solução de sulfato de bleomicina.
- Realize a eletroporação.
NOTA: Os eletrodos mostrados na Figura 1 foram produzidos na oficina de pesquisa da Universidade de Halle-Wittenberg. Eles são feitos de aço inoxidável e se encaixam na empunhadura do eletroporador. Os eletrodos foram projetados para uso em placas de fixação ultrabaixa de 96 poços. Eletrodos de aço inoxidável semelhantes também podem ser facilmente fabricados para aplicações alternativas.- Esterilize os eletrodos com etanol a 70% e deixe os eletrodos secarem. O diâmetro dos eletrodos é de 1 mm, a folga entre os dois eletrodos é de 4 mm e o comprimento de cada eletrodo é de 8 mm (Figura 1a).
- Coloque os eletrodos no fundo do poço, com os esferóides entre os eletrodos. Isso permite o posicionamento ideal do esferóide entre os dois eletrodos (Figura 1b).
- Agite a placa para permitir que os esferóides se movam do fundo do poço e sejam colocados entre os eletrodos. O esferóide ficará apenas entre os eletrodos por alguns segundos.
- Inicie a eletroporação com as configurações preferidas.
- Substitua a solução de sulfato de bleomicina no poço trocando 150 μL de meio por 150 μL de meio fresco.
- Incubar as células por até 10 dias a 37 °C em uma atmosfera umidificada contendo 5% de CO2. Se os esferóides não tratados começarem a desenvolver um centro escuro, encerre o experimento. Troque 150 μL do meio de cultura celular a cada 2-3 dias. Assim, evite a ruptura do esferóide posicionando a ponta da pipeta na região da borda do poço, inclinando a placa e pipetando lentamente.
3. Determinação do tamanho do esferóide
- Meça o tamanho do esferóide no dia do tratamento (ponto de partida) e 3-7 dias após o tratamento usando microscopia de campo claro, calculando a área da seção transversal dos esferóides usando ImageJ Fiji11.
- Tire uma imagem dos esferóides individuais com a barra de escala. Use uma ampliação pela qual todo o esferóide seja visível. Por exemplo, a ampliação de 5x foi usada para CM2005.1. Salve a imagem como JPEG.
- Analise o tamanho do esferóide calculando a área da seção transversal usando ImageJ/Fiji.
- Instale o software (https://imagej.net/Fiji/Downloads).
- Inicie o ImageJ/Fiji. Importe a imagem esferoide: Arquivo > Abrir.
- Para definir a escala, escolha o botão de linha da barra de ferramentas e marque a linha da barra de escala na imagem com um clique do mouse: Analisar > Definir escala. Usando uma distância conhecida, preencha a distância da barra de escala. Altere a unidade de comprimento para μm. Clique no campo global para atribuir as configurações de todas as imagens com o mesmo fator de ampliação.
- Converter a imagem para 8 bits: Imagem > Digite > 8 bits.
- Escolha Imagem > Ajustar > Limite Automático (Selecione > Não redefinir intervalo). O esferóide é marcado em vermelho ou preto, dependendo do marcador de limiar escolhido. Ajuste os controles deslizantes para que os pixels esferoides fiquem vermelhos, mas os pixels não esferoides não mudem de cor. Feche a janela de diálogo Limite sem clicar em nenhum dos botões.
- Para calcular a área da seção transversal do esferoide, escolha Analisar > Definir Medidas e clique em Área, Limitar ao Limite e Exibir rótulo. Feche a janela de diálogo Definir medidas clicando em OK.
- Para mostrar os resultados, escolha Analisar > Analisar partículas e altere o tamanho (μm2) = 10000-infinito para remover o ruído. Clique no botão Exibir resultados e feche a janela clicando em OK. Nos Resultados, os esferoides com o rótulo e a área são mostrados. Ao repetir as análises de vários esferoides, os resultados são listados na janela Resultados .
- Para determinar a resposta relativa ao tratamento dos esferoides tratados com ECT em comparação com os controles não tratados e tratados individualmente, calcule as alterações percentuais da área da seção transversal.
4. Determinação da viabilidade esferóide
- Meça a viabilidade do esferóide 3-7 dias após o tratamento usando um ensaio de viabilidade celular adequado para culturas de células 3D de acordo com as instruções do fabricante. O ensaio precisa penetrar e lisar grandes esferóides para permitir a detecção de viabilidade por quantificação de ATP, que sinaliza a presença de células metabolicamente ativas.
NOTA: Neste experimento, foi utilizado um ensaio baseado em luminescência como método de leitura. A viabilidade dos esferoides tratados com ECT foi comparada com os controles sete dias após o tratamento.
Resultados
Os experimentos foram conduzidos com eletrodos portáteis personalizados, compostos de aço inoxidável de alta qualidade. A espessura dos eletrodos é de 1 mm, a largura é de 4 mm, a folga entre os dois eletrodos é de 4 mm e o comprimento de cada eletrodo é de 8 mm (Figura 1). EP e bleomicina isoladamente não têm efeito significativo na viabilidade e crescimento de esferoides tumorais UM e CM. A ECT mostra uma redução significativa na viabilidade do tumor e no tamanho do esferoide. Perda da arquitetura esferóide com fragmentos de células desconstruídas ao redor dos esferoides e necrose na região central e periférica de todos os esferoides testados foram observadas após ECT com bleomicina. A Figura 2 mostra os resultados das linhagens celulares CM2005.1. As linhagens celulares UM metastáticas mostraram uma resposta mais alta em comparação com as linhagens celulares primárias após ECT8.

Figura 1: Eletrodos portáteis personalizados. Os eletrodos são feitos de aço inoxidável de alta qualidade. A alça dos eletrodos é fornecida com o eletroporador. A espessura dos eletrodos é de 1 mm, a largura é de 4 mm, a folga entre os dois eletrodos é de 4 mm e o comprimento de cada eletrodo é de 8 mm (a); Eletroporação de esferoides em formato de 96 poços (B). Clique aqui para ver uma versão maior desta figura.
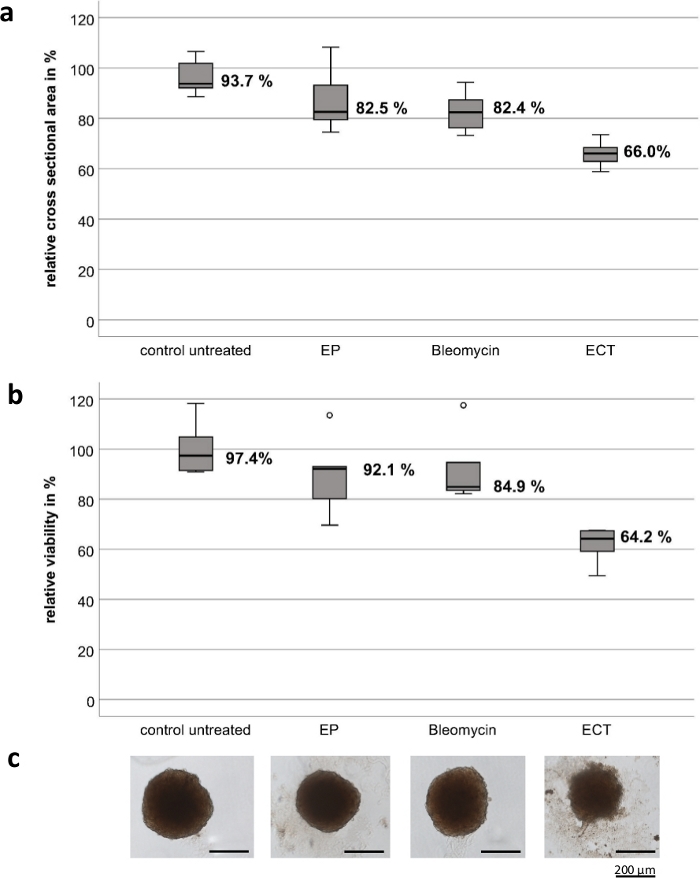
Figura 2: Efeito citotóxico da eletroquimioterapia em esferoides tumorais da linha celular de melanoma conjuntival CM2005.1. A eletroquimioterapia (ECT, 750 V/cm após a aplicação de 2,5 μg/mL de bleomicina) causou efeitos citotóxicos mais fortes nos esferoides em comparação com a eletroporação (EP) isolada ou quimioterapia com bleomicina (2,5 g/mL) isoladamente. O efeito citotóxico foi medido calculando a área da seção transversal e um ensaio de viabilidade como uma porcentagem do controle não tratado sete dias após o tratamento. Os gráficos de caixa mostram a área média da seção transversal dos esferóides (a); a viabilidade média dos esferóides (b); Imagens representativas de esferoides, barra de escala = 200 μm (c). Clique aqui para ver uma versão maior desta figura.
Discussão
A PE é utilizada em diversas aplicações biotecnológicas e clínicas12. Novos desenvolvimentos tecnológicos, como eletrodos especialmente projetados com alta especificidade para cada célula-alvo e local, podem ajudar a ECT a atingir o tecido em qualquer parte do corpo12. O desenho e a posição dos eletrodos devem permitir a acessibilidade completa do tumor e garantir que o tecido saudável seja minimamente afetado ou não danificado pelo tratamento13.
Publicações anteriores mostraram o efeito da ECT em suspensões de células de melanoma humano in vitro 7,8. A literatura referente à aplicação da ECT em modelos de células oculares 3D ou outros ambientes in vivo semelhantes, permitindo uma utilização terapêutica mais segura, é limitada. Brun et al. postulam que as células 3D no andaime durante a análise morfológica têm uma forma redonda diferente da forma alongada mostrada nas culturas 2D, mas extremamente semelhante às células de biópsias de pacientes9. O refinamento dos cenários terapêuticos e dos instrumentos utilizados nas culturas 3D pode levar a uma otimização dos parâmetros da ECT, permitindo uma abordagem clínica mais precisa9.
Descrevemos um desenvolvimento tecnológico de novos eletrodos para a aplicação de ECT em culturas de células 3D. A bleomicina é o agente citotóxico mais comumente administrado em combinação com ECT11. Estudos anteriores do nosso grupo mostraram que as configurações de EP aplicadas (750 Volts/cm, 8 pulsos, 100 ms, 5 Hz) eram adequadas para o tratamento de tumores oculares in vitro. As etapas críticas da técnica incluem o curto tempo necessário para realizar a ECT enquanto o esferóide está afundando após a mobilização, bem como a dimensão precisa dos eletrodos. A necessidade dos eletrodos customizados deveu-se às dificuldades na realização da ECT nos poços com os instrumentos disponíveis. Dados não publicados de nosso grupo mostraram aumento do dano esferóide ao transferir os esferoides para um poço maior ou para uma cubeta para prepará-los para o tratamento e depois de volta ao poço de cultura. Uma vantagem da técnica descrita é a falta de manipulação de esferóides para realizar o tratamento, pois os organoides não são transferidos para placas ou poços maiores. Portanto, todos os esferóides mantêm sua forma. Outra vantagem é o uso de ensaios de viabilidade 3D mais robustos para determinar a citotoxicidade da ECT em comparação com os ensaios de viabilidade padrão, como o ensaio MTT. Assim, todas as células do esferóide são lisadas e são necessárias lavagens celulares adicionais, remoção de meio e várias etapas de pipetagem.
As limitações dos métodos descritos são a curta vida útil dos esferoides, que afeta o tamanho do tumor, bem como a necrose celular, como visto no centro do organoide tumoral. A alta taxa de mortalidade associada tanto no MC quanto na UM e as opções terapêuticas limitadas exigem o enriquecimento das possibilidades terapêuticas existentes. A ECT pode oferecer uma modalidade adjuvante para a melhora da qualidade de vida do paciente e prolongar a sobrevida do paciente. Essas condições in vitro imitam um ambiente in vivo com maior precisão, oferecendo resultados promissores para posterior aplicação humana. Estudos futuros usando esferoides preparados a partir de culturas primárias podem fornecer resultados mais representativos para a otimização das configurações de ECT para um tratamento direcionado.
Divulgações
Este relatório não recebeu nenhuma doação específica de qualquer agência de financiamento nos setores público, comercial ou sem fins lucrativos.
Agradecimentos
Este estudo foi apoiado pelo Dr. Rolf M. Schwiete-Stiftung. Os autores agradecem a Martine J. Jager (Laboratório de Oftalmologia do LUMC, Leiden, Holanda) e Helen Kalirai (Liverpool Ocular Oncology Research Group, Molecular and Clinical Cancer Medicine, University of Liverpool, Reino Unido) por fornecerem as linhagens celulares UM. Gostaríamos também de agradecer a Sabine Hecht (Departamento de Oftalmologia, Hospital Universitário de Halle (Saale), Alemanha) pela assistência técnica.
Materiais
| Name | Company | Catalog Number | Comments |
| Bleomycin sulfate | Enzo | BML-AP302-0010 | 10 mg |
| Cell culture flask 75 cm | TPP | TPP90076 | |
| Cell culture flask TC175 cm | Sarstedt | 83,39,12,002 | Standard with Filter |
| Cliniporator | IGEA | EPS01 | Electroporator |
| Corning Costar Ultra-Low Attachment Multiple Well Plate, 96 well, round bottom | Corning | 7007 | 96Well clear round Bottom, Ultra low attachment plates |
| EGF 1MG | Sigma-Aldrich | E4127-.1MG | |
| F-12 K Nut Mix (1x) | Gibco | 21127-022 | |
| Fetal Bovine Serum, South American | Corning | 35-079-CV | LOT Nr. 35079010, Reservierungsnummer: EU00478541 |
| FKS | |||
| KGM-2 | Lonza | CC-3103 | |
| PBS w/o. CaCl und MgCl | PromoCell | C-40232 | 500 ml |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333-100ml | |
| RPMI 1640 | Gibco | 11504566 | ATCC modification, HEPES, liquid, 500 ml |
| Tecan Infinity M Plex | Tecan | ||
| Trypsin-EDTA 1x Solution | Sigma-Aldrich | 59430C-100ml |
Referências
- Kaliki, S., Shields, C. L. Uveal melanoma: relatively rare but deadly cancer. Eye (Lond). 31 (2), 241-257 (2017).
- Chang, A. E., Karnell, L. H., Menck, H. R. The National Cancer Data Base report on cutaneous and noncutaneous melanoma: a summary of 84,836 cases from the past decade. The American College of Surgeons Commission on Cancer and the American Cancer Society. Cancer. 83 (8), 1664-1678 (1998).
- Dogrusoz, M., Jager, M. J., Damato, B. Uveal Melanoma Treatment and Prognostication. Asia-Pacific Journal of Ophthalmology. 6 (2), 186-196 (2017).
- Damato, B., Coupland, S. E. Management of conjunctival melanoma. Expert Review of Anticancer Therapy. 9 (9), 1227-1239 (2009).
- Norregaard, J. C., Gerner, N., Jensen, O. A., Prause, J. U. Malignant melanoma of the conjunctiva: occurrence and survival following surgery and radiotherapy in a Danish population. Graefe's Archive for Clinical and Experimental Ophthalmology. 234 (9), 569-572 (1996).
- Fiorentzis, M., et al. Electrochemotherapy with bleomycin and cisplatin enhances cytotoxicity in primary and metastatic uveal melanoma cell lines in vitro. Neoplasma. 65 (2), 210-215 (2018).
- Fiorentzis, M., et al. Conjunctival melanoma and electrochemotherapy: preliminary results using 2D and 3D cell culture models in vitro. Acta Ophthalmologica. 97 (4), 632-640 (2019).
- Fiorentzis, M., et al. The Potential Use of Electrochemotherapy in the Treatment of Uveal Melanoma: In vitro Results in 3D Tumor Cultures and In vivo Results in a Chick Embryo Model. Cancers (Basel). 11 (9), (2019).
- Brun, P., et al. Cell-seeded 3D scaffolds as in vitro models for electroporation. Bioelectrochemistry. 125, 15-24 (2019).
- Sersa, G., et al. Electrochemotherapy in treatment of tumours. European Journal of Surgical Oncology. 34 (2), 232-240 (2008).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529(2017).
- Miklavcic, D., et al. Electrochemotherapy: technological advancements for efficient electroporation-based treatment of internal tumors. Medical & Biological Engineering & Computing. 50 (12), 1213-1225 (2012).
- Miklavcic, D., Corovic, S., Pucihar, G., Pavselj, N. Importance of tumour coverage by sufficiently high local electric field for effective electrochemotherapy. EJC Supplements. 4 (11), 45-51 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados