Method Article
Özelleştirilmiş Elektrot Kullanılarak 3D Oküler Melanom Sferoidlerinde Elektrokemoterapi
Bu Makalede
Özet
Burada, 3D konjonktival ve uveal melanom sferoidlerinin geliştirilmesi ve 3D sferoidlerin bir kültür kuyusunda in vitro elektrokemoterapisi için elde tutulan özelleştirilmiş elektrotların kullanımı için bir protokol sunuyoruz. Bu, oküler melanom tedavisinde elektrokemoterapinin kullanımında yeni bakış açıları sunmaktadır.
Özet
Elektrokemoterapi (EKT), membran değişikliklerine bağlı olarak uygulanan ajanın sitotoksik etkisini artıran, elektrik atımı uygulamasını takiben geçici gözenek oluşumunun sitotoksik ilaçların verilmesi ile birleştirilmesidir. İn vitro 3D kültür sistemleri, in vivo tümör büyümesini simüle eder ve tümörlerin biyolojik özelliklerini geleneksel tek katmanlı hücre kültürlerinden daha doğru bir şekilde korur. Konjonktival melanom (CM) ve uveal melanom (UM) hücre hatları kullanılarak 3D tümör organoidlerinin geliştirilmesi için bir protokol ve ayrıca tümör ortamını tahrip etmeden kültür kuyusunda in vitro EKT için uygun olan elde tutulan özelleştirilmiş elektrotların kullanımı için bir protokol tanımladık. Bu protokol, 3D CM ve UM sferoidlerinin kültürünü ve büyümesini ve bunların tek başına bleomisin (2.5 μg/mL), elektroporasyon (EP) (750 Volt/cm, 8 darbe, 100 μs, 5 Hz) ve EP ve bleomisin kombinasyonu olarak EKT'ye reaksiyonlarını analiz eder. Bu protokolde kullanılan ilaç konsantrasyonu ve EP ayarları, önceki deneylere göre tercih edilen EKT koşulları olarak belirlenmiştir. Sferoid canlılığını belirlemek için kullanılan test, tedaviden 3-7 gün sonra gerçekleştirildi. 3D tümör sferoidlerinin canlılığı ve büyümesi üzerindeki etkisi sadece EKT'den sonra anlamlıydı. Özelleştirilmiş elektrotlar, bakliyatların kültür kuyusunda uygulanmasını kolaylaştırmak için ayrıntılı olarak açıklanmıştır. 3D UM ve CM sferoidlerinin bu yeni tedavisi, gelecekteki klinik uygulamalar için bir basamak taşı oluşturmaktadır.
Giriş
Uveal melanom (UM) erişkinlerde en sık görülen primer göz içi tümörü iken, konjonktival melanom (KM) tüm oküler melanomların %2'sini oluşturur 1,2,3,4,5,6. Brakiterapi, proton ışını radyoterapisi ve fototerapi UM'de ilk basamak tedaviler iken, globün enükleasyonu gerekli olabilir 1,2,3. KM'nin tedavisi oküler onkoloji merkezleri arasında farklılık gösterir; Eksizyonel biyopsi ve ardından lokal kemoterapi ve/veya radyoterapi en sık tedavi yaklaşımıdır4. Tedaviye rağmen, KM, %25-30 arasında bir mortalite ile ilişkilidir5.
Oküler melanomda CM ve UM sferoidlerinin oluşumu ve EKT uygulaması ile ilgili literatür yetersizdir 6,7,8. Tümör sferoidleri, geleneksel 2D hücre kültürlerinden daha iyi biyolojik özelliklere sahiptir ve in vivo tümör ortamını taklit etmek için yararlı bir araç olarak önerilmiştir9. Elektrokemoterapi (EKT), geçirgen olmayan sitotoksik ilaçların kullanımını elektroporasyon (EP) ile birleştirir10. EP, kanser hücrelerinde anti-kanser ilaç alımının lokalize bir artışı için hücreleri geçici olarak geçirgen hale getiren ve hücre ölümünün artmasına neden olan kısa ve yoğun elektrik darbelerinin lokal uygulamasıdır11. Bu çalışmada CM ve UM sferoidlerinin gelişimini tanımlayan bir protokol oluşturulmuş ve bleomisin ile EKT sonrası sonuçlar araştırılmıştır. Bu protokol, oküler onkoloji alanındaki araştırmacılara sferoidler üzerinde diğer terapötik modaliteleri kullanarak veya EKT'nin daha fazla etkisini araştırarak yardımcı olabilir. EKT'nin oftalmolojide sınırlı kullanımı nedeniyle, bu modalitenin etkisi ve süreci hakkında çok az bilgi vardır; Bu nedenle, bu deney gelecekte tedavi seçeneklerinin spektrumunu genişletebilir. Tümör ortamında herhangi bir tahribat olmadan kültür kuyucuklarında sferoidin ECT'sine izin veren yeni bir özelleştirilmiş el tipi plaka elektrot ayarı öneriyoruz.
Protokol
1. Küresel oluşum
- Küresel oluşum için bağlı olarak büyüyen kanser hücre dizilerini kullanın.
- Steril tezgah koşulları altında hücre kültürü ile ilgili tüm adımları sağlayın.
- İlgili hücre hatları için önerildiği gibi standart tam kültür ortamını hazırlayın ve bir su banyosu kullanarak 37 ° C'ye ısıtın.
NOT: Burada, insan konjonktival hücre hatları CM2005.1, CRMM1, CRMM2 ile uveal melanom hücre hatları 92.1, OMM1 ve OMM2, sırasıyla% 10 fetal sığır serumu ve % 10 fetal sığır serumu içeren RPMI içeren Ham F-12 ortamında kullanıldı ve kültürlendi. - Standart enzimatik sindirim yöntemlerini (örneğin, tripsin-EDTA çözeltisi) kullanarak ilgilenilen hücreleri ayırın.
- Hayati hücrelerin sayısını belirlemek için, 10 μL hücre süspansiyonunu 10 μL Tripan mavisi çözeltisinde (1: 1) yeniden süspanse edin ve hücreleri 5 dakika içinde bir oda (hemositometre veya otomatik hücre sayacı) kullanarak sayın. Hücreler birleşimin %<90'ında ve iyi durumda olmalıdır.
- Sferoidler oluşturmak için, 96 oyuklu ultra düşük bağlantı plakalarında toplam hacmi 200 μL tam kültür ortamı ile oyuk başına 5 x 103 hücre tohumlayın. Plakayı 37 °C'de% 5 CO2 içeren nemlendirilmiş bir atmosferde inkübe edin.
NOT: Hücresel bağlanmanın etkili bir şekilde inhibisyonu için, yüzeyde kovalent bağlı hidrofilik, iyonik olmayan, nötr yüklü hidrojel ile ultra düşük bağlantı plakaları kullanın. Bu hidrojel, hücrelerin ölümsüzleşmesini engeller ve onları 3D sferoidler oluşturmak için askıya alınmış bir duruma zorlar. - Mikroskop kullanarak küresel oluşumu kontrol edin.
NOT: Bazı hücre hatları ilk pasajda yuvarlak 3D tümör sferoidleri oluşturmaz. Karanlık bir merkez geliştirmeye başlamadan önce tümör küre kültürünü geçin. Tripsinizasyon ile 4-10 gün sonra hücre hattına bağlı olarak tümör kitlelerini ayırın. Daha sonra, tek hücreleri taze bir 96 ultra düşük bağlantı plakasına tohumlayın. Bu prosedürü birkaç pasaj için tekrarlayarak, hücreler 3D kültüre adapte olacaktır.
2. Tümör sferoidlerinin elektrokemoterapisi
- Bir tahlil kontrolü olarak, tedavi edilmemiş sferoidleri ve sadece EP veya bleomisin ile tedavi edilen sferoidleri kullanın.
- Elektroporatör ayarlarını yapın (darbe sayıları, darbe frekansı, süre, süre ve voltaj; Malzeme Tablosuna bakın). Melanom hücreleri için 750 Volt/cm gücünde, 100 μs darbe süresinde, 5 Hz tekrarlama frekansında 8 kare dalga elektrik darbesi kullanın.
- Küresel kültürün 3. gününde, 15 mL'lik bir tüpte 5 μg / mL konsantrasyonda steril PBS'de taze bleomisin sülfat çözeltisi hazırlayın.
- 200 μL kültür ortamını çıkararak ve her kuyucuk için 100 μL taze tam kültür ortamı ile yeniden doldurarak sferoidlerin hücre kültürü ortamını değiştirin.
- Her oyuğa 100 μL bleomisin sülfat çözeltisi ekleyin (nihai konsantrasyon 2.5 μg / mL). Bleomisin sülfat çözeltisi yerine sadece EP ile muamele edilen işlenmemiş kontrollere ve sferoidlere 100 μL taze ortam ekleyin.
- Elektroporasyonu gerçekleştirin.
NOT: Şekil 1'de gösterilen elektrotlar, Halle-Wittenberg Üniversitesi'nin araştırma atölyesinde üretilmiştir. Paslanmaz çelikten yapılmıştır ve elektroporatörün tutamağına uyar. Elektrotlar, 96 kuyulu ultra düşük bağlantı plakasında kullanılmak üzere tasarlanmıştır. Benzer paslanmaz çelik elektrotlar alternatif uygulamalar için de kolayca üretilebilir.- Elektrotları %70 etanol ile sterilize edin ve elektrotların kurumasını bekleyin. Elektrotların çapı 1 mm, iki elektrot arasındaki boşluk 4 mm ve her elektrotun uzunluğu 8 mm'dir (Şekil 1a).
- Elektrotları, sferoidler elektrotlar arasında olacak şekilde kuyunun dibine yerleştirin. Bu, sferoidin iki elektrot arasında ideal şekilde konumlandırılmasını sağlar (Şekil 1b).
- Sferoidlerin kuyunun dibinden hareket etmesine ve elektrotlar arasına yerleştirilmesine izin vermek için plakayı sallayın. Sferoid, elektrotlar arasında sadece birkaç saniye kalacaktır.
- Tercih edilen ayarlarla elektroporasyonu başlatın.
- 150 μL ortamı 150 μL taze ortamla değiştirerek kuyudaki bleomisin sülfat çözeltisini değiştirin.
- Hücreleri% 5 CO2 içeren nemlendirilmiş bir atmosferde 37 ° C'de 10 güne kadar inkübe edin. Tedavi edilmeyen sferoidler karanlık bir merkez geliştirmeye başlarsa, deneyi sonlandırın. Her 2-3 günde bir 150 μL hücre kültürü ortamını değiştirin. Bu nedenle, pipet ucunu kuyunun kenar bölgesine yerleştirerek, plakayı eğerek ve yavaşça pipetleyerek küresel bozulmayı önleyin.
3. Küresel boyutun belirlenmesi
- Tedavi gününde (başlangıç noktası) ve tedaviden 3-7 gün sonra, ImageJ Fiji11 kullanarak sferoidlerin kesit alanını hesaplayarak parlak alan mikroskobu kullanarak sferoid boyutunu ölçün.
- Ölçek çubuğu ile tek kürelerin bir görüntüsünü alın. Tüm sferoidin görülebileceği bir büyütme oranı kullanın. Örneğin, CM2005.1 için 5x büyütme kullanılmıştır. Görüntüyü JPEG olarak kaydedin.
- ImageJ/Fiji kullanarak kesit alanını hesaplayarak küresel boyutu analiz edin.
- Yazılımı yükleyin (https://imagej.net/Fiji/Downloads).
- ImageJ/Fiji'yi başlatın. Sferoid görüntüsünü içe aktarın: Dosya > Aç.
- Ölçeği ayarlamak için, araç çubuğunun çizgi düğmesini seçin ve fare tıklamasıyla görüntüdeki ölçek çubuğunun çizgisini işaretleyin: Analiz Et > Ölçeği Ayarla. Bilinen bir uzaklık kullanarak, ölçek çubuğunun mesafesini doldurun. Uzunluk birimini μm olarak değiştirin. Aynı büyütme faktörüne sahip tüm görüntülerin ayarlarını atamak için genel alanı tıklatın.
- Görüntüyü 8 bit'e dönüştürme: Görüntü > 8 bit> yazın.
- Görüntü > Otomatik Eşiği Ayarla> öğesini seçin (Aralığı sıfırlama > öğesini seçin). Küre, seçilen eşik işaretleyiciye bağlı olarak kırmızı veya siyah olarak işaretlenir. Kaydırıcıları, küresel pikseller kırmızıya dönecek, ancak küresel olmayan piksellerin rengi değişmeyecek şekilde ayarlayın. Düğmelerin hiçbirini tıklatmadan Eşik iletişim penceresini kapatın.
- Sferoidin kesit alanını hesaplamak için Analiz Et > Ölçümleri Ayarla'yı seçin ve Alan, Eşikle Sınırla ve Etiketi Görüntüle'ye tıklayın. Tamam'ı tıklatarak Ölçüleri Ayarla iletişim penceresini kapatın.
- Sonuçları göstermek için Parçacıkları Analiz Et > Analiz Et'i seçin ve gürültüyü gidermek için boyutu (μm2) = 10000-sonsuz olarak değiştirin. Sonuçları görüntüle düğmesine tıklayın ve Tamam'a tıklayarak pencereyi kapatın. Sonuçlar'da, etiketli ve alanlı sferoidler gösterilir. Birkaç sferoidin analizlerini tekrarlayarak, sonuçlar Sonuçlar penceresinde listelenir.
- EKT ile tedavi edilen sferoidlerin tedavi edilmemiş ve tek tedavi edilen kontrollere kıyasla göreceli tedavi yanıtını belirlemek için, kesit alanının yüzde değişimlerini hesaplayın.
4. Küresel canlılığın belirlenmesi
- Üretici talimatlarına göre 3D hücre kültürleri için uygun bir hücre canlılığı testi kullanarak tedaviden 3-7 gün sonra sferoid canlılığını ölçün. Testin, metabolik olarak aktif hücrelerin varlığına işaret eden ATP'nin kantitasyonu ile canlılığın tespit edilmesine izin vermek için büyük sferoidlere nüfuz etmesi ve parçalaması gerekir.
NOT: Bu deneyde, okuma yöntemi olarak lüminesans tabanlı bir test kullanılmıştır. EKT ile tedavi edilen sferoidlerin canlılığı, tedaviden yedi gün sonra kontrollerle karşılaştırıldı.
Sonuçlar
Deneyler, yüksek kaliteli paslanmaz çelikten oluşan özelleştirilmiş el elektrotları ile gerçekleştirildi. Elektrotların kalınlığı 1 mm, genişliği 4 mm, iki elektrot arasındaki boşluk 4 mm ve her bir elektrotun uzunluğu 8 mm'dir (Şekil 1). EP ve bleomisin tek başına hem UM hem de CM tümör sferoidlerinin canlılığı ve büyümesi üzerinde anlamlı bir etkiye sahip değildir. EKT, tümör canlılığında ve sferoid boyutunda önemli bir azalma gösterir. Bleomisin ile EKT sonrası sferoidlerin etrafında dekonstrükte hücre parçaları ile sferoid mimari kaybı ve test edilen tüm sferoidlerin merkezi ve periferik bölgesinde nekroz gözlendi. Şekil 2 , CM2005.1 hücre hatlarının sonuçlarını göstermektedir. Metastatik UM hücre hatları, ECT8'i takiben primer hücre hatlarına kıyasla daha yüksek bir yanıt gösterdi.

Şekil 1: Özelleştirilmiş el elektrotları. Elektrotlar yüksek kaliteli paslanmaz çelikten yapılmıştır. Elektrotların sapı elektroporatör ile sağlanır. Elektrotların kalınlığı 1 mm, genişliği 4 mm, iki elektrot arasındaki boşluk 4 mm ve her elektrotun uzunluğu 8 mm'dir (a); 96 kuyulu bir formatta (b) sferoidlerin elektroporasyonu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
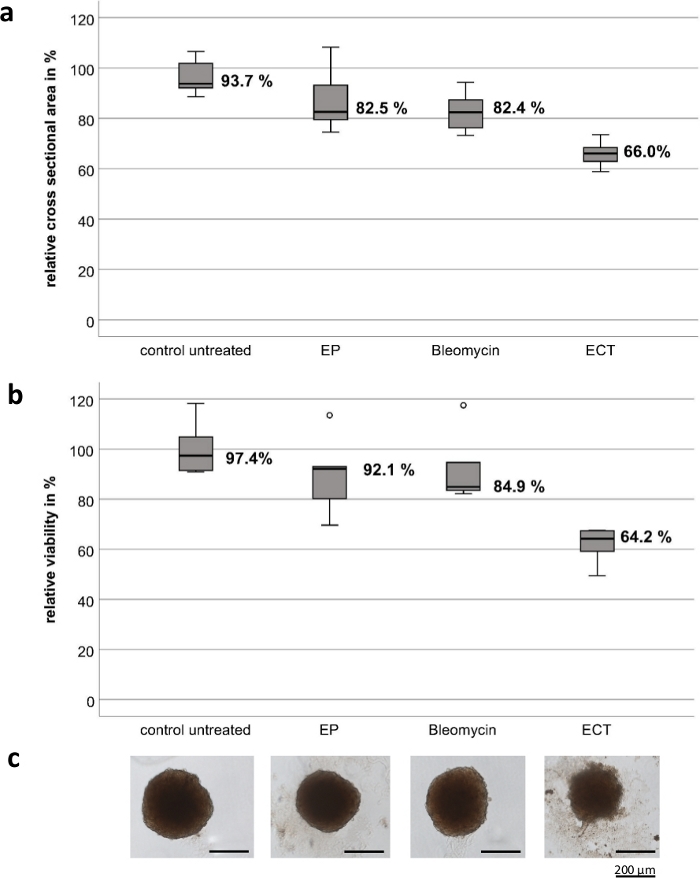
Şekil 2: Elektrokemoterapinin konjonktival melanom hücre hattı CM2005.1'in tümör sferoidleri üzerindeki sitotoksik etkisi. Elektrokemoterapi (EKT, 2.5 μg/mL bleomisin uygulamasından sonra 750 V/cm), tek başına elektroporasyon (EP) veya tek başına bleomisin (2.5 g/mL) kullanılarak yapılan kemoterapiye kıyasla sferoidlerde daha güçlü sitotoksik etkilere neden olmuştur. Sitotoksik etki, tedaviden yedi gün sonra tedavi edilmeyen kontrolün yüzdesi olarak hem kesit alanı hem de bir canlılık testi hesaplanarak ölçüldü. Kutu grafikleri, sferoidlerin (a) ortalama kesit alanını gösterir; sferoidlerin ortalama canlılığı (b); Sferoidlerin temsili görüntüleri, ölçek çubuğu = 200 μm (C). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
EP çeşitli biyoteknolojik ve klinik uygulamalarda kullanılmaktadır12. Her hedef hücre ve bölge için yüksek özgüllüğe sahip özel olarak tasarlanmış elektrotlar gibi yeni teknolojik gelişmeler, EKT'nin vücudun herhangi bir yerindeki dokuyu hedeflemesine yardımcı olabilir12. Elektrotların tasarımı ve konumu, tümörün tam erişilebilirliğine izin vermeli ve sağlıklı dokunun tedaviden sadece minimum düzeyde etkilenmesini veya hasar görmemesini sağlamalıdır13.
Önceki yayınlar, insan melanom hücre süspansiyonlarında EKT'nin etkisini in vitro 7,8 göstermiştir. EKT'nin 3D oküler hücre modellerinde veya diğer benzer in vivo ortamlarda uygulanmasına atıfta bulunan ve daha güvenli bir terapötik kullanım sağlayan literatür sınırlıdır. Brun ve ark. morfolojik analiz sırasında iskeledeki 3 boyutlu hücrelerin, 2 boyutlu kültürlerde gösterilen uzun şekilden farklı yuvarlak bir şekle sahip olduğunu, ancak hastaların biyopsilerinden elde edilen hücrelere son derece benzer olduğunu varsaymaktadır9. 3D kültürlerde kullanılan tedavi ayarlarının ve aletlerin iyileştirilmesi, EKT parametrelerinin optimizasyonuna yol açarak daha doğru bir klinik yaklaşıma izin verebilir9.
3D hücre kültürlerinde EKT uygulaması için yeni elektrotlarla ilgili teknolojik bir gelişmeyi tarif ediyoruz. Bleomisin, EKT11 ile kombinasyon halinde en sık uygulanan sitotoksik ajandır. Grubumuzun daha önceki çalışmaları, uygulanan EP ayarlarının (750 Volt/cm, 8 darbe, 100 ms, 5 Hz) oküler tümörlerin in vitro tedavisi için uygun olduğunu göstermiştir. Tekniğin kritik adımları, mobilizasyondan sonra sferoid batarken EKT'yi gerçekleştirmek için gereken kısa sürenin yanı sıra elektrotların kesin boyutunu içerir. Özelleştirilmiş elektrotlara duyulan gereklilik, mevcut aletlerle kuyularda EKT gerçekleştirmedeki zorluklardan kaynaklanıyordu. Grubumuzdan yayınlanmamış veriler, sferoidleri tedaviye hazırlamak için daha büyük bir kuyuya veya bir küvete aktarırken ve daha sonra kültür kuyusuna geri dönerken sferoid hasarının arttığını gösterdi. Tarif edilen tekniğin bir avantajı, tedaviyi gerçekleştirmek için küresel manipülasyonun olmamasıdır, çünkü organoidler daha büyük plakalara veya kuyucuklara aktarılmaz. Bu nedenle, tüm sferoidler formlarını korurlar. Diğer bir avantaj, MTT testi gibi standart canlılık testlerine kıyasla ECT'nin sitotoksisitesini belirlemek için daha sağlam 3D canlılık testlerinin kullanılmasıdır. Böylece, sferoidin tüm hücreleri parçalanır ve ek hücre yıkama, orta ve çoklu pipetleme adımlarının çıkarılması gerekir.
Tarif edilen yöntemlerin sınırlamaları, tümör organoidinin merkezinde görüldüğü gibi, tümörün boyutunu ve hücre nekrozunu etkileyen sferoidlerin kısa ömrüdür. Hem CM hem de UM'de eşlik eden yüksek mortalite oranı ve sınırlı tedavi seçenekleri, mevcut terapötik olasılıkların zenginleştirilmesini gerektirmektedir. EKT, hastanın yaşam kalitesini iyileştirmek ve hastanın sağkalımını uzatmak için adjuvan bir modalite sunabilir. Bu in vitro koşullar, daha yüksek hassasiyetle in vivo bir ortamı taklit eder ve daha fazla insan uygulaması için umut verici sonuçlar sunar. Primer kültürlerden hazırlanan sferoidlerin kullanıldığı gelecekteki çalışmalar, hedefe yönelik bir tedavi için EKT ayarlarının optimizasyonu için daha temsili sonuçlar verebilir.
Açıklamalar
Bu rapor, kamu, ticari veya kar amacı gütmeyen sektörlerdeki herhangi bir finansman kuruluşundan özel bir hibe almamıştır.
Teşekkürler
Bu çalışma Dr. Rolf M. Schwiete-Stiftung tarafından desteklenmiştir. Yazarlar, UM hücre hatlarını sağladıkları için Martine J. Jager'e (LUMC Oftalmoloji Laboratuvarı, Leiden, Hollanda) ve Helen Kalirai'ye (Liverpool Oküler Onkoloji Araştırma Grubu, Moleküler ve Klinik Kanser Tıbbı, Liverpool Üniversitesi, İngiltere) teşekkür eder. Teknik yardım için Sabine Hecht'e (Oftalmoloji Anabilim Dalı, Halle Üniversite Hastanesi (Saale), Almanya) teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Bleomycin sulfate | Enzo | BML-AP302-0010 | 10 mg |
| Cell culture flask 75 cm | TPP | TPP90076 | |
| Cell culture flask TC175 cm | Sarstedt | 83,39,12,002 | Standard with Filter |
| Cliniporator | IGEA | EPS01 | Electroporator |
| Corning Costar Ultra-Low Attachment Multiple Well Plate, 96 well, round bottom | Corning | 7007 | 96Well clear round Bottom, Ultra low attachment plates |
| EGF 1MG | Sigma-Aldrich | E4127-.1MG | |
| F-12 K Nut Mix (1x) | Gibco | 21127-022 | |
| Fetal Bovine Serum, South American | Corning | 35-079-CV | LOT Nr. 35079010, Reservierungsnummer: EU00478541 |
| FKS | |||
| KGM-2 | Lonza | CC-3103 | |
| PBS w/o. CaCl und MgCl | PromoCell | C-40232 | 500 ml |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333-100ml | |
| RPMI 1640 | Gibco | 11504566 | ATCC modification, HEPES, liquid, 500 ml |
| Tecan Infinity M Plex | Tecan | ||
| Trypsin-EDTA 1x Solution | Sigma-Aldrich | 59430C-100ml |
Referanslar
- Kaliki, S., Shields, C. L. Uveal melanoma: relatively rare but deadly cancer. Eye (Lond). 31 (2), 241-257 (2017).
- Chang, A. E., Karnell, L. H., Menck, H. R. The National Cancer Data Base report on cutaneous and noncutaneous melanoma: a summary of 84,836 cases from the past decade. The American College of Surgeons Commission on Cancer and the American Cancer Society. Cancer. 83 (8), 1664-1678 (1998).
- Dogrusoz, M., Jager, M. J., Damato, B. Uveal Melanoma Treatment and Prognostication. Asia-Pacific Journal of Ophthalmology. 6 (2), 186-196 (2017).
- Damato, B., Coupland, S. E. Management of conjunctival melanoma. Expert Review of Anticancer Therapy. 9 (9), 1227-1239 (2009).
- Norregaard, J. C., Gerner, N., Jensen, O. A., Prause, J. U. Malignant melanoma of the conjunctiva: occurrence and survival following surgery and radiotherapy in a Danish population. Graefe's Archive for Clinical and Experimental Ophthalmology. 234 (9), 569-572 (1996).
- Fiorentzis, M., et al. Electrochemotherapy with bleomycin and cisplatin enhances cytotoxicity in primary and metastatic uveal melanoma cell lines in vitro. Neoplasma. 65 (2), 210-215 (2018).
- Fiorentzis, M., et al. Conjunctival melanoma and electrochemotherapy: preliminary results using 2D and 3D cell culture models in vitro. Acta Ophthalmologica. 97 (4), 632-640 (2019).
- Fiorentzis, M., et al. The Potential Use of Electrochemotherapy in the Treatment of Uveal Melanoma: In vitro Results in 3D Tumor Cultures and In vivo Results in a Chick Embryo Model. Cancers (Basel). 11 (9), (2019).
- Brun, P., et al. Cell-seeded 3D scaffolds as in vitro models for electroporation. Bioelectrochemistry. 125, 15-24 (2019).
- Sersa, G., et al. Electrochemotherapy in treatment of tumours. European Journal of Surgical Oncology. 34 (2), 232-240 (2008).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529(2017).
- Miklavcic, D., et al. Electrochemotherapy: technological advancements for efficient electroporation-based treatment of internal tumors. Medical & Biological Engineering & Computing. 50 (12), 1213-1225 (2012).
- Miklavcic, D., Corovic, S., Pucihar, G., Pavselj, N. Importance of tumour coverage by sufficiently high local electric field for effective electrochemotherapy. EJC Supplements. 4 (11), 45-51 (2006).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır