Method Article
カスタマイズされた電極を使用した3D眼黒色腫スフェロイドの電気化学療法
要約
ここでは、3D結膜およびブドウ膜黒色腫スフェロイドの開発と、培養ウェルでの3Dスフェロイドのinvitro電気化学療法のためのハンドヘルドカスタマイズ電極の使用のためのプロトコルを紹介します。これは、眼の黒色腫治療における電気化学療法の使用に新たな視点を提供します。
要約
電気化学療法 (ECT) は、電気パルス適用後の一過性の細孔形成と細胞毒性薬物の投与の組み合わせであり、膜の変化による適用薬剤の細胞毒性効果を高めます。in vitro 3D培養システムは、従来の単層細胞培養よりも正確に、in vivo腫瘍の増殖をシミュレートし、腫瘍の生物学的特性をより正確に保存します。結膜黒色腫(CM)およびブドウ膜黒色腫(UM)細胞株を使用した3D腫瘍オルガノイドの開発、および腫瘍環境を破壊することなく培養ウェル内のin vitro ECTに適したハンドヘルドカスタマイズ電極の使用に関するプロトコルについて説明します。このプロトコルでは、3D CMおよびUMスフェロイドの培養と増殖、およびブレオマイシン(2.5 μg/mL)のみ、エレクトロポレーション(EP)(750 V/cm、8パルス、100 μs、5 Hz)のみ、およびEPとブレオマイシンの組み合わせとしてのECTに対する反応を分析します。このプロトコルで使用された薬物濃度と EP 設定は、以前の実験に従って好ましい ECT 条件として確立されました。スフェロイド生存率を決定するために使用されたアッセイは、処理の3〜7日後に実施されました。3D腫瘍スフェロイドの生存率と増殖への影響は、ECT後にのみ有意でした。カスタマイズされた電極は、培養ウェルでのパルスの適用を容易にするために詳細に説明されています。3D UMおよびCMスフェロイドのこの新しい治療法は、将来の臨床応用への足がかりとなります。
概要
ぶどう膜黒色腫 (UM) は成人で最も一般的な原発性眼内腫瘍ですが、結膜黒色腫 (CM) は全眼黒色腫の 2% を占めています 1,2,3,4,5,6。小線源治療、陽子線治療、および光線治療はUMの第一選択治療ですが、地球の除核が必要な場合があります1,2,3。CMの治療法は眼腫瘍センターによって異なります。切除生検とそれに続く局所化学療法および/または放射線療法は、最も頻繁な治療アプローチです 4.治療にもかかわらず、CMは25%〜30%の死亡率と関連しています5。
CMおよびUMスフェロイドの形成と、眼の黒色腫6,7,8におけるECTの適用に関する文献は不足しています。腫瘍スフェロイドは、従来の2D細胞培養よりも優れた生物学的特徴を有しており、in vivo腫瘍環境を模倣するための有用なツールとして提案されている9。電気化学療法 (ECT) は、非透過性の細胞毒性薬の使用とエレクトロポレーション (EP) 10 を組み合わせたものです。EPは、短くて強い電気パルスの局所適用であり、細胞を一時的に透過化して癌細胞における抗癌薬の取り込みを局所的に増加させ、細胞死を増加させます11。この研究では、CM および UM スフェロイドの発達を説明するプロトコルを確立し、ブレオマイシンによる ECT 後の結果を調査します。このプロトコルは、スフェロイド上の他の治療法を使用した眼腫瘍学の分野の研究者を支援したり、ECTのさらなる効果を研究したりする可能性があります。眼科におけるECTの使用が限られているため、このモダリティの効果とプロセスに関する知識はほとんどありません。したがって、この実験は、将来的に治療の選択肢の範囲を広げる可能性があります。私たちは、腫瘍環境を破壊することなく培養ウェル内のスフェロイドのECTを可能にする、新しいカスタマイズされたハンドヘルドプレート電極設定を提案します。
プロトコル
1. スフェロイド形成
- スフェロイド形成には、接着的に増殖するがん細胞株を使用します。
- 細胞培養に関連するすべてのステップは、滅菌ベンチ条件下で行ってください。
- 目的の細胞株に推奨される標準的な完全培地を調製し、ウォーターバスを使用して37°Cに温めます。
注:ここでは、ヒト結膜細胞株CM2005.1、CRMM1、CRMM2、ならびにブドウ膜黒色腫細胞株92.1、OMM1およびOMM2を使用し、それぞれ10%ウシ胎児血清および10%ウシ胎児血清を含むRPMIを含むハムF-12培地で培養した。 - 標準的な酵素消化法(トリプシン-EDTA溶液など)を使用して、目的の細胞を分離します。
- 生命細胞の数を決定するには、10 μLの細胞懸濁液を10 μLのトリパンブルー溶液(1:1)に再懸濁し、チャンバー(血球計算盤または自動セルカウンター)を使用して5分以内に細胞をカウントします。細胞はコンフルエントの<90%で、良好な状態である必要があります。
- スフェロイドを形成するには、ウェルあたり5 x 103 個の細胞を、総量200 μLの完全培地で96ウェルの超低接着プレートに播種します。プレートを37°Cで、5%のCO2を含む加湿雰囲気でインキュベートします。
注:細胞付着を効果的に阻害するには、表面に共有結合した親水性、非イオン性、中性に帯電したヒドロゲルを備えた超低付着プレートを使用してください。このハイドロゲルは、細胞の不死化を阻害し、細胞を懸濁状態に強制して3Dスフェロイドを構築します。 - 顕微鏡を使用してスフェロイドの形成を確認します。
注:一部の細胞株は、最初の継代で丸い3D腫瘍スフェロイドを形成しません。腫瘍球が暗い中心を発達し始める前に、腫瘍球培養を通過します。トリプシン化により、4〜10日後に細胞株に応じて腫瘍塊を解離します。その後、新鮮な96超低接着プレートに単一細胞を播種します。この手順を数回の継代で繰り返すことで、細胞は3D培養に適応します。
2. 腫瘍スフェロイドの電気化学療法
- アッセイコントロールとして、未処理のスフェロイドおよびEPまたはブレオマイシンのみで処理したスフェロイドを使用してください。
- エレクトロポレーターの設定(パルスカウント、パルス周波数、持続時間、電圧、材料表を参照)を調整します。黒色腫細胞には、強度 750 ボルト/cm 、パルス幅 100 μs、繰り返し周波数 5 Hz の 8 つの方形波電気パルスを使用します。
- スフェロイド培養の3日目に、15 mLチューブに5 μg/mLの濃度の滅菌PBS中の新鮮なブレオマイシン硫酸塩溶液を調製します。
- スフェロイドの細胞培養培地を交換するには、200 μLの培地を取り出し、各ウェルに100 μLの新鮮な完全培地を補充します。
- 各ウェルに100 μLのブレオマイシン硫酸塩溶液を添加します(最終濃度2.5 μg/mL)。ブレオマイシン硫酸塩溶液の代わりにEPのみで処理した未処理のコントロールおよびスフェロイドに、100 μLの新鮮な培地を加えます。
- エレクトロポレーションを行います。
注: 図1 に示す電極は、ハレ・ヴィッテンベルク大学の研究ワークショップで製造されました。ステンレス製で、エレクトロポレーターのグリップにフィットします。電極は、96ウェルの超低アタッチメントプレートで使用するように設計されています。同様のステンレス鋼電極は、代替アプリケーションでも簡単に製造できます。- 電極を70%エタノールで滅菌し、電極を乾燥させます。電極の直径は1mm、2つの電極間のギャップは4mm、各電極の長さは8mmです(図1a)。
- 電極をウェルの底に置き、電極の間にスフェロイドを置きます。これにより、2つの電極間にスフェロイドを理想的に配置することができます(図1b)。
- プレートを振って、スフェロイドがウェルの底から移動し、電極の間に配置されるようにします。回転楕円体は、電極間に数秒間だけ存在します。
- エレクトロポレーションを好みの設定で開始します。
- ウェル内のブレオマイシン硫酸溶液を、150 μLの培地を150 μLの新鮮な培地と交換して置き換えます。
- 細胞を37°Cで最大10日間、5%CO2を含む加湿雰囲気でインキュベートします。未処理のスフェロイドが暗い中心を発達し始めた場合は、実験を終了します。2〜3日ごとに150μLの細胞培養培地を交換してください。これにより、ピペットチップをウェルの端領域に配置し、プレートを傾けてゆっくりとピペッティングすることにより、スフェロイドの破壊を回避します。
3. スフェロイドサイズの決定
- ImageJ Fiji11を使用してスフェロイドの断面積を計算することにより、治療日(開始点)および治療後3〜7日目に、明視野顕微鏡を使用してスフェロイドのサイズを測定します。
- スケールバーで単一のスフェロイドの画像を撮ります。スフェロイド全体が見える倍率を使用します。たとえば、CM2005.1では5倍の倍率が使用されました。画像をJPEGとして保存します。
- ImageJ/Fijiを使用して断面積を計算し、回転楕円体のサイズを解析します。
- ソフトウェアをインストールします(https://imagej.net/Fiji/Downloads)。
- ImageJ/Fijiを起動します。回転楕円体画像をインポートします: [ファイル ] > 開きます。
- スケールを設定するには、ツールバーの線ボタンを選択し、マウスをクリックして画像内のスケールバーの線をマークします: [分析 ]> [スケールの設定]。既知の距離を使用して、縮尺記号の距離を記入します。[長さの単位] を [μm] に変更します。フィールド グローバルをクリックして、同じ倍率を持つすべての画像の設定を割り当てます。
- 画像を 8 ビットに変換する: Image > Type > 8 ビット。
- [イメージ] > [調整] > [自動しきい値] を選択します ([範囲をリセットしない] >選択します)。回転楕円体は、選択したしきい値マーカーに応じて赤または黒でマークされます。スフェロイドピクセルが赤に変わり、非スフェロイドピクセルの色が変わらないようにスライダーを調整します。[しきい値] ダイアログ ウィンドウを閉じるには、どのボタンもクリックしません。
- 回転楕円体の断面積を計算するには、「解析」>「測定値の設定」を選択し、「面積」、「しきい値に制限」、「ラベルを表示」をクリックします。「測定値の設定」ダイアログ・ウィンドウを閉じるには、「OK」をクリックします。
- 結果を表示するには、[ 分析 ] > [粒子の分析 ] を選択し、サイズ (μm2) = 10000-無限大を変更してノイズを除去します。 [結果の表示 ] ボタンをクリックし、[ OK] をクリックしてウィンドウを閉じます。 結果には、ラベルと面積を持つスフェロイドが表示されます。複数の回転楕円体の解析を繰り返すと、結果が [結果 ]ウィンドウに一覧表示されます。
- ECT処理されたスフェロイドの相対治療反応を未処理および単一処理のコントロールと比較するには、断面積の変化率を計算します。
4. スフェロイド生存率の判定
- メーカーの指示に従って、3D細胞培養に適した細胞生存率アッセイを使用して、処理の3〜7日後にスフェロイド生存率を測定します。このアッセイでは、代謝活性細胞の存在を知らせるATPの定量による生存率の検出を可能にするために、大きなスフェロイドに浸透して溶解する必要があります。
注:この実験では、読み出し法として発光ベースのアッセイを使用しました。ECTで処理したスフェロイドの生存率を、治療の7日後に対照と比較しました。
結果
実験は、高品質のステンレス鋼で構成されたカスタマイズされたハンドヘルド電極を使用して行われました。電極の厚さは1mm、幅は4mm、2つの電極間のギャップは4mm、各電極の長さは8mmです(図1)。EPとブレオマイシンのみでは、UMおよびCM腫瘍スフェロイドの生存率および増殖に有意な影響は認められない。ECTは、腫瘍の生存率とスフェロイドサイズの大幅な減少を示しています。スフェロイド周囲の細胞断片が解体されたスフェロイド構造の喪失と、試験したすべてのスフェロイドの中央領域および末梢領域の壊死が、ブレオマイシンによるECT後に観察されました。 図2 にCM2005.1細胞株の結果を示します。転移性UM細胞株は、ECT8後の初代細胞株と比較して高い反応を示しました。

図1:カスタマイズされたハンドヘルド電極。 電極は高級ステンレス鋼で作られています。電極のハンドルにはエレクトロポレーターが付いています。電極の厚さは1mm、幅は4mm、2つの電極間のギャップは4mm、各電極の長さは8mm(a)です。96ウェルフォーマットでのスフェロイドのエレクトロポレーション(B)。 この図の拡大版を表示するには、ここをクリックしてください。
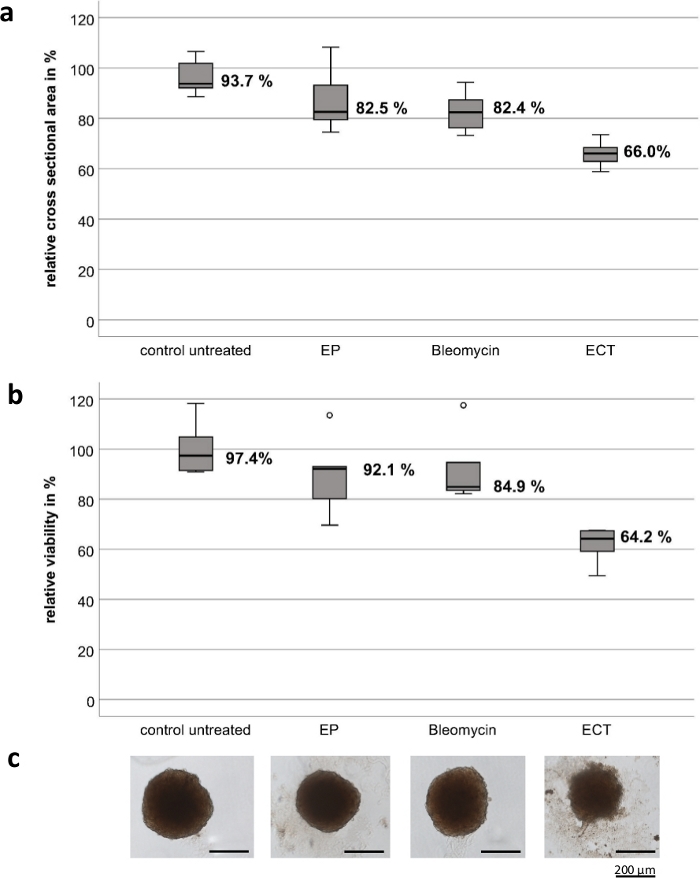
図2:結膜黒色腫細胞株CM2005.1の腫瘍スフェロイドに対する電気化学療法の細胞毒性効果。 電気化学療法(ECT、2.5 μg/mLブレオマイシン適用後750 V/cm)は、エレクトロポレーション(EP)単独またはブレオマイシン(2.5 g/mL)単独の化学療法と比較して、スフェロイドにおいて強い細胞毒性作用を引き起こした。細胞傷害性効果は、断面積と生存率アッセイの両方を、治療の7日後に未治療の対照の割合として計算することによって測定されました。箱ひげ図は、スフェロイドの平均断面積を示しています(a)。スフェロイドの平均生存率(b);スフェロイドの代表的な画像、スケールバー= 200μm(C)。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
EPは、さまざまなバイオテクノロジーおよび臨床アプリケーションで使用されています12。新しい技術開発、例えば、すべての標的細胞および部位に対して高い特異性を有する特別に設計された電極のような、ECTは、体内の任意の場所で組織を標的とするのを助けるかもしれない12。電極の設計と位置は、腫瘍への完全なアクセスを可能にし、健康な組織が治療による影響を最小限に抑えたり、損傷を受けないようにしなければならない13。
以前の出版物では、in vitro でヒト黒色腫細胞懸濁液における ECT の効果が示されています 7,8。3D眼球細胞モデルまたは他の同様のin vivo環境でのECTの適用に言及している文献は限られており、より安全な治療利用を可能にします。Brunらは、形態学的解析中の足場内の3D細胞は、2D培養で示される細長い形状とは異なる丸い形状をしているが、患者の生検からの細胞と非常に類似していると仮定しています9。3D培養で使用される治療設定と器具の改良は、ECTパラメータの最適化につながり、より正確な臨床アプローチを可能にする可能性があります9。
本稿では、ECTを3D細胞培養に応用するための新しい電極に関する技術開発について述べる。ブレオマイシンは、ECT11と組み合わせて最も一般的に投与される細胞毒性物質です。私たちのグループの以前の研究では、適用されたEP設定(750ボルト/ cm、8パルス、100ミリ秒、5Hz)がin vitroでの眼腫瘍の治療に適していることが示されました。この技術の重要なステップには、動員後にスフェロイドが沈んでいる間にECTを実行するのに必要な短時間や、電極の正確な寸法が含まれます。カスタマイズされた電極が必要になったのは、利用可能な機器を使用してウェルでECTを実行するのが困難だったためです。私たちのグループからの未発表のデータは、スフェロイドをより大きなウェルまたはキュベットに移して処理の準備をし、その後培養ウェルに戻すと、スフェロイドの損傷が増加することを示しています。記載されている技術の利点は、オルガノイドがより大きなプレートやウェルに移されないため、治療を行うためのスフェロイド操作がないことです。したがって、すべてのスフェロイドはその形状を保持します。別の利点は、MTTアッセイなどの標準的な生存率アッセイと比較して、ECTの細胞毒性を決定するために、より堅牢な3D生存率アッセイを使用することです。これにより、スフェロイドのすべての細胞が溶解され、追加の細胞洗浄、培地の除去、および複数のピペッティングステップが必要になります。
記載されている方法の限界は、スフェロイドの寿命が短いことであり、これは腫瘍オルガノイドの中心に見られるように、腫瘍のサイズと細胞壊死に影響を及ぼします。CMとUMの両方で関連する高い死亡率と限られた治療オプションにより、既存の治療可能性を豊かにする必要があります。ECTは、患者の生活の質を改善し、患者の生存期間を延ばすためのアジュバントモダリティを提供する場合があります。これらのin vitro条件は、より高い精度でin vivoの設定を模倣し、さらなるヒトへの応用に有望な結果を提供します。初代培養物から調製したスフェロイドを用いた今後の研究では、標的治療のためのECT設定の最適化について、より代表的な結果を得ることができます。
開示事項
このレポートは、公共、商業、または非営利セクターの資金提供機関から特定の助成金を受けていません。
謝辞
この研究は、Rolf M. Schwiete-Stiftung博士の支援を受けました。著者らは、UM細胞株を提供してくださったMartine J. Jager氏(オランダ、ライデン、LUMC眼科研究所)とHelen Kalirai氏(英国リバプール大学、Molecular and Clinical Cancer Medicine、Liverpool Ocular Oncology Research Group)に感謝します。また、技術支援をいただいたSabine Hecht氏(ドイツ・ハレ大学病院(ザーレ)眼科)にも感謝いたします。
資料
| Name | Company | Catalog Number | Comments |
| Bleomycin sulfate | Enzo | BML-AP302-0010 | 10 mg |
| Cell culture flask 75 cm | TPP | TPP90076 | |
| Cell culture flask TC175 cm | Sarstedt | 83,39,12,002 | Standard with Filter |
| Cliniporator | IGEA | EPS01 | Electroporator |
| Corning Costar Ultra-Low Attachment Multiple Well Plate, 96 well, round bottom | Corning | 7007 | 96Well clear round Bottom, Ultra low attachment plates |
| EGF 1MG | Sigma-Aldrich | E4127-.1MG | |
| F-12 K Nut Mix (1x) | Gibco | 21127-022 | |
| Fetal Bovine Serum, South American | Corning | 35-079-CV | LOT Nr. 35079010, Reservierungsnummer: EU00478541 |
| FKS | |||
| KGM-2 | Lonza | CC-3103 | |
| PBS w/o. CaCl und MgCl | PromoCell | C-40232 | 500 ml |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333-100ml | |
| RPMI 1640 | Gibco | 11504566 | ATCC modification, HEPES, liquid, 500 ml |
| Tecan Infinity M Plex | Tecan | ||
| Trypsin-EDTA 1x Solution | Sigma-Aldrich | 59430C-100ml |
参考文献
- Kaliki, S., Shields, C. L. Uveal melanoma: relatively rare but deadly cancer. Eye (Lond). 31 (2), 241-257 (2017).
- Chang, A. E., Karnell, L. H., Menck, H. R. The National Cancer Data Base report on cutaneous and noncutaneous melanoma: a summary of 84,836 cases from the past decade. The American College of Surgeons Commission on Cancer and the American Cancer Society. Cancer. 83 (8), 1664-1678 (1998).
- Dogrusoz, M., Jager, M. J., Damato, B. Uveal Melanoma Treatment and Prognostication. Asia-Pacific Journal of Ophthalmology. 6 (2), 186-196 (2017).
- Damato, B., Coupland, S. E. Management of conjunctival melanoma. Expert Review of Anticancer Therapy. 9 (9), 1227-1239 (2009).
- Norregaard, J. C., Gerner, N., Jensen, O. A., Prause, J. U. Malignant melanoma of the conjunctiva: occurrence and survival following surgery and radiotherapy in a Danish population. Graefe's Archive for Clinical and Experimental Ophthalmology. 234 (9), 569-572 (1996).
- Fiorentzis, M., et al. Electrochemotherapy with bleomycin and cisplatin enhances cytotoxicity in primary and metastatic uveal melanoma cell lines in vitro. Neoplasma. 65 (2), 210-215 (2018).
- Fiorentzis, M., et al. Conjunctival melanoma and electrochemotherapy: preliminary results using 2D and 3D cell culture models in vitro. Acta Ophthalmologica. 97 (4), 632-640 (2019).
- Fiorentzis, M., et al. The Potential Use of Electrochemotherapy in the Treatment of Uveal Melanoma: In vitro Results in 3D Tumor Cultures and In vivo Results in a Chick Embryo Model. Cancers (Basel). 11 (9), (2019).
- Brun, P., et al. Cell-seeded 3D scaffolds as in vitro models for electroporation. Bioelectrochemistry. 125, 15-24 (2019).
- Sersa, G., et al. Electrochemotherapy in treatment of tumours. European Journal of Surgical Oncology. 34 (2), 232-240 (2008).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529(2017).
- Miklavcic, D., et al. Electrochemotherapy: technological advancements for efficient electroporation-based treatment of internal tumors. Medical & Biological Engineering & Computing. 50 (12), 1213-1225 (2012).
- Miklavcic, D., Corovic, S., Pucihar, G., Pavselj, N. Importance of tumour coverage by sufficiently high local electric field for effective electrochemotherapy. EJC Supplements. 4 (11), 45-51 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved