Method Article
맞춤형 전극을 사용한 3D 안구 흑색종 스페로이드의 전기화학 요법
요약
여기에서는 3D 결막 및 포도막 흑색종 스페로이드의 개발과 배양 웰에서 3D 스페로이드의 체외 전기화학 요법을 위한 휴대용 맞춤형 전극의 사용을 위한 프로토콜을 제시합니다. 이것은 안구 흑색종 치료에서 전기 화학 요법의 사용에 대한 새로운 관점을 제공합니다.
초록
전기화학요법(ECT)은 전기펄스 적용 후 일시적인 기공 형성과 세포독성 약물 투여의 조합으로, 멤브레인 변화로 인해 적용된 제제의 세포독성 효과를 향상시킵니다. 체외 3D 배양 시스템은 생체 내 종양 성장을 시뮬레이션하고 기존의 단층 세포 배양보다 더 정확하게 종양의 생물학적 특성을 보존합니다. 결막 흑색종(CM) 및 포도막 흑색종(UM) 세포주를 사용한 3D 종양 오가노이드 개발 프로토콜과 종양 환경을 파괴하지 않고 배양 웰에서 체외 ECT에 적합한 휴대용 맞춤형 전극의 사용을 설명합니다. 이 프로토콜은 3D CM 및 UM 스페로이드의 배양 및 성장과 블레오마이신 단독(2.5μg/mL), 전기천공법(EP)(750Volts/cm, 8pulses, 100μs, 5Hz) 단독, EP와 블레오마이신의 조합으로서의 ECT에 대한 반응을 분석합니다. 이 프로토콜에 사용된 약물 농도 및 EP 설정은 이전 실험에 따라 선호되는 ECT 조건으로 설정되었습니다. 스페로이드 생존율을 결정하기 위해 사용된 분석은 처리 후 3-7일 후에 수행되었습니다. 3D 종양 스페로이드의 생존력과 성장에 미치는 영향은 ECT 후에만 중요했습니다. 맞춤형 전극은 배양 웰에서 펄스의 적용을 용이하게 하기 위해 자세히 설명되어 있습니다. 3D UM 및 CM 스페로이드의 이 새로운 치료법은 향후 임상 적용을 위한 디딤돌을 설정합니다.
서문
포도막 흑색종(UM)은 성인에서 가장 흔한 원발성 안구 종양인 반면, 결막 흑색종(CM)은 모든 안구 흑색종의 2%를 차지합니다 1,2,3,4,5,6. 근접치료(Brachytherapy), 양성자빔 방사선요법(proton beam radiotherapy), 광선요법(phototherapy)은 UM의 1차 치료법이지만, 지구의 적출술(enucleation)이 필요할 수 있다 1,2,3. CM 치료는 안구 종양학 센터마다 다릅니다. 절제 생검 후 국소 화학요법 및/또는 방사선 요법을 시행하는 것이 가장 빈번한 치료 방법이다4. 치료에도 불구하고 CM은 25%-30%5의 사망률과 관련이 있습니다.
CM 및 UM 스페로이드의 형성과 안구 흑색종에서 ECT의 적용에 대한 문헌이 부족합니다 6,7,8. 종양 스페로이드는 기존의 2D 세포 배양보다 더 나은 생물학적 특징을 가지고 있으며 생체 내 종양 환경을 모방하는 유용한 도구로 제안되었습니다9. 전기화학요법(ECT)은 불투과성 세포독성 약물과 전기천공법(EP)을 결합한 요법입니다10. EP는 짧고 강렬한 전기 펄스를 국부적으로 응용하여 세포를 일시적으로 투과화하여 암세포의 항암제 흡수를 국부적으로 증가시키고 세포 사멸을 증가시키는 것입니다11. 본 연구는 CM 및 UM 스페로이드의 발달을 설명하는 프로토콜을 수립하고 블레오마이신을 사용한 ECT 후 결과를 조사합니다. 이 프로토콜은 스페로이드에 대한 다른 치료 방식을 사용하거나 ECT의 추가 효과를 연구하는 안구 종양학 분야의 연구자를 지원할 수 있습니다. 안과에서 ECT의 제한된 사용으로 인해 이 양식의 효과와 과정에 대한 지식이 거의 없습니다. 따라서 이 실험은 향후 치료 옵션의 스펙트럼을 넓힐 수 있습니다. 우리는 종양 환경의 파괴 없이 배양 웰에서 스페로이드의 ECT를 허용하는 새로운 맞춤형 휴대용 플레이트 전극 설정을 제안합니다.
프로토콜
1. 스페로이드 형성
- 스페로이드 형성을 위해 부착하여 성장하는 암 세포주를 사용합니다.
- 멸균 벤치 조건에서 모든 세포 배양 관련 단계를 제공합니다.
- 관심 세포주에 권장되는 표준 완전 배양 배지를 준비하고 수조를 사용하여 37°C로 예열합니다.
참고: 여기에서는 인간 결막 세포주 CM2005.1, CRMM1, CRMM2 및 포도막 흑색종 세포주 92.1, OMM1 및 OMM2를 사용하여 각각 10% 소 태아 혈청을 함유하는 Ham F-12 배지와 10% 소 태아 혈청을 함유하는 RPMI에서 배양했습니다. - 표준 효소 분해 방법(예: 트립신-EDTA 용액)을 사용하여 관심 세포를 분리합니다.
- 필수 세포의 수를 측정하려면 10μL의 Trypan blue 용액(1:1)에 10μL의 세포 현탁액을 재현탁하고 5분 이내에 챔버(혈구계 또는 자동 세포 계수기)를 사용하여 세포를 계수합니다. 세포는 합류점의 <90%이고 양호한 상태여야 합니다.
- 스페로이드를 형성하려면 96웰 초저 부착 플레이트에 총 부피 200μL의 완전 배양 배지로 웰당 5 x 103 세포를 시딩합니다. 5 %CO2를 함유 한 가습 분위기에서 37 ° C에서 플레이트를 배양합니다.
알림: 세포 부착을 효과적으로 억제하려면 표면에 공유 결합된 친수성, 비이온성, 중성 하전 하이드로겔이 있는 초저 부착 플레이트를 사용하십시오. 이 하이드로겔은 세포의 불멸화를 억제하고 세포를 부유 상태로 만들어 3D 스페로이드를 만듭니다. - 현미경을 사용하여 스페로이드 형성을 확인합니다.
참고: 일부 세포주는 첫 번째 통로에서 둥근 3D 종양 스페로이드를 형성하지 않습니다. 종양 구체 배양이 어두운 중심을 형성하기 시작하기 전에 통과합니다. 세포주에 따라 종양 덩어리를 4-10일 후에 트립신화(trypsinization)로 해리합니다. 그 후, 새로운 96 초저 부착 플레이트에 단세포를 파종합니다. 여러 계대에 대해 이 절차를 반복하면 세포가 3D 배양에 적응할 수 있습니다.
2. 종양 스페로이드의 전기화학요법
- 분석 대조군으로 처리되지 않은 스페로이드와 EP 또는 블레오마이신만 투여한 스페로이드를 사용합니다.
- electroporator에 대한 설정을 조정합니다(펄스 수, 펄스 주파수, 지속 시간 및 voltage, 재료 표 참조). 흑색종 세포의 경우 750 Volts/cm 강도, 100 μs 펄스 지속 시간, 5 Hz 반복 주파수의 8 구형파 전기 펄스를 사용합니다.
- 스페로이드 배양 3일차에 15mL 튜브에 5μg/mL 농도의 멸균 PBS에 새로운 블레오마이신 설페이트 용액을 준비합니다.
- 200μL의 배양 배지를 제거하고 각 웰에 대해 100μL의 새로운 완전 배양 배지를 다시 채워 스페로이드의 세포 배양 배지를 교환합니다.
- 각 웰에 100μL의 블레오마이신 설페이트 용액을 추가합니다(최종 농도: 2.5μg/mL). 블레오마이신 황산염 용액 대신 EP로만 처리된 처리되지 않은 대조군 및 스페로이드에 100μL의 새로운 배지를 추가합니다.
- 전기천공법을 수행합니다.
참고: 그림 1 에 표시된 전극은 할레-비텐베르크 대학의 연구 작업장에서 생산되었습니다. 그들은 스테인레스 스틸로 만들어졌으며 electroporator의 그립에 맞습니다. 전극은 96웰 초저 부착 플레이트에 사용하도록 설계되었습니다. 유사한 스테인리스강 전극도 대체 응용 분야를 위해 쉽게 제조할 수 있습니다.- 전극을 70% 에탄올로 살균하고 전극을 건조시킵니다. 전극의 직경은 1mm, 두 전극 사이의 간격은 4mm, 각 전극의 길이는 8mm입니다(그림 1a).
- 전극 사이에 스페로이드가 있도록 우물 바닥에 전극을 놓습니다. 이를 통해 두 전극 사이에 스페로이드를 이상적으로 배치할 수 있습니다(그림 1b).
- 플레이트를 흔들어 스페로이드가 웰 바닥에서 이동하여 전극 사이에 놓일 수 있도록 합니다. 스페로이드는 몇 초 동안만 전극 사이에 있습니다.
- 원하는 설정으로 electroporation을 시작합니다.
- 150μL의 배지를 150μL의 새 배지로 교환하여 웰의 블레오마이신 설페이트 용액을 교체합니다.
- 5%CO2를 함유하는 가습된 분위기에서 37°C에서 최대 10일 동안 세포를 배양합니다. 처리되지 않은 스페로이드가 어두운 중심을 형성하기 시작하면 실험을 종료합니다. 2-3일마다 150μL의 세포 배양 배지를 교환합니다. 따라서 피펫 팁을 웰의 가장자리 영역에 배치하고 플레이트를 기울이고 천천히 피펫팅하여 스페로이드 중단을 방지합니다.
3. 스페로이드 크기의 결정
- ImageJ Fiji11을 사용하여 스페로이드의 단면적을 계산하여 명시야 현미경을 사용하여 치료 당일(시작점)과 치료 후 3-7일의 스페로이드 크기를 측정합니다.
- 스케일 바가 있는 단일 스페로이드의 이미지를 촬영합니다. 전체 스페로이드가 보이는 배율을 사용합니다. 예를 들어, CM2005.1에는 5배 배율이 사용되었습니다. 이미지를 JPEG로 저장합니다.
- ImageJ/Fiji를 사용하여 단면적을 계산하여 스페로이드 크기를 분석합니다.
- 소프트웨어(https://imagej.net/Fiji/Downloads)를 설치합니다.
- ImageJ/Fiji를 시작합니다. spheroid-image: File > Open을 가져옵니다.
- 스케일을 설정하려면 도구 모음의 선 버튼을 선택하고 마우스 클릭으로 이미지에서 스케일 바의 선을 표시합니다: Analyze > Set Scale. 알려진 거리를 사용하여 축척 막대의 거리를 채웁니다. 길이 단위를 μm로 변경합니다. 전역 필드를 클릭하여 동일한 배율을 가진 모든 이미지에 대한 설정을 할당합니다.
- 이미지를 8비트로 변환: 이미지 > 유형 > 8비트입니다.
- 이미지를 선택하고 > 자동 임계값을 조정합니다(범위를 재설정하지 않음> 선택 >). 스페로이드는 선택한 임계값 마커에 따라 빨간색 또는 검은색으로 표시됩니다. 스페로이드 픽셀이 빨간색으로 바뀌지만 스페로이드가 아닌 픽셀의 색상은 변경되지 않도록 슬라이더를 조정합니다. Threshold(임계값) 대화 상자 창을 아무 버튼도 클릭하지 않고 닫습니다.
- 스페로이드의 단면적을 계산하려면 분석 > 측정 설정을 선택하고 면적, 한계 및 레이블 표시를 클릭합니다. OK를 클릭하여 Set Measurements 대화 상자 창을 닫습니다.
- 결과를 표시하려면 [Analyze ] > [Analyze Particles ]를 선택하고 크기(μm2) = 10000-무한대를 변경하여 노이즈를 제거합니다. Display results 버튼을 클릭하고 OK를 클릭하여 창을 닫습니다. 결과에는 레이블과 영역이 있는 스페로이드가 표시됩니다. 여러 스페로이드의 해석을 반복하면 결과가 결과 창에 나열됩니다.
- ECT 처리된 스페로이드의 상대적 처리 반응을 미처리 및 단일 처리 대조군과 비교하여 확인하려면 단면적의 백분율 변화를 계산합니다.
4. 스페로이드 생존 능력의 결정
- 제조업체 지침에 따라 3D 세포 배양에 적합한 세포 생존율 분석을 사용하여 처리 후 3-7일 후에 스페로이드 생존율을 측정합니다. 이 분석은 대사 활성 세포의 존재를 나타내는 ATP의 정량화를 통해 생존력을 검출할 수 있도록 대형 스페로이드를 관통하고 용해해야 합니다.
참고: 이 실험에서는 판독 방법으로 발광 기반 분석을 사용했습니다. ECT 처리된 스페로이드의 생존력은 처리 7일 후 대조군과 비교되었습니다.
결과
실험은 고급 스테인리스강으로 구성된 맞춤형 휴대용 전극으로 수행되었습니다. 전극의 두께는 1mm, 너비는 4mm, 두 전극 사이의 간격은 4mm, 각 전극의 길이는 8mm입니다(그림 1). EP와 블레오마이신 단독은 UM 및 CM 종양 스페로이드의 생존력과 성장에 큰 영향을 미치지 않습니다. ECT는 종양 생존율과 스페로이드 크기가 현저히 감소하는 것으로 나타났습니다. 블레오마이신을 사용한 ECT 후 테스트된 모든 스페로이드의 중앙 및 주변 영역에서 스페로이드 주변의 해체된 세포 단편을 동반한 스페로이드 구조의 손실과 괴사가 관찰되었습니다. 그림 2 는 CM2005.1 세포주의 결과를 보여줍니다. 전이성 UM 세포주는 ECT8 이후 1차 세포주에 비해 더 높은 반응을 보였습니다.

그림 1: 맞춤형 휴대용 전극. 전극은 고급 스테인리스강으로 만들어졌습니다. 전극의 손잡이에는 electroporator가 제공됩니다. 전극의 두께는 1mm, 너비는 4mm, 두 전극 사이의 간격은 4mm, 각 전극의 길이는 8mm(a)입니다. 96웰 형식(B)에서 스페로이드의 전기천공법. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
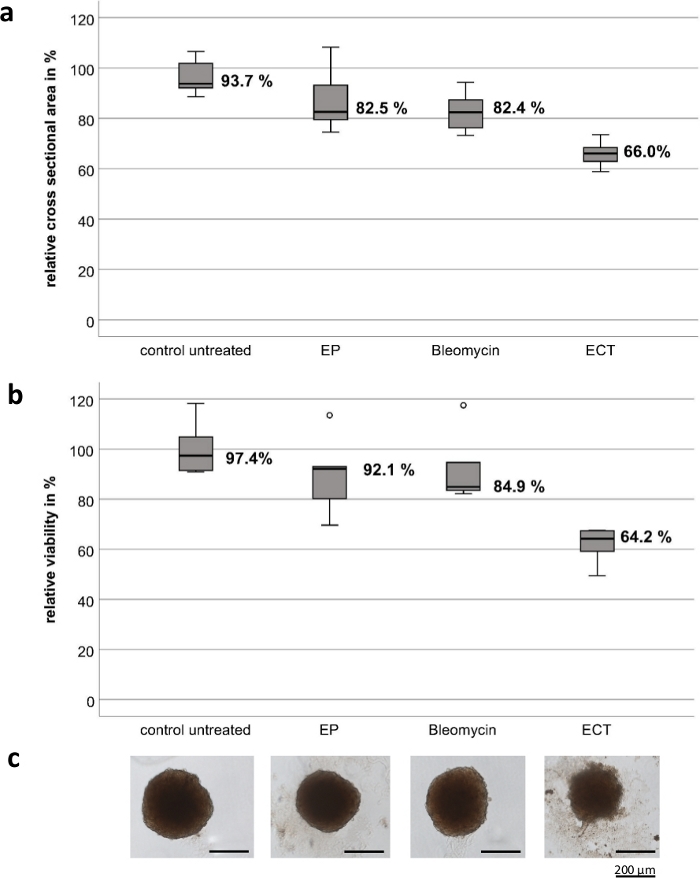
그림 2: 결막 흑색종 세포주 CM2005.1의 종양 스페로이드에 대한 전기화학요법의 세포독성 효과. 전기화학요법(ECT, 2.5 μg/mL 블레오마이신 도포 후 750 V/cm)은 전기천공법(EP) 단독 또는 블레오마이신(2.5 g/mL) 단독을 사용한 화학요법에 비해 스페로이드에서 더 강력한 세포독성 효과를 일으켰습니다. 세포독성 효과는 단면적과 생존력 분석을 모두 처리 후 7일 후에 처리되지 않은 대조군의 백분율로 계산하여 측정되었습니다. 상자 플롯은 스페로이드(a)의 평균 단면적을 보여줍니다. 스페로이드의 평균 생존 능력(B); 스페로이드의 대표 이미지, 스케일 바 = 200 μm (c). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
EP는 다양한 생명 공학 및 임상 응용 분야에 사용됩니다12. 모든 표적 세포와 부위에 대해 높은 특이성을 갖도록 특별히 설계된 전극과 같은 새로운 기술 개발은 신체 어느 곳에서나 ECT 표적 조직을 도울 수 있습니다12. 전극의 설계와 위치는 종양에 대한 완전한 접근을 허용해야 하며, 건강한 조직이 치료로 인해 최소한의 영향을 받거나 손상되지 않도록 보장해야 한다13.
이전 간행물에서는 인간 흑색종 세포 현탁액에서 ECT의 효과를 in vitro 7,8로 보여주었습니다. 3D 안구 세포 모델 또는 기타 유사한 생체 내 환경에 ECT를 적용하여 보다 안전한 치료 활용을 가능하게 하는 것에 대한 문헌은 제한적입니다. Brun 등은 형태학적 분석 중 골격의 3D 세포가 2D 배양에서 나타난 길쭉한 모양과 다른 둥근 모양을 가지고 있지만 환자의 생검에서 얻은 세포와 매우 유사하다고 가정합니다9. 3D 배양에 사용되는 치료 환경 및 기구의 개선은 ECT 매개변수의 최적화로 이어질 수 있으며, 이를 통해 보다 정확한 임상적 접근이 가능해질 수 있다9.
우리는 3D 세포 배양에 ECT를 적용하기 위한 새로운 전극에 관한 기술 개발에 대해 설명합니다. 블레오마이신(Bleomycin)은 ECT11과 함께 가장 일반적으로 투여되는 세포독성제입니다. 우리 그룹의 이전 연구에서는 적용된 EP 설정(750 Volts/cm, 8 pulses, 100 ms, 5 Hz)이 in vitro 안구 종양 치료에 적합하다는 것을 보여주었습니다. 이 기술의 중요한 단계에는 가동 후 스페로이드가 가라앉는 동안 ECT를 수행하는 데 필요한 짧은 시간과 전극의 정확한 치수가 포함됩니다. 맞춤형 전극의 필요성은 사용 가능한 기기로 우물에서 ECT를 수행하는 데 어려움이 있었기 때문입니다. 우리 그룹의 미발표 데이터에 따르면 스페로이드를 더 큰 우물이나 큐벳으로 옮겨 처리를 준비한 다음 배양 웰로 다시 보낼 때 스페로이드 손상이 증가한 것으로 나타났습니다. 설명된 기술의 장점은 오가노이드가 더 큰 플레이트나 웰로 전달되지 않기 때문에 처리를 수행하기 위한 스페로이드 조작이 없다는 것입니다. 따라서 모든 스페로이드는 형태를 유지합니다. 또 다른 장점은 MTT 분석과 같은 표준 생존도 분석과 비교하여 ECT의 세포 독성을 결정하기 위해 더 강력한 3D 생존도 분석을 사용한다는 것입니다. 이에 따라 스페로이드의 모든 세포가 용해되고 추가 세포 세척, 배지 제거 및 여러 피펫팅 단계가 필요합니다.
설명된 방법의 한계는 스페로이드의 수명이 짧다는 것인데, 이는 종양의 크기에 영향을 미치고 종양 오가노이드의 중심에서 볼 수 있듯이 세포 괴사에 영향을 미칩니다. CM과 UM 모두에서 높은 사망률과 제한된 치료 옵션은 기존 치료 가능성의 풍부화를 필요로 합니다. ECT는 환자의 삶의 질을 개선하고 환자의 생존을 연장하기 위한 보조 방법을 제공할 수 있습니다. 이러한 체외 조건은 더 높은 정밀도로 생체 내 설정을 모방하여 향후 인간 적용을 위한 유망한 결과를 제공합니다. 1차 배양에서 준비된 스페로이드를 사용하는 향후 연구는 표적 치료를 위한 ECT 설정 최적화를 위한 보다 대표적인 결과를 제공할 수 있습니다.
공개
이 보고서는 공공, 상업 또는 비영리 부문의 자금 지원 기관으로부터 특정 보조금을 받지 않았습니다.
감사의 말
이 연구는 Rolf M. Schwiete-Stiftung 박사의 지원을 받았습니다. 저자들은 UM 세포주를 제공한 Martine J. Jager(네덜란드 라이덴 소재 LUMC 안과 연구소)와 Helen Kalirai(영국 리버풀 대학교 분자 및 임상 암 의학 리버풀 안구 종양학 연구 그룹)에게 감사를 표합니다. 또한 기술 지원을 해주신 Sabine Hecht(독일 할레 대학병원 안과)에게도 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Bleomycin sulfate | Enzo | BML-AP302-0010 | 10 mg |
| Cell culture flask 75 cm | TPP | TPP90076 | |
| Cell culture flask TC175 cm | Sarstedt | 83,39,12,002 | Standard with Filter |
| Cliniporator | IGEA | EPS01 | Electroporator |
| Corning Costar Ultra-Low Attachment Multiple Well Plate, 96 well, round bottom | Corning | 7007 | 96Well clear round Bottom, Ultra low attachment plates |
| EGF 1MG | Sigma-Aldrich | E4127-.1MG | |
| F-12 K Nut Mix (1x) | Gibco | 21127-022 | |
| Fetal Bovine Serum, South American | Corning | 35-079-CV | LOT Nr. 35079010, Reservierungsnummer: EU00478541 |
| FKS | |||
| KGM-2 | Lonza | CC-3103 | |
| PBS w/o. CaCl und MgCl | PromoCell | C-40232 | 500 ml |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333-100ml | |
| RPMI 1640 | Gibco | 11504566 | ATCC modification, HEPES, liquid, 500 ml |
| Tecan Infinity M Plex | Tecan | ||
| Trypsin-EDTA 1x Solution | Sigma-Aldrich | 59430C-100ml |
참고문헌
- Kaliki, S., Shields, C. L. Uveal melanoma: relatively rare but deadly cancer. Eye (Lond). 31 (2), 241-257 (2017).
- Chang, A. E., Karnell, L. H., Menck, H. R. The National Cancer Data Base report on cutaneous and noncutaneous melanoma: a summary of 84,836 cases from the past decade. The American College of Surgeons Commission on Cancer and the American Cancer Society. Cancer. 83 (8), 1664-1678 (1998).
- Dogrusoz, M., Jager, M. J., Damato, B. Uveal Melanoma Treatment and Prognostication. Asia-Pacific Journal of Ophthalmology. 6 (2), 186-196 (2017).
- Damato, B., Coupland, S. E. Management of conjunctival melanoma. Expert Review of Anticancer Therapy. 9 (9), 1227-1239 (2009).
- Norregaard, J. C., Gerner, N., Jensen, O. A., Prause, J. U. Malignant melanoma of the conjunctiva: occurrence and survival following surgery and radiotherapy in a Danish population. Graefe's Archive for Clinical and Experimental Ophthalmology. 234 (9), 569-572 (1996).
- Fiorentzis, M., et al. Electrochemotherapy with bleomycin and cisplatin enhances cytotoxicity in primary and metastatic uveal melanoma cell lines in vitro. Neoplasma. 65 (2), 210-215 (2018).
- Fiorentzis, M., et al. Conjunctival melanoma and electrochemotherapy: preliminary results using 2D and 3D cell culture models in vitro. Acta Ophthalmologica. 97 (4), 632-640 (2019).
- Fiorentzis, M., et al. The Potential Use of Electrochemotherapy in the Treatment of Uveal Melanoma: In vitro Results in 3D Tumor Cultures and In vivo Results in a Chick Embryo Model. Cancers (Basel). 11 (9), (2019).
- Brun, P., et al. Cell-seeded 3D scaffolds as in vitro models for electroporation. Bioelectrochemistry. 125, 15-24 (2019).
- Sersa, G., et al. Electrochemotherapy in treatment of tumours. European Journal of Surgical Oncology. 34 (2), 232-240 (2008).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529(2017).
- Miklavcic, D., et al. Electrochemotherapy: technological advancements for efficient electroporation-based treatment of internal tumors. Medical & Biological Engineering & Computing. 50 (12), 1213-1225 (2012).
- Miklavcic, D., Corovic, S., Pucihar, G., Pavselj, N. Importance of tumour coverage by sufficiently high local electric field for effective electrochemotherapy. EJC Supplements. 4 (11), 45-51 (2006).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유