Method Article
Electroquimioterapia en esferoides de melanoma ocular 3D mediante un electrodo personalizado
En este artículo
Resumen
Aquí, presentamos un protocolo para el desarrollo de esferoides de melanoma conjuntival y uveal en 3D y el uso de electrodos personalizados portátiles para la electroquimioterapia in vitro de esferoides 3D en un pozo de cultivo. Esto ofrece nuevas perspectivas en el uso de la electroquimioterapia en el tratamiento del melanoma ocular.
Resumen
La electroquimioterapia (TEC) es la combinación de la formación transitoria de poros tras la aplicación de pulsos eléctricos con la administración de fármacos citotóxicos, lo que aumenta el efecto citotóxico del agente aplicado debido a los cambios en la membrana. Los sistemas de cultivo 3D in vitro simulan el crecimiento tumoral in vivo y preservan las características biológicas de los tumores con mayor precisión que los cultivos celulares monocapa convencionales. Describimos un protocolo para el desarrollo de organoides tumorales en 3D utilizando líneas celulares de melanoma conjuntival (CM) y melanoma uveal (UM), así como el uso de electrodos personalizados de mano, adecuados para la TEC in vitro en el pozo de cultivo sin destruir el entorno tumoral. Este protocolo analiza el cultivo y crecimiento de esferoides CM y UM 3D y su reacción a bleomicina (2,5 μg/mL) sola, electroporación (EP) (750 voltios/cm, 8 pulsos, 100 μs, 5 Hz) sola, y ECT como combinación de EP y bleomicina. La concentración del fármaco y los ajustes de PE utilizados en este protocolo se establecieron como condiciones preferidas de TEC de acuerdo con experimentos previos. El ensayo utilizado para determinar la viabilidad del esferoide se realizó entre 3 y 7 días después del tratamiento. El efecto sobre la viabilidad y el crecimiento de los esferoides tumorales 3D fue significativo solo después de la TEC. Los electrodos personalizados se describen en detalle para facilitar la aplicación de pulsos en el pozo de cultivo. Este novedoso tratamiento de esferoides 3D UM y CM establece un trampolín para futuras aplicaciones clínicas.
Introducción
El melanoma uveal (UM) es el tumor intraocular primario más frecuente en adultos, mientras que el melanoma conjuntival (MC) representa el 2% de todos los melanomas oculares 1,2,3,4,5,6. La braquiterapia, la radioterapia con haz de protones y la fototerapia son los tratamientos de primera línea en la UM, mientras que la enucleación del globo puede ser necesaria 1,2,3. El tratamiento de la MC varía entre los centros de oncología ocular; La biopsia por escisión seguida de quimioterapia local y/o radioterapia es el abordaje de tratamiento más frecuente4. A pesar del tratamiento, la MC se asocia con una mortalidad del 25% al 30%5.
Existe escasez de literatura sobre la formación de esferoides CM y UM y la aplicación de la TEC en el melanoma ocular 6,7,8. Los esferoides tumorales tienen mejores características biológicas que los cultivos celulares 2D convencionales y se han propuesto como una herramienta útil para imitar el entorno tumoral in vivo9. La electroquimioterapia (TEC) combina el uso de fármacos citotóxicos no permeables con la electroporación (EP)10. La PE es la aplicación local de pulsos eléctricos cortos e intensos que permeabilizan transitoriamente las células para un aumento localizado de la absorción de fármacos anticancerígenos en las células cancerosas y da lugar a un aumento de la muerte celular11. Este estudio establece un protocolo que describe el desarrollo de esferoides CM y UM e investiga los resultados después de la TEC con bleomicina. Este protocolo podría ayudar a los investigadores en el campo de la oncología ocular que utilizan otras modalidades terapéuticas sobre los esferoides o estudiar los efectos adicionales de la TEC. Debido al uso limitado de la TEC en oftalmología, hay poco conocimiento sobre el efecto y el proceso de esta modalidad; Por lo tanto, este experimento puede ampliar el espectro de opciones de tratamiento en el futuro. Proponemos un novedoso ajuste de electrodo de placa manual personalizado, que permite la TEC del esferoide en los pocillos de cultivo sin ninguna destrucción del entorno tumoral.
Protocolo
1. Formación de esferoides
- Utilice líneas celulares cancerosas de crecimiento adherente para la formación de esferoides.
- Proporcionar todos los pasos asociados al cultivo celular en condiciones de banco estéril.
- Prepare el medio de cultivo completo estándar como se recomienda para las líneas celulares de interés y caliéntelo a 37 °C con un baño de agua.
NOTA: Aquí, se utilizaron las líneas celulares conjuntivales humanas CM2005.1, CRMM1, CRMM2, así como las líneas celulares de melanoma uveal 92.1, OMM1 y OMM2 y se cultivaron en medio Ham F-12 que contenía 10% de suero fetal bovino y RPMI que contenía 10% de suero fetal bovino, respectivamente. - Separe las células de interés utilizando métodos de digestión enzimática estándar (por ejemplo, solución de tripsina-EDTA).
- Para determinar el número de células vitales, vuelva a suspender 10 μL de la suspensión celular en 10 μL de solución de azul de tripán (1:1) y cuente las células utilizando una cámara (hemocitómetro o un contador de células automatizado) dentro de los 5 minutos. Las celdas deben estar al <90% de la confluencia y en buen estado.
- Para formar esferoides, siembre 5 x 103 celdas por pocillo con un volumen total de 200 μL de medio de cultivo completo en placas de fijación ultra bajas de 96 pocillos. Incubar la placa a 37 °C en una atmósfera humidificada que contenga 5% de CO2.
NOTA: Para una inhibición efectiva de la unión celular, use placas de fijación ultra bajas con un hidrogel hidrófilo, no iónico y con carga neutra unido covalentemente en la superficie. Este hidrogel inhibe la inmortalización de las células y las obliga a entrar en un estado suspendido para construir esferoides 3D. - Verifique la formación de esferoide con un microscopio.
NOTA: Algunas líneas celulares no forman esferoides tumorales redondos en 3D en el primer pasaje. Pase el cultivo de la esfera tumoral antes de que comiencen a desarrollar un centro oscuro. Disociar las masas tumorales en función de la línea celular a los 4-10 días mediante tripsinización. A continuación, siembre las células individuales en una nueva placa de fijación ultra baja 96. Al repetir este procedimiento durante varios pasajes, las células se adaptarán al cultivo en 3D.
2. Electroquimioterapia de los esferoides tumorales
- Como control de ensayo, utilice esferoides no tratados y esferoides tratados solo con EP o bleomicina sola.
- Ajuste la configuración del electroporador (conteo de pulsos, frecuencia de pulsos, tiempo de duración y voltaje; consulte la tabla de materiales). Para las células de melanoma, use 8 pulsos eléctricos de onda cuadrada de 750 voltios/cm de fuerza, duración del pulso de 100 μs, frecuencia de repetición de 5 Hz.
- En el día 3 del cultivo de esferoides, prepare una solución fresca de sulfato de bleomicina en PBS estéril a una concentración de 5 μg/mL en un tubo de 15 mL.
- Cambie el medio de cultivo celular de los esferoides retirando 200 μL de medio de cultivo y rellenando con 100 μL de medio de cultivo completo fresco para cada pocillo.
- Añadir 100 μL de solución de sulfato de bleomicina a cada pocillo (concentración final 2,5 μg/mL). Añadir 100 μL de medio fresco a los controles no tratados y a los esferoides tratados únicamente con EP en lugar de solución de sulfato de bleomicina.
- Realizar la electroporación.
NOTA: Los electrodos que se muestran en la Figura 1 se produjeron en el taller de investigación de la Universidad de Halle-Wittenberg. Están hechos de acero inoxidable y se ajustan a la empuñadura del electroporador. Los electrodos fueron diseñados para su uso en placas de fijación ultra bajas de 96 pocillos. También se pueden fabricar fácilmente electrodos de acero inoxidable similares para aplicaciones alternativas.- Esterilice los electrodos con etanol al 70% y deje que los electrodos se sequen. El diámetro de los electrodos es de 1 mm, el espacio entre los dos electrodos es de 4 mm y la longitud de cada electrodo es de 8 mm (Figura 1a).
- Coloque los electrodos en el fondo del pocillo, con los esferoides entre los electrodos. Esto permite el posicionamiento ideal del esferoide entre los dos electrodos (Figura 1b).
- Agite la placa para permitir que los esferoides se muevan desde el fondo del pozo y se coloquen entre los electrodos. El esferoide solo estará entre los electrodos durante un par de segundos.
- Inicie la electroporación con los ajustes preferidos.
- Reemplace la solución de sulfato de bleomicina en el pocillo intercambiando 150 μL de medio por 150 μL de medio fresco.
- Incubar las células durante un máximo de 10 días a 37 °C en una atmósfera humidificada que contenga un 5% deCO2. Si los esferoides no tratados comienzan a desarrollar un centro oscuro, finalice el experimento. Intercambie 150 μL del medio de cultivo celular cada 2-3 días. De este modo, evite la interrupción del esferoide colocando la punta de la pipeta en la región del borde del pocillo, inclinando la placa y pipeteando lentamente.
3. Determinación del tamaño del esferoide
- Mida el tamaño del esferoide el día del tratamiento (punto de partida) y 3-7 días después del tratamiento utilizando microscopía de campo claro calculando el área de la sección transversal de los esferoides utilizando ImageJ Fiji11.
- Tome una imagen de los esferoides individuales con la barra de escala. Utilice un aumento por el cual todo el esferoide sea visible. Por ejemplo, se utilizó un aumento de 5x para CM2005.1. Guarde la imagen como JPEG.
- Analice el tamaño del esferoide calculando el área de la sección transversal utilizando ImageJ/Fiji.
- Instale el software (https://imagej.net/Fiji/Downloads).
- Iniciar ImageJ/Fiji. Importe la imagen de esferoide: Archivo > Abrir.
- Para establecer la escala, elija el botón de línea de la barra de herramientas y marque la línea de la barra de escala en la imagen haciendo clic con el ratón: Analizar > Establecer escala. Usando una distancia conocida, rellene la distancia de la barra de escala. Cambie la unidad de longitud a μm. Haga clic en el campo global para asignar la configuración de todas las imágenes con el mismo factor de ampliación.
- Convertir la imagen a 8 bits: Tipo de > de imagen > 8 bits.
- Elija Imagen > Ajustar > umbral automático (seleccione > No restablecer rango). El esferoide está marcado en rojo o negro dependiendo del marcador de umbral elegido. Ajuste los controles deslizantes para que los píxeles esferoides se vuelvan rojos, pero los píxeles no esferoides no cambien de color. Cierre la ventana de diálogo Umbral sin hacer clic en ninguno de los botones.
- Para calcular el área de la sección transversal del esferoide, elija Analizar > Establecer mediciones y haga clic en Área, Limitar a umbral y Mostrar etiqueta. Cierre la ventana de diálogo Establecer medidas haciendo clic en Aceptar.
- Para mostrar los resultados, elija Analizar > Analizar partículas y cambie el tamaño (μm2) = 10000-infinito para eliminar el ruido. Haga clic en el botón Mostrar resultados y cierre la ventana haciendo clic en Aceptar. En los Resultados, se muestran los esferoides con la etiqueta y el área. Al repetir los análisis de varios esferoides, los resultados se enumeran en la ventana Resultados .
- Para determinar la respuesta relativa al tratamiento de los esferoides tratados con TEC en comparación con los controles no tratados y tratados con un solo tratamiento, calcule los cambios porcentuales del área de la sección transversal.
4. Determinación de la viabilidad de los esferoides
- Mida la viabilidad del esferoide de 3 a 7 días después del tratamiento utilizando un ensayo de viabilidad celular adecuado para cultivos celulares 3D de acuerdo con las instrucciones del fabricante. El ensayo necesita penetrar y lisar esferoides grandes para permitir la detección de la viabilidad mediante la cuantificación de ATP, que señala la presencia de células metabólicamente activas.
NOTA: En este experimento, se utilizó un ensayo basado en luminiscencia como método de lectura. La viabilidad de los esferoides tratados con TEC se comparó con los controles siete días después del tratamiento.
Resultados
Los experimentos se llevaron a cabo con electrodos manuales personalizados, que están compuestos de acero inoxidable de alta calidad. El grosor de los electrodos es de 1 mm, el ancho es de 4 mm, el espacio entre los dos electrodos es de 4 mm y la longitud de cada electrodo es de 8 mm (Figura 1). La EP y la bleomicina por sí solas no tienen un efecto significativo sobre la viabilidad y el crecimiento de los esferoides tumorales UM y CM. La TEC muestra una reducción significativa en la viabilidad tumoral y en el tamaño de los esferoides. Se observó pérdida de la arquitectura esferoide con fragmentos celulares deconstruidos alrededor de los esferoides y necrosis en la región central y periférica de todos los esferoides probados después de la TEC con bleomicina. La Figura 2 muestra los resultados de las líneas celulares CM2005.1. Las líneas celulares UM metastásicas mostraron una respuesta más alta en comparación con las líneas celulares primarias después de la TEC8.

Figura 1: Electrodos de mano personalizados. Los electrodos están hechos de acero inoxidable de alta calidad. El mango de los electrodos está provisto con el electroporador. El grosor de los electrodos es de 1 mm, el ancho es de 4 mm, el espacio entre los dos electrodos es de 4 mm y la longitud de cada electrodo es de 8 mm (a); Electroporación de esferoides en un formato de 96 pocillos (B). Haga clic aquí para ver una versión más grande de esta figura.
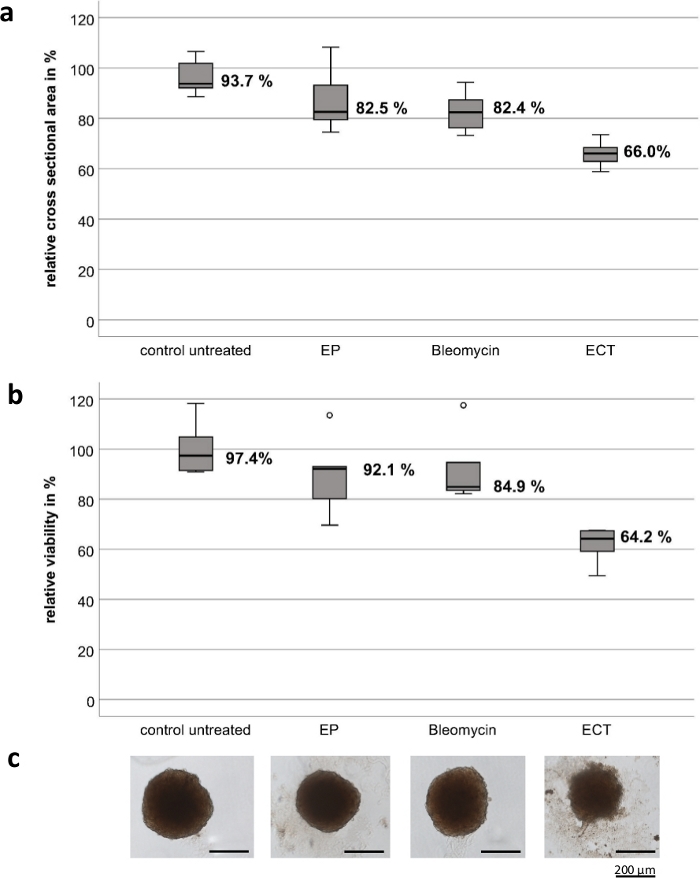
Figura 2: Efecto citotóxico de la electroquimioterapia sobre esferoides tumorales de la línea celular de melanoma conjuntival CM2005.1. La electroquimioterapia (TEC, 750 V/cm después de la aplicación de 2,5 μg/mL de bleomicina) causó efectos citotóxicos más fuertes en los esferoides en comparación con la electroporación (EP) sola o la quimioterapia con bleomicina (2,5 g/mL) sola. El efecto citotóxico se midió calculando el área de la sección transversal y un ensayo de viabilidad como porcentaje del control no tratado siete días después del tratamiento. Los diagramas de caja muestran el área media de la sección transversal de los esferoides (a); la viabilidad media de los esferoides (b); Imágenes representativas de esferoides, barra de escala = 200 μm (C). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La EP se utiliza en diversas aplicaciones biotecnológicas y clínicas12. Los nuevos desarrollos tecnológicos, como los electrodos especialmente diseñados con alta especificidad para cada célula y sitio objetivo, pueden ayudar a la TEC a dirigirse al tejido en cualquier parte del cuerpo12. El diseño y la posición de los electrodos deben permitir el acceso completo al tumor y garantizar que el tejido sano se vea mínimamente afectado o no dañado por el tratamiento13.
Publicaciones previas mostraron el efecto de la TEC en suspensiones de células de melanoma humano in vitro 7,8. La literatura referente a la aplicación de la TEC en modelos 3D de células oculares u otros entornos in vivo similares, que permitan una utilización terapéutica más segura, es limitada. Brun et al. postulan que las células 3D en el andamio durante el análisis morfológico tienen una forma redonda diferente de la forma alargada mostrada en los cultivos 2D, pero extremadamente similar a las células de las biopsias de los pacientes9. El refinamiento de los entornos terapéuticos y de los instrumentos utilizados en los cultivos 3D puede conducir a una optimización de los parámetros de la TEC, lo que permite un abordaje clínico más preciso9.
Describimos un desarrollo tecnológico de nuevos electrodos para la aplicación de TEC en cultivos celulares 3D. La bleomicina es el agente citotóxico más comúnmente administrado en combinación con la TEC11. Estudios previos de nuestro grupo demostraron que los ajustes de EP aplicados (750 voltios/cm, 8 pulsos, 100 ms, 5 Hz) eran adecuados para el tratamiento de tumores oculares in vitro. Los pasos críticos de la técnica incluyen el corto tiempo necesario para realizar la TEC mientras el esferoide se hunde después de la movilización, así como la dimensión precisa de los electrodos. La necesidad de los electrodos personalizados se debió a las dificultades para realizar la TEC en los pozos con los instrumentos disponibles. Los datos no publicados de nuestro grupo mostraron un aumento del daño de los esferoides cuando se transfirieron los esferoides a un pocillo más grande o a una cubeta para prepararlos para el tratamiento y luego de vuelta al pocillo de cultivo. Una ventaja de la técnica descrita es la falta de manipulación de esferoides para realizar el tratamiento, ya que los organoides no se transfieren a placas o pocillos más grandes. Por lo tanto, todos los esferoides conservan su forma. Otra ventaja es el uso de ensayos de viabilidad 3D más robustos para determinar la citotoxicidad de la TEC en comparación con los ensayos de viabilidad estándar, como el ensayo MTT. De este modo, todas las células del esferoide se lisan y se requiere un lavado adicional de las células, la eliminación del medio y múltiples pasos de pipeteo.
Las limitaciones de los métodos descritos son la corta vida útil de los esferoides, que afecta el tamaño del tumor, así como la necrosis celular, como se observa en el centro del organoide tumoral. La alta tasa de mortalidad asociada tanto en MC como en MA y las limitadas opciones terapéuticas requieren el enriquecimiento de las posibilidades terapéuticas existentes. La TEC puede ofrecer una modalidad adyuvante para mejorar la calidad de vida del paciente y prolongar su supervivencia. Estas condiciones in vitro imitan un entorno in vivo con mayor precisión, lo que ofrece resultados prometedores para su posterior aplicación en humanos. Los estudios futuros que utilizan esferoides preparados a partir de cultivos primarios pueden ofrecer resultados más representativos para la optimización de los ajustes de TEC para un tratamiento dirigido.
Divulgaciones
Este informe no recibió ninguna subvención específica de ninguna agencia de financiamiento en los sectores público, comercial o sin fines de lucro.
Agradecimientos
Este estudio fue apoyado por el Dr. Rolf M. Schwiete-Stiftung. Los autores agradecen a Martine J. Jager (Laboratorio de Oftalmología del LUMC, Leiden, Países Bajos) y Helen Kalirai (Grupo de Investigación en Oncología Ocular de Liverpool, Medicina Molecular y Clínica del Cáncer, Universidad de Liverpool, Reino Unido) por proporcionar las líneas celulares de la UM. También nos gustaría agradecer a Sabine Hecht (Departamento de Oftalmología, Hospital Universitario de Halle (Saale), Alemania) por su asistencia técnica.
Materiales
| Name | Company | Catalog Number | Comments |
| Bleomycin sulfate | Enzo | BML-AP302-0010 | 10 mg |
| Cell culture flask 75 cm | TPP | TPP90076 | |
| Cell culture flask TC175 cm | Sarstedt | 83,39,12,002 | Standard with Filter |
| Cliniporator | IGEA | EPS01 | Electroporator |
| Corning Costar Ultra-Low Attachment Multiple Well Plate, 96 well, round bottom | Corning | 7007 | 96Well clear round Bottom, Ultra low attachment plates |
| EGF 1MG | Sigma-Aldrich | E4127-.1MG | |
| F-12 K Nut Mix (1x) | Gibco | 21127-022 | |
| Fetal Bovine Serum, South American | Corning | 35-079-CV | LOT Nr. 35079010, Reservierungsnummer: EU00478541 |
| FKS | |||
| KGM-2 | Lonza | CC-3103 | |
| PBS w/o. CaCl und MgCl | PromoCell | C-40232 | 500 ml |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333-100ml | |
| RPMI 1640 | Gibco | 11504566 | ATCC modification, HEPES, liquid, 500 ml |
| Tecan Infinity M Plex | Tecan | ||
| Trypsin-EDTA 1x Solution | Sigma-Aldrich | 59430C-100ml |
Referencias
- Kaliki, S., Shields, C. L. Uveal melanoma: relatively rare but deadly cancer. Eye (Lond). 31 (2), 241-257 (2017).
- Chang, A. E., Karnell, L. H., Menck, H. R. The National Cancer Data Base report on cutaneous and noncutaneous melanoma: a summary of 84,836 cases from the past decade. The American College of Surgeons Commission on Cancer and the American Cancer Society. Cancer. 83 (8), 1664-1678 (1998).
- Dogrusoz, M., Jager, M. J., Damato, B. Uveal Melanoma Treatment and Prognostication. Asia-Pacific Journal of Ophthalmology. 6 (2), 186-196 (2017).
- Damato, B., Coupland, S. E. Management of conjunctival melanoma. Expert Review of Anticancer Therapy. 9 (9), 1227-1239 (2009).
- Norregaard, J. C., Gerner, N., Jensen, O. A., Prause, J. U. Malignant melanoma of the conjunctiva: occurrence and survival following surgery and radiotherapy in a Danish population. Graefe's Archive for Clinical and Experimental Ophthalmology. 234 (9), 569-572 (1996).
- Fiorentzis, M., et al. Electrochemotherapy with bleomycin and cisplatin enhances cytotoxicity in primary and metastatic uveal melanoma cell lines in vitro. Neoplasma. 65 (2), 210-215 (2018).
- Fiorentzis, M., et al. Conjunctival melanoma and electrochemotherapy: preliminary results using 2D and 3D cell culture models in vitro. Acta Ophthalmologica. 97 (4), 632-640 (2019).
- Fiorentzis, M., et al. The Potential Use of Electrochemotherapy in the Treatment of Uveal Melanoma: In vitro Results in 3D Tumor Cultures and In vivo Results in a Chick Embryo Model. Cancers (Basel). 11 (9), (2019).
- Brun, P., et al. Cell-seeded 3D scaffolds as in vitro models for electroporation. Bioelectrochemistry. 125, 15-24 (2019).
- Sersa, G., et al. Electrochemotherapy in treatment of tumours. European Journal of Surgical Oncology. 34 (2), 232-240 (2008).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529(2017).
- Miklavcic, D., et al. Electrochemotherapy: technological advancements for efficient electroporation-based treatment of internal tumors. Medical & Biological Engineering & Computing. 50 (12), 1213-1225 (2012).
- Miklavcic, D., Corovic, S., Pucihar, G., Pavselj, N. Importance of tumour coverage by sufficiently high local electric field for effective electrochemotherapy. EJC Supplements. 4 (11), 45-51 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados