Method Article
البكتريا الزراعية-بوساطة تحويل الجنين غير الناضج من خطوط الذرة المستعبدة المستنعين باستخدام الجينات المورجينية
In This Article
Summary
يمكن استخدام الجينات المورجينية النباتية لتحسين التحول الوراثي للأنماط الجينية المتمردة. وصف هنا هو بروتوكول التحول الوراثي بوساطة Agrobacterium(QuickCorn) لثلاثة خطوط ذرة عامة هامة أصيلة.
Abstract
أظهرت هنا هو بروتوكول مفصل للتحول الوراثي Agrobacteriumبوساطة من خطوط الذرة الأصيلة باستخدام الجينات المورفيجينية طفرة بيبي (Bbm) وWuschel2 (Wus2). وينظم BBM من قبل الذرة الفوسفوليبيد المنتقلة جين(Pltp)المروج، وWus2 تحت سيطرة الذرة auxin-inducible(Axig1)المروج. سلالة Agrobacterium تحمل هذه الجينات المورفولوجية على نقل الحمض النووي (T-DNA) ونسخ إضافية من الفوعة الزراعية (vir)وتستخدم لتصيب الذرة الأجنة غير ناضجة explants. تتشكل الأجنة الجسدية على الكوتيلا من الأجنة المصابة ويمكن اختيارها عن طريق مقاومة مبيدات الأعشاب وتنبت في النباتات. يسمح نظام إعادة التركيب /اللوكسP المنشط بالحرارة المدمج في بناء الحمض النووي بإزالة الجينات المورجينية من جينوم الذرة خلال مرحلة مبكرة من عملية التحول. يمكن تحقيق ترددات تحويل ية تبلغ حوالي 14% و4% و4% (أعداد الأحداث المعدلة وراثياً المستقلة لكل 100 جنين مصاب) لـ W22 وB73 وMo17 على التوالي باستخدام هذا البروتوكول.
Introduction
التحول هو أداة أساسية لتقييم التعبير الجيني الأجنبي في الذرة وإنتاج خطوط الذرة المعدلة وراثيا لأغراض البحث والأغراض التجارية على حد سواء. الوصول إلى التحول الإنتاجية العالية يمكن أن يسهل الحاجة المتزايدة للذرة الجزيئية ودراسات البيولوجيا الخلوية1. والقدرة على تحويل أنواع المحاصيل وراثيا أمر حيوي للمختبرات العامة والخاصة على حد سواء. وهذا يسمح لكل من الفهم الأساسي لآليات تنظيم الجينات وكذلك تحسين المحاصيل على نطاق عالمي لدعم السكان المتزايدين باستمرار.
اكتشاف أن الأجنة غير ناضجة من الذرة يمكن استخدامها لإنتاج الكالوس regenerable نشأت في عام 19752. منذ هذا الوحي ، تطلبت معظم بروتوكولات تحويل الذرة القابلة للتوسع تشكيل واختيار callus قبل التجديد3. أثناء عملية التحول الجيني، يتم استزراع الأجنة غير الناضجة المصابة بالأجنةالزراعية أو اللاليستية الغير ناضجة على الوسائط للتحريض الجنيني على الكاموس. ثم يتم استزراع calli المستحث على وسائل الإعلام الانتقائية (على سبيل المثال ، التي تحتوي على مبيد أعشاب) بحيث تكون قطع الكالوس المتحولة فقط قادرة على البقاء على قيد الحياة. هذه المقاومة للمبيدات الأعشاب كالي المعدلة وراثيا المفترضة هي يستكثر وتجدد في النباتات. في حين أن هذه الطريقة فعالة ، إلا أن العملية طويلة وكثيفة العمالة ، ويمكن أن يستغرق الأمر أكثر من 3 أشهر لإكمال4. والأهم من ذلك، أن بروتوكولات تحويل الذرة التقليدية تمتلك قيدًا أكبر بكثير،أي أنه لا يمكن تحويل سوى عدد محدود من الأنماط الجينية للذرة 5و6.
لوي وآخرون7,8 ذكرت سابقا "QuickCorn" طريقة التحول التي خفضت ليس فقط إلى حد كبير مدة عملية التحول ولكن أيضا توسيع قائمة الأنماط الجينية القابلة للتحويل. طريقة QuickCorn يستخدم تقويم العظام الذرة(Zm-Bbm وZm-Wus2)من عوامل النسخ Arabidopsis BABY BOOM (BBM)9 وWUSCHEL (WUS)10. عندما أدرجت في نظام ناقلات التحول، هذه الجينات تعمل بشكل تآزري لتحفيز النمو الجنيني7.
ويستند بروتوكول QuickCorn الموصوفة في هذا العمل على البروتوكول في جونز وآخرون11، الذي كان تحسينا آخر للطريقة التي ذكرتها لوي وآخرون7،8. في هذه الدراسة ، سلالة Agrobacterium LBA4404 (Thy-) التي تؤوي ناقل ثنائي بناء PHP81430(الشكل 1)والتبعية plasmid PHP7153912 وتستخدم للتحول. يحتوي T-DNA من PHP81430 على المكونات الجزيئية التالية. (1) التحول الانتقائية علامة الجين Hra التعبير كاسيت. الذرة Hra (Zm-Hra)الجين هو تعديل الجين acetolactase (ALS) التي تتحمل مبيدات الأعشاب ALS المثبطة مثل sulfonylureas وimidazolinones13،14. وينظم الجين Zm-Hra من قبل المروج ALS الذرة الرفيعة8 ومثبط البروتينات البطاطس الثاني(دبوسالثاني) المنهي15. يحتوي T-DNA أيضا (2) كاسيت التعبير تمتلك التحول علامة للشاشة الجينات ZsGreen. وينظم هذا الجين البروتين الفلورسنت الأخضر ZsGreen من زوانثوس sp. الشعاب المرجانية16 من قبل مروج في بيهوم أوبيكيتين / intron والأرز ubiquitin المنهي.
بالإضافة إلى ذلك، يحتوي T-DNA على (3) الجين المورجينيجين Bbm كاسيت التعبير. BBM هو عامل النسخ المرتبطة نمو الجنين9،17. وينظم BBM من قبل الذرة فوسفوليبيد تورفيز البروتين(Pltp)المروج8 والأرز T28 المنهي18. Zm-Pltp هو جين مع تعبير قوي في ظهارة scutellar الجنين ، والشعر الحريري ، والخلايا الفرعية ورقة (يحيط خلايا الحرس) ، وانخفاض التعبير في الأعضاء التناسلية ، وليس التعبير في جذور8. كما أنه يحتوي على (4) الجين morphogenic Wus2 كاسيت التعبير. Wus2 هو آخر عامل النسخ المرتبطة بالحفاظ على meristem apical19. Zm-Wus2 تحت سيطرة مروج الذرة auxin-inducible(Zm-Axig1)20 والذرة In2-1 المنهي21. وأخيرا، يحتوي الحمض النووي T(5) على الكري- نظام إعادةالتركيب. الجين recombinase الكريات 22 تحت سيطرة الذرة الحرارة صدمة البروتين 17.7 (Hsp17.7)23 المروج والبطاطا دبوسالثاني المنهي. موقعين loxP (في نفس الاتجاه)24 الجناح أربعة أشرطة التعبير الجيني بما في ذلك ZsGreen، cre، Bbm وWus2.
ولأن وجود الجينات المورجينية غير مرغوب فيه لنضج النبات وذرية لاحقة، تم بناء نظام إعادة تركيب الكري-لوكسب الناجم عن الحرارة في الحمض النووي T لإزالة الجينات المورجينية من جينوم الذرة للسماح بتجديد الكالوس الطبيعي وتطوير النبات. عند المعالجة الحرارية ، يزيل تعبير بروتين CRE جميع الجينات المتحولة باستثناء جين اختيار Hra. يجب أن تكون التحويلات الناجحة مقاومة لمبيدات الأعشاب ولكن ZsGreen-negative. لزيادة تعزيز وتيرة التحول ، وسلالة Agrobacterium تؤوي أيضا بلازميد التبعي إضافية (PHP71539) التي لديها نسخ إضافية من الفوعة Agrobacterium (فير)الجينات12.
تختلف طريقة QuickCorn عن بروتوكولات تحويل الذرة التقليدية ، لأنها لا تنطوي على خطوة التعريفي الكالوس أثناء التحويل. خلال الأسبوع الأول بعد الإصابة بالبكتيريا الزراعية، تتطور الأجنة الجسدية على ظهارة scutellar للأجنة غير الناضجة المصابة. ثم يتم نقل الأجنة إلى وسط مع الهرمونات التي تشجع نضوج الأجنة وتشكيل تبادل لاطلاق النار. نقل سريع للأجنة الجسدية على النضج / اطلاق النار تشكيل المتوسطة يتخطى مرحلة كالوس التقليدية المستخدمة سابقا لتحويل الذرة ويسمح التوليد المباشر للنباتات T08. بالمقارنة مع أساليب تحويل الذرة المنشورة سابقا6، فإن طريقة QuickCorn أسرع وأكثر كفاءة وأقل اعتمادًا على النمط الجيني. باستخدام هذه الطريقة، عادة ما تكون النباتات المتجذرة جاهزة للنقل إلى التربة في غضون 5-7 أسابيع فقط، بدلاً من الأشهر الثلاثة أو أكثر التي تتطلبها البروتوكولات التقليدية. الغرض من هذه المقالة هو تقديم وصف متعمق وبيان توضيحي للطريقة ، مما يسمح للتكرار بشكل أسهل في بيئة المختبر الموجودة عادة في معظم المؤسسات الأكاديمية.
Protocol
1- إعداد وسائل الإعلام للنمو
- للحصول على وصفات متوسطة النمو الدقيق لهذا البروتوكول، يرجى الرجوع إلى الجدول 1.
- لإعداد 1 لتر من وسائل الإعلام، ووضع كوب 2 لتر على لوحة اثارة ووضع شريط اثارة داخل.
- ملء الكأس مع 900 مل من الماء المقطر وبدوره على لوحة اثارة. يجب أن يكون شريط اثارة الغزل بسرعة متوسطة.
- تزن جميع المكونات المجففة وتذوب في كوب.
- قياس جميع المكونات السائلة، إن وجدت، وإضافة إلى الكأس.
- جلب وحدة التخزين النهائية إلى 1 لتر باستخدام الماء المقطر.
- قياس درجة الحموضة والتكيف مع مواصفات وصفة.
- إذا صياغة وسيلة نمو السائل، لا يضاف أجار. إرفاق معقم مرشح إلى مضخة فراغ وصب وسط نمو السائل من خلال مرشح. بدوره على المضخة والانتظار حتى يتم سحب جميع السائل من خلال. ضع غطاءً على الحاوية وأرفق ملصقًا.
- إذا صياغة وسط نمو الصلبة، بعد ضبط درجة الحموضة، إضافة أجار مباشرة في زجاجة أو قارورة.
- صب 1 لتر متوسطة النمو السائل في قارورة إرلنماير 2 L, أو تقسيمه إلى اثنين من زجاجات 1 لتر للأوتوكلاف (500 مل لكل منهما). إذا تم استخدام زجاجتين، قم بتقسيم العقيق وأضفه مباشرة إلى الزجاجات.
- غطاء قارورة مع غطاء تنفس، مثل طبقتين من رقائق الألومنيوم، للسماح للبخار للهروب. إذا كنت تستخدم زجاجة، وغطاء فضفاضة غطاء المسمار على الجزء العلوي.
- الأوتوكلاف عند 121 درجة مئوية لمدة 25 دقيقة.
- بعد الأوتوكلاف، وإزالة متوسط النمو من الأوتوكلاف وبارد إلى 55-60 درجة مئوية (حمام مائي تعيين إلى 55 درجة مئوية يمكن أن تجعل هذا أسهل). الحفاظ على متوسط النمو في حالة سائلة لبضع ساعات حتى يكون من المناسب صب لوحات.
- مرة واحدة تبريد، إضافة جميع إضافات ما بعد التعقيم (انظر الجدول 1)ومزيج جيدا.
- بعد إضافة جميع المكونات، صب حجم المعين في الحاوية التي تختارها في غطاء تدفق لامينار.
- يمكن صب متوسط النمو في أطباق بيتري المطلوبة يدويًا أو باستخدام جهاز صرف سائل. عند صب يدويا، فمن المستحسن لنقل كمية كبيرة من متوسطة الأوتوكلاف إلى كوب معقم أصغر (500 مل) لسهولة التعامل معها.
- السماح للنمو المتوسطة لتبرد وترسيخ.
- المتوسطة النمو سوف تكون متاحة للاستخدام مرة واحدة تصبح صلبة وأفضل استخدام في اليوم التالي بعد تجفيف قليلا بين عشية وضحاها في غطاء التدفق المعقم وأكوام من لوحات مغطاة. بعد التجفيف بين عشية وضحاها، ونقل لوحات في الأكمام البلاستيكية، أضعاف على نهاية فضفاضة، والحفاظ على هذا في مكان مع قليلا من الشريط. وهذا يمنع التجفيف المفرط. يمكن تخزين المتوسطة في بيئة باردة ومظلمة ونظيفة (4-16 درجة مئوية) لمدة تصل إلى شهر واحد.
2. زراعة النباتات المانحة وحصاد آذان غير ناضجة
- زراعة أي ذرة متاحة للجمهور أصيلة (أي B73، Mo17، أو W22) في الدفيئة في 1.5 غالون (5.9 لتر) الأواني التي تحتوي على ركيزة بدون تربة. استخدم 16/8 (يوم/ليلة) فترة تصوير، مع متوسط درجات حرارة 25.5 درجة مئوية خلال النهار و20 درجة مئوية في الليل.
- يتم سقي النباتات حسب الحاجة وتخصيبها بسماد إطلاق متحكم فيه (N-P-K من 15-9-12) ، والذي يمكن دمجه إما في مزيج التربة أو إضافته إلى السطح بعد الزراعة.
- عادة ما يستغرق حوالي 70-90 يوما بعد إنبات البذور للآذان لتظهر. مع ظهور براعم الأذن، قم بتغطيتها بحقيبة إطلاق النار لمنع حدوث التلقيح غير المنضبط.
- حوالي 2-3 أيام بعد ظهور الحرير وإذا كان حبوب اللقاح سوف تكون متاحة في اليوم التالي، وقطع الحرير باستخدام مقص التي تم تعقيمها في الإيثانول 70٪. قطع الحرير وقشر ما يقرب من 2.5 سم تحت نهاية أوراق قشر، حيث تظهر الحرير. يمكن إجراء التلقيح في اليوم التالي. تأكد من إعادة تعقيم المقص بين كل أذن.
- بمجرد خروج الأنثرز من شرابة، قم بتغطية شرابة بكيس شرابة ومشبك ورق غير زلق في قاعدة الحقيبة حول ساق.
- في صباح اليوم التالي، ثني بلطف أكثر من المصنع والاستفادة من الحقيبة لتشجيع حبوب اللقاح ليتم الافراج عنهم.
- إزالة كيس شرابة وأضعاف الجزء العلوي من كيس أكثر لمنع حبوب اللقاح من الهروب. فمن الأفضل عموما لحقيبة شرابة 1 قبل يوم من ذلك سيتم استخدامها (لتجنب تراكم حبوب اللقاح الميتة وإلقاء anthers). يمكن جمع حبوب اللقاح الطازجة من شرابات لمدة 3-5 أيام. عندما يخرج الأنثيل من الأزهار الداخلية في قاعدة شرابة، أن شرابة من المرجح أن لا تنتج حبوب اللقاح قابلة للحياة في اليوم التالي.
- استخدام حبوب اللقاح من نفس النبات (selfing) أو من نبات آخر من نفس الأصيلة (sibbing).
- أزل كيس الأذن أو اقطع نهاية الكيس لتعريض الحرير، ثم قم بسكب حبوب اللقاح بسرعة من كيس شرابة على الحرير.
- غطي الأذن بكيس شرابة على الفور وتدبيس قاعدة الكيس حول ساق لتأمينه. قد يكون من المفيد عزل النبات فعليًا عن النباتات المزهرة من الأنماط الجينية المختلفة أثناء التلقيح للمساعدة في منع التلقيح المتبادل. اترك كيس شرابة على الأذن حتى تصبح الأذن غير الناضجة جاهزة للحصاد.
- 9-12 يوما بعد التلقيح، وآذان الشاشة لحجم الجنين. حرك كيس التلقيح لأعلى ساق لفضح الأذن. سحب بلطف قشر أسفل لفضح حبات على حوالي ثلث إلى ربع محيط الأذن وحوالي ثلث المسافة أسفل الأذن. لن تكون النواة القريبة من الطرف ممثلة لمتوسط حجم الجنين.
- باستخدام مشرط، شريحة قبالة غطاء نواة واحدة التي تبدو مشابهة لغالبية حبات أخرى في الحجم واللون.
- استخدم ملعقة (مع مسطرة) لإزالة الجنين كما هو موضح في الخطوة 4.6. قياس طول الجنين باستخدام مسطرة مدمجة على ملعقة أو فرجار رقمي. إذا كان الجنين بين 1.5-2.0 مم، حصاد الأذن. إذا كان ~ 1.3 ملم، قد تكون الأذن جاهزة للحصاد في وقت لاحق من اليوم، ويمكن فحصها مرة أخرى في حوالي 7-8 ساعة.
3. إعداد ثقافة تعليق البكتريا الزراعية للعدوى
ملاحظة: يتم تخزين سلالة Agrobacterium LBA4404 (Thy-) التي تحتوي على PHP81430(الشكل 1)وPHP7153912 كمخزون من الجلسرين عند -80 درجة مئوية. ويمكن الحصول على هذه المواد من كورتيفا Agriscience من خلال اتفاق نقل المواد. LBA4404 (Thy-) هو سلالة auxotrophic التي تحتاج إلى thymidine الموردة في وسائل الإعلام النمو. الفائدة الأساسية للسلالة الزراعية auxotroph هو لأغراض الاحتواء البيولوجي. وله فائدة إضافية تتمثل في الحد من النمو المفرط للمنتجات الزراعية. لا تنمو سلالة الزراعة الأوستروتروبيك بدون الثيميدين التكميلي. ومع ذلك، يمكن أن يتم توفير الثيميدين (يفترض) عن طريق الأنسجة النباتية المنال في الثقافة. لذلك ، لا تزال هناك حاجة لتوفير مضاد حيوي في الوسط للسيطرة تمامًا على الزراعة الأوستروتروبيك. ومع ذلك، سيكون من الأسهل السيطرة عليها بسبب النمو للخطر من سلالة auxotrophic في غياب الثيميدين.
- قبل أربعة أيام من تاريخ العدوى، بدء لوحة "الأم" من الأسهم الجلسرين عن طريق streaking البكتيريا على لوحة YP مع 50 ملغ / لتر thymidine، 50 ملغ / لتر جنتاميسين، و 50 ملغ / لتر spectinomycin(الجدول 1). احتضان لوحة "الأم" في حاضنة 20 درجة مئوية لمدة 3 أيام.
- قبل يوم واحد من تجربة العدوى ، قم بإعداد لوحة "تعمل" عن طريق اختيار واحدة إلى خمس مستعمرات من لوحة "الأم" وإزالة البكتيريا من لوحة "الأم" إلى لوحة YP جديدة (مع الثيميدين ، جنتاموسين ، وspectinomycin ؛ الجدول 1).
- الشرائط اليومية "العمل" لوحة في الأرباع المتتابعة وتشغيل حلقة 1x من خلال منطقة فقط المتتالية في الربع المتعاقبة ، وتكرار لتشكيل الأرباع التي تم تخفيفها بشكل تسلسلي. احتضان لوحة "العمل" بين عشية وضحاها في حاضنة 27 درجة مئوية.
- بعد الانتهاء من تشريح الجنين (الخطوة 4.8) ، استخدم حلقة أو أداة مماثلة لجمع Agrobacterium من منطقة من لوحة "العمل" حيث يكون النمو البكتيري مرئيًا كخطوط رقيقة من المستعمرات.
ملاحظة: تجنب مناطق من لوحة مع حديقة كثيفة من النمو البكتيري. ومن المرجح أن يكون نمو البكتريا الزراعية قد بدأ بالفعل في الانخفاض في المناطق الكثيفة، بينما في المناطق ذات المستعمرات المرئية، تكون البكتيريا في مرحلة النمو المناسبة للعدوى. - تعليق البكتيريا التي تم جمعها في أنبوب 50 مل تحتوي على 10 مل من 700A المتوسطة السائلة(الجدول 1). دوامة لتعليق ثقافة البكتيريا تماما.
- قياس الكثافة البصرية عند الطول الموجي 550 نانومتر. ضبط مستوى الصوت حتى OD بين 0.35-0.45، مع 0.4 تكون القيمة المثلى.
ملاحظة: إذا كان OD أعلى من 0.45، إضافة أكثر 700A المتوسطة السائلة. إذا كان OD أقل من 0.35، تطعيم المزيد من المستعمرات الزراعية في ثقافة التعليق.
4. تشريح الأجنة والعدوى والزراعة المشتركة
- حدد آذان مناسبة لتجارب التحول؛ وينبغي أن يكون لهذه مجموعة بذور جيدة ولها الأجنة التي تتراوح في الحجم من 1.5-2.0 ملم. وعادة ما يتم حصادها بين 9-12 يوما بعد التلقيح. يمكن استخدام الأذنين المنتقَاة طازجة أو مخزنة لمدة 1-4 أيام عند 4 درجات مئوية، على الرغم من أن جودة الاستجابة من المرجح أن تتحلل تدريجياً مع التخزين المطول بعد اليوم الأول.
- إزالة قشور والحرير. أدخل مقبضًا في قاعدة الأذن أو أعلىها. يمكن أن يكون مقبض زوج من ملقط، مفك البراغي، الخ.
- ضع الأذنين في وعاء كبير (على سبيل المثال، 2 لتر كوب مع مقبض صعودا، وملء الحاوية مع محلول التطهير. محلول التطهير هو 1.8 لتر من 20٪ التبييض التجاري (1.65٪ هيبوكلوريت الصوديوم) واثنين من قطرات من السطحي Tween 20.
- تعقيم الأذنين داخل مقعد تدفق التصفيق. بعد 20 دقيقة، إفراغ محلول التبييض وشطف الأذنين 3x (5 دقيقة لكل منهما) باستخدام كمية سخية من الماء المقطر المعقم. يُرفع الماء ويُترك للآذان لتجف لعدة دقائق.
ملاحظة: من المهم أن تكون الأذنين مغمورة بالكامل في محلول التبييض لمدة 20 دقيقة. حرك الأذنين بعناية في محلول التبييض في بعض الأحيان لطرد فقاعات الهواء. - إعداد 2 مل أنبوب الطرد المركزي الدقيق مليئة 700A المتوسطة السائلة. سيتم استخدام هذا الأنبوب لجمع الأجنة غير الناضجة.
- تأخذ الأذن واستخدام مشرط معقم، وإزالة أعلى 1-2 ملم من التيجان نواة لفضح endosperm. استخدم ملعقة صغيرة لإزالة الجنين الزغوتي غير الناضج (IZE). وسوف يكون موجودا في IZE داخل النواة، على الجانب الذي يواجه غيض من الأذن، وبالقرب من المرفق إلى الكوز. باستخدام ملعقة، إدراجها في endosperm في pericarp أبعد بعيدا عن الجنين، ثم تطور بلطف صعودا لطرد endosperm والسماح لإزالة الجنين(الشكل 2).
- باستخدام ملعقة، نقل الجنين إلى أنبوب يحتوي على المتوسط السائل 700A. استمر في القيام بذلك حتى يتم جمع ما يصل إلى 100 جنين. يمكن ملء أنابيب متعددة (~ 100 جنين / أنبوب) قبل الانتقال إلى الخطوة التالية. عند هذه النقطة، يجب إعداد تعليق Agrobacterium (انظر الخطوة 3.5).
- قم بإزالة الوسط السائل 700A من أنبوب الجنين بـ 1 مل ماصة. إضافة جديدة 700A المتوسطة لغسل الأجنة، ثم إزالة تلك الوسائط كذلك.
- أضف 1 مل من تعليق Agrobacterium والدوامة على إعداد منخفض (3/10) لمدة 30 s أو أنبوب مقلوب 12x-15x لخلط. السماح لهذا الأنبوب للراحة أفقيا على مقاعد البدلاء لمدة 5 دقيقة.
- بعد 5 دقيقة، نقل أنبوب كامل من الأجنة وتعليق Agrobacterium على لوحة من 562V زراعة وسيطة(الجدول 1). ويمكن تحقيق ذلك عن طريق وضع لوحة على مقاعد البدلاء وصب محتويات أنبوب بسرعة على لوحة. دوامة بلطف لوحة لتوزيع الأجنة وإزالة تعليق Agrobacterium باستخدام ماصة 1 مل.
- تأكد من أن يتم وضع الأجنة مع الجانب scutellum (جولة) التي تواجه صعودا. استخدم عدسة مكبرة أو نطاق تشريح، إذا لزم الأمر. وضع لوحات في صناديق بلاستيكية (19 سم × 28 سم × 5.1 سم) واحتضان لوحات بين عشية وضحاها 16-18 ساعة في 21 درجة مئوية في الظلام. لا يوجد التفاف لوحة الفردية باستخدام فيلم البارافين أو شريط تنفيس ضروري.
- بعد زراعة بين عشية وضحاها المشتركة، ونقل الأجنة المصابة، الجانب scutellum صعودا، على يستريح المتوسطة 605T(الجدول 1). ضع حوالي 30 جنينًا لكل طبق. احتضان لوحات في 26-28 درجة مئوية في الظلام.
- احتضان لمدة 4-10 أيام (يفضل 7 أيام). في هذا الوقت ، يمكن ملاحظة تطور الأجنة الجسدية على سطح السبينية الزيجوتيكية(الشكل 3).
5. الاختيار، والمعالجة الحرارية، والتجدد
- بعد فترة الراحة، تصدم الحرارة الأجنة. ضع الصندوق الذي يحتوي على لوحات الأجنة في حاضنة 45 درجة مئوية مع رطوبة نسبية 70٪ لمدة ساعتين. ثم، وإزالة مربع من حاضنة 45 درجة مئوية ومكان في حاضنة الظلام 26-28 درجة مئوية لمدة 1-2 ساعة.
ملاحظة: إذا لم تتمكن من تحقيق رطوبة 70٪ في حاضنة، إضافة طبقة مزدوجة من المناشف الورقية المعفّق إلى الجزء السفلي من مربع لوحة ونقع مع الماء المعفّق للحفاظ على الرطوبة داخل المربع. أعد الأطباق إلى الصندوق الموجود فوق المناشف الورقية وختم الغطاء قبل وضعه عند درجة حرارة 45 درجة مئوية. استخدام مقياس الرطوبة الرقمية الصغيرة / ميزان الحرارة لمراقبة درجة الحرارة والرطوبة. - نقل IZEs المعالجة بالحرارة من متوسط الراحة إلى متوسط تكوين تبادل لاطلاق النار (13329A) التي تحتوي على 0.05 ملغ / L imazapyr كعامل انتقائي(الجدول 1). عند نقل, إزالة coleoptiles, إذا كان موجودا, باستخدام ملقط تلميح غرامة أو مقص الجراحية.
- ضع 10-15 جنينًا لكل طبق لتجنب الاكتظاظ. إبقاء الأجنة في هذا المتوسط لمدة أسبوعين في حاضنة الظلام 26 درجة مئوية.
- نقل الأجنة إلى وسط التأصيل (13158; الجدول 1) لمدة 1-2 أسابيع. ضع حوالي ثماني قطع لكل طبق واحتضنها في غرفة خفيفة أو غرفة خفيفة (16 يومًا / 8 ليلة ، 20-150 ميكرومول / م2/ سنة) عند 27 درجة مئوية.
- كما الزارع تطوير، ووضع الزارع أقوى التي تحتوي على كل من يطلق النار وجذور قوية على لوحات جديدة من تأصيل المتوسطة، مكان واحد النبات لكل لوحة. وهذا سيسمح لنمو الزارع أقوى. ضع الأطباق في غرفة الإضاءة أو غرفة الضوء لمدة 7-14 يومًا أخرى.
ملاحظة: قم بإزالة أي قطع callus المرتبطة بالبلانتليت بعناية للتأكد من أنها على اتصال جيد مع الوسط. - كما يصبح النبات أكثر قوة، وإزالة النبات من تأصيل المتوسطة وشطف الجذور مع مياه الصنبور لإزالة أجار.
- زرع النباتات الفردية في 3 في2 (~ 19 سم2)الأواني التي تحتوي على ركيزة التربة قبل الرطب. ضع الأواني في صينية (27 سم × 54 سم) مع ثقوب التصريف وغطي الشقة بقبة رطوبة بلاستيكية. ويمكن تحقيق خطوة التأقلم هذه إما في غرفة النمو أو في الدفيئة مع شروط النمو الموصوفة في القسم 2 (الخطوة 2.1) أعلاه.
6. زرع الدفيئة وإنتاج بذور T1
- تحقق من النباتات 2x في اليوم الواحد. الماء حسب الحاجة. تأكد من أن النباتات لا تجف ولا تُسقي. الحفاظ على ركيزة جافة قليلا يشجع نمو الجذر.
ملاحظة: يمكن إزالة قبة الرطوبة بعد 4-7 أيام من الزرع. وينبغي أن تزرع النباتات في هذه الأواني الصغيرة حتى أنها قد تعافى بشكل واضح من الإجهاد من زرع التربة. وينبغي أن يستغرق هذا حوالي 9-14 يوما. - زرع كامل المكونات بدون تربة ونبات في وعاء 1.5 جالون (5.9 لتر). الحفاظ على في الدفيئة والماء عندما يشعر التربة الجافة لمسة.
- إضافة الأسمدة الإفراج التي تسيطر عليها مع N-P-K من 15-9-12 إلى وعاء، والتي يمكن دمجها إما في مزيج الركيزة أو تطبيقها على السطح.
- عندما يبدأ إطلاق النار على الأذن في الظهور من النبات ، استخدم كيس تبادل لاطلاق النار لتغطية براعم الأذن. تأكد من استخدام حقيبة شبه شفافة بحيث يمكن ملاحظة الحرير الناشئدون إزالة الحقيبة. حقيبة تبادل لاطلاق النار يسمح للتلقيح للرقابة أن يحدث. من المهم دائما حقيبة شرابات المعدلة وراثيا.
- بعد ظهور الحرير (1-2 أيام)، تقليم الحرير ظهرت إلى طول موحد. سيكون هذا حوالي 2.5 سم تحت الجزء العلوي من أوراق قشر. استخدام زوج من مقص نظيفة التي تم تعقيمها في الإيثانول 70٪. من خلال تقليم الحرير ، تتطور خصلة موحدة في اليوم التالي لحدوث التلقيح.
- بالنسبة لغالبية الأنماط الجينية للذرة ، فإن الوقت الأمثل للتلقيح هو 2-3 أيام بعد ظهور شرابة أو الحرير.
- جمع حبوب اللقاح إما من نفس النبات (إذا كان التلقيح الذاتي) أو من نوع البرية من نفس الأصيلة (إذا تجاوز أو incrossing).
- جمع حبوب اللقاح في كيس شرابة وتطبيقه على خصلة الحرير من النبات T0. إذا كان حبوب اللقاح من نبات من النوع البري (غير المعدل وراثيا) ، ضع حبوب اللقاح في كيس شرابة بني عادي. إذا كان حبوب اللقاح من نبات معدل وراثيا، ضع حبوب اللقاح في كيس مخطط أخضر للإشارة إلى أن حبوب اللقاح معدلة وراثيا.
- اتبع الخطوات 2.5-2.10 للحصول على تفاصيل التلقيح.
- حوالي 2 أسابيع بعد التلقيح، وإزالة أكياس شرابة من الأذنين، والسماح لتجف إلى أسفل للبدء. للمساعدة في تجفيف، والتوقف عن سقي النبات 21-25 يوما بعد التلقيح. يمكنك أيضا سحب الأوراق قشر لفضح البذور. هذه الممارسة تساعد أيضا على منع العفن.
- حوالي 45 يوما بعد التلقيح، وحصاد البذور وتخزينها في التخزين البارد في 4-12 درجة مئوية.
النتائج
يظهر هنا بروتوكول خطوة بخطوة للتحول الوراثي بوساطة زراعيةلثلاثة خطوط ذرة عامة أصيلة (B73 و Mo17 و W22) التي كانت مهمة في مجال علم الوراثة الذرة. لم يكن من الممكن تحقيق التحول في الخطوط الثلاثة الأصيلة باستخدام بروتوكولات تحويل الذرة التقليدية5. ويبين الشكل 1 والشكل 2 مواد البناء والبداية، على التوالي، المستخدمة هنا. يتم حصاد الأذنين بشكل عام بعد 9-12 يومًا من التلقيح. IZEs مع أطوال تتراوح بين 1.5-2.0 ملم هي أفضل explants للتحول لهذا البروتوكول(الشكل 2).
بعد ثمانية أيام من العدوى ، تم تصور ZsGreen- التعبير عن الأجنة الجسدية تحت قناة GFP من المجهر الفلوري(الشكل 3). وخضعت هذه الهيئة للمعالجة الحرارية بعد 8 أيام من الإصابة (الخطوتان 5-1 و5-2). أدى هذا العلاج التعبير عن ReRE recombinase التي استأصلت Bbm، Wus2، cre، وأشرطة التعبير ZsGreen محاطة بين موقعي loxP (الشكل 1). ثم تم استزراع الأنسجة المعالجة بالحرارة على متوسط تكوين التصوير الذي يحتوي على imazapyr مبيد الأعشاب لاختيار الأنسجة المتحولة بعد إزالة الجينات المورجينية.
لوحظ تتكاثر الأنسجة مع الأجنة الناضجة أو براعم تبادل لاطلاق النار التي كانت مقاومة لimazapyr حوالي 3-4 أسابيع بعد العدوى(الشكل 4). كانت بعض الأنسجة المقاومة للإيمازابير سلبية بالنسبة لـ ZsGreen ، مما يشير إلى أن الختان بوساطة الكريةقد حدث على الأرجح في هذه الأنسجة(الشكل 4). بعد أن تم نقل الأنسجة إلى تأصيل حضانة متوسطة وخفيفة ، بدأت البراعم في التطور(الشكل 5). تم حصاد براعم النمو صحية وقوية مع جذور متطورة(الشكل 5). يبدو أن بعض الأنسجة لديها براعم متعددة(الشكل 5E ، F ، G). قد يكون هذا النوع من "عشبي" regenerant بسبب النباتات الكلونية لها أنماط تكامل متحولة متطابقة. التحليل البيولوجي الجزيئي مطلوب للنمط الجيني لهذه النباتات.
واستجابت جميع الخطوط العامة الأصيلة الثلاثة بشكل جيد باستخدام هذا البروتوكول وكذلك البناء المستخدم في هذا العمل. أنتجت W22 أعلى تردد من البراعم المقاومة للإيمازابير ، مع تردد حوالي 14٪ (حوالي 14 يطلق النار المعدلة وراثيا لكل 100 الأجنة غير ناضجة المصابة). أنتجت كل من B73 و Mo17 حوالي 4٪ براعم معدلة وراثيا. وتشير هذه الترددات إلى جميع البراعم المحورة وراثياً، بما في ذلك كلا النباتين اللذين يحملان الجينات المورجينية والنباتات ذات الجين المورجيني الذي أزيل عن طريق الختان بوساطة CRE.

الشكل 1: التمثيل التخطيطي لمنطقة T-DNA من البلازميد الثنائية PHP81430. RB = الحدود اليمنى T-DNA; loxP = CRE إعادة الدمج الهدف الموقع؛ Axig1الموالية:Wus2 = الذرة auxin- المروج inducible(Zm-Axig1)+ Zm-Wus2 + الذرة In2-1 المنهي؛ Pltppro:Zm-Bbm = بروتين فوسفوليبيد الذرة(Zm-Pltp)المروج + Zm-Bbm + الأرز T28 المنهي(Os-T28)؛ Hsppro:cre = بروتين صدمة حرارة الذرة 17.7 المروج(Zm-Hsp17.7)+ الكريات المؤن recombinase + مثبط البروتينات البطاطس الثاني(pinII)المنهي؛ يوبيبرو:ZsGreen = مروج أوبيكيتين الذرة الرفيعة / intron(Sb-Ubi)+ البروتين الفلوري الأخضر ZsGreen الجينات + الأرز ubiquitin المنهي(Os-Ubi)؛ Hra كاسيت = الذرة الرفيعة acetolactase synthase(Sb-Als)المروج + الذرة Hra(Zm-Hra)الجينات + pinII المنهي؛ LB = يسار الحدود T-DNA; colE1، تكرار أصل بلازميد ColE125؛ المواصفاتR = spectinomycin الجينات المقاومة aadA1 من Tn21 لاختيار البكتيريا26؛ Rep A, B, C = تكرار الأصل من pRiA4 من rhizogenes Agrobacterium27. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
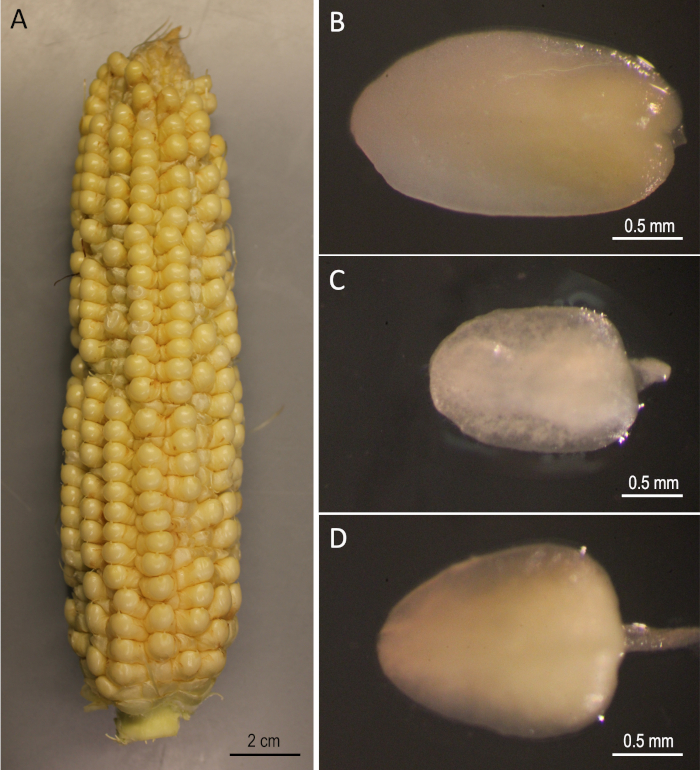
الشكل 2: مواد البدء. B73 آذان حصاد 12 يوما بعد التلقيح(A). الأجنة غير الناضجة من B73(B)، Mo17(C)، وW22(D). يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
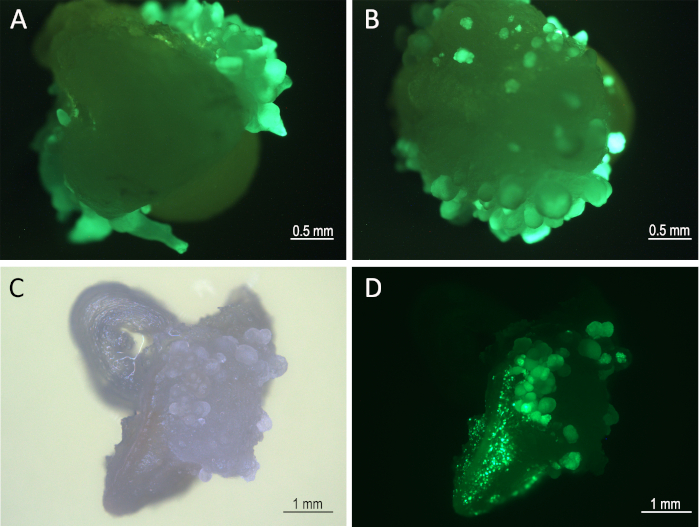
الشكل 3: تطور الأنسجة على راحة متوسطة 1 أسبوع بعد الإصابة. الأجنة (8 أيام بعد العدوى) تحت مجهر الفلورية (مرشح GFP) تظهر GFP تعبر عن الأجنة الجسدية من Mo17(A)و W22(B). تطوير الأنسجة (B73) تحت الحقل الساطع(C)ومرشح GFP(D). يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: تطوير الأنسجة على متوسط النضج مع الاختيار. لوحة نضوج W22(A). تطوير الأنسجة (Mo17، 15 يوما بعد العدوى) تحت حقل مشرق(B)ومرشح GFP(C). تطوير الأنسجة (Mo17، 28 يوما بعد العدوى) تحت حقل مشرق(D)ومرشح GFP(E). تشير السهام إلى تجديد الأنسجة التي تفتقر إلى التعبير GFP ، مما يشير إلى استئصال جين ZsGreen بين مواقع loxP بعد نشاط بروتين CRE الناجم عن الحرارة. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: تطوير الأنسجة على تأصيل وسائل الإعلام. يطلق النار على W22 (أ) ، B73(B)، وMo17(C ، D). حدث مع يطلق النار على عدة (regenerants العشبية) من B73(E)وW22(F، G). يطلق النار مع جذور B73(H)وW22(أنا). يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: المؤلفات الإعلامية لتحويل الذرة. يرجى الضغط هنا لعرض هذا الجدول (انقر على اليمين للتحميل).
Discussion
البروتوكولات التقليدية لتحويل الذرة تتبع نموذج عزل الأجنة الزيجوتية غير الناضجة لإنتاج أنسجة الكالوس المعدلة وراثيا، والتي يتم تجديدها في النباتات الخصبة4،6. في حين أن هذا فعال ، يمكن أن تكون البروتوكولات القائمة على الكالوس مضيعة للوقت ، وغالبًا ما يستغرق الأمر ما يصل إلى 3 أشهر حتى تنتج عملية زراعة الأنسجة النباتات. ما يجعل الأسلوب المعروض هنا مهمًا هو أنه خالٍ من الكالوس وفعال وسريع ويسمح بتجديد نباتات T0 في نصف الإطار الزمني تقريبًا. كما يبدو أن أقل اعتمادا على النمط الجيني، وبالتالي يمكن أن تكون فعالة لمعظم inbreds المتاحة للجمهور8،11.
وفي حين ينبغي اتباع جميع الخطوات بفعالية، فإن الإعداد الصحيح لوسائط الإعلام للنمو أمر حتمي. يجب إضافة مكونات وسائط النمو في المراحل الصحيحة، سواء قبل الأوتوكلاف أو ما بعد هُنا، لضمان أن تُستلم المواد النباتية التركيز المناسب للمواد الكيميائية. وهذا يضمن أن المركبات الحساسة مثل المضادات الحيوية لا تنهار. ومن المهم أيضا أن توضع المواد النباتية على وسط النمو الصحيح في كل مرحلة، كما هو مبين في البروتوكول. عدم وضع المواد على متوسط النمو السليم يمكن أن يؤدي إلى الموت المادي. بالإضافة إلى ذلك ، يجب تجنب وضع عدد كبير جدًا من الأجنة أو الأنسجة النامية على لوحات. في حين أن وضع ضعف عدد قطع الأنسجة قد يوفر تكلفة المواد الكيميائية وأطباق بيتري (وحتى مساحة الحاضنة) ، يمكن أن يمنع نمو الأنسجة في الأطباق المكتظة بشكل خطير. أثناء إجراء العدوى ، يجب التأكد من أن الكثافة البصرية لتعليق Agrobacterium مناسبة. إذا كانت كثافة التعليق البكتيري منخفضة للغاية، فقد لا تحدث عدوى مناسبة.
إن جودة مواد البدء ضرورية للنجاح في بروتوكولات التحويل. يجب أن تكون الأذنالمستخدمة في تشريح الأجنة صحية، مما يعني أن النبات الذي ينتجها صحي. كما يجب أن تمتلك مجموعة بذور كافية وأن تكون خالية من الآفات والأمراض. أيضا، لا ينبغي أن تستخدم Agrobacterium القديمة. يجب ألا يزيد عمر لوحة "الأم" عن أسبوعين. بعد هذه النقطة ، يجب أن تكون لوحة "الأم" الجديدة مخطوطة لبدء تجارب جديدة.
في حين تم إظهار هذا الأسلوب أن تكون أقل اعتماداً على النمط الجيني، فإنه لا يمكن افتراض أن كافة الأسطر ستكون ناجحة بنفس القدر. لا يزال هناك اختلاف بين الخطوط وكذلك الاختلافات في النجاح على أساس البناء المستخدم. كما أن التغير بين الأذنو الأذن والأذن أمر لا مفر منه عند العمل مع أجنة غير ناضجة، لذا من الناحية المثالية يجب أن تستخدم التجارب آذانًا متعددة لحساب ذلك. في هذا العمل ، كان أداء W22 الأصيل هو الأفضل ، مع تردد تحويل يُبعد هـو 14 ٪، يليه B73 و Mo17 (4٪ لكل منهما). وذكر لوي وآخرون8 باستخدام بروتوكول QuickCorn لتحويل B73 و Mo17. في هذا العمل، تراوحت ترددات التحويل بين 9% -50% لـ B73 و15%-35% لـ Mo17.
ويمكن أن تعزى إحدى الاحتمالات لترددات التحويل المنخفضة لـ B73 و Mo17 الملحوظة في هذا العمل إلى التقلبات الموسمية في نوعية الأذن. الفرق الآخر بين هذا العمل وعمل لوي وآخرون8 هو أن بنيات ناقلات مختلفة استخدمت هنا. في عمل لوي، لم تتم إزالة الجينات المورجينية من النباتات المتحولة، بل تم إسكاتها تنموياً في المراحل اللاحقة. في هذا العمل ، تمت إزالة الجينات المورفولوجية بعد 8 أيام من العدوى. من الممكن أن B73 و Mo17 قد تحتاج إلى وجود أطول من Bbm / Wus2 لتطوير الأجنة الجسدية.
باستخدام هذه الطريقة ، هناك إمكانية للحصول على نباتات الهروب غير المعدلة وراثيا ، والغرز متعددة الأبعاد ، والجينات المتحولة غير المهورة. لن يكون لهذه النباتات نمط ظاهري مختلف بشكل ملحوظ ، لذلك يلزم الكشف عن طريق PCR لتحديد ما إذا كان النبات معدل وراثيا. ولتحقيق ذلك، يمكن استخدام أجهزة تحديد أولي ة لـ PCR داخل المنطقة المنتاستئصال والتمهيديات المحيطة بالمنطقة المنتاستئصالة. كما يمكن أن تنتج التحولات المستقلة المتعددة نباتات من نفس الجنين غير الناضج، مما يجعل تحديد معدل الاسترداد المتحول المستقل الكلي أمرًا صعبًا. كان معيارنا هو حساب معدل التحول على أساس أخذ عينات من نبات واحد من كل جنين غير ناضج أنتج النباتات وقسمة هذا على عدد الأجنة المصابة. من شبه المؤكد أن هذه الطريقة تقلل من العدد الفعلي للأحداث المستقلة التي تم استردادها كزارع. ويتطلب التمييز بين الأحداث المستقلة من نفس الجنين تسلسل المناطق الحدودية حول الجينات المتحولة، وسيكون ذلك مكلفا ً للغاية ويستغرق وقتاً طويلاً بالنسبة لمعظم التطبيقات؛ على الرغم من ذلك، قد تكون هناك حالات تكون فيها هذه البيانات مفيدة.
وقد ثبت أن هذه الطريقة من التحول زراعة الأنسجة لتكون فعالة جدا، ولكن لا يزال يمكن أن تحدث مشاكل. وإذا كانت المواد النباتية لا تستجيب، فمن الممكن أن تكون هناك مشكلة في الخط الأصيل الخاص، مما يشير إلى أن متغيرات مثل تكوين وسائط النمو وتوقيت الاستزراع الفرعي تتطلب تعديلات. متغير آخر هو تصميم متجه السليم والبناء الدقيق للمتجه ، إذا تم تغيير المتجه الأصلي. يمكن أن يكون هناك أيضا مشاكل مع حساسية imazapyr، وبعض الخطوط هي أكثر حساسية من غيرها، وتركيز imazapyr قد تحتاج إلى تعديل لتحقيق النباتات التي تم تحويلها بنجاح.
وعلى مدى السنوات الثلاثين الماضية، تغيرت وأحرزت بروتوكولات زراعة أنسجة الذرة وتحويلها تقدما؛ ويعتقد أن هذا البروتوكول تقصير سوف تعزز هذا التقدم. هذه الطريقة فعالة للإعدادات الأكاديمية لأنها أقل استهلاكًا للوقت من الطرق التقليدية. وبالإضافة إلى ذلك، فإنه لا يتطلب مشغلين مدربين تدريبا عاليا، مما يجعله أكثر قابلية للتوزيع على نطاق واسع بالمقارنة مع الأساليب التقليدية. في المستقبل ، يمكن الجمع بين هذه الطريقة مع التكنولوجيات الجديدة مثل هندسة الجينوم.
Disclosures
أليسيا ماسترز، وليام غوردون كام، وتود جونز هم من موظفي Corteva Agriscience التي زودت البروتوكول وآذان الذرة من B73، Mo17، وW22 المستخدمة في هذه المقالة. المؤلفين Minjeong كانغ، مورغان ماكاو، جاكوب زوبريست، وكان وانغ ليس لديهم ما يكشف.
Acknowledgements
نشكر فريق كورتيفا للدفيئة على توفير آذان غير ناضجة للذرة ، ومختبر إعداد ية وسائل الإعلام Corteva لتقديم المساعدة في صنع وسائل الإعلام ، ونينغ وانغ من كورتيفا للمساعدة في بناء Agrobacterium ، وكيونسوب لي من جامعة ولاية أيوا للمساعدة. تم دعم هذا المشروع جزئيًا من قبل برنامج أبحاث الجينوم النباتي للمؤسسة العلمية الوطنية ، ومنحة 1725122 و 1917138 إلى K.W.، ومن قبل برنامج التدريب البحثي للبحوث النباتية التنبؤية (منحة مؤسسة العلوم الوطنية DGE-1545453) إلى J.Z.، من قبل مشروع USDA NIFA Hatch #IOW04341، من قبل صناديق ولاية أيوا، ومركز الهندسة الحيوية للمحاصيل التابع لجامعة ولاية أيوا.
Materials
| Name | Company | Catalog Number | Comments |
| 2,4-D | Millipore Sigma | D7299 | |
| 6-Benzylaminopurine (BAP) | Millipore Sigma | B3408 | |
| Acetosyringone | Millipore Sigma | D134406 | |
| Agar | Millipore Sigma | A7921 | |
| Aluminum foil | To cover the flask | ||
| Ammonium Sulfate | Millipore Sigma | A4418 | |
| Analytical balance | To weigh small quantities of chemicals | ||
| Autocalve | Primus (Omaha, NE) | PSS5-K | To autoclave media and tools |
| Bacterial culture loop (10 µl) | Fisher scientific | 22-363-597 | Collects Agrobacterium from plate to transfer to liquid |
| Bactoagar | BD bioscience | 214030 | |
| Beakers (1 L, 2 L, 4 L) | To mix the chemicals for media | ||
| Benomyl | Millipore Sigma | #45339 | |
| Bleach (8.25% Sodium Hypochlorite) | Clorox | For seed sterilization | |
| Boric Acid | Millipore Sigma | B6768 | |
| Calcium Chloride Dihydrate | Millipore Sigma | C7902 | |
| Carbenicillin | Millipore Sigma | C3416 | |
| Casein Hydrolysate | Phytotech | C184 | |
| Cefotaxime | Phytotech | C380 | |
| Conical tube (50 mL) | Fisher scientific | 06-443-19 | Contain liquid medium and Agro suspension |
| Cuvette (Semi-micro) | Fisher scientific | 14955127 | To hold liquid for measuring OD |
| Dicamba | Phytotech | D159 | |
| Digital hygrometer | Checking temperature and humidity for heat treatment | ||
| EDTA, Disodium Salt, Dihydrate | Millipore Sigma | 324503 | |
| Eppendorf tube (2.0 mL) | ThermoFischer Scientific | AM12475 | |
| Eriksson's Vitamins | Phytotech | E330 | 1000x in liquid |
| Ethanol (70%) | Sterilizing tools and surfaces | ||
| Ferrous Sulfate Heptahydrate | Millipore Sigma | F8263 | |
| Fertilizer, Osmocote Plus 15-9-12 | ICL Specialty Fertilizers (Dublin, OH) | A903206 | Fertilizer |
| Flask (2 L) | Pyrex | 10-090E | To autoclave media and tools |
| Flats (Standard 1020, open w/holes, 11"W x 21.37"L x 2.44"D) | Hummert International (Earth City, Mo) | 11300000 | Tray to hold soil and pot insert, fits Humidome |
| Forceps (fine-tipped and large) | Fine for handling embryos; larger for large plant materials and use as ear holders | ||
| Gentamicin | Gold Biotechnologies | G-400 | |
| Glass bottle (1 L) | Pyrex | 06-414-1D | To autoclave medium |
| Graduated cylinder | To adjust volume of media | ||
| Imazapyr | Millipore Sigma | 37877 | |
| Incubator, 20 °C | Percival Scientific | Model I-36NL | To grow mother plate and incubate embryos during Agro infection |
| Incubator, 27 °C | Percival Scientific | Model I-36NL | To grow co-cultivation plate and maize embryo culture |
| Incubator, 45 °C | Heat shock treatment | ||
| Insert TO Standard, pots | Hummert International (Earth City, Mo) | 11030000 | For transplanting plants from rooting to soil, fits flat and Humidome |
| Laminar flow hood | Maintains sterile conditions | ||
| L-proline | Phytotech | P698 | |
| Magnesium Sulfate Heptahydrate | Millipore Sigma | M1880 | |
| Maize inbred seed B73 | U.S National Plant Germplasm | id=47638 | |
| Maize inbred seed Mo17 | U.S National Plant Germplasm | id=15785 | |
| Maize inbred seed W22 | U.S National Plant Germplasm | id=61755 | |
| Manganese Sulfate Monohydrate | Millipore Sigma | M7899 | |
| Milli-Q Water purification systems | Millipore sigma | MILLIQ | For tissue culture grade water |
| MS Basal Medium | Millipore Sigma | M5519 | |
| MS Basal Salt Mixture | Millipore Sigma | M5524 | |
| N6 Basal Salt Mixture | Millipore Sigma | C1416 | |
| Paperclips, non-skid | Holding on tassel bags | ||
| Peptone | BD bioscience | 211677 | |
| Petri dish (100x15 mm) | Fisher scientific | FB0875713 | For bacteria culture medium |
| Petri dish (100x25 mm) | Fisher scientific | FB0875711 | For the plant tissue culture medium |
| pH meter | Fisher scientific | AB150 | To adjust pH of media |
| Pipette (1 mL) | ThermoFischer Scientific | 4641100N | |
| Plastic Boxes | The Container Store | 10048430 | For tissue culture storage and incubation |
| Plastic humidy dome (Humi-Dome) | Hummert International (Earth City, Mo) | 14385100 | Plastic cover for soil flat |
| Potassium Iodide | Millipore Sigma | 793582 | |
| Potassium Nitrate | Millipore Sigma | P8291 | |
| Potassium Phosphate Monobasic | Millipore Sigma | P5655 | |
| Scale | To weigh chemicals for media | ||
| Scalpel Blade (No. 11, 4 cm) | Thermo Scientific | 3120030 | remove the top of the kernel crowns for embryo dissection |
| Scalpel handle | Holding scalpel blades | ||
| Schenk & Hildebrandt Vitamin (S&H vitamin) | Phytotech | S826 | 100x powder |
| Scissors | Cutting ear shoots | ||
| Shoot bag (Canvasback- semi-transparent) | Seedburo (Des Plaines, IL) | S26 | Semi-transparent bag to cover ear shoots |
| Silver Nitrate | Millipore Sigma | S7276 | |
| Sodium Molybdate Dihydrate | Millipore Sigma | M1651 | |
| Soiless substrate LC1 | SunGro Horticulture (Agawam, Ma) | #521 | For growing maize plants |
| Spatula (Double Ended Micro-Tapered) | Fischer Scientific | 2140110 | Dissecting embryos from kernels |
| Spatula (with spoon) | Fisher scientific | 14-375-10 | To measure chemicals for media |
| Spectinomycin | Millipore Sigma | S4014 | |
| Spectrophotometer (Genesys 10S UV-Vis) | Thermo Scientific | 840-300000 | Measure OD of Agro suspension |
| Stirring bar | Fisher scientific | 14-513-67 | To mix media |
| Stirring hotplates | To mix media | ||
| Syringe (without needle, 60 mL) | Fisher scientific | 14-823-43 | For filter sterilization |
| Syringe filter (0.22 µm) | Fisher scientific | 09-720-004 | For filter sterilization |
| Tassel bag (Canvasback- brown) | Seedburo (Des Plaines, IL) | T514 | Bag to cover tassels of non-transgenic plants |
| Tassel bag (Canvasback-green stripe) | Seedburo (Des Plaines, IL) | T514G | Bag to cover tassels of transgenic plants |
| Thiamine HCl | Phytotech | T390 | |
| Thidiazuron | Phytotech | T888 | |
| Thymidine | Millipore Sigma | T1895 | |
| Timentin | Phytotech | T869 | |
| Tween 20 | Fisher Scientific | Cas #9005-64-5 | surfactant |
| Vortex Genie 2 | Scientific Industries | SI0236 | Homogenizes liquids (Agro suspension) |
| Water bath (large - Precision model 186) | Fisher scientific | any that can fit 4+ 2L flasks and reach 55 °C | Keeps autoclaved media at optimal temperature |
| Weigh dish | Fisher scientific | 08-732-112 | To measure chemicals for media |
| Weighing paper | Fisher scientific | 09-898-12A | To measure chemicals for media |
| Yeast Extract | Fisher Scientific | BP14222 | |
| Zeatin | Millipore Sigma | Z0164 |
References
- Zhao, Z. Y., et al. High throughput genetic transformation mediated by Agrobacterium tumefaciens in maize. Molecular Breeding. 8 (4), 323-333 (2002).
- Green, C. E., Phillips, R. L. Plant regeneration from tissue cultures of maize. Crop Science. 15 (3), 417-421 (1975).
- Ji, Q., Xu, X., Wang, K. Genetic transformation of major cereal crops. International Journal of Developmental Biology. 57, 495-508 (2013).
- Frame, B., Warnberg, K., Main, M., Wang, K., Wang, K. Maize (Zea mays, L). Agrobacterium Protocols. , 101-117 (2015).
- Frame, B., et al. Improved Agrobacterium-mediated transformation of three maize inbred lines using MS salts. Plant Cell Reports. 25 (1), 1024-1034 (2006).
- Que, Q., et al. Maize transformation technology development for commercial event generation. Frontiers in Plant Science. 5 (379), (2014).
- Lowe, K. S., et al. Morphogenic regulators Baby boom and Wuschel improve monocot transformation. The Plant Cell. 28 (9), 1998-2015 (2016).
- Lowe, K. S., et al. Rapid genotypes independent maize transformation via direct somatic embryogenesis. In Vitro Cellular & Developmental Biology - Plant. 54 (3), 240-252 (2018).
- Boutilier, K., et al. Ectopic expression of BABY BOOM triggers a conversion from vegetative to embryonic growth. The Plant Cell. 14 (8), 1737-1749 (2002).
- Zuo, J., Niu, Q. W., Frugis, G., Chua, N. H. The WUSCHEL gene promotes vegetative-to-embryonic transition in Arabidopsis. The Plant Journal. 30 (3), 349-359 (2002).
- Jones, T. J., Kumar, S., Barone, P., Smith, M., et al. Maize transformation using the morphogenic genes Baby Boom and Wuschel2. Transgenic Plants. , 81-93 (2019).
- Anand, A., et al. An improved ternary vector system for Agrobacterium-mediated rapid maize transformation. Plant Molecular Biology. 97 (1-2), 187-200 (2018).
- Ray, K., et al. Mutant acetolactate synthase gene is an efficient in vitro selectable marker for the genetic transformation of Brassica juncea (Oilseed Mustard). Journal of Plant Physiology. 161 (9), 1079-1083 (2004).
- Green, J. M., Hale, T., Pagano, M. A., Andreassi, J. L., Gutteridge, S. A. Response of 98140 corn with gat4621 and hra transgenes to glyphosate and ALS-inhibiting herbicides. Weed Science. 57 (2), 142-148 (2009).
- An, G., et al. Functional analysis of the 3' control region of the potato wound-inducible proteinase inhibitor II gene. The Plant Cell. 1 (1), 115-122 (1989).
- Matz, M. V., et al. Fluorescent proteins from nonbioluminescent Anthozoa species. Nature Biotechnology. 17 (10), 969-973 (1999).
- Passarinho, P., et al. Target Genes Provide Diverse Entry Points into Cell Proliferation and Cell Growth Pathways. Plant Molecular Biology. 68 (3), 225-237 (2008).
- Bhyri, P., Khrishnamurthy, N., Narayanan, E., Nott, A., Sarangi, R. R. Novel plant terminator sequences. Patent Number US2014/0130205. , (2014).
- Laux, T., Mayer, K. F., Berger, J., Jürgens, G. The WUSCHEL gene is required for shoot and floral meristem integrity in Arabidopsis. Development. 122 (1), 87-96 (1996).
- Garnaat, C., Lowe, K., Roth, B. Zm-AXIG1-specific polynucleotides and methods of use. Patent Number WO2002006499. , (2002).
- Hershey, H. P., Stoner, T. D. Isolation and characterization of cDNA clones for RNA species induced by substituted benzenesulfonamides in corn. Plant Molecular Biology. 17 (4), 679-690 (1991).
- Abremski, K., Hoess, R. Bacteriophage P1 site-specific recombination. Purification and properties of the Cre recombinase protein. Journal of Biological Chemistry. 259 (3), 1509-1514 (1984).
- Sun, A. Q., et al. Cloning and Function Analysis of Small Heat Shock Protein Gene ZmHSP17.7 from Maize. ACTA Agronomica Sinica. 41 (3), 414 (2015).
- Sauer, B., Henderson, N. Site-specific DNA recombination in mammalian cells by the Cre recombinase of bacteriophage P1. Proceedings of the National Academy of Sciences of the United States of America. 85 (14), 5166-5170 (1988).
- Hershfield, V., Boyer, H. W., Yanofsky, C., Lovett, M. A., Helinski, D. R. Plasmid ColEl as a molecular vehicle for cloning and amplification of DNA. Proceedings of the National Academy of Sciences of the United States of America. 71 (9), 3455-3459 (1974).
- Liebert, C. A., Hall, R. M., Summers, A. O. Transposon Tn21, flagship of the floating genome. Microbiology and Molecular Biology Reviews. 63 (3), 507-522 (1999).
- Nishiguchi, R., Takanami, M., Oka, A. Characterization and sequence determination of the replicator region in the hairy-root-inducing plasmid pRiA 4b. Molecular and General Genetics. 206 (1), 1-8 (1987).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved