Method Article
Agrobacterium-Transformation d’embryon immature médié des lignées consanguines de maïs récalcitrants utilisant des gènes morphogènes
Dans cet article
Résumé
Les gènes morphogènes végétaux peuvent être utilisés pour améliorer la transformation génétique des génotypes récalcitrants. Décrit ici est un protocole de transformation génétique Agrobacterium-négocié(QuickCorn) pour trois lignées de maïs de maïs public importants consanguins.
Résumé
Démontré ici est un protocole détaillé pour Agrobacterium-négociétransformation génétique des lignées consanguines de maïs en utilisant des gènes morphogènes Baby boom (Bbm) et Wuschel2 (Wus2). Le bbm est réglementé par le promoteur du gène de transfert de phospholipides de maïs (Pltp), et Wus2 est sous le contrôle d’un promoteur de l’élin-inductible au maïs (Axig1). Une souche d’Agrobacterium portant ces gènes morphgéniques sur l’ADN de transfert (ADN T) et des copies supplémentaires des gènes de virulence d’Agrobacterium (vir) sont employées pour infecter des explants immatures d’embryon de maïs. Les embryons somatiques se forment sur la scutella des embryons infectés et peuvent être sélectionnés par résistance aux herbicides et germés en plantes. Un système de recombinaison cre/loxP activé par la chaleur intégré à la construction de l’ADN permet d’éliminer les gènes morphogènes du génome du maïs au cours d’une étape précoce du processus de transformation. Des fréquences de transformation d’environ 14 %, 4 % et 4 % (nombre d’événements transgéniques indépendants pour 100 embryons infectés) peuvent être atteintes pour les W22, B73 et Mo17, respectivement, en utilisant ce protocole.
Introduction
La transformation est un outil de base pour évaluer l’expression des gènes étrangers dans le maïs et produire des lignées de maïs génétiquement modifiées à des fins de recherche et commerciales. L’accès à une transformation à haut débit peut faciliter le besoin accru d’études de biologie moléculaire et cellulaire du maïs1. La capacité de transformer génétiquement les espèces cultivées est vitale pour les laboratoires publics et privés. Cela permet à la fois une compréhension fondamentale des mécanismes de régulation des gènes ainsi que l’amélioration des cultures à l’échelle mondiale pour soutenir une population en croissance constante.
La découverte que des embryons immatures provenant du maïs pourraient être utilisés pour la production de callus régenerable a pris naissance en 19752. Depuis cette révélation, la plupart des protocoles évolutifs de transformation du maïs ont nécessité la formation et la sélection des calus avant la régénération3. Pendant le processus de transformation génétique, les embryons immatures infectés ou biolistic-bombardés d’Agrobacteriumsont cultivés sur des médias pour l’induction embryogénique de callus. Les calli induits sont ensuite cultivés sur des supports sélectifs (p. ex., contenant un herbicide) de sorte que seules les morceaux de callus transformés peuvent survivre. Ces calli transgéniques putatifs résistants aux herbicides sont en vrac et régénérés en plantes. Bien que cette méthode soit efficace, le processus est long et laborieux, et il peut prendre plus de 3 mois pour terminer4. Plus important encore, les protocoles conventionnels de transformation du maïs possèdent une limitation beaucoup plus grande, c’est-à-dire que seul un nombre limité de génotypes de maïs peuvent être transformés5,6.
Lowe et coll.7,8 ont déjà signalé une méthode de transformation « QuickCorn » qui a non seulement considérablement réduit la durée du processus de transformation, mais a également élargi la liste des génotypes transformables. La méthode QuickCorn utilise des orthologs de maïs (Zm-Bbm et Zm-Wus2) des facteurs de transcription d’Arabidopsis BABY BOOM (BBM)9 et WUSCHEL (WUS)10. Lorsqu’ils sont incorporés dans le système vectoriel de transformation, ces gènes travaillent en synergie pour stimuler la croissance embryonnaire7.
Le protocole QuickCorn décrit dans ce travail était basé sur le protocole dans Jones et al11, qui était une amélioration supplémentaire de la méthode rapportée par Lowe et al7,8. Dans la présente étude, une souche D’Agrobacterium LBA4404 (Thy-) hébergeant une construction vectorielle binaire PHP81430 (figure 1) et un plasmide accessoire PHP7153912 sont utilisés pour la transformation. L’ADN T de PHP81430 contient les composants moléculaires suivants. (1) La cassette d’expression sélective de gène de marqueur de transformation Hra. Le gène du maïs Hra (Zm-Hra) est un gène modifié de la synthase acétolactase (SLA) qui tolère les herbicides inhibiteurs de la SLA tels que les sulfonylurères et les imidazolinones13,14. Le gène Zm-Hra est régulé par le promoteur de sorgho ALS8 et inhibiteur de la protéase de pomme de terre II (pinII) terminateur15. Le T-ADN contient également (2) une cassette d’expression possédant le gène marqueur sérigraphiable de transformation ZsGreen. Ce gène de protéine fluorescente verte ZsGreen de Zoanthus sp. corail de récif16 est réglé par un promoteur d’ubiquitine de sorgho/intron et le terminateur d’ubiquitine de riz.
En outre, le T-ADN contient (3) le gène morphogénique Bbm expression cassette. Bbm est un facteur de transcription associé au développement de l’embryon9,17. Bbm est réglementé par la protéine de transfert phospholipide de maïs (Pltp) promoteur8 et riz T28 terminator18. Zm-Pltp est un gène avec une forte expression dans l’épithélium scutellar embryon, poils de soie, et les cellules subsidiaires de feuilles (flanking les cellules de garde), faible expression dans les organes reproducteurs, et aucune expression dans les racines8. Il contient également (4) le gène morphogénique Wus2 cassette d’expression. Wus2 est un autre facteur de transcription associé au maintien du mériistem apaïque19. Zm-Wus2 est sous le contrôle d’un promoteur de maïs auxin-inductible (Zm-Axig1)20 et le maïs In2-1 terminator21. Enfin, l’ADN T contient (5) le système de recombinaison cre-loxP. Le gène cre recombinase22 est sous le contrôle de la protéine de choc thermique du maïs 17,7 (Hsp17.7)23 promoteur et pomme de terre pinII terminator. Deux sites loxP (dans la même orientation)24 flanc quatre cassettes d’expression génique, y compris ZsGreen, cre, Bbm et Wus2.
Étant donné que la présence des gènes morphgéniques n’est pas souhaitée pour la maturité des plantes et la progéniture subséquente, le système de recombinaison cre-loxP induit par la chaleur a été intégré dans l’ADN T pour éliminer les gènes morphogènes du génome du maïs afin de permettre la régénération normale des callus et le développement des plantes. Lors du traitement thermique, l’expression de la protéine CRE élimine tous les transgènes à l’exception du gène de sélection Hra. Les transformateurs réussis doivent être résistants aux herbicides, mais ZsGreen-négatif. Pour améliorer encore la fréquence de transformation, la souche Agrobacterium abrite également un plasmide accessoire supplémentaire (PHP71539) qui a des copies supplémentaires de virulence Agrobacterium (vir) gènes12.
La méthode QuickCorn est différente des protocoles conventionnels de transformation du maïs, car elle n’implique pas une étape d’induction du callus pendant la transformation. Au cours de la première semaine après l’infection par Agrobacterium, les embryons somatiques se développent sur l’épithélium scutellar des embryons immatures infectés. Les embryons sont ensuite transférés vers un milieu avec des hormones qui encouragent la maturation des embryons et la formation de pousses. Le transfert rapide des embryons somatiques sur le milieu de maturation/formation de pousse saute le stade traditionnel de callus précédemment utilisé pour la transformation du maïs et permet la génération directe de plantes T08. Par rapport aux méthodes de transformation du maïs publiées précédemment6, la méthode QuickCorn est plus rapide, plus efficace et moins dépendante du génotype. En utilisant cette méthode, les plantes enracinées sont généralement prêtes à être transférées dans le sol en seulement 5-7 semaines, plutôt que les trois mois ou plus requis par les protocoles traditionnels. Le but de cet article est de fournir une description et une démonstration approfondies de la méthode, permettant une reproduction plus facile dans un cadre de laboratoire généralement trouvé dans la plupart des établissements universitaires.
Protocole
1. Préparation des médias de croissance
- Pour les recettes moyennes de croissance exactes pour ce protocole, veuillez vous référer au tableau 1.
- Pour préparer 1 L de support, placez un bécher de 2 L sur une plaque à remuer et placez une barre à remuer à l’intérieur.
- Remplir le bécher de 900 ml d’eau distillée et allumer la plaque à remuer. La barre d’agitation doit tourner à vitesse moyenne.
- Peser tous les ingrédients en poudre et dissoudre dans un bécher.
- Mesurer tous les ingrédients liquides, le cas échéant, et ajouter au bécher.
- Porter le volume final à 1 L à l’aide d’eau distillée.
- Mesurez le pH et ajustez-les aux spécifications de la recette.
- Si vous formulez un milieu de croissance liquide, aucune gélose n’est ajoutée. Fixez un stérilisateur de filtre à une pompe à vide et versez le milieu de croissance liquide à travers le filtre. Allumez la pompe et attendez que tout le liquide soit tiré à travers. Placez un bouchon sur le contenant et attachez une étiquette.
- Si vous formulez un milieu de croissance solide, après l’ajustement du pH, ajouter l’agar directement dans une bouteille ou une fiole.
- Verser le milieu de croissance liquide de 1 L dans un flacon Erlenmeyer de 2 L, ou le diviser en deux bouteilles automatiques de 1 L (500 ml chacune). Si deux bouteilles sont utilisées, diviser l’agar et l’ajouter directement aux bouteilles.
- Couvrir le flacon d’un couvercle respirant, comme deux couches de papier d’aluminium, pour permettre à la vapeur de s’échapper. Si vous utilisez une bouteille, bouchonner lâchement le couvercle de vis sur le dessus.
- Autoclave à 121 oC pendant 25 min.
- Après l’autoclacage, retirer le milieu de croissance de l’autoclave et laisser refroidir jusqu’à 55-60 oC (un bain d’eau réglé à 55 oC peut faciliter les choses). Maintenir le milieu de croissance à l’état liquide pendant quelques heures jusqu’à ce qu’il soit pratique de verser les assiettes.
- Une fois refroidis, ajouter tous les additifs post-stérilisation (voir tableau 1) et bien mélanger.
- Après l’ajout de tous les ingrédients, versez le volume désigné dans le contenant de choix dans une hotte à débit laminaire.
- Le milieu de croissance peut être versé dans les plats Petri désirés manuellement ou à l’aide d’un appareil de distribution liquide. Lors de la coulée manuelle, il est recommandé de transférer un grand volume de milieu autoclaved dans un plus petit bécher stérile (500 ml) pour faciliter la manipulation.
- Laisser refroidir le milieu de croissance et se solidifier.
- Le milieu de croissance sera disponible pour une fois de plus en plus solide et est mieux utilisé le lendemain après le séchage légèrement pendant la nuit dans un capot à débit stérile comme des piles de plaques à couvercle. Après le séchage de nuit, transférer les assiettes dans des manches en plastique, plier sur l’extrémité lâche, et le garder en place avec un petit peu de ruban adhésif. Cela évite un séchage excessif. Le milieu peut être stocké dans un environnement frais, sombre et propre (4-16 oC) jusqu’à 1 mois.
2. Cultiver des plantes donneuses et récolter des oreilles immatures
- Cultivez tout maïs accessible au public consanguin (c.-à-d. B73, Mo17 ou W22) dans une serre dans des pots de 1,5 gallon (5,9 L) contenant un substrat sans sol. Utilisez une période de photos de 16/8 (jour/nuit), avec des températures moyennes de 25,5 oC pendant la journée et de 20 oC la nuit.
- Les plantes sont arrosées au besoin et fertilisées à l’arme à feu à l’eau à l’eau (N-P-K de 15-9-12), qui peuvent être incorporées dans le mélange du sol ou ajoutées à la surface après la plantation.
- Il faut habituellement environ 70-90 jours après la germination des graines pour les oreilles à émerger. Lorsque les pousses d’oreilles émergent, couvrez-les d’un sac de pousse pour éviter que la pollinisation incontrôlée ne se produise.
- Environ 2-3 jours après l’apparition des soies et si le pollen sera disponible le lendemain, couper les soies à l’aide de ciseaux qui ont été stérilisés dans 70% d’éthanol. Couper les soies et l’enveloppe à environ 2,5 cm au-dessous de l’extrémité des feuilles d’enveloppe, où les soies émergent. La pollinisation peut être effectuée le lendemain. Assurez-vous de rester ilize ciseaux entre chaque oreille.
- Une fois que les anthèques sortent d’un gland, recouvrez le gland d’un sac de gland et d’un trombone non désilié à la base du sac autour de la tige.
- Le lendemain matin, pliez doucement la plante et appuyez sur le sac pour encourager le pollen à être libéré.
- Retirer le sac de gland et plier le dessus du sac pour empêcher le pollen de s’échapper. Il est généralement préférable de sac le gland 1 jour avant qu’il ne soit utilisé (pour éviter l’accumulation de pollen mort et les anthères hangar). Le pollen frais peut être prélevé dans les glands pendant environ 3-5 jours. Lorsque les anthères émergent des fleurons intérieurs à la base du gland, ce gland ne produira probablement pas de pollen viable le lendemain.
- Utilisez le pollen de la même plante (auto-autodisation) ou d’une autre plante de la même consanguinité (sibbing).
- Retirez le sac d’oreilles ou coupez l’extrémité du sac pour exposer les soies, puis versez rapidement le pollen du sac de gland sur les soies.
- Couvrez l’oreille avec le sac de gland immédiatement et agrafez la base du sac autour de la tige pour la fixer. Il peut être utile d’isoler physiquement la plante des plantes à fleurs de différents génotypes pendant la pollinisation pour aider à prévenir la pollinisation croisée. Laissez le sac de gland sur l’oreille jusqu’à ce que l’oreille immature soit prête à récolter.
- 9-12 jours après la pollinisation, dépistez les oreilles pour la taille de l’embryon. Faites glisser le sac de pollinisation vers le haut de la tige pour exposer l’oreille. Tirez doucement l’enveloppe vers le bas pour exposer les grains sur environ un tiers à un quart de la circonférence de l’oreille et environ un tiers de la distance en bas de l’oreille. Les grains près de la pointe ne seront pas représentatifs de la taille moyenne de l’embryon.
- À l’aide d’un scalpel, couper le bouchon d’un seul grain qui semble semblable à la majorité des autres grains de taille et de couleur.
- Utilisez une spatule (avec une règle) pour enlever l’embryon tel que décrit à l’étape 4.6. Mesurez la longueur de l’embryon à l’aide d’une règle intégrée sur la spatule ou d’un étrier numérique. Si l’embryon est entre 1,5 et 2,0 mm, récoltez l’oreille. S’il s’agit d’un mois d’heure de 1,3 mm, l’oreille peut être prête à être récoltée plus tard dans la journée et peut être vérifiée à nouveau dans environ 7-8 h.
3. Préparation de la culture de suspension d’Agrobacterium pour l’infection
REMARQUE : La souche D’Agrobacterium LBA4404 (Thy-) contenant phP81430 (figure 1) et PHP7153912 est stockée sous forme de stock de glycérol à -80 oC. Ces documents peuvent être obtenus auprès de Corteva Agriscience dans le cadre d’un accord de transfert de matériel. LBA4404 (Thy-) est une souche auxotrophique qui a besoin de thymidine fourni dans les médias de croissance. L’utilité principale de la souche auxotrophe Agro est à des fins de biocontenu. Il a l’avantage supplémentaire de réduire la surcroissance agro. La souche auxotrophique Agro ne pousse pas sans thymidine supplémentaire. Néanmoins, la thymidine peut (vraisemblablement) être fournie par le tissu végétal mourant dans la culture. Par conséquent, il est encore nécessaire de fournir un antibiotique dans le milieu pour contrôler complètement l’agro auxotrophique. Cependant, il sera plus facile à contrôler en raison de la croissance compromise de la souche auxotrophique en l’absence de thymidine.
- Quatre jours avant la date de l’infection, initier une plaque "mère" du stock de glycérol en stries les bactéries sur une plaque YP avec 50 mg/L de thymidine, 50 mg/L de gentamicin, et 50 mg/L de spectinomycine (tableau 1). Incuber l’assiette « mère » dans un incubateur de 20 oC pendant 3 jours.
- Un jour avant l’expérience d’infection, préparez une plaque « de travail » en sélectionnant une à cinq colonies de la plaque « mère » et en striant les bactéries de la plaque « mère » à une nouvelle plaque de PJ (avec de la thymidine, de la gentamycine et de la spectinomycine; Tableau 1).
- Sillonnez la plaque quotidienne de « travail » dans des quadrants séquentiels et exécutez la boucle 1x à travers la zone juste rayée dans le quadrant successif, répétant pour former des quadrants qui ont été dilués en série. Incuber la plaque "travailler" pendant la nuit dans un incubateur de 27 oC.
- Après avoir terminé la dissection de l’embryon (étape 4.8), utilisez une boucle ou un outil similaire pour recueillir l’agrobactérie dans une région de la plaque « de travail » où la croissance bactérienne est visible sous forme de fines stries de colonies.
REMARQUE : Évitez les zones de la plaque avec une pelouse dense de croissance bactérienne. La croissance de l’Agrobacterium a probablement déjà commencé à diminuer dans les zones denses, tandis que dans les zones avec des colonies visibles, les bactéries sont dans la phase de croissance appropriée pour l’infection. - Suspendre les bactéries collectées dans un tube de 50 ml contenant 10 ml de milieu liquide 700A (tableau 1). Vortex de suspendre complètement la culture des bactéries.
- Mesurer la densité optique à une longueur d’onde de 550 nm. Ajustez le volume jusqu’à ce que l’OD se situe entre 0,35-0,45, 0,4 étant la valeur optimale.
REMARQUE: Si l’OD est supérieur à 0,45, ajouter plus de 700A milieu liquide. Si l’OD est inférieure à 0,35, inoculer plus de colonies d’agrodans la culture de suspension.
4. Dissection d’embryon, infection, et co-culture
- Sélectionnez des oreilles appropriées pour les expériences de transformation; ceux-ci devraient avoir un bon ensemble de graine et avoir des embryons qui vont dans la taille de 1.5-2.0 mm. Ils sont généralement récoltés entre 9-12 jours après la pollinisation. Les oreilles récoltées peuvent être utilisées fraîches ou entreposées pendant 1 à 4 jours à 4 oC, bien que la qualité de la réponse se dégradera probablement progressivement avec un stockage prolongé au-delà du premier jour.
- Retirer les cosses et les soies. Insérer une poignée dans la base ou le haut de l’oreille. La poignée peut être une paire de forceps, tournevis, etc.
- Placer les oreilles dans un grand récipient (p. ex., un bécher de 2 L avec la poignée vers le haut, remplir le récipient d’une solution de désinfection. La solution de désinfection est 1,8 L de 20% d’eau de Javel commerciale (1,65% d’hypochlorite de sodium) et quelques gouttes de surfactant Tween 20.
- Stériliser les oreilles à l’intérieur d’un banc à débit laminaire. Après 20 min, vider la solution d’eau de Javel et rincer les oreilles 3x (5 min chacune) à l’aide d’une généreuse quantité d’eau distillée stérile. Retirer l’eau et laisser sécher les oreilles pendant plusieurs minutes.
REMARQUE : Il est important que les oreilles soient complètement immergées dans la solution d’eau de Javel pendant 20 min. Déplacez les oreilles soigneusement autour dans la solution d’eau de Javel de temps en temps pour déloger des bulles d’air. - Préparer un tube microcentrifuge de 2 ml rempli de 700A milieu liquide. Ce tube sera utilisé pour recueillir les embryons immatures.
- Prenez l’oreille et à l’aide d’un scalpel stérile, enlever le haut 1-2 mm des couronnes de noyau pour exposer l’endosperme. Utilisez une micro spatule pour enlever l’embryon zygotique immature (IZE). L’IZE sera situé dans le noyau, sur le côté face à la pointe de l’oreille, et près de l’attachement à l’esquif. À l’aide de la spatule, insérez-la dans l’endosperme dans le péricarpe le plus éloigné de l’embryon, puis tordez doucement vers le haut pour déloger l’endosperme et permettre l’ablation de l’embryon (Figure 2).
- À l’aide de la spatule, transférer l’embryon dans le tube contenant le milieu liquide 700A. Continuez jusqu’à ce que jusqu’à 100 embryons aient été recueillis. Plusieurs tubes peuvent être remplis (100 embryons/tube) avant de passer à l’étape suivante. À ce stade, la suspension d’Agrobacterium doit être préparée (voir l’étape 3.5).
- Retirer le milieu liquide 700A du tube embryonnaire à l’huile de 1 ml. Ajouter le milieu 700A frais pour laver les embryons, puis retirer ce milieu ainsi.
- Ajouter 1 ml de suspension Agrobacterium et vortex sur un réglage bas (3/10) pour 30 s ou tube inverti 12x-15x à mélanger. Laisser reposer ce tube horizontalement sur le banc pendant 5 min.
- Après 5 min, transférer le tube entier des embryons et la suspension D’Agrobacterium sur une plaque de 562V milieu de co-culture (tableau 1). Ceci peut être réalisé en plaçant la plaque sur le banc et en versant rapidement le contenu du tube sur la plaque. Faites tourbillonner doucement la plaque pour distribuer les embryons et retirez la suspension De l’Agrobacterium à l’aide d’une pipette de 1 ml.
- Assurez-vous que les embryons sont placés avec le côté scutellum (rond) vers le haut. Utilisez une loupe ou une lunette de dissection, si nécessaire. Placer les assiettes dans des boîtes en plastique (19 cm x 28 cm x 5,1 cm) et les couver pendant la nuit de 16 à 18 h à 21 oC dans l’obscurité. Aucun emballage de plaque individuel à l’aide de film de paraffine ou de ruban d’évent n’est nécessaire.
- Après la co-culture de nuit, déplacez les embryons infectés, côté scutellum vers le haut, sur le milieu de repos 605T (tableau 1). Placer environ 30 embryons par assiette. Incuber les plaques à 26-28 oC dans l’obscurité.
- Incuber pendant 4-10 jours (7 jours est préféré). À l’heure actuelle, le développement d’embryons somatiques peut être observé à la surface du scutellum zygotique (figure 3).
5. Sélection, traitement thermique et régénération
- Après la période de repos, la chaleur choque les embryons. Placer la boîte contenant les plaques d’embryons dans un incubateur de 45 oC avec une humidité relative de 70 % pendant 2 h. Ensuite, retirez la boîte de l’incubateur de 45 oC et placez-la dans l’incubateur sombre de 26 à 28 oC pendant 1 à 2 h.
REMARQUE : Si vous n’arrivez pas à atteindre 70 % d’humidité dans un incubateur, ajoutez une double couche de serviettes en papier autoclaveautoauto-clés au fond de la boîte et trempez-laisser de l’eau autoclaved pour maintenir l’humidité dans la boîte. Remettre les assiettes dans la boîte sur le dessus des essuie-tout et sceller le couvercle avant de les placer à 45 oC. Utilisez un petit hygromètre/thermomètre numérique pour surveiller la température et l’humidité. - Transférer les EBE traitées à la chaleur du milieu de repos au milieu de formation de pousses (13329A) contenant 0,05 mg/L d’imazapyr en tant qu’agent sélectif (tableau 1). Lors du transfert, retirer les coleoptiles, s’il est présent, à l’aide de forceps à pointe fine ou de ciseaux chirurgicaux.
- Placez de 10 à 15 embryons par assiette pour éviter la surpopulation. Gardez les embryons dans ce milieu pendant 2 semaines dans l’incubateur sombre de 26 oC.
- Transférer les embryons au milieu d’enracinement (13158; Tableau 1) pendant 1-2 semaines. Placer autour de huit pièces par assiette et incuber dans une salle lumineuse ou une chambre légère(16 jours/8 nuit, 20-150 'mol/m 2/s) à 27 oC.
- Au fur et à mesure que les plantules se développent, placez des plantules plus fortes contenant à la fois des pousses et des racines vigoureuses sur de nouvelles plaques de milieu d’enracinement, placez une plante par assiette. Cela permettra une croissance plus forte des plantets. Placez les assiettes dans la salle lumineuse ou la chambre lumineuse pendant encore 7-14 jours.
REMARQUE : Retirez soigneusement les morceaux de callus associés au plantet pour vous assurer qu’il est en bon contact avec le milieu. - Au fur et à mesure que la plante devient plus vigoureuse, retirer la plante du milieu d’enracinement et rincer les racines à l’eau du robinet pour enlever l’agar.
- Transplanter des plantes individuelles dans des pots de 3 sur2 (19 cm2)contenant un substrat sans sol pré-humide. Placer les pots dans un plateau (27 cm x 54 cm) avec des trous de vidange et recouvrir le plat d’un dôme d’humidité plastique. Cette étape d’acclimatation peut être réalisée soit dans la chambre de croissance ou dans la serre chaude avec des conditions de croissance décrites dans la section 2 (étape 2.1) ci-dessus.
6. Transplantation à la serre et la production de graines T1
- Vérifier les plantes 2x par jour. De l’eau au besoin. Assurez-vous que les plantes ne sont ni séchées ni surarroisées. Le maintien d’un substrat légèrement sec favorise la croissance des racines.
REMARQUE : Le dôme d’humidité peut être enlevé 4-7 jours après la transplantation. Les plantes doivent être cultivées dans ces petits pots jusqu’à ce qu’elles se soient visiblement remises du stress de la transplantation dans le sol. Cela devrait prendre environ 9-14 jours. - Transplanter l’ensemble du bouchon sans sol et le plantlet dans un pot de 1,5 gal (5,9 L). Maintenir dans la serre chaude et l’eau quand le sol se sent sec au toucher.
- Ajouter un engrais à libération contrôlée avec du N-P-K de 15-9-12 dans le pot, qui peut être soit incorporé dans le mélange de substrat ou appliqué à la surface.
- Lorsque les pousses d’oreilles commencent à émerger de la plante, utilisez un sac de pousse s’apaise pour couvrir les pousses d’oreilles. Assurez-vous d’utiliser un sac semi-transparent afin que les soies émergentes puissent être observées sans enlever le sac. Le sac de pousse permet une pollinisation contrôlée. Il est important de toujours sac glands transgéniques.
- Après l’émergence des soies (1-2 jours), coupez les soies émergées à une longueur uniforme. Ce sera environ 2,5 cm au-dessous du dessus des feuilles d’enveloppe. Utilisez une paire de ciseaux propres qui ont été stérilisés dans 70% d’éthanol. En coupant les soies, une touffe uniforme se développe le lendemain pour que la pollinisation se produise.
- Pour la majorité des génotypes de maïs, le temps optimal pour la pollinisation est de 2-3 jours après l’émergence du gland ou de la soie.
- Recueillir le pollen de la même plante (si elle est auto-pollinisée) ou d’un type sauvage de la même consanguinité (si croisement ou croisement).
- Recueillir le pollen dans un sac de gland et l’appliquer sur la touffe de soie de la plante T0. Si le pollen provient d’une plante sauvage (non transgénique), placez le pollen dans un sac de gland brun nature. Si le pollen provient d’une plante transgénique, placez le pollen dans un sac à rayures vertes pour indiquer que le pollen est transgénique.
- Suivez les étapes 2.5-2.10 pour plus de détails sur la pollinisation.
- Environ 2 semaines après la pollinisation, retirer les sacs de gland des oreilles et permettre le séchage pour commencer. Pour aider à sécher, cessez d’arroser la plante 21-25 jours après la pollinisation. Vous pouvez également retirer les feuilles d’enveloppe pour exposer la graine. Cette pratique aide également à prévenir la moisissure.
- Environ 45 jours après la pollinisation, récoltez les graines et entreposez-les à froid entre 4 et 12 oC.
Résultats
Il est démontré ici un protocole étape par étape pourla transformation génétique de trois lignées de maïs de race publique (B73, Mo17 et W22) qui ont été importantes dans le domaine de la génétique du maïs. La transformation des trois lignées consanguines n’a pas pu être réalisée en utilisant les protocoles conventionnels de transformation du maïs5. La figure 1 et la figure 2 montrent les matériaux de construction et de démarrage, respectivement, utilisés ici. Les oreilles sont généralement récoltées 9-12 jours après la pollinisation. Les EE Dont la longueur varie entre 1,5 et 2,0 mm sont les meilleures explantations pour la transformation de ce protocole (Figure 2).
Huit jours après l’infection, des embryons somatiques exprimant ZsGreenont été visualisés sous le canal GFP d’un microscope fluorescent (Figure 3). Les EDE infectées ont été soumises à un traitement thermique 8 jours après l’infection (étapes 5.1 et 5.2). Ce traitement a induit l’expression de la recombinase CRE qui a excisé les cassettes d’expression Bbm, Wus2, cre, et ZsGreen flanquées entre les deux sites loxP (Figure 1). Les tissus traités à la chaleur ont ensuite été cultivés sur le milieu de formation de pousses contenant l’herbicide imazapyr pour la sélection des tissus transformés après l’élimination des gènes morphogènes.
Des tissus proliférants avec des embryons en maturation ou des bourgeons de pousse résistants à l’imazapyr ont été observés environ 3-4 semaines après l’infection (figure 4). Certains tissus résistants à l’imazapyr étaient négatifs pour ZsGreen, ce quisuggère que l’excision à médiation crécérée s’est probablement produite dans ces tissus (figure 4). Après que les tissus ont été déplacés à l’incubation moyenne et légère d’enracinement, les pousses ont commencé à se développer (figure 5). Des pousses saines et vigoureuses avec des racines bien développées ont été récoltées (Figure 5). Certains tissus semblaient avoir plusieurs pousses(Figure 5E,F,G). Ce type de régénération « herbeuse » peut être dû à des plantes clonales ayant des modèles d’intégration transgéniques identiques. Une analyse biologique moléculaire est nécessaire pour génotyper ces plantes.
Les trois lignées de consanguins publiques ont bien répondu en utilisant ce protocole ainsi que la construction utilisée dans ce travail. W22 a produit la fréquence la plus élevée de pousses résistantes aux imazapyrs, avec une fréquence d’environ 14 % (environ 14 pousses transgéniques pour 100 embryons immatures infectés). B73 et Mo17 ont produit environ 4 % de pousses transgéniques. Ces fréquences indiquent toutes les pousses transgéniques, y compris les plantes porteuses des gènes morphgéniques et des plantes dont le gène morphogène est éliminé par l’excision médiée par le CRE.

Figure 1 : Représentation schématique de la région T-ADN du plasmide binaire PHP81430. RB - bordure droite t-ADN; loxP - CRE recombinase site cible; Axig1pro:Wus2 - promoteur auxin-inductible de maïs (Zm-Axig1) - Zm-Wus2 - maïs In2-1 terminateur; Pltppro:Zm-Bbm - protéine de transfert phospholipide de maïs (Zm-Pltp) promoteur - Zm-Bbm - riz T28 terminator (Os-T28); Hsppro:cre - protéine de choc thermique de maïs 17,7 promoteur (Zm-Hsp17.7) - gène de recombinase de cre - inhibiteur de protéase de pomme de terre II (pinII) terminateur ; Ubipro:ZsGreen - sorghum ubiquitin promoter/intron (Sb-Ubi) - protéine fluorescente verte ZsGreen gène - rice ubiquitin terminator (Os-Ubi); Cassette de Hra - sorgho acetolactase synthase (Sb-Als) promoteur - maïs Hra (Zm-Hra) gène - pinII terminator; LB - frontière T-ADN gauche; colE1, origine de réplication du plasmide ColE125; SpecR - gène résistant à la spectinomycine aadA1 de Tn21 pour la sélection des bactéries26; Rep A,B,C - origine de réplication de pRiA4 d’Agrobacterium rhizogenes27. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
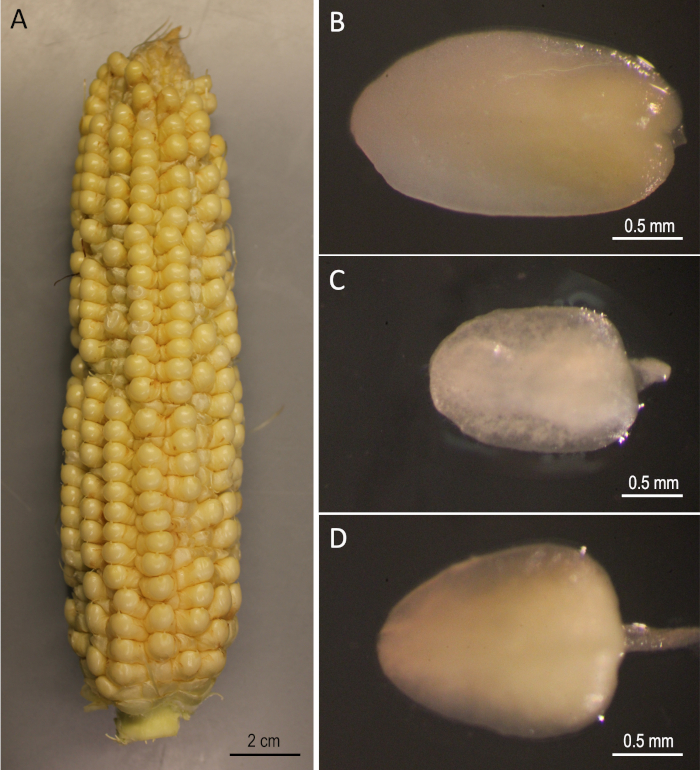
Figure 2 : Matériaux de départ. B73 oreilles récoltées 12 jours après la pollinisation (A). Embryons immatures de B73 (B), Mo17 (C), et W22 (D). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
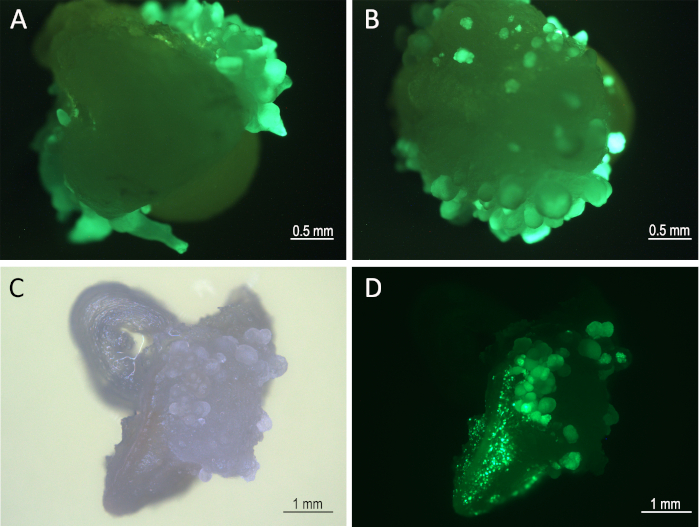
Figure 3 : Développement tissulaire sur le repos moyen 1 semaine après l’infection. Embryons (8 jours après l’infection) sous un microscope à florescence (filtre GFP) montrant des embryons somatiques de Mo17 (A) et W22 (B). Tissu en développement (B73) sous le champ lumineux (C) et le filtre GFP (D). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 4 : Développement tissulaire sur le milieu de maturation avec sélection. Une plaque de maturation W22 (A). Tissu en développement (Mo17, 15 jours après l’infection) sous le filtre de champ lumineux (B) et GFP (C). Tissu en développement (Mo17, 28 jours après l’infection) sous le filtre de champ lumineux (D) et DeFp (E). Les flèches indiquent des tissus régénérants qui manquent d’expression de GFP, suggérant l’excision du gène zsGreen entre les emplacements de loxP après l’activité induite par la chaleur de protéine de CRE. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 5 : Développement tissulaire sur les supports d’enracinement. Pousses de W22 (A), B73 (B), et Mo17 (C,D). Événement avec plusieurs pousses (regènes herbeux) de B73 (E) et W22 (F,G). Pousses avec des racines de B73 (H) et W22 (I). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Tableau 1 : Compositions médiatiques pour la transformation du maïs. S’il vous plaît cliquez ici pour voir ce tableau (Cliquez à droite pour télécharger).
Discussion
Les protocoles traditionnels pour la transformation du maïs suivent le paradigme de l’isolation des embryons zygotiques immatures pour produire des tissus callus transgéniques, qui sont régénérés en plantes fertiles4,6. Bien que cela soit efficace, les protocoles à base de callus peuvent prendre beaucoup de temps, et il faut souvent jusqu’à 3 mois pour que le processus de culture tissulaire produise des plantes. Ce qui rend la méthode présentée ici significative, c’est qu’elle est sans callus, efficace, rapide, et permet la régénération des plantes T0 dans environ la moitié du temps. Il semble également être moins dépendant du génotype et peut donc être efficace pour la plupart des consanguins accessibles au public8,11.
Bien que toutes les étapes doivent être suivies efficacement, une préparation correcte des médias de croissance est impérative. Les composants des supports de croissance doivent être ajoutés aux étapes correctes, avant et après l’autoclave, pour s’assurer que le matériel végétal reçoit la bonne concentration de produits chimiques. Cela permettra de s’assurer que les composés sensibles comme les antibiotiques ne se décomposent pas. Il est également important que le matériel végétal soit placé sur le bon milieu de croissance à chaque étape, comme indiqué dans le protocole. Ne pas placer de matériel sur le bon milieu de croissance peut entraîner la mort matérielle. En outre, il faut éviter de placer trop d’embryons ou de développer des tissus sur des assiettes. Bien que le placement de deux fois plus de morceaux de tissu peut économiser le coût des produits chimiques et des plats Petri (et même l’espace incubateur), la croissance des tissus dans les plaques surpeuplées peut être sérieusement inhibée. Lors de l’exécution de l’infection, il faut s’assurer que la densité optique de la suspension Agrobacterium est appropriée. Si la densité de suspension bactérienne est trop faible, une infection appropriée peut ne pas se produire.
La qualité des matériaux de départ est essentielle au succès des protocoles de transformation. Les oreilles utilisées pour la dissection des embryons doivent être saines, ce qui signifie que la plante qui les produit est saine. Ils doivent également posséder un ensemble de semences adéquat et être exempts de ravageurs et de maladies. En outre, l’ancien Agrobacterium ne doit pas être utilisé. L’assiette « mère » ne doit pas avoir plus de 2 semaines. Après ce point, une nouvelle plaque de « mère » devrait être strié pour commencer de nouvelles expériences.
Bien qu’il ait été démontré que cette méthode dépend moins du génotype, on ne peut pas présumer que toutes les lignes seront également réussies. Il peut encore y avoir des variations entre les lignes ainsi que des différences de succès basées sur la construction utilisée. La variabilité de l’oreille à l’oreille est également inévitable lorsque l’on travaille avec des embryons immatures, donc idéalement, les expériences devraient utiliser plusieurs oreilles pour expliquer cela. Dans ce travail, la race W22 a obtenu les meilleurs résultats, avec une fréquence de transformation de plus de 14 %, suivie de B73 et Mo17 (4 % chacune). Lowe et coll.8 ont déclaré utiliser le protocole QuickCorn pour la transformation B73 et Mo17. Dans ce travail, les fréquences de transformation variaient de 9% à 50% pour le B73 et de 15%-35% pour le Mo17.
Une possibilité pour les fréquences de transformation inférieures pour B73 et Mo17 observées dans ce travail peut être attribuée à la fluctuation saisonnière de la qualité de l’oreille. Une autre différence entre ce travail et celui de Lowe et coll.8 est que différentes constructions vectorielles ont été utilisées ici. Dans les travaux de Lowe, les gènes morphogènes n’ont pas été retirés des plantes transformées, mais plutôt réduits au silence dans les derniers stades. Dans ce travail, les gènes morphogènes ont été enlevés 8 jours après l’infection. Il est possible que B73 et Mo17 aient besoin d’une plus longue présence de Bbm/Wus2 pour le développement d’embryons somatiques.
En utilisant cette méthode, il est possible d’obtenir des plantes d’évacuation non transgéniques, des insertions multimériques et des transgènes non-transgéniques. Ces plantes n’auront pas un phénotype sensiblement différent, de sorte que la détection par PCR est nécessaire pour déterminer si une plante est transgénique. Pour ce faire, les amorces PCR dans la région excisée et les amorces qui bordent la région excisée peuvent être utilisées. De multiples transformations indépendantes peuvent également produire des plantes à partir du même embryon immature, ce qui rend difficile la détermination du taux total de récupération des transformateurs indépendants. Notre norme a été de calculer un taux de transformation basé sur l’échantillonnage d’une plante à partir de chaque embryon immature qui a produit des plantes et de diviser par le nombre d’embryons infectés. Cette méthode sous-estime presque certainement le nombre réel d’événements indépendants récupérés sous forme de plantules. La discrimination entre les événements indépendants d’un même embryon nécessite le séquençage des régions frontalières autour des transgènes, ce qui sera prohibitif et long pour la plupart des applications; cependant, il peut y avoir des cas dans lesquels ces données sont utiles.
Cette méthode de transformation de la culture tissulaire s’est avérée très efficace, mais des problèmes peuvent encore se produire. Si le matériel végétal ne répond pas, il est possible qu’il y ait un problème avec la lignée consanguine particulière, ce qui suggère que des variables telles que la composition des médias de croissance et le moment de la subculturing nécessitent des ajustements. Une autre variable est la conception appropriée des vecteurs et la construction précise du vecteur, si le vecteur d’origine est modifié. Il peut également y avoir des problèmes avec la sensibilité à l’imazapyr, car certaines lignes sont plus sensibles que d’autres, et la concentration d’imazapyr peut avoir besoin d’être ajustée pour atteindre avec succès des plantes transformées.
Au cours des 30 dernières années, la culture des tissus de maïs et les protocoles de transformation ont changé et progressé; et on croit que ce protocole raccourci fera avancer cette progression. Cette méthode est efficace pour les milieux académiques parce qu’elle prend moins de temps que les méthodes traditionnelles. En outre, elle n’exige pas d’opérateurs hautement qualifiés, ce qui la rend plus favorable à une distribution généralisée par rapport aux méthodes traditionnelles. À l’avenir, cette méthode pourra être combinée avec de nouvelles technologies telles que l’ingénierie génomique.
Déclarations de divulgation
Alicia Masters, William Gordon-Kamm et Todd Jones sont des employés de Corteva Agriscience qui ont fourni le protocole et les oreilles de maïs de B73, Mo17 et W22 utilisés dans cet article. Les auteurs Minjeong Kang, Morgan McCaw, Jacob Zobrist et Kan Wang n’ont rien à révéler.
Remerciements
Nous remercions l’équipe de serre de Corteva d’avoir fourni des oreilles immatures au maïs, le laboratoire de préparation des médias de Corteva pour avoir fourni de l’aide pour la fabrication des médias, Ning Wang de Corteva pour son aide dans la construction d’Agrobacterium et Keunsub Lee de l’Université d’État de l’Iowa pour l’aide. Ce projet a été financé en partie par le National Science Foundation Plant Genome Research Program Grant 1725122 et 1917138 à K.W., par Predictive Plant Phenomics Research Traineeship Program (National Science Foundation Grant DGE-1545453) à J.Z., par le projet usDA NIFA Hatch #IOW04341, par des fonds de l’État de l’Iowa, et par Crop Bioengineering Center de l’Université d’État de l’Iowa.
matériels
| Name | Company | Catalog Number | Comments |
| 2,4-D | Millipore Sigma | D7299 | |
| 6-Benzylaminopurine (BAP) | Millipore Sigma | B3408 | |
| Acetosyringone | Millipore Sigma | D134406 | |
| Agar | Millipore Sigma | A7921 | |
| Aluminum foil | To cover the flask | ||
| Ammonium Sulfate | Millipore Sigma | A4418 | |
| Analytical balance | To weigh small quantities of chemicals | ||
| Autocalve | Primus (Omaha, NE) | PSS5-K | To autoclave media and tools |
| Bacterial culture loop (10 µl) | Fisher scientific | 22-363-597 | Collects Agrobacterium from plate to transfer to liquid |
| Bactoagar | BD bioscience | 214030 | |
| Beakers (1 L, 2 L, 4 L) | To mix the chemicals for media | ||
| Benomyl | Millipore Sigma | #45339 | |
| Bleach (8.25% Sodium Hypochlorite) | Clorox | For seed sterilization | |
| Boric Acid | Millipore Sigma | B6768 | |
| Calcium Chloride Dihydrate | Millipore Sigma | C7902 | |
| Carbenicillin | Millipore Sigma | C3416 | |
| Casein Hydrolysate | Phytotech | C184 | |
| Cefotaxime | Phytotech | C380 | |
| Conical tube (50 mL) | Fisher scientific | 06-443-19 | Contain liquid medium and Agro suspension |
| Cuvette (Semi-micro) | Fisher scientific | 14955127 | To hold liquid for measuring OD |
| Dicamba | Phytotech | D159 | |
| Digital hygrometer | Checking temperature and humidity for heat treatment | ||
| EDTA, Disodium Salt, Dihydrate | Millipore Sigma | 324503 | |
| Eppendorf tube (2.0 mL) | ThermoFischer Scientific | AM12475 | |
| Eriksson's Vitamins | Phytotech | E330 | 1000x in liquid |
| Ethanol (70%) | Sterilizing tools and surfaces | ||
| Ferrous Sulfate Heptahydrate | Millipore Sigma | F8263 | |
| Fertilizer, Osmocote Plus 15-9-12 | ICL Specialty Fertilizers (Dublin, OH) | A903206 | Fertilizer |
| Flask (2 L) | Pyrex | 10-090E | To autoclave media and tools |
| Flats (Standard 1020, open w/holes, 11"W x 21.37"L x 2.44"D) | Hummert International (Earth City, Mo) | 11300000 | Tray to hold soil and pot insert, fits Humidome |
| Forceps (fine-tipped and large) | Fine for handling embryos; larger for large plant materials and use as ear holders | ||
| Gentamicin | Gold Biotechnologies | G-400 | |
| Glass bottle (1 L) | Pyrex | 06-414-1D | To autoclave medium |
| Graduated cylinder | To adjust volume of media | ||
| Imazapyr | Millipore Sigma | 37877 | |
| Incubator, 20 °C | Percival Scientific | Model I-36NL | To grow mother plate and incubate embryos during Agro infection |
| Incubator, 27 °C | Percival Scientific | Model I-36NL | To grow co-cultivation plate and maize embryo culture |
| Incubator, 45 °C | Heat shock treatment | ||
| Insert TO Standard, pots | Hummert International (Earth City, Mo) | 11030000 | For transplanting plants from rooting to soil, fits flat and Humidome |
| Laminar flow hood | Maintains sterile conditions | ||
| L-proline | Phytotech | P698 | |
| Magnesium Sulfate Heptahydrate | Millipore Sigma | M1880 | |
| Maize inbred seed B73 | U.S National Plant Germplasm | id=47638 | |
| Maize inbred seed Mo17 | U.S National Plant Germplasm | id=15785 | |
| Maize inbred seed W22 | U.S National Plant Germplasm | id=61755 | |
| Manganese Sulfate Monohydrate | Millipore Sigma | M7899 | |
| Milli-Q Water purification systems | Millipore sigma | MILLIQ | For tissue culture grade water |
| MS Basal Medium | Millipore Sigma | M5519 | |
| MS Basal Salt Mixture | Millipore Sigma | M5524 | |
| N6 Basal Salt Mixture | Millipore Sigma | C1416 | |
| Paperclips, non-skid | Holding on tassel bags | ||
| Peptone | BD bioscience | 211677 | |
| Petri dish (100x15 mm) | Fisher scientific | FB0875713 | For bacteria culture medium |
| Petri dish (100x25 mm) | Fisher scientific | FB0875711 | For the plant tissue culture medium |
| pH meter | Fisher scientific | AB150 | To adjust pH of media |
| Pipette (1 mL) | ThermoFischer Scientific | 4641100N | |
| Plastic Boxes | The Container Store | 10048430 | For tissue culture storage and incubation |
| Plastic humidy dome (Humi-Dome) | Hummert International (Earth City, Mo) | 14385100 | Plastic cover for soil flat |
| Potassium Iodide | Millipore Sigma | 793582 | |
| Potassium Nitrate | Millipore Sigma | P8291 | |
| Potassium Phosphate Monobasic | Millipore Sigma | P5655 | |
| Scale | To weigh chemicals for media | ||
| Scalpel Blade (No. 11, 4 cm) | Thermo Scientific | 3120030 | remove the top of the kernel crowns for embryo dissection |
| Scalpel handle | Holding scalpel blades | ||
| Schenk & Hildebrandt Vitamin (S&H vitamin) | Phytotech | S826 | 100x powder |
| Scissors | Cutting ear shoots | ||
| Shoot bag (Canvasback- semi-transparent) | Seedburo (Des Plaines, IL) | S26 | Semi-transparent bag to cover ear shoots |
| Silver Nitrate | Millipore Sigma | S7276 | |
| Sodium Molybdate Dihydrate | Millipore Sigma | M1651 | |
| Soiless substrate LC1 | SunGro Horticulture (Agawam, Ma) | #521 | For growing maize plants |
| Spatula (Double Ended Micro-Tapered) | Fischer Scientific | 2140110 | Dissecting embryos from kernels |
| Spatula (with spoon) | Fisher scientific | 14-375-10 | To measure chemicals for media |
| Spectinomycin | Millipore Sigma | S4014 | |
| Spectrophotometer (Genesys 10S UV-Vis) | Thermo Scientific | 840-300000 | Measure OD of Agro suspension |
| Stirring bar | Fisher scientific | 14-513-67 | To mix media |
| Stirring hotplates | To mix media | ||
| Syringe (without needle, 60 mL) | Fisher scientific | 14-823-43 | For filter sterilization |
| Syringe filter (0.22 µm) | Fisher scientific | 09-720-004 | For filter sterilization |
| Tassel bag (Canvasback- brown) | Seedburo (Des Plaines, IL) | T514 | Bag to cover tassels of non-transgenic plants |
| Tassel bag (Canvasback-green stripe) | Seedburo (Des Plaines, IL) | T514G | Bag to cover tassels of transgenic plants |
| Thiamine HCl | Phytotech | T390 | |
| Thidiazuron | Phytotech | T888 | |
| Thymidine | Millipore Sigma | T1895 | |
| Timentin | Phytotech | T869 | |
| Tween 20 | Fisher Scientific | Cas #9005-64-5 | surfactant |
| Vortex Genie 2 | Scientific Industries | SI0236 | Homogenizes liquids (Agro suspension) |
| Water bath (large - Precision model 186) | Fisher scientific | any that can fit 4+ 2L flasks and reach 55 °C | Keeps autoclaved media at optimal temperature |
| Weigh dish | Fisher scientific | 08-732-112 | To measure chemicals for media |
| Weighing paper | Fisher scientific | 09-898-12A | To measure chemicals for media |
| Yeast Extract | Fisher Scientific | BP14222 | |
| Zeatin | Millipore Sigma | Z0164 |
Références
- Zhao, Z. Y., et al. High throughput genetic transformation mediated by Agrobacterium tumefaciens in maize. Molecular Breeding. 8 (4), 323-333 (2002).
- Green, C. E., Phillips, R. L. Plant regeneration from tissue cultures of maize. Crop Science. 15 (3), 417-421 (1975).
- Ji, Q., Xu, X., Wang, K. Genetic transformation of major cereal crops. International Journal of Developmental Biology. 57, 495-508 (2013).
- Frame, B., Warnberg, K., Main, M., Wang, K., Wang, K. Maize (Zea mays, L). Agrobacterium Protocols. , 101-117 (2015).
- Frame, B., et al. Improved Agrobacterium-mediated transformation of three maize inbred lines using MS salts. Plant Cell Reports. 25 (1), 1024-1034 (2006).
- Que, Q., et al. Maize transformation technology development for commercial event generation. Frontiers in Plant Science. 5 (379), (2014).
- Lowe, K. S., et al. Morphogenic regulators Baby boom and Wuschel improve monocot transformation. The Plant Cell. 28 (9), 1998-2015 (2016).
- Lowe, K. S., et al. Rapid genotypes independent maize transformation via direct somatic embryogenesis. In Vitro Cellular & Developmental Biology - Plant. 54 (3), 240-252 (2018).
- Boutilier, K., et al. Ectopic expression of BABY BOOM triggers a conversion from vegetative to embryonic growth. The Plant Cell. 14 (8), 1737-1749 (2002).
- Zuo, J., Niu, Q. W., Frugis, G., Chua, N. H. The WUSCHEL gene promotes vegetative-to-embryonic transition in Arabidopsis. The Plant Journal. 30 (3), 349-359 (2002).
- Jones, T. J., Kumar, S., Barone, P., Smith, M., et al. Maize transformation using the morphogenic genes Baby Boom and Wuschel2. Transgenic Plants. , 81-93 (2019).
- Anand, A., et al. An improved ternary vector system for Agrobacterium-mediated rapid maize transformation. Plant Molecular Biology. 97 (1-2), 187-200 (2018).
- Ray, K., et al. Mutant acetolactate synthase gene is an efficient in vitro selectable marker for the genetic transformation of Brassica juncea (Oilseed Mustard). Journal of Plant Physiology. 161 (9), 1079-1083 (2004).
- Green, J. M., Hale, T., Pagano, M. A., Andreassi, J. L., Gutteridge, S. A. Response of 98140 corn with gat4621 and hra transgenes to glyphosate and ALS-inhibiting herbicides. Weed Science. 57 (2), 142-148 (2009).
- An, G., et al. Functional analysis of the 3' control region of the potato wound-inducible proteinase inhibitor II gene. The Plant Cell. 1 (1), 115-122 (1989).
- Matz, M. V., et al. Fluorescent proteins from nonbioluminescent Anthozoa species. Nature Biotechnology. 17 (10), 969-973 (1999).
- Passarinho, P., et al. Target Genes Provide Diverse Entry Points into Cell Proliferation and Cell Growth Pathways. Plant Molecular Biology. 68 (3), 225-237 (2008).
- Bhyri, P., Khrishnamurthy, N., Narayanan, E., Nott, A., Sarangi, R. R. Novel plant terminator sequences. Patent Number US2014/0130205. , (2014).
- Laux, T., Mayer, K. F., Berger, J., Jürgens, G. The WUSCHEL gene is required for shoot and floral meristem integrity in Arabidopsis. Development. 122 (1), 87-96 (1996).
- Garnaat, C., Lowe, K., Roth, B. Zm-AXIG1-specific polynucleotides and methods of use. Patent Number WO2002006499. , (2002).
- Hershey, H. P., Stoner, T. D. Isolation and characterization of cDNA clones for RNA species induced by substituted benzenesulfonamides in corn. Plant Molecular Biology. 17 (4), 679-690 (1991).
- Abremski, K., Hoess, R. Bacteriophage P1 site-specific recombination. Purification and properties of the Cre recombinase protein. Journal of Biological Chemistry. 259 (3), 1509-1514 (1984).
- Sun, A. Q., et al. Cloning and Function Analysis of Small Heat Shock Protein Gene ZmHSP17.7 from Maize. ACTA Agronomica Sinica. 41 (3), 414 (2015).
- Sauer, B., Henderson, N. Site-specific DNA recombination in mammalian cells by the Cre recombinase of bacteriophage P1. Proceedings of the National Academy of Sciences of the United States of America. 85 (14), 5166-5170 (1988).
- Hershfield, V., Boyer, H. W., Yanofsky, C., Lovett, M. A., Helinski, D. R. Plasmid ColEl as a molecular vehicle for cloning and amplification of DNA. Proceedings of the National Academy of Sciences of the United States of America. 71 (9), 3455-3459 (1974).
- Liebert, C. A., Hall, R. M., Summers, A. O. Transposon Tn21, flagship of the floating genome. Microbiology and Molecular Biology Reviews. 63 (3), 507-522 (1999).
- Nishiguchi, R., Takanami, M., Oka, A. Characterization and sequence determination of the replicator region in the hairy-root-inducing plasmid pRiA 4b. Molecular and General Genetics. 206 (1), 1-8 (1987).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon