Method Article
Agrobacterium-תיווך המעבר העובר בלתי בוגר של הסרבן מתוך תירס שורות באמצעות גנים מורפולגניים
In This Article
Summary
גנים מורפולגניים הצמח יכול לשמש כדי לשפר את הטרנספורמציה גנטית של גנוטיפים הסרבן. המתואר כאן הוא Agrobacterium-תיווך הטרנספורמציה גנטית (quickcorn) פרוטוקול עבור שלושה חשובים הציבור תירס שורות.
Abstract
הפגינו כאן הוא פרוטוקול מפורט עבור Agrobacterium-תיווך הטרנספורמציה גנטית של תירס שורות מורפולגניות באמצעות גנים מורגניים התינוק בום (bbm) ו Wuschel2 (Wus2). Bbm מוסדר על ידי תירס פוספוליפיד מיזם גנטי (pltp), ו Wus2 הוא תחת השליטה של תירס מinducible (Axig1) מיזם. זן Agrobacterium נושאת אלה גנים מורפולגניים על העברת דנ א (T-DNA) ועותקים נוספים של התקפה ואלימה של agrobacterium (vir) גנים משמשים כדי להדביק תירס העובר בלתי בוגר explants. העוברים הסומטיים מטפסים על הסמשתלה של העוברים הנגועים וניתן לבחור על ידי התנגדות לעשבים ומונבטים לצמחים. המופעל חום מערכת שילוב של loxP מובנה במבנה ה-DNA מאפשר הסרה של גנים מורפולגניים מן הגנום תירס בשלב מוקדם של תהליך השינוי. תדרים שינוי של כ 14%, 4%, ו 4% (מספרים של אירועים הטרנסגניים עצמאית לכל 100 עוברים נגועים) ניתן להשיג עבור W22, B73, ו Mo17, בהתאמה, באמצעות פרוטוקול זה.
Introduction
טרנספורמציה היא כלי בסיסי להערכת ביטוי גנים זרים תירס וייצור קווי תירס מהונדסים גנטית למטרות מחקר ומסחרי. גישה לשינוי תפוקה גבוהה יכולה להקל על הצורך המוגבר בלימודי הביולוגיה המולקולרית והתאית1. היכולת לשנות את מינים היבול בצורה גנטית היא חיונית למעבדות ציבוריות ופרטיות. זה מאפשר הן הבנה יסודית של מנגנוני רגולציה הגנים, כמו גם שיפור היבול בקנה מידה גלובלי כדי לתמוך באוכלוסיה ההולכת וגוברת.
התגלית כי עוברים בלתי בוגרים מתירס יכול לשמש לייצור של יבלות שלנו מקורו ב 19752. מאז ההתגלות הזאת, מדרגיים ביותר של תירס פרוטוקולים המרה יש צורך היווצרות ובחירה לפני התחדשות3. במהלך תהליך של שינוי גנטי, agrobacteriumאו ביוליסטיק-העוברים הופצץ בלתי בוגרים הם מתורבתים על מדיה עבור embryogenic יבלות האינדוקציה. Çallı המושרה אז הם מתורבתים על מדיה סלקטיבית (למשל, המכיל קוטל הצמחים), כך שרק חתיכות çallı שהפכו מסוגלים לשרוד. הקריאה האנטי-מגנטית העמידים בפני עשבים מולתרים ונוצרות מחדש לצמחים. בעוד שיטה זו יעילה, התהליך ארוך ועתיר עבודה, והוא יכול להימשך שלושה חודשים עד להשלמת4. וחשוב מכך, הפרוטוקולים של שינוי הצורה של תירס קונבנציונאלי הם בעלי מגבלה גדולה הרבה יותר, כלומר, רק מספר מצומצם של הגנוטיפים של תירס יכול להיהפך5,6.
לואו ואח '7,8 דיווחו בעבר על שיטת שינוי "quickcorn", שלא רק הקטינה באופן משמעותי את משך תהליך הטרנספורמציה אלא גם הרחיבה את רשימת הגנוטיפים הטרנספורבית. השיטה של מהירות התירס משתמשת ברישומי תירס (זם-bbm ו -Wus2) של מרכיבי התעתיק של התינוק בום (BBM)9 ורכרוכי (wus)10. כאשר משולבים במערכת וקטור שינוי, גנים אלה לעבוד בסינרגיה כדי לעורר embryogenic צמיחה7.
פרוטוקול quickcorn המתואר בעבודה זו התבסס על הפרוטוקול ב-Jones ואח '11, שהיה שיפור נוסף של השיטה שדווחה על-ידי לאו et7,8. במחקר הנוכחי, מאמץ Agrobacterium LBA4404 (שלך-) מחסה מבנה וקטורי בינארי PHP81430 (איור 1) ו-פלבין האביזר PHP7153912 משמשים לטרנספורמציה. T-DNA של PHP81430 מכיל את הרכיבים המולקולריים הבאים. (1) השינוי הסלקטיבי של הקלטת ביטוי של גן הרה . ה"תירס hra " הוא גן שונה לacetolactase סטנדרטים (als), שהוא מאוד סובלני לקוטלי עשבים שאינם מעכבים כגון סולופולוביאס וסרנוזולונס13,14. הגן של הארה ב מוסדר על ידי היזם דורה ALS8 ו תפוחי אדמה מעכבי פרוטטינואז ii (pinii) שליחות קטלנית15. T-DNA גם מכיל (2) קלטת ביטוי בעל שינוי הצורה מאפשר לסמן גן Zsgreen. זה ירוק חלבון הפלואורסצנטי גן Zsgreen מתוך זוציץ sp. השונית אלמוג16 מוסדר על ידי היזם המקדם של דורה/intron ואורז אוביקוויב שליחות קטלנית.
בנוסף, ה-DNA מכיל (3) את הקלטת ביטוי הגן המורפולגני Bbm . Bbm הוא גורם שעתוק הקשורים להתפתחותהעובר 9,17. Bbm מוסדר על ידי תירס מפוספוליפיד חלבון (pltp) יזם8 ואורז T28 שליחות קטלנית18. זם-Pltp הוא גן עם ביטוי חזק באפיתל העובר, שערות משי, ותאי הבת של העלה (מאגף את תאי המשמר), ביטוי נמוך באברי הרבייה, ואין ביטוי בשורשים8. הוא מכיל גם (4) את הקלטת Wus2 ביטוי הגן מורפולגניים. Wus2 הוא עוד גורם שעתוק הקשורים לתחזוקת מריאגזע האפיפיורי19. זם-Wus2 הוא תחת שליטה של תירס הinducible יזם (זם-Axig1)20 ו תירס In2-1 שליחות קטלנית21. בסופו של דבר, ה-DNA מכיל (5) מערכת שילוברקומבינציה של היצורים. Recombinase היצור הג22 הוא תחת שליטה של תירס הלם חום חלבון 17.7 (hsp 28.5)23 מקדם תפוחי אדמה ומחסל הסיכה2. שני אתרי Loxp (באותו כיוון)24 אגף ארבע קלטות של ביטוי גנים כולל zsgreen, היצורים, bbm ו Wus2.
בגלל הנוכחות של הגנים מורפולגניים אינו רצוי עבור בגרות הצמח הבאים צאצאים, הנגרמת חום המושרה -loxp מערכת רקומבינציה ילוב נבנה לתוך ה-DNA כדי להסיר גנים מורפולגניים מן הגנום תירס כדי לאפשר התחדשות באופן רגיל יבלות ופיתוח הצמח. בעת טיפול בחום, הביטוי של חלבון היצור מסיר את כל הטרנסגנים למעט הגן על בחירת ה- Hra . Transformants מוצלחת צריך להיות עמיד לצמחים אבל Zsgreen-שלילי. כדי לשפר עוד יותר את תדירות ההמרה, זן Agrobacterium גם נמלים אביזר נוסף פלמיד (PHP71539) כי יש עותקים נוספים של Agrobacterium התקפה אלימה (vir) גנים12.
שיטת QuickCorn שונה מפרוטוקולים קונבנציונליים של שינוי תירס, שכן היא אינה כרוכה בצעד האינדוקציה קריאה במהלך שינוי. במהלך השבוע הראשון לאחר זיהום עם Agrobacterium, העוברים הסומטיים להתפתח על האפיתל scutellar של העוברים בוגרים נגועים. העוברים מועברים לאחר מכן למדיום עם הורמונים המעודדים התבגרות והיווצרות העובר. במהירות העברת העוברים הסומטיים על התבגרות/לירות היווצרות בינונית מדלג על שלב יבלות המסורתי ששימש בעבר לשינוי תירס והיתרי דור ישיר של צמחים T08. לעומת שיטות השינוי של תירס שפורסמובעבר, שיטת התירס המהירה מהירה יותר, יעילה יותר ופחות גנוטיפ. באמצעות שיטה זו, צמחים מושרשת הם בדרך כלל מוכנים להעביר לקרקע רק 5-7 שבועות, ולא שלושה או יותר חודשים הנדרשים על ידי פרוטוקולים מסורתיים. מטרת מאמר זה היא לספק תיאור מעמיק והדגמה של השיטה, המאפשרת שכפול קל יותר בהגדרת מעבדה הנמצאת בדרך כלל ברוב המוסדות האקדמיים.
Protocol
1. הכנה למדיית גדילה
- לקבלת מתכונים מדויקים לצמיחה בינונית עבור פרוטוקול זה, אנא פנה לטבלה 1.
- עבור הכנת 1 L של התקשורת, מניחים בגביע 2 L על צלחת מהומה ומניחים בר מהומה בתוך.
- מילוי גביע עם 900 mL של מים מזוקקים ולהדליק את צלחת מהומה. בר המהומה צריך להיות מסתובב במהירות בינונית.
- שוקלים כל אבקת מרכיבים ומתמוסס בגביע.
- למדוד את כל החומרים נוזלי, אם בכלל, ולהוסיף את הגביע.
- הביאו את אמצעי האחסון הסופי ל-1 L באמצעות מים מזוקקים.
- למדוד את ה-pH ולהתאים מפרט מתכון.
- אם ניסוח מדיום גדילה נוזלי, אף אגר לא יתווסף. הצמד מסנן לחיטוי למשאבת ואקום ויוצקים את בינוני הגדילה הנוזלי דרך המסנן. הפעל את המשאבה והמתן עד שכל הנוזל יעבור. הצב כובע על המיכל וחבר תווית.
- אם גיבוש מדיום גדילה מוצק, לאחר pH מכוונן, להוסיף אגר ישירות לתוך בקבוק או בקבוקון.
- יוצקים את 1 L הצמיחה נוזל בינוני לתוך בקבוקון 2 L Erlenmeyer אייר, או לחלק אותו לשני 1 בקבוקים autoclavable הנכון (500 mL כל אחד). אם משתמשים בשני בקבוקים, מחלקים את אגר ומוסיפים ישירות לבקבוקים.
- כיסוי בקבוקון עם כיסוי נשימה, כגון שתי שכבות של רדיד אלומיניום, כדי לאפשר קיטור להימלט. אם משתמשים בבקבוק, מכסה את הבורג בראש.
- אוטוקלב ב 121 ° c עבור 25 דקות.
- לאחר autoclaving ינג, להסיר את מדיום הצמיחה מן החיטוי וקריר עד 55-60 ° צ' (אמבטיה מים מוגדר 55 ° צ' יכול לעשות את זה קל). לשמור על מדיום הצמיחה במצב נוזלי במשך כמה שעות עד שיהיה נוח לשפוך צלחות.
- לאחר מקורר, להוסיף את כל התוספים הפוסט עיקור (לראות טבלה 1) ולערבב היטב.
- לאחר הוספת כל החומרים, יוצקים את הנפח המיועד לתוך מיכל הבחירה במכסה של זרם למינארי.
- ניתן לשפוך את בינוני הגדילה לתוך מנות פטרי הרצויות באופן ידני או באמצעות מנגנון החילוק הנוזלי. כאשר מוזג באופן ידני, מומלץ להעביר נפח גדול של בינונית אוטומטית לתוך גביע סטרילי קטן יותר (500 mL) כדי להקל על הטיפול.
- אפשר בינוני גדילה להתקרר ולגבש.
- בינוני הגדילה יהיה זמין לשימוש פעם אחת להיות מוצק והוא הטוב ביותר בשימוש למחרת לאחר ייבוש מעט לילה במכסה הזרימה סטרילי כמו ערימות של צלחות כיסוי. לאחר ייבוש הלילה, להעביר את הצלחות לתוך שרוולים פלסטיק, לקפל מעל הקצה רופף, ולשמור את זה במקום עם קצת נייר דבק. זה מונע ייבוש מוגזם. ניתן לאחסן בינונית בסביבה מגניבה, חשוכה ונקייה (4-16 ° c) עד חודש אחד.
2. הגדלת צמחי התורמים והקציר של האוזניים הילדותיים
- לגדול כל תירס זמין לציבור (כלומר, B73, Mo17, או W22) בחממה 1.5 גלון (5.9 L) סירים המכילים מצע מצע. השתמש ב16/8 (יום/לילה) בזמן הצילום, עם טמפרטורות ממוצעות של 25.5 ° c במהלך היום ו-20 ° c בלילה.
- צמחים הם להשקות לפי הצורך מופרית עם דשן שחרור מבוקר (N-P-K של 15-9-12), אשר ניתן לשלב לערבב את הקרקע או להוסיף לפני השטח לאחר נטיעת.
- זה בדרך כלל לוקח כ 70-90 ימים לאחר נביטת הזרעים עבור האוזניים לצוץ. כאשר האוזניים מתרחשות, לכסות אותם עם שקית לירות כדי למנוע האבקה בלתי מבוקרת להתרחש.
- כ 2-3 ימים לאחר משי התפתחה, אם אבקה יהיה זמין למחרת, לחתוך את משי באמצעות מספריים כי כבר מעוקר ב 70% אתנול. חותכים את המשי ואת הקליפה בערך 2.5 ס מ מתחת לקצה של הקליפה, איפה המשי להגיח. ניתן לבצע האבקה למחרת. הקפד לעקר מחדש מספריים בין כל אוזן.
- ברגע שאנונים מגיחים מציצית, כסו את הציצית עם שקית ציצית ואטב נייר ללא החלקה בבסיס השקית שמסביב לקנה.
- למחרת בבוקר, לכופף בעדינות את הצמח מעל ולהקיש על השקית כדי לעודד אבקה להשתחרר.
- הסר את השקית הציצית וקפל את החלק העליון של השקית על מנת למנוע אבקה לברוח. בדרך כלל הטוב ביותר לארוז את הציצית יום אחד לפני שהוא ישמש (כדי למנוע בנייה של אבקה מתה ושפך לשפוך). אבקה טרייה ניתן לאסוף מן הגדילים עבור כ 3-5 ימים. כאשר מגיעים מהפלוריטות הפנימיות בבסיס הציצית, כנראה שהציצית לא תפיק אבקה בת קיימא למחרת.
- השתמש אבקה מן הצמח אותו (לבצע) או מצמח אחר של אותו מדומה (מזיתרים).
- הסר את שקית האוזן או גזור את סוף השקית כדי לחשוף את בדי המשי, ואז במהירות לשפוך אבקה מן השקית הציצית על משי.
- כסו את האוזן בשקית הציצית באופן מיידי והידוק בסיס השקית סביב הקנה כדי לאבטח אותו. זה יכול להיות מועיל פיזית לבודד את הצמח מצמחים פורחים של גנוטיפים שונים במהלך האבקה כדי לעזור למנוע האבקה החוצה. השאירו את השקית הציצית על האוזן עד שהאוזן הילדותית תהיה מוכנה לקציר.
- 9-12 ימים לאחר האבקה, אוזני מסך לגודל העובר. החליקו את השקית ההאבקה במעלה הקנה כדי לחשוף את האוזן. בעדינות למשוך את הקליפה לחשוף את הגרעינים על כשליש לרבע היקף האוזן ועל שליש מהמרחק במורד האוזן. גרעינים ליד הקצה לא יהיה נציג של גודל העובר הממוצע.
- באמצעות אזמל, לחתוך את הכובע של גרעין יחיד המופיע דומה לרוב של גרעינים אחרים בגודל ובצבע.
- השתמש במרית (עם סרגל) כדי להסיר את העובר כמתואר בשלב 4.6. למדוד את אורך העובר באמצעות סרגל מובנה על המרית או caliper דיגיטלי. אם העובר הוא בין 1.5-2.0 מ"מ, לקצור את האוזן. אם זה ~ 1.3 מ"מ, האוזן עשוי להיות מוכן הקציר מאוחר יותר ביום ניתן לבדוק שוב בערך 7-8 h.
3. הכנת תרבות ההשעיה של Agrobacterium לזיהום
הערה: The Agrobacterium זן LBA4404 (שלך-) המכיל PHP81430 (איור 1) ו PHP7153912 מאוחסן כמניה גליצרול ב-80 ° c. ניתן להשיג חומרים אלה מקורטבע Agriscience באמצעות הסכם העברת חומרים. LBA4404 (שלך-) הוא זן auxotrophic שצריך תימידין שסופקו במדיית הצמיחה. הכלי העיקרי של הנבג העזר אגרו הוא למטרות biocontainment. יש לו יתרון נוסף של הפחתת צמיחת יתר אגרו. המאמץ auxotrophic אגרו לא לגדול ללא thymidine משלים. עם זאת, תימידין יכול (ככל הנראה) להיות מסופק על ידי רקמת צמח גוסס בתרבות. לכן, יש עדיין צורך לספק אנטיביוטיקה במדיום כדי לשלוט לחלוטין auxotrophic אגרו. עם זאת, יהיה קל יותר לשלוט בשל הצמיחה נפרץ של זן auxotrophic בהעדר thymidine.
- ארבעה ימים לפני התאריך של זיהום, ליזום "אמא" צלחת מתוך מלאי גליצרול על ידי מעבר חיידקים על צלחת YP עם 50 mg/L thymidine, 50 mg/L gentamicin, ו 50 mg/L spectinomycin (טבלה 1). מודקת את צלחת "האם" בחממה של 20 ° c במשך 3 ימים.
- יום אחד לפני הניסוי הזיהום, להכין צלחת "עבודה" על ידי בחירת אחד לחמש מושבות מן הצלחת "האם" ויורד את החיידקים מן הצלחת "האם" לצלחת YP חדש (עם thymidine, ג'אמיצין, ו spectinomycin; טבלה 1).
- פס היומי "עבודה" צלחת ברביעים רציפים ולהפעיל את הלולאה 1x דרך האזור פשוט מעובד לתוך הרביע העוקב, חוזר לחלקי טופס כי כבר מדולל בצורה סדרתית. מודקת את הצלחת "עובד" לילה בחממה 27 ° c.
- לאחר השלמת העובר לנתיחה (שלב 4.8), להשתמש לולאה או כלי דומה כדי לאסוף Agrobacterium מאזור של "עבודה" צלחת שם הצמיחה חיידקים גלוי כמו פסים דקים של המושבות.
הערה: הימנע מאזורים של הצלחת עם מדשאה צפופה של גידול חיידקי. הצמיחה Agrobacterium כנראה כבר החלה לרדת באזורים צפופים, ואילו באזורים עם מושבות גלוי החיידקים נמצאים בשלב הצמיחה הנכונה של זיהום. - להשעות את החיידקים שנאספו בצינור 50 mL המכיל 10 מ ל של 700A נוזלי בינוני (שולחן 1). מערבולת להשעות את תרבות החיידקים לחלוטין.
- למדוד את הצפיפות האופטית באורך גל של 550 ננומטר. כוונן את אמצעי האחסון עד שהOD יהיה בין 0.35-0.45, כאשר 0.4 הוא הערך האופטימלי.
הערה: אם ה-OD גבוה מ-0.45, הוסף מדיום נוזלי יותר 700A. אם ה-OD נמוך מ-0.35, האיחסן מושבות אגרו יותר בתרבות ההשעיה.
4. ניתוח העובר, זיהום וטיפוח-תרגול
- בחרו אוזניים מתאימות לניסויים בשינוי הצורה; אלה צריכים להיות מערכת זרעים טובה יש עוברים כי טווח בגודל של 1.5-2.0 מ"מ. הם קוצרים בדרך כלל בין 9-12 ימים לאחר האבקה. אוזניים שנקטפו ניתן להשתמש טרי או מאוחסן במשך 1-4 ימים ב 4 ° c, אם כי איכות התגובה צפויה לבזות בהדרגה עם אחסון ממושך מעבר ליום הראשון.
- . הסר את ההאסקים והמשי הכנס נקודת אחיזה לתוך הבסיס או לחלק העליון של האוזן. ידית יכול להיות זוג מלקחיים, מברג, וכו '.
- מניחים אוזניים במיכל גדול (למשל, 2 מגביע L עם ידית למעלה, למלא את המיכל עם פתרון חיטוי. הפתרון לחיטוי הוא 1.8 L של 20% אקונומיקה מסחרית (1.65% נתרן היפוכלוניט) וכמה טיפות של החומרים הפעילי רצף 20.
- מחטא את האוזניים בתוך ספסל זורם למינארי. לאחר 20 דקות, רוקן את פתרון אקונומיקה ולשטוף את האוזניים 3x (5 דקות כל אחד) באמצעות כמות נדיבה של מים מזוקקים סטרילי. הסירו את המים והניחו לאוזניים להתייבש למשך מספר דקות.
הערה: חשוב שהאוזניים יהיו שקועים לחלוטין בתמיסת האקונומיקה במשך 20 דקות. הזיזו את האוזניים בזהירות מסביב לתמיסת האקונומיקה מדי פעם כדי להוציא בועות אוויר. - הכינו שפופרת מיקרוצנטריפוגה 2 מ ל מלאה 700A בינונית נוזלית. הצינור הזה ישמש כדי לאסוף את העוברים בלתי בוגרים.
- קח את האוזן באמצעות אזמל סטרילי, להסיר את העליון 1-2 mm של כתרי הקרנל כדי לחשוף את האנדוזרע. מיקרו מרית כדי להסיר את העובר הזיפטי בלתי בוגר (להשתמש). הארגון יהיה ממוקם בתוך הקרנל, בצד הפונה לקצה האוזן, וליד הקובץ המצורף ל קלח. תוך שימוש במרית, הכניסו אותו לתוך האנדוזה שבקרום הלב הרחוק ביותר מהעובר, ולאחר מכן סובבו בעדינות כלפי מעלה כדי להוציא את האנדוזרע ולאפשר הסרת העובר (איור 2).
- באמצעות המרית, העבירו את העובר לתוך הצינור המכיל 700 מדיום נוזלי. המשך לעשות זאת עד 100 עוברים נאספו. שפופרות מרובות עשוי להיות מלא (~ 100 עוברים/שפופרת) לפני שתמשיך לשלב הבא. בשלב זה, ההשעיה Agrobacterium צריך להיות מוכן (ראה שלב 3.5).
- הסירו את 700A בינונית נוזלית מצינור העובר עם פיפטה בגודל 1 מ ל. הוסף טרי 700A בינוני כדי לשטוף את העוברים, ולאחר מכן להסיר את המדיה גם.
- הוסף 1 מ ל של ההשעיה Agrobacterium ומערבולת על הגדרה נמוכה (3/10) עבור 30 s או היפוך צינור 12x-15x כדי לערבב. אפשר לצינור הזה לנוח באופן אופקי על הספסל במשך 5 דקות.
- לאחר 5 דקות, להעביר את הצינור כולו של העוברים ו Agrobacterium ההשעיה על צלחת של 562v שיתוף בינוני (שולחן 1). זה יכול להיות מושגת על ידי הצבת צלחת על הספסל ובמהירות לשפוך את תכולת הצינור על הצלחת. מערבולת בעדינות את הצלחת להפיץ את העוברים ולהסיר את ההשעיה Agrobacterium באמצעות פיפטה 1 mL.
- ודא כי העוברים ממוקמים עם צד הסטללום (עגול) פונה כלפי מעלה. השתמש בזכוכית מגדלת או בטווח מבתר, במידת הצורך. לוחות מניחים בקופסאות פלסטיק (19 ס"מ x 28 ס"מ x 5.1 ס מ) ו מודפות את הצלחות לילה 16-18 h ב 21 ° c בחושך. אין צורך בעטיפת לוחית בודדת המשתמשת בסרט פרפין או בטייפ.
- לאחר שיתוף טיפוח הלילה, להעביר את העוברים נגועים, scutellum בצד, על מנוחה בינונית 605T (שולחן 1). מניחים סביב 30 עוברים לצלחת. מודאת הצלחות ב 26-28 ° c בחושך.
- מודטה עבור 4-10 ימים (7 ימים הוא המועדף). בשלב זה, התפתחות העוברים הסומטיים ניתן לצפות על פני השטח של הזיטטיים scutellum (איור 3).
5. בחירה, טיפול בחום והתחדשות
- לאחר תקופת המנוחה, החום מזעזע את העוברים. מניחים את התיבה המכילה את לוחות העוברים בחממה 45 ° c עם 70% לחות יחסית 2 h. לאחר מכן, הסר את התיבה מהאינקובטור 45 ° c ומקום בחממה הכהה 26-28 ° c עבור 1-2 h.
הערה: אם לא ניתן להגיע 70% לחות בחממה, הוסיפו שכבה כפולה של מגבות נייר אוטוקלאויים לתחתית תיבת הצלחת והשתזפו במים אוטוקלשים כדי לשמור על לחות בתוך הקופסה. החזר את הלוחות אל התיבה שעל גבי מגבות הנייר ואטום את המכסה לפני שתמקם ב-45 ° c. השתמש בתרמומטר דיגיטלי קטן/טרמומטר כדי לפקח על הטמפרטורה והלחות. - להעביר את הטיפול בחום שטופלו מן המדיום מנוחה להיווצרות לירות בינונית (13329A) המכיל 0.05 mg/L imazapyr כסוכן סלקטיבי (שולחן 1). בעת העברה, להסיר אריחי coleoptiles אם קיים, באמצעות מלקחיים טיפ עדין או מספריים כירורגי.
- מקום 10-15 עוברים לצלחת כדי למנוע צפיפות יתר. שמרו על העוברים במדיום זה במשך שבועיים ב -26 ° c באינקובטור הכהה.
- להעביר את העוברים השתרשות בינונית (13158; שולחן 1) במשך 1-2 שבועות. מניחים סביב שמונה חתיכות לצלחת ו הדגירה בחדר אור או תא אור (16 יום/8 בלילה, 20-150 μ:002/s) ב 27 ° c.
- כמו שתילי לפתח, המקום שתילי חזק יותר המכיל הן נצרי ושורשים נמרצת על לוחות חדשים של השתרשות בינונית, מקום צמח אחד לכל צלחת. הדבר יאפשר הגידול החזק יותר. הניחו את הצלחות בחדר האור או בתא האור בעוד 7-14 ימים נוספים.
הערה: הסר בזהירות את כל החלקים המשויכים לפלנטתן כדי לוודא שהוא בקשר טוב עם המדיום. - כמו הצמח הופך נמרץ יותר, להסיר את הצמח מן השתרשות בינונית ולשטוף את השורשים עם מי ברז להסיר אגר.
- השתלת צמחים בודדים לתוך 3 ב2 (~ 19 ס מ2) סירים המכילים מצע מצע מראש. מניחים את הסירים במגש (27 ס"מ x 54 ס מ) עם חורים ניקוז ולכסות את הדירה עם כיפת לחות פלסטיק. שלב הסתגלות זה יכול להיות מושגת בחדר הצמיחה או בחממה עם תנאי גדילה המתוארים בסעיף 2 (שלב 2.1) לעיל.
6. הזרגת החממה וייצור זרעי T1
- בדוק את הצמחים 2x ליום. . מים כנדרש ודא כי הצמחים אינם יבשים החוצה ולא השקיו. שמירה על מצע יבש מעט מעודדת צמיחת שורש.
הערה: כיפת הלחות ניתן להסיר 4-7 ימים לאחר שתילת העציץ. צמחים צריכים להיות גדלים אלה סירים קטנים עד שהם התאושש בעליל מן הלחץ של השתלת לקרקע. זה צריך לקחת בערך 9-14 ימים. - להשתיל את התקע מצע כולו לתוך 1.5 גל (5.9 L) סיר. לשמור על החממה והמים כאשר הקרקע מרגיש יבש למגע.
- הוסף דשן שחרור מבוקר עם N-P-K של 15-9-12 לסיר, אשר יכול להיות משולב לתוך תערובת מצע או להחיל על פני השטח.
- כאשר האוזן יורה מתחיל לצאת מן הצמח, להשתמש בשקית לירות כדי לכסות את האוזן נצרי. הקפידו להשתמש בשק שקוף למחצה, כך שמשי המתעוררים יכול להיות נצפה ללא הסרת השקית. שק לירות מאפשר האבקה מבוקרת להתרחש. חשוב תמיד לארוז את הגדילים הטרנסגניים.
- לאחר שמשי להגיח (1-2 ימים), לקצץ את בדי המשי הגיח לאורך אחיד. זה יהיה כ 2.5 ס מ מתחת לחלק העליון של הקליפה עלים. השתמש זוג מספריים נקיים כי כבר מעוקר ב 70% אתנול. על-ידי גזיזת בדי המשי, מתפתח מדים אחידים ביום המחרת להתרחשות האבקה.
- עבור רוב הגנוטיפים של תירס, הזמן האופטימלי להאבקה הוא 2-3 ימים לאחר הופעתה או הופעת משי.
- לאסוף את האבקה מן הצמח אותו (אם להיות עצמית מואבקים) או מסוג פראי של הטבעי זהה (אם חוצות או חוצה).
- לאסוף את האבקה בשקית ציצית ולהחיל אותו על קווצת של הצמח T0. אם האבקה היא מצמח פראי (לא טרנסגניים), מניחים את האבקה בשקית הציצית חום. אם האבקה היא מצמח טרנסגניים, הניחו את האבקה בשקית פסים ירוקה כדי לציין כי האבקה היא טרנסגניים.
- בצע את השלבים 2.5-2.10 עבור פרטי האבקה.
- כשבועיים לאחר ההאבקה, מסירים את השקיות הציצית מהאוזניים, ומאפשרים להתייבש להתחיל. כדי לעזור להתייבש, להפסיק להשקות את הצמח 21-25 ימים לאחר האבקה. אתה יכול גם למשוך בחזרה את הקליפה עוזב כדי לחשוף את הזרע. תרגול זה גם עוזר למנוע עובש.
- כ 45 ימים לאחר האבקה, הקציר זרעים וחנות באחסון קר ב 4-12 ° c.
תוצאות
הפגינו כאן הוא פרוטוקול צעד אחר צעד עבור Agrobacterium-תיווך הטרנספורמציה גנטית של שלושה הציבור תירס שורות הטבעי (B73, Mo17, ו W22) כי היו משמעותיים בתחום גנטיקה של תירס. שינוי שלושת הקווים המואליים לא ניתן להשיג באמצעות שימוש רגיל של תירס שינוי פרוטוקולים5. איור 1 ואיור 2 מראים את המבנה וחומרי ההתחלה, בהתאמה, משומשים כאן. אוזניים הם בדרך כלל לקצור 9-12 ימים לאחר האבקה. רסטר עם אורכים בין 1.5-2.0 מ"מ הם הexplants הטובה ביותר עבור שינוי עבור פרוטוקול זה (איור 2).
שמונה ימים לאחר ההדבקה, העוברים ביטוי הסומאטיים של Zsgreenהביעו מתחת לערוץ ה-gfp של מיקרוסקופ פלורסנט (איור 3). המחלה הנגועה הייתה נתונה לטיפול בחום 8 ימים לאחר ההידבקות (שלבים 5.1 ו-5.2). טיפול זה השפיע על הביטוי של היצור recombinase כי הניח את Bbm, Wus2, היצור , ו zsgreen ביטוי קלטות מוקף בין שני אתרי loxp (איור 1). הרקמות שטופלו בחום היו אז מתורבתים על היווצרות לירות בינונית המכילה את imazapyr הצמחים לבחירה של רקמת הטרנספורמציה לאחר הסרת גנים מורפולגניים.
מתרבים רקמות עם עוברים התבגרות או לירות ניצנים כי היו עמידים imazapyr נצפו סביב 3-4 שבועות לאחר זיהום (איור 4). כמה הרקמות העמידות imazapyr היו שליליות עבור ZsGreen, הרומז כיהכריתה של היצור-מתווכת סביר שהתרחשה ברקמות אלה (איור 4). לאחר הרקמות הועברו השתרשות הדגירה בינונית וקלה, יורה החלה לפתח (איור 5). נצרי בריאה ונמרצת עם שורשים מפותחים היטב נקצרו (איור 5). כמה רקמות הופיעו יש מספר נצרי (איור 5E, F, G). סוג זה של "דשא" מחדש עשוי להיות עקב צמחי שבטים בעלי דפוסי אינטגרציה זהים. ניתוח ביולוגי מולקולרי נדרש כדי גנוטיפ אלה צמחים.
כל שלושת הקווים הציבוריים הגיבו היטב באמצעות פרוטוקול זה, כמו גם את המבנה המשמש בעבודה זו. W22 הפיק את התדר הגבוה ביותר של imazapyr עמיד נצרי, עם תדר של כ 14% (על 14 הטרנסגניים לצלם לכל 100 העוברים בוגרים נגועים). שניהם B73 ו Mo17 הפיק כ 4% הטרנסגניים נצרי. התדרים הללו מצביעים על כל הצילומים הטרנסגניים, כולל הצמחים הנושאים את הגנים המוורגניים והצמחים עם הגנים המוורגניים שהוסרו על ידי הסרת הצורה בתיווך.

איור 1: ייצוג סכמטי של אזור ה-DNA של הפלPHP81430 הבינארי. RB = הגבול T-DNA הימני; Loxp = היצורים recombinase אתר היעד; Axig1pro:Wus2 = תירס אוקאין-inducible יזם (זם-Axig1) + זם-Wus2 + תירס In2-1 שליחות קטלנית; Pltppro:זם-bbm = תירס פוספוליפיד חלבונים העברת חלבון (זם-Pltp) מיזם + זם-Bbm + אורז T28 שליחות קטלנית (Os-T28); Hsppro: היצור = תירס הלם חום חלבון 17.7 יזם (כלומר-hsp 28.5) + ביצורים Recombinase gene + תפוחי אדמה מעכבי השני (קשירה) שליחותקטלנית; Ubipro:zsgreen = דורה אוביקוויב יזם/Intron (Sb-Ubi) + חלבון פלורסנט ירוק zsgreen גן + אורז אוביקוויב שליחות קטלנית (Os-ubi); קלטת Hra = דורה acetolactase סטנדרטים (Sb-Als) מיזם + תירס Hra (זם-Hra) וכלי קשירה שליחות קטלנית; ליברות = הגבול T-DNA שמאל; colE1, מקור השכפול של פלאמיד ColE125; SpecR = Spectinomycin גן aadA1 מTn21 עבור בחירת החיידק26; נציג A, B, C = מקור השכפול מ pRiA4 של Agrobacterium. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
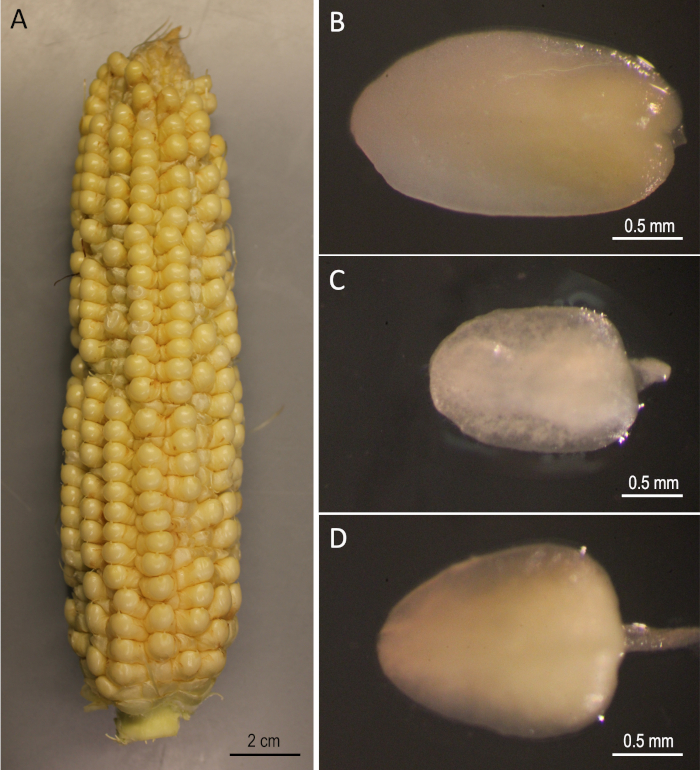
איור 2: חומרי התחלה. אוזניים B73שנקטפו 12 ימים לאחר האבקה (א). עוברים לא בוגרים של B73 (ב), Mo17 (ג) ו-W22 (ד). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
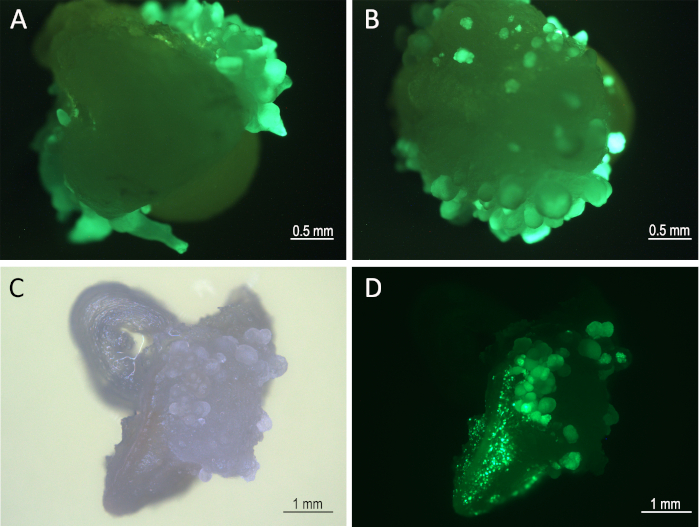
איור 3: התפתחות רקמות על מנוחה מדיום 1 שבוע לאחר ההדבקה. עוברים (8 ימים לאחר הזיהום) תחת מיקרוסקופ פלורנציה (מסנןgfp) המראה gfp ביטוי העוברים הסומטיים של Mo17 (a) ו W22 (ב). פיתוח רקמות (B73) תחת שדה בהיר (C) ו-gfp מסנן (D). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4: התפתחות רקמות על התבגרות בינונית עם בחירה. צלחת ההבשלה של W22 (א). פיתוח רקמות (Mo17, 15 ימים לאחר ההדבקה) תחת שדה בהיר (ב) ו-gfp מסנן (ג). פיתוח רקמות (Mo17, 28 ימים לאחר ההדבקה) תחת שדה בהיר (D) ו-gfp מסנן (E). חצים הצבע כדי ליצור מתחדשות רקמות כי הם חסרים ביטוי GFP, מציע את כריתה של גן Zsgreen בין האתרים loxp לאחר המושרה חום פעילות חלבון. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 5: התפתחות רקמות על השתרשות התקשורת. נצרי של W22 (א), B73 (ב) ו-MO17 (C, D). אירוע עם מספר רב של מB73 (E) ו-W22 (F, G). מצלם עם שורשי B73 (H) ו-W22 (I). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
טבלה 1: קומפוזיציות מדיה לשינוי של תירס. אנא לחץ כאן כדי להציג טבלה זו (לחץ לחיצה ימנית כדי להוריד).
Discussion
פרוטוקולים מסורתיים עבור התמרת תירס בצע את הפרדיגמה של בידוד עוברי זיפטיים בלתי-מפותחים כדי לייצר רקמת הטרנסג הטרנסגניים, אשר נוצר מחדש לתוך צמחים פוריים4,6. אמנם זה יעיל, callus-מבוססי פרוטוקולים יכולים לגזול זמן רב, וזה לוקח עד 3 חודשים לתהליך התרבות רקמה לייצר צמחים. מה שהופך את השיטה המוצגת כאן משמעותי היא כי הוא callus-חינם, יעיל, מהיר, ומאפשר התחדשות של צמחים T0 בערך במחצית מפרק הזמן. זה נראה גם פחות מסוג גנוטיפ, ולכן הוא יכול להיות יעיל עבור הזמינים ביותר מפגרים8,11.
בעוד כל הצעדים יש לעקוב באופן יעיל, נכון הכנה מדיית גדילה היא הכרחית. רכיבי מדיה צמיחה צריך להתווסף בשלבים הנכונים, מראש ולאחר האוטוקלב, כדי להבטיח כי חומר הצמח מקבל את הריכוז הנכון של כימיקלים. זה יבטיח תרכובות רגישות כמו אנטיביוטיקה לא להישבר. חשוב גם שחומר הצמח מוצב על המדיום הגדילה הנכון בכל שלב, כפי שמצוין בפרוטוקול. לא הצבת חומר על מדיום הגדילה הנכון עלולה לגרום למוות חומרי. בנוסף, יש להימנע מהצבת עוברים רבים מדי או מפתחים רקמות על לוחות. בעוד הצבת פי שניים מכלי הרקמה הרבים עשויים לחסוך את העלות של כימיקלים ומנות פטרי (ואפילו מרחב החממה), הצמיחה של רקמות לוחות צפוף יכול להיות מעכבות ברצינות. בעת ביצוע הזיהום, יש להבטיח כי הצפיפות האופטית של ההשעיה Agrobacterium מתאים. אם צפיפות ההשעיה החיידקית נמוכה מדי, ייתכן שהדבקה נכונה לא תתרחש.
איכות החומרים המתחילים חיונית להצלחה בפרוטוקולי השינוי. אוזניים המשמשות לניתוח העובר חייב להיות בריא, כלומר הצמח שמייצר אותם הוא בריא. הם גם חייבים להחזיק בערכת זרעים נאותה ולהיות מזיקים ונטול מחלות. כמו כן, אין להשתמש באגרובאכטריום הזקן. לוחית האימהות צריכה להיות. לא יותר משבועיים לאחר נקודה זו, לוחית "אמא" חדשה צריכה להיות מקוטעת כדי להתחיל בניסויים חדשים.
בעוד ששיטה זו הוצגה בפני פחות מסוג גנוטיפ, אין אפשרות להניח כי כל השורות יהיו מוצלחות באותה מידה. עדיין יכול להיות וריאציה בין הקווים, כמו גם הבדלים בהצלחה בהתבסס על המבנה בשימוש. ההבדלים בין האוזן לאוזן הוא גם בלתי נמנע כאשר עובדים עם עוברים בוגרים, כך שניסויים אידיאליים צריכים להשתמש במספר אוזניים כדי להסביר זאת. בעבודה זו, W22 ביצע את הטוב ביותר, עם מעל ~ 14% תדירות ההמרה, ואחריו B73 ו Mo17 (~ 4% כל אחד). לאו ואח '8 דיווח על שימוש בפרוטוקול quickcorn לשינוי B73 ו-Mo17. בעבודה זו, תדרי השינוי נעו מ -9%-50% עבור B73 ו-15%-35% עבור Mo17.
אפשרות אחת תדרי שינוי נמוך עבור B73 ו Mo17 נצפו בעבודה זו ניתן לייחס תנודות באיכות האוזן עונתית. הבדל נוסף בין עבודה זו לבין זה של לאו ואח '8 הוא שנעשה שימוש במבנה וקטורי שונה כאן. בעבודתו של לאו, הגנים המוסגניים לא הוסרו מהצומח ההפוך, אלא הושתקו מבחינה מנטלית בשלבים המאוחרים. בעבודה זו, הגנים המורפולגניים הוסרו 8 ימים לאחר ההדבקה. ייתכן שB73 ו-Mo17 יזדקקו לנוכחות ארוכה יותר של Bbm/Wus2 לפיתוח עוברים סומטיים.
שימוש בשיטה זו, יש אפשרות של קבלת צמחי בריחה לא הטרנסגניים, הוספות multimeric, ו טרנסגנים מונגיטים. צמחים אלה לא יהיה פנוטיפים שונים באופן ניכר, כך זיהוי ה-PCR נדרש כדי לקבוע אם הצמח הוא טרנסגניים. כדי לעשות זאת, ניתן ליישם את האזור הפנימי של ה-PCR בתוך האזור המגורש והתחל בכיוון השטח המגורש. שינויי צורה עצמאיים מרובים יכולים גם לייצר צמחים מן העובר אותו בלתי בוגר, מה שהופך את הנחישות של שיעור התאוששות עצמאית טרנספורמאנט הכולל קשה. התקן שלנו כבר לחשב שיעור שינוי המבוסס על דגימת צמח אחד מכל עובר בלתי הולם כי הפיק צמחים וחלוקת זה על ידי מספר העוברים נגוע. שיטה זו כמעט ללא ספק מעריכה את המספר הממשי של אירועים עצמאיים ששוחזרו כמו פלנטטים. האפליה בין אירועים עצמאיים מאותו העובר דורשת רצף של אזורי גבול סביב הטרנסגנים, וזה יהיה יקר באופן גמיש וארוך זמן עבור רוב היישומים; עם זאת, ייתכנו מקרים בהם נתונים אלה שימושיים.
שיטה זו של שינוי התרבות רקמה הוכיחה להיות יעילה מאוד, אבל בעיות עדיין יכול להתרחש. אם חומר הצמח אינו מגיב, ייתכן שיש בעיה עם הקו הטבעי המסוים, הרומז כי משתנים כגון הרכב מדיה צמיחה ותזמון של subculturing דורשים התאמות. משתנה נוסף הוא עיצוב וקטורי נאות ובנייה וקטורית מדויקת, אם הווקטור המקורי שונה. יכול להיות גם בעיות עם רגישות imazapyr, כמו כמה קווים רגישים יותר מאחרים, ואת הריכוז של imazapyr יכול להיות צריך להיות מותאם כדי להשיג צמחים שהפכו בהצלחה.
במהלך 30 השנים האחרונות, התרבות של רקמת תירס ופרוטוקולי טרנספורמציה השתנו והתקדמה; והוא האמין כי פרוטוקול מקוצר זה יהיה להמשך התקדמות זו. שיטה זו יעילה להגדרות אקדמיות משום שהיא פחות גוזלת זמן מאשר שיטות מסורתיות. בנוסף, היא אינה דורשת מפעילים מיומנים ביותר, מה שהופך אותה לקלה יותר להפצה נרחבת בהשוואה לשיטות מסורתיות. בעתיד, שיטה זו יכולה להיות משולבת עם טכנולוגיות חדשות כגון הנדסת גנום.
Disclosures
אלישיה מאסטרס, ויליאם גורדון-Kamm, וטוד ג ' ונס הם עובדים של קורטבע אגרימדע שסיפק את הפרוטוקול ואת האוזניים תירס של B73, Mo17, ו W22 בשימוש במאמר זה. המחברים Minjeong Kang, מורגן McCaw, ג'ייקוב Zobrist, ו קאן וואנג אין מה לגלות.
Acknowledgements
אנו מודים לצוות החממה של קורטבע לאספקת תירס בלתי מפותח, מעבדת ההכנה של המדיה של קורטבע למתן סיוע ביצירת מדיה, נינג וואנג מקורטבע לעזרה עם בניית Agrobacterium , ו-Keunsub לי מאוניברסיטת איווה סטייט לקבלת סיוע. פרויקט זה היה נתמך באופן חלקי על ידי הלאומית המדע הגנום צמח מחקר תוכנית גרנט 1725122 ו 1917138 K.W., על ידי צמח חזוי Phenomics המחקר traineeship תוכנית (לאומי המדע הקרן גרנט DGE-1545453) כדי J.Z., על ידי משרד החקלאות nifa לבקוע הפרויקט #IOW04341, על ידי מדינת איווה קרנות, ועל ידי מרכז ביוהנד
Materials
| Name | Company | Catalog Number | Comments |
| 2,4-D | Millipore Sigma | D7299 | |
| 6-Benzylaminopurine (BAP) | Millipore Sigma | B3408 | |
| Acetosyringone | Millipore Sigma | D134406 | |
| Agar | Millipore Sigma | A7921 | |
| Aluminum foil | To cover the flask | ||
| Ammonium Sulfate | Millipore Sigma | A4418 | |
| Analytical balance | To weigh small quantities of chemicals | ||
| Autocalve | Primus (Omaha, NE) | PSS5-K | To autoclave media and tools |
| Bacterial culture loop (10 µl) | Fisher scientific | 22-363-597 | Collects Agrobacterium from plate to transfer to liquid |
| Bactoagar | BD bioscience | 214030 | |
| Beakers (1 L, 2 L, 4 L) | To mix the chemicals for media | ||
| Benomyl | Millipore Sigma | #45339 | |
| Bleach (8.25% Sodium Hypochlorite) | Clorox | For seed sterilization | |
| Boric Acid | Millipore Sigma | B6768 | |
| Calcium Chloride Dihydrate | Millipore Sigma | C7902 | |
| Carbenicillin | Millipore Sigma | C3416 | |
| Casein Hydrolysate | Phytotech | C184 | |
| Cefotaxime | Phytotech | C380 | |
| Conical tube (50 mL) | Fisher scientific | 06-443-19 | Contain liquid medium and Agro suspension |
| Cuvette (Semi-micro) | Fisher scientific | 14955127 | To hold liquid for measuring OD |
| Dicamba | Phytotech | D159 | |
| Digital hygrometer | Checking temperature and humidity for heat treatment | ||
| EDTA, Disodium Salt, Dihydrate | Millipore Sigma | 324503 | |
| Eppendorf tube (2.0 mL) | ThermoFischer Scientific | AM12475 | |
| Eriksson's Vitamins | Phytotech | E330 | 1000x in liquid |
| Ethanol (70%) | Sterilizing tools and surfaces | ||
| Ferrous Sulfate Heptahydrate | Millipore Sigma | F8263 | |
| Fertilizer, Osmocote Plus 15-9-12 | ICL Specialty Fertilizers (Dublin, OH) | A903206 | Fertilizer |
| Flask (2 L) | Pyrex | 10-090E | To autoclave media and tools |
| Flats (Standard 1020, open w/holes, 11"W x 21.37"L x 2.44"D) | Hummert International (Earth City, Mo) | 11300000 | Tray to hold soil and pot insert, fits Humidome |
| Forceps (fine-tipped and large) | Fine for handling embryos; larger for large plant materials and use as ear holders | ||
| Gentamicin | Gold Biotechnologies | G-400 | |
| Glass bottle (1 L) | Pyrex | 06-414-1D | To autoclave medium |
| Graduated cylinder | To adjust volume of media | ||
| Imazapyr | Millipore Sigma | 37877 | |
| Incubator, 20 °C | Percival Scientific | Model I-36NL | To grow mother plate and incubate embryos during Agro infection |
| Incubator, 27 °C | Percival Scientific | Model I-36NL | To grow co-cultivation plate and maize embryo culture |
| Incubator, 45 °C | Heat shock treatment | ||
| Insert TO Standard, pots | Hummert International (Earth City, Mo) | 11030000 | For transplanting plants from rooting to soil, fits flat and Humidome |
| Laminar flow hood | Maintains sterile conditions | ||
| L-proline | Phytotech | P698 | |
| Magnesium Sulfate Heptahydrate | Millipore Sigma | M1880 | |
| Maize inbred seed B73 | U.S National Plant Germplasm | id=47638 | |
| Maize inbred seed Mo17 | U.S National Plant Germplasm | id=15785 | |
| Maize inbred seed W22 | U.S National Plant Germplasm | id=61755 | |
| Manganese Sulfate Monohydrate | Millipore Sigma | M7899 | |
| Milli-Q Water purification systems | Millipore sigma | MILLIQ | For tissue culture grade water |
| MS Basal Medium | Millipore Sigma | M5519 | |
| MS Basal Salt Mixture | Millipore Sigma | M5524 | |
| N6 Basal Salt Mixture | Millipore Sigma | C1416 | |
| Paperclips, non-skid | Holding on tassel bags | ||
| Peptone | BD bioscience | 211677 | |
| Petri dish (100x15 mm) | Fisher scientific | FB0875713 | For bacteria culture medium |
| Petri dish (100x25 mm) | Fisher scientific | FB0875711 | For the plant tissue culture medium |
| pH meter | Fisher scientific | AB150 | To adjust pH of media |
| Pipette (1 mL) | ThermoFischer Scientific | 4641100N | |
| Plastic Boxes | The Container Store | 10048430 | For tissue culture storage and incubation |
| Plastic humidy dome (Humi-Dome) | Hummert International (Earth City, Mo) | 14385100 | Plastic cover for soil flat |
| Potassium Iodide | Millipore Sigma | 793582 | |
| Potassium Nitrate | Millipore Sigma | P8291 | |
| Potassium Phosphate Monobasic | Millipore Sigma | P5655 | |
| Scale | To weigh chemicals for media | ||
| Scalpel Blade (No. 11, 4 cm) | Thermo Scientific | 3120030 | remove the top of the kernel crowns for embryo dissection |
| Scalpel handle | Holding scalpel blades | ||
| Schenk & Hildebrandt Vitamin (S&H vitamin) | Phytotech | S826 | 100x powder |
| Scissors | Cutting ear shoots | ||
| Shoot bag (Canvasback- semi-transparent) | Seedburo (Des Plaines, IL) | S26 | Semi-transparent bag to cover ear shoots |
| Silver Nitrate | Millipore Sigma | S7276 | |
| Sodium Molybdate Dihydrate | Millipore Sigma | M1651 | |
| Soiless substrate LC1 | SunGro Horticulture (Agawam, Ma) | #521 | For growing maize plants |
| Spatula (Double Ended Micro-Tapered) | Fischer Scientific | 2140110 | Dissecting embryos from kernels |
| Spatula (with spoon) | Fisher scientific | 14-375-10 | To measure chemicals for media |
| Spectinomycin | Millipore Sigma | S4014 | |
| Spectrophotometer (Genesys 10S UV-Vis) | Thermo Scientific | 840-300000 | Measure OD of Agro suspension |
| Stirring bar | Fisher scientific | 14-513-67 | To mix media |
| Stirring hotplates | To mix media | ||
| Syringe (without needle, 60 mL) | Fisher scientific | 14-823-43 | For filter sterilization |
| Syringe filter (0.22 µm) | Fisher scientific | 09-720-004 | For filter sterilization |
| Tassel bag (Canvasback- brown) | Seedburo (Des Plaines, IL) | T514 | Bag to cover tassels of non-transgenic plants |
| Tassel bag (Canvasback-green stripe) | Seedburo (Des Plaines, IL) | T514G | Bag to cover tassels of transgenic plants |
| Thiamine HCl | Phytotech | T390 | |
| Thidiazuron | Phytotech | T888 | |
| Thymidine | Millipore Sigma | T1895 | |
| Timentin | Phytotech | T869 | |
| Tween 20 | Fisher Scientific | Cas #9005-64-5 | surfactant |
| Vortex Genie 2 | Scientific Industries | SI0236 | Homogenizes liquids (Agro suspension) |
| Water bath (large - Precision model 186) | Fisher scientific | any that can fit 4+ 2L flasks and reach 55 °C | Keeps autoclaved media at optimal temperature |
| Weigh dish | Fisher scientific | 08-732-112 | To measure chemicals for media |
| Weighing paper | Fisher scientific | 09-898-12A | To measure chemicals for media |
| Yeast Extract | Fisher Scientific | BP14222 | |
| Zeatin | Millipore Sigma | Z0164 |
References
- Zhao, Z. Y., et al. High throughput genetic transformation mediated by Agrobacterium tumefaciens in maize. Molecular Breeding. 8 (4), 323-333 (2002).
- Green, C. E., Phillips, R. L. Plant regeneration from tissue cultures of maize. Crop Science. 15 (3), 417-421 (1975).
- Ji, Q., Xu, X., Wang, K. Genetic transformation of major cereal crops. International Journal of Developmental Biology. 57, 495-508 (2013).
- Frame, B., Warnberg, K., Main, M., Wang, K., Wang, K. Maize (Zea mays, L). Agrobacterium Protocols. , 101-117 (2015).
- Frame, B., et al. Improved Agrobacterium-mediated transformation of three maize inbred lines using MS salts. Plant Cell Reports. 25 (1), 1024-1034 (2006).
- Que, Q., et al. Maize transformation technology development for commercial event generation. Frontiers in Plant Science. 5 (379), (2014).
- Lowe, K. S., et al. Morphogenic regulators Baby boom and Wuschel improve monocot transformation. The Plant Cell. 28 (9), 1998-2015 (2016).
- Lowe, K. S., et al. Rapid genotypes independent maize transformation via direct somatic embryogenesis. In Vitro Cellular & Developmental Biology - Plant. 54 (3), 240-252 (2018).
- Boutilier, K., et al. Ectopic expression of BABY BOOM triggers a conversion from vegetative to embryonic growth. The Plant Cell. 14 (8), 1737-1749 (2002).
- Zuo, J., Niu, Q. W., Frugis, G., Chua, N. H. The WUSCHEL gene promotes vegetative-to-embryonic transition in Arabidopsis. The Plant Journal. 30 (3), 349-359 (2002).
- Jones, T. J., Kumar, S., Barone, P., Smith, M., et al. Maize transformation using the morphogenic genes Baby Boom and Wuschel2. Transgenic Plants. , 81-93 (2019).
- Anand, A., et al. An improved ternary vector system for Agrobacterium-mediated rapid maize transformation. Plant Molecular Biology. 97 (1-2), 187-200 (2018).
- Ray, K., et al. Mutant acetolactate synthase gene is an efficient in vitro selectable marker for the genetic transformation of Brassica juncea (Oilseed Mustard). Journal of Plant Physiology. 161 (9), 1079-1083 (2004).
- Green, J. M., Hale, T., Pagano, M. A., Andreassi, J. L., Gutteridge, S. A. Response of 98140 corn with gat4621 and hra transgenes to glyphosate and ALS-inhibiting herbicides. Weed Science. 57 (2), 142-148 (2009).
- An, G., et al. Functional analysis of the 3' control region of the potato wound-inducible proteinase inhibitor II gene. The Plant Cell. 1 (1), 115-122 (1989).
- Matz, M. V., et al. Fluorescent proteins from nonbioluminescent Anthozoa species. Nature Biotechnology. 17 (10), 969-973 (1999).
- Passarinho, P., et al. Target Genes Provide Diverse Entry Points into Cell Proliferation and Cell Growth Pathways. Plant Molecular Biology. 68 (3), 225-237 (2008).
- Bhyri, P., Khrishnamurthy, N., Narayanan, E., Nott, A., Sarangi, R. R. Novel plant terminator sequences. Patent Number US2014/0130205. , (2014).
- Laux, T., Mayer, K. F., Berger, J., Jürgens, G. The WUSCHEL gene is required for shoot and floral meristem integrity in Arabidopsis. Development. 122 (1), 87-96 (1996).
- Garnaat, C., Lowe, K., Roth, B. Zm-AXIG1-specific polynucleotides and methods of use. Patent Number WO2002006499. , (2002).
- Hershey, H. P., Stoner, T. D. Isolation and characterization of cDNA clones for RNA species induced by substituted benzenesulfonamides in corn. Plant Molecular Biology. 17 (4), 679-690 (1991).
- Abremski, K., Hoess, R. Bacteriophage P1 site-specific recombination. Purification and properties of the Cre recombinase protein. Journal of Biological Chemistry. 259 (3), 1509-1514 (1984).
- Sun, A. Q., et al. Cloning and Function Analysis of Small Heat Shock Protein Gene ZmHSP17.7 from Maize. ACTA Agronomica Sinica. 41 (3), 414 (2015).
- Sauer, B., Henderson, N. Site-specific DNA recombination in mammalian cells by the Cre recombinase of bacteriophage P1. Proceedings of the National Academy of Sciences of the United States of America. 85 (14), 5166-5170 (1988).
- Hershfield, V., Boyer, H. W., Yanofsky, C., Lovett, M. A., Helinski, D. R. Plasmid ColEl as a molecular vehicle for cloning and amplification of DNA. Proceedings of the National Academy of Sciences of the United States of America. 71 (9), 3455-3459 (1974).
- Liebert, C. A., Hall, R. M., Summers, A. O. Transposon Tn21, flagship of the floating genome. Microbiology and Molecular Biology Reviews. 63 (3), 507-522 (1999).
- Nishiguchi, R., Takanami, M., Oka, A. Characterization and sequence determination of the replicator region in the hairy-root-inducing plasmid pRiA 4b. Molecular and General Genetics. 206 (1), 1-8 (1987).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved