Method Article
Agrobacterium-Transformación de embriones inmaduros mediados de líneas endogámicas de maíz recalcitrante utilizando genes morfogénicos
En este artículo
Resumen
Los genes morfogénicos de las plantas se pueden utilizar para mejorar la transformación genética de los genotipos recalcitrantes. Aquí se describe un protocolo de transformación genética mediada por Agrobacterium(QuickCorn) para tres importantes líneas de maíz público endogámico.
Resumen
Aquí se muestra un protocolo detallado para la transformación genética mediada por Agrobacteriumde las líneas endogámicas de maíz utilizando genes morfogénicos Baby boom (Bbm) y Wuschel2 (Wus2). Bbm está regulado por el promotor del gen de la fosfolípido sin transferencia de maíz (Pltp), y Wus2 está bajo el control de un promotor inducible de auxina de maíz (Axig1). Una cepa de Agrobacterium que transporta estos genes morfogénicos en el ADN de transferencia (ADN-T) y copias adicionales de los genes de virulencia de Agrobacterium (vir) se utilizan para infectar explantes de embriones inmaduros de maíz. Los embriones somáticos se forman en la escutella de embriones infectados y pueden ser seleccionados por resistencia a herbicidas y germinados en plantas. Un sistema de recombinación de cre/loxP activado por calor integrado en la construcción del ADN permite la eliminación de genes morfogénicos del genoma del maíz durante una etapa temprana del proceso de transformación. Las frecuencias de transformación de aproximadamente 14%, 4% y 4% (números de eventos transgénicos independientes por cada 100 embriones infectados) se pueden lograr para W22, B73 y Mo17, respectivamente, utilizando este protocolo.
Introducción
La transformación es una herramienta básica para evaluar la expresión génica extraña en el maíz y producir líneas de maíz modificadas genéticamente tanto para fines de investigación como comerciales. El acceso a una transformación de alto rendimiento puede facilitar la creciente necesidad de estudios de biología molecular y celular de maíz1. La capacidad de transformar genéticamente las especies de cultivos es vital para los laboratorios públicos y privados. Esto permite tanto la comprensión fundamental de los mecanismos de regulación genética como la mejora de los cultivos a escala mundial para apoyar a una población en constante crecimiento.
El descubrimiento de que los embriones inmaduros del maíz podrían utilizarse para la producción de callos regenerables originado en 19752. Desde esta revelación, la mayoría de los protocolos de transformación de maíz escalables han requerido la formación y selección de callos antes de la regeneración3. Durante el proceso de transformación genética, agrobacterium-embriones inmaduros infectados o biolisticos-bombardeados se cultivan en medios para la inducción del callo embriogénico. Los calli inducidos se cultivan en medios selectivos (por ejemplo, que contienen un herbicida) de modo que sólo las piezas de callo transformadas puedan sobrevivir. Estos calli transgénicos putativos resistentes a los herbicidas se abultan y se regeneran en plantas. Si bien este método es eficaz, el proceso es largo y laborioso, y puede tomar más de 3 meses para completar4. Más importante aún, los protocolos convencionales de transformación del maíz poseen una limitación mucho mayor, es decir, sólo un número limitado de genotipos de maíz se pueden transformar5,6.
7,8 informaron anteriormente de un método de transformación "QuickCorn" que no sólo redujo en gran medida la duración del proceso de transformación, sino que también amplió la lista de genotipos transformables. El método QuickCorn utiliza ortologs de maíz (Zm-Bbm y Zm-Wus2) de los factores de transcripción de Arabidopsis BABY BOOM (BBM)9 y WUSCHEL (WUS)10. Cuando se incorporan en el sistema vectorial de transformación, estos genes trabajan sinérgicamente para estimular el crecimiento embrionario7.
El protocolo QuickCorn descrito en este trabajo se basó en el protocolo de Jones et al11, que fue una mejora adicional del método reportado por Lowe et al7,8. En el presente estudio, se utiliza para la transformación una cepa Debacterium LBA4404(Thy-) que alberga una construcción vectorial binaria PHP81430(Figura 1)y plásmido accesorio PHP7153912. El ADN-T de PHP81430 contiene los siguientes componentes moleculares. (1) El gen de marcador selectivo de transformación Hra expression cassette. El gen Hra de maíz (Zm-Hra) es un gen de acetolactasa sintasa (ALS) modificado que es tolerante a los herbicidas inhibidores de la ELA como las sulfonilareas y las imidazolinonas13,14. El gen Zm-Hra está regulado por el promotor de la ALS de sorgo8 y el inhibidor de la proteína de patata II(pinII) terminador15. El ADN-T también contiene (2) un casete de expresión que posee el gen marcador de transformación screenable ZsGreen. Este gen de proteína fluorescente verde ZsGreen de Zoanthus sp. coral de arrecife16 está regulado por un promotor/intron de la ubiquitina de sorgo y terminador de ubiquitina de arroz.
Además, el ADN-T contiene (3) el gen morfogénico del casete de expresión Bbm. Bbm es un factor de transcripción asociado con el desarrollo embrionario9,17. Bbm está regulado por el promotor de la proteína de la fosfolípido sin transferencia de maíz (Pltp)8 y el arroz T28 terminator18. Zm-Pltp es un gen con fuerte expresión en el epitelio escutellar embrionario, pelos de seda y células subsidiarias de las hojas (que flanquean las células de protección), baja expresión en órganos reproductivos, y ninguna expresión en las raíces8. También contiene (4) el gen morfogénico del casete de expresión Wus2. Wus2 es otro factor de transcripción asociado con el mantenimiento del meristem apical19. Zm-Wus2 está bajo el control de un promotor inducible de auxina de maíz (Zm-Axig1)20 y maíz In2-1 terminador21. Por último, el ADN-T contiene (5) el sistema de recombinación cre-loxP. El gen cre recombinase22 está bajo el control de la proteína de choque térmico de maíz 17.7 (Hsp17.7)23 promotor y terminador de pinII de patata. Dos sitios loxP (en la misma orientación)24 flanquean cuatro casetes de expresión génica incluyendo ZsGreen, cre, Bbm y Wus2.
Debido a que la presencia de los genes morfogénicos no se desea para la madurez de las plantas y la progenie posterior, el sistema de recombinación de cre-loxP inducido por calor se incorporó en el ADN-T para eliminar genes morfogénicos del genoma del maíz para permitir la regeneración normal del caldo y el desarrollo de las plantas. Tras el tratamiento térmico, la expresión de la proteína CRE elimina todos los transgenes excepto el gen de selección Hra. Los transformadores exitosos deben ser resistentes a los herbicidas, pero ZsGreen-negativo. Para mejorar aún más la frecuencia de transformación, la cepa Agrobacterium también alberga un plásmido accesorio adicional (PHP71539) que tiene copias adicionales de los genes de agrobacterium virulence (vir)12.
El método QuickCorn es diferente de los protocolos de transformación de maíz convencionales, ya que no implica un paso de inducción de callos durante la transformación. Durante la primera semana después de la infección con Agrobacterium,se desarrollan embriones somáticos en el epitelio escutelar de los embriones inmaduros infectados. Los embriones se transfieren a un medio con hormonas que fomentan la maduración de embriones y la formación de brotes. La rápida transferencia de embriones somáticos al medio de maduración/formación de brotes se salta la etapa tradicional de callo utilizada anteriormente para la transformación del maíz y permite la generación directa de plantas T08. En comparación con los métodos de transformación de maíz publicados anteriormente6, el método QuickCorn es más rápido, más eficiente y menos dependiente del genotipo. Usando este método, las plantas enraizadas están típicamente listas para transferir al suelo en sólo 5-7 semanas, en lugar de los tres o más meses requeridos por los protocolos tradicionales. El propósito de este artículo es proporcionar una descripción en profundidad y una demostración del método, lo que permite una replicación más fácil en un entorno de laboratorio que normalmente se encuentra en la mayoría de las instituciones académicas.
Protocolo
1. Preparación de los medios de crecimiento
- Para obtener recetas exactas de medios de crecimiento para este protocolo, consulte la Tabla 1.
- Para preparar 1 L de medios, coloque un vaso de precipitados de 2 L en un plato de agitación y coloque una barra de agitación en el interior.
- Llene el vaso de precipitados con 900 ml de agua destilada y encienda la placa de agitación. La barra de agitación debe girar a una velocidad media.
- Pesar todos los ingredientes en polvo y disolver en un vaso de precipitados.
- Mida todos los ingredientes líquidos, si los hay, y agréguelos al vaso de precipitados.
- Lleve el volumen final a 1 L con agua destilada.
- Mida el pH y ajuste las especificaciones de la receta.
- Si se formula un medio de crecimiento líquido, no se añade ningún agar. Fije un esterilizador de filtro a una bomba de vacío y vierta el medio de crecimiento líquido a través del filtro. Encienda la bomba y espere hasta que todo el líquido se extraiga a través. Coloque una tapa en el recipiente y adjunte una etiqueta.
- Si formula un medio de crecimiento sólido, después de ajustar el pH, agregue el agar directamente en una botella o matraz.
- Vierta el medio de crecimiento líquido de 1 L en un matraz Erlenmeyer de 2 L, o divídalo en dos botellas autoclavables de 1 L (500 ml cada una). Si se utilizan dos botellas, divida el agar y agréguelo directamente a las botellas.
- Cubra el matraz con una cubierta transpirable, como dos capas de papel de aluminio, para permitir que el vapor escape. Si utiliza una botella, tapar holgadamente la tapa del tornillo en la parte superior.
- Autoclave a 121oC durante 25 min.
- Después del autoclave, retire el medio de crecimiento del autoclave y enfríe a 55-60 oC (un baño de agua ajustado a 55 oC puede hacer esto más fácil). Mantenga el medio de crecimiento en estado líquido durante unas horas hasta que sea conveniente verter las placas.
- Una vez enfriado, añadir todos los aditivos posteriores a la esterilización (ver Tabla 1) y mezclar a fondo.
- Después de añadir todos los ingredientes, vierta el volumen designado en el recipiente de su elección en una campana de flujo laminar.
- El medio de crecimiento se puede verter en los platos Petri deseados manualmente o utilizando un aparato dispensador de líquido. Cuando se vierte manualmente, se recomienda transferir un gran volumen de medio autoclavedo en un vaso de precipitados estéril más pequeño (500 ml) para facilitar su manipulación.
- Deje que el medio de crecimiento se enfríe y solidifique.
- El medio de crecimiento estará disponible para su uso una vez que se vuelva sólido y se utiliza mejor al día siguiente después de secar ligeramente durante la noche en una campana de flujo estéril como pilas de placas tapadas. Después del secado durante la noche, transfiera las placas en mangas de plástico, doble sobre el extremo suelto y mantenga esto en su lugar con un poco de cinta. Esto evita el secado excesivo. El medio se puede almacenar en un ambiente fresco, oscuro y limpio (4-16 oC) durante un máximo de 1 mes.
2. Cultivo de plantas de donantes y cosecha de orejas inmaduras
- Cultivar cualquier maíz endogámico disponible públicamente (es decir, B73, Mo17 o W22) en un invernadero en macetas de 1,5 galones (5,9 L) que contengan un sustrato sin suelo. Utilice un período fotográfico de 16/8 (día/noche), con temperaturas medias de 25,5 oC durante el día y 20 oC por la noche.
- Las plantas se riegen según sea necesario y se fertilizan con un fertilizante de liberación controlada (N-P-K de 15-9-12), que puede incorporarse a la mezcla del suelo o añadirse a la superficie después de la plantación.
- Por lo general, toma alrededor de 70-90 días después de la germinación de la semilla para que las orejas surjan. A medida que surjan brotes auditivos, cúbralos con una bolsa de brote para evitar que se produzca una polinización incontrolada.
- Unos 2-3 días después de que hayan surgido las sedas y si el polen estará disponible al día siguiente, corta las sedas usando tijeras que han sido esterilizadas en 70% etanol. Cortar las sedas y la cáscara aproximadamente 2,5 cm por debajo del extremo de las hojas de cáscara, donde emergen las sedas. La polinización se puede realizar al día siguiente. Asegúrese de resterilize las tijeras entre cada oreja.
- Una vez que las anteras emergen de una tasel, cubra la bolola con una bolsa de talla y un clip de papel antideslizante en la base de la bolsa alrededor del tallo.
- A la mañana siguiente, dobla suavemente la planta y toca la bolsa para animar a que se libere el polen.
- Retire la bolsa de la tala y doble la parte superior de la bolsa para evitar que el polen escape. Por lo general, es mejor embolsar la bola 1 día antes de que se utilizará (para evitar la acumulación de polen muerto y arrojar anteras). El polen fresco se puede recoger de las tasels durante unos 3-5 días. Cuando las antelas emergen de los floretes internos en la base de la tassel, es probable que la bolo no produzca polen viable al día siguiente.
- Utilice el polen de la misma planta (autouso) o de otra planta de la misma endogámica (sibbing).
- Retire la bolsa de la oreja o corte el extremo de la bolsa para exponer las sedas, luego vierta rápidamente el polen de la bolsa de la quilla sobre las sedas.
- Cubra la oreja con la bolsa de la talla inmediatamente y engrape la base de la bolsa alrededor del tallo para asegurarla. Puede ser útil aislar físicamente la planta de plantas en flor de diferentes genotipos durante la polinización para ayudar a prevenir la polinización cruzada. Deje la bolsa de la tala en la oreja hasta que la oreja inmadura esté lista para cosechar.
- 9-12 días después de la polinización, los oídos de la pantalla para el tamaño del embrión. Deslice la bolsa de polinización hasta el tallo para exponer la oreja. Tire suavemente de la cáscara hacia abajo para exponer los granos en aproximadamente un tercio a un cuarto de la circunferencia de la oreja y alrededor de un tercio de la distancia por la oreja. Los núcleos cerca de la punta no serán representativos del tamaño medio del embrión.
- Usando un bisturí, corte la tapa de un solo núcleo que parezca similar a la mayoría de otros núcleos en tamaño y color.
- Utilice una espátula (con una regla) para extraer el embrión como se describe en el paso 4.6. Mida la longitud del embrión usando una regla incorporada en la espátula o una pinza digital. Si el embrión está entre 1,5-2,0 mm, cosechar el oído. Si es de 1,3 mm, la oreja puede estar lista para cosechar más tarde en el día y se puede comprobar de nuevo en aproximadamente 7-8 h.
3. Preparación del cultivo de suspensión de Agrobacterium para la infección
NOTA: La cepa Agrobacterium LBA4404(Thy-) que contiene PHP81430(Figura 1) y PHP7153912 se almacena como una acción de glicerol a -80 oC. Estos materiales se pueden obtener de Corteva Agriscience a través de un Acuerdo de Transferencia de Materiales. LBA4404(Thy-) es una cepa auxotrófica que necesita timidina suministrada en los medios de crecimiento. La utilidad principal de la cepa agro auxotroph es para fines de biocontención. Tiene el beneficio adicional de reducir el crecimiento excesivo de Agro. La cepa auxiliaragroa Agro no crece sin timidina suplementaria. Sin embargo, la timidina puede (presumiblemente) ser suministrada por el tejido vegetal moribundo en el cultivo. Por lo tanto, todavía hay una necesidad de proporcionar un antibiótico en el medio para controlar completamente el agro auxotropo. Sin embargo, será más fácil de controlar debido al crecimiento comprometido de la cepa auxoterófica en ausencia de timidina.
- Cuatro días antes de la fecha de la infección, inicie una placa "madre" de la población de glicerol rayando las bacterias en una placa YP con 50 mg/L de timidina, 50 mg/L de gentamicina y 50 mg/L de espectinomicina (Tabla 1). Incubar la placa "madre" en una incubadora de 20oC durante 3 días.
- Un día antes del experimento de infección, preparar una placa de "trabajo" seleccionando de una a cinco colonias de la placa "madre" y rayando las bacterias de la placa "madre" a una nueva placa YP (con timidina, gentamicina y espectinomicina; Tabla 1).
- Raya la placa diaria de "trabajo" en cuadrantes secuenciales y ejecuta el bucle 1x a través del área con rayas justas en el cuadrante sucesivo, repitiendo para formar cuadrantes que se han diluido en serie. Incubar la placa "en funcionamiento" durante la noche en una incubadora de 27oC.
- Después de completar la disección embrionaria (paso 4.8), utilice un bucle o una herramienta similar para recolectar Agrobacterium de una región de la placa "de trabajo" donde el crecimiento bacteriano es visible como finas vetas de colonias.
NOTA: Evite las áreas de la placa con un césped denso de crecimiento bacteriano. El crecimiento de Agrobacterium probablemente ya ha comenzado a disminuir en áreas densas, mientras que en las áreas con colonias visibles las bacterias están en la fase de crecimiento adecuado para la infección. - Suspenda las bacterias recogidas en un tubo de 50 ml que contenga 10 ml de medio líquido 700A (Tabla 1). Vórtice para suspender completamente el cultivo de bacterias.
- Mida la densidad óptica a una longitud de onda de 550 nm. Ajuste el volumen hasta que el OD esté entre 0,35-0,45, siendo 0,4 el valor óptimo.
NOTA: Si el OD es superior a 0,45, agregue más medios líquidos 700A. Si la Do es inferior a 0,35, inocular más colonias agromarinas en el cultivo de suspensión.
4. Disección, infección y cocultivo de embriones
- Seleccione orejas adecuadas para experimentos de transformación; estos deben tener un buen conjunto de semillas y tienen embriones que varían en tamaño de 1.5-2.0 mm. Por lo general se cosechan entre 9-12 días después de la polinización. Las orejas cosechadas se pueden utilizar frescas o almacenadas durante 1-4 días a 4 oC, aunque la calidad de la respuesta probablemente se degradará progresivamente con un almacenamiento prolongado más allá del primer día.
- Retire las cáscaras y las sedas. Inserte un asa en la base o en la parte superior de la oreja. El mango puede ser un par de fórceps, destornillador, etc.
- Coloque las orejas en un recipiente grande (por ejemplo, vaso de 2 L con la manija hacia arriba, llene el recipiente con solución de desinfección. La solución de desinfección es 1,8 L de 20% de lejía comercial (1,65% hipoclorito de sodio) y un par de gotas de tensioactivo Tween 20.
- Esterilice las orejas dentro de un banco de flujo laminar. Después de 20 min, vacíe la solución de lejía y enjuague las orejas 3 veces (5 min cada una) utilizando una generosa cantidad de agua destilada estéril. Retire el agua y deje que las orejas se sequen durante varios minutos.
NOTA: Es importante que las orejas estén completamente sumergidas en la solución de lejía durante 20 minutos. - Preparar un tubo de microcentrífuga de 2 ml lleno de medio líquido 700A. Este tubo se utilizará para recoger los embriones inmaduros.
- Tome la oreja y usando un bisturí estéril, retire la parte superior 1-2 mm de las coronas del núcleo para exponer el endospermo. Utilice una micro espátula para eliminar el embrión cigota inmaduro (IZE). El IZE se ubicará dentro del núcleo, en el lado que mira hacia la punta de la oreja, y cerca del accesorio a la mazorca. Usando la espátula, insértela en el endospermo en el pericarpo más alejado del embrión, luego gire suavemente hacia arriba para desalojar el endospermo y permitir la eliminación del embrión(Figura 2).
- Con la espátula, transfiera el embrión al tubo que contiene el medio líquido 700A. Continúe haciendo esto hasta que se hayan recogido hasta 100 embriones. Se pueden llenar varios tubos (100 embriones/tubo) antes de continuar con el siguiente paso. En este punto, se debe preparar la suspensión de Agrobacterium (ver paso 3.5).
- Retire el medio líquido 700A del tubo embrionario con una pipeta de 1 ml. Agregue el medio fresco 700A para lavar los embriones, luego retire ese medio también.
- Añadir 1 mL de la suspensión Agrobacterium y vórtice en un ajuste bajo (3/10) para 30 s o invertir el tubo 12x-15x para mezclar. Deje que este tubo descanse horizontalmente en el banco durante 5 minutos.
- Después de 5 min, transferir todo el tubo de embriones y la suspensión de Agrobacterium a un plato de medio de cocultivo de 562V(Tabla 1). Esto se puede lograr colocando la placa en el banco y vertiendo rápidamente el contenido del tubo en la placa. Gire suavemente la placa para distribuir los embriones y retire la suspensión de Agrobacterium utilizando una pipeta de 1 ml.
- Asegúrese de que los embriones se colocan con el lado de scutellum (redondo) hacia arriba. Utilice una lupa o un endoscopio, si es necesario. Colocar las placas en cajas de plástico (19 cm x 28 cm x 5,1 cm) e incubar las placas durante 16-18 h a 21 oC en la oscuridad. No es necesario envolver placas individuales con película de parafina o cinta de ventilación.
- Después del cocultivo nocturno, mueva los embriones infectados, lado de escutellum hacia arriba, en el medio de reposo 605T(Tabla 1). Coloque alrededor de 30 embriones por placa. Incubar las placas a 26-28 oC en la oscuridad.
- Incubar durante 4-10 días (se prefiere 7 días). En este momento, el desarrollo de embriones somáticos se puede observar en la superficie del escutellum cigotico(Figura 3).
5. Selección, tratamiento térmico y regeneración
- Después del período de descanso, el calor amortigua los embriones. Colocar la caja que contiene las placas de los embriones en una incubadora de 45oC con una humedad relativa del 70% durante 2 h. A continuación, retire la caja de la incubadora de 45 oC y colóquela en la incubadora oscura de 26-28 oC durante 1-2 h.
NOTA: Si no puede alcanzar el 70% de humedad en una incubadora, agregue una doble capa de toallas de papel autoclave en la parte inferior de la caja de placas y remoje con agua autoclave para mantener la humedad dentro de la caja. Vuelva a colocar las placas en la caja situada enlaparte de las toallas de papel y cierre la tapa antes de colocarlas a 45 oC. Utilice un pequeño higrómetro/termómetro digital para controlar la temperatura y la humedad. - Transferir los IzEs tratados térmicamente del medio de reposo al medio de formación del brote (13329A) que contenga 0,05 mg/L imazapyr como agente selectivo (Tabla 1). Cuando se transfiera, retire los coleóptos, si están presentes, utilizando fórceps de punta fina o tijeras quirúrgicas.
- Coloque entre 10 y 15 embriones por placa para evitar el hacinamiento. Mantener los embriones en este medio durante 2 semanas en la incubadora oscura de 26oC.
- Transferir los embriones al medio de enraizamiento (13158; Tabla 1) durante 1-2 semanas. Colocar alrededor de ocho piezas por placa e incubar en una sala de luz o cámara de luz (16 días/8 noches, 20-150 émol/m2/s) a 27oC.
- A medida que se desarrollan las plantas, coloque plantitas más fuertes que contengan tanto brotes como raíces vigorosas en nuevas placas de medio de enraizamiento, coloque una planta por placa. Esto permitirá un crecimiento más fuerte de las plantas. Coloque las placas en la sala de luz o en la cámara de luz durante otros 7-14 días.
NOTA: Retire cuidadosamente cualquier pieza de callo asociada con el plantlet para asegurarse de que está en buen contacto con el medio. - A medida que la planta se vuelve más vigorosa, retire la planta del medio de enraizamiento y enjuague las raíces con agua del grifo para eliminar el agar.
- Trasplantar plantas individuales enmacetas de 3 en 2 (19 cm2)que contengan un sustrato sin suelo prehumedecido. Coloque las macetas en una bandeja (27 cm x 54 cm) con orificios de drenaje y cubra el plano con una cúpula de humedad plástica. Este paso de aclimatación se puede lograr en la cámara de crecimiento o en invernadero con las condiciones de crecimiento descritas en la sección 2 (paso 2.1) anterior.
6. Trasplante al invernadero y producción de semillas T1
- Revise las plantas 2 veces al día. Agua según sea necesario. Asegúrese de que las plantas no estén secas ni regadas en exceso. Mantener un sustrato ligeramente seco fomenta el crecimiento de la raíz.
NOTA: La cúpula de humedad se puede eliminar 4-7 días después del trasplante. Las plantas deben ser cultivadas en estas macetas pequeñas hasta que se hayan recuperado visiblemente de la tensión del trasplante al suelo. Esto debería tomar alrededor de 9-14 días. - Trasplante todo el tapón sin tierra y el plantlet en una olla de 1,5 galones (5,9 L). Mantener en el invernadero y el agua cuando el suelo se siente seco al tacto.
- Añadir un fertilizante de liberación controlada con N-P-K de 15-9-12 a la olla, que se puede incorporar a la mezcla de sustrato o aplicar a la superficie.
- Cuando los brotes de oído comiencen a emerger de la planta, use una bolsa de salparar para cubrir los brotes de oído. Asegúrese de utilizar una bolsa que sea semitransparente para que las sedas emergentes se puedan observar sin retirar la bolsa. La bolsa de brote permite la polinización controlada. Es importante embolsar siempre las bolos transgénicas.
- Después de que surjan las sedas (1-2 días), recorta las sedas emergidas a una longitud uniforme. Esto será unos 2,5 cm por debajo de la parte superior de las hojas de la cáscara. Utilice un par de tijeras limpias que hayan sido esterilizadas en 70% de etanol. Al recortar las sedas, un mechón uniforme se desarrolla al día siguiente para que se produzca polinización.
- Para la mayoría de los genotipos de maíz, el tiempo óptimo para la polinización es de 2-3 días después de la aparición de la tala o seda.
- Recoger el polen de la misma planta (si se autopolinizan) o de un tipo salvaje de la misma raza (si se cruza o se cruza).
- Recoger el polen en una bolsa de la tala y aplicarlo al mechón de seda de la planta T0. Si el polen es de una planta de tipo silvestre (no transgénica), coloque el polen en una bolsa de tala marrón claro. Si el polen es de una planta transgénica, coloque el polen en una bolsa de rayas verdes para indicar que el polen es transgénico.
- Siga los pasos 2.5-2.10 para los detalles de la polinización.
- Aproximadamente 2 semanas después de la polinización, retire las bolsas de tala de las orejas y deje que comience el secado. Para ayudar a secar, deje de regar la planta 21-25 días después de la polinización. También puede retirar las hojas de la cáscara para exponer la semilla. Esta práctica también ayuda a prevenir el moho.
- Alrededor de 45 días después de la polinización, cosechar semillas y almacenar en almacenamiento en frío a 4-12 oC.
Resultados
Aquí se muestra un protocolo paso a paso para la transformación genética mediada por Agrobacteriumde tres líneas de endogámica de maíz público (B73, Mo17 y W22) que han sido significativas en el campo de la genética del maíz. La transformación de las tres líneas endogámicas no pudo lograrse utilizando los protocolos convencionales de transformación del maíz5. La Figura 1 y la Figura 2 muestran los materiales de construcción y de partida, respectivamente, utilizados aquí. Las orejas generalmente se cosechan 9-12 días después de la polinización. Los Izes con longitudes que oscilan entre 1,5-2,0 mm son los mejores explantes para la transformación de este protocolo(Figura 2).
Ocho días después de la infección, ZsGreen-expresando embriones somáticos fueron visualizados bajo el canal GFP de un microscopio fluorescente (Figura 3). Los IME infectados fueron sometidos a tratamiento térmico 8 días después de la infección (pasos 5.1 y 5.2). Este tratamiento indujo la expresión de recombinación de CRE que extirpó los casetes de expresión Bbm, Wus2, crey ZsGreen flanqueados entre los dos sitios loxP (Figura 1). Los tejidos tratados térmicamente se cultivaron en el medio de formación de brotes que contenía el herbicida imazapyr para la selección de tejido transformado después de la eliminación del gen morfogénico.
Se observaron tejidos proliferantes con embriones maduradores o brotes de brotes resistentes a imazapyr alrededor de 3-4 semanas después de la infección(Figura 4). Algunos tejidos resistentes a imazapyr fueron negativos para ZsGreen, lo que sugiere que la escisión mediada por creprobablemente ocurrió en estos tejidos(Figura 4). Después de que los tejidos se movieron a medio de enraizamiento y incubación de luz, los brotes comenzaron a desarrollarse(Figura 5). Se cosecharon brotes de crecimiento saludable y vigoroso con raíces bien desarrolladas (Figura 5). Algunos tejidos parecían tener múltiples brotes(Figura 5E,F,G). Este tipo de regenerador "hierba" puede deberse a plantas clonales que tienen patrones idénticos de integración de transgenes. Se requiere un análisis biológico molecular para genotipo de estas plantas.
Las tres líneas endogámicas públicas respondieron bien utilizando este protocolo, así como la construcción utilizada en este trabajo. W22 produjo la mayor frecuencia de brotes resistentes a imazapyr, con una frecuencia de aproximadamente 14% (alrededor de 14 brotes transgénicos por cada 100 embriones inmaduros infectados). Tanto B73 como Mo17 produjeron alrededor del 4% de brotes transgénicos. Estas frecuencias indican todos los brotes transgénicos, incluyendo tanto plantas portadoras de genes morfogénicos como plantas con el gen morfogénico eliminado por la escisión mediada por CRE.

Figura 1: Representación esquemática de la región T-DNA del plásmido binario PHP81430. RB - borde derecho de T-DNA; loxP - sitio de destino de recombinación de CRE; Axig1pro:Wus2 - promotor inducible de auxina de maíz (Zm-Axig1) + Zm-Wus2 + terminador de maíz In2-1; Pltppro:Zm-Bbm - proteína fosfolípido sólido transferasa de maíz (Zm-Pltp) promotor + Zm-Bbm + arroz T28 terminador (Os-T28); Hsppro:cre - proteína de choque térmico de maíz 17.7 promotor (Zm-Hsp17.7) + cre recombinase gene + inhibidor de la proteína de patata II (pinII) terminador; Ubipro:ZsGreen - sorgo ubiquitina promotor/intrón (Sb-Ubi) + proteína fluorescente verde ZsGreen gene + terminador de ubiquitina de arroz (Os-Ubi); Cassette hra - sorghum acetolactase sintasa (Sb-Als) promotor + maíz Hra (Zm-Hra) gene + terminador pinII; LB - borde de ADN-T izquierdo; colE1, origen de replicación del plásmido ColE125; EspecificaciónR - gen resistente a la espectromicina aadA1 de Tn21 para la selección de bacterias26; Rep A,B,C - origen de replicación de pRiA4 de Agrobacterium rhizogenes27. Haga clic aquí para ver una versión más grande de esta figura.
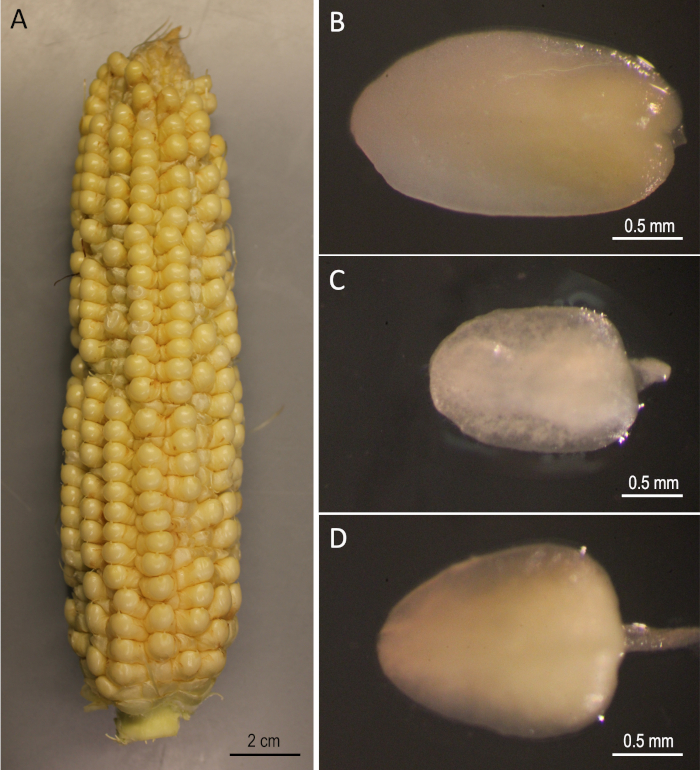
Figura 2: Materiales de arranque. B73 orejas cosechadas 12 días después de la polinización (A). Embriones inmaduros de B73 (B), Mo17 (C) y W22 (D). Haga clic aquí para ver una versión más grande de esta figura.
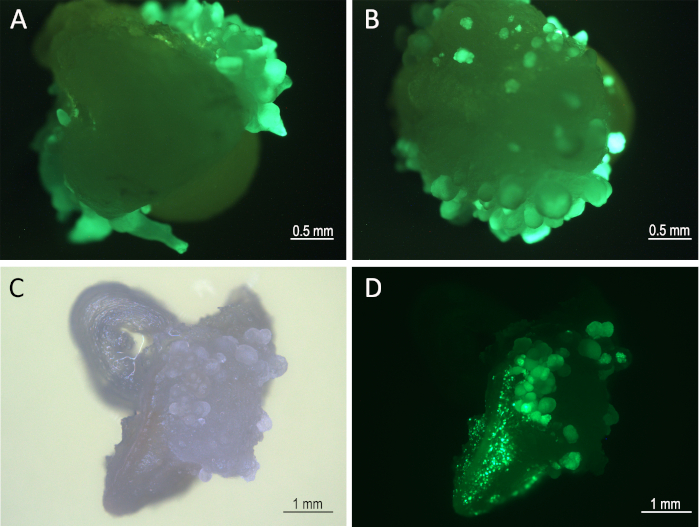
Figura 3: Desarrollo de tejidos en el medio de reposo 1 semana después de la infección. Embriones (8 días después de la infección) bajo un microscopio de florescencia (filtro GFP) que muestra GFP expresando embriones somáticos de Mo17 (A) y W22 (B). Tejido en desarrollo (B73) bajo campo brillante (C) y filtro GFP (D). Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Desarrollo de tejidos en medio de maduración con selección. Una placa de maduración W22 (A). Tejido en desarrollo (Mo17, 15 días después de la infección) bajo campo brillante (B) y filtro GFP (C). Tejido en desarrollo (Mo17, 28 días después de la infección) bajo campo brillante (D) y filtro GFP (E). Las flechas apuntan a la regeneración de tejidos que carecen de expresión GFP, lo que sugiere la escisión del gen ZsGreen entre los sitios loxP después de la actividad de proteína CRE inducida por el calor. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Desarrollo de tejidos en medios de enraizamiento. Disparos de W22 (A), B73 (B) y Mo17 (C,D). Evento con múltiples brotes (regenerantes herbáceos) de B73 (E) y W22 (F,G). Dispara con raíces de B73 (H) y W22 (I). Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Composiciones de medios para la transformación del maíz. Haga clic aquí para ver esta tabla (haga clic con el botón derecho para descargar).
Discusión
Los protocolos tradicionales para la transformación del maíz siguen el paradigma de aislar embriones cigoticos inmaduros para producir tejido caldo transgénico, que se regenera en plantas fértiles4,6. Si bien esto es eficaz, los protocolos basados en callos pueden llevar mucho tiempo, y a menudo toma hasta 3 meses para que el proceso de cultivo de tejidos produzca plantas. Lo que hace que el método presentado aquí sea significativo es que es libre de calus, eficiente, rápido, y permite la regeneración de plantas T0 en aproximadamente la mitad del período de tiempo. También parece ser menos dependiente del genotipo y, por lo tanto, puede ser eficaz para la mayoría de los endogámicos disponibles al público8,11.
Si bien todos los pasos deben seguirse de manera efectiva, es imperativo una preparación correcta de los medios de crecimiento. Los componentes de los medios de crecimiento deben añadirse en las etapas correctas, tanto antes como después del autoclave, para garantizar que el material vegetal reciba la concentración adecuada de productos químicos. Esto asegurará que los compuestos sensibles como los antibióticos no se descompongan. También es importante que el material vegetal se coloque en el medio de crecimiento correcto en cada etapa, como se indica en el protocolo. No colocar material en el medio de crecimiento adecuado puede resultar en la muerte material. Además, se debe evitar la colocación de demasiados embriones o el desarrollo de tejidos en las placas. Mientras que la colocación del doble de piezas de tejido puede ahorrar el costo de los productos químicos y los platos de Petri (e incluso el espacio de la incubadora), el crecimiento de tejido en placas superpobladas puede ser seriamente inhibido. Durante la realización de la infección, debe asegurarse de que la densidad óptica de la suspensión Debacterium es adecuada. Si la densidad de la suspensión bacteriana es demasiado baja, es posible que no se produzca una infección adecuada.
La calidad de los materiales de partida es esencial para el éxito en los protocolos de transformación. Las orejas utilizadas para la disección embrionaria deben ser saludables, lo que significa que la planta que los produce es saludable. También deben poseer un conjunto adecuado de semillas y estar libres de plagas y enfermedades. Además, no se debe utilizar Agrobacterium antiguo. El plato de "madre" no debe tener más de 2 semanas de edad. Después de este punto, una nueva placa "madre" debe ser rayada para comenzar nuevos experimentos.
Si bien se ha demostrado que este método es menos dependiente del genotipo, no se puede suponer que todas las líneas tendrán el mismo éxito. Todavía puede haber variación entre las líneas, así como diferencias en el éxito basadas en la construcción que se utiliza. La variabilidad de oído a oído también es inevitable cuando se trabaja con embriones inmaduros, por lo que lo ideal es que los experimentos usen múltiples orejas para explicar esto. En este trabajo, endogámico W22 tuvo el mejor desempeño, con una frecuencia de transformación superior al 14 %, seguido de B73 y Mo17 (4% cada uno). 8 informaron utilizando el protocolo QuickCorn para la transformación B73 y Mo17. En este trabajo, las frecuencias de transformación oscilaron entre 9%-50% para B73 y 15%-35% para Mo17.
Una posibilidad para las frecuencias de transformación más bajas para B73 y Mo17 observadas en este trabajo puede atribuirse a la fluctuación estacional de la calidad del oído. Otra diferencia entre este trabajo y el de Lowe et al.8 es que aquí se utilizaron diferentes construcciones vectoriales. En el trabajo de Lowe, los genes morfogénicos no fueron eliminados de las plantas transformadas, sino más bien silenciados en el desarrollo en las etapas posteriores. En este trabajo, los genes morfogénicos se eliminaron 8 días después de la infección. Es posible que B73 y Mo17 necesiten una presencia más larga de Bbm/Wus2 para el desarrollo de embriones somáticos.
Utilizando este método, existe la posibilidad de obtener plantas de escape no transgénicas, inserciones multiméricas y transgenes sin extirter. Estas plantas no tendrán un fenotipo notablemente diferente, por lo que se requiere la detección por PCR para determinar si una planta es transgénica. Para lograrlo, se pueden emplear imprimaciones de ITP dentro de la región extirpada y imprimaciones que flanquean la región extirpada. Múltiples transformaciones independientes también pueden producir plantas a partir del mismo embrión inmaduro, lo que dificulta la determinación de la tasa de recuperación transformadora independiente total. Nuestro estándar ha sido calcular una tasa de transformación basada en el muestreo de una planta de cada embrión inmaduro que produjo plantas y dividiendo esto por el número de embriones infectados. Este método casi con seguridad subestima el número real de eventos independientes recuperados como plantlets. La discriminación entre eventos independientes del mismo embrión requiere la secuenciación de regiones fronterizas alrededor de transgenes, y esto será prohibitivamente costoso y llevará mucho tiempo para la mayoría de las aplicaciones; sin embargo, puede haber casos en los que estos datos son útiles.
Este método de transformación del cultivo de tejidos ha demostrado ser muy eficaz, pero todavía pueden ocurrir problemas. Si el material vegetal no responde, es posible que haya un problema con la línea endogámica particular, lo que sugiere que variables como la composición de los medios de crecimiento y el momento de la subcultura requieren ajustes. Otra variable es el diseño vectorial adecuado y la construcción vectorial precisa, si se altera el vector original. También puede haber problemas con la sensibilidad imazapyr, ya que algunas líneas son más sensibles que otras, y la concentración de imazapyr puede necesitar ser ajustada para lograr plantas transformadas con éxito.
En los últimos 30 años, el cultivo de tejidos de maíz y los protocolos de transformación han cambiado y progresado; y se cree que este protocolo acortado promoverá esta progresión. Este método es eficaz para los entornos académicos porque consume menos tiempo que los métodos tradicionales. Además, no demanda operadores altamente capacitados, por lo que es más susceptible a una distribución generalizada en comparación con los métodos tradicionales. En el futuro, este método se puede combinar con nuevas tecnologías como la ingeniería del genoma.
Divulgaciones
Alicia Masters, William Gordon-Kamm y Todd Jones son empleados de Corteva Agriscience que suministraban el protocolo y las orejas de maíz de B73, Mo17 y W22 utilizados en este artículo. Los autores Minjeong Kang, Morgan McCaw, Jacob Zobrist y Kan Wang no tienen nada que revelar.
Agradecimientos
Agradecemos al equipo de invernadero de Corteva por proporcionar orejas inmaduras de maíz, el laboratorio de preparación de medios de Corteva para proporcionar asistencia en la fabricación de medios, Ning Wang de Corteva por ayuda con la construcción Debacterium, y Keunsub Lee de la Universidad Estatal de Iowa para obtener ayuda. Este proyecto fue apoyado parcialmente por el Programa de Investigación del Genoma Vegetal de la Fundación Nacional de Ciencias 1725122 y 1917138 a K.W., por el Programa de Prácticas de Investigación en Fenómica de Plantas Predictivas (National Science Foundation Grant DGE-1545453) a J.Z., por el proyecto NIFA Hatch del USDA #IOW04341, por fondos del Estado de Iowa, y por el Centro de Bioingeniería crop de la Universidad Estatal de Iowa.
Materiales
| Name | Company | Catalog Number | Comments |
| 2,4-D | Millipore Sigma | D7299 | |
| 6-Benzylaminopurine (BAP) | Millipore Sigma | B3408 | |
| Acetosyringone | Millipore Sigma | D134406 | |
| Agar | Millipore Sigma | A7921 | |
| Aluminum foil | To cover the flask | ||
| Ammonium Sulfate | Millipore Sigma | A4418 | |
| Analytical balance | To weigh small quantities of chemicals | ||
| Autocalve | Primus (Omaha, NE) | PSS5-K | To autoclave media and tools |
| Bacterial culture loop (10 µl) | Fisher scientific | 22-363-597 | Collects Agrobacterium from plate to transfer to liquid |
| Bactoagar | BD bioscience | 214030 | |
| Beakers (1 L, 2 L, 4 L) | To mix the chemicals for media | ||
| Benomyl | Millipore Sigma | #45339 | |
| Bleach (8.25% Sodium Hypochlorite) | Clorox | For seed sterilization | |
| Boric Acid | Millipore Sigma | B6768 | |
| Calcium Chloride Dihydrate | Millipore Sigma | C7902 | |
| Carbenicillin | Millipore Sigma | C3416 | |
| Casein Hydrolysate | Phytotech | C184 | |
| Cefotaxime | Phytotech | C380 | |
| Conical tube (50 mL) | Fisher scientific | 06-443-19 | Contain liquid medium and Agro suspension |
| Cuvette (Semi-micro) | Fisher scientific | 14955127 | To hold liquid for measuring OD |
| Dicamba | Phytotech | D159 | |
| Digital hygrometer | Checking temperature and humidity for heat treatment | ||
| EDTA, Disodium Salt, Dihydrate | Millipore Sigma | 324503 | |
| Eppendorf tube (2.0 mL) | ThermoFischer Scientific | AM12475 | |
| Eriksson's Vitamins | Phytotech | E330 | 1000x in liquid |
| Ethanol (70%) | Sterilizing tools and surfaces | ||
| Ferrous Sulfate Heptahydrate | Millipore Sigma | F8263 | |
| Fertilizer, Osmocote Plus 15-9-12 | ICL Specialty Fertilizers (Dublin, OH) | A903206 | Fertilizer |
| Flask (2 L) | Pyrex | 10-090E | To autoclave media and tools |
| Flats (Standard 1020, open w/holes, 11"W x 21.37"L x 2.44"D) | Hummert International (Earth City, Mo) | 11300000 | Tray to hold soil and pot insert, fits Humidome |
| Forceps (fine-tipped and large) | Fine for handling embryos; larger for large plant materials and use as ear holders | ||
| Gentamicin | Gold Biotechnologies | G-400 | |
| Glass bottle (1 L) | Pyrex | 06-414-1D | To autoclave medium |
| Graduated cylinder | To adjust volume of media | ||
| Imazapyr | Millipore Sigma | 37877 | |
| Incubator, 20 °C | Percival Scientific | Model I-36NL | To grow mother plate and incubate embryos during Agro infection |
| Incubator, 27 °C | Percival Scientific | Model I-36NL | To grow co-cultivation plate and maize embryo culture |
| Incubator, 45 °C | Heat shock treatment | ||
| Insert TO Standard, pots | Hummert International (Earth City, Mo) | 11030000 | For transplanting plants from rooting to soil, fits flat and Humidome |
| Laminar flow hood | Maintains sterile conditions | ||
| L-proline | Phytotech | P698 | |
| Magnesium Sulfate Heptahydrate | Millipore Sigma | M1880 | |
| Maize inbred seed B73 | U.S National Plant Germplasm | id=47638 | |
| Maize inbred seed Mo17 | U.S National Plant Germplasm | id=15785 | |
| Maize inbred seed W22 | U.S National Plant Germplasm | id=61755 | |
| Manganese Sulfate Monohydrate | Millipore Sigma | M7899 | |
| Milli-Q Water purification systems | Millipore sigma | MILLIQ | For tissue culture grade water |
| MS Basal Medium | Millipore Sigma | M5519 | |
| MS Basal Salt Mixture | Millipore Sigma | M5524 | |
| N6 Basal Salt Mixture | Millipore Sigma | C1416 | |
| Paperclips, non-skid | Holding on tassel bags | ||
| Peptone | BD bioscience | 211677 | |
| Petri dish (100x15 mm) | Fisher scientific | FB0875713 | For bacteria culture medium |
| Petri dish (100x25 mm) | Fisher scientific | FB0875711 | For the plant tissue culture medium |
| pH meter | Fisher scientific | AB150 | To adjust pH of media |
| Pipette (1 mL) | ThermoFischer Scientific | 4641100N | |
| Plastic Boxes | The Container Store | 10048430 | For tissue culture storage and incubation |
| Plastic humidy dome (Humi-Dome) | Hummert International (Earth City, Mo) | 14385100 | Plastic cover for soil flat |
| Potassium Iodide | Millipore Sigma | 793582 | |
| Potassium Nitrate | Millipore Sigma | P8291 | |
| Potassium Phosphate Monobasic | Millipore Sigma | P5655 | |
| Scale | To weigh chemicals for media | ||
| Scalpel Blade (No. 11, 4 cm) | Thermo Scientific | 3120030 | remove the top of the kernel crowns for embryo dissection |
| Scalpel handle | Holding scalpel blades | ||
| Schenk & Hildebrandt Vitamin (S&H vitamin) | Phytotech | S826 | 100x powder |
| Scissors | Cutting ear shoots | ||
| Shoot bag (Canvasback- semi-transparent) | Seedburo (Des Plaines, IL) | S26 | Semi-transparent bag to cover ear shoots |
| Silver Nitrate | Millipore Sigma | S7276 | |
| Sodium Molybdate Dihydrate | Millipore Sigma | M1651 | |
| Soiless substrate LC1 | SunGro Horticulture (Agawam, Ma) | #521 | For growing maize plants |
| Spatula (Double Ended Micro-Tapered) | Fischer Scientific | 2140110 | Dissecting embryos from kernels |
| Spatula (with spoon) | Fisher scientific | 14-375-10 | To measure chemicals for media |
| Spectinomycin | Millipore Sigma | S4014 | |
| Spectrophotometer (Genesys 10S UV-Vis) | Thermo Scientific | 840-300000 | Measure OD of Agro suspension |
| Stirring bar | Fisher scientific | 14-513-67 | To mix media |
| Stirring hotplates | To mix media | ||
| Syringe (without needle, 60 mL) | Fisher scientific | 14-823-43 | For filter sterilization |
| Syringe filter (0.22 µm) | Fisher scientific | 09-720-004 | For filter sterilization |
| Tassel bag (Canvasback- brown) | Seedburo (Des Plaines, IL) | T514 | Bag to cover tassels of non-transgenic plants |
| Tassel bag (Canvasback-green stripe) | Seedburo (Des Plaines, IL) | T514G | Bag to cover tassels of transgenic plants |
| Thiamine HCl | Phytotech | T390 | |
| Thidiazuron | Phytotech | T888 | |
| Thymidine | Millipore Sigma | T1895 | |
| Timentin | Phytotech | T869 | |
| Tween 20 | Fisher Scientific | Cas #9005-64-5 | surfactant |
| Vortex Genie 2 | Scientific Industries | SI0236 | Homogenizes liquids (Agro suspension) |
| Water bath (large - Precision model 186) | Fisher scientific | any that can fit 4+ 2L flasks and reach 55 °C | Keeps autoclaved media at optimal temperature |
| Weigh dish | Fisher scientific | 08-732-112 | To measure chemicals for media |
| Weighing paper | Fisher scientific | 09-898-12A | To measure chemicals for media |
| Yeast Extract | Fisher Scientific | BP14222 | |
| Zeatin | Millipore Sigma | Z0164 |
Referencias
- Zhao, Z. Y., et al. High throughput genetic transformation mediated by Agrobacterium tumefaciens in maize. Molecular Breeding. 8 (4), 323-333 (2002).
- Green, C. E., Phillips, R. L. Plant regeneration from tissue cultures of maize. Crop Science. 15 (3), 417-421 (1975).
- Ji, Q., Xu, X., Wang, K. Genetic transformation of major cereal crops. International Journal of Developmental Biology. 57, 495-508 (2013).
- Frame, B., Warnberg, K., Main, M., Wang, K., Wang, K. Maize (Zea mays, L). Agrobacterium Protocols. , 101-117 (2015).
- Frame, B., et al. Improved Agrobacterium-mediated transformation of three maize inbred lines using MS salts. Plant Cell Reports. 25 (1), 1024-1034 (2006).
- Que, Q., et al. Maize transformation technology development for commercial event generation. Frontiers in Plant Science. 5 (379), (2014).
- Lowe, K. S., et al. Morphogenic regulators Baby boom and Wuschel improve monocot transformation. The Plant Cell. 28 (9), 1998-2015 (2016).
- Lowe, K. S., et al. Rapid genotypes independent maize transformation via direct somatic embryogenesis. In Vitro Cellular & Developmental Biology - Plant. 54 (3), 240-252 (2018).
- Boutilier, K., et al. Ectopic expression of BABY BOOM triggers a conversion from vegetative to embryonic growth. The Plant Cell. 14 (8), 1737-1749 (2002).
- Zuo, J., Niu, Q. W., Frugis, G., Chua, N. H. The WUSCHEL gene promotes vegetative-to-embryonic transition in Arabidopsis. The Plant Journal. 30 (3), 349-359 (2002).
- Jones, T. J., Kumar, S., Barone, P., Smith, M., et al. Maize transformation using the morphogenic genes Baby Boom and Wuschel2. Transgenic Plants. , 81-93 (2019).
- Anand, A., et al. An improved ternary vector system for Agrobacterium-mediated rapid maize transformation. Plant Molecular Biology. 97 (1-2), 187-200 (2018).
- Ray, K., et al. Mutant acetolactate synthase gene is an efficient in vitro selectable marker for the genetic transformation of Brassica juncea (Oilseed Mustard). Journal of Plant Physiology. 161 (9), 1079-1083 (2004).
- Green, J. M., Hale, T., Pagano, M. A., Andreassi, J. L., Gutteridge, S. A. Response of 98140 corn with gat4621 and hra transgenes to glyphosate and ALS-inhibiting herbicides. Weed Science. 57 (2), 142-148 (2009).
- An, G., et al. Functional analysis of the 3' control region of the potato wound-inducible proteinase inhibitor II gene. The Plant Cell. 1 (1), 115-122 (1989).
- Matz, M. V., et al. Fluorescent proteins from nonbioluminescent Anthozoa species. Nature Biotechnology. 17 (10), 969-973 (1999).
- Passarinho, P., et al. Target Genes Provide Diverse Entry Points into Cell Proliferation and Cell Growth Pathways. Plant Molecular Biology. 68 (3), 225-237 (2008).
- Bhyri, P., Khrishnamurthy, N., Narayanan, E., Nott, A., Sarangi, R. R. Novel plant terminator sequences. Patent Number US2014/0130205. , (2014).
- Laux, T., Mayer, K. F., Berger, J., Jürgens, G. The WUSCHEL gene is required for shoot and floral meristem integrity in Arabidopsis. Development. 122 (1), 87-96 (1996).
- Garnaat, C., Lowe, K., Roth, B. Zm-AXIG1-specific polynucleotides and methods of use. Patent Number WO2002006499. , (2002).
- Hershey, H. P., Stoner, T. D. Isolation and characterization of cDNA clones for RNA species induced by substituted benzenesulfonamides in corn. Plant Molecular Biology. 17 (4), 679-690 (1991).
- Abremski, K., Hoess, R. Bacteriophage P1 site-specific recombination. Purification and properties of the Cre recombinase protein. Journal of Biological Chemistry. 259 (3), 1509-1514 (1984).
- Sun, A. Q., et al. Cloning and Function Analysis of Small Heat Shock Protein Gene ZmHSP17.7 from Maize. ACTA Agronomica Sinica. 41 (3), 414 (2015).
- Sauer, B., Henderson, N. Site-specific DNA recombination in mammalian cells by the Cre recombinase of bacteriophage P1. Proceedings of the National Academy of Sciences of the United States of America. 85 (14), 5166-5170 (1988).
- Hershfield, V., Boyer, H. W., Yanofsky, C., Lovett, M. A., Helinski, D. R. Plasmid ColEl as a molecular vehicle for cloning and amplification of DNA. Proceedings of the National Academy of Sciences of the United States of America. 71 (9), 3455-3459 (1974).
- Liebert, C. A., Hall, R. M., Summers, A. O. Transposon Tn21, flagship of the floating genome. Microbiology and Molecular Biology Reviews. 63 (3), 507-522 (1999).
- Nishiguchi, R., Takanami, M., Oka, A. Characterization and sequence determination of the replicator region in the hairy-root-inducing plasmid pRiA 4b. Molecular and General Genetics. 206 (1), 1-8 (1987).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados