Method Article
Agrobacterium- Посредника незрелых эмбрионов Преобразование непокорных кукурузы инбредных линий с использованием морфогенных генов
В этой статье
Резюме
Морфогенные гены растений могут быть использованы для улучшения генетической трансформации непокорных генотипов. Описано здесь Agrobacterium-опосредованногогенетической трансформации (Быстрый кукурузы) протокол для трех важных общественных кукурузы инбредных линий.
Аннотация
Здесь демонстрируется подробный протокол для Агробактерии-опосредованной генетической трансформации кукурузы инбредных линий с использованием морфогенных генов Baby boom (Bbm) и Wuschel2 ( Wuschel2 ). Bbm регулируется геном фосфолипидной передачи кукурузы(Pltp)промоутер, и Wus2 находится под контролем кукурузы auxin-индуцируемой (Axig1) промоутер. Штамм Agrobacterium, несущий эти морфогенные гены на передаче ДНК (T-DNA) и дополнительные копии вирулентности Agrobacterium (vir)генов используются для заражения незрелых эмбрионов кукурузы. Соматические эмбрионы образуются на скателле инфицированных эмбрионов и могут быть отобраны при устойчивости к гербицидам и прорастают в растения. Тепло-активированная система рекомбинации cre/loxP, встроенная в конструкцию ДНК, позволяет удалять морфогенные гены из генома кукурузы на ранней стадии процесса трансформации. Частоты трансформации примерно 14%, 4% и 4% (количество независимых трансгенных событий на 100 инфицированных эмбрионов) могут быть достигнуты для W22, B73 и Mo17, соответственно, с помощью этого протокола.
Введение
Трансформация является основным инструментом для оценки экспрессии иностранных генов в кукурузе и производства генетически модифицированных линий кукурузы как для научных исследований, так и для коммерческих целей. Доступ к высокой трансформации пропускной связи может облегчить повышенную потребность в молекулярной и клеточной биологии кукурузы исследований1. Способность к генетическим преобразованиям видов сельскохозяйственных культур имеет жизненно важное значение как для государственных, так и для частных лабораторий. Это позволяет как фундаментальному пониманию механизмов регулирования генов, так и улучшению урожая в глобальном масштабе для поддержки постоянно растущего населения.
Открытие, что незрелые эмбрионы из кукурузы могут быть использованы для производства regenerable каллуса возникла в 19752. После этого откровения, большинство масштабируемых протоколов преобразования кукурузы требуют формирования каллуса и отбора до регенерации3. В процессе генетической трансформации, Agrobacterium-инфицированныхили биолистных бомбардиров незрелых эмбрионов культивируются на носителях для эмбриональной индукции каллуса. Индуцированные калли затем культивируются на селективных носителей (например, содержащие гербицид), так что только преобразованные части каллуса способны выжить. Эти гербицид-устойчивые кондативные трансгенные калли ссыпаются и регенерируются в растения. Хотя этот метод является эффективным, процесс является длительным и трудоемким, и это может занять свыше 3 месяцев, чтобы завершить4. Что еще более важно, обычные протоколы преобразования кукурузы обладают гораздо большим ограничением, то есть только ограниченное количество генотипов кукурузы может быть преобразовано5,6.
Lowe et al.7,8 ранее сообщали о методе преобразования "Быстрый кукуруза", который не только значительно сократил продолжительность процесса трансформации, но и расширил список трансформируемых генотипов. Метод КвикКорн использует ортологовы кукурузы (Мм-Bbm и Мм-Wus2) из Arabidopsis транскрипционные факторы BABY BOOM (BBM)9 и WUSCHEL (WUS)10. При включении в систему переносицы трансформации, эти гены работают синергетически, чтобы стимулировать эмбриональный рост7.
Протокол Квиккорна, описанный в этой работе, был основан на протоколе в Jones et al11, который был дальнейшим улучшением метода, о котором сообщили Lowe et al7,8. В настоящем исследовании, штамм агробактерий LBA4404 (Thy-) укрывательство бинарный вектор построить PHP81430 (Рисунок 1) и аксессуар плазмиды PHP7153912 используются для преобразования. Т-ДНК PHP81430 содержит следующие молекулярные компоненты. (1) Преобразование селективного маркера гена Hra экспрессии кассеты. Кукуруза Hra (м-Гра) ген модифицированный ацетолактаз синтазы (ALS) ген, который терпим к БАС-ингибирующих гербицидов, таких как сульфонилурес и имидазолиноны13,14. Ген «М-Гра» регулируется промоутером сорго ALS8 и ингибитором картофеля протеиназы II(контактII) терминатором15. T-DNA также содержит (2) кассету выражения обладая геном экранизации преобразования screenable sGreen. Этот зеленый флуоресцентный ген белка SGreen от зоантовского рифового коралла16 регулируется промоутером сорго убиквитин/интроном и рисовым терминатором убиквитин.
Дополнительно, T-ДНК содержит (3) морфогенный ген Bbm экспрессия кассеты. Bbm является транскрипционным фактором, связанным с развитием эмбриона9,17. Bbm регулируется кукурузой фосфолипид трансферазы белка (Pltp) промоутер8 и риса T28 терминатор18. Мм-Pltp это ген с сильным выражением в эмбрионе scutellar эпителлий, шелковые волоски, и лист вспомогательных клеток (флангинг сторожевых клеток), низкое выражение в репродуктивных органах, и не выражение в корнях8. Он также содержит (4) морфогенный ген Wus2 экспрессии кассеты. Wus2 является еще одним фактором транскрипции, связанных с поддержанием апиического меритем19. М-Wus2 находится под контролем кукурузы auxin-индуцируемого промоутера (м-Axig1)20 и кукурузы In2-1 терминатор21. Наконец, T-DNA содержит (5) систему рекомбинации cre-loxP. Ген cre recombinase22 находится под контролем белка теплового шока кукурузы 17.7 (Hsp17.7)23 промоутер и картофельный контактii терминатор. Два участка loxP (в той же ориентации)24 фланга четыре гена экспрессии кассеты, включая SGreen, cre, Bbm и Wus2.
Поскольку наличие морфогенных генов не является желательным для зрелости растений и последующего потомства, тепло-индуцированной системы рекомбинации cre-loxP была встроена в Т-ДНК, чтобы удалить морфогенные гены из генома кукурузы, чтобы нормальное регенерации каллуса и развития растений. При тепловой обработке экспрессия белка CRE удаляет все трансгены, за исключением гена отбора hra. Успешные трансформаторы должны быть устойчивыми к гербицидам, но sGreen-отрицательным. Для дальнейшего повышения частоты трансформации, штамм Agrobacterium также гавани дополнительный аксессуар плазмид (PHP71539), который имеет дополнительные копии Agrobacterium вирулентности (вир) генов12.
Метод «КвикКорн» отличается от обычных протоколов преобразования кукурузы, так как он не предполагает шага индукции во время преобразования. В течение первой недели после заражения агробактериями,соматические эмбрионы развиваются на скателларе эпителия инфицированных незрелых эмбрионов. Эмбрионы затем передаются в среду с гормонами, которые способствуют созреванию эмбриона и образованию побегов. Быстро перенос соматических эмбрионов на созревание / стрелять формирования среды пропускает традиционный этап каллуса ранее используется для преобразования кукурузы и позволяет прямое поколение T0 растений8. По сравнению с ранее опубликованными методами преобразования кукурузы6,метод QuickCorn быстрее, эффективнее и менее зависим от генотипа. Используя этот метод, корневые растения, как правило, готовы к переходу в почву всего за 5-7 недель, а не через три или более месяцев, требуемых традиционными протоколами. Цель юных статей состоит в том, чтобы предоставить подробное описание и демонстрацию метода, что позволяет легче тиражировать в лабораторных условиях, как правило, в большинстве академических учреждений.
протокол
1. Подготовка средств массовой информации роста
- Для точного роста средних рецептов для этого протокола, пожалуйста, обратитесь к таблице 1.
- Для подготовки 1 L средств массовой информации, место 2 L стакан на перемешать пластины и место перемешать бар внутри.
- Заполните стакан 900 мл дистиллированной воды и включите перемешать пластины. Перемешивания бар должен вращаться со средней скоростью.
- Взвесьте все порошкообразные ингредиенты и растворите в стакане.
- Измерьте все жидкие ингридиенты, если любые, и добавьте к стакану.
- Доведите окончательный объем до 1 Л с использованием дистиллированной воды.
- Измерьте рН и приспособите к спецификациям рецепта.
- При формулах жидкой среды роста, агар не добавляется. Прикрепите фильтр стерилизатора к вакуумному насосу и залить жидкость среды роста через фильтр. Включите насос и подождите, пока вся жидкость вытащится. Поместите крышку на контейнер и прикрепите этикетку.
- При формулировании твердой среды роста, после pH регулируется, добавить агар непосредственно в бутылку или колбу.
- Налейте 1 L жидкости роста среды в 2 L Erlenmeyer колбу, или разделить его на две 1 L autoclavable бутылки (500 мл каждый). Если используются две бутылки, разделить агар и добавить непосредственно в бутылки.
- Обложка колбу с дышащий крышкой, такие как два слоя алюминиевой фольги, чтобы пара бежать. При использовании бутылки, свободно крышка крышка винта на вершине.
- Автоклав при 121 градусов по Цельсию в течение 25 мин.
- После автоклавирования, удалить среду роста от автоклава и охладить до 55-60 градусов по Цельсию (водяная ванна установлена до 55 градусов по Цельсию может сделать это проще). Держите медиум роста в жидком состоянии в течение нескольких часов, пока не будет удобно залить тарелки.
- После охлаждения, добавить все после стерилизации добавки (см. таблицу 1) и тщательно перемешать.
- После того, как все ингредиенты добавляются, залить назначенный объем в контейнер выбора в ламинарный капот потока.
- Среда роста может быть вылита в желаемые блюда Петри вручную или с помощью жидкого дозирующего аппарата. При заливке вручную рекомендуется перевести большой объем автоклавированной среды в меньший стерильный стакан (500 мл) для удобства обработки.
- Дайте среднему росту охладиться и укрепиться.
- Среда роста будет доступна для использования, как только становится твердой и лучше всего использовать на следующий день после высыхания немного на ночь в стерильных капота потока, как стеки крышкой пластин. После ночной сушки, передать пластины в пластиковые рукава, сложить над свободным концом, и держать это на месте с небольшим количеством ленты. Это предотвращает чрезмерную сушку. Средний может храниться в прохладной, темной и чистой среде (4-16 градусов по Цельсию) в течение 1 месяца.
2. Выращивание растений-доноров и сбор незрелых ушей
- Выращивайте любые общедоступные породы кукурузы (т.е. B73, Mo17 или W22) в теплице в 1,5 галлонах (5,9 л) горшках, содержащих безпочвенный субстрат. Используйте 16/8 (день /ночь) фото период, со средней температурой 25.5 C в течение дня и 20 градусов по Цельсию ночью.
- Растения поливают по мере необходимости и удобряют контролируемым удобрением (N-P-K 15-9-12), которые могут быть либо включены в почвенную смесь, либо добавлены к поверхности после посадки.
- Это обычно занимает около 70-90 дней после прорастания семян для ушей, чтобы выйти. Как ухо побеги возникают, покрыть их стрелять мешок, чтобы предотвратить неконтролируемое опыление от происходящих.
- Примерно через 2-3 дня после появления шелка, и если пыльца будет доступна на следующий день, вырезать шелк с помощью ножниц, которые были стерилизованы в 70% этанола. Вырезать шелк и шелуху примерно на 2,5 см ниже конца листьев шелки, где появляются шелки. Опыление может быть выполнено на следующий день. Будьте уверены, чтобы восстановителей ножницы между каждым ухом.
- Как только anthers выйти из кисточки, накройте кисточку с кисточкой мешок и не-скид скрепки у основания мешок вокруг стебля.
- На следующее утро, осторожно согнуть растение снова и нажмите мешок, чтобы поощрять пыльцу, чтобы быть освобождены.
- Удалите мешок кисточки и сложите верхнюю часть мешка, чтобы предотвратить побег пыльцы. Это, как правило, лучше мешок кисточкой 1 день, прежде чем он будет использоваться (чтобы избежать накопления мертвой пыльцы и пролить пыльники). Свежую пыльцу можно собирать из кистей около 3-5 дней. Когда пыльники выходят из внутренних соцветий в основании кисточки, что кисточка, скорее всего, не производят жизнеспособной пыльцы на следующий день.
- Используйте пыльцу из того же растения (селфи) или с другого растения того же инбредного (сиббинга).
- Снимите ушную мешок или вырежьте конец мешка, чтобы разоблачить шелк, затем быстро залить пыльцу из кисточки мешок на шелк.
- Обложка ухо с кисточкой мешок немедленно и основной базы мешок вокруг стебля, чтобы обеспечить его. Это может быть полезно, чтобы физически изолировать растение от цветущих растений различных генотипов во время опыления, чтобы помочь предотвратить перекрестное опыление. Оставьте мешок кисточки на ухо, пока незрелые ухо будет готово к сбору урожая.
- 9-12 дней после опыления, экран ные уши для размера эмбриона. Сдвиньте мешок опыления вверх по стебле, чтобы разоблачить ухо. Аккуратно потяните шелуху вниз, чтобы разоблачить ядра примерно на одну треть до одной четверти окружности уха и около одной трети расстояния вниз по уху. Ядра возле кончика не будут репрезентативными для среднего размера эмбриона.
- Используя скальпель, отрежьте крышку одного ядра, который выглядит похожим на большинство других ядер по размеру и цвету.
- Используйте шпатель (с линейкой), чтобы удалить эмбрион, как описано в шаге 4.6. Измерьте длину эмбриона с помощью встроенной линейки на шпателе или цифрового калибра. Если эмбрион находится между 1,5-2,0 мм, урожай уха. Если это 1,3 мм, ухо может быть готово к сбору урожая позже в тот же день и может быть проверено еще раз примерно в 7-8 ч.
3. Подготовка агробактерии суспензии культуры для инфекции
ПРИМЕЧАНИЕ: Штамм agrobacterium LBA4404 (Thy-), содержащий PHP81430(Рисунок 1) и PHP7153912 хранится в виде глицерола при -80 градусов по Цельсию. Эти материалы можно получить в Компании Corteva Agriscience в рамках соглашения о передаче материалов. LBA4404 (Thy-) является auxotrophic штамм, который нуждается в тимидин поставляется в средствах роста. Основная полезность штамма auxotroph Agro предназначена для целей биосодержания. Это имеет дополнительное преимущество сокращения разрастания Агро. Аотрофный штамм Агро не растет без дополнительного тимидина. Тем не менее, тимидин может (предположительно) быть поставлены умирающих тканей растений в культуре. Таким образом, по-прежнему необходимо обеспечить антибиотик в среде, чтобы полностью контролировать auxotrophic Agro. Тем не менее, это будет легче контролировать из-за скомпрометированного роста auxotrophic штамма при отсутствии тимидина.
- За четыре дня до даты заражения, инициировать "мать" пластины из глицерола фонда, полос бактерий на пластине YP с 50 мг / л тимидин, 50 мг / л гентамицин, и 50 мг / л спектриномицина (Таблица 1). Инкубировать «материнскую» тарелку в инкубаторе 20 градусов по Цельсию в течение 3 дней.
- За день до инфекционного эксперимента подготовьте «рабочую» пластину, выбрав от одной до пяти колоний из «материнской» пластины и перебросив бактерии из «материнской» пластины в новую пластину YP (с тимидином, гентамицином и спектриномицином; Таблица 1).
- Полоса ежедневно "рабочие" пластины в последовательных квадрантов и запустить петлю 1x через только что полосатый области в последовательный квадрант, повторяя образки квадрантов, которые были последовательно разбавлены. Инкубировать "рабочую" пластину на ночь в инкубаторе 27 градусов по Цельсию.
- После завершения вскрытия эмбриона (шаг 4.8), используйте петлю или аналогичный инструмент для сбора агробактерии из области "рабочей" пластины, где рост бактерий виден как тонкие полосы колоний.
ПРИМЕЧАНИЕ: Избегайте участков пластины с плотным газоном бактериального роста. Рост агробактерий, вероятно, уже начал снижаться в густонаселенных районах, в то время как в районах с видимыми колониями бактерии находятся в надлежащей фазе роста инфекции. - Приостановить собранные бактерии в 50 мл трубки, содержащей 10 мл 700A жидкой среде (Таблица 1). Vortex приостановить культуры бактерий полностью.
- Измерьте оптическую плотность на длине волны 550 нм. Отрегулируйте громкость до тех пор, пока OD не будет соответствовать 0,35-0,45, при этом оптимальным значением является 0,4.
ПРИМЕЧАНИЕ: Если OD выше 0,45, добавьте больше жидкостной среды 700A. Если ОД ниже 0,35, привить больше агро колоний в культуре подвески.
4. Вскрытие эмбрионов, инфекция и совместное культивирование
- Выберите подходящие уши для экспериментов по преобразованию; они должны иметь хороший набор семян и эмбрионы, которые варьируются в размерах от 1,5-2,0 мм. Они обычно собирают между 9-12 дней после опыления. Собранные уши можно использовать свежими или хранить в течение 1-4 дней при 4 градусах По Цельсию, хотя качество реакции, скорее всего, постепенно ухудшится при длительном хранении после первого дня.
- Удалите шелуху и шелк. Вставьте ручку в основание или верхнюю часть уха. Ручка может быть парой щипц, отверткой и т.д.
- Поместите уши в большой контейнер (например, 2 л стакана с ручкой вверх, заполните контейнер раствором дезинфекции. Раствор для дезинфекции составляет 1,8 л из 20% коммерческого отбеливателя (1,65% гипохлорит натрия) и пары капель сурфактанта Tween 20.
- Стерилизовать уши внутри ламинарной скамейки потока. После 20 минут, опорожнить раствор отбеливателя и промыть уши 3x (5 мин каждый) с помощью щедрого количества стерильной дистиллированной воды. Снимите воду и дайте ушам высохнуть в течение нескольких минут.
ПРИМЕЧАНИЕ: Важно, чтобы уши были полностью погружены в раствор отбеливателя в течение 20 мин. Переместите уши осторожно вокруг в растворе отбеливателя время от времени выбить пузырьки воздуха. - Подготовьте микроцентрифугную трубку размером 2 мл, наполненную жидкой средой 700А. Эта трубка будет использоваться для сбора незрелых эмбрионов.
- Возьмите ухо и с помощью стерильного скальпеля, удалить верхние 1-2 мм коронок ядра подвергать эндосперма. Используйте микро-шпатель для удаления незрелого зиготического эмбриона .). Изе будет расположен в ядре, на стороне, обращенной к кончику уха, и рядом с креплением к подошве. Используя шпатель, вставьте его в эндосперм в перикарп дальше от эмбриона, затем осторожно скрутить вверх, чтобы выбить эндосперма и позволяют удаление эмбриона (Рисунок 2).
- Используя шпатель, перенесите эмбрион в трубку, содержащую жидкостную среду 700A. Продолжайте делать это до тех пор, пока не будет собрано до 100 эмбрионов. Несколько труб может быть заполнено (100 эмбрионов / трубки), прежде чем приступить к следующему шагу. На этом этапе должна быть подготовлена приостановка агробактерий (см. шаг 3.5).
- Удалить 700A жидкой среде из эмбриона трубки с 1 мл пипетки. Добавить свежие 700A среды для мытья эмбрионов, а затем удалить, что средства массовой информации, а также.
- Добавьте 1 мл суспензии agrobacterium и вихря на низкой настройке (3/10) для 30 с или инвертировать трубку 12x-15x для смешивания. Разрешить эту трубку, чтобы отдохнуть горизонтально на скамейке в течение 5 минут.
- После 5 мин, перенесите всю трубку эмбрионов и Agrobacterium подвески на пластину 562V со-культивирования среды (Таблица 1). Это может быть достигнуто путем размещения пластины на скамейке и быстро заливки содержимого трубки на пластину. Аккуратно закружайте пластину, чтобы распределить эмбрионы и удалить agrobacterium подвески с помощью 1 мл пипетки.
- Убедитесь, что эмбрионы помещаются с scutellum (круглый) стороны лицом вверх. При необходимости используйте увеличительное стекло или рассекающий область. Поместите тарелки в пластиковые ящики (19 см х 28 см х 5,1 см) и инкубировать пластины на ночь 16-18 ч при 21 градусов по Цельсию в темноте. Никакая индивидуальная обертка пластины с использованием парафина пленки или вентиляционной ленты не требуется.
- После ночного совместного культивирования, переместить инфицированных эмбрионов, scutellum вверх, на отдых среднего 605T (Таблица 1). Поместите около 30 эмбрионов на тарелку. Инкубировать пластины при 26-28 градусов по Цельсию в темноте.
- Инкубировать в течение 4-10 дней (7 дней является предпочтительным). В это время на поверхности зиготического скутеля можно наблюдать развитие соматических эмбрионов(рисунок 3).
5. Отбор, термальная обработка и регенерация
- После периода отдыха тепловой шок эмбрионов. Поместите коробку, содержащую пластины эмбрионов, в инкубатор 45 градусов с 70% относительной влажностью в течение 2 ч. Затем снимите коробку с инкубатора 45 градусов по Цельсию и поместите в темный инкубатор 26-28 градусов по Цельсию на 1-2 ч.
ПРИМЕЧАНИЕ: Если не в состоянии достичь 70% влажности в инкубаторе, добавить двойной слой автоматических бумажных полотенец в нижней части пластины поле и замочить с автоклавированной водой для поддержания влажности в коробке. Вернуть тарелки в коробку поверх бумажных полотенец и запечатать крышку перед размещением при 45 градусах Цельсия. Используйте небольшой цифровой гигрометр/термометр для мониторинга температуры и влажности. - Перенесите теплообработанные ИЗе из среды отдыха в среду формирования побега (13329A), содержащую 0,05 мг/Л imazapyr в качестве селективного агента(Таблица 1). При передаче, удалить колеоплиты, если присутствует, используя штраф наконечник щипцы или хирургические ножницы.
- Поместите 10-15 эмбрионов на тарелку, чтобы избежать перенаселенности. Держите эмбрионы в этой среде в течение 2 недель в темном инкубаторе 26 градусов по Цельсию.
- Перенос эмбрионов на укоренение (13158; Таблица 1) в течение 1-2 недель. Поместите около восьми штук на тарелку и инкубировать в светлой комнате или световой камере (16 день /8 ночь, 20-150 моль/м2/с) при 27 градусах Цельсия.
- По мере развития растительных растений, поместите более сильные растения, содержащие как побеги, так и энергичные корни, на новые пластины укоренения среды, поместите по одному растению на тарелку. Это позволит обеспечить более сильный рост растений. Поместите пластины в светлую комнату или световую камеру еще на 7-14 дней.
ПРИМЕЧАНИЕ: Тщательно удалите любые каллусы, связанные с растительной, чтобы убедиться, что он находится в хорошем контакте со средой. - По мере того как завод будет более ядреным, извлеките завод от укоренения среды и промыть корни с водой крана для того чтобы извлечь агар.
- Переплануните отдельные растения на3 в2 горшки, содержащие предварительно увлажненный безпочвы субстрат. Поместите кастрюли в лоток (27 см х 54 см) с дренажными отверстиями и накройте квартиру пластиковым куполом влажности. Этот шаг акклиматизации может быть достигнут либо в камере роста, либо в теплице с условиями роста, описанными в разделе 2 (шаг 2.1) выше.
6. Пересадка в теплицу и производство семян Т1
- Проверьте растения 2 x в день. Вода по мере необходимости. Убедитесь, что растения не высохнут и не переполнились. Поддержание слегка сухого субстрата способствует росту корней.
ПРИМЕЧАНИЕ: Купол влажности можно удалить через 4-7 дней после пересадки. Растения должны быть выращены в этих небольших горшках, пока они не заметно оправился от стресса трансплантации в почву. Это должно занять около 9-14 дней. - Пересадите всю безпочву вилку и саженец в 1,5 гал (5,9 л) горшок. Поддержание в теплице и воде, когда почва чувствует себя сухой на ощупь.
- Добавьте в кастрюлю контролируемое удобрение с N-P-K 15-9-12, которое может быть либо включено в смесь субстрата, либо нанесено на поверхность.
- Когда ухо побеги начинают выходить из завода, использовать стрелять мешок, чтобы покрыть ухо побеги. Обязательно используйте полупрозрачный мешок, чтобы можно было наблюдать за появлением шелка без снятия сумки. Стрелять мешок позволяет для контролируемого опыления происходит. Важно всегда мешок трансгенных кистей.
- После появления шелка (1-2 дня) обрезать вытежки шелка до равномерной длины. Это будет примерно на 2,5 см ниже верхней части листьев шелухи. Используйте пару чистых ножниц, которые были стерилизованы в 70% этанола. Путем обрезки шелка, равномерное пучок развивается на следующий день для опыления произойти.
- Для большинства генотипов кукурузы оптимальное время для опыления – 2-3 дня после появления кисточки или шелка.
- Сбор пыльцы либо из того же растения (если быть самоопыхать) или от дикого типа же инбредных (если outcrossing или incrossing).
- Соберите пыльцу в мешок с кисточкой и нанесите ее на пучок шелка растения Т0. Если пыльца из дикого типа (нетрансгенного) растения, поместите пыльцу в простой коричневый мешок кисточкой. Если пыльца из трансгенного растения, поместите пыльцу в зеленый полосатый мешок, чтобы показать, что пыльца трансгенных.
- Выполните шаги 2.5-2.10 для получения подробной информации о опыления.
- Примерно через 2 недели после опыления, удалить кисточкой мешки из ушей, и позволяют сухой вниз, чтобы начать. Чтобы помочь высохнуть, прекратите поливать растение через 21-25 дней после опыления. Вы также можете отодвинуть листья шелухи, чтобы разоблачить семена. Эта практика также помогает предотвратить плесень.
- Примерно через 45 дней после опыления, урожай семян и хранить в холодном хранении при 4-12 градусах Цельсия.
Результаты
Демонстрация здесь является пошаговым протоколом для Агробактерии-опосредованной генетической трансформации трех публичных линий кукурузы (B73, Mo17 и W22), которые были значительными в области генетики кукурузы. Трансформация трех инбредных линий не может быть достигнута с помощью обычных протоколов преобразования кукурузы5. На рисунке 1 и рисунке 2 показаны конструкция и исходные материалы, соответственно, используемые здесь. Уши, как правило, собирают через 9-12 дней после опыления. ИКЕ с длиной от 1,5 до 2,0 мм являются лучшими примерами для преобразования для этого протокола(рисунок 2).
Через восемь дней после заражения, SsGreen-выражениесоматических эмбрионов были визуализированы под каналом GFP флуоресцентного микроскопа(рисунок 3). Через 8 дней после инфицирования (шаги 5.1 и 5.2) инфицированные ИКЕ подверглись тепловой обработке. Эта обработка индуцировала выражение recombinasa CRE которая excised Bbm, Wus2, cre, и кассеты выражения sGreen flanked между 2 местами loxP (Рисунок 1). Теплообработанные ткани затем культивировались на среде формирования побега, содержащей гербицид имазапир для выбора преобразованной ткани после удаления морфогенных генов.
Пролиферирующие ткани со созревающими эмбрионами или стрелять почки, которые были устойчивы к imazapyr наблюдались около 3-4 недель после инфекции(Рисунок 4). Некоторые имазапир-устойчивые ткани были отрицательными для SGreen, предполагая, что cre-опосредованного иссечения, вероятно, произошло в этих тканях (Рисунок 4). После того, как ткани были перенесены на укоренение средней и легкой инкубации, побеги начали развиваться(рисунок 5). Здоровые и энергичные растущие побеги с хорошо развитыми корнями были собраны(рисунок 5). Некоторые ткани, как представляется, несколько побегов(Рисунок 5E,F, G). Этот тип "травяной" регенерант может быть связано с клональными растениями, имеющими идентичные модели трансгенной интеграции. Молекулярный биологический анализ необходим для генотипа этих растений.
Все три общедоступные инбредные линии хорошо отреагировали, используя этот протокол, а также конструкцию, используемую в этой работе. W22 производил самую высокую частоту имазапир-резистентных побегов, с частотой примерно 14% (около 14 трансгенных побегов на 100 инфицированных незрелых эмбрионов). Как B73, так и Mo17 произвели около 4% трансгенных побегов. Эти частоты указывают на все трансгенные побеги, включая оба растения, несущие морфогенные гены, и растения с морфогенным геном, удаленным при опосредованном иссечении CRE.

Рисунок 1: Схематическое представление области Т-ДНК двоичной плазмиды PHP81430. RB - правая граница Т-ДНК; локсП и целевой участок рекомбиназы CRE; Axig1pro:Wus2 - кукуруза auxin-индуцируемая промоутер (зм-Axig1) Pltppro:Мм-Ббм - кукуруза фосфолипидный трансферазный белок(Мм-Плтп)промоутер - м-Ббм - рис T28 терминатор (Os-T28); Hsppro:cre й кукурузный белок теплового шока 17.7 промоутер(Зм-Hsp17.7) Ubipro:SGreen и сорго убиквитин промоутер / интрон (Sb-Ubi) - зеленый флуоресцентный белок sGreen гена риса убиквитин терминатор (Ос-Уби); Hra кассета и сорго ацетолактазы синтазы (Sb-Als) промоутер й кукуруза Hra (м-Хра) гена pinII терминатор; LB - левая граница T-ДНК; colE1, репликация происхождения плазмидного ColE125; СпецРР . спектромицин устойчивый ген aadA1 от Tn21 для выбора бактерий26; Rep A,B,C - репликация происхождения из pRiA4 из agrobacterium rhizogenes27. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
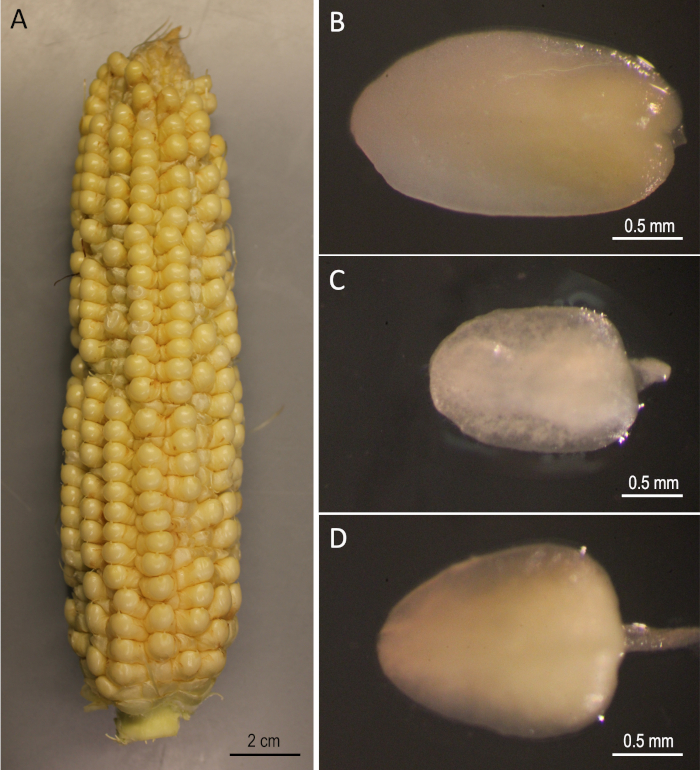
Рисунок 2: Начальные материалы. B73 уши собраны 12 дней после опыления(A). Незрелые эмбрионы B73 (B), Mo17 (C), и W22 (D). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
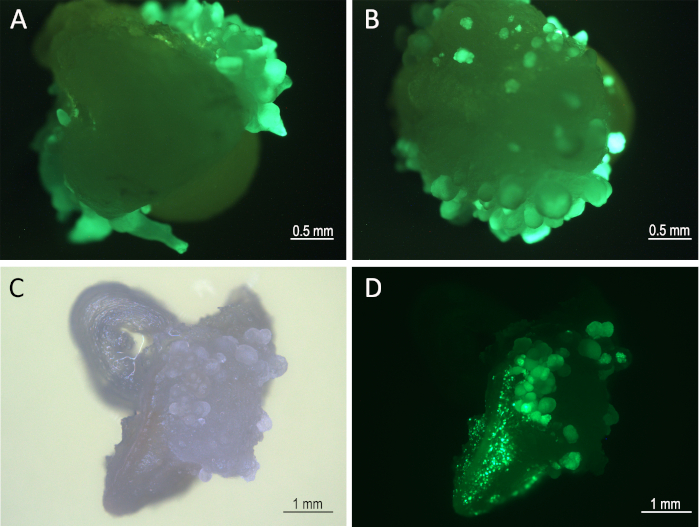
Рисунок 3: Ткань развития на отдых еврея хитовой 1 неделя после инфекции. Эмбрионы (8 дней после инфекции) под цветочным микроскопом (GFP фильтр), показывающий GFP, выражающий соматические эмбрионы Mo17(A)и W22(B). Разработка тканей (B73) под ярким полем(C)и GFP фильтром(D). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 4: Ткань развития на созревание среды с выбором. Пластина созревания W22(A). Разработка тканей (Mo17, 15 дней после инфицирования) под ярким полем(B)и GFP фильтром(C). Разработка тканей (Mo17, 28 дней после инфицирования) под ярким полем(D)и GFP фильтром(E). Стрелки указывают на регенерацию тканей, которые не имеют экспрессии GFP, предполагая иссечение гена SGreen между участками loxP после тепло-индуцированной активности белка CRE. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 5: Разработка тканей на укоренении носителей. Съемки W22 (A), B73 (B), и Mo17 (C,D). Событие с несколькими побегами (травянистые регенеранты) Из B73 (E) и W22(F,G). Побеги с корнями B73(H)и W22(I). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Таблица 1: Медиа-композиции для преобразования кукурузы. Пожалуйста, нажмите здесь, чтобы просмотреть эту таблицу (Право нажмите, чтобы скачать).
Обсуждение
Традиционные протоколы для преобразования кукурузы следуют парадигме изоляции незрелых зиготических эмбрионов для производства трансгенной ткани каллуса, которая регенерируется в плодородные растения4,6. Хотя это эффективно, каллус-основанные протоколы могут быть требующими много времени, и это часто занимает до 3 месяцев для процесса культуры тканей для производства растений. Что делает представленный здесь метод значительным, так это то, что он без каллуса, эффективен, быстр и позволяет регенерацию растений T0 примерно за половину таймфрейма. Он также, как представляется, менее генотип-зависимых и, таким образом, может быть эффективным для большинства общедоступных инбредных8,11.
Хотя все шаги должны быть эффективно соблюдены, правильный рост подготовки средств массовой информации является обязательным. Компоненты носителей роста должны быть добавлены на правильных стадиях, как до, так и после автоклава, для обеспечения того, чтобы растительный материал получал надлежащую концентрацию химических веществ. Это гарантирует, что чувствительные соединения, такие как антибиотики, не разрушатся. Важно также, чтобы растительный материал помещался на правильную среду роста на каждом этапе, как указано в протоколе. Не размещение материала на надлежащей среде роста может привести к материальной смерти. Кроме того, следует избегать размещения слишком большого количества эмбрионов или развития тканей на пластинах. При размещении в два раза больше частей ткани может сэкономить стоимость химических веществ и Петри блюда (и даже инкубатор пространства), рост тканей в переполненных пластин может быть серьезно сдерживается. При выполнении инфекции, следует обеспечить, чтобы оптическая плотность подвески Agrobacterium является целесообразным. Если плотность бактериальной подвески слишком низкая, надлежащей инфекции не может произойти.
Качество исходных материалов имеет важное значение для успеха в протоколах трансформации. Уши, используемые для вскрытия эмбрионов, должны быть здоровыми, а это означает, что растение, которое их производит, является здоровым. Они также должны обладать адекватным набором семян и быть вредителями и болезнями. Кроме того, старый агробактерий не следует использовать. Табличка "мать" должна быть не более 2 недель. После этого момента, новая "мать" пластины должны быть полосатые, чтобы начать новые эксперименты.
Хотя этот метод был показан менее зависимым от генотипа, нельзя предположить, что все строки будут одинаково успешными. Там все еще могут быть различия между линиями, а также различия в успехе на основе конструкции используется. Вариабельность ухо-к-уху также неизбежна при работе с незрелыми эмбрионами, поэтому в идеале эксперименты должны использовать несколько ушей для учета этого. В этой работе, инбредный W22 показал лучшее, с частотой преобразования более 14%, а затем B73 и Mo17 (по 4%). Lowe et al.8 сообщили об использовании протокола квиккорна для преобразования B73 и Mo17. В этой работе частоты трансформации варьировались от 9%-50% для B73 и 15%-35% для Mo17.
Одна из возможностей для более низких частот преобразования для B73 и Mo17, наблюдаемых в этой работе, может быть связана с сезонными колебаниями качества уха. Еще одно различие между этой работой и работой Lowe et al.8 заключается в том, что здесь использовались различные векторные конструкции. В работе Лоу морфогенные гены не удалялись из преобразованных растений, а скорее замалчивались на более поздних стадиях. В этой работе морфогенные гены были удалены через 8 дней после заражения. Вполне возможно, что B73 и Mo17 может потребоваться более длительное присутствие Bbm/Wus2 для развития соматических эмбрионов.
Используя этот метод, существует возможность получения нетрансгенных растений побега, мультимерных вставок и неакцизных трансгенов. Эти растения не будут иметь заметно другой фенотип, поэтому обнаружение ПЦР требуется, чтобы определить, является ли растение трансгенным. Для этого могут быть использованы праймеры ПЦР в пределах выселенного региона и праймеры, обрамленные в вырезанном регионе. Несколько независимых преобразований могут также производить растения из одного и того же незрелого эмбриона, что затрудняет определение общего независимого коэффициента восстановления трансформаторов. Наш стандарт в том, чтобы вычислить скорость трансформации на основе выборки одного растения из каждого незрелого эмбриона, который производил растения, и разделять это на количество инфицированных эмбрионов. Этот метод почти наверняка недооценивает фактическое количество независимых событий, восстановленных в качестве растений. Дискриминация между независимыми событиями из одного и того же эмбриона требует секвенирования пограничных регионов вокруг трансгенов, и это будет непомерно дорого и отнимает много времени для большинства приложений; однако могут быть случаи, когда эти данные являются полезными.
Этот метод трансформации культуры тканей оказался очень эффективным, но проблемы все еще могут возникнуть. Если растительный материал не отвечает, возможно, что существует проблема с конкретной инбредной линии, предполагая, что такие переменные, как состав медиароста роста и сроки субкультирования требуют корректировки. Другой переменной является правильное векторное проектирование и точная векторная конструкция, если первоначальный вектор изменен. Там также могут быть проблемы с чувствительностью imazapyr, так как некоторые линии являются более чувствительными, чем другие, и концентрация imazapyr, возможно, потребуется настроить для достижения успешно преобразованных растений.
За последние 30 лет культура и протоколы преобразования тканей кукурузы изменились и продвинулись вперед; и считается, что этот сокращенный протокол будет способствовать этому прогрессу. Этот метод эффективен для академических параметров, поскольку он занимает меньше времени, чем традиционные методы. Кроме того, она не требует высококвалифицированных операторов, что делает его более приемлемым для широкого распространения по сравнению с традиционными методами. В будущем этот метод может быть объединен с новыми технологиями, такими как геномная инженерия.
Раскрытие информации
Алисия Мастерс, Уильям Гордон-Камм и Тодд Джонс являются сотрудниками Corteva Agriscience, которые предоставили протокол и кукурузные уши B73, Mo17 и W22, используемых в этой статье. Авторам Минчжон Кану, Моргану Маккоу, Джейкобу Зобристу и Кану Вану нечего раскрывать.
Благодарности
Мы благодарим тепличную команду Corteva за предоставление кукурузы незрелые уши, Corteva медиа-подготовители лаборатории для оказания помощи в создании средств массовой информации, Нин Ван из Corteva за помощь в строительстве агробактерий, и Keunsub Ли из Университета штата Айова за помощь. Этот проект был частично поддержан Национальным научным фондом фонда исследования генома растений программа Грант 1725122 и 1917138 к KW, по прогнозированию растений феномика исследований программы (Национальный научный фонд Грант DGE-1545453) в J.З., по USDA NIFA Hatch проекта #IOW04341, государство Айова средств, и по биоинженерии центра штата Айова.
Материалы
| Name | Company | Catalog Number | Comments |
| 2,4-D | Millipore Sigma | D7299 | |
| 6-Benzylaminopurine (BAP) | Millipore Sigma | B3408 | |
| Acetosyringone | Millipore Sigma | D134406 | |
| Agar | Millipore Sigma | A7921 | |
| Aluminum foil | To cover the flask | ||
| Ammonium Sulfate | Millipore Sigma | A4418 | |
| Analytical balance | To weigh small quantities of chemicals | ||
| Autocalve | Primus (Omaha, NE) | PSS5-K | To autoclave media and tools |
| Bacterial culture loop (10 µl) | Fisher scientific | 22-363-597 | Collects Agrobacterium from plate to transfer to liquid |
| Bactoagar | BD bioscience | 214030 | |
| Beakers (1 L, 2 L, 4 L) | To mix the chemicals for media | ||
| Benomyl | Millipore Sigma | #45339 | |
| Bleach (8.25% Sodium Hypochlorite) | Clorox | For seed sterilization | |
| Boric Acid | Millipore Sigma | B6768 | |
| Calcium Chloride Dihydrate | Millipore Sigma | C7902 | |
| Carbenicillin | Millipore Sigma | C3416 | |
| Casein Hydrolysate | Phytotech | C184 | |
| Cefotaxime | Phytotech | C380 | |
| Conical tube (50 mL) | Fisher scientific | 06-443-19 | Contain liquid medium and Agro suspension |
| Cuvette (Semi-micro) | Fisher scientific | 14955127 | To hold liquid for measuring OD |
| Dicamba | Phytotech | D159 | |
| Digital hygrometer | Checking temperature and humidity for heat treatment | ||
| EDTA, Disodium Salt, Dihydrate | Millipore Sigma | 324503 | |
| Eppendorf tube (2.0 mL) | ThermoFischer Scientific | AM12475 | |
| Eriksson's Vitamins | Phytotech | E330 | 1000x in liquid |
| Ethanol (70%) | Sterilizing tools and surfaces | ||
| Ferrous Sulfate Heptahydrate | Millipore Sigma | F8263 | |
| Fertilizer, Osmocote Plus 15-9-12 | ICL Specialty Fertilizers (Dublin, OH) | A903206 | Fertilizer |
| Flask (2 L) | Pyrex | 10-090E | To autoclave media and tools |
| Flats (Standard 1020, open w/holes, 11"W x 21.37"L x 2.44"D) | Hummert International (Earth City, Mo) | 11300000 | Tray to hold soil and pot insert, fits Humidome |
| Forceps (fine-tipped and large) | Fine for handling embryos; larger for large plant materials and use as ear holders | ||
| Gentamicin | Gold Biotechnologies | G-400 | |
| Glass bottle (1 L) | Pyrex | 06-414-1D | To autoclave medium |
| Graduated cylinder | To adjust volume of media | ||
| Imazapyr | Millipore Sigma | 37877 | |
| Incubator, 20 °C | Percival Scientific | Model I-36NL | To grow mother plate and incubate embryos during Agro infection |
| Incubator, 27 °C | Percival Scientific | Model I-36NL | To grow co-cultivation plate and maize embryo culture |
| Incubator, 45 °C | Heat shock treatment | ||
| Insert TO Standard, pots | Hummert International (Earth City, Mo) | 11030000 | For transplanting plants from rooting to soil, fits flat and Humidome |
| Laminar flow hood | Maintains sterile conditions | ||
| L-proline | Phytotech | P698 | |
| Magnesium Sulfate Heptahydrate | Millipore Sigma | M1880 | |
| Maize inbred seed B73 | U.S National Plant Germplasm | id=47638 | |
| Maize inbred seed Mo17 | U.S National Plant Germplasm | id=15785 | |
| Maize inbred seed W22 | U.S National Plant Germplasm | id=61755 | |
| Manganese Sulfate Monohydrate | Millipore Sigma | M7899 | |
| Milli-Q Water purification systems | Millipore sigma | MILLIQ | For tissue culture grade water |
| MS Basal Medium | Millipore Sigma | M5519 | |
| MS Basal Salt Mixture | Millipore Sigma | M5524 | |
| N6 Basal Salt Mixture | Millipore Sigma | C1416 | |
| Paperclips, non-skid | Holding on tassel bags | ||
| Peptone | BD bioscience | 211677 | |
| Petri dish (100x15 mm) | Fisher scientific | FB0875713 | For bacteria culture medium |
| Petri dish (100x25 mm) | Fisher scientific | FB0875711 | For the plant tissue culture medium |
| pH meter | Fisher scientific | AB150 | To adjust pH of media |
| Pipette (1 mL) | ThermoFischer Scientific | 4641100N | |
| Plastic Boxes | The Container Store | 10048430 | For tissue culture storage and incubation |
| Plastic humidy dome (Humi-Dome) | Hummert International (Earth City, Mo) | 14385100 | Plastic cover for soil flat |
| Potassium Iodide | Millipore Sigma | 793582 | |
| Potassium Nitrate | Millipore Sigma | P8291 | |
| Potassium Phosphate Monobasic | Millipore Sigma | P5655 | |
| Scale | To weigh chemicals for media | ||
| Scalpel Blade (No. 11, 4 cm) | Thermo Scientific | 3120030 | remove the top of the kernel crowns for embryo dissection |
| Scalpel handle | Holding scalpel blades | ||
| Schenk & Hildebrandt Vitamin (S&H vitamin) | Phytotech | S826 | 100x powder |
| Scissors | Cutting ear shoots | ||
| Shoot bag (Canvasback- semi-transparent) | Seedburo (Des Plaines, IL) | S26 | Semi-transparent bag to cover ear shoots |
| Silver Nitrate | Millipore Sigma | S7276 | |
| Sodium Molybdate Dihydrate | Millipore Sigma | M1651 | |
| Soiless substrate LC1 | SunGro Horticulture (Agawam, Ma) | #521 | For growing maize plants |
| Spatula (Double Ended Micro-Tapered) | Fischer Scientific | 2140110 | Dissecting embryos from kernels |
| Spatula (with spoon) | Fisher scientific | 14-375-10 | To measure chemicals for media |
| Spectinomycin | Millipore Sigma | S4014 | |
| Spectrophotometer (Genesys 10S UV-Vis) | Thermo Scientific | 840-300000 | Measure OD of Agro suspension |
| Stirring bar | Fisher scientific | 14-513-67 | To mix media |
| Stirring hotplates | To mix media | ||
| Syringe (without needle, 60 mL) | Fisher scientific | 14-823-43 | For filter sterilization |
| Syringe filter (0.22 µm) | Fisher scientific | 09-720-004 | For filter sterilization |
| Tassel bag (Canvasback- brown) | Seedburo (Des Plaines, IL) | T514 | Bag to cover tassels of non-transgenic plants |
| Tassel bag (Canvasback-green stripe) | Seedburo (Des Plaines, IL) | T514G | Bag to cover tassels of transgenic plants |
| Thiamine HCl | Phytotech | T390 | |
| Thidiazuron | Phytotech | T888 | |
| Thymidine | Millipore Sigma | T1895 | |
| Timentin | Phytotech | T869 | |
| Tween 20 | Fisher Scientific | Cas #9005-64-5 | surfactant |
| Vortex Genie 2 | Scientific Industries | SI0236 | Homogenizes liquids (Agro suspension) |
| Water bath (large - Precision model 186) | Fisher scientific | any that can fit 4+ 2L flasks and reach 55 °C | Keeps autoclaved media at optimal temperature |
| Weigh dish | Fisher scientific | 08-732-112 | To measure chemicals for media |
| Weighing paper | Fisher scientific | 09-898-12A | To measure chemicals for media |
| Yeast Extract | Fisher Scientific | BP14222 | |
| Zeatin | Millipore Sigma | Z0164 |
Ссылки
- Zhao, Z. Y., et al. High throughput genetic transformation mediated by Agrobacterium tumefaciens in maize. Molecular Breeding. 8 (4), 323-333 (2002).
- Green, C. E., Phillips, R. L. Plant regeneration from tissue cultures of maize. Crop Science. 15 (3), 417-421 (1975).
- Ji, Q., Xu, X., Wang, K. Genetic transformation of major cereal crops. International Journal of Developmental Biology. 57, 495-508 (2013).
- Frame, B., Warnberg, K., Main, M., Wang, K., Wang, K. Maize (Zea mays, L). Agrobacterium Protocols. , 101-117 (2015).
- Frame, B., et al. Improved Agrobacterium-mediated transformation of three maize inbred lines using MS salts. Plant Cell Reports. 25 (1), 1024-1034 (2006).
- Que, Q., et al. Maize transformation technology development for commercial event generation. Frontiers in Plant Science. 5 (379), (2014).
- Lowe, K. S., et al. Morphogenic regulators Baby boom and Wuschel improve monocot transformation. The Plant Cell. 28 (9), 1998-2015 (2016).
- Lowe, K. S., et al. Rapid genotypes independent maize transformation via direct somatic embryogenesis. In Vitro Cellular & Developmental Biology - Plant. 54 (3), 240-252 (2018).
- Boutilier, K., et al. Ectopic expression of BABY BOOM triggers a conversion from vegetative to embryonic growth. The Plant Cell. 14 (8), 1737-1749 (2002).
- Zuo, J., Niu, Q. W., Frugis, G., Chua, N. H. The WUSCHEL gene promotes vegetative-to-embryonic transition in Arabidopsis. The Plant Journal. 30 (3), 349-359 (2002).
- Jones, T. J., Kumar, S., Barone, P., Smith, M., et al. Maize transformation using the morphogenic genes Baby Boom and Wuschel2. Transgenic Plants. , 81-93 (2019).
- Anand, A., et al. An improved ternary vector system for Agrobacterium-mediated rapid maize transformation. Plant Molecular Biology. 97 (1-2), 187-200 (2018).
- Ray, K., et al. Mutant acetolactate synthase gene is an efficient in vitro selectable marker for the genetic transformation of Brassica juncea (Oilseed Mustard). Journal of Plant Physiology. 161 (9), 1079-1083 (2004).
- Green, J. M., Hale, T., Pagano, M. A., Andreassi, J. L., Gutteridge, S. A. Response of 98140 corn with gat4621 and hra transgenes to glyphosate and ALS-inhibiting herbicides. Weed Science. 57 (2), 142-148 (2009).
- An, G., et al. Functional analysis of the 3' control region of the potato wound-inducible proteinase inhibitor II gene. The Plant Cell. 1 (1), 115-122 (1989).
- Matz, M. V., et al. Fluorescent proteins from nonbioluminescent Anthozoa species. Nature Biotechnology. 17 (10), 969-973 (1999).
- Passarinho, P., et al. Target Genes Provide Diverse Entry Points into Cell Proliferation and Cell Growth Pathways. Plant Molecular Biology. 68 (3), 225-237 (2008).
- Bhyri, P., Khrishnamurthy, N., Narayanan, E., Nott, A., Sarangi, R. R. Novel plant terminator sequences. Patent Number US2014/0130205. , (2014).
- Laux, T., Mayer, K. F., Berger, J., Jürgens, G. The WUSCHEL gene is required for shoot and floral meristem integrity in Arabidopsis. Development. 122 (1), 87-96 (1996).
- Garnaat, C., Lowe, K., Roth, B. Zm-AXIG1-specific polynucleotides and methods of use. Patent Number WO2002006499. , (2002).
- Hershey, H. P., Stoner, T. D. Isolation and characterization of cDNA clones for RNA species induced by substituted benzenesulfonamides in corn. Plant Molecular Biology. 17 (4), 679-690 (1991).
- Abremski, K., Hoess, R. Bacteriophage P1 site-specific recombination. Purification and properties of the Cre recombinase protein. Journal of Biological Chemistry. 259 (3), 1509-1514 (1984).
- Sun, A. Q., et al. Cloning and Function Analysis of Small Heat Shock Protein Gene ZmHSP17.7 from Maize. ACTA Agronomica Sinica. 41 (3), 414 (2015).
- Sauer, B., Henderson, N. Site-specific DNA recombination in mammalian cells by the Cre recombinase of bacteriophage P1. Proceedings of the National Academy of Sciences of the United States of America. 85 (14), 5166-5170 (1988).
- Hershfield, V., Boyer, H. W., Yanofsky, C., Lovett, M. A., Helinski, D. R. Plasmid ColEl as a molecular vehicle for cloning and amplification of DNA. Proceedings of the National Academy of Sciences of the United States of America. 71 (9), 3455-3459 (1974).
- Liebert, C. A., Hall, R. M., Summers, A. O. Transposon Tn21, flagship of the floating genome. Microbiology and Molecular Biology Reviews. 63 (3), 507-522 (1999).
- Nishiguchi, R., Takanami, M., Oka, A. Characterization and sequence determination of the replicator region in the hairy-root-inducing plasmid pRiA 4b. Molecular and General Genetics. 206 (1), 1-8 (1987).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены