Method Article
عزل القلب من القلب الثابتة للكيمياء المناعية وتحليل بلودي
In This Article
Summary
الهدف من هذا العمل هو تطوير طريقة لعزل عضلة القلب بشكل مستنسخ من القلب البالغ وقياس محتوى الحمض النووي والنية.
Abstract
يتكون قلب الثدييات البالغ من أنواع مختلفة من الخلايا بما في ذلك خلايا القلب والخلايا البطانية والضوباء الليفية. نظرًا لأنه من الصعب تحديد نواة من الخلايا القلبية القلبية بشكل موثوق في أقسام النسيج ، تعتمد العديد من المجموعات على عزل الخلايا القلبية القابلة للحياة قبل التثبيت لأداء المناعة. ومع ذلك ، تتطلب هذه التقنيات الحية عزل cardiomyocyte الأمثل لتحقيق أقصى قدر من العائد ، ومقومات البقاء وجودة العينات ، مع التقلبات المتأصلة من عينة إلى عينة على الرغم من أقصى الأمثل. هنا، ونحن تقرير بروتوكول استنساخها، التي تنطوي على تثبيت قبل الهضم الأنزيمي للقلب، مما يؤدي إلى أقصى عائد مع الحفاظ على مورفولوجيا في الجسم الحي من cardiomyocytes الفردية. لقد طورنا منصة تحليل آلية لتحديد عدد محتويات النوى والحمض النووي لكل نواة لـ cardiomyocytes الفردية. بعد فضح تجويف الصدر، تم القبض على القلب في دياستول عن طريق الضخ مع 60 م ك. ك. في برنامج تلفزيوني. بعد ذلك ، تم إصلاح القلب في محلول 4٪ شبهformaldehyde (PFA) ، ثم هضمه بمحلول كولاجين 60 ملغم /مليلتر. بعد الهضم، تم تفرد الخلايا عن طريق التثاب، وتم إثراء جزء القلب من خلال الطرد المركزي التفاضلي. كانت تلطخت أمراض القلب المعزولة لتروبونين تي α actinin لتقييم نقاء السكان الذين تم الحصول عليها. وعلاوة على ذلك، قمنا بتطوير منصة تحليل الصور لتحديد نواة القلب و ploidy حالة بعد تلطيخ DAPI. أدت التقييمات غير القابلة لل لتصوير النتائج إلى نتائج متسقة وقابلة للتكرار. وهكذا، مع هذا البروتوكول، فمن الممكن للحفاظ على مورفولوجيا أصلية من أمراض القلب الفردية للسماح للكيمياء المناعية وتحليل محتوى الحمض النووي مع تحقيق أقصى عائد.
Introduction
وقد أمراض القلب السبب الرئيسي للوفاة في معظم الدول الغربية لعقود عديدة1,2. على الرغم من أن العديد من التحسينات في علاج أمراض القلب والأوعية الدموية قد تحسنت البقاء على قيد الحياة, لا توجد حاليا أي علاجات يمكن أن تحل محل فقدان عضلة القلب. لذلك، كانت الدراسات المتعلقة بوظيفة cardiomyocyte، والانتشار، و المبرمج المبرمج والتضخم ولا تزال محور التركيز الرئيسي للمجتمع العلمي. منذ قلب الثدييات الكبار لديه قدرة تجديدية محدودة جدا، مع معدل تجديد القلب القلبية المقدرة من أقل من 1٪ سنويا، فمن المهم للغاية لتحديد موثوق الأحداث تكاثرية cardiomyocyte3،4. معظم الاستراتيجيات التي تقيس الأحداث الانتشارية تعتمد إما على تلطيخ التناسخ النووي المدمجة الحمض النووي لتقييم الانتشار السابق أو الحالي، أو وصمة عار للعلامات النووية للانتشار النشط5. من المهم بشكل خاص تحديد موثوق الأحداث التكاثرية cardiomyocyte منذ العدد الإجمالي للقلب التكاثري منخفض جدا3،6. على سبيل المثال ، استنادا إلى معدل تجديد 1 ٪ من القلب الذاتية في السنة ، يمكن للمرء أن يتوقع أن تجد بين 25 و 50 cardiomyocytes أن تكون تكاثرية في أي وقت من الأوقات في قلب الماوس الكبار7،8. قد تؤدي أي أخطاء في تحديد نواة القلب العضلي إلى نتائج إيجابية خاطئة. ولذلك، فمن الأهمية بمكان لتحديد موثوق نيوية cardiomyocyte، والتي ثبت أنها صعبة وغير موثوق بها من أقسام النسيج9. تحديد عضلة القلب هو أكثر دقة بكثير من الخلايا المفردة من أقسام الأنسجة كما أنه قد يكون من الصعب التمييز بين cardiomyocytes من أنواع الخلايا الأخرى حتى عند استخدام علامات مثل α-actinin، على الرغم من PCM1 قد يكون علامة موثوق بها من نيات cardiomyocyte في أقسام الأنسجة10.
تعتمد البروتوكولات الحالية على عزل الخلايا القلبية الحية قبل التثبيت ، والتي من المعروف أنها تسبب وفاة ما لا يقل عن 30٪ من الخلايا القلبية القلبية ، وقد تؤدي إلى اختيار غير مقصود لفئات محددة من الخلايا القلبيةالقلبية 11. وعلاوة على ذلك، فإن من المعروف أن من الصعب تحسين هذه البروتوكولات من أجل توفير نتائج قابلة للاستنساخ. حتى تقنيات العزل الأمثل يمكن أن تنتج عادة ما لا يزيد عن 65٪ حية، وقضبان على شكل cardiomyocytes مع غلة متفاوتة12.
للتغلب على هذه القضايا، وضعنا بروتوكولًا يسمح للباحثين بعزل عضلة القلب الثابتة. منذ يتم إصلاح العينات قبل العزل، يتم تعظيم العائد، ويتم الحفاظ على مورفولوجيا الجسم الحي بشكل جيد. وعلاوة على ذلك، مع هذا البروتوكول من الممكن لعزل cardiomyocytes من العينات السريرية، والتي عادة ما تكون ثابتة مباشرة بعد الشراء. وعلاوة على ذلك, لتحديد cardiomyocytes ولدت حديثا, من المهم لقياس nucleation والوضع ploidy من cardiomyocytes الفردية, منذ فقط يُفترض أن تكون قد تشكلت حديثاً. لا يمكن أن يميز قياس تدفق الشقوق بين تعدد النوى والبوليبلويد وهو بروتوكول طويل الوقت والموارد بشكل نسبي. إن تحديد وقياس النوى في الصور هو منخفض جداً وعرضة للتحيز البشري. الكم الآلي لصور ثابتة، معزولة DAPI الملون cardiomyocytes يحل كل من هذه المشاكل. ويمكن الحصول على تحديد التصوير القائم على النوى وتوزيعات غير مُنْحَة مع حد أدنى من الوقت والكواشف باستخدام المعدات الأساسية.
Protocol
وقد أجريت جميع التجارب الحيوانية وفقا للمبادئ التوجيهية المعاهد الوطنية للصحة ووافقت عليها جامعة مينيسوتا لجنة الرعاية الحيوانية المؤسسية (IACUC).
1. إعداد الحلول والمعدات الجراحية
- قبل العزل، تعقيم المعدات الجراحية باستخدام محلول الإيثانول 70٪.
- إضافة 2.24 غرام من KCl إلى 500 مل الفوسفات المخزنة المالحة (PBS) حل للحصول على تركيز النهائي من 60 مل. تخزين KCl-PBS حل في درجة حرارة الغرفة. استخدام 3 مل من KCl- برنامج تلفزيوني حل لكل ماوس.
- تمييع 32٪ شبهformaldehyde (PFA) حل مع برنامج تلفزيوني في الحصول على التركيز النهائي من PFA 4٪ . إعداد 10 مل من 4٪ PFA في برنامج تلفزيوني لكل فأرة. يمكن تخزين محلول PFA المخفف في 4 درجة مئوية لمدة 2-3 أسابيع في حاوية زجاجية.
ملاحظة: يمكن تخزين محلول PFA المعد بنسبة 4% عند -20 درجة مئوية لفترات زمنية أطول. - إعداد 1 مل من الحل collagenase لكل ماوس عن طريق إضافة 60 ملغ من collagenase، اكتب 2 لكل 1 مل من برنامج تلفزيوني.
2. perfusion و تثبيت القلب
- تخدير الحيوان باستخدام 2-5٪ isoflurane مع معدل تدفق الأكسجين من 1 لتر / دقيقة. تأكيد التخدير عن طريق التأكد من عدم وجود حركة وانخفاض معدل التنفس.
ملاحظة: حقن الهيبارين (100-500 U/kg) قبل القتل الرحيم يمكن أن يزيد من جودة الخلية والغلة عن طريق منع جلطات الدم، مما يسمح لضخ أكثر كفاءة للقلب مع المثبت. - القتل الرحيم الحيوان وفقا لمنهجيات المعتمدة.
ملاحظة: اتبعنا المبادئ التوجيهية للجمعية الطبية البيطرية الأمريكية للقتل الرحيم للحيوانات، وحصلنا على موافقة IACUC المحلية للقتل الرحيم. - وضع الحيوان القتل الرحيم في موقف supine، والشريط أسفل الأطراف الموسعة.
- قطع من خلال الصدر لفضح القلب باستخدام مقص نهاية حادة. قطع الشريان الأورطي التنازلي والوريد الوريدي السفلي.
- اثقب القلب عن طريق حقن 3 مل من محلول KCl-PBS من خلال البطين الأيسر بمعدل تدفق 3 مل/دقيقة باستخدام مضخة مُتعالِمة متصلة بضخة 23 غ من إبرة الفراشة (26 غ للولدان). تأكد من عدم اختراق الحاجز.
ملاحظة: بدلاً من ذلك، استخدم إبرة متصلة بحقنة لحقن الحلول. - Perfuse القلب عن طريق حقن 10 مل من 4٪ محلول PFA لمدة 10 دقيقة باستخدام مضخة ال peristaltic بمعدل 1 مل / دقيقة.
- إزالة القلب كله باستخدام مقص. بعد إزالة القلب ، من الممكن عزل منطقة معينة من القلب عن طريق التهز. وضع القلب، أو جزء منه في أنبوب 1.5 مل microcentrifuge التي تحتوي على 1 مل من 4٪ محلول PFA. احتضان القلب على الروك في درجة حرارة الغرفة مع سرعة هزاز بين 20-30 دورة في الدقيقة لمدة 1 ساعة.
3. عزل القلب الثابتة
- ضع القلب في طبق بيتري يحتوي على حل PBS. الضغط على القلب للتخلص من أي PFA المتبقية في البطينين، وغسل في برنامج تلفزيوني.
- وضع القلب الثابت في أنبوب جديد 1.5 مل microcentrifuge التي تحتوي على محلول الكولاجيناز (60 ملغ / مل). ضع الأنبوب على الروك (20-30 دورة في الدقيقة) عند 37 درجة مئوية للحضانة بين عشية وضحاها.
ملاحظة: تمديد فترة الحضانة تصل إلى 1 أسبوع وتجديد الحل collagenase كل يومين للحد من الاختلاف المحتمل في العائد إذا كان من المتوقع أن تكون القلوب ليفية، والتي قد تتطلب وقتا أطول من هضم الكولاجين للهضم الكولاجين خارج الخلية. - وضع حل الكولاجين والقلب في طبق بيتري 35 ملم. افصل القلب إلى قطع 1 ملم باستخدام ملقط أو مقص.
- استخدام ماصة نقل إلى مزيد من triturate الأنسجة المنفصلة لمدة 2 دقيقة. إذا كانت جزيئات الأنسجة لا تزال في الطبق، استخدم ماصة نقل مع فتحة أضيق ومواصلة التثاقل. استمر حتى يتم تقسيم معظم الأنسجة.
ملاحظة: يزيد التثابت يسبب cardiomyocytes الفردية لكسر. تأكد من عدم الإفراط في إعادة الturate عن طريق التحقق بانتظام تحت المجهر. - وضع شبكة نايلون 200-600 ميكرومتر على افتتاح أنبوب الطرد المركزي 15 مل.
ملاحظة: بالنسبة إلى عضلة القلب المتضخمة، يوصى باستخدام شبكة نايلون 400 ميكرومتر بدلاً من 200 ميكرومتر. - إضافة 5 مل من برنامج تلفزيوني إلى طبق بيتري التي تحتوي على الخلايا المنفصلة وتصفية الحل من خلال شبكة النايلون، بما في ذلك جزيئات الأنسجة. غسل شبكة النايلون عن طريق تمرير إضافية 4 مل PBS.
- الطرد المركزي الحل المصفاة في 10-100 س ز لمدة 1 دقيقة.
ملاحظة: 100 × ز الطرد المركزي لن تسفر عن 100٪ نقية cardiomyocyte السكان، وبعض الخلايا غير cardiomyocyte من المرجح أن تدرج. - تجاهل supernatant إلا إذا كان أحد يريد وصمة عار / تقييم الخلايا القلبية غير القلبية وكذلك. Resuspend بيليه في 10 مل PBS قبل تلطيخ.
4. تلطيخ القلب
- جمع الخلايا عن طريق الطرد المركزي في 100 س ز لمدة 1 دقيقة وإضافة 5 مل من حل permeabilization (على سبيل المثال، 0.5٪ تريتون X-100 في برنامج تلفزيوني). احتضان لمدة 20 دقيقة في درجة حرارة الغرفة على الروك.
ملاحظة: بالنسبة للخطوات 4.1 و 4.2 و 4.4 استخدام أنابيب أجهزة الطرد المركزي 15 مل كما أنه من الأسهل لإزالة افرنح دون إزعاج بيليه الخلية بالمقارنة مع أنابيب microcentuge 1.5 مل. - جمع الخلايا عن طريق الطرد المركزي في 100 س ز لمدة 1 دقيقة، إضافة 5 مل من العازلة حظر (على سبيل المثال، 3٪ البوم مصل البقر [BSA] في برنامج تلفزيوني) واحتضان لمدة 30 دقيقة في درجة حرارة الغرفة على الروك.
- جمع الخلايا عن طريق الطرد المركزي في 100 س ز لمدة 1 دقيقة وإضافة 1 مل من محلول الأجسام المضادة الأولية (في برنامج تلفزيوني) مع نسبة التخفيف المناسبة. نقل الحل إلى 1.5 مل microcentrifuge أنبوب وحضانة cardiomyocytes في حل الأجسام المضادة الأولية في ظل ظروف الأمثل (على سبيل المثال، 4 درجة مئوية بين عشية وضحاها).
- نقل cardiomyocytes مع حل الأجسام المضادة الأولية إلى أنبوب جهاز طرد مركزي 15 مل وإضافة 9 مل من برنامج تلفزيوني. احتضان القلب و 10 دقيقة في درجة حرارة الغرفة على الروك.
- جمع الخلايا عن طريق الطرد المركزي في 100 س ز لمدة 1 دقيقة وإضافة 10 مل من برنامج تلفزيوني. احتضان القلب و 10 دقيقة في درجة حرارة الغرفة على الروك. كرر هذه الخطوة مرة أخرى.
- جمع الخلايا عن طريق الطرد المركزي في 100 × ز لمدة 1 دقيقة وإضافة حل الأجسام المضادة الثانوية التي تحتوي على DAPI. احتضان لمدة 30 دقيقة في درجة حرارة الغرفة على الروك، تليها تكرار الخطوة 4.5 مرتين لغسل عضلة القلب.
- ضع الخلايا إما على الأغطية أو اللوحات المتوافقة مع المجهر وامضي في التصوير.
ملاحظة: تم التقاط الصور التي تضمنتها المخطوطة بأهداف 10x و40x. وكانت أشعة الليزر المستخدمة: 405 نانومتر لDAPI، 561 نانومتر لألفا أكتينين و 640 نانومتر لإدو.
5. برنامج التصوير الإعداد
ملاحظة: اتبع مع هذه الخطوات باستخدام الملف التكميلي 1-SoftwareScreenshots.pdf.
- تحميل توزيع فيجي من ImageJ.
- فتح فيجي. انقر على التعليمات > تحديث... > إدارة مواقع التحديث. تحقق من "IJPB -الإضافات" و "Biomedgroup" تحديث المواقع لتحميل التبعيات الإضافات سبليت Ellipse و Morpholibj.
- انقر فوق إغلاق. وينبغي لفيجي أن تبدأ في تنزيل التبعيات. إعادة تشغيل فيجي عند الانتهاء.
- تحميل Rstudio وفتحه.
- نسخ install.packages( ج ("ggplot2" ، "autothresholdr" ، "dplyr" ، "purrr" ، "jsonlite" ، "shiny")) في سطر الأوامر في وحدة التحكم R واضغط على مفتاح Enter. c اكتب "ص" استجابة لجميع المطالبات لتثبيت جميع تبعيات R (لقطة 1 في الملف التكميلي 1).
6. صورة كمية
- افتح فيجي واسحب "AnalyzeNucleation.py" (تم توفيره كملف رمز تكميلي) إلى شريط الحالة في فيجي. سيؤدي هذا إلى فتح إطار تحرير البرامج النصية. انقر فوق تشغيل في الزاوية اليسرى السفلى للبدء في ذلك (لقطة 2 في ملف تكميلي 1).
- مربع حوار يطفو علىالمنبثقة (ملف تكميلي 1: لقطة 3)، يسأل عن موقع دليل البيانات الإخراج. سيتم تخزين كافة بيانات التحليل، والأرقام، والبيانات الأخرى المستخدمة من قبل هذا البرنامج في هذا المجلد. مربع حوار آخر أكبر سوف يطفو على المنبثقة، وعرض جميع إعدادات تحليل الصور(ملف تكميلي 1: لقطة شاشة 4).
- حدد موقع الدليل الذي يحتوي على صور ليتم تحليلها.
- أدخل تنسيق اسم ملف الصورة باستخدام التعبيرات العادية. أدخل تنسيق اسم ملف الصورة، مع الإشارة إلى أجزاء اسم الملف التي تتوافق مع الصف والعمود والقناة والموقع (اختياريًا) داخل الأقواس، باستخدام التعبيرات العادية. لا تضع مسافات داخل الأقواس. إحاطة الأجزاء المتغيرة لتنسيق اسم الملف في أقواس {}. تعتمد طريقة حفظ الملفات على برنامج التصوير، وستسترد هذه الخطوة المعلومات ذات الصلة من اسم ملف الصورة.
ملاحظة: على سبيل المثال، سلسلة التنسيق
ص" لوحة 1-(؟ P[A-Za-z]+)(؟ P<العمود>[0-9]+)-(؟ P[A-Za-z]+).tif"
يصف اسم الملف الذي يبدأ بـ "لوحة 1-"، متبوعاً بحرف أبجدي واحد أو أكثر يشير إلى الصف، والذي يتبعه رقم أو أكثر يشير إلى العمود، والذي يتبعه "-"، والذي يتبعه حرف أو أكثر يشير إلى القناة، والذي يتبعه "tif". الحروف الموجودة داخل أقواس الزاوية مثل "<>" هي أسماء متغيرة ويتم نسخها تلقائيًا في البيانات عند تجميعها. يجب أن يكون أحد أسماء المتغيرات "" - الإشارة إلى اسم القنوات التي تكون فيها البقعة النووية مرئية وحيث تكون الخلايا القلبية مرئية. يجب أن تكون هذه الأسماء تماماً كما هي في الجزء المطابق بواسطة المتغير "" في أسماء ملفات التعبير العادية.
- حدد كيفية تجميع الصور باستخدام أسماء المتغيرات المفصولة بفواصل. سيتم فتح جميع الصور الموجودة ضمن مجموعة معينة وتحليلها في دفعة واحدة. على سبيل المثال، إذا كانت الصور مقسمة إلى مجموعات لكل بئر، وهناك بئر لكل تركيبة فريدة من الصف والعمود، ثم اكتب "صف، عمود" في هذا الحقل.
ملاحظة: يجب أن تكون هذه المتغيرات التجميع مجموعة فرعية من المتغيرات المستخدمة في سلسلة التنسيق. لا تستخدم "قناة" كمتغير تجميع، سيؤدي ذلك إلى فصل صور القناة المقابلة عن بعضها البعض. - قم بالإشارة إلى ما إذا كانت الصور مخيطه معاً في صورة واحدة جيداً أو منفصلة لكل موقع. في الحالة السابقة، لا يجب الإشارة إلى الموقع في سلسلة تنسيق اسم الملف.
- اختر طريقة العتبة التي يجب استخدامها لفصل النوى عن الخلفية. وجميع طرق تحديد العتبات القياسية في فيجي متاحة. اختبار أساليب مختلفة العتب لتحديد الذي يعمل بشكل أفضل لمجموعة الصور. في هذا المثال، اختر الأسلوب Otsu.
- حدد ما إذا كان يجب إعادة حساب العتبة لكل صورة موقع أو إذا كان يجب استخدام نفس الحد لكل صورة في المجموعة. الإشارة إلى ما إذا كانت صور القلب و القلب هي brightfield أو استخدام علامة الفلورسنت.
- الإشارة إلى طريقة عتبة cardiomyocyte. إذا تم اختيار الحقل الساطع في الخطوة السابقة، سيتم تطبيق أسلوب العتبة هذا على صور الحقول الساطعة التي تم تصفيتها من الحافة. حدد ما إذا كان يجب إعادة حساب العتبة لكل صورة موقع أو إذا كان يجب استخدام نفس الحد لكل صورة في المجموعة.
- حدد عدد صفوف صور الموقع التي تغطي كل بئر. حدد عدد أعمدة صور الموقع التي تغطي كل بئر. الإشارة إلى الحد الأدنى من المساحة من النوى في بكسل. استخدام حجم منخفض بسخاء، سيتم حساب عتبة أعلى وأكثر دقة في خطوة التحليل. الإشارة إلى الحد الأدنى من منطقة عضلة القلب.
- بعد اختيار الإعدادات المطلوبة انقر فوق موافق.
- ستظهر صور تشبه تلك الموجودة في الشكل 3 والشكل 4 على الشاشة، والتي تظهر المراحل المختلفة لخط أنابيب التحليل. فحص هذه الصور للتأكد من أن العتبة والتجزئة تحدث بشكل صحيح.
- يجب الآن أن يتم تعبئة مجلد النتائج المحددة مع بيانات التحليل(ملف تكميلي 1: لقطة شاشة 5). يمكن حفظ الملفات الأخرى غير بيانات التحليل بأمان في هذا المجلد طالما أن أسماءها لا تبدأ بـ "cm_" أو "nuclei_" أو "nucleilink_".
7 - تحليل البيانات
ملاحظة: يمكن تحليل ملفات csv التي يتم إنتاجها يدوياً. كل مجموعة فرعية من الصور المحللة تنتج ثلاثة أضعاف من ملفات csv المسماة "nuclei(بيانات التعريف).csv"، "nucleilink(بيانات التعريف).csv" و "cardiomyocytes(بيانات التعريف) csv" حيث يتم استبدال (بيانات التعريف) بسلسلة من أزواج القيمة الاسمية للنموذج "_(الاسم)=(القيمة)"، حيث (الاسم) و (القيمة) هي تسلسلات من الأحرف الأبجدية الرقمية المشتقة من السلاسل المتطابقة في التعبير العادي المعطى سابقاً. (على سبيل المثال، إذا تمت الإشارة إلى الصف والعمود في أسماء الملفات، فستكون هناك سلاسل مثل "_row= F" و"_column =8"). العمود الأيسر غير مسمى من كل ملف نوى وناوية هو رقم معرف نواة. العمود "مين" من ملف الانوكلين هو معرف القلبية التي تحتوي على نواة وقال كليا أو 0 خلاف ذلك. العمود "ماكس" من النوى هو معرف من أعلى مرقمة cardiomyocyte التي تحتوي على نواة قال في جزء منه، أو 0 خلاف ذلك. العمود "الوسط" لملف cardiomyocytes هو رقم معرف cardiomyocyte.
- فتح "AnalyzeMultinucleatedServer.R" في Rstudio (المقدمة كملف التعليمات البرمجية التكميلية).
- في الجزء العلوي من هذا الملف متغير يسمى "اسم المجلد". بجانب هو filepath. في هنا، اكتب المسار إلى مجلد بيانات الإخراج المحدد في الخطوة الأخيرة، دون أن يكون هناك خط مائل نهائي (ملف تكميلي 1: لقطة شاشة 6).
- في الزاوية اليسرى العليا من نافذة تحرير البرنامج النصي يجب أن يكون هناك سهم أخضر يسمى تشغيل التطبيق. انقر فوق هذا السهم. قد يستغرق الأمر بعض الوقت لتحميل البيانات وللتطبيق ليطفو.
- في البداية، ستكون ثلاثة رسوم بيانية مسورة مرئية، واحدة للإشارة إلى الحد الأدنى لعتبة المنطقة النووية الصالحة، واحدة للإشارة إلى الحد الأدنى لعتبة شدة الوسط النووي، وأخرى للإشارة إلى الحد الأقصى لقطر الحد الأدنى الصالح للزرار بالنسبة لـ cardiomyocyytes. استخدم أشرطة التمرير لتعيين هذه العتبات (ملف تكميلي 1: لقطة شاشة 7).
ملاحظة: في كل من هذه الرسوم البيانية، يجب أن تكون هناك ذروة كبيرة واسعة تقابل النياية أو الخلايا القلبية القلبية الصالحة، محاطة بذيل واسع يمثل الحطام أو الخلايا القلبية المجزأة الخاطئة. استخدام العتبات لقطع ذيل واحد من كل من قمم قبالة. - مرر لأسفل. انقر على زر تطبيق العتبات المحددة (أسفل الملف التكميلي 1: لقطة شاشة 7).
- انقر فوق زر توزيع كثافة الرسم. وهذا سيجعل من مخطط توزيع الكثافة النووية لكل من العينة الكاملة والأراضي الفرعية المنفصلة لكل متغير تجميعي.
ملاحظة: على سبيل المثال، إذا تم إدخال متغيرات التجميع في التعبير العادي في مربع الحوار فيجي، ستظهر هنا مخططات تشير إلى توزيع الكثافة حسب الصف وبعمود(الملف التكميلي 1: لقطة الشاشة 8). إذا كانت الإضاءة وظروف التلطيخ ثابتة عبر الأجزاء المختلفة من العينة ، فيجب أن تظهر جميع هذه المؤامرات بوضوح قمتين شديدتين ، باهتة ، أطول واحدة للنيات diploid وواحدة أكثر إشراقًا وأقصر للنيات رباعية ال وبعدل. - وسوف يؤدي الاختلاف داخل العينة في هذا النمط لا تكون مرئية في مؤامرة عينة كاملة وهناك وجود مجموعة كبيرة ومتنوعة في موقع القمم diploid و tetraploid بالصف، العمود، أو متغير تجميع آخر. في الحالة الأخيرة، قم بالتمرير لأسفل، حدد مربع الاختيار Normalizely بشكل منفصل حسب المجموعة لحساب هذا الاختلاف(الملف التكميلي 1: لقطة شاشة 9).
- انقر على زر حساب Ploidy (ملف تكميلي 1: لقطة شاشة 9). انقر فوق زر رسم توزيع بلويدي المقدر. ستظهر الرسوم البيانية في النوافذ الفارغة إلى اليمين. في الرسم البياني الكامل الذي تم تطبيعه، يجب أن يكون نمط الذروتين مرئيًا إذا لم يكن مرئيًا من قبل.
- حدد عتبات لعزل القمم diploid و tetraploid من كل منهما الآخر و outs باستخدام المتزلجون(ملف تكميلي 1: لقطة شاشة 9). مرر لأسفل. انقر على زر حساب Ploidy و Nucleation (ملف تكميلي 1: لقطة شاشة 10).
- انقر فوق زر رسم وحفظ في مجلد النتائج. سوف المؤامرة المحفوظة في مجلد النتائج المحددة تظهر أيضا في هذا الإطار التفاعلي(ملف تكميلي 1: لقطة شاشة 10).
النتائج
تم عزل عضلة القلب وفقا للبروتوكول المذكور أعلاه. باستخدام هذه الطريقة ، عادة ما نحصل على تفرد القلب بشكل موحد التي هي نقية نسبيا دون تلويث الخلايا غير cardiomyocyte (الشكل 1أ). يتم التعرف بسهولة على Cardiomyocytes تحت المجهر حقل مشرق نظرا لحجمها المميز و birefringence. هذه التقنية سهلة التنفيذ وتوفر نتائج متسقة من العزل المختلفة مع نتائج القلب مماثلة والجودة(الشكل 1ب). يمكن تخزين الخلايا القلبية المعزولة في 4 درجة مئوية لعدة أسابيع قبل استخدام المزيد.
يمكن استخدام أجهزة القلب التي تم عزلها وفقًا للبروتوكول أعلاه لتطبيقات المصب المختلفة ، مثل قياس حجم القلب والقلب و القلب و ploidy و المناعة للكيمياء. ونتيجة تمثيلية، فإننا نظهر أن عضلة القلب المعزولة وفقا لهذا البروتوكول يمكن أن تكون ملطخة باستخدام الأجسام المضادة وفلوروكروم-مترافق azides للكيمياء انقر للكشف عن توطين بروتينات محددة أو للكشف عن تكرار الحمض النووي cardiomyocyte، على التوالي. على سبيل المثال، نحن الملون cardiomyocytes مع الأجسام المضادة التعرف على α actinin لإظهار نمط تلطيخ Z-الخط المميزة من الساركوميريات (الشكل 2A). في تجربة منفصلة، قمنا بإدارة التناظرية thymidine 5-Ethynyl-2'deoxyuridine (EdU) إلى الفئران قبل عزل عضلة القلب الثابتة. بعد عزل cardiomyocyte، نحن ملطخة لEdU أدرجت باستخدام بروتوكولات القياسية13، وكانوا قادرين على الكشف عن cardiomyocytes التي خضعت لمرحلة S في أي أحادية الnucleated، binucleated وثلاثين نواة cardiomyocytes (الشكل 2B).
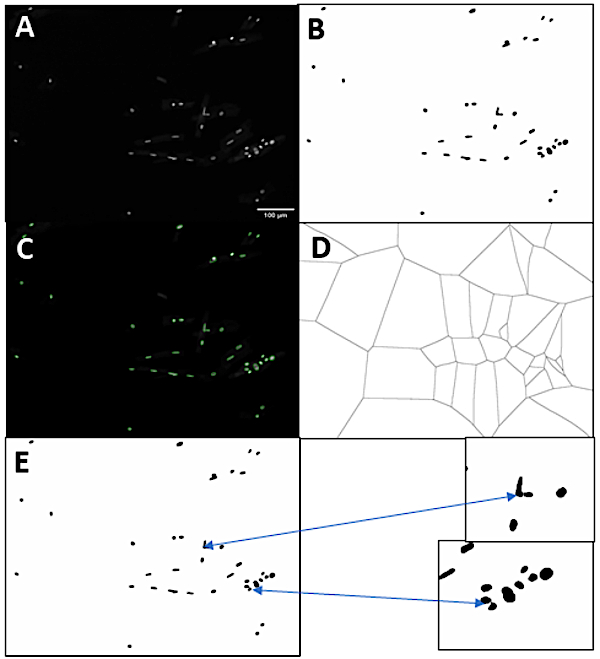
لزيادة توسيع فائدة طريقة العزل ، طورنا خط أنابيب يسمح بالتدميم الكمي للقلب العضلي اللويدي القائم على تلطيخ الحمض النووي المتكامل. لتكون قادرة على قياس حالة ploidy من الخلايا أو النوى، ونحن بحاجة إلى جزء النوى وococytes. ويبين الشكل 3 تمثيلاً للاستراتيجية التي استخدمناها لتحديد النوى الفردية. أولاً، الصورة الأصلية صورة الحمض النووي الملون (الشكل 3أ) هو العتبة على أساس كثافة (الشكل 3B). هنا، استخدمنا DAPI لطخة للحمض النووي، ولكن أي صبغة نووية أخرى التي تظهر ارتباط خطي مع محتوى الحمض النووي ستعمل. يسمح البرنامج باختيار أي من طرق الحد الأقصى في فيجي ، ولكن في هذا المثال تم استخدام طريقة Otsu. يتم استبعاد الأقنعة النووية التي تلمس حافة الصورة أو أصغر من الحد الأدنى المحدد لعتبة مساحة البكسل. ثم، علامات الحذف تناسب الأقنعة النووية، وتجزئة النوى الفردية. يوضح الشكل 3C هذه الحذف المتراكبة على الصورة الأصلية. بعد ذلك، يتم ملء الثقوب في الأقنعة، ثم يتم تقسيم بكسل الصورة إلى مناطق على أساس القطع الناقص التي هي معظم قريبة إلى (الشكل 3D). ثم تستخدم حدود هذه الأراضي لرسم خطوط من خلال المجموعات النووية، والانتهاء من عملية التجزئة النووية (الشكل 3هاء).
الخطوة التالية ينطوي على الكشف عن أمراض القلب. بالنسبة لصور cardiomyocyte التي يتم الحصول عليها على أساس الخلايا الملطخة بالفلورسنت(الشكل 4A)، فإن العملية مشابهة جدًا لتلك التي للنيات. يتم عتب الصورة استناداً إلى قيمة كثافة محسوبة بواسطة أسلوب العتبة المحدد، في هذه الحالة طريقة المثلث. يتم استبعاد أقنعة cardiomyocyte التي يتم تحديدها التي تم لمس حدود الصورة أو أقل من حجم معين ويتم تعبئة الثقوب في الأقنعة لتوفير تجزئة بشكل صحيح cardiomyocytes (الشكل 4B). لأن تكون لدى الخلايا القلبية شكلًا غير منتظم أكثر من النوى ، لم تتم أي محاولة لتجزئة مجموعات cardiomyocyte. بدلاً من ذلك، يتم استبعاد هذه المجموعات بناءً على قطرها الأدنى المرتفع فيريت خلال خطوة التحليل. يتم تجزئة من صور الحقل الساطعة بشكل مختلف قليلاً. أولاً، تتم معالجة صورة الحقل المشرق الأصلي(الشكل 4C)مع مرشح حافة سوبل. يقوم عامل التصفية هذا بحساب القيمة المطلقة لتدرج كل بكسل داخل الصورة. بكسل في المناطق مع التغيرات السريعة تلقي قيم عالية والبكسل في المناطق السلسة للصورة تلقي قيم منخفضة. ثم يتم عتب هذه الصورة التي تم تصفيتها بالحافة بالكثافة ، باستخدام طريقة المثلث ، مما يؤدي إلى وجود أجهزة cardiomyocytes ملثمين (الشكل 4D). ثم يتم تنعيم هذه الأقنعة غير النظامية للغاية وربطها ببعضها البعض عن طريق إغلاق شكلي باستخدام دائرة ذات دائرة نصف قطرها 2 بكسل، والتي تملأ جميع المناطق البيضاء في الصورة حيث لا يمكن أن تناسب الدائرة دون تداخل منطقة سوداء (الشكل 4E). وأخيرا، يتم تعبئة الثقوب في الأقنعة، والمناطق التي تلمس الحدود مستبعدة، ويتم إزالة الجسيمات الصغيرة، والانتهاء من عملية تجزئة cardiomyocyte (الشكل 4F).
باستخدام استراتيجية التجزئة المحددة، يمكننا بعد ذلك تحديد حالة نوية قلبيات القلب الفردية. باستخدام هذا النهج، حددنا حالة نوية عضلة القلب المعزولة من قلوب فئران CD-1 في وقت مبكر من نقاط ما بعد الولادة. وأظهرت قلوب الفئران حديثي الولادة (اليوم الأول من الحياة) أن غالبية عضلة القلب في تلك المرحلة أحادية النوى(الشكل 5: حديثي الولادة). هذا التردد العالي من القلب أحادية النواة هو أقل بكثير في الفئران الأحداث (2 أسابيع من العمر)، حيث القلب أحادية النواة تشكل حوالي 25٪ من مجموع السكان cardiomyocyte(الشكل 5: الأحداث). وأخيرا، يمكننا قياس حالة ploidy من النوى الفردية داخل cardiomyocytes، وتحديد ما إذا كانت diploid أو tetraploid. وتظهر هذه النتائج ارتفاع وتيرة النوى رباعية في الفئران المراهقين (الشكل 6).

الشكل 1: كفاءة عزل القلب العضلي بعد التثبيت. (أ) صورة تمثيلية من cardiomyocytes معزولة ملطخة DAPI لإظهار نوات. (DAPI (أزرق)، برايتفيلد (رمادي)) (ب) العائد من cardiomyocytes معزولة عن الفئران المختلفة في 3 أشهر من العمر. أشرطة المقياس = 50 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
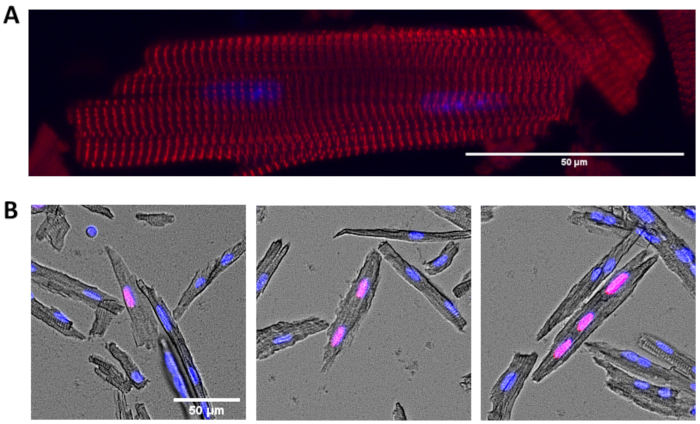
الشكل 2: الكيمياء المناعية من أمراض القلب المعزولة. (أ) صورة تمثيلية من cardiomyocytes ملطخة α actinin (α actinin (الأحمر) وDAPI (الأزرق)). (ب) Cardiomyocytes ملطخة لEdU أدرجت (الأحمر) وDAPI (الأزرق). تظهر الخلايا القلبية التمثيلية أحادية النوى (يسار) وbinucleated (الأوسط) وثلاثية النوى (يمين) وEdU إيجابية. أشرطة المقياس = 50 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 3: استراتيجية التقسيم النووي. (A) الأصلي DAPI صورة القناة. (B) الصورة المعتباة (في هذا المثال، تم استخدام طريقة Otsu). (C) أقنعة تم تحديدها من الصور المتراكبة على الصورة الملطخة الأصلية DAPI. (D) Voronoi tessellation على أساس الأقنعة النووية. (E) النوى المجزأة النهائية، مع تمييز مجموعات الانقسام. أشرطة المقياس = 100 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: استراتيجية لتجزئة القلبية. (A) الأصلي الفلورسنت تروبونين أنا ملطخة صورة cardiomyocyte. (ب) المثلث- عتب الصورة، بعد ملء الثقوب واستبعاد الأجسام الصغيرة وتلك التي تلمس الحدود. (C) الأصلي صورة القلبية في الميدان مشرق (D) حافة - تصفية والمثلث - عتبات صورة cardiomyocyte (E) حافة تصفية الصورة بعد إغلاق مورفولوجية مع دائرة نصف قطرها 2 بكسل (F) نفس الصورة بعد ملء الثقوب واستبعاد الكائنات الصغيرة وتلك التي لمس الحدود. أشرطة المقياس = 100 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: تصنيف عضلة القلب على أساس عدد النوى. تحتوي قلوب حديثي الولادة (عمرها يوم واحد) على أكثر من القلب أحادية النوى من قلوب الأحداث (عمرها 14 يومًا). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
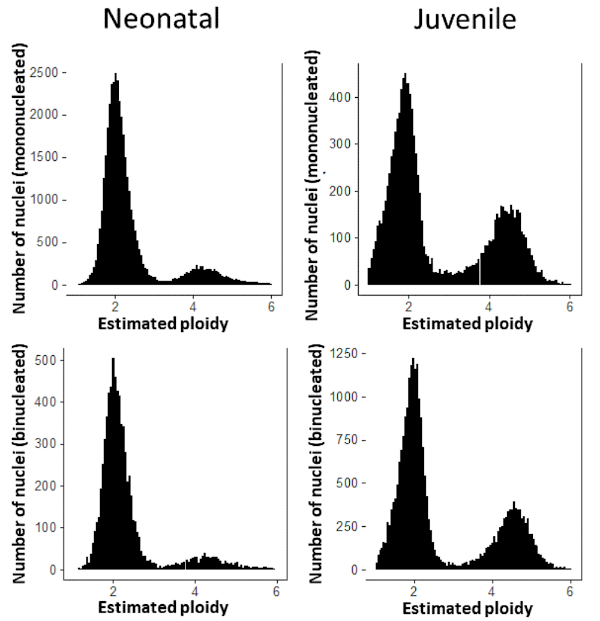
الشكل 6: توزيع محتوى الحمض النووي في القلب في النواة. في الولدان (إلى اليسار)، 13.5٪ من نويات CM أحادية النوبات هي رباعية و 11.9٪ من نويات CM الثنائية هي رباعية. في الأحداث (يمين)، 33.9٪ من نويات CM أحادية النويات هي رباعية و31.2٪ من نوات CM الثنائية هي رباعية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الملف التكميلي 1: لقطات شاشة البرامج. الرجاء الضغط هنا لعرض هذا الملف (انقر بزر الماوس الأيمن للتحميل).
الملف التكميلي 2: AnalyzeNucleation.py. الرجاء الضغط هنا لعرض هذا الملف (انقر بزر الماوس الأيمن للتحميل).
الملف التكميلي 3: AnalyzeMultinucleatedServer.R. الرجاء الضغط هنا لعرض هذا الملف (انقر بزر الماوس الأيمن للتحميل).
Discussion
منذ لا يمكن الحفاظ على cardiomyocytes في الثقافة، من المهم عزل القلبية الأولية لتكون قادرة على دراسة الهندسة المعمارية الخاصة بهم وظيفة11. وبالتالي، تم استخدام تقنيات عزل القلب العضلي على نطاق واسع في مجال القلب. إذا كان الهدف هو تحديد الجوانب الوظيفية للقلب العضلي، فمن المهم عزل cardiomyocytes قابلة للحياة. ويمكن أيضا أن تستخدم هذه القلبية الحية لأداء المثبطات المناعية على الخلايا القلبية المعزولة. ومع ذلك ، فإن تحسين تقنية عزل القلب الحية أمر صعب تقنيًا ، وحتى أفضل التقنيات عادة ما تؤدي فقط إلى 60-65٪ من القلب على شكل قضيب ، ويتم ثني القلب المتبقية ويموتون أو موتى11،12. هنا، طورنا تقنية من شأنها أن تسمح للباحثين لإصلاح القلب أولا، ومن ثم عزل عضلة القلب بكفاءة. يسمح هذا البروتوكول الجديد لعوائد أعلى بكثير من القلب على شكل قضيب مقارنة بالبروتوكولات المنشورة سابقا. وعلاوة على ذلك، قمنا بتطوير منصة تحليل التصوير لتصنيف cardiomyocytes تلقائيا على أساس nucleation و ploidy. مع هذه المنهجيات الجديدة، يمكن للمجموعات وصمة عار cardiomyocytes للبروتينات المختلفة، ودراسة القلبية من ploidy و nucleation الوضع كبديل للإمكانات التجديدية للقلب.
البروتوكول الموصوف هنا واضح نسبياً، ويمكن تنفيذه بدون أي معدات متطورة. قد تختلف كمية الكولاجين وحضانة الوقت لعملية الهضم اعتمادا على الكثير collagenase، والشركة التي توفر ذلك. استخدمنا الكولاجين من النوع 2، لأن هذا هو الأكثر استخداما لهضم القلب للحصول على القلب الحية. استنادا إلى ملاحظاتنا، قررنا أن الحضانة بين عشية وضحاها مع 60 ملغ/مل الكولاجين نوع 2 هو الأمثل لقلوب الماوس تقريبا جميع بغض النظر عن مستوى التليف. لم يكن لدينا مشكلة عسر الهضم الزائد كما يتم إصلاح البروتينات داخل الخلايا وليس في متناول الكولاجين خارج الخلية. ومع ذلك، إذا لم يتم هضم القلب بشكل صحيح، قد تكون هناك حاجة إلى التثاب أكثر قوة، مما يسبب تفتيت الخلايا بسبب الإجهاد القص. وبالتالي ، من المهم التأكد من أن القلب هضم بشكل صحيح قبل الانتقال إلى التثاقب. يمكن اختبار صلابة القلب عن طريق الضغط باستخدام ملقط لتقييم درجة الهضم. بعد الحضانة مع الكولاجيناز، وينبغي أن تكون قلوب أقل صلابة وسهلة لتمزيق. ويمكن أيضا أن أنواع أخرى من collagenase يمكن استخدامها. استخدم تقرير سابق مزيجًا من الكولاجين B و D14.
وعلاوة على ذلك، نعتقد أن هذا البروتوكول يمكن استخدامها لتقييم العدد الإجمالي للقلب العضلي في القلب15. ومع ذلك، إذا كان الهدف هو الحصول على وقياس جميع cardiomyocytes من القلب، فمن المهم لاحتضان قلوب لفترات طويلة من الزمن في حل الكولاجيناز (على سبيل المثال، 3-7 أيام)، حيث ينبغي تجديد حل الكولاجيناز مرة واحدة في اليوم. وهذا سوف يقلل من التناقضات في كفاءة العزل من خلال القضاء على تأثير درجة التثاقل على العائد cardiomyocyte.
استخدام محتوى الحمض النووي لقياس ploidy ليست جديدة، وقد استخدمت في عملية استئصال الدراجات منذ عقود. في الآونة الأخيرة ، تبين أن المجهر يمكن أن تستخدم بالمثل لتقدير محتوى الحمض النووي لكل نواة16. هنا، قمنا بتنفيذ هذه الاستراتيجية لقياس ploidy من نواة القلب، كبديل ل cardiomyocytes شكلت حديثا. العقيدة في مجال تجديد القلب هو أن أحادية النواة فقط، يمكن أن تخضع خلايا القلب ثنائي الخلايا السيتوكينية و تؤدي إلى ظهور خلايا القلب الجديدة. منذ أنه من الصعب جدا لقياس تكوين cardiomyocyte جديدة في الجسم الحي، وعزل cardiomyocytes التي تمت مطاردتها بعد إدارة التناظرية نوكليوتيد الحمض النووي وتحديد مستوى أحادية النواة، وقد استخدمت cardiomyocytes مُنَقَدَة كتكياس لقدرة القلب على توليد القلب الجديد17. هنا ، نحن نقدم ماكرو لـ ImageJ يسمح بالكمية السهلة لـ cardiomyocyte ploidy. ويجب، كحد أدنى، قياس 500 نوات لتحقيق تقدير دقيق لموقع قمة مجموعة الـ 1. إذا تم توخي الحذر لضمان أن ظروف التلطيخ والتصوير متناسقة عبر كل بئر من لوحة imaged ، فقط 500 نواة عبر العينة بأكملها تحتاج إلى صورة ، وإلا ، هناك حاجة إلى أن تكون 500 نواة لكل مجموعة الصورة18،19. وتشمل القيود على القياس القائم على التصوير للنيوية و ploidy صعوبة في التمييز بين النوى من الخلايا المضمّنة من نوى القلب العضلي الضمّي الفعلي، عند استخدام صور ثنائية الأبعاد. قد تؤدي هذه الخلايا الملتصقة إلى المبالغة في تقدير كمية الخلايا متعددة النوى وتقلل من دقة قياسات نواة عضلة القلب رباعية النخاع. استراتيجية واحدة ممكنة لحل هذه المشكلة سيكون لاستخدام علامة cardiomyocyte النووية PCM16،20. ومع ذلك، فقد واجهتنا صعوبات للحصول على PCM1 موثوق بها تلطيخ على الخلايا أو الأنسجة ثابتة بشكل صحيح.
وثمة قيد محتمل آخر هو أن بعض صور البقع النووية قد يكون لها تلطيخ سيتوبلازمي خلفية كبيرة، مما يحول دون العتبة المناسبة باستخدام أساليب فيجي المبنية دون معالجة مسبقة واسعة النطاق. وبالإضافة إلى ذلك، فإن المساهمة غير المنتظمة لهذه الخلفية fluorescence في تقديرات ploidy يقلل من دقتها. وعلاوة على ذلك، إذا لم تترك الخلايا في محلول تلوين الحمض النووي لفترة كافية، فإن الصبغة الفلورية لن ترتبط بالتشبع داخل النوى ولن يكون افتراض وجود علاقة خطية بين الكثافة النووية المتكاملة ومحتوى الحمض النووي دقيقاً بعد الآن.
وتجدر الإشارة إلى أن البرنامج لا يمكن تقسيم مجموعات cardiomyocyte وبدلا من ذلك إزالتها من التحليل. ولذلك، من المهم للغاية أن تُزرع خلايا القلب ذات الكثافة المنخفضة نسبياً (على سبيل المثال، 1000 خلية/سم2). علاوة على ذلك ، لا يمكن للبرنامج التمييز بين جهازي cardiomyocytes اصطف من نهاية إلى نهاية وطويلة ، وdydmyocytes المفرد. وقد تؤدي هذه الأنواع من التجمعات إلى تضخيم تقديرات تعدد النيات خطأ.
على الرغم من أن الطريقة الموصوفة لا تسمح بالحصول على خلايا القلب القابلة للتطبيق وبالتالي لا يمكن استخدامها لقياس العمليات الخلوية الديناميكية ، إذا كان الهدف هو إجراء مناعة ، نعتقد أن الطريقة الموصوفة متفوقة على البروتوكولات الحالية مع غلة أعلى من خلايا القلب وجودة أفضل من حيث المورفولوجيا وتوطين البروتين. وأخيرا، يمكن استخدام الطريقة الموصوفة لعزل الخلايا القلبية القلبية من العينات السريرية14،21. ونحن نعتقد أن المنهجية المذكورة يمكن أن تساعد الباحثين مختلفة للحصول على عالية الجودة cardiomyocytes وقياس نوات و ploidy كبديل لتشكيل cardiomyocyte جديدة.
Disclosures
ليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
ويدعم JHvB من المنح من المعاهد القومية للصحة، الطب التجديدي مينيسوتا، وجائزة البحوث الطبية الحيوية الفردية من مؤسسة هارتويل.
Materials
| Name | Company | Catalog Number | Comments |
| 96 wells plate for imaging | Corning | 3340 | We use these plates as they are suitable for imaging, although glass bottom plates would be better for confocal imaging |
| Alpha actinin | Novus Biologicals | NBP1-32462 | This antibody is used as a marker of cardiomyocyte sarcomeres |
| Blunt scissors | Fine Scissor Tools | 14072-10 | We prefer blunt scissors as the possibility of tearing heart tissue is lower when exposing the heart |
| C57BL/6J | The Jackson Laboratory | 664 | Used for imaging, assessing ploidy and nucleation in cardiomyocyte population |
| CD-1 mice | Charles river | 22 | Used for imaging, assessing ploidy and nucleation in cardiomyocyte population |
| Collagenase 2 | Worthington | LS004177 | For the purpose of this protocol, the batch to batch differences are minimal and don't affect overall yield and quality of the isolation |
| Copper (II) sulfate pentahydrate | Sigma-Aldrich | 203165-10G | For edu staining |
| Cy5 Picolyl Azide | Click Chemistry Tools | 1177-25 | Azide used for edu staining |
| Cytation3 | BioTek | - | Used for automated imaging for DNA analysis |
| DAPI | Life Technologies | D3571 | DAPI used for DNA staining. Stocks were dissolved in distilled water. |
| donkey anti-mouse IgG-Alexa568 | Life Technologies | A10037 | Secondary antibody used to detect alpha actinin staining within cardiomyocytes |
| Forceps | ROBOZ | RS-5137 | We use these curved, blunt forceps, although straight forceps could also be used |
| Hydrochloric acid | Fisher Scientific | A144212 | To set pH of Tris-HCl buffer to pH 8.5 |
| ImageJ | imagej.net/Fiji/Downloads | - | Used for analyzing images |
| L-ascorbic acid | Sigma-Aldrich | 255564-100G | For edu staining |
| Needle for infusion | TERUMO | SV*23BLK | We use winged infusion sets throughout the protocol as it is easy to manipulate the position of the needle with these sets during injection |
| Nikon A1R HD25 | Nikon | - | Used to take confocal images of alpha actinin staining |
| Nylon mesh 200 micron | Elko filtering | 03-200/54 | Mesh used for filtering regular cardiomyocytes (not hypertrophied) |
| Nylon mesh 400 micron | Elko filtering | 06-400/38 | Mesh used for filtering hypertrophied adult cardiomyocytes |
| Phosphate Buffered Saline (1X) | Corning | 21-040-CV | This can also be prepared in the lab. Although sterility is important in this experiment, we think it is sufficient to prepare PBS and filtering it |
| Potassium chloride, Granular | Mallinckrodt | 6858 | Granular potassium chloride was preffered by us as it forms less aggregates when stored in room temperature |
| R | r-project.org | - | Used for data analysis of the measurements obtained from images |
| Tris Base | Fisher Scientific | BP152-5 | Used to buffer EdU staining reaction |
References
- Benjamin, E. J., et al. Heart Disease and Stroke Statistics-2017 Update: A Report From the American Heart Association. Circulation. 135 (10), e146 (2017).
- Heidenreich, P. A., et al. Forecasting the future of cardiovascular disease in the United States: a policy statement from the American Heart Association. Circulation. 123 (8), 933-944 (2011).
- Eschenhagen, T., et al. Cardiomyocyte Regeneration: A Consensus Statement. Circulation. 136 (7), 680-686 (2017).
- Tzahor, E., Poss, K. D. Cardiac regeneration strategies: Staying young at heart. Science. 356 (6342), 1035-1039 (2017).
- Bergmann, O., et al. Dynamics of Cell Generation and Turnover in the Human Heart. Cell. 161 (7), 1566-1575 (2015).
- Richardson, G. D. Simultaneous Assessment of Cardiomyocyte DNA Synthesis and Ploidy: A Method to Assist Quantification of Cardiomyocyte Regeneration and Turnover. Journal of Visualized Experiments. (111), (2016).
- Bergmann, O., et al. Evidence for cardiomyocyte renewal in humans. Science. 324 (5923), 98-102 (2009).
- Senyo, S. E., et al. Mammalian heart renewal by pre-existing cardiomyocytes. Nature. 493 (7432), 433-436 (2013).
- Ang, K. L., et al. Limitations of conventional approaches to identify myocyte nuclei in histologic sections of the heart. American Journal of Physiology-Cell Physiology. 298 (6), C1603-C1609 (2010).
- Bergmann, O., et al. Identification of cardiomyocyte nuclei and assessment of ploidy for the analysis of cell turnover. Experimental Cell Research. 317 (2), 188-194 (2011).
- O'Connell, T. D., Rodrigo, M. C., Simpson, P. C. Isolation and culture of adult mouse cardiac myocytes. Methods in Molecular Biology. 357, 271-296 (2007).
- Ackers-Johnson, M., et al. A Simplified, Langendorff-Free Method for Concomitant Isolation of Viable Cardiac Myocytes and Nonmyocytes From the Adult Mouse Heart. Circulation Research. 119 (8), 909-920 (2016).
- Shaklee, J., et al. Development of a Click-Chemistry Reagent Compatible with Mass Cytometry. Scientific Reports. 8 (1), 6657 (2018).
- Mollova, M., et al. Cardiomyocyte proliferation contributes to heart growth in young humans. Proceedings of the National Academy of Sciences of the United States of America. 110 (4), 1446-1451 (2013).
- Naqvi, N., et al. A proliferative burst during preadolescence establishes the final cardiomyocyte number. Cell. 157 (4), 795-807 (2014).
- Roukos, V., Pegoraro, G., Voss, T. C., Misteli, T. Cell cycle staging of individual cells by fluorescence microscopy. Nature Protocols. 10 (2), 334-348 (2015).
- Patterson, M., et al. Frequency of mononuclear diploid cardiomyocytes underlies natural variation in heart regeneration. Nature Genetics. 49 (9), 1346-1353 (2017).
- Gomes, C. J., Harman, M. W., Centuori, S. M., Wolgemuth, C. W., Martinez, J. D. Measuring DNA content in live cells by fluorescence microscopy. Cell Division. 13, 6 (2018).
- Woo, L. A., et al. High-content phenotypic assay for proliferation of human iPSC-derived cardiomyocytes identifies L-type calcium channels as targets. Journal of Molecular and Cellular Cardiology. 127, 204-214 (2018).
- Morikawa, Y., Heallen, T., Leach, J., Xiao, Y., Martin, J. F. Dystrophin-glycoprotein complex sequesters Yap to inhibit cardiomyocyte proliferation. Nature. 547 (7662), 227-231 (2017).
- Bergmann, O., Jovinge, S. Isolation of cardiomyocyte nuclei from post-mortem tissue. Journal of Visualized Experiments. (65), (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved