Method Article
从固定心脏分离心肌细胞进行免疫细胞化学和倍体分析
摘要
这项工作的目标是开发一种方法,从成人心脏中可重复分离心肌细胞,并测量DNA含量和核。
摘要
成年哺乳动物心脏由各种细胞类型组成,包括心肌细胞、内皮细胞和成纤维细胞。由于难以可靠地识别组织学部分的心肌细胞核,许多组依靠在固定之前隔离可行的心肌细胞进行免疫清除。然而,这些活体心肌细胞分离技术需要优化,以最大限度地提高样品的产量、可行性和质量,尽管最大优化,但样品之间固有的波动。在这里,我们报告一个可重复的协议,涉及在心脏酶消化之前固定,这导致最大产量,同时保持单个心肌细胞的体内形态。我们进一步开发了一个自动化分析平台,以确定单个心肌细胞每个细胞核和DNA含量的数量。在露出胸腔后,心脏在PBS中用60 mM KCl灌注在糖尿病中。接下来,将心脏固定在4%的甲醛(PFA)溶液中,然后用60mg/mL胶原酶溶液消化。消化后,细胞通过三生体化进行奇异化,通过分色离心丰富心肌细胞部分。分离的心肌细胞被染色为特波α T和三种-行为素,以评估获得的人口的纯度。此外,我们开发了一个图像分析平台,以确定心肌细胞核化和DPI染色后倍数状态。基于图像的倍体评估可产生一致且可重现的结果。因此,有了这个协议,可以保留单个心肌细胞的原生形态,从而在达到最大产量的同时进行免疫细胞化学和DNA含量分析。
引言
几十年来,心脏病一直是大多数西方国家的主要,死因。虽然在心血管疾病的治疗的许多改进提高了存活率,但目前没有治疗方法可以取代丢失的心肌细胞。因此,有关心肌细胞功能、增殖、凋亡和肥大的研究一直是并继续是科学界的主要焦点。由于成年哺乳动物心脏的再生能力非常有限,估计心肌细胞的更新率每年不到1%,因此,可靠地识别心肌细胞增殖事件3、4,4至关重要。大多数测量增殖事件的策略要么依靠染色来结合DNA核苷酸类比来评估以前的或目前的增殖,要么依靠活性增殖的核标记的染色5。要可靠地识别心肌细胞增殖事件尤为重要,因为增殖性心肌细胞的总数如此之低,为3,6。,6例如,根据每年1%的内源性心肌细胞的更新率,人们可以预期在成人小鼠心脏7,8的任何给定时间发现25至50个心肌细胞是增殖的。心肌细胞核识别的任何不准确都可能导致误报结果。因此,从组织学第9节中,可靠地识别心肌细胞核至关重要。从单细胞鉴定心肌细胞比从组织部分准确得多,因为即使使用α-actinin等标记物,也很难区分心肌细胞与其他细胞类型,尽管PCM1可能是组织学部分10中心肌细胞核的可靠标记。
目前的协议依赖于在固定之前隔离活心细胞,已知会导致至少30%的心肌细胞死亡,并可能导致无意中选择特定人群的心肌细胞11。此外,这些协议是出了名的难以优化,以提供可重现的结果。即使是优化的分离技术,通常可以产生不超过65%的活的,棒状心肌细胞,产量变化12。
为了克服这些问题,我们开发了一个方案,允许研究人员分离固定心肌细胞。由于样品在分离前是固定的,因此产量最大化,体内形态保存良好。此外,通过此协议,可以分离出心肌细胞与临床样本,这些样本通常在采购后立即固定。此外,为了识别新生成的心肌细胞,测量单个心肌细胞的核和倍体状态非常重要,因为通常只有二倍体心肌细胞才被假定为新形成的。流细胞学不能区分多核和多倍体,是一种相对的时间和资源密集型的协议。图像中核的手动大纲和测量非常低的吞吐量,容易出现人为偏差。固定、隔离的、有偏僻的 DAPI 染色心肌细胞的图像的自动定量解决了这两个问题。基于成像的成核和倍体分布测定,可以用最少的时间和试剂使用基本设备获得。
研究方案
所有动物实验均符合国家卫生研究院指南,并经明尼苏达大学机构动物护理和使用委员会(IACUC)批准。
1. 准备溶液和手术设备
- 隔离前,使用70%乙醇溶液对手术设备进行消毒。
- 将 2.24 g KCl 添加到 500 mL 磷酸盐缓冲盐水 (PBS) 溶液中,获得 60 mM 的最终浓度。在室温下存储 KCl-PBS 溶液。每只鼠标使用 3 mL 的 KCl-PBS 解决方案。
- 将 32% 对甲醛 (PFA) 溶液与 PBS 稀释,以获得 4% PFA 的最终浓度。每只鼠标在 PBS 中准备 10 mL 的 4% PFA。稀释的 PFA 溶液可储存在 4 °C 的玻璃容器中 2-3 周。
注:准备好的 4% PFA 溶液可储存在 -20 °C 下更长时间。 - 每只小鼠加入60毫克胶原酶,每1mL的PBS2型,准备1 mL的胶原酶溶液。
2. 心脏灌注和固定
- 使用 2-5% 异氟,氧气流速为 1 L/min,对动物进行麻醉。确认缺乏运动和降低呼吸速率来确认麻醉。
注:安乐死前注射肝素(100-500 U/kg)可以通过预防血块提高细胞质量和产量,从而允许用固定剂更有效地灌注心脏。 - 根据批准的方法对动物进行安乐死。
注:我们遵循美国兽医医学协会的动物安乐死指南,并获得当地国际兽协会的安乐死批准。 - 将安乐死动物放在超前位置,用胶带向下卷起延长的四肢。
- 用钝端剪刀切开胸部露出心脏。切下大动脉和劣质的洞穴静脉。
- 通过左心室注射 3 mL KCl-PBS 溶液,流速为 3 mL/min,使用附着在输液组上的 23 G 蝴蝶针(新生儿为 26 G)来吸附心脏。确保不要刺穿隔膜。
注:或者,使用针连接到注射器注射溶液。 - 使用近位泵以 1 mL/min 的速度注射 10 mL 的 4% PFA 溶液 10 分钟,使心脏吸气。
- 用剪刀把整个心脏都去掉。切除心脏后,可以通过倾斜来隔离心脏的特定区域。将心脏或心脏的一部分放在含有 1 mL 4% PFA 溶液的 1.5 mL 微离心管中。在室温下在摇杆上孵育心脏,摇速在 20-30 rpm 之间,持续 1 小时。
3. 固定心肌细胞的隔离
- 将心脏放在含有 PBS 溶液的培养皿中。挤压心脏,去除心室中剩余的任何PFA,并在PBS中清洗。
- 将固定心脏放入含有胶原酶溶液(60mg/mL)的新的1.5 mL微离心管中。将管子放在摇杆(20-30 rpm)37°C上,进行过夜孵育。
注:将潜伏时间延长至1周,每两天补充一次胶原酶溶液,以减少如果心脏预期为纤维化,其产量可能变化,这可能需要较长的胶原酶消化时间来消化细胞外胶原蛋白。 - 将胶原酶溶液和心脏放入35毫米培养皿中。使用钳子或剪刀将心脏分离成 1 mm 片断。
- 使用转移移液器进一步三化分离的组织2分钟。如果组织颗粒仍留在培养皿中,请使用开口较窄的转移移液器并继续三角化。继续,直到大部分组织被分解。
注:过度三角化会导致单个心肌细胞破裂。在显微镜下定期检查,确保不要过度三角化。 - 在 15 mL 离心管的开口上放置 200-600 μm 尼龙网。
注:对于肥大性心肌细胞,建议使用 400 μm 尼龙网而不是 200 μm。 - 将 5 mL 的 PBS 添加到含有分离细胞的培养皿中,并通过尼龙网(包括组织颗粒)过滤溶液。通过通过额外的 4 mL PBS 清洗尼龙网。
- 以 10-100 x g 将过滤溶液离 心 1 分钟。
注:100 x g 离心不会产生100%的纯心肌细胞群体,一些非心肌细胞很可能包括在内。 - 丢弃上一提液,除非一个人想染色/评估非心肌细胞心脏细胞。在染色前将颗粒重新在 10 mL PBS 中。
4. 染色心肌细胞
- 以100 x g 离心收集细胞1分钟,并加入5 mL的渗透溶液(例如,PBS中的0.5%Triton X-100)。在摇杆上室温下孵育20分钟。
注:对于步骤 4.1、4.2 和 4.4,使用 15 mL 离心管,因为与 1.5 mL 微离心管相比,在不干扰细胞颗粒的情况下,更容易去除上流水。 - 以100 x g 离心收集细胞1分钟,加入5 mL的阻断缓冲液(例如,PBS中的3%牛血清白蛋白[BSA]),并在摇杆的室温下孵育30分钟。
- 以100xg离心收集细胞1分钟,并g加入1 mL的原抗体溶液(PBS),并达到适当的稀释比。将溶液转移到1.5 mL微离心管中,并在优化条件下(例如,4°C过夜)在原抗体溶液中孵育心肌细胞。
- 将具有原抗体溶液的心肌细胞转移到15 mL离心管中,并加入9 mL的PBS。在摇杆上在室温下孵育心肌细胞10分钟。
- 以100 x g离心收集细胞1分钟,并加入10 mL的PBS。在摇杆上在室温下孵育心肌细胞10分钟。再次重复此步骤。
- 以100xg离心收集细胞1分钟,并g加入含有DAPI的二级抗体溶液。在摇杆上室温下孵育30分钟,然后重复步骤4.5两次,清洗心肌细胞。
- 将细胞放在盖玻片或显微镜兼容的板上,然后继续成像。
注:手稿中包含的图像以 10 倍和 40 倍的目标拍摄。使用的激光为:DAPI的405纳米,阿尔法行为素的561纳米和640纳米的Edu。
5. 设置成像软件
注:使用补充文件 1 -软件屏幕快照.pdf 执行这些步骤。
- 下载 ImageJ 的斐济版。
- 打开斐济。单击帮助 > 更新...> 管理更新站点。检查"IJPB插件"和"生物组"更新网站下载依赖项插件椭圆分裂和Morpholibj。
- 单击 "关闭"。斐济应开始下载依赖项。完成后重新启动斐济。
- 下载 Rstudio 并打开它。
- 将安装.包(c("ggplot2","自动呼啸器","dplyr","purrr","jsonlite","闪亮")复制到R控制台的命令行,然后按 Enter键。c键入"y"以响应安装所有 R 依赖项的所有提示(补充文件 1中的屏幕截图 1)。
6. 图像量化
- 打开斐济,将"AnalyzeNucleation.py"(作为补充代码文件提供)拖入斐济的状态栏。这将打开一个脚本编辑窗口。单击左下角的"运行"以开始(补充文件1 中的屏幕截图 2)。
- 将弹出一个对话框(补充文件1:屏幕截图3),询问输出数据目录的位置。本软件使用的所有分析数据、数字和其他数据都将存储在此文件夹中。另一个更大的对话框将弹出,显示所有图像分析设置(补充文件1:屏幕截图4)。
- 选择要分析的图像的目录位置。
- 使用正则表达式输入图像文件名格式。输入图像文件名格式,使用正则表达式指示文件名的哪些部分对应于大括号中的行、列、通道和(可选)站点。不要将空格放在大括号中。以大括号 + 包围文件名格式的可变部分。文件的保存方式取决于映像软件,此步骤将从映像文件名中检索相关信息。
注: 例如,格式字符串
r" 板 1 - (?P[A-Za-z])(?P<列>{0-9})-(?P<通道>[A-Za-z].tif"
描述以"板 1-"开头的文件名,后跟一个或多个字母表示行,后跟一个或多个数字表示列,后跟"-",后跟一个或多个字母表示通道,后跟".tif"。尖括号内的字母(如"<>")是变量名称,在收集时会自动复制到数据中。其中一个变量名称必须为"<通道>" - 指示核污渍可见的通道的名称和心肌细胞可见的通道的名称。这些名称必须与 正 则表达式文件名中"<通道>"变量匹配的部件中的名称完全相同。
- 指示如何使用逗号分隔的变量名称对图像进行分组。给定组中的所有图像都将在一批批内打开和分析。例如,如果图像被划分为每个井的集,并且每个唯一的行和列组合都有一个井,则在此字段中写入"行,列"。
注意:这些分组变量必须是格式字符串中使用的变量的子集。不要使用"通道"作为分组变量,这将相互分离相应的通道图像。 - 指示图像是否拼接在一个井图像中,还是每个站点是分开的。在上一种情况下,不应在文件名格式字符串中指示站点。
- 选择要使用哪种阈值方法将核与背景分离。斐济的所有标准阈值方法都可用。测试不同的阈值方法,以确定哪种方法最适合映像集。在此示例中,选择 Otsu 方法。
- 指示是否应重新计算每个站点图像的阈值,或者是否应对组中的每个图像使用相同的阈值。指示心肌细胞图像是亮场还是使用荧光标记。
- 指示心肌细胞阈值方法。如果在上一步中选择了亮场,则此阈值方法将应用于边缘筛选的亮场图像。指示是否应重新计算每个站点图像的阈值,或者是否应对组中的每个图像使用相同的阈值。
- 指示覆盖每个井的站点图像行数。指示覆盖每个井的站点图像的列数。以像素为单位指示核的最小区域。使用大尺寸低,在分析步骤中计算出更高、更精确的阈值。指示心肌细胞的最小区域。
- 选择所需设置后,单击"确定"。
- 类似于图 3 和图 4 中的图像 将显示在屏幕上,显示分析管道的不同阶段。检查这些映像,以确保正确进行阈值和分段。
- 所选结果文件夹现在应填充分析数据(补充文件1:屏幕截图 5)。分析数据以外的文件可以安全地保存在此文件夹中,只要它们的名称不以"cm_","nuclei_"或"nucleilink_"。
7. 数据分析
注:可以手动分析所生产的 csv 文件。每个分析的图像子集都会生成一组名为"核(元数据)csv"、"核链接(元数据)"和"心肌细胞(元数据)、csv"的 csv 文件,其中(元数据)替换为"_(名称)=(值)"形式的名称值对序列,其中(名称)和(值)是从前面给出的正则表达式中匹配的字符串派生的字母数字字符序列。(例如,如果在文件名中指示了行和列,则_row"_column=F"等字符串将存在。每个核和核链接文件的未命名左列是一个核 ID 号。核链接文件的"Min"列是心肌细胞的ID,它完全包含或0否则包含说核。核的"Max"列是部分包含该细胞核的最高编号心肌细胞的ID,否则为0。心肌细胞文件的"平均"列是心肌细胞ID号。
- 在 Rstudio 中打开"分析穆廷化服务器.R"(作为补充代码文件提供)。
- 此文件的顶部是一个名为"文件夹名称"的变量。旁边是文件路径。在这里,键入在最后一步中选择的输出数据文件夹的路径,而不使用最终斜杠(补充文件 1:屏幕截图 6)。
- 在脚本编辑窗口的左上角应该有一个绿色箭头,标记为运行 应用程序。单击此箭头。加载数据并弹出应用可能需要一些时间。
- 最初,将显示三个浇注图,一个指示最小有效核区域阈值,一个指示最小有效核平均强度阈值,一个指示心肌细胞的最大有效最小铁杉直径。使用滑块设置这些阈值(补充文件1:屏幕截图 7)。
注:在每一个图表中,应存在与有效核或心肌细胞对应的大而宽的峰,两侧是代表碎片或错误分割的心肌细胞的宽尾。使用阈值切断每个峰值的一条尾部。 - 向下滚动。单击"应用 选定阈值"按钮 (补充 文件 1 的底部:屏幕截图 7)。
- 单击"绘图 强度分布"按钮。这将为每个分组变量呈现整个样本和单独子图的核强度分布图。
注意:例如,如果 和 <列> 分组变量输入到斐济对话框中的正则表达式中,将显示指示强度分布(按行和按列)的绘图(补充文件1:屏幕截图 8)。如果样品的不同部分的照明和染色条件保持不变,这些图应清楚地显示两个强度峰值,一个调暗,高一个用于二倍核,一个更亮,更短,用于四倍核。 - 样本内变化将导致此模式在全样本图中不可见,并且按行、列或其他分组变量的二倍体和四倍体峰值的位置存在很大的变化。在后一种情况下,向下滚动选中"按 组单独规范化"复选框 以考虑此变体(补充文件 1:屏幕截图 9)。
- 单击"计算 倍体"按钮 (补充文件 1:屏幕截图 9)。单击"绘制 估计 Ploid"分布按钮。图形将显示在右侧的空窗口中。在规范化全样本图中,如果以前不是,则双峰值模式应可见。
- 选择阈值,使用滑块将二倍体和四倍位数峰彼此隔离,并使用滑块隔离离群值(补充文件 1:屏幕截图 9)。向下滚动。单击"计算倍体和成核"按钮(补充文件 1: 屏幕截图 10)。
- 单击"绘图 "按钮并保存到"结果"文件夹中。保存到所选结果文件夹中的绘图也将出现在此交互式窗口中(补充文件1:屏幕截图 10)。
结果
根据上述协议分离心肌细胞。使用这种方法,我们通常得到均匀的奇异性心肌细胞,相对纯净,不污染非心肌细胞(图1A)。心肌细胞由于其特征大小和双参照性,在明亮的场显微镜下很容易识别。这种技术易于实现,并且从具有可比心肌细胞产量和质量的不同隔离中提供一致的结果(图1B)。分离的心肌细胞可以在4°C储存几个星期,然后再进一步使用。
根据上述协议分离的心肌细胞可用于各种下游应用,如测量心肌细胞大小、心肌细胞倍体和免疫细胞化学。作为一个代表性的结果,我们表明,根据该协议分离的心肌细胞可以使用抗体和氟铬结合的阿齐德进行染色,用于点击化学,分别检测特定蛋白质的定位或检测心肌细胞DNA复制。例如,我们用抗体染色心肌细胞,α-actinin,以显示沙康的特征 z 线染色模式 (图 2A) 。在另一项实验中,在分离固定心肌细胞之前,我们给小鼠施用胸腺素模拟5-乙酰-2'-脱氧核糖核酸(EdU)。在心肌细胞分离后,我们使用标准协议13染色为合并EdU,并能够检测在单核、双核和三核心肌细胞中经历了S阶段的心肌细胞(图2B)。
为了进一步扩大分离方法的效用,我们开发了一种管道,允许基于集成DNA染色的心肌细胞倍体定量。为了能够测量细胞或核的倍体状态,我们需要分割核和心肌细胞。图 3显示了我们用于识别单个核的策略的表示。首先,原始图像DNA染色图像(图3A)是根据强度(图3B)阈值的。在这里,我们使用DAPI染色DNA,但任何其他核染料,显示线性相关性的DNA含量将工作。该程序允许选择任何斐济的强度阈值方法,但在此示例中使用了 Otsu 的方法。将排除接触图像边缘或小于指定最小像素面积阈值的核蒙版。然后,椭圆适合核掩码,分割单个核。图 3C显示了这些叠加在原始图像上的椭圆。接下来,在蒙版中填充孔,然后根据它们最近的椭圆将图像的像素划分为区域(图 3D)。然后,这些领土的边界用于划线穿过核星团,完成核分割过程(图3E)。
下一步涉及发现心肌细胞。对于基于荧光染色细胞获得的心肌细胞图像(图4A),这个过程与核非常相似。图像根据所选阈值方法计算的强度值进行阈值,本例中为三角形方法。已识别的触动图像边界或低于特定尺寸的心肌细胞掩码将排除在外,并在掩码中填充孔以提供正确分割的心肌细胞(图4B)。由于心肌细胞的形状比核形状更不规则,因此没有尝试分割心肌细胞群。相反,在分析步骤中,这些聚类根据其高最小 Feret 的直径进行排除。来自明亮场图像的分割过程略有不同。首先,使用索贝尔边缘滤波器处理原始亮场图像(图4C)。此滤镜计算图像中每个像素的渐变的绝对值。快速变化区域中的像素接收高值,图像平滑区域中的像素接收低值。然后,使用三角法按强度对边缘滤波图像进行阈值,从而产生蒙版心肌细胞(图4DD)。然后,这些高度不规则的蒙版通过形态关闭通过形态关闭链接在一起,使用半径为 2 像素的圆,该圆填充图像中所有白色区域,其中圆无法容纳而不重叠黑色区域(图 4E)。最后,填充掩码中的孔,排除接触边界的区域,去除小颗粒,完成心肌细胞分割过程(图4F)。
使用概述的分段策略,我们可以确定单个心肌细胞的成核状态。使用这种方法,我们确定了心肌细胞的成核状态,这些细胞在产后早期时间点与近亲CD-1小鼠的心脏分离。新生小鼠的心脏(生命的第一天)显示,当时大多数心肌细胞是单核的(图5:新生儿)。这种高频率的单核心肌细胞在幼鼠(2周大)中要低得多,其中单核心肌细胞占心肌细胞总数的25%左右(图5:幼鼠)。最后,我们可以测量心肌细胞内单个核的倍体状态,并确定它们是二倍体还是四肢体。这些结果表明,青少年小鼠四肢体核频率较高(图6)。

图1:固定后心肌细胞分离的效率。 (A) 与DAPI染上污迹的分离心肌细胞的代表性图像,以显示核。(DAPI(蓝色),光明场(灰色)(B) 3个月大时从不同小鼠分离出的心肌细胞的产量。比例线 = 50 μm. 请单击此处查看此图的较大版本。
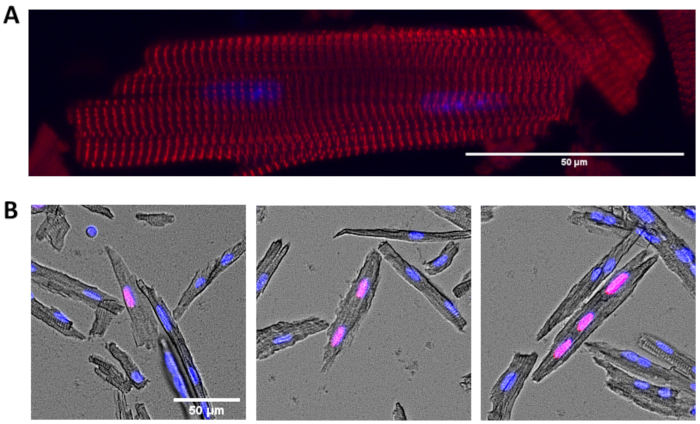
图2:分离心肌细胞的免疫细胞化学。 (A) 因黑色-α素(α-α)和DAPI(蓝色)而染色的心肌细胞的代表形象。(B) 心肌细胞染色为合并EdU(红色)和DAPI(蓝色)。显示单核(左)、双核(中)和三核(右)和EdU阳性的代表性心肌细胞。比例线 = 50 μm. 请单击此处查看此图的较大版本。
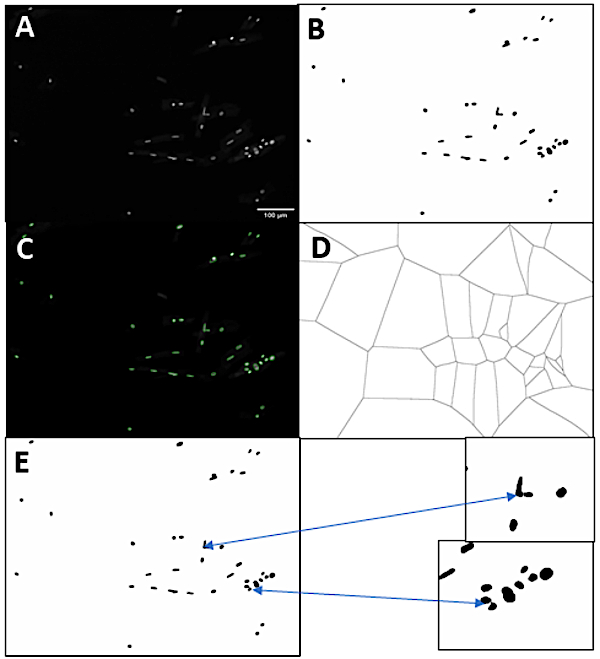
图3:核分割战略。 (A) 原始 DAPI 通道图像。(B) 阈值图像(在此示例中,使用 Otsu 的方法)。(C) 从覆盖在原始 DAPI 染色图像上的阈值图像中识别的蒙版。(D) 基于核面具的沃罗诺伊镶嵌。(E) 最终分段的核,并突出显示分裂聚类。比例线 = 100 μm. 请单击此处查看此图的较大版本。

图4:心肌细胞分割策略。 (A) 原荧光肌蛋白我染色心肌细胞图像.(B) 三角形阈值图像,填充孔后排除小物体和接触边框的物体。(C) 原始亮场心肌细胞图像 ( D )边缘过滤和三角形阈值心肌细胞图像 ( E )边缘过滤图像后形态学关闭与半径为两像素 (F) 相同的图像后, 填充孔, 排除小对象和接触边界。比例线 = 100 μm. 请单击此处查看此图的较大版本。

图5:根据核数对心肌细胞进行分类。 新生儿心脏(1天大)含有比青少年心脏(14天大)更多的单核心肌细胞。 请单击此处查看此图的较大版本。
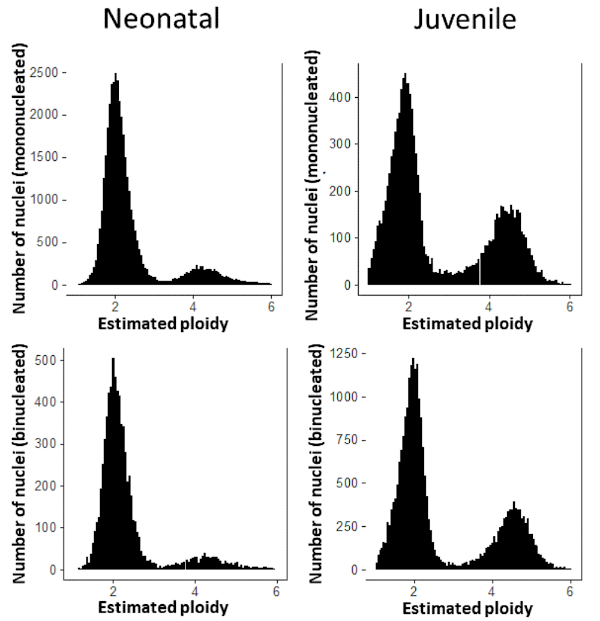
图6:每细胞核心肌细胞DNA含量的分布。 在新生儿(左),13.5%的单核CM核是四核体,11.9%的双核CM核是四核体。在青少年(右),33.9%的单核CM核是四核,31.2%的双核CM核是四核。 请单击此处查看此图的较大版本。
补充文件1:软件屏幕截图。请单击此处查看此文件(右键单击以下载)。
补充文件2:AnalyzeNucleation.py。请单击此处查看此文件(右键单击以下载)。
补充文件3:分析穆丁化服务器.R.请单击此处查看此文件(右键单击以下载)。
讨论
由于心肌细胞不能在培养中保持,因此分离原发性心肌细胞能够研究其结构和功能11是十分重要的。因此,心肌细胞分离技术在心脏领域得到了广泛的应用。如果目标是确定心肌细胞的功能方面,那么分离可行的心肌细胞就很重要。这些活的心肌细胞也可用于对孤立的心肌细胞进行免疫抑制。然而,优化隔离活体心肌细胞的技术在技术上是具有挑战性的,即使是最好的技术通常也只产生60-65%的活棒状心肌细胞,而其余的心肌细胞都是球状的,死亡或死亡11,12。11,12在这里,我们开发了一种技术,允许研究人员首先修复心脏,然后有效地分离心肌细胞。与之前发布的协议相比,这种新协议允许棒状心肌细胞的产量高得多。此外,我们开发了一个成像分析平台,根据核化和倍体化自动对心肌细胞进行分类。有了这些新方法,组可以染色心肌细胞为不同的蛋白质,并研究心肌细胞倍体和核状态作为代理的心脏再生潜力。
此处描述的协议相对简单,无需任何高级设备即可执行。胶原酶的量和消化的孵育时间可能因胶原酶很多以及提供胶原酶的公司而异。我们使用胶原酶类型2,因为这是最广泛的用于消化心脏获得活的心肌细胞。根据我们的观察,我们确定,与60mg/mL胶原酶2型过夜孵育是几乎所有小鼠心脏的最佳选择,无论纤维化程度如何。我们从来没有过度消化的问题,因为细胞内蛋白质是固定的,不像细胞外胶原蛋白那样容易获得。然而,如果心脏不能正确消化,可能需要更有力的三角,这会导致细胞分裂,由于剪切应力。因此,在进入三角化之前,确保心脏被正确消化是至关重要的。心脏的硬度可以通过用钳子挤压来测试,以评估消化的程度。使用胶原酶孵育后,心脏应不那么僵硬,容易撕裂。其他类型的胶原酶也可以使用。上一份报告使用了胶原酶B和D14的组合。
此外,我们相信,这个协议可以用来评估心脏15的心肌细胞总数。然而,如果目标是从心脏获得和量化所有心肌细胞,重要的是在胶原酶溶液中长期孵育心脏(例如,3-7天),其中胶原酶溶液应每天补充一次。这将通过消除三生体化程度对心肌细胞产量的影响,最大限度地减少隔离效率的不一致。
使用DNA含量测量倍体并不是什么新鲜事,它已被用于流式细胞学几十年。最近,它表明,显微镜同样可以用来估计每核16的DNA含量。在这里,我们实施了这一策略,以测量心肌细胞核的倍体,作为新形成的心肌细胞的代用。心脏再生领域的教条是,只有单核,二倍体心肌细胞可以经历细胞因子,并产生新的心肌细胞。由于测量体内新的心肌细胞形成是非常具有挑战性的,隔离心肌细胞被追逐后,DNA核苷酸模拟和确定单核,二体肌细胞的水平已被用作近似的能力,心脏产生新的心肌细胞17。在这里,我们为 ImageJ 提供了一个宏,它允许对心肌细胞倍体进行简单的定量。在最低限度,必须测量500个原子核,以达到对G1峰值位置的准确估计。如果注意确保染色和成像条件在成像板的每个井中保持一致,则整个样品中只需要成像500个核,否则,每个图像组18、19,需要500个核。在使用二维图像时,基于成像的成核和倍体测量的局限性包括难以区分核与粘附细胞和实际心肌细胞核。这种粘附细胞可能导致高估多核细胞的数量,降低四倍体心肌细胞细胞细胞种群的测量精度。解决这个问题的一个可能策略是使用心肌细胞核标记PCM16,20。6,然而,我们很难在正确固定的细胞或组织上获得可靠的PCM1染色。
另一个潜在的限制是,一些核染色图像可能有显著的背景细胞质染色,防止使用斐济内置的方法,而无需广泛的预处理适当的阈值。此外,这种背景荧光对倍数估计值的不规则贡献降低了其准确性。此外,如果细胞在DNA染色溶液中未留足时间,荧光染料不会与核内的饱和结合,核综合强度与DNA含量之间线性关系的假设将不再准确。
应当指出,软件无法分割心肌细胞聚类,而是将其从分析中删除。因此,以相对较低的密度(例如,1000个细胞/厘米2)播种心肌细胞至关重要。此外,该软件无法区分两个心肌细胞排列到端到端和长,奇异的心肌细胞。这些类型的聚类可能会错误地夸大多核估计值。
虽然所述方法不允许获得可行的心肌细胞,因此不能用于测量动态细胞过程,但如果目标是进行免疫控制,我们相信所述方法优于现有协议,具有更高的心肌细胞产量和更好的质量在形态学和蛋白质定位方面。最后,所述方法可用于从临床样本14、21中分离心肌细胞。我们相信,所述方法可以帮助不同的研究人员获得高质量的心肌细胞,并测量成核和倍体作为新的心肌细胞形成的代理。
披露声明
作者没有什么可透露的。
致谢
JHvB由美国国家卫生研究所、明尼苏达州再生医学基金会和哈特威尔基金会的生物医学研究奖资助。
材料
| Name | Company | Catalog Number | Comments |
| 96 wells plate for imaging | Corning | 3340 | We use these plates as they are suitable for imaging, although glass bottom plates would be better for confocal imaging |
| Alpha actinin | Novus Biologicals | NBP1-32462 | This antibody is used as a marker of cardiomyocyte sarcomeres |
| Blunt scissors | Fine Scissor Tools | 14072-10 | We prefer blunt scissors as the possibility of tearing heart tissue is lower when exposing the heart |
| C57BL/6J | The Jackson Laboratory | 664 | Used for imaging, assessing ploidy and nucleation in cardiomyocyte population |
| CD-1 mice | Charles river | 22 | Used for imaging, assessing ploidy and nucleation in cardiomyocyte population |
| Collagenase 2 | Worthington | LS004177 | For the purpose of this protocol, the batch to batch differences are minimal and don't affect overall yield and quality of the isolation |
| Copper (II) sulfate pentahydrate | Sigma-Aldrich | 203165-10G | For edu staining |
| Cy5 Picolyl Azide | Click Chemistry Tools | 1177-25 | Azide used for edu staining |
| Cytation3 | BioTek | - | Used for automated imaging for DNA analysis |
| DAPI | Life Technologies | D3571 | DAPI used for DNA staining. Stocks were dissolved in distilled water. |
| donkey anti-mouse IgG-Alexa568 | Life Technologies | A10037 | Secondary antibody used to detect alpha actinin staining within cardiomyocytes |
| Forceps | ROBOZ | RS-5137 | We use these curved, blunt forceps, although straight forceps could also be used |
| Hydrochloric acid | Fisher Scientific | A144212 | To set pH of Tris-HCl buffer to pH 8.5 |
| ImageJ | imagej.net/Fiji/Downloads | - | Used for analyzing images |
| L-ascorbic acid | Sigma-Aldrich | 255564-100G | For edu staining |
| Needle for infusion | TERUMO | SV*23BLK | We use winged infusion sets throughout the protocol as it is easy to manipulate the position of the needle with these sets during injection |
| Nikon A1R HD25 | Nikon | - | Used to take confocal images of alpha actinin staining |
| Nylon mesh 200 micron | Elko filtering | 03-200/54 | Mesh used for filtering regular cardiomyocytes (not hypertrophied) |
| Nylon mesh 400 micron | Elko filtering | 06-400/38 | Mesh used for filtering hypertrophied adult cardiomyocytes |
| Phosphate Buffered Saline (1X) | Corning | 21-040-CV | This can also be prepared in the lab. Although sterility is important in this experiment, we think it is sufficient to prepare PBS and filtering it |
| Potassium chloride, Granular | Mallinckrodt | 6858 | Granular potassium chloride was preffered by us as it forms less aggregates when stored in room temperature |
| R | r-project.org | - | Used for data analysis of the measurements obtained from images |
| Tris Base | Fisher Scientific | BP152-5 | Used to buffer EdU staining reaction |
参考文献
- Benjamin, E. J., et al. Heart Disease and Stroke Statistics-2017 Update: A Report From the American Heart Association. Circulation. 135 (10), e146 (2017).
- Heidenreich, P. A., et al. Forecasting the future of cardiovascular disease in the United States: a policy statement from the American Heart Association. Circulation. 123 (8), 933-944 (2011).
- Eschenhagen, T., et al. Cardiomyocyte Regeneration: A Consensus Statement. Circulation. 136 (7), 680-686 (2017).
- Tzahor, E., Poss, K. D. Cardiac regeneration strategies: Staying young at heart. Science. 356 (6342), 1035-1039 (2017).
- Bergmann, O., et al. Dynamics of Cell Generation and Turnover in the Human Heart. Cell. 161 (7), 1566-1575 (2015).
- Richardson, G. D. Simultaneous Assessment of Cardiomyocyte DNA Synthesis and Ploidy: A Method to Assist Quantification of Cardiomyocyte Regeneration and Turnover. Journal of Visualized Experiments. (111), (2016).
- Bergmann, O., et al. Evidence for cardiomyocyte renewal in humans. Science. 324 (5923), 98-102 (2009).
- Senyo, S. E., et al. Mammalian heart renewal by pre-existing cardiomyocytes. Nature. 493 (7432), 433-436 (2013).
- Ang, K. L., et al. Limitations of conventional approaches to identify myocyte nuclei in histologic sections of the heart. American Journal of Physiology-Cell Physiology. 298 (6), C1603-C1609 (2010).
- Bergmann, O., et al. Identification of cardiomyocyte nuclei and assessment of ploidy for the analysis of cell turnover. Experimental Cell Research. 317 (2), 188-194 (2011).
- O'Connell, T. D., Rodrigo, M. C., Simpson, P. C. Isolation and culture of adult mouse cardiac myocytes. Methods in Molecular Biology. 357, 271-296 (2007).
- Ackers-Johnson, M., et al. A Simplified, Langendorff-Free Method for Concomitant Isolation of Viable Cardiac Myocytes and Nonmyocytes From the Adult Mouse Heart. Circulation Research. 119 (8), 909-920 (2016).
- Shaklee, J., et al. Development of a Click-Chemistry Reagent Compatible with Mass Cytometry. Scientific Reports. 8 (1), 6657 (2018).
- Mollova, M., et al. Cardiomyocyte proliferation contributes to heart growth in young humans. Proceedings of the National Academy of Sciences of the United States of America. 110 (4), 1446-1451 (2013).
- Naqvi, N., et al. A proliferative burst during preadolescence establishes the final cardiomyocyte number. Cell. 157 (4), 795-807 (2014).
- Roukos, V., Pegoraro, G., Voss, T. C., Misteli, T. Cell cycle staging of individual cells by fluorescence microscopy. Nature Protocols. 10 (2), 334-348 (2015).
- Patterson, M., et al. Frequency of mononuclear diploid cardiomyocytes underlies natural variation in heart regeneration. Nature Genetics. 49 (9), 1346-1353 (2017).
- Gomes, C. J., Harman, M. W., Centuori, S. M., Wolgemuth, C. W., Martinez, J. D. Measuring DNA content in live cells by fluorescence microscopy. Cell Division. 13, 6 (2018).
- Woo, L. A., et al. High-content phenotypic assay for proliferation of human iPSC-derived cardiomyocytes identifies L-type calcium channels as targets. Journal of Molecular and Cellular Cardiology. 127, 204-214 (2018).
- Morikawa, Y., Heallen, T., Leach, J., Xiao, Y., Martin, J. F. Dystrophin-glycoprotein complex sequesters Yap to inhibit cardiomyocyte proliferation. Nature. 547 (7662), 227-231 (2017).
- Bergmann, O., Jovinge, S. Isolation of cardiomyocyte nuclei from post-mortem tissue. Journal of Visualized Experiments. (65), (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。