Method Article
Isolement des cardiomyocytes des coeurs fixes pour l’immunocytochimie et l’analyse de ploy
Dans cet article
Résumé
Le but de ce travail est de développer une méthode pour isoler de façon reproductiblement les cardiomyocytes du cœur adulte et mesurer la teneur en ADN et la nucléation.
Résumé
Le cœur des mammifères adultes est composé de différents types de cellules, y compris les cardiomyocytes, les cellules endothéliales et les fibroblastes. Puisqu’il est difficile d’identifier de manière fiable les noyaux de cardiomyocytes sur les sections histologiques, beaucoup de groupes comptent sur l’isolement des cardiomyocytes viables avant la fixation pour effectuer l’immunostaining. Cependant, ces techniques d’isolation des cardiomyocytes vivants nécessitent une optimisation pour maximiser le rendement, la viabilité et la qualité des échantillons, avec des fluctuations inhérentes d’échantillon à échantillon malgré une optimisation maximale. Ici, nous rapportons un protocole reproductible, impliquant la fixation avant la digestion enzymatique du coeur, qui conduit au rendement maximum tout en préservant la morphologie in vivo des cardiomyocytes individuels. Nous avons développé une plate-forme d’analyse automatisée pour déterminer le nombre de noyaux et de contenu d’ADN par noyau pour les cardiomyocytes individuels. Après avoir exposé la cavité thoracique, le cœur a été arrêté dans le diastole par perfusion avec 60 mM KCl dans PBS. Ensuite, le cœur a été fixé dans 4% de solution de paraformaldéhyde (PFA), puis digéré avec 60 mg/mL solution de collagènease. Après digestions, les cellules ont été singularisées par trituration, et la fraction de cardiomyocyte a été enrichie par la centrifugation différentielle. Des cardiomyocytes isolés ont été tachés pour troponin T et α-actinine pour évaluer la pureté de la population obtenue. En outre, nous avons développé une plate-forme d’analyse d’image pour déterminer la nucléation de cardiomyocyte et le statut de ploidy suivant la coloration de DAPI. Les évaluations de stratagèmes basées sur l’image ont mené à des résultats cohérents et reproductibles. Ainsi, avec ce protocole, il est possible de préserver la morphologie indigène des cardiomyocytes individuels pour permettre l’immunocytochemie et l’analyse de la teneur en ADN tout en obtenant un rendement maximal.
Introduction
Les maladies cardiaques ont été la principale cause de décès dans la majorité des pays occidentaux depuis de nombreuses décennies1,2. Bien que de nombreuses améliorations dans le traitement des maladies cardiovasculaires ont amélioré la survie, il n’existe actuellement aucun traitement qui peut remplacer les cardiomyocytes perdus. Par conséquent, les études liées à la fonction cardiomyocyte, la prolifération, l’apoptose et l’hypertrophie ont été et continuent d’être un foyer majeur de la communauté scientifique. Étant donné que le cœur des mammifères adultes a une capacité régénératrice très limitée, avec un taux de renouvellement des cardiomyocytes estimé à moins de 1 % par an, il est crucial d’identifier de manière fiable les événements prolifératifs de cardiomyocyte3,4. La plupart des stratégies qui mesurent les événements prolifératifs reposent soit sur la coloration pour les analogues incorporés de nucléotides d’ADN pour évaluer la prolifération précédente ou actuelle, ou la tache pour les marqueurs nucléaires de prolifération active5. Il est particulièrement important d’identifier de manière fiable les événements prolifératifs cardiomyocytes puisque le nombre global de cardiomyocytes prolifératifs est si faible3,,6. Par exemple, sur la base d’un taux de renouvellement de 1% de cardiomyocytes endogènes par an, on peut s’attendre à trouver entre 25 et 50 cardiomyocytes à proliférer à un moment donné dans le cœur de souris adulte7,8. Toute inexactitude dans l’identification des noyaux de cardiomyocyte pourrait mener à de faux résultats positifs. Par conséquent, il est essentiel d’identifier de manière fiable les noyaux de cardiomyocytes, qui se sont avérés difficiles et peu fiables à partir des sections histologiques9. L’identification des cardiomyocytes est beaucoup plus précise à partir des cellules individuelles que des sections de tissu car il pourrait être difficile de distinguer les cardiomyocytes d’autres types de cellules, même lorsque vous utilisez des marqueurs tels que α-actinine, bien que PCM1 pourrait être un marqueur fiable de noyaux cardiomyocytés dans les sections histologiques10.
Les protocoles actuels reposent sur l’isolement des cardiomyocytes vivants avant la fixation, qui est connu pour causer la mort d’au moins 30% des cardiomyocytes, et pourrait conduire à la sélection par inadvertance de populations spécifiques de cardiomyocytes11. En outre, ces protocoles sont notoirement difficiles à optimiser pour fournir des résultats reproductibles. Même les techniques d’isolation optimisées ne peuvent généralement pas produire plus de 65% de cardiomyocytes vivants en forme de tige avec des rendements variables12.
Pour surmonter ces problèmes, nous avons développé un protocole qui permet aux chercheurs d’isoler les cardiomyocytes fixes. Puisque les échantillons sont fixés avant l’isolement, le rendement est maximisé, et la morphologie in vivo est bien préservée. En outre, avec ce protocole, il est possible d’isoler les cardiomyocytes des échantillons cliniques, qui sont généralement fixés immédiatement après l’approvisionnement. En outre, pour identifier les cardiomyocytes nouvellement générés, il est important de mesurer le statut de nucléation et de stratagème des cardiomyocytes individuels, puisque seuls les cardiomyocytes diploïdes sont généralement supposés être nouvellement formés. La cytométrie de flux ne peut pas distinguer la multinucléation du polyploïdage et est un protocole relativement exigeant en temps et en ressources. La description manuelle et la mesure des noyaux dans les images sont très faibles et sujettes aux biais humains. La quantification automatisée des images de cardiomyocytes fixes et isolés tachés de DAPI résout ces deux problèmes. La détermination basée sur l’imagerie des distributions de nucléation et de stratagème peut être obtenue avec un minimum de temps et de réactifs à l’aide d’équipement de base.
Protocole
Toutes les expériences animales ont été effectuées conformément aux lignes directrices des National Institutes of Health et approuvées par le Comité institutionnel de soins et d’utilisation des animaux de l’Université du Minnesota (IACUC).
1. Préparation des solutions et de l’équipement chirurgical
- Avant l’isolement, stériliser l’équipement chirurgical en utilisant une solution d’éthanol à 70 %.
- Ajouter 2,24 g de KCl à 500 mL de solution saline tamponnée de phosphate (PBS) pour obtenir une concentration finale de 60 mM. Stockez la solution KCl-PBS à température ambiante. Utilisez 3 mL de solution KCl-PBS par souris.
- Diluer 32% paraformaldéhyde (PFA) solution avec PBS pour obtenir une concentration finale de 4% PFA. Préparer 10 mL de 4% PFA en PBS par souris. La solution PFA diluée peut être conservée à 4 °C pendant 2 à 3 semaines dans un récipient en verre.
REMARQUE : La solution PFA préparée à 4 % peut être conservée à -20 °C pendant de plus longues périodes. - Préparer 1 mL de solution de collagène par souris en ajoutant 60 mg de collagènease, type 2 par 1 mL de PBS.
2. Perfusion et fixation du cœur
- Anesthésier l’animal en utilisant 2-5% isoflurane avec un débit d’oxygène de 1 L/min. Confirmez l’anesthésie en confirmant le manque de mouvement et le taux de respiration plus faible.
NOTE: Injection d’héparine (100-500 U/kg) avant l’euthanasie peut augmenter la qualité cellulaire et le rendement en empêchant les caillots sanguins, permettant ainsi une perfusion plus efficace du cœur avec fixatif. - Euthanasier l’animal selon des méthodologies approuvées.
REMARQUE : Nous avons suivi les lignes directrices de l’American Veterinary Medical Association pour l’euthanasie des animaux et obtenu l’approbation locale de l’IACUC pour l’euthanasie. - Placez l’animal euthanasié en position de supination et collez les membres étendus.
- Couper à travers la poitrine pour exposer le cœur à l’aide de ciseaux à extrémité émoussée. Couper l’aorte descendante et la veine inférieure de caval.
- Perfusez le cœur en injectant 3 mL de solution KCl-PBS à travers le ventricule gauche avec un débit de 3 mL/min à l’aide d’une pompe péristaltique attachée à un ensemble de perfusion avec une aiguille papillon de 23 G (26 G pour les nouveau-nés). Assurez-vous de ne pas percer le septum.
REMARQUE : Sinon, utilisez une aiguille attachée à une seringue pour injecter des solutions. - Perfusez le cœur en injectant 10 mL de 4% de solution PFA pendant 10 min à l’aide d’une pompe péristaltique à une vitesse de 1 mL/min.
- Retirez tout le cœur à l’aide de ciseaux. Après avoir enlevé le cœur, il est possible d’isoler une région spécifique du cœur en incisant. Placez le cœur, ou un segment de celui-ci dans un tube de microcentrifuge de 1,5 mL contenant 1 ml de solution PFA de 4%. Incuber le cœur sur le rocker à température ambiante avec une vitesse de bascule comprise entre 20 et 30 tr/min pendant 1 h.
3. Isolement des cardiomyocytes fixes
- Placer le cœur dans une boîte de Pétri contenant une solution PBS. Pressez le cœur pour se débarrasser de toute PFA restant dans les ventricules, et laver dans PBS.
- Placez le cœur fixe dans un nouveau tube de microcentrifuge de 1,5 mL contenant une solution de collagène (60 mg/mL). Placer le tube sur le rocker (20-30 tr/min) à 37 °C pour l’incubation de nuit.
REMARQUE : Prolongez le temps d’incubation jusqu’à 1 semaine et réapprovisionnez la solution de collagène tous les deux jours pour réduire la variation possible du rendement si l’on s’attend à ce que les cœurs soient fibrotiques, ce qui pourrait nécessiter une plus longue digestion de la collagènease pour digérer le collagène extracellulaire. - Mettre la solution de collagène et le cœur dans une boîte de Pétri de 35 mm. Dissocier le cœur en morceaux de 1 mm à l’aide de forceps ou de ciseaux.
- Utilisez une pipette de transfert pour triturer davantage le tissu dissocié pendant 2 min. Si des particules de tissu restent dans le plat, utilisez une pipette de transfert avec une ouverture plus étroite et continuez la trituration. Continuer jusqu’à ce que la majorité du tissu soit décomposée.
REMARQUE : La trituration provoque une rupture des cardiomyocytes individuels. Assurez-vous de ne pas trop triturer en vérifiant régulièrement sous un microscope. - Placez un maillage en nylon de 200 à 600 μm sur l’ouverture d’un tube de centrifugeuse de 15 mL.
REMARQUE : Pour les cardiomyocytes hypertrophiés, il est recommandé d’utiliser une maille de nylon de 400 μm au lieu de 200 μm. - Ajouter 5 mL de PBS à la boîte de Pétri contenant des cellules dissociées et filtrer la solution à l’eau à l’eau de nylon, y compris les particules de tissu. Laver la maille de nylon en passant 4 mL PBS supplémentaires.
- Centrifuge la solution filtrée à 10-100 x g pendant 1 min.
NOTE : 100 x g de centrifugation ne donnera pas 100% population de cardiomyocytes purs, et certaines cellules non-cardiomyocytes sont susceptibles d’être inclus. - Jetez le supernatant à moins que l’on veut tacher / évaluer les cellules cardiaques non-cardiomyocytes ainsi. Resuspendez le granulé dans 10 mL PBS avant la coloration.
4. Cartaining cardiomyocytes
- Recueillir les cellules par centrifugation à 100 x g pendant 1 min et ajouter 5 mL de solution de perméabilisation (par exemple, 0,5% Triton X-100 en PBS). Incuber pendant 20 min à température ambiante sur le rocker.
REMARQUE : Pour les étapes 4.1, 4.2 et 4.4 utiliser des tubes de centrifugeuse de 15 mL car il est plus facile d’enlever le supernatant sans perturber le granulé cellulaire par rapport aux tubes de microcentrifuge de 1,5 mL. - Recueillir les cellules par centrifugation à 100 x g pendant 1 min, ajouter 5 mL de tampon de blocage (par exemple, 3% d’albumine de sérum bovin [BSA] en PBS) et incuber pendant 30 min à température ambiante sur un rocker.
- Recueillir les cellules par centrifugation à 100 x g pendant 1 min et ajouter 1 mL de solution d’anticorps primaires (en PBS) avec le rapport de dilution approprié. Transférer la solution dans un tube de microcentrifuge de 1,5 mL et incuber les cardiomyocytes dans une solution d’anticorps primaire dans des conditions optimisées (p. ex., 4 °C pendant la nuit).
- Transférer les cardiomyocytes avec une solution d’anticorps primaire dans un tube de centrifugeuse de 15 ml et ajouter 9 ml de PBS. Incuber les cardiomyocytes pendant 10 min à température ambiante sur un rocker.
- Recueillir les cellules par centrifugation à 100 x g pendant 1 min et ajouter 10 mL de PBS. Incuber les cardiomyocytes pendant 10 min à température ambiante sur un rocker. Répétez cette étape une fois de plus.
- Recueillir les cellules par centrifugation à 100 x g pendant 1 min et ajouter la solution d’anticorps secondaire contenant DAPI. Incuber pendant 30 min à température ambiante sur un rocker, suivi d’une étape répétée 4,5 deux fois pour laver les cardiomyocytes.
- Placez les cellules soit sur des couvercles ou des plaques compatibles avec le microscope et procédez à l’imagerie.
REMARQUE : Les images incluses dans le manuscrit ont été prises avec des objectifs 10x et 40x. Les lasers utilisés étaient : 405 nm pour DAPI, 561 nm pour Alpha actinin et 640 nm pour Edu.
5. Logiciel d’imagerie d’installation
REMARQUE : Suivez ces étapes à l’aide du fichier supplémentaire 1-SoftwareScreenshots.pdf.
- Téléchargez la distribution fidjienne de ImageJ.
- Fidji. Cliquez sur Aide > Mise à jour... > Gérer les sites de mise à jour. Consultez les sites de mise à jour « IJPB-plugin » et « iomedgroup » pour télécharger les plugins dépendances Ellipse Split et Morpholibj.
- Cliquez sur Fermer. Fidji devrait commencer à télécharger les dépendances. Redémarrez Fidji une fois terminé.
- Téléchargez Rstudio et ouvrez-le.
- Copiez install.packages(c(« ggplot2 », « autothresholdr », « dplyr », « purrr », « jsonlite », « brillant »)dans la ligne de commande de la console R et appuyez sur la touche Entrée. Tapez « » en réponse à toutes les invites à installer toutes les dépendances R (Capture d’écran 1 dans le fichier supplémentaire 1).
6. Quantification de l’image
- Ouvrez les Fidji et faites glisser « AnalyzeNucleation.py » (fourni sous forme de fichier de code supplémentaire) dans la barre d’état des Fidji. Cela ouvrira une fenêtre d’édition de scripts. Cliquez sur Exécuter dans le coin inférieur gauche pour commencer (Capture d’écran 2 dans le fichier supplémentaire 1).
- Une boîte de dialogue apparaîtra(Fichier supplémentaire 1: Capture d’écran 3), demandant l’emplacement du répertoire de données de sortie. Toutes les données d’analyse, chiffres et autres données utilisées par ce logiciel seront stockées dans ce dossier. Une autre boîte de dialogue plus grande apparaîtra, affichant tous les paramètres d’analysed’image (Fichier supplémentaire 1: Capture d’écran 4).
- Sélectionnez l’emplacement du répertoire contenant des images à analyser.
- Entrez le format nom de fichier d’image à l’aide d’expressions régulières. Entrez le format nom de fichier d’image, indiquant quelles parties du nom de fichier correspondent à la ligne, à la colonne, au canal et (en option) au sein des accolades, à l’aide d’expressions régulières. Ne placez pas d’espaces dans les accolades. Entourez les parties variables du format de nom de fichier dans les accolades {}. La façon dont les fichiers sont enregistrés dépend du logiciel d’imagerie, et cette étape récupérera les informations pertinentes à partir du nom de fichier d’image.
REMARQUE : Par exemple, la chaîne de format
r » Plaque 1-(? P[A-Za-z]+)(? P[0-9]+)-(? P[A-Za-z]+).tif »
décrit un nom de fichier qui commence par « lan », qui est suivie d’une ou plusieurs lettres alphabétiques indiquant la ligne, qui est suivie d’un ou plusieurs chiffres indiquant la colonne, qui est suivie par « », qui est suivie par une ou plusieurs lettres indiquant le canal, qui est suivie par « ». Les lettres à l’intérieur des crochets d’angle comme « <> » sont des noms variables et sont automatiquement copiées dans les données lorsqu’elles sont collectées. L’un des noms variables doit être « » - Indiquer le nom des canaux dans lesquels la tache nucléaire est visible et où les cardiomyocytes sont visibles. Ces noms doivent être exactement comme ils sont dans la partie appariée par la variable « » dans les noms de fichiers d’expression régulière.
- Indiquez comment les images doivent être regroupées à l’aide de noms de variables séparés par virgule. Toutes les images d’un groupe donné seront ouvertes et analysées en un seul lot. Par exemple, si les images sont divisées en ensembles pour chaque puits, et qu’il y a un puits pour chaque combinaison unique de ligne et de colonne, écrivez « ligne, colonne » dans ce champ.
REMARQUE : Ces variables de regroupement doivent être un sous-ensemble des variables utilisées dans la chaîne de format. N’utilisez pas « canal » comme variable de regroupement, cela séparera les images correspondantes des canaux les unes des autres. - Indiquez si les images sont cousues ensemble dans une image de puits ou si elles sont séparées pour chaque site. Dans le premier cas, le site ne doit pas être indiqué dans la chaîne de format nom de fichier.
- Choisissez la méthode de seuil à utiliser pour séparer les noyaux de l’arrière-plan. Toutes les méthodes de seuil standard des Fidji sont disponibles. Testez différentes méthodes de seuil pour déterminer ce qui fonctionne le mieux pour l’ensemble d’images. Dans cet exemple, choisissez la méthode Otsu.
- Indiquez si le seuil doit être recalculé pour chaque image de site ou si le même seuil doit être utilisé pour chaque image du groupe. Indiquez si les images de cardiomyocytes sont de champ lumineux ou utilisez un marqueur fluorescent.
- Indiquez la méthode de seuil de cardiomyocyte. Si brightfield a été choisi dans l’étape précédente, cette méthode de seuil sera appliquée aux images de champ lumineux filtrées par bord. Indiquez si le seuil doit être recalculé pour chaque image de site ou si le même seuil doit être utilisé pour chaque image du groupe.
- Indiquez le nombre de lignes d’images de site qui couvrent chaque puits. Indiquez le nombre de colonnes d’images de site qui couvrent chaque puits. Indiquez la zone minimale des noyaux en pixels. Utilisez une taille minimale généreusement basse, un seuil plus élevé et plus précis sera calculé dans l’étape d’analyse. Indiquez la zone minimale des cardiomyocytes.
- Après avoir choisi les paramètres souhaités, cliquez sur OK.
- Les images ressemblant à celles de la figure 3 et de la figure 4 apparaîtront à l’écran, montrant les différentes étapes du pipeline d’analyse. Inspectez ces images pour vous assurer que les seuils et la segmentation se produisent correctement.
- Le dossier de résultats sélectionné doit maintenant être rempli de donnéesd’analyse( Fichier supplémentaire 1 : Capture d’écran 5). Les fichiers autres que les données d’analyse peuvent être enregistrés en toute sécurité dans ce dossier tant que leurs noms ne commencent pas par « cm_ », « nuclei_ » ou « nucleilink_ ».
7. Analyse des données
REMARQUE : Les fichiers csv qui sont produits peuvent être analysés manuellement. Chaque sous-ensemble d’images analysé produit un triplet de fichiers csv nommés « noyaux(métadonnées).csv », « nucléilink(métadonnées).csv » et « cidomyocytes(métadonnées), csv », où (métadonnées) est remplacée par une séquence de paires de valeur de nom du formulaire « _(name)=(value », où (nom) et (valeur) sont des séquences de caractères alphanumériques dérivés de chaînes appariées dans l’expression régulière donnée précédemment. (Par exemple, si la ligne et la colonne étaient indiquées dans les noms de fichiers, des chaînes comme « _row=F » et « _column=8 » seront présentes). La colonne la plus à gauche non nommée de chaque fichier noyaux et noyaux est un numéro d’ID noyau. La colonne « » du fichier noyaux est l’id du cardiomyocyte qui contenait ledit noyau entièrement ou 0 autrement. La colonne « a » des noyaux est l’ID du cardiomyocyte le plus numéroté qui contenait ledit noyau en partie, ou 0 autrement. La colonne « moyenne » du fichier cardiomyocytes est le numéro d’identification de cardiomyocyte.
- Ouvrez « AnalyzeMultinucleatedServer.R » dans Rstudio (fourni sous forme de fichier de code supplémentaire).
- En haut de ce fichier se trouve une variable nommée « folderName ». A côté se trouve un dossier. Dans ici, tapez le chemin d’accès au dossier de données de sortie sélectionné dans la dernière étape, sans la barre oblique finale (Fichier supplémentaire 1: Capture d’écran 6).
- Dans le coin supérieur gauche de la fenêtre d’édition du script, il doit y avoir une flèche verte étiquetée Exécuter l’application. Cliquez sur cette flèche. Il peut prendre un certain temps pour les données à charger et pour l’application à pop up.
- Au départ, trois graphiques de gating seront visibles, l’un pour indiquer le seuil minimum valide de zone nucléaire, l’autre pour indiquer le seuil d’intensité moyenne nucléaire valide minimum, et l’autre pour indiquer le diamètre minimum valide maximum de feret pour les cardiomyocytes. Utilisez les curseurs pour définir ces seuils (Fichier supplémentaire 1: Capture d’écran 7).
REMARQUE : Dans chacun de ces graphiques, un grand pic large correspondant aux noyaux ou aux cardiomyocytes valides doit être présent, flanqué de larges queues représentant des débris ou des cardiomyocytes segmentés erronés. Utilisez les seuils pour couper une queue de chacun des pics. - Faites défiler. Cliquez sur le bouton Appliquer les seuils sélectionnés (en bas du fichier supplémentaire 1: Capture d’écran 7).
- Cliquez sur le bouton Tracer la distribution d’intensité. Cela rendra la parcelle de la distribution d’intensité nucléaire de l’échantillon entier et des sous-parcelles séparées pour chaque variable de regroupement.
REMARQUE : Par exemple, si et les variables de regroupement ont été entrées dans l’expression régulière de la boîte de dialogue Fidji, des parcelles indiquant la distribution d’intensité par ligne et par colonne s’affichent ici (Fichier supplémentaire 1: Capture d’écran 8). Si les conditions d’illumination et de coloration étaient constantes dans les différentes parties de l’échantillon, ces parcelles devraient toutes indiquer clairement deux pics d’intensité, un gradateur, plus grand pour les noyaux diploïdes et un plus lumineux et plus court pour les noyaux tétraploïdes. - La variation intrasample fera en sorte que ce modèle n’est pas visible dans l’ensemble de l’intrigue de l’échantillon et qu’il y a une grande variété dans l’emplacement des pics diploïdes et tétraploïdes par ligne, colonne ou autre variable de regroupement. Dans ce dernier cas, faites défiler vers le bas cochez la case à cocher Normaliser séparément par groupe pour tenir compte de cette variation ( Fichier supplémentaire1: Capture d’écran 9).
- Cliquez sur le bouton Calculer Ployy (Fichier supplémentaire 1: Capture d’écran 9). Cliquez sur le bouton Tracer la distribution de ploy estimé. Les graphiques apparaissent dans les fenêtres vides à droite. Dans le graphique normalisé à échantillon entier, le modèle à deux pics doit être visible s’il ne l’était pas auparavant.
- Sélectionnez les seuils pour isoler les pics diploïdes et tétraploïdes les uns des autres et les valeurs aberrantes à l’aide des curseurs (Fichier supplémentaire 1: Capture d’écran 9). Faites défiler. Cliquez sur le bouton Calculer Ployy et Nucleation (Fichier supplémentaire 1: Capture d’écran 10).
- Cliquez sur le bouton Tracer et enregistrer dans le dossier résultats. L’intrigue enregistrée dans le dossier de résultats sélectionné s’affiche également dans cette fenêtre interactive(Fichier supplémentaire 1: Capture d’écran 10).
Résultats
Les cardiomyocytes ont été isolés selon le protocole décrit ci-dessus. En utilisant cette méthode, nous obtenons généralement des cardiomyocytes uniformément singuliers qui sont relativement purs sans contaminer les cellules non cardiomyocytes (Figure 1A). Les cardiomyocytes sont facilement identifiables sous la microscopie lumineuse de champ en raison de leur taille caractéristique et de la birefringence. Cette technique est facile à mettre en œuvre et fournit des résultats cohérents de différents isolements avec des rendements et une qualité de cardiomyocytes comparables (Figure 1B). Les cardiomyocytes isolés peuvent être stockés à 4 °C pendant plusieurs semaines avant d’être utilisés davantage.
Les cardiomyocytes qui ont été isolés selon le protocole ci-dessus peuvent être utilisés pour diverses applications en aval, telles que la taille de cardiomyocyte, le stratagème de cardiomyocyte et l’immunocytochimie. En conséquence représentative, nous montrons que les cardiomyocytes isolés selon ce protocole peuvent être tachés à l’aide d’anticorps et d’azides fluorochromes conjugués pour la chimie des clics afin de détecter la localisation de protéines spécifiques ou de détecter la réplication de l’ADN cardiomyocyte, respectivement. Par exemple, nous avons taché des cardiomyocytes avec des anticorps reconnaissant α-actinine pour montrer le modèle caractéristique de coloration en ligne z des sarcomeres (Figure 2A). Dans une expérience distincte, nous avons administré l’analogue de thymidine 5-Ethynyl-2'-désoxyuridine (Edu) aux souris avant d’isoler les cardiomyocytes fixes. Après l’isolement cardiomyocyte, nous avons taché pour incorporé EdU utilisant les protocoles standard13, et avons été en mesure de détecter les cardiomyocytes qui avaient subi la phase S dans les cardiomyocytes mononucléés, binucléated et trinucléés (Figure 2B).
Pour étendre davantage l’utilité de la méthode d’isolement, nous avons développé un pipeline qui permet la quantification du stratagème de cardiomyocyte basé sur la coloration intégrée de l’ADN. Pour pouvoir mesurer l’état de stratagème des cellules ou des noyaux, nous avons eu besoin de segmenter les noyaux et les cardiomyocytes. La figure 3 montre une représentation de la stratégie que nous avons utilisée pour identifier les noyaux individuels. Tout d’abord, l’image originale tachéed’ADN( figure 3A) est seuil basée surl’intensité( Figure 3B). Ici, nous avons utilisé DAPI pour tacher pour l’ADN, mais tout autre colorant nucléaire qui montre une corrélation linéaire avec la teneur en ADN fonctionnerait. Le programme permet de choisir l’une des méthodes de seuil d’intensité des Fidji, mais dans cet exemple, la méthode d’Otsu a été utilisée. Les masques nucléaires qui touchent le bord de l’image ou qui sont plus petits que le seuil de zone minimale de pixel spécifié sont exclus. Ensuite, les ellipses sont adaptées aux masques nucléaires, segmentant les noyaux individuels. La figure 3C montre ces ellipses superposées sur l’image d’origine. Ensuite, les trous sont remplis dans les masques, et les pixels de l’image sont ensuite divisés en territoires basés sur laquelle ellipse ils sont les plus proximaux à (Figure 3D). Les frontières de ces territoires sont ensuite utilisées pour tracer des lignes à travers les grappes nucléaires, en terminant le processus de segmentation nucléaire (Figure 3E).
L’étape suivante consiste à détecter les cardiomyocytes. Pour les images cardiomyocytes obtenues à partir de cellules tachées fluorescentes (Figure 4A),le processus est très similaire à celui des noyaux. L’image est seuilnée en fonction d’une valeur d’intensité calculée par la méthode de seuil sélectionnée, dans ce cas la méthode triangle. Les masques cardiomyocytes identifiés qui touchent la limite de l’image ou qui sont en dessous d’une certaine taille sont exclus et des trous sont remplis dans les masques pour fournir des cardiomyocytes correctement segmentés (figure 4B). Parce que les cardiomyocytes ont une forme plus irrégulière que les noyaux, aucune tentative n’est faite pour segmenter les grappes de cardiomyocytes. Au lieu de cela, ces grappes sont exclues en fonction de leur diamètre minimum élevé feret au cours de l’étape d’analyse. La segmentation des images de champ lumineux se fait légèrement différemment. Tout d’abord, l’image de champ lumineuxd’origine( Figure 4C) est traitée avec un filtre de bord Sobel. Ce filtre calcule la valeur absolue du dégradé de chaque pixel dans l’image. Les pixels dans les régions avec des changements rapides reçoivent des valeurs élevées et les pixels dans les régions lisses de l’image reçoivent des valeurs faibles. Cette image filtrée par bord est ensuite seuil par intensité, à l’aide de la méthode Triangle, résultant en cardiomyocytes masqués (Figure 4D). Ces masques très irréguliers sont ensuite lissés et reliés entre eux par fermeture morphologique à l’aide d’un cercle d’un rayon de 2 pixels, qui remplit toutes les régions blanches de l’image où le cercle ne peut s’adapter sans superposer une région noire (Figure 4E). Enfin, les trous dans les masques sont remplis, les régions touchant la frontière sont exclues, et de petites particules sont enlevées, ce qui termine le processus de segmentation des cardiomyocytes (Figure 4F).
À l’aide de la stratégie de segmentation décrite, nous pouvons alors déterminer l’état de nucléation des cardiomyocytes individuels. En utilisant cette approche, nous avons déterminé l’état de nucléation des cardiomyocytes isolés des coeurs des souris de CD-1 outbred aux temps postnatal tôt. Les cœurs de souris nouveau-nées (premier jour de la vie) ont montré que la majorité des cardiomyocytes à ce moment-là sont mononucléés (figure 5: néonatal). Cette fréquence élevée de cardiomyocytes mononucléés est beaucoup plus faible chez les souris juvéniles (2 semaines), où les cardiomyocytes mononucléés représentent environ 25 % de la population totale de cardiomyocytes(figure 5: juvénile). Enfin, nous pouvons mesurer le statut de stratagème des noyaux individuels dans les cardiomyocytes, et déterminer s’ils sont diploïdes ou tétraploïdes. Ces résultats montrent une fréquence plus élevée des noyaux tétraploïdes chez les souris adolescentes (figure 6).

Figure 1 : Efficacité de l’isolement de cardiomyocyte après fixation. (A) Image représentative des cardiomyocytes isolés tachés de DAPI pour montrer des noyaux. (DAPI (bleu), Brightfield (gris)) (B) Rendement des cardiomyocytes isolés de différentes souris à l’âge de 3 mois. Barres d’échelle = 50 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
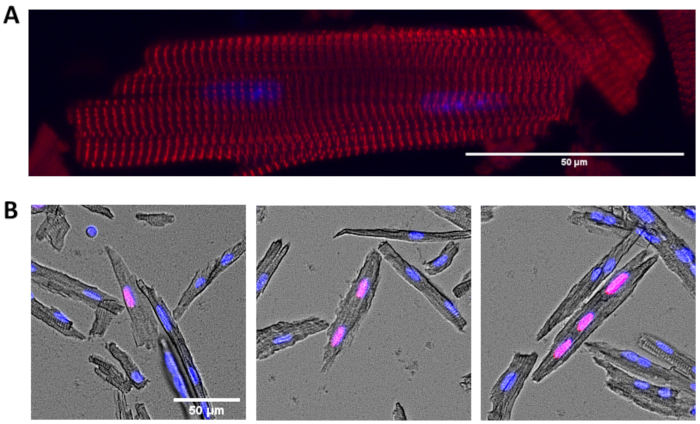
Figure 2 : Immunocytochimie des cardiomyocytes isolés. (A) Image représentative des cardiomyocytes tachés pour α-actinine (α-actinine (rouge) et DAPI (bleu)). (B) Cardiomyocytes tachés pour incorporé EdU (rouge) et DAPI (bleu). Des cardiomyocytes représentatifs qui sont mononucléés (à gauche), binucléisés (au milieu) et trinucléés (à droite) et edu positifs sont montrés. Barres d’échelle = 50 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
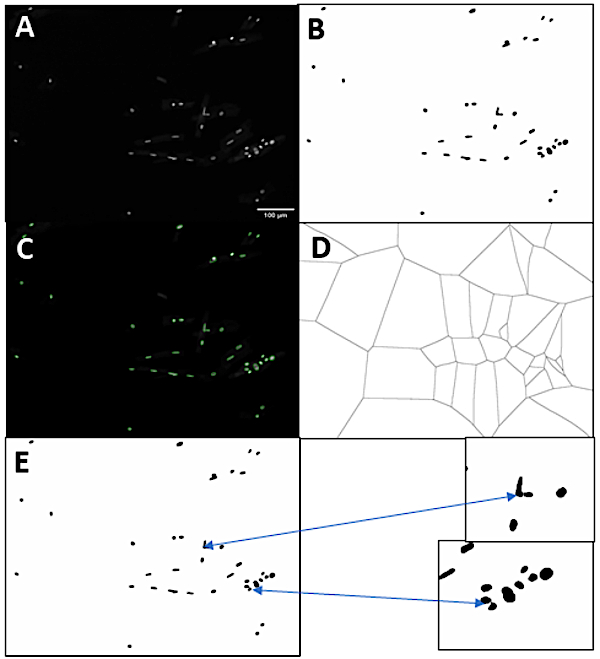
Figure 3 : Stratégie de segmentation nucléaire. (A) Image originale du canal DAPI. (B) Image à seuil (dans cet exemple, la méthode d’Otsu a été utilisée). (C) Masques identifiés à partir des images à seuil superposées sur l’image tachée originale du DAPI. (D) Tessellation voronoi basée sur des masques nucléaires. (E) Derniers noyaux segmentés, avec des grappes fractionnées mises en surbrillance. Barres d’échelle = 100 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.

Figure 4 : Stratégie de segmentation des cardiomyocytes. (A) Original fluorescent Troponin J’ai taché image cardiomyocyte. (B) Image à seuil triangle, après avoir rempli les trous et à l’exclusion des petits objets et de ceux qui touchent la bordure. (C) Image cardiomyocyte de champ lumineux originale (D) Image cardiomyocyte de bord-filtrée et triangle-seuiled (E) Image morphologique de bord après fermeture morphologique avec un rayon de deux pixels (F) Même image après avoir rempli des trous et à l’exclusion des petits objets et ceux touchant la frontière. Barres d’échelle = 100 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.

Figure 5 : Classification des cardiomyocytes en fonction du nombre de noyaux. Les cœurs néonatals (1 jour) contiennent plus de cardiomyocytes mononucléés que les cœurs juvéniles (14 jours). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
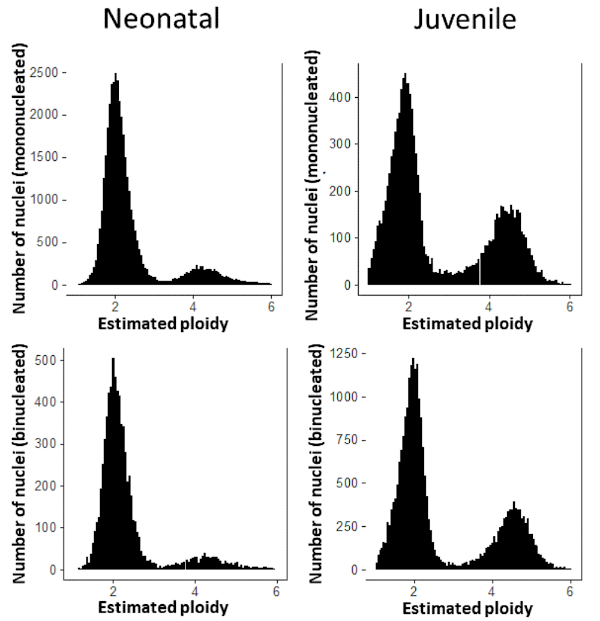
Figure 6 : Distribution de la teneur en ADN de cardiomyocyte par noyau. Chez les nouveau-nés (à gauche), 13,5 % des noyaux CM mononucléés sont tétraploïdes et 11,9 % des noyaux cm binucléated sont tétraploïdes. Chez les juvéniles (à droite), 33,9 % des noyaux CM mononucléés sont tétraploïdes et 31,2 % des noyaux cm binucléisés sont tétraploïdes. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Fichier supplémentaire 1 : Captures d’écran logicielles. Veuillez cliquer ici pour voir ce fichier (cliquez avec le bouton droit pour télécharger).
Dossier supplémentaire 2 : AnalyzeNucleation.py. Veuillez cliquer ici pour voir ce fichier (cliquez avec le bouton droit pour télécharger).
Fichier supplémentaire 3 : AnalyzeMultinucleatedServer.R. Veuillez cliquer ici pour voir ce fichier (cliquez avec le bouton droit pour télécharger).
Discussion
Étant donné que les cardiomyocytes ne peuvent pas être maintenus en culture, il est important d’isoler les cardiomyocytes primaires pour pouvoir étudier leur architecture et leur fonction11. Par conséquent, les techniques d’isolement cardiomyocyte ont été largement utilisées dans le domaine cardiaque. Si l’objectif est de déterminer les aspects fonctionnels des cardiomyocytes, il est important d’isoler les cardiomyocytes viables. Ces cardiomyocytes vivants peuvent également être utilisés pour effectuer l’immunostaining sur les cardiomyocytes isolés. Cependant, l’optimisation de la technique d’isolement des cardiomyocytes vivants est techniquement difficile, et même les meilleures techniques ne donnent généralement que 60-65% de cardiomyocytes vivants en forme de tige, et les cardiomyocytes restants sont tous balled up et mourir ou mort11,12. Ici, nous avons développé une technique qui permettra aux chercheurs de fixer d’abord le cœur, puis d’isoler efficacement les cardiomyocytes. Ce nouveau protocole permet des rendements beaucoup plus élevés de cardiomyocytes en forme de tige par rapport aux protocoles publiés précédemment. En outre, nous avons développé une plate-forme d’analyse d’imagerie pour catégoriser les cardiomyocytes automatiquement en fonction de la nucléation et du stratagème. Avec ces nouvelles méthodologies, les groupes peuvent tacher les cardiomyocytes pour différentes protéines, et étudier le ployage cardiomyocyte et le statut de nucléation comme substituts pour le potentiel régénératif du cœur.
Le protocole décrit ici est relativement simple et peut être exécuté sans équipement avancé. La quantité de collagènease et le temps d’incubation pour la digestion peut varier en fonction du lot de collagène, et la société de le fournir. Nous avons utilisé la collagène de type 2, car c’est le plus largement utilisé pour digérer le cœur pour obtenir des cardiomyocytes vivants. Sur la base de nos observations, nous avons déterminé que l’incubation de nuit avec 60 mg/mL collagènease type 2 est optimale pour presque tous les cœurs de souris indépendamment du niveau de fibrose. Nous n’avons jamais eu un problème de surdiggestion que les protéines intracellulaires sont fixes et pas aussi accessibles que le collagène extracellulaire. Cependant, si le cœur n’est pas digéré correctement, une trituration plus vigoureuse pourrait être nécessaire, ce qui provoque la fragmentation cellulaire due au stress de cisaillement. Ainsi, il est crucial de s’assurer que le cœur est digéré correctement avant de passer à la trituration. La rigidité du cœur peut être testée en serrant avec des forceps pour évaluer le degré de digestion. Après l’incubation avec la collagène, les cœurs doivent être moins raides et faciles à déchirer. D’autres types de collagène peuvent également être utilisés. Un rapport précédent a utilisé une combinaison de collagèneases B et D14.
En outre, nous croyons que ce protocole peut être utilisé pour évaluer le nombre global de cardiomyocytes dans le cœur15. Cependant, si l’objectif est d’obtenir et de quantifier tous les cardiomyocytes du cœur, il est important d’incuber les cœurs pendant de longues périodes de temps dans la solution de collagène (par exemple, 3-7 jours), où la solution de collagène devrait être réapprovisionnée une fois par jour. Cela permettra de minimiser les incohérences dans l’efficacité de l’isolement en éliminant l’impact du degré de trituration sur le rendement des cardiomyocytes.
L’utilisation du contenu de l’ADN pour mesurer le stratagème n’est pas nouvelle, et a été utilisée dans la cytométrie de flux pendant des décennies. Récemment, il a été démontré que la microscopie peut également être utilisée pour estimer la teneur en ADN par noyau16. Ici, nous avons mis en œuvre cette stratégie pour mesurer le stratagème des noyaux de cardiomyocytes, comme substitut pour les cardiomyocytes nouvellement formés. Le dogme dans le domaine de la régénération cardiaque est que seuls les cardiomyocytes diploïdes mononucléés peuvent subir une cytokinesis et donner naissance à de nouveaux cardiomyocytes. Puisqu’il est très difficile de mesurer la nouvelle formation de cardiomyocyte in vivo, isolant les cardiomyocytes qui ont été poursuivis après l’administration d’un analogue de nucléotid d’ADN et déterminant le niveau des cardiomyocytes de diploïde mononucléés a été employé comme approximation de la capacité du coeur pour produire de nouveaux cardiomyocytes17. Ici, nous fournissons une macro pour ImageJ qui permet la quantification facile du stratagème de cardiomyocyte. Au minimum, 500 noyaux doivent être mesurés pour obtenir une estimation précise de l’emplacement du pic G1. Si l’on veille à ce que les conditions de coloration et d’imagerie soient uniformes dans chaque puits de la plaque d’image, seuls 500 noyaux sur l’ensemble de l’échantillon doivent être photographiés, sinon, il doit y avoir 500 noyaux par groupe d’images18,19. Les limites de la mesure basée sur l’imagerie de la nucléation et du stratagème incluent la difficulté à distinguer les noyaux des cellules adhérentes des noyaux cardiomyocytés réels, lors de l’utilisation d’images bidimensionnelles. De telles cellules adhérentes pourraient entraîner une surestimation de la quantité de cellules multinucléées et diminuer la précision des mesures de la population du noyau de cardiomyocyte tétraploïde. Une stratégie possible pour résoudre ce problème serait d’utiliser le marqueur nucléaire cardiomyocyte PCM16,20. Cependant, nous avons eu des difficultés à obtenir des taches PCM1 fiables sur des cellules ou des tissus correctement fixes.
Une autre limitation potentielle est que certaines images de taches nucléaires pourraient avoir des taches cytoplasmiques de fond significatives, empêchant le seuil approprié utilisant les Fidji construit dans les méthodes sans prétraitement étendu. En outre, la contribution irrégulière de cette fluorescence de fond dans les estimations de stratagème réduit leur précision. En outre, si les cellules ne sont pas laissées dans la solution de coloration de l’ADN pendant suffisamment de temps, le colorant fluorescent ne se liera pas à la saturation dans les noyaux et l’hypothèse d’une relation linéaire entre l’intensité intégrée nucléaire et la teneur en ADN ne sera plus exacte.
Il convient de noter que le logiciel ne peut pas segmenter les grappes de cardiomyocytes et les supprime plutôt de l’analyse. Par conséquent, il est d’une importance cruciale de semer des cardiomyocytes à une densité relativement faible (p. ex., 1000 cellules/cm2). De plus, le logiciel ne peut pas faire la distinction entre deux cardiomyocytes alignés de bout en bout et de longs cardiomyocytes singuliers. Ces types de grappes pourraient gonfler par erreur les estimations multinucléaires.
Bien que la méthode décrite ne permet pas d’obtenir des cardiomyocytes viables et ne peut donc pas être utilisé pour mesurer les processus cellulaires dynamiques, si l’objectif est d’effectuer l’immunostaining, nous croyons que la méthode décrite est supérieure aux protocoles existants avec des rendements plus élevés de cardiomyocytes et une meilleure qualité en termes de morphologie et de localisation des protéines. Enfin, la méthode décrite pourrait être utilisée pour isoler les cardiomyocytes des échantillons cliniques14,21. Nous croyons que la méthodologie décrite peut aider différents chercheurs à obtenir des cardiomyocytes de haute qualité et mesurer la nucléation et le stratagème comme substituts pour la formation de nouveaux cardiomyocytes.
Déclarations de divulgation
Les auteurs n’ont rien à révéler.
Remerciements
JHvB est soutenu par des subventions du NIH, médecine régénérative du Minnesota, et un prix de recherche biomédicale individuel de la Fondation Hartwell.
matériels
| Name | Company | Catalog Number | Comments |
| 96 wells plate for imaging | Corning | 3340 | We use these plates as they are suitable for imaging, although glass bottom plates would be better for confocal imaging |
| Alpha actinin | Novus Biologicals | NBP1-32462 | This antibody is used as a marker of cardiomyocyte sarcomeres |
| Blunt scissors | Fine Scissor Tools | 14072-10 | We prefer blunt scissors as the possibility of tearing heart tissue is lower when exposing the heart |
| C57BL/6J | The Jackson Laboratory | 664 | Used for imaging, assessing ploidy and nucleation in cardiomyocyte population |
| CD-1 mice | Charles river | 22 | Used for imaging, assessing ploidy and nucleation in cardiomyocyte population |
| Collagenase 2 | Worthington | LS004177 | For the purpose of this protocol, the batch to batch differences are minimal and don't affect overall yield and quality of the isolation |
| Copper (II) sulfate pentahydrate | Sigma-Aldrich | 203165-10G | For edu staining |
| Cy5 Picolyl Azide | Click Chemistry Tools | 1177-25 | Azide used for edu staining |
| Cytation3 | BioTek | - | Used for automated imaging for DNA analysis |
| DAPI | Life Technologies | D3571 | DAPI used for DNA staining. Stocks were dissolved in distilled water. |
| donkey anti-mouse IgG-Alexa568 | Life Technologies | A10037 | Secondary antibody used to detect alpha actinin staining within cardiomyocytes |
| Forceps | ROBOZ | RS-5137 | We use these curved, blunt forceps, although straight forceps could also be used |
| Hydrochloric acid | Fisher Scientific | A144212 | To set pH of Tris-HCl buffer to pH 8.5 |
| ImageJ | imagej.net/Fiji/Downloads | - | Used for analyzing images |
| L-ascorbic acid | Sigma-Aldrich | 255564-100G | For edu staining |
| Needle for infusion | TERUMO | SV*23BLK | We use winged infusion sets throughout the protocol as it is easy to manipulate the position of the needle with these sets during injection |
| Nikon A1R HD25 | Nikon | - | Used to take confocal images of alpha actinin staining |
| Nylon mesh 200 micron | Elko filtering | 03-200/54 | Mesh used for filtering regular cardiomyocytes (not hypertrophied) |
| Nylon mesh 400 micron | Elko filtering | 06-400/38 | Mesh used for filtering hypertrophied adult cardiomyocytes |
| Phosphate Buffered Saline (1X) | Corning | 21-040-CV | This can also be prepared in the lab. Although sterility is important in this experiment, we think it is sufficient to prepare PBS and filtering it |
| Potassium chloride, Granular | Mallinckrodt | 6858 | Granular potassium chloride was preffered by us as it forms less aggregates when stored in room temperature |
| R | r-project.org | - | Used for data analysis of the measurements obtained from images |
| Tris Base | Fisher Scientific | BP152-5 | Used to buffer EdU staining reaction |
Références
- Benjamin, E. J., et al. Heart Disease and Stroke Statistics-2017 Update: A Report From the American Heart Association. Circulation. 135 (10), e146 (2017).
- Heidenreich, P. A., et al. Forecasting the future of cardiovascular disease in the United States: a policy statement from the American Heart Association. Circulation. 123 (8), 933-944 (2011).
- Eschenhagen, T., et al. Cardiomyocyte Regeneration: A Consensus Statement. Circulation. 136 (7), 680-686 (2017).
- Tzahor, E., Poss, K. D. Cardiac regeneration strategies: Staying young at heart. Science. 356 (6342), 1035-1039 (2017).
- Bergmann, O., et al. Dynamics of Cell Generation and Turnover in the Human Heart. Cell. 161 (7), 1566-1575 (2015).
- Richardson, G. D. Simultaneous Assessment of Cardiomyocyte DNA Synthesis and Ploidy: A Method to Assist Quantification of Cardiomyocyte Regeneration and Turnover. Journal of Visualized Experiments. (111), (2016).
- Bergmann, O., et al. Evidence for cardiomyocyte renewal in humans. Science. 324 (5923), 98-102 (2009).
- Senyo, S. E., et al. Mammalian heart renewal by pre-existing cardiomyocytes. Nature. 493 (7432), 433-436 (2013).
- Ang, K. L., et al. Limitations of conventional approaches to identify myocyte nuclei in histologic sections of the heart. American Journal of Physiology-Cell Physiology. 298 (6), C1603-C1609 (2010).
- Bergmann, O., et al. Identification of cardiomyocyte nuclei and assessment of ploidy for the analysis of cell turnover. Experimental Cell Research. 317 (2), 188-194 (2011).
- O'Connell, T. D., Rodrigo, M. C., Simpson, P. C. Isolation and culture of adult mouse cardiac myocytes. Methods in Molecular Biology. 357, 271-296 (2007).
- Ackers-Johnson, M., et al. A Simplified, Langendorff-Free Method for Concomitant Isolation of Viable Cardiac Myocytes and Nonmyocytes From the Adult Mouse Heart. Circulation Research. 119 (8), 909-920 (2016).
- Shaklee, J., et al. Development of a Click-Chemistry Reagent Compatible with Mass Cytometry. Scientific Reports. 8 (1), 6657 (2018).
- Mollova, M., et al. Cardiomyocyte proliferation contributes to heart growth in young humans. Proceedings of the National Academy of Sciences of the United States of America. 110 (4), 1446-1451 (2013).
- Naqvi, N., et al. A proliferative burst during preadolescence establishes the final cardiomyocyte number. Cell. 157 (4), 795-807 (2014).
- Roukos, V., Pegoraro, G., Voss, T. C., Misteli, T. Cell cycle staging of individual cells by fluorescence microscopy. Nature Protocols. 10 (2), 334-348 (2015).
- Patterson, M., et al. Frequency of mononuclear diploid cardiomyocytes underlies natural variation in heart regeneration. Nature Genetics. 49 (9), 1346-1353 (2017).
- Gomes, C. J., Harman, M. W., Centuori, S. M., Wolgemuth, C. W., Martinez, J. D. Measuring DNA content in live cells by fluorescence microscopy. Cell Division. 13, 6 (2018).
- Woo, L. A., et al. High-content phenotypic assay for proliferation of human iPSC-derived cardiomyocytes identifies L-type calcium channels as targets. Journal of Molecular and Cellular Cardiology. 127, 204-214 (2018).
- Morikawa, Y., Heallen, T., Leach, J., Xiao, Y., Martin, J. F. Dystrophin-glycoprotein complex sequesters Yap to inhibit cardiomyocyte proliferation. Nature. 547 (7662), 227-231 (2017).
- Bergmann, O., Jovinge, S. Isolation of cardiomyocyte nuclei from post-mortem tissue. Journal of Visualized Experiments. (65), (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon