Method Article
면역 세포 화학 및 Ploidy 분석을 위한 고정된 심혼에서 심근세포의 격리
요약
이 연구의 목표는 성인 심장에서 심근세포를 재현하고 DNA 함량 및 핵형성을 측정하는 방법을 개발하는 것입니다.
초록
성인 포유류 심장은 심근세포, 내피 세포 및 섬유아세포를 포함한 다양한 세포 유형으로 구성됩니다. 조직학적 섹션에서 심근세포핵을 안정적으로 식별하기 어렵기 때문에, 많은 그룹은 면역염색을 수행하기 위해 고정하기 전에 가능한 심근세포분리에 의존합니다. 그러나 이러한 살아있는 심근세포 격리 기술은 최대 최적화에도 불구하고 샘플에서 샘플로의 고유한 변동과 함께 샘플의 수율, 생존 가능성 및 품질을 최대화하기 위해 최적화가 필요합니다. 여기에서, 우리는 개별 심근세포의 생체 내 형태를 보존하면서 최대 수율로 이끌어 내는 심혼의 효소 소화의 앞에 고정을 관련시키는 재현가능한 프로토콜을 보고합니다. 우리는 또한 개별 심근세포에 대한 핵 당 핵과 DNA 함량의 수를 결정하기 위해 자동화 된 분석 플랫폼을 개발했다. 가슴 구멍을 노출 한 후, 심장은 PBS에서 60 mM KCl과 관혈에 의해 diastole에서 체포되었다. 다음으로, 심장은 4% 파라포름알데히드(PFA) 용액으로 고정된 다음 60 mg/mL 콜라게나제 용액으로 소화하였다. 소화 후, 세포는 트리튜션에 의해 특이화되었고, 심근세포 분획은 차동 원심분리를 통해 농축되었다. 분리된 심근세포는 로포닌 T와 α 액틴을 위해 염색되어 얻은 집단의 순도를 평가하였다. 또한, DAPI 염색 후 심근세포 핵형성 및 계피 상태를 결정하는 영상 분석 플랫폼을 개발했습니다. 이미지 기반 의 ploidy 평가는 일관되고 재현 가능한 결과로 이어졌습니다. 따라서, 이 프로토콜을 통해, 면역세포화학 및 DNA 함량 분석을 허용하기 위해 개별 심근세포의 네이티브 형태를 보존하는 동시에 최대 수율을 달성할 수 있다.
서문
심장 질환은 수십 년 동안 서방 국가의 대다수에서 주요 사망 원인이되었습니다1,,2. 심혈 관 질환의 치료에 많은 개선 은 생존을 향상, 비록 현재 잃어버린 된 심근 세포를 대체 할 수 있는 치료. 따라서 심근 세포 기능, 증식, 세포및 비대와 관련된 연구는 과학 계의 주요 초점이되고 있습니다. 성인 포유류 심장은 연간 1% 미만의 추정 심근세포 재생률을 가진 매우 제한된 재생 능력을 가지고 있기 때문에 심근세포 증식 이벤트3,,4를안정적으로 식별하는 것이 매우 중요합니다. 증식적 사건을 측정하는 대부분의 전략은 이전 또는 현재증식을 평가하기 위해 통합된 DNA 뉴클레오티드 유사체에 대한 염색또는 활성 증식5의핵 마커에 대한 얼룩에 의존한다. 증식성 심근세포의 전체 수가3,,6이너무 낮기 때문에 심근세포 증식 이벤트를 안정적으로 식별하는 것이 특히 중요하다. 예를 들어, 연간 내인성 심근세포의 1% 갱신률을 기준으로, 성인 마우스 심장7,,8에서주어진 시간에 25~50개의 심근세포가 증식될 것으로 예상할 수 있다. 심근 세포 핵의 식별에 있는 어떤 부정확성은 거짓 양성 결과로 이끌어 낼 수 있습니다. 따라서 조직학적 섹션에서 어렵고 신뢰할 수 없는 것으로 입증된 심근세포 핵을 안정적으로 식별하는 것이중요하다. 심근세포의 식별은 조직 단면도보다 단일 세포보다 훨씬 정확하며, PCM1은 조직학적섹션(10)에서심근세포 핵의 신뢰할 수 있는 마커일 수 있지만, α 액틴과 같은 마커를 사용하는 경우에도 다른 세포 유형과 심근세포를 구별하기 어려울 수 있다.
현재 프로토콜은 심근세포의 적어도 30%의 죽음을 일으키는 것으로 알려져 있으며, 심근세포11의특정 집단의 우발적 인 선택으로 이어질 수 있습니다 고정하기 전에 살아있는 심근구를 분리에 의존한다. 또한 이러한 프로토콜은 재현 가능한 결과를 제공하기 위해 최적화하기가 매우 어렵습니다. 최적화된 절연 기술조차도 일반적으로 다양한 수율12를가진 65% 이하의 살아있는 막대 모양의 심근구를 생성할 수 없습니다.
이러한 문제를 극복하기 위해, 우리는 연구원이 고정 된 심근 세포를 분리 할 수있는 프로토콜을 개발했습니다. 샘플은 격리 전에 고정되기 때문에 수율이 최대화되고 생체 내 형태가 잘 보존됩니다. 더욱이, 이 프로토콜을 사용하면 임상 샘플에서 심근세포들을 분리할 수 있으며, 이는 조달 직후에 일반적으로 고정된다. 더욱이, 새로 생성된 심근세포를 규명하기 위해, 개별 심근세포의 핵형성 및 계피 상태를 측정하는 것이 중요하며, 이는 디플로이드 심근세포들만이 전형적으로 새로 형성되는 것으로 가정되기 때문에 이다. 유동 세포측정은 다중핵을 폴리플로이디로부터 구별할 수 없으며 상대적으로 시간과 자원 집약적인 프로토콜이다. 이미지 내핵의 수동 개요 및 측정은 매우 낮은 처리량이며 인간의 편견에 취약합니다. 고정된 DAPI 염색 심근세포의 이미지를 자동화하여 이러한 두 가지 문제를 모두 해결합니다. 핵 형성 및 ploidy 분포의 이미징 기반 결정은 기본 장비를 사용하여 최소한의 시간과 시약을 얻을 수 있습니다.
프로토콜
모든 동물 실험은 건강 지침의 국가 학회에 따라 수행하고 미네소타 대학 기관 동물 관리 및 사용위원회 (IACUC)에 의해 승인되었다.
1. 솔루션 및 수술 장비 준비
- 격리하기 전에 70% 에탄올 용액을 사용하여 수술 장비를 소독합니다.
- KCl 2.24g을 500mL 인산염 완충식식염(PBS) 용액에 추가하여 60mMMMMM의 최종 농도를 얻습니다. KCl-PBS 솔루션을 실온에 저장합니다. 마우스당 KCl-PBS 솔루션 3mL을 사용하십시오.
- PBS로 32% 파라포름알데히드(PFA) 용액을 희석하여 최종 농도를 4% PFA로 얻습니다. 마우스당 PBS로 PFA 4%의 10mL를 준비합니다. 희석된 PFA 용액은 유리 용기에 2-3주 동안 4°C로 저장할 수 있다.
참고: 준비된 4% PFA 용액은 장시간 -20°C에 저장할 수 있습니다. - PBS 의 1 mL 당 60 mg의 콜라게나아제, 유형 2를 추가하여 마우스 당 콜라게나아제 용액 1mL을 준비하십시오.
2. 심장의 관류와 고정
- 1 L/min의 산소 유량으로 2-5%의 이소플루란을 사용하여 동물을 마취시합니다. 무브먼트부족과 호흡률을 낮게 확인하여 마취를 확인한다.
참고: 안락사 전에 헤파린(100-500 U/kg)을 주입하면 혈전을 예방하여 세포 품질과 수율을 높일 수 있으므로 심장의 보다 효율적인 관류를 고정할 수 있습니다. - 승인 된 방법론에 따라 동물을 안락사.
참고: 우리는 동물의 안락사에 대한 미국 수의학 협회 지침을 따르고 안락사에 대한 현지 IACUC 승인을 얻었습니다. - 안락사 된 동물을 supine 위치에 놓고 연장 된 팔다리를 테이프로 놓습니다.
- 가슴을 잘라 무딘 끝 가위를 사용하여 심장을 노출합니다. 내림차순 대목과 열등한 카발 정맥을 잘라냅니다.
- 23G 나비 바늘(신네이트용 26G)을 주입세트에 부착한 연막 펌프를 사용하여 좌심실을 통해 KCl-PBS 용액 3mL를 3mL의 유량으로 주입하여 심장을 퍼퓨즈한다. 중격을 관통하지 않도록하십시오.
참고: 또는 주사기에 부착된 바늘을 사용하여 용액을 주입하십시오. - 1 mL/분 의 속도로 연막 펌프를 사용하여 10 분 동안 4 % PFA 용액의 10 mL을 주입하여 심장을 perfuse.
- 가위를 사용하여 전체 심장을 제거합니다. 심장을 제거 한 후 절개를하여 심장의 특정 영역을 분리 할 수 있습니다. 심장, 또는 4% PFA 용액의 1mL를 포함하는 1.5 mL 마이크로 센심 분리기 튜브에 그것의 세그먼트를 놓습니다. 실온에서 로커에 심장을 배양하여 20-30 rpm 사이의 흔들기 속도로 1시간 동안 배양합니다.
3. 고정 심근세포의 격리
- PBS 용액이 들어 있는 페트리 접시에 하트를 놓습니다. 심실에 남아있는 PFA를 제거하고 PBS에서 씻어 심혼을 짜내십시오.
- 콜라게나아제 용액(60 mg/mL)을 함유한 새로운 1.5mL 마이크로센심분리기 튜브에 고정된 심장을 넣습니다. 하룻밤 잠복식을 위해 37 °C에 로커 (20-30 rpm)에 튜브를 놓습니다.
참고: 인큐베이션 시간을 최대 1주까지 연장하고 하트가 섬유질이 예상되는 경우 수율의 가능한 변화를 줄이기 위해 2일마다 콜라게나아제 용액을 보충하여 세포외 콜라겐을 소화하기 위해 콜라게나아제 소화의 시간이 길어질 수 있습니다. - 콜라게나아제 용액과 하트를 35mm 페트리 접시에 넣습니다. 집게 나 가위를 사용하여 심장을 1mm 조각으로 분리합니다.
- 이송 파이펫을 사용하여 2 분 동안 해리 된 조직을 더 세살하게하십시오. 조직 입자가 여전히 접시에 남아 있는 경우, 더 좁은 개구부와 전송 파이펫을 사용하고 트리튜레이션을 계속합니다. 조직의 대부분이 분해 될 때까지 계속.
참고: 과다로 인해 개별 심근세포가 파손됩니다. 현미경으로 정기적으로 확인하여 삼중되지 않도록하십시오. - 15mL 원심분리기 튜브의 개구부 위에 200-600 μm 나일론 메쉬를 놓습니다.
참고: 비대성 심근세포의 경우 200 μm 대신 400 μm 나일론 메쉬를 사용하는 것이 좋습니다. - 해리 된 세포를 포함하는 페트리 접시에 PBS5 mL을 추가하고 조직 입자를 포함하여 나일론 메쉬를 통해 용액을 필터링하십시오. 4mL PBS를 추가하여 나일론 메쉬를 씻으시면 됩니다.
- 1 분 동안 10-100 x g에서 필터링 된 용액을 원심 분리합니다.
참고: 100 x g 원심 분리는 100% 순수한 심근세포 집단을 산출하지 않으며, 일부 비심근구세포세포는 포함될 가능성이 높다. - 하나는 얼룩 /뿐만 아니라 비 심근 세포 심장 세포를 평가 하 고 싶지 않는 한 상체를 폐기. 염색하기 전에 10mL PBS에서 펠릿을 다시 중단합니다.
4. 심근세포 염색
- 1분 동안 100 x g에서 원심분리로 세포를 수집하고 5mL의 투과성 용액(예: PBS의 0.5% 트리톤 X-100)을 추가합니다. 로커의 실온에서 20분 동안 배양하십시오.
참고: 4.1, 4.2 및 4.4 단계의 경우 1.5 mL 미세 원심 분리튜브에 비해 세포 펠릿을 방해하지 않고 상퍼나탄을 제거하기 쉽기 때문에 15mL 원심분리기를 사용합니다. - 1 분 동안 100 x g에서 원심 분리로 세포를 수집하고, 블로킹 버퍼 5 mL (예 : PBS의 3 % 소 혈청 알부민 [BSA])를 추가하고 로커의 실온에서 30 분 동안 배양하십시오.
- 1분 동안 100 x g에서 원심분리로 세포를 수집하고 적절한 희석 비로 1차 항체 용액(PBS)의 1mL을 추가한다. 용액을 1.5mL 마이크로센심심분리기 튜브로 옮기고 최적화된 조건(예를 들어, 하룻밤 사이에 4°C)에서 1차 항체 용액에서 심근구를 배양한다.
- 15mL 원심분리기 튜브에 1차 항체 용액을 사용하여 심근세포를 전달하고 PBS의 9mL를 추가한다. 로커의 실온에서 심근세포가 10분 동안 배양합니다.
- 1 분 동안 100 x g에서 원심 분리에 의해 세포를 수집하고 PBS의 10 mL을 추가합니다. 로커의 실온에서 심근세포가 10분 동안 배양합니다. 이 단계를 다시 한 번 반복합니다.
- 1 분 동안 100 x g에서 원심 분리에 의해 세포를 수집하고 DAPI를 포함하는 이차 항체 용액을 추가합니다. 로커의 실온에서 30분 동안 배양한 다음 심근세포를 세척하기 위해 4.5단계를 반복합니다.
- 커버립 또는 현미경 호환 플레이트에 세포를 놓고 이미징을 진행합니다.
참고: 원고에 포함된 이미지는 10배 와 40배의 목표로 촬영되었습니다. 사용된 레이저는 DAPI를 위한 405nm, 알파 액티닌을 위한 561nm 및 에듀를 위한 640nm이었습니다.
5. 설치 이미징 소프트웨어
참고: 보충 파일 1-Software스크린.pdf를 사용하여 다음 단계를 따르십시오.
- ImageJ의 피지 배포판을 다운로드하십시오.
- 피지 오픈. 도움말 및 업데이트를 클릭합니다... > 업데이트 사이트 관리. "IJPB 플러그인"과 "Biomedgroup" 업데이트 사이트를 확인하여 종속성 플러그인 타원 스플리트와 모르폴리비즈를 다운로드하십시오.
- 닫기클릭 . 피지는 종속성을 다운로드하기 시작해야합니다. 완료되면 피지를 다시 시작합니다.
- Rstudio를 다운로드하고 엽니다.
- Copy Enter install.packages(c("ggplot2","자동 문턱", "dplyr", "purrr", "jsonlite", "shiny"))R 콘솔의 명령줄에 입력 키를 누릅니다. install.packagesc 모든 R 종속성을 설치하는 모든 프롬프트에 대한 응답으로 "y"를 입력합니다(추가 파일 1의스크린샷 1).
6. 이미지 정량화
- 피지를 열고 "AnalyzeNucleation.py"(보충 코드 파일로 제공)를 피지의 상태 표시줄로 드래그합니다. 이렇게 하면 스크립트 편집 창이 열립니다. 왼쪽 아래 모서리에서 실행을 클릭하여 시작합니다(추가 파일 1의스크린샷 2).
- 대화 상자가 나타납니다(보충 파일 1: 스크린 샷 3), 출력 데이터 디렉터리의 위치를 요청. 이 소프트웨어에서 사용하는 모든 분석 데이터, 수치 및 기타 데이터가 이 폴더에 저장됩니다. 또 다른, 더 큰 대화 상자가 팝업됩니다, 모든 이미지 분석 설정을 표시(보충 파일 1: 스크린 샷 4).
- 분석할 이미지가 포함된 디렉터리 위치를 선택합니다.
- 정규 식을 사용하여 이미지 파일 이름 형식을 입력합니다. 일반 식을 사용하여 파일 이름의 일부가 행, 열, 채널 및 (선택적으로) 중괄호 내에 있는 사이트에 해당하는 부분을 나타내는 이미지 파일 이름 형식을 입력합니다. 중괄호 안에 공간을 두지 마십시오. 파일 이름 형식의 가변 부분을 중괄호 {}로 서둘러 둘러싸습니다. 파일을 저장하는 방법은 이미징 소프트웨어에 따라 다르며 이 단계는 이미지 파일 이름에서 관련 정보를 검색합니다.
참고: 예를 들어 형식 문자열
r" 플레이트 1-(? P&row>[A-Za-z]+)(? P&column>[0-9]+)-(? P&채널>[A-Za-z]+).tif"
"플레이트 1-"로 시작하는 파일 이름을 설명하고, 행을 나타내는 하나 이상의 알파벳 문자가 그 다음에 열을 나타내는 하나 이상의 숫자다음에 "-"가 뒤따르고 채널을 나타내는 하나 이상의 문자가 뒤따릅니다. "&>"와 같은 각도 대괄호 내부의 문자는 가변 이름이며 수집될 때 자동으로 데이터로 복사됩니다. 변수 이름 중 하나는 "&채널>"여야 합니다. - 핵 얼룩이 보이는 채널의 이름과 심근세포가 보이는 위치를 나타냅니다. 이러한 이름은 정규 식 파일 이름의 "&channel>" 변수와 일치하는 파트의 이름과 정확히 일치해야 합니다.
- 쉼표 구분된 변수 이름을 사용하여 이미지를 그룹화하는 방법을 나타냅니다. 지정된 그룹 내의 모든 이미지가 한 일괄 처리로 열리고 분석됩니다. 예를 들어 이미지가 각 웰에 대해 집합으로 분할되고 행과 열의 각 고유 조합에 대해 잘 구성된 경우 이 필드에 "행, 열"을 씁니다.
참고: 이러한 그룹화 변수는 형식 문자열에 사용되는 변수의 하위 집합이어야 합니다. "채널"을 그룹화 변수로 사용하지 마십시오. - 이미지가 하나의 웰 이미지로 함께 꿰매어졌는지 또는 각 사이트에 대해 분리되어 있는지 여부를 나타냅니다. 이전의 경우 사이트를 파일 이름 형식 문자열에 표시해서는 안 됩니다.
- 배경에서 핵을 분리하는 데 사용할 임계값 방법을 선택합니다. 피지의 모든 표준 임계값 방법을 사용할 수 있습니다. 다른 임계값 을 테스트하여 이미지 집합에 가장 적합한 방법을 결정합니다. 이 예제에서는 오쓰 방법을 선택합니다.
- 각 사이트 이미지에 대해 임계값을 다시 계산해야 하는지 또는 그룹의 모든 이미지에 대해 동일한 임계값을 사용해야 하는지 여부를 나타냅니다. 심근구상이 밝은지 또는 형광 마커를 사용하는지 여부를 표시합니다.
- 심근세포 임계값 을 나타냅니다. 이전 단계에서 브라이트필드를 선택한 경우 이 임계값 지정 메서드가 가장자리 필터링된 브라이트필드 이미지에 적용됩니다. 각 사이트 이미지에 대해 임계값을 다시 계산해야 하는지 또는 그룹의 모든 이미지에 대해 동일한 임계값을 사용해야 하는지 여부를 나타냅니다.
- 각 이미지를 잘 덮는 사이트 이미지의 행 수를 나타냅니다. 각 이미지를 잘 덮는 사이트 이미지의 열 수를 나타냅니다. 픽셀단위로 핵의 최소 영역을 나타냅니다. 아낌없이 낮은 최소 크기를 사용하면 분석 단계에서 더 높고 정확한 임계값이 계산됩니다. 심근세포의 최소 면적을 나타냅니다.
- 원하는 설정을 선택한 후 확인을 클릭합니다.
- 그림 3 및 그림 4에 있는 것과 유사한 이미지가 화면에 나타나 분석 파이프라인의 여러 단계를 표시합니다. 이러한 이미지를 검사하여 임계값 및 세분화가 제대로 발생하는지 확인합니다.
- 선택한 결과 폴더는 이제 분석데이터(추가 파일 1: 스크린샷 5)로 채워져야 합니다. 분석 데이터가 아닌 파일은 이름이 "cm_", "nuclei_"또는 "nucleilink_"로 시작되지 않는 한 이 폴더에 안전하게 저장할 수 있습니다.
7. 데이터 분석
참고: 생성된 csv 파일을 수동으로 분석할 수 있습니다. 각 분석된 이미지 하위 집합은 "핵(메타데이터).csv"라는 csv 파일의 삼중을 생성하며, "핵링크(메타데이터).csv", 그리고 "심근세포(메타데이터),csv", 여기서 (메타데이터)는 "_(name)=(값)"의 이름 값 쌍의 시퀀스로 대체되며, 여기서 (이름) 및 (값)은 이전에 주어진 일반 표현식에서 일치하는 문자열에서 파생된 영숫자 문자의 시퀀스입니다. 예를 들어 행과 열이 파일 이름에 표시된 경우 "_row=F" 및 "_column=8"과 같은 문자열이 표시됩니다. 각 핵 및 핵링크 파일의 이름 없는 왼쪽 열은 핵 ID 번호입니다. 핵링크 파일의 "Min" 컬럼은 전적으로 또는 0핵을 포함하는 심근세포의 ID이다. 핵의 "최대" 컬럼은 부분적으로 상기 핵을 함유한 가장 높은 번호의 심근세포의 ID, 또는 0 그렇지 않으면. 심근세포 파일의 "평균" 열은 심근세포 ID 번호입니다.
- Rstudio에서 "분석다중 핵을 분석한 Server.R"을 엽니다(추가 코드 파일로 제공).
- 이 파일의 맨 위에는 "folderName"이라는 변수가 있습니다. 그 옆에는 파일 경로가 있습니다. 여기서 최종 슬래시 없이 마지막 단계에서 선택한 출력 데이터 폴더에 경로를 입력합니다(보충파일 1: 스크린샷 6).
- 스크립트 편집 창의 왼쪽 위 모서리에 실행 앱이라는녹색 화살표가 있어야 합니다. 이 화살표를 클릭합니다. 데이터가 로드되고 앱이 팝업되는 데 다소 시간이 걸릴 수 있습니다.
- 처음에는 3개의 게이팅 그래프가 표시되며, 하나는 최소 유효한 핵 영역 임계값을 나타내고, 하나는 최소 유효한 핵 평균 강도 임계값을 나타내고, 하나는 심근세포에 대한 최대 유효한 최소 페렛 직경을 나타낸다. 슬라이더를 사용하여 이러한 임계값을설정합니다(보충 파일 1: 스크린샷 7).
참고: 이러한 각 그래프에서 유효한 핵 또는 심근세포에 해당하는 크고 넓은 피크가 존재해야 하며, 파편이나 잘못된 분할 된 심근세포구를 나타내는 넓은 꼬리에 의해 측면에 있어야합니다. 임계값을 사용하여 각 피크의 꼬리를 하나씩 잘라냅니다. - 아래로 스크롤합니다. 선택한 임계값 을 적용하는 단추를 클릭합니다(보충 파일 1의아래쪽 : 스크린샷 7).
- 단추 플롯 강도 분포를클릭합니다. 이렇게 하면 각 그룹화 변수에 대해 전체 샘플과 별도의 서브플롯모두의 핵 강도 분포플롯이 렌더링됩니다.
참고: 예를 들어, 피지 대화 상자에서 정규 식에 그룹화 변수를 입력한 경우 행및 열별 강도 분포를 나타내는플롯(추가 파일 1: 스크린샷 8)이 나타납니다. 조명 및 염색 조건이 시료의 다른 부분에 걸쳐 일정한 경우에, 이 플롯은 모두 명확하게 2개의 강렬 봉우리, 희미한, 디플로이드 핵을 위한 더 크고 더 짧은 것을 보여주어야 한다. - 샘플 내 변화는 이 패턴이 전체 샘플 플롯에서 표시되지 않게 되고 행, 열 또는 기타 그룹화 변수에 의해 디플로이드 및 테트라클로이드 피크의 위치에 큰 다양성이 존재합니다. 후자의 경우, 이 변형을 설명하기 위해 그룹별로 별도로 정규화된 확인란을 아래로 스크롤합니다(추가파일 1: 스크린샷 9).
- 버튼을 클릭 플로이디 계산 (보충 파일 1: 스크린 샷 9). 버튼을 클릭하려면 플로이디 분포플롯을 플롯합니다. 그래프는 오른쪽빈 창에 나타납니다. 정규화된 전체 샘플 그래프에서는 이전이 아닌 경우 2피크 패턴을 표시해야 합니다.
- 슬라이더를 사용하여 디플로이드와 테트라클로이드 피크를 서로 와 이상값에서 분리하려면 임계값을 선택합니다(추가파일 1: 스크린샷 9). 아래로 스크롤합니다. 버튼을 클릭 플로이디 와 핵 계산 (보충 파일 1: 스크린 샷 10).
- 단추 플롯을 클릭하고 결과 폴더에 저장합니다. 선택한 결과 폴더에 저장된 플롯도 이 대화형 창에나타납니다(추가 파일 1: 스크린샷 10).
결과
심근세포는 위에서 설명한 프로토콜에 따라 격리되었다. 이 방법을 사용하여, 우리는 일반적으로 비 심근 세포(도 1A)를오염하지 않고 상대적으로 순수한 균일하게 단각된 심근세포를 얻습니다. 심근 세포는 그들의 특징적인 크기와 birefringence 때문에 밝은 필드 현미경 검사법에서 쉽게 확인됩니다. 이 기술은 구현하기 쉽고 유사한 심근세포 수율 및 품질(그림 1B)와다른 격리에서 일관된 결과를 제공합니다. 고립 된 심근 세포는 추가 사용 전에 몇 주 동안 4 °C에서 저장할 수 있습니다.
상기 프로토콜에 따라 격리된 심근세포는 심근세포 크기, 심근세포 계피 및 면역세포화학 측정과 같은 다양한 다운스트림 애플리케이션에 사용될 수 있다. 대표적인 결과로, 우리는 이 프로토콜에 따라 격리된 심근세포가 특정 단백질의 국소화를 검출하거나 각각 심근세포 DNA 복제를 검출하기 위하여 클릭 화학을 위한 항체 및 불소-공주 아지드를 사용하여 염색될 수 있다는 것을 보여줍니다. 예를 들어, 우리는 α 액티닌을 인식하는 항체로 심근세포에 염색하여 사르코프레의 특징적인 z라인 염색 패턴을 나타내었다(도2A). 별도의 실험에서, 우리는 고정 된 심근 세포를 분리하기 전에 마우스에 티미딘 아날로그 5-에티닐-2'-deoxyuridine (EdU)를 투여했다. 심근세포 절연 후, 표준프로토콜(13)을사용하여 EdU를 통합하여 염색하고, 단핵, 이중핵 및 삼핵된 심근세포(도2B)에서S상을 겪은 심근구를 검출할 수 있었다.
격리 방법의 실용성을 더욱 확장하기 위해 통합 된 DNA 염색을 기반으로 심근 세포 계포의 정량화를 허용하는 파이프 라인을 개발했습니다. 세포 나 핵의 ploidy 상태를 측정할 수 있기 위하여는, 우리는 핵과 심근세포를 분할할 필요가 있었습니다. 도 3은 개별 핵을 식별하는 데 사용한 전략의 표현을 나타낸다. 먼저, 원본 이미지 DNA 염색이미지(도3A)는강도(도3B)에따라 임계값이 된다.Figure 3 여기서는 DAPI를 사용하여 DNA에 얼룩을 두었지만 DNA 함량과 선형 상관 관계를 보이는 다른 핵 염료는 효과가 있습니다. 이 프로그램은 피지의 강도 임계 값 방법 중 하나의 선택 할 수 있습니다, 하지만이 예에서 오츠의 방법이 사용되었다. 이미지의 가장자리를 터치하거나 지정된 최소 픽셀 영역 임계값보다 작은 핵 마스크는 제외됩니다. 그런 다음 타원은 핵 마스크에 적합하여 개별 핵을 분할합니다. 그림 3C는 원본 이미지에 겹쳐진 이러한 타원을 표시합니다. 다음으로, 구멍은 마스크로 채워지고 이미지의 픽셀은 가장 근접한 타원에 따라 영역으로 분할됩니다(그림3D).Figure 3 이러한 영토의 경계는 핵 군집을 통해 선을 그리는 데 사용되어 핵 세분화프로세스(그림 3E)를완료합니다.
다음 단계는 심근세포의 검출을 포함합니다. 형광 염색세포(도4A)를기반으로 얻어지는 심근세포 이미지의 경우, 이 과정은 핵에 대해 매우 유사하다. 이미지는 선택한 임계값 메서드에 의해 계산된 강도 값을 기반으로 임계값이 되며,이 경우 삼각형 메서드가 있습니다. 식별된 심근세포 마스크는 이미지의 경계를 만지거나 특정 크기 이하인 것으로 확인되었으며, 구멍은 마스크에 채워져 제대로 분할된 심근세포(도4B)를제공한다. 심근세포는 핵보다 더 불규칙한 모양을 가지고 있기 때문에 심근세포 군집을 분할하려는 시도는 없습니다. 대신 이러한 클러스터는 분석 단계에서 높은 최소 Feret의 지름에 따라 제외됩니다. 밝은 필드 이미지의 세분화는 약간 다르게 진행됩니다. 먼저, 원래 밝은 필드이미지(도 4C)는소벨 엣지 필터로 처리된다. 이 필터는 이미지 내의 각 픽셀의 그라데이션의 절대 값을 계산합니다. 빠르게 변경된 영역의 픽셀은 이미지의 부드러운 영역에서 높은 값과 픽셀을 수신하여 낮은 값을 받습니다. 이 에지 필터링 된 이미지는 삼각형 방법을 사용하여 강도에 의해 임계 값으로 임계 값을 가하면 마스크 된 심근 세포(그림 4D)가발생합니다. 이러한 고불규칙한 마스크는 반지름 이2픽셀의 원을 사용하여 형태학적 닫기를 통해 함께 매끄럽게 연결되며, 이는 검은 색영역(그림 4E)을겹치지 않고 원이 맞지 않는 이미지의 모든 흰색 영역을 채웁니다. 마지막으로, 마스크의 구멍이 채워지고, 테두리를 만지는 영역은 배제되고, 작은 입자가 제거되어 심근세포 세분화과정(도 4F)을마무리한다.
설명된 분할 전략을 사용하여 개별 심근세포의 핵 형성 상태를 결정할 수 있습니다. 이 접근법을 사용하여, 우리는 초기 산후 시간 점에 있는 근친 CD-1 마우스의 심혼에서 분리된 심근세포의 핵경위를 결정했습니다. 신생아 마우스의 심장 (생활의 첫날)은 그 시점에서 심근세포의 대부분이 단핵(그림 5: 신생아)이 있음을 보여 주었다. 단핵근세포의 이 고주파는 청소년 마우스(2주 령)에서 훨씬 낮으며, 단핵근세포는 전체 심근세포 집단의 약 25%를 구성한다(그림5: 청소년). 마지막으로, 우리는 심근세포 내의 개별 핵의 ploidy 상태를 측정하고, 디플로이드인지 테트라클로이드인지 여부를 결정할 수 있습니다. 이러한 결과는 사춘기 마우스에서 테트라클로드 핵의 더 높은 주파수를나타낸다(도 6).

그림 1: 고정 후 심근세포 격리의 효율. (A)핵을 나타내기 위해 DAPI로 염색된 분리된 심근세포의 대표적인 이미지. (DAPI(파란색), 브라이트필드(그레이)) (B)3개월에 다른 마우스로부터 분리된 심근세포의 수율. 스케일 바 = 50 μm. 여기를 클릭하여 이 그림의 더 큰 버전을 확인하십시오.
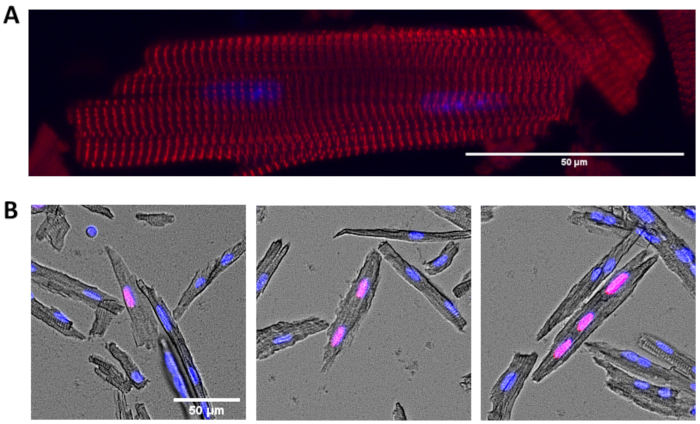
그림 2: 분리된 심근세포의 면역세포화학. (A)α 액틴(α 액티닌(α 액티닌 및 DAPI(파란색)을 위해 염색된 심근세포의 대표적인 이미지. (B)통합 된 EdU (빨간색) 및 DAPI (파란색)에 대한 염색 된 심근 세포. 단핵(왼쪽), 이중핵(middle) 및 삼핵(오른쪽) 및 EdU 양성인 대표적인 심근세포가 나타났다. 스케일 바 = 50 μm. 여기를 클릭하여 이 그림의 더 큰 버전을 확인하십시오.
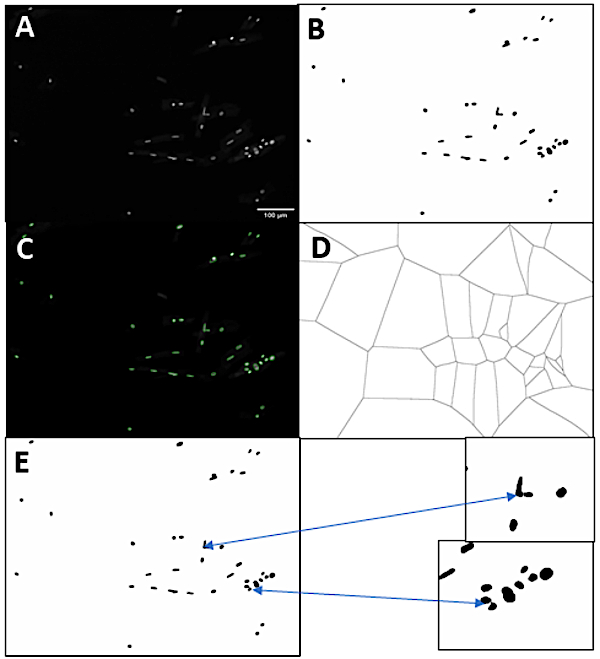
그림 3: 핵 세분화 전략. (A)오리지널 DAPI 채널 이미지. (B)임계값 이미지(이 예에서는 오츠의 방법이 사용되었습니다). (C)원래 DAPI 스테인드 이미지에 겹쳐진 임계값 이미지로부터 확인된 마스크. (D)핵 마스크를 기반으로 한 보로노이 테셀레이션. (E)분할 클러스터가 강조된 최종 분할 된 핵. 스케일 바 = 100 μm. 여기를 클릭하여 이 그림의 더 큰 버전을 확인하십시오.

그림 4: 심근세포 세분화를 위한 전략. (A)원래 형광 트로포닌 나는 심장 근세포 이미지를 염색했다. (B)삼각형 임계값 이미지, 구멍을 채우고 작은 물체와 테두리를 만지는 것을 제외한 후. (C)원래 밝은 필드 심근 세포 이미지(D)에지 필터링 및 삼각형 임계 값 심근 세포 이미지(E)2 픽셀(F)구멍을 채우고 작은 물체와 국경을 만지는 사람들을 제외 한 후 동일한 이미지의 반경으로 형태 폐쇄 후 에지 필터링 된 이미지. 스케일 바 = 100 μm. 여기를 클릭하여 이 그림의 더 큰 버전을 확인하십시오.

그림 5: 핵 수에 기초한 심근세포의 분류. 신생아 심장 (1 일)은 청소년 심장 (14 일)보다 더 많은 단핵 근구를 함유하고 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
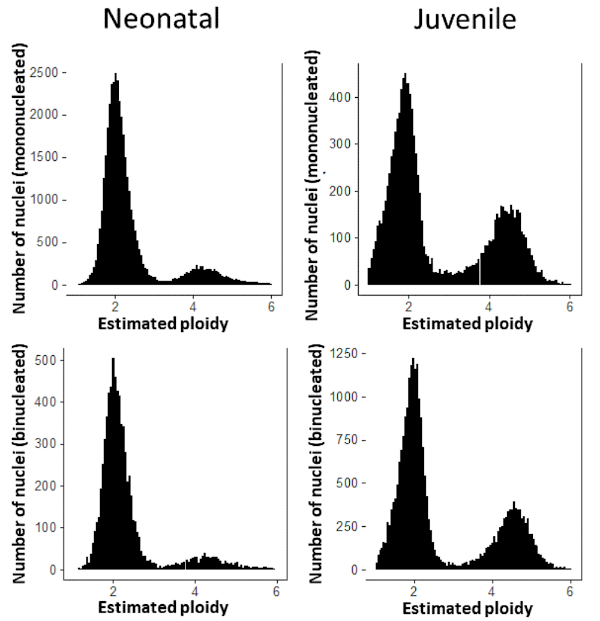
그림 6: 핵당 심근세포 DNA 함량의 분포. 신생아(왼쪽)에서는 단핵CM 핵의 13.5%가 테트라클로이드와 11.9%의 이중핵CM 핵이 테트라클로이드이다. 청소년(오른쪽)에서는 단핵CM 핵의 33.9%가 테트라클로이드와 31.2%의 이중핵CM 핵이 테트라클로이드된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 파일 1: 소프트웨어 스크린샷. 이 파일을 보려면 여기를 클릭하십시오 (다운로드하려면 마우스 오른쪽 클릭).
보충 파일 2: AnalyzeNucleation.py. 이 파일을 보려면 여기를 클릭하십시오 (다운로드하려면 마우스 오른쪽 클릭).
보충 파일 3: 분석다핵 서버.R. 이 파일을 보려면 여기를 클릭하십시오 (다운로드하려면 마우스 오른쪽 클릭).
토론
심근세포는 문화에서 유지될 수 없기 때문에, 1차 심근세포는 그들의 건축과기능(11)을연구할 수 있도록 분리하는 것이 중요하다. 따라서 심근세포 격리 기술은 심장 장에서 널리 사용되고 있습니다. 목표는 심근 세포의 기능적 측면을 결정하는 경우, 가능한 심근 세포를 분리하는 것이 중요합니다. 이 살아있는 심근세포는 또한 고립된 심근세포에 면역 염색을 능력을 발휘하기 위하여 이용될 수 있습니다. 그러나, 살아있는 심근세포 분리 기술을 최적화하는 것은 기술적으로 도전적이며, 심지어 최고의 기술은 일반적으로 60-65% 살아있는 막대 모양의 심근세포만 을 산출하고, 나머지 심근세포는 모두11,,12로죽거나 죽어가고 있다. 여기에서, 우리는 연구원이 먼저 심혼을 고치고, 그 때 심근세포를 효율적으로 분리할 수 있는 기술을 개발했습니다. 이 새로운 프로토콜은 이전에 발표된 프로토콜에 비해 막대 모양의 심근세포의 훨씬 더 높은 수율을 허용합니다. 또한, 우리는 핵 형성과 ploidy에 따라 심근세포를 자동으로 분류하는 이미징 분석 플랫폼을 개발했습니다. 이러한 새로운 방법론을 통해, 그룹은 다른 단백질을 위한 심근세포에 얼룩을 내고, 심장의 재생 잠재력을 위한 대리로 심근세포 계측기 및 핵형성 상태를 연구할 수 있습니다.
여기에 설명된 프로토콜은 비교적 간단하며 고급 장비 없이 수행할 수 있습니다. 콜라게나아제와 소화를 위한 잠복기의 양은 콜라게나아제 부지에 따라 달라질 수 있으며, 이를 제공하는 회사에 따라 달라질 수 있습니다. 우리는 콜라게나아제 타입 2를 사용했습니다, 이것은 살아있는 심근세포를 얻기 위한 심혼을 소화하기 위하여 가장 널리 이용되기 때문에. 우리의 관측에 근거하여, 우리는 60 mg/mL 콜라게나아제 타입 2를 가진 하룻밤 잠복이 섬유증의 수준에 관계없이 거의 모든 마우스 심혼을 위해 최적이라고 결정했습니다. 우리는 세포내 단백질이 고정되고 세포외 콜라겐만큼 접근하기 때문에 과다 소화의 문제가 없었습니다. 그러나 심장이 제대로 소화되지 않으면 더 격렬한 트리튜레이션이 필요할 수 있으며, 이로 인해 전단 응력으로 인한 세포 단편화가 발생할 수 있습니다. 따라서, 심혼이 trituration으로 이동하기 전에 제대로 소화되는지 확인하는 것이 중요합니다. 심장의 뻣뻣함은 소화 정도를 평가하기 위해 집게로 압박하여 테스트 할 수 있습니다. 콜라게나아제와 함께 배양에 따라, 마음은 덜 뻣뻣하고 찢어 쉽게해야한다. 콜라게나아제의 다른 모형은 또한 이용될 수 있습니다. 이전 보고서는 콜라게나아제 B와 D14의조합을 사용했다.
더욱이, 우리는 이 프로토콜이 심장15에있는 심근세포의 전반적인 수를 평가하기 위하여 이용될 수 있다고 믿습니다. 그러나, 심장으로부터 모든 심근낭을 채취하고 정량화하는 것이 목표라면, 콜라게나아제 용액(예를 들어, 3-7일)에서 오랜 시간 동안 심장을 배양하는 것이 중요하며, 콜라게나제 용액은 하루에 한 번 보충되어야 한다. 이를 통해 심근세포 수율에 대한 트리튜레이션 정도의 영향을 제거하여 격리 효율의 불일치를 최소화할 수 있습니다.
ploidy를 측정하기 위하여 DNA 내용의 사용은 새로운 것이 아닙니다, 수십 년 동안 유동 세포측정에 이용되었습니다. 최근에는 현미경 검사법을 유사하게핵(16)당DNA 함량을 추정하는 데 사용될 수 있는 것으로 나타났다. 여기에서, 우리는 새로 형성된 심근세포에 대한 대리로서 심근세포 핵의 계수를 측정하는 이 전략을 구현했습니다. 심장 재생 분야의 교리는 단핵, 디플로이드 심근세포만 세포균증을 겪고 새로운 심근세포가 생길 수 있다는 것입니다. 생체 내에서 새로운 심근세포 형성을 측정하는 것은 매우 어렵기 때문에 DNA 뉴클레오티드 아날로그의 투여 후 쫓겨난 심근세포를 분리하고 단핵구의 수준을 결정하는 데 매우 도전적이기 때문에, 디플로이드 심근세포는 새로운 심근세포17을생성하는 심장의 능력의 근사치로 사용되어 왔다. 여기에서는 심근세포 계포의 용이한 정량화를 허용하는 ImageJ용 매크로를 제공합니다. 최소한, 500핵은 G1 피크의 위치를 정확하게 추정하기 위해 측정되어야 한다. 염색 및 이미징 조건이 이미지 플레이트의 모든 우물에서 일관되도록 주의를 기울이면 전체 샘플에 걸쳐 500개의 핵만 을 심화해야 하며, 그렇지 않으면 이미지그룹(18,,19)당500개의 핵이 있어야 한다. 핵형성과 계피의 이미징 기반 측정의 한계는 2차원 심분 심근핵으로부터 핵을 구별하는 어려움을 포함한다. 이러한 부착 된 세포는 다핵 세포의 양과 과대 평가될 수 있으며 테트라클로이드 심근세포 핵 집단의 측정 정확도를 감소시킬 수 있습니다. 이 문제를 해결하기 위한 한 가지 가능한 전략은 심근세포 핵 마커 PCM16,,20을사용하는 것이다. 그러나, 우리는 제대로 고정 된 세포 또는 조직에 신뢰할 수있는 PCM1 염색을 얻기 위해 어려움을 겪었습니다.
또 다른 잠재적 인 제한은 일부 핵 얼룩 이미지가 중요한 배경 세포질 얼룩을 가질 수 있다는 것입니다, 광범위한 전처리없이 방법에 내장 피지의 내장을 사용하여 적절한 임계 값을 방지. 또한, 이러한 배경 형광의 불규칙한 기여는 그 정확도를 감소시킨다. 더욱이, 세포가 충분한 시간 동안 DNA 염색 용액에 남아 있지 않으면, 형광염은 핵 내의 포화에 결합되지 않으며 핵 통합 강도와 DNA 함량 사이의 선형 관계의 가정은 더 이상 정확하지 않을 것이다.
소프트웨어가 심근세포 클러스터를 분할할 수 없으며 대신 분석에서 제거할 수 없습니다. 따라서, 상대적으로 낮은 밀도(예를 들어, 1000세포/cm2)에서심근세포를 종자하는 것이 매우 중요하다. 또한, 소프트웨어는 종단 간 및 긴 단수 심근세포에 줄지어 있는 두 개의 심근세포사이를 구별할 수 없다. 이러한 종류의 클러스터는 잘못 팽창 다중 핵 추정을 팽창시킬 수 있습니다.
설명된 방법은 실행 가능한 심근세포를 얻는 것을 허용하지 않으며 따라서 동적 세포 과정을 측정하는 데 사용될 수 없지만, 면역염색을 수행하는 것이 목표라면, 우리는 설명된 방법이 형태및 단백질 국소화 측면에서 심근세포의 높은 수율과 더 나은 품질을 가진 기존 프로토콜보다 우수하다고 믿습니다. 마지막으로, 기술된 방법은 임상샘플(14,,21)으로부터심근세포를 분리하는 데 사용될 수 있다. 우리는 기술된 방법론이 고품질 심근세포를 얻고 새로운 심근세포 대형을 위한 대리로 핵형성 및 ploidy를 측정하는 것을 다른 연구원을 도울 수 있다고 믿습니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
JHvB는 NIH, 재생 의학 미네소타, 하트웰 재단의 개별 생물 의학 연구 상으로부터 보조금에 의해 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| 96 wells plate for imaging | Corning | 3340 | We use these plates as they are suitable for imaging, although glass bottom plates would be better for confocal imaging |
| Alpha actinin | Novus Biologicals | NBP1-32462 | This antibody is used as a marker of cardiomyocyte sarcomeres |
| Blunt scissors | Fine Scissor Tools | 14072-10 | We prefer blunt scissors as the possibility of tearing heart tissue is lower when exposing the heart |
| C57BL/6J | The Jackson Laboratory | 664 | Used for imaging, assessing ploidy and nucleation in cardiomyocyte population |
| CD-1 mice | Charles river | 22 | Used for imaging, assessing ploidy and nucleation in cardiomyocyte population |
| Collagenase 2 | Worthington | LS004177 | For the purpose of this protocol, the batch to batch differences are minimal and don't affect overall yield and quality of the isolation |
| Copper (II) sulfate pentahydrate | Sigma-Aldrich | 203165-10G | For edu staining |
| Cy5 Picolyl Azide | Click Chemistry Tools | 1177-25 | Azide used for edu staining |
| Cytation3 | BioTek | - | Used for automated imaging for DNA analysis |
| DAPI | Life Technologies | D3571 | DAPI used for DNA staining. Stocks were dissolved in distilled water. |
| donkey anti-mouse IgG-Alexa568 | Life Technologies | A10037 | Secondary antibody used to detect alpha actinin staining within cardiomyocytes |
| Forceps | ROBOZ | RS-5137 | We use these curved, blunt forceps, although straight forceps could also be used |
| Hydrochloric acid | Fisher Scientific | A144212 | To set pH of Tris-HCl buffer to pH 8.5 |
| ImageJ | imagej.net/Fiji/Downloads | - | Used for analyzing images |
| L-ascorbic acid | Sigma-Aldrich | 255564-100G | For edu staining |
| Needle for infusion | TERUMO | SV*23BLK | We use winged infusion sets throughout the protocol as it is easy to manipulate the position of the needle with these sets during injection |
| Nikon A1R HD25 | Nikon | - | Used to take confocal images of alpha actinin staining |
| Nylon mesh 200 micron | Elko filtering | 03-200/54 | Mesh used for filtering regular cardiomyocytes (not hypertrophied) |
| Nylon mesh 400 micron | Elko filtering | 06-400/38 | Mesh used for filtering hypertrophied adult cardiomyocytes |
| Phosphate Buffered Saline (1X) | Corning | 21-040-CV | This can also be prepared in the lab. Although sterility is important in this experiment, we think it is sufficient to prepare PBS and filtering it |
| Potassium chloride, Granular | Mallinckrodt | 6858 | Granular potassium chloride was preffered by us as it forms less aggregates when stored in room temperature |
| R | r-project.org | - | Used for data analysis of the measurements obtained from images |
| Tris Base | Fisher Scientific | BP152-5 | Used to buffer EdU staining reaction |
참고문헌
- Benjamin, E. J., et al. Heart Disease and Stroke Statistics-2017 Update: A Report From the American Heart Association. Circulation. 135 (10), e146 (2017).
- Heidenreich, P. A., et al. Forecasting the future of cardiovascular disease in the United States: a policy statement from the American Heart Association. Circulation. 123 (8), 933-944 (2011).
- Eschenhagen, T., et al. Cardiomyocyte Regeneration: A Consensus Statement. Circulation. 136 (7), 680-686 (2017).
- Tzahor, E., Poss, K. D. Cardiac regeneration strategies: Staying young at heart. Science. 356 (6342), 1035-1039 (2017).
- Bergmann, O., et al. Dynamics of Cell Generation and Turnover in the Human Heart. Cell. 161 (7), 1566-1575 (2015).
- Richardson, G. D. Simultaneous Assessment of Cardiomyocyte DNA Synthesis and Ploidy: A Method to Assist Quantification of Cardiomyocyte Regeneration and Turnover. Journal of Visualized Experiments. (111), (2016).
- Bergmann, O., et al. Evidence for cardiomyocyte renewal in humans. Science. 324 (5923), 98-102 (2009).
- Senyo, S. E., et al. Mammalian heart renewal by pre-existing cardiomyocytes. Nature. 493 (7432), 433-436 (2013).
- Ang, K. L., et al. Limitations of conventional approaches to identify myocyte nuclei in histologic sections of the heart. American Journal of Physiology-Cell Physiology. 298 (6), C1603-C1609 (2010).
- Bergmann, O., et al. Identification of cardiomyocyte nuclei and assessment of ploidy for the analysis of cell turnover. Experimental Cell Research. 317 (2), 188-194 (2011).
- O'Connell, T. D., Rodrigo, M. C., Simpson, P. C. Isolation and culture of adult mouse cardiac myocytes. Methods in Molecular Biology. 357, 271-296 (2007).
- Ackers-Johnson, M., et al. A Simplified, Langendorff-Free Method for Concomitant Isolation of Viable Cardiac Myocytes and Nonmyocytes From the Adult Mouse Heart. Circulation Research. 119 (8), 909-920 (2016).
- Shaklee, J., et al. Development of a Click-Chemistry Reagent Compatible with Mass Cytometry. Scientific Reports. 8 (1), 6657 (2018).
- Mollova, M., et al. Cardiomyocyte proliferation contributes to heart growth in young humans. Proceedings of the National Academy of Sciences of the United States of America. 110 (4), 1446-1451 (2013).
- Naqvi, N., et al. A proliferative burst during preadolescence establishes the final cardiomyocyte number. Cell. 157 (4), 795-807 (2014).
- Roukos, V., Pegoraro, G., Voss, T. C., Misteli, T. Cell cycle staging of individual cells by fluorescence microscopy. Nature Protocols. 10 (2), 334-348 (2015).
- Patterson, M., et al. Frequency of mononuclear diploid cardiomyocytes underlies natural variation in heart regeneration. Nature Genetics. 49 (9), 1346-1353 (2017).
- Gomes, C. J., Harman, M. W., Centuori, S. M., Wolgemuth, C. W., Martinez, J. D. Measuring DNA content in live cells by fluorescence microscopy. Cell Division. 13, 6 (2018).
- Woo, L. A., et al. High-content phenotypic assay for proliferation of human iPSC-derived cardiomyocytes identifies L-type calcium channels as targets. Journal of Molecular and Cellular Cardiology. 127, 204-214 (2018).
- Morikawa, Y., Heallen, T., Leach, J., Xiao, Y., Martin, J. F. Dystrophin-glycoprotein complex sequesters Yap to inhibit cardiomyocyte proliferation. Nature. 547 (7662), 227-231 (2017).
- Bergmann, O., Jovinge, S. Isolation of cardiomyocyte nuclei from post-mortem tissue. Journal of Visualized Experiments. (65), (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유