A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تفاعل الأوعية الدموية الشبكية كما تم تقييمه من قبل التصوير المقطعي التصويري التصويري التصويري
In This Article
Summary
تصف هذه المقالة طريقة لقياس تفاعل الأوعية الدموية في الشبكية في الجسم الحي مع الموضوعات البشرية باستخدام تقنية استفزاز التنفس بالغاز لتقديم محفزات نشطة مع الحصول على صور الشبكية.
Abstract
وقد ثبت أن إمدادات الأوعية الدموية إلى شبكية العين تتكيف بشكل حيوي من خلال تضيق الأوعية وتوسع الأوعية لاستيعاب المطالب الأيضية للشبكية. هذه العملية، التي يشار إليها باسم تفاعل الأوعية الدموية الشبكية (RVR)، يتم التوسط عن طريق اقتران الأوعية الدموية العصبية، والتي تضعف في وقت مبكر جدا في أمراض الأوعية الدموية الشبكية مثل اعتلال الشبكية السكري. لذلك ، قد تكون الطريقة الممكنة سريريًا لتقييم وظيفة الأوعية الدموية ذات أهمية كبيرة في كل من البيئات البحثية والسريرية. في الآونة الأخيرة، في تصوير الجسم الحي من الأوعية الدموية الشبكية على مستوى الشعيرات الدموية جعلت ممكنة من قبل موافقة ادارة الاغذية والعقاقير من التصوير المقطعي التصوير المقطعي التماسك البصري (OCTA)، وهو غير الغازية، والحد الأدنى من المخاطر وطريقة تصوير الأوعية بدون صبغمع قرار مستوى الشعيرات الدموية. وفي الوقت نفسه، أظهر العديد من المحققين تغيرات فسيولوجية ومرضية في RVR. تم تصميم الطريقة الموضحة في هذه المخطوطة للتحقيق في RVR باستخدام OCTA دون الحاجة إلى إدخال تعديلات على إجراءات التصوير السريري أو الجهاز. وهو يوضح التصوير في الوقت الحقيقي لشبكية العين والأوعية الدموية الشبكية أثناء التعرض لظروف فرط القدرة أو فرط أكسدة. يتم إجراء الامتحان بسهولة مع اثنين من الموظفين في أقل من 30 دقيقة مع الحد الأدنى من عدم الراحة الموضوع أو خطر. هذه الطريقة قابلة للتكيف مع أجهزة تصوير العيون الأخرى وقد تختلف التطبيقات استنادًا إلى تكوين خليط الغاز وعدد المرضى. قوة هذه الطريقة هي أنه يسمح بإجراء تحقيق في وظيفة الأوعية الدموية الشبكية على المستوى الشعري في البشر في الجسم الحي. القيود المفروضة على هذه الطريقة هي إلى حد كبير تلك التي من OCTA وغيرها من أساليب التصوير الشبكية بما في ذلك القطع الأثرية التصوير والنطاق الديناميكي المقيد. النتائج التي تم الحصول عليها من هذه الطريقة هي صور OCT و OCTA لشبكية العين. هذه الصور قابلة لأي تحليل ممكن على أجهزة OCT أو OCTA المتاحة تجاريًا. الطريقة العامة، ومع ذلك، يمكن تكييفها مع أي شكل من أشكال التصوير في العيون.
Introduction
يعتمد الطلب الأيضي على إمدادات كافية ومستمرة من الأكسجين التي يوفرها نظام منظم جيدًا من الشرايين والشعيرات الدموية والفينولين1. وقد أظهرت العديد من الدراسات أن وظيفة أكبر عيار الأوعية الشبكية البشرية يمكن تقييمها في الجسم الحي مع مختلف الفسيولوجية2،,3،,4،,5 والدوائية6،,7 محفزات. بالإضافة إلى ذلك ، وظيفة غير طبيعية من هذا الجهاز الوعائي هو شائع في أمراض الأوعية الدموية الشبكية مثل اعتلال الشبكية السكري حيث تفاعل الأوعية الدموية الشبكية (RVR) وقد ثبت أن تكون مخففة حتى في مراحله الأولى8،9 من خلال كل من الغاز استفزاز9 وتجارب الضوء الخفقان5،10،11. كما ارتبطت عوامل خطر الأوعية الدموية الشبكية مثل التدخين بضعف RVR12 وتدفق دم الشبكية13. هذه النتائج مهمة لأن الأعراض السريرية لمرض الأوعية الدموية في الشبكية تحدث في وقت متأخر نسبيا في عملية المرض وعلامات سريرية في وقت مبكر ثبت من المرض تفتقر إلى14. وبالتالي، يمكن أن يوفر تقييم RVR مقاييس مفيدة لسلامة الأوعية الدموية من أجل التقييم المبكر للتشوهات التي يمكن أن تبدأ أو تفاقم أمراض تنكسية الشبكية.
وقد اعتمدت تجارب RVR السابقة عادة على أجهزة مثل مقياس تدفق الدم بالليزر9 أو كاميرات ممولة مجهزة بمرشحات خاصة15 للحصول على صورة الشبكية. ومع ذلك ، يتم تحسين هذه التقنيات للأوعية ذات القطر الأكبر مثل الشرايين16 والأفير15، والتي ليست حيث يحدث الغاز والمغذيات الدقيقة والتبادل الجزيئي. وقد تمكنت دراسة أكثر حداثة لتحديد RVR من الشعيرات الدموية باستخدام التصوير البصريات التكيفية17، ولكن على الرغم من تحسين الاستبانة المكانية ، فإن هذه الصور لها حجم حقل أصغر ولا تمت الموافقة على إدارة الأغذية والعقاقير للاستخدام السريري18.
وقد قدم ظهور مؤخرا من التصوير المقطعي التصوير المقطعي البصري (OCTA) وافقت ادارة الاغذية والعقاقير, طريقة الأوعية غير الغازية والصباغة لتقييم التغيرات مستوى الشعيرات الدموية في المرضى الإنسان والمواضيع في الجسم الحي. يتم قبول الأوكتا على نطاق واسع في الممارسة السريرية كأداة فعالة لتقييم ضعف في التروية الشعرية في أمراض الأوعية الدموية في الشبكية مثل اعتلال الشبكية السكري19، انسداد الشبكية الوريدي20، التهاب الأوعية الدموية21 وغيرها الكثير22. لذلك يوفر OCTA فرصة ممتازة لتقييم التغيرات في مستوى الشعيرات الدموية ، والتي يمكن أن يكون لها تغايرية مكانية وزمنية كبيرة23 بالإضافة إلى التغيرات المرضية ، في بيئة سريرية. أظهرت مجموعتنا مؤخرًا أنه يمكن استخدام الأوكتا لتحديد مدى استجابة أوعية الشبكية في المستوى الشعري2 للتغيرات الفسيولوجية في الأكسجين الملهم ، وهو حافز انقباضي شبكية العين16،24، وثاني أكسيد الكربون ، وهو تحفيز الأوعية الشبكية3،5.
الهدف من هذه المقالة هو وصف بروتوكول من شأنها أن تسمح للقارئ لتقييم تفاعل الأوعية الدموية الشبكية من الشرايين الصغيرة وسرير الشعيرات الدموية باستخدام OCTA. يتم تكييف الأساليب من تلك المعروضة في لو وآخرون25 الذين وصفوا قياس التفاعل الأوعية الدموية الدماغية مع التصوير بالرنين المغناطيسي. على الرغم من أن الطرق الحالية تم تطويرها واستخدامها أثناء تصوير OCTA2، إلا أنها تنطبق على أجهزة تصوير شبكية العين الأخرى مع تعديلات بسيطة وواضحة نسبيًا.
Access restricted. Please log in or start a trial to view this content.
Protocol
تمت الموافقة على هذه الدراسة من قبل مجلس المراجعة المؤسسية في جامعة جنوب كاليفورنيا والتزمت بمبادئ إعلان هلسنكي.
1. إعداد الغاز جهاز عدم التنفس
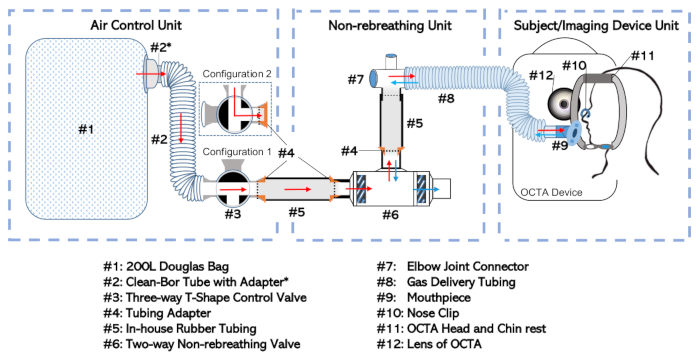
الشكل 1: رسم بياني لجهاز عدم التنفس. وقد تم تقسيم الإعداد الكامل إلى ثلاث وحدات منفصلة وفقا لوظيفتها والتردد الذي يتم التعامل معها بشكل مستقل. وتشمل هذه: وحدة التحكم في الهواء، ووحدة عدم التنفس، ووحدة جهاز الموضوع/التصوير، يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
-
تجميع الأجهزة
- قم بتوصيل حقيبة دوغلاس(الشكل 1#1) بالصمام الثلاثي الاتجاه (#3) في منفذ منفذ انتقائي عبر الأنبوب الداخلي قطره 35 مم (#2؛ انظر جدول المواد)مع محول (#2*). وسيطلق على هذا المزيج اسم "وحدة التحكم الجوي" كما هو مبين في الشكل 1.
- قم بتوصيل صمام عدم التنفس ثنائي الاتجاه (#6) بموصل مفصل الكوع (#7) في منفذ الفم للصمام غير المنفأ. شكل الاتصال باستخدام أنبوب مطاطي (#5) مزود بمحول (#4).
- توصيل مفصل الكوع إلى أنابيب تسليم الغاز (#8). هذا الإعداد، بما في ذلك صمام عدم التنفس (#6)، والأنابيب في المنزل (#5)، والمحولات (#4)، ومشترك الكوع (#7)، وأنابيب توصيل الغاز (#8) سيطلق عليها اسم "وحدة عدم التنفس".
ملاحظة: تقليل مقدار المسافة الميتة بين فم الشخص والحجاب الحاجز لصمام عدم التنفس في الاتجاهين (#6). - قم بتوصيل وحدة التحكم الجوي في منفذ الصمام الثلاثي (#3) بوحدة عدم التنفس في ميناء البطانة لصمام عدم التنفس ثنائي الاتجاه (#6). قم بإجراء الاتصال باستخدام أنابيب مطاطية إضافية (#5) ومحولات (#4) كما هو موضح سابقًا يسمح بإدراج القطع في بعضها البعض.
- ختم جميع الاتصالات فضفاضة عن طريق التفاف المفاصل مع ختم الشريط لضمان تناسب محكم.
- قم بتوصيل أنابيب توصيل الغاز (#8) في نهايته المفتوحة بلسان حال (#9) كما هو موضح في وحدة جهاز الموضوع/التصوير من الشكل 1.
ملاحظة: يمكن تأجيل هذه الخطوة (1.1.6) حتى يصبح اختبار الموضوع جاهزًا للبدء (الخطوة 3.5).
-
إعداد وحدة التحكم الجوي لعدم إعادة التنفس بالغاز
- عزل وحدة التحكم الجوي عن طريق فصلها عن أي أنابيب داخلية (#5) أو محولات (#4) إذا لم تكن منفصلة بالفعل.
- تأكد من أن حقيبة دوغلاس (#1) فارغة أو فارغة حقيبة دوغلاس (#1) من أي هواء عن طريق لف الحقيبة بشكل منهجي من الطرف القاصي نحو منفذ الكيس مع الصمام الثلاثي (#3) المحدد للتكوين 1 كما هو موضح في الشكل 1.
- ملء كيس دوغلاس (#1) مع خليط الغاز المناسب.
- إذا كان المقصود فقط عدم التنفس في الغرفة الهواء، قم بتعيين الصمام الثلاثي الاتجاه إلى التكوين 2 (كما هو موضح في الشكل 1)ولا تملأ حقيبة دوغلاس (#1). وإلا استمر مع الخطوات التي تتضمن الخطوة 1.2.3.
- قم بتوصيل وحدة التحكم الجوي (الموضحة في الشكل 1)في منفذ الصمام الثلاثي (#3) بأسطوانة غاز (تحتوي على خليط الهواء المطلوب) باستخدام المحولات والأنابيب المناسبة. استخدم محول الكفة لتركيب أنبوب تعبئة غاز مقاس 1/8 بوصة إلى القطر الخارجي للصمام الثلاثي (#3).
- تعيين تجميع صمام ثلاثي الاتجاه إلى التكوين 1 (كما هو مبين في الشكل 1)للسماح للغاز المقصود للتدفق من اسطوانة التخزين إلى كيس دوغلاس (#1). فتح اسطوانة الغاز.
- بمجرد تعبئة حقيبة دوغلاس (#1) إلى الحجم المقصود (عادة نصف مملوءة)، أغلق منفذ أسطوانة الغاز وحدد الصمام الثلاثي الاتجاه إلى التكوين 2، الذي يعزل الغاز داخل كيس دوغلاس (#1). فصل وحدة التحكم الجوي من أي أنابيب تستخدم لملء حقيبة دوغلاس (#1).
2. إعداد الموضوع للتصوير
- بعد أن يوافق الموضوع على المشاركة في الدراسة ، والجلوس هذا الموضوع وراء جهاز التصوير OCTA. شرح إجراءات الاختبار للموضوع.
- تأكيد التاريخ الطبي للموضوع للتأكد من أن الشخص المعني ليس لديه حالات طبية موجودة تزيد من خطر المشاركة في الدراسة.
ملاحظة: أمراض القلب والأوعية الدموية أو الرئوية الموجودة من قبل هي عوامل الخطر التي يمكن استبعاد الأشخاص من المشاركة فيها. من الضروري أن يفهم الموضوع أنه يمكنهم إيقاف الإجراء في أي وقت لأي سبب من الأسباب مثل الشعور بالدوار أو بعض الانزعاج الإضافي غير المتوقع. - تحديد العين التي سيتم تقييمها وفقا لبروتوكول الاختبار. قد يتم صورة عين واحدة فقط للحد من وقت الاختبار وتقليل المضايقات المحتملة من عدم تنفس الغاز.
- النظر في تمدد العين إذا كان هذا الموضوع لديه حجم التلميذ من حوالي 2.5 ملم أو أقل. على الرغم من أن التمدد ليس إلزاميًا ، إلا أنه يعزز فرص الحصول على صور ذات جودة جيدة. إلى دلالة, غرس قطرة واحدة كل من 0.5% محلول العيون هيدروكلوريد بروباراكين, 1% محلول العيون مداري و 2.5% محلول فينيلفرين هيدروكلوريد العيون. يجب أن يحدث التمدد الكامل في غضون 10-15 دقيقة.
3. تجربة استفزاز الغاز واقتناء الصور
- إنشاء ملف تعريف للمريض في جهاز OCTA.
- ارتداء القفازات.
- مسح أسفل الرأس ثماني الذقن والراحة مع مسحة الكحول لتطهير الإعداد.
- حرر اللسان (#9) من عبوته المعقمة.
ملاحظة: الامتناع عن لمس لسان حال أكبر قدر ممكن من هذا المكون يجعل الاتصال المباشر مع بطانة المخاط من فم الموضوع - توصيل لسان حال (#9) بأنابيب توصيل الغاز (#8)
- ضع مقياس أكسدة النبض على إصبع الأشخاص وابدأ في مراقبة مستويات تشبع الأكسجين والنبض.
ملاحظة: بمجرد أن يبدأ الموضوع في التنفس خليط الهواء المطلوب ، يجب مراقبة مقياس أكسدة النبض باستمرار من قبل الفاحص. إذا انخفض تشبع الأكسجين للموضوع إلى أقل من 94٪، يجب إيقاف التجربة، كإجراء وقائي للسلامة، ولاحظ الموضوع حتى يعودوا إلى خط الأساس. - ضبط ارتفاع الإعداد OCTA بحيث يمكن لهذا الموضوع بسهولة بقية ذقنهم على مسند الذقن (#11) دون الإفراط في تمديد أو ثني رقبتهم.
- حلقة أنابيب تسليم الغاز (#8) مع لسان حال (#9) مرفق من خلال الرأس والذقن بقية مع لسان حال (#9) التي تواجه المريض. يكون حلقة أنابيب من خلال oppposite الجهاز جانب العين التي يتم بعد أن يكون هذا الموضوع.
- أدخل اللسان في فم المريض. تشجيع هذا الموضوع لممارسة التنفس من خلال الإعداد عدم التنفس لخلق الألفة مع الجهاز. تأكد من أن هذا الموضوع يأخذ تنفس عميق لتسهيل تبادل الغاز.
- ضع مشبك الأنف (#10) على هذا الموضوع للتأكد من أنهم يتنفسون من خلال لسان حال.
- احتفظ بالصمام الثلاثي الاتجاه في التكوين 2 أو قم بتغييره إلى التكوين 1 اعتمادًا على ما إذا كان يتم الحصول على صور للتعرض لهواء الغرفة أو خليط غاز معين، على التوالي. للرجوع إليها في المستقبل، لاحظ الوقت كبداية لاستنشاق الغاز.
- ضع الموضوع ذقنهم على القسم الأيمن أو الأيسر من مسند الذقن (#11) وفقًا للعين المختارة للتصوير.
- تأكد من أنها تتحرك رؤوسهم إلى الأمام حتى جبهتهم في اتصال ثابت مع مسند الرأس (#11).
- التقاط فحص OCTA من الفائدة كما يحددها بروتوكول الاختبار. في هذه الدراسة، تم التقاط ثلاث صور 3 مم × 3 مم تركزت على fovea بعد دقيقة واحدة من تنفس الغاز.
- يكون هذا الموضوع إبقاء رؤوسهم تواجه إلى الأمام ولا يزال في حين تركز على الهدف في وسط وجهة نظرهم
- في الصورة الحية التي شوهدت في عرض القزحية ، مركز المسح الضوئي.
- جلب القزحية في التركيز عن طريق تحريك مسند الذقن في أو خارج باستخدام الأسهم من اليسار واليمين.
- تأكد من تركز تراجع foveal في الفحص OCT، والتي يجب أن تحدث بشكل افتراضي.
- التقاط صورة. المسح سوف تستمر عادة عدة ثوان على جهاز OCTA.
- عرض صورة OCTA بعد الانتهاء من المسح الضوئي والتأكد من أنها ذات جودة كافية. يجب أن تكون قوة الإشارة 7 أو أفضل على مقياس من 10 نقاط التي تقدمها الشركة المصنعة للأوكتا.
- حدد حفظ العين أو إعادة مسحها.
- كرر الخطوات 3.14.1-3.14.7 لأكبر عدد ممكن من عمليات المسح الضوئي.
- السماح للموضوع بالجلوس من الجهاز. إزالة مقطع الأنف (#10) ولسان حال (#9) عندما لا تكون هناك حاجة إلى مزيد من مسح العين مع هذا الخليط الغاز.
- السماح للرعايا استراحة 2 دقيقة قبل البدء في CO2 تجارب استفزاز الغاز.
- ملء كيس دوغلاس مع أول خليط الهواء المطلوب (تتكون من 5٪ CO2،21٪ الأكسجين و النيتروجين 74٪ ) على النحو المحدد في الخطوة 1.2. سيكون الصمام الثلاثي في التكوين 2 بعد هذه الخطوة.
- إعداد كامل لجهاز عدم إعادة التنفس بالغاز عن طريق ربط وحدة التحكم الجوي بوحدة عدم التنفس كما هو موضح في الشكل 1 والموصوف في الخطوة 1.1.4. تأكد من أن جميع المفاصل محكمة الإغلاق مع شريط الختم.
- كرر الخطوات 3.9-3.14، ولكن الآن قم بتعيين الصمام الثلاثي الاتجاه إلى التكوين 1 عند توجيهه في الخطوة 3.11.
- إعطاء الموضوعات استراحة 10 دقيقة بعد استفزاز غاز CO2 للسماح بالعودة إلى خط الأساس.
- في حين أن هذا الموضوع هو في استراحة، وملء حقيبة دوغلاس مع 100٪ O2 وفقا للخطوة 1.2.
- كرر الخطوات 3.17-3.18 لإجراء التجربة تحت شروط استفزاز الغاز O2 بنسبة 100٪.
4. تنظيف التجريبية
- تجاهل العناصر التي يمكن التخلص منها من الإعداد: لسان حال الموضوع (#9) ومقطع الأنف (#10).
- تنظيف راحة الرأس والذقن (#11) باستخدام مسحة الكحول. مسح كرسي الموضوع، جدول أوكتا ومقابض أوكتا مع مسح مطهر لإزالة أي اللعاب خاطئ.
- افصل الإعداد في مكوناته الأساسية - وحدة التحكم في الهواء ووحدة عدم التنفس - في الصمام الثلاثي (#3).
- وبما أنه لم يكن ينبغي لأي زفير جوي من هذا الموضوع أن يصل إلى عناصر وحدة المراقبة الجوية، وأن يفرغ حقيبة دوغلاس وفقا للخطوة 1-2-2، وأن يكون في موقع لاسترجاعه في المستقبل. افصل أنبوب البور النظيف (#2) بالمحول (#2*) والصمام الثلاثي (#3) عن حقيبة دوغلاس إذا رغبت في ذلك لتسهيل التخزين. هذا يكمل وحدة التحكم الجوي تنظيف.
- قم بإزالة أنابيب توصيل الغاز (#8) من وحدة عدم التنفس عن طريق فصلها عن مفصل الكوع (#7). افصل أنابيب المطاط الداخلية (#5) ومحولات الأنابيب (#4)، عن صمام عدم التنفس في الاتجاهين (#6). ثم تفعل الشيء نفسه من مفصل الكوع (#7) عن طريق إزالة الشريط الختم وفصل الأجزاء عن طريق سحبها بعيدا.
ملاحظة: يمكن تسهيل التنظيف الأكثر شمولاً لصمام عدم التنفس في الاتجاهين عن طريق تفكيكه لإزالة الحجاب الحاجز الداخلي للحصول على رعاية إضافية. -
إعداد حمام مطهر لتنظيف المكونات القابلة لإعادة استخدام
- ملء حاوية كبيرة بما يكفي لغمر أنابيب تسليم الغاز (#8) مع مطهر المنظفات المخفف بشكل مناسب ومختلطة بشكل جيد. في هذه الحالة، تمييع المنظفات بالماء إلى نسبة 1:6425.
- نقع أنابيب تسليم الغاز (#8)، في اتجاهين صمام غير التنفس (#6)، مفصل الكوع (#7)، أنابيب المطاط في المنزل (#5) ومحولات الأنابيب (#4) في حمام مطهر أعدت لمدة 10 دقيقة على الأقل.
- إزالة جميع أجزاء بعد انتهاء الحمام وشطف لهم جيدا بالماء.
- ضعها على منشفة ورقية على كونترتوب نظيف لتجفف الهواء.
- بمجرد الانتهاء من تجفيف الهواء، تخلص من منشفة ورقية ووضع جميع المكونات بعيدا للتخزين.
5- تصدير وتحليل بيانات الثمانية من البلدان الأمريكية
-
تصدير بيانات OCTA
- تصدير بيانات OCTA عن طريق إدراج جهاز وسائط قابل للإزالة من اختيار في جهاز الكمبيوتر OCTA. العثور على هذا الموضوع والمسح الضوئي من الفائدة.
- حدد تصدير لإنشاء مجلد مضغوط يحتوي على موضوع بيانات الفائدة بتنسيق .bmp على جهاز الوسائط القابلة للإزالة.
-
تحليل بيانات OCTA
- تنظيم بيانات الـ OCTA على كمبيوتر مختبري مع القدرة على إجراء تحليل ومعالجة صور إضافية.
- استخدم برنامجًا نصيًا مخصصًا لمنع الضوضاء باستخدام تقنية تحديد عمومية وتنفيذ استخراج ميزة إضافية. Binarize والهيكل العظمي للصور OCTA.
- على الصور بعد المعالجة، حساب كثافة الهيكل العظمي للوعاء (VSD)19،26، وهو مقياس بلا بعد من الطول الخطي الإجمالي للأوعية في صورة محسوبة بالمعادلة التالية التي يتم تنفيذها على صورة هيكل عظمي من OCTA:
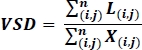
حيث أنا وj تشير إلى تنسيق بكسل(i, j), L(i, j) يشير إلى بكسل أبيض يمثل فك الارتباط, X(i,j) يشير إلى جميع بكسل, ويشير n إلى أبعاد صفيف بكسل, والتي يمكن افتراض أن تكون n x n بكسل19,,26. يمثل مقام هذه المعادلة العدد الإجمالي للبيكسلات التي يتم حسابها كما هو مكتوب من الصورة الهيكلية، ولكن يمكن اعتبارها تمثل المساحة الفعلية للصورة بأكملها.
Access restricted. Please log in or start a trial to view this content.
النتائج
يتكون الناتج من هذه التجربة من القراءات اليدوية المأخوذة من مقياس أكسدة النبض ، والتوقيت الملاحظ للتعرض للغاز أو المسح الضوئي لـ OCTA وبيانات التصوير الأولية OCTA. تتكون صورة OCTA من الأشعة المقطعية OCT B وإشارة فك الارتباط المرتبطة بكل فحص B. يتم إعطاء معلمات البيانات حسب مواصفات الجهاز. تم استخد...
Access restricted. Please log in or start a trial to view this content.
Discussion
المنهجية التي وصفت للتو هي البروتوكول الكامل لتجربة استفزاز تنفس الغاز التي تسمح لقياس RVR موضوع في بيئة خاضعة للرقابة في نقاط زمنية محددة مع عدم إدخال تعديلات على جهاز التصوير OCTA والحد الأدنى من الانزعاج أو خطر على هذا الموضوع. يتم وصف هذا الإعداد بطريقة تسمح بإجراء تعديلات سهلة لتناسب اح?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
وقد قدم كارل زايس ميديتيك المنح التمويل والمعدات والدعم المالي لAHK المتعلقة بموضوع هذه المادة.
Acknowledgements
تم دعم هذا العمل من قبل NIH K08EY027006 ، R01EY030564 ، UH3NS100614 ، منح البحوث من كارل زايس ميديتيك شركة (دبلن ، كاليفورنيا) وتمويل إدارة غير مقيد من البحوث لمنع العمى (نيويورك ، نيويورك).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 5% CO2 gas [5% CO2, 21% O2, 74% N2] (Compressed) | Institution Dependent (Praxair) | ||
| Bacdown Disinfectant Detergent | Decon Labs | 8001 | https://deconlabs.com/products/disinfectant-bdd/ |
| Clean-Bor Tubes (35 mm Inner Diameter) | Vacumed | 1011-108 | http://www.vacumed.com/zcom/product/Product.do?compid=27&skuid=1197 |
| Cuff adapter for Douglas bag filling | Vacumed | 22254 | http://www.vacumed.com/zcom/product/Product.do?compid=27&prodid=343 |
| Douglas bag (200 L capacity) | Harvard Apparatus | 500942 | https://www.harvardapparatus.com/douglas-bag.html |
| Elbow Joint (Inner Diameter 19 mm/Outer Diameter 22 mm), Modified in House | |||
| Fingertip Pulse Oximeter (Pro-Series) | CMS | CMS 500DL | https://www.walmart.com/ip/Pro-Series-CMS-500DL-Fingertip-Pulse-Oximeter-Blood-Oxygen-Saturation-Monitor-with-silicon-cover-batteries-and-lanyard/479049154 |
| Gas Delivery Tube (22 mm Inner Diameter) Modified in House | |||
| Gas filling tube (1/8" for compressed gas) | |||
| Hydrogen Peroxide Cleaner Disinfectant Wipes | Clorox Healthcare | 30824 | https://www.cloroxpro.com/products/clorox-healthcare/hydrogen-peroxide-cleaner-disinfectants/?gclid=EAIaIQobChMIk-KG4vi15QIVcRh9Ch0NNwLPEAAYASAAEgJIa_D_BwE&gclsrc=aw.ds |
| Lubricant Eye Drops | Refresh | Refresh Plus | https://www.refreshbrand.com/Products/refresh-plus |
| Manual Directional Control Valves: Three-Way T-Shape Stopcock Type (Inner Diameter 28.6 mm, Outer Diameter 35 mm) | Hans Rudolph | 2100C Series | www.rudolphkc.com |
| Medical O2 (Compressed) | Institution Dependent | ||
| Mouth piece (Silicone, Model #9061) | Hans Rudolph | 602076 | www.rudolphkc.com |
| OCTA Imaging Device (PLEX Elite 9000) | Carl Zeiss Meditec, Dublin, CA, USA | https://www.zeiss.com/meditec/int/product-portfolio/optical-coherence-tomography-devices/plex-elite-9000-swept-source-oct.html | |
| Phenylephrine Hydrochloride Ophthalmic Solution, USP 2.5% | Paragon Bioteck, Inc | NDC 42702-102-15 | https://paragonbioteck.com/products/diagnostics/phenylephrine-hydrochloride-ophthalmic-solution-usp-2-5/ |
| Plastic Nose Clip Sterile Foam CS100 | Sklar Sterile | 96-2951 | https://www.sklarcorp.com/disposables/plastic/plastic-nose-clip-sterile-foam-box-of-100.html |
| Proparacaine Hydrochloride Ophthalmic Solution, USP .5% | Bausch + Lomb | NDC 24208-730-06 | https://www.bausch.com/ecp/our-products/rx-pharmaceuticals/generics |
| Regulator (tank dependent- 5% CO2: Fisherbrand Mulitstage Gas Cylinder Regulators) | Genstar Technologies Company | 10575150 | https://www.fishersci.com/shop/products/fisherbrand-multistage-cylinder-regulators-22/10575150?keyword=true |
| Regulator (tank dependent- Oxygen: Fisherbrand Multistage Gas Cylinder Regulators) | Genstar Technologies Company | 10575145 | https://www.fishersci.com/shop/products/fisherbrand-multistage-cylinder-regulators-22/10575145?keyword=true |
| Rubber Tubing (Inner diameter 19 mm, Outer diameter 27 mm), Made in House | |||
| Sealing tape- Parafilm Wrap (2" Wide) | Cole Parmer | PM992 | https://www.coleparmer.com/i/parafilm-pm992-wrap-2-wide-250-ft-roll/0672050?PubID=VV&persist=True&ip=no&gclid=EAIaIQobChMInY3vqomz5QIVfyCtBh1VSg64EAAYASAAEgJ9n_D_BwE |
| Sterile Alcohol Prep Pads | Medline | MDS090670 | https://www.medline.com/product/Sterile-Alcohol-Prep-Pads/Swab-Pads/Z05-PF03816 |
| Tropicamide Ophthalmic Solution, USP 1% | Akorn | NDC 17478-102-12 | http://www.akorn.com/prod_detail.php?ndc=17478-102-12 |
| Tubing Adapter, Made in House | |||
| Two-way non-rebreathing valve (2600 Series- Inner Diameter 28.6 mm, Outer Diameter 35 mm) | Hans Rudolph | 2600 Series, UM-112078 | www.rudolphkc.com |
References
- Country, M. W. Retinal metabolism: A comparative look at energetics in the retina. Brain Research. 1672, 50-57 (2017).
- Ashimatey, B. S., Green, K. M., Chu, Z., Wang, R. K., Kashani, A. H. Impaired Retinal Vascular Reactivity in Diabetic Retinopathy as Assessed by Optical Coherence Tomography Angiography. Investigative Ophthalmology & Visual Science. 60 (7), 2468(2019).
- Hickam, J. B. M. D., Frayser, R. P. D. Studies of the Retinal Circulation in Man: Observations on Vessel Diameter, Arteriovenous Oxygen Difference, and Mean Circulation Time. Circulation. 33 (2), 302-316 (1966).
- Dorner, G. T., Garhoefer, G., Zawinka, C., Kiss, B., Schmetterer, L. Response of Retinal Blood Flow to CO2 -Breathing in Humans. European Journal of Ophthalmology. 12 (6), 459-466 (2002).
- Linsenmeier, R. A., Zhang, H. F. Retinal oxygen: from animals to humans. Progress in Retinal and Eye Research. 58, 115-151 (2017).
- Eliakim, M., Mor, I., Michaelson, I. C. Assessment of pharmacologic effects on the retinal circulation of hypertensive subjects by a quantitative method. Microvascular Research. 4 (4), 374-383 (1972).
- Gilmore, E. D., et al. Retinal arteriolar hemodynamic response to an acute hyperglycemic provocation in early and sight-threatening diabetic retinopathy. Microvascular Research. 73 (3), 191-197 (2007).
- Hickam, J. B., Sieker, H. O. Retinal Vascular Reactivity in Patients with Diabetes Mellitus and with Atherosclerosis. Circulation. 22 (2), 243-246 (1960).
- Gilmore, E. D., et al. Retinal Arteriolar Diameter, Blood Velocity, and Blood Flow Response to an Isocapnic Hyperoxic Provocation in Early Sight-Threatening Diabetic Retinopathy. Investigative Ophthalmology & Visual Science. 48 (4), 1744(2007).
- Garhofer, G. Reduced response of retinal vessel diameters to flicker stimulation in patients with diabetes. British Journal of Ophthalmology. 88 (7), 887-891 (2004).
- Felder, A. E., Wanek, J., Blair, N. P., Shahidi, M. Inner Retinal Oxygen Extraction Fraction in Response to Light Flicker Stimulation in Humans. Investigative Ophthalmology & Visual Science. 56 (11), 6633-6637 (2015).
- Rose, K., Flanagan, J. G., Patel, S. R., Cheng, R., Hudson, C. Retinal Blood Flow and Vascular Reactivity in Chronic Smokers. Investigative Ophthalmology & Visual Science. 55 (7), 4266(2014).
- Omae, T., Nagaoka, T., Yoshida, A. Effects of Habitual Cigarette Smoking on Retinal Circulation in Patients With Type 2 Diabetes. Investigative Ophthalmology & Visual Science. 57 (3), 1345(2016).
- Pusparajah, P., Lee, L. H., Abdul Kadir, K. Molecular Markers of Diabetic Retinopathy: Potential Screening Tool of the Future. Frontiers in Physiology. 7, (2016).
- Hammer, M., Vilser, W., Riemer, T., Schweitzer, D. Retinal vessel oximetry-calibration, compensation for vessel diameter and fundus pigmentation, and reproducibility. Journal of Biomedical Optics. 13 (5), 054015(2008).
- Gilmore, E. D., Hudson, C., Preiss, D., Fisher, J. Retinal arteriolar diameter, blood velocity, and blood flow response to an isocapnic hyperoxic provocation. American Journal of Physiology-Heart and Circulatory Physiology. 288 (6), 2912-2917 (2005).
- Duan, A., Bedggood, P. A., Metha, A. B., Bui, B. V. Reactivity in the human retinal microvasculature measured during acute gas breathing provocations. Scientific Reports. 7 (1), 2113(2017).
- Burns, S. A., Elsner, A. E., Sapoznik, K. A., Warner, R. L., Gast, T. J. Adaptive optics imaging of the human retina. Progress in Retinal and Eye Research. 68, 1-30 (2019).
- Kim, A. Y., Chu, Z., Shahidzadeh, A., Wang, R. K., Puliafito, C. A., Kashani, A. H. Quantifying Microvascular Density and Morphology in Diabetic Retinopathy Using Spectral-Domain Optical Coherence Tomography Angiography. Investigative Ophthalmology & Visual Science. 57 (9), (2016).
- Koulisis, N., et al. Quantitative microvascular analysis of retinal venous occlusions by spectral domain optical coherence tomography angiography. PLOS ONE. 12 (4), 0176404(2017).
- Kim, A. Y., et al. Quantifying Retinal Microvascular Changes in Uveitis Using Spectral-Domain Optical Coherence Tomography Angiography. American Journal of Ophthalmology. 171, 101-112 (2016).
- Kashani, A. H., et al. Optical coherence tomography angiography: A comprehensive review of current methods and clinical applications. Progress in Retinal and Eye Research. 60, 66-100 (2017).
- Yu, D. Y., et al. Retinal capillary perfusion: Spatial and temporal heterogeneity. Progress in Retinal and Eye Research. 70, 23-54 (2019).
- Tayyari, F., et al. The Relationship between Retinal Vascular Reactivity and Arteriolar Diameter in Response to Metabolic Provocation. Investigative Ophthalmology & Visual Science. 50 (10), 4814(2009).
- Lu, H., Liu, P., Yezhuvath, U., Cheng, Y., Marshall, O., Ge, Y. MRI Mapping of Cerebrovascular Reactivity via Gas Inhalation Challenges. Journal of Visualized Experiments. (94), e52306(2014).
- Reif, R., Qin, J., An, L., Zhi, Z., Dziennis, S., Wang, R. Quantifying Optical Microangiography Images Obtained from a Spectral Domain Optical Coherence Tomography System. International Journal of Biomedical Imaging. 2012, 1-11 (2012).
- Olafsdottir, O. B., Eliasdottir, T. S., Kristjansdottir, J. V., Hardarson, S. H., Stefánsson, E. Retinal Vessel Oxygen Saturation during 100% Oxygen Breathing in Healthy Individuals. PLOS ONE. 10 (6), 0128780(2015).
- Kiss, B., et al. Retinal Blood Flow during Hyperoxia in Humans Revisited: Concerted Results Using Different Measurement Techniques. Microvascular Research. 64 (1), 75-85 (2002).
- Yezhuvath, U. S., Lewis-Amezcua, K., Varghese, R., Xiao, G., Lu, H. On the assessment of cerebrovascular reactivity using hypercapnia BOLD MRI. NMR in biomedicine. 22 (7), 779-786 (2009).
- Hardarson, S. H., et al. Automatic Retinal Oximetry. Investigative Ophthalmology & Visual Science. 47 (11), 5011(2006).
- Sousa, D. C., Leal, I., Moreira, S., Dionísio, P., Abegão Pinto, L., Marques-Neves, C. Hypoxia challenge test and retinal circulation changes - a study using ocular coherence tomography angiography. Acta Ophthalmologica. 96 (3), 315-319 (2018).
- Slessarev, M., Somogyi, R., Preiss, D., Vesely, A., Sasano, H., Fisher, J. A. Efficiency of oxygen administration: Sequential gas delivery versus "flow into a cone" methods. Critical Care Medicine. 34 (3), 829-834 (2006).
- Gilmore, E. D., Hudson, C., Venkataraman, S. T., Preiss, D., Fisher, J. Comparison of Different Hyperoxic Paradigms to Induce Vasoconstriction: Implications for the Investigation of Retinal Vascular Reactivity. Investigative Ophthalmology & Visual Science. 45 (9), 3207(2004).
- Shahidi, A. M., Patel, S. R., Huang, D., Tan, O., Flanagan, J. G., Hudson, C. Assessment of total retinal blood flow using Doppler Fourier Domain Optical Coherence Tomography during systemic hypercapnia and hypocapnia. Physiological Reports. 2 (7), 12046(2014).
- Maleki, N., et al. The Effect of Hypercarbia and Hyperoxia on the Total Blood Flow to the Retina as Assessed by Magnetic Resonance Imaging. Investigative Ophthalmology & Visual Science. 52 (9), 6867(2011).
- Smit, B., Smulders, Y. M., vander Wouden, J. C., Oudemans-van Straaten, H. M., Spoelstra-de Man, A. M. E. Hemodynamic effects of acute hyperoxia: systematic review and meta-analysis. Critical Care. 22 (1), 45(2018).
- Piccolino, F. P., Cagini, C., Fruttini, D., Nicolò, M., Eandi, C. M., Tito, S. Retinal Vascular Reactivity in Central Serous Chorioretinopathy. Investigative Ophthalmology & Visual Science. 59 (11), 4425(2018).
- Sousa, D. C., et al. A Protocol to Evaluate Retinal Vascular Response Using Optical Coherence Tomography Angiography. Frontiers in Neuroscience. 13, 566(2019).
- Robinson, F., Riva, C. E., Grunwald, J. E., Petrig, B. L., Sinclair, S. H. Retinal Blood Flow Autoregulation in Response to on Acute Increase in Blood Pressure. Investigative Ophthalmology & Visual Science. 27 (5), 5(1986).
- Gherghel, D., Hosking, S. L., Cunliffe, I. A. Abnormal Systemic and Ocular Vascular Response to Temperature Provocation in Primary Open-Angle Glaucoma Patients: A Case for Autonomic Failure. Investigative Ophthalmology & Visual Science. 45 (10), 3546(2004).
- You, Q., et al. Reproducibility of vessel density measurement with Optical Coherence Tomography Angiography in eyes with and without retinopathy. Retina. 37 (8), 1475-1482 (2017).
- Lei, J., et al. Repeatability and Reproducibility of Superficial Macular Retinal Vessel Density Measurements Using Optical Coherence Tomography Angiography En Face Images. JAMA Ophthalmology. 135 (10), 1092(2017).
- Czakó, C., et al. Intrasession and Between-Visit Variability of Retinal Vessel Density Values Measured with OCT Angiography in Diabetic Patients. Scientific Reports. 8 (1), 10598(2018).
- Field, A. S., Laurienti, P. J., Yen, Y. F., Burdette, J. H., Moody, D. M. Dietary Caffeine Consumption and Withdrawal: Confounding Variables in Quantitative Cerebral Perfusion Studies. Radiology. 227 (1), 129-135 (2003).
- Baek, S. U., et al. Diurnal change of retinal vessel density and mean ocular perfusion pressure in patients with open-angle glaucoma. PLOS ONE. 14 (4), 0215684(2019).
- Müller, V. C., Storp, J. J., Kerschke, L., Nelis, P., Eter, N., Alnawaiseh, M. Diurnal variations in flow density measured using optical coherence tomography angiography and the impact of heart rate, mean arterial pressure and intraocular pressure on flow density in primary open-angle glaucoma patients. Acta Ophthalmologica. 97 (6), (2019).
- Sarwar, S., et al. Diurnal variation of choriocapillaris vessel flow density in normal subjects measured using optical coherence tomography angiography. International Journal of Retina and Vitreous. 4 (1), 37(2018).
- Liu, P., De Vis, J. B., Lu, H. Cerebrovascular reactivity (CVR) MRI with CO2 challenge: A technical review. NeuroImage. 187, 104-115 (2019).
- Ting, D. S. W., et al. Optical Coherence Tomographic Angiography in Type 2 Diabetes and Diabetic Retinopathy. JAMA Ophthalmology. 135 (4), 306(2017).
- Spaide, R. F., Fujimoto, J. G., Waheed, N. K., Sadda, S. R., Staurenghi, G. Optical coherence tomography angiography. Progress in retinal and eye research. 64, 1-55 (2018).
- An, D., et al. Quantitative comparisons between optical coherence tomography angiography and matched histology in the human eye. Experimental Eye Research. 170, 13-19 (2018).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved