Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Réactivité vasculaire rétinienne évaluée par l’angiographie de la tomographie de la cohérence optique
Dans cet article
Résumé
Cet article décrit une méthode pour mesurer la réactivité réactivature rétinienne de vascularisation in vivo avec des sujets humains utilisant une technique de provocation de respiration de gaz pour délivrer des stimuli vasoactives tout en acquérant des images rétiniennes.
Résumé
L’approvisionnement vasculaire à la rétine a été montré pour s’adapter dynamiquement par vasoconstriction et vasodilatation pour répondre aux exigences métaboliques de la rétine. Ce processus, appelé réactivité vasculaire rétinienne (RVR), est médié par le couplage neurovasculaire, qui est altéré très tôt dans les maladies vasculaires rétiniennes telles que la rétinopathie diabétique. Par conséquent, une méthode cliniquement faisable d’évaluer la fonction vasculaire peut être d’un intérêt significatif à la fois dans la recherche et les milieux cliniques. Récemment, l’imagerie in vivo de la vascularisation rétinienne au niveau capillaire a été rendue possible par l’approbation de FDA de l’angiographie de tomographie de cohérence optique (OCTA), une méthode non invasive, minimale de risque et d’angiographie sans teint avec la résolution de niveau capillaire. Parallèlement, des changements physiologiques et pathologiques dans le RVR ont été montrés par plusieurs investigateurs. La méthode indiquée dans ce manuscrit est conçue pour étudier le RVR à l’aide de l’OCTA sans avoir besoin de modifications aux procédures ou appareils d’imagerie clinique. Il démontre l’imagerie en temps réel de la rétine et la vascularisation rétinienne lors de l’exposition à des conditions hypercapniques ou hyperoxiques. L’examen est facilement effectué avec deux membres du personnel en moins de 30 minutes avec un minimum d’inconfort ou de risque sujet. Cette méthode est adaptable à d’autres dispositifs d’imagerie ophtalmique et les applications peuvent varier en fonction de la composition du mélange de gaz et de la population de patients. Une force de cette méthode est qu’elle permet une étude de la fonction vasculaire rétinienne au niveau capillaire dans les sujets humains in vivo. Les limites de cette méthode sont en grande partie celles de l’OCTA et d’autres méthodes d’imagerie rétinienne, y compris les artefacts d’imagerie et une plage dynamique restreinte. Les résultats obtenus à partir de la méthode sont des images OCT et OCTA de la rétine. Ces images sont à l’écoute de toute analyse possible sur les périphériques OCT ou OCTA disponibles dans le commerce. La méthode générale, cependant, peut être adaptée à n’importe quelle forme d’imagerie ophtalmique.
Introduction
La demande métabolique de la rétine dépend d’un approvisionnement adéquat et constant en oxygène fourni par un système bien réglementé d’artérioles, de capillaires et de venuesles1. Plusieurs études ont démontré que la fonction des vaisseaux rétiniens humains de plus grand calibre peut être évaluée in vivo avec divers physiologiques2,3,4,5 et pharmacologiques6,7 stimuli. En outre, la fonction anormale de ce système vasculaire est commune dans les maladies vasculaires rétiniennes telles que la rétinopathie diabétique où la réactivité vasculaire rétinienne (RVR) a été montré pour être atténuée même dans ses premiers stades8,9 à la fois par provocation de gaz9 et des expériences de lumière vacillante5,10,11. Les facteurs de risque vasculaires rétinaux tels que le tabagisme ont également été corrélés avec le RVR12 altéré et le flux sanguin rétinien13. Ces résultats sont importants puisque les symptômes cliniques de la maladie vasculaire rétinienne se produisent relativement tard dans le processus de la maladie et les marqueurs cliniques tôt prouvés de la maladie manquent14. Ainsi, l’évaluation de RVR peut fournir des mesures utiles de l’intégrité vasculaire pour l’évaluation tôt des anomalies qui peuvent initier ou exacerber les maladies dégénératives rétiniennes.
Les expériences précédentes de RVR se sont généralement appuyées sur des dispositifs tels qu’un débit de sang laser9 ou des caméras de fundus équipées de filtres spéciaux15 pour l’acquisition d’images rétinales. Cependant, ces technologies sont optimisées pour les navires de plus grand diamètre tels que les artérioles16 et les15, qui ne sont pas là où le gaz, le micronutriment et l’échange moléculaire se produisent. Une étude plus récente a été en mesure de quantifier le RVR des capillaires en utilisant l’imagerie optique adaptative17, mais en dépit de la résolution spatiale améliorée, ces images ont une plus petite taille de champ et ne sont pas approuvés par la FDA pour une utilisation clinique18.
L’avènement récent de l’angiographie de tomographie de cohérence optique (OCTA) a fourni une méthode angiographique approuvée par la FDA, non invasive et sans teinture d’évaluer les changements de niveau capillaire chez les patients humains et les sujets in vivo. OCTA est largement accepté dans la pratique clinique comme un outil efficace pour évaluer l’affaiblissement de la perfusion capillaire dans les maladies vasculaires rétiniennes telles que la rétinopathie diabétique19, occlusions veineuses rétiniennes20, vasculitis21 et beaucoup d’autres22. OCTA fournit donc une excellente occasion pour l’évaluation des changements de niveau capillaire, qui peuvent avoir l’hétérogénéité spatiale et temporelle significative23 ainsi que des changements pathologiques, dans un cadre clinique. Notre groupe a récemment démontré que l’OCTA peut être utilisée pour quantifier la réactivité des vaisseaux rétinaires au niveau capillaire2 aux changements physiologiques de l’oxygène inspiré, qui est un stimulus vasoconstrictif rétinaire16,24, et le dioxyde de carbone, qui est un stimulus vasodilaté rétinaire3,5.
Le but de cet article est de décrire un protocole qui permettra au lecteur d’évaluer la réactivité vasculaire rétinienne des petits artérioles et lit capillaire à l’aide de l’OCTA. Les méthodes sont adaptées de celles présentées dans Lu et autres25 qui ont décrit la mesure de la réactivité cérébrovasculaire avec la formation image de résonance magnétique. Bien que les méthodes actuelles aient été développées et utilisées lors de l’imagerieOCTA 2,elles s’appliquent à d’autres dispositifs d’imagerie rétinienne avec des modifications relativement simples et évidentes.
Access restricted. Please log in or start a trial to view this content.
Protocole
Cette étude a été approuvée par l’University of Southern California Institutional Review Board et a adhéré aux principes de la Déclaration d’Helsinki.
1. Configuration de l’appareil de non-réfrigération du gaz
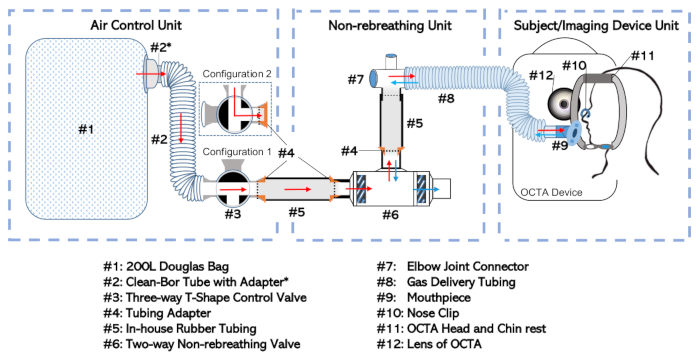
Figure 1 : Diagramme de l’appareil non respirant. La configuration complète a été divisée en trois unités distinctes en fonction de leur fonction et de la fréquence avec laquelle ils sont traités indépendamment. Il s’agit notamment de l’unité de contrôle de l’air, de l’unité de non-réfrigération et de l’unité des dispositifs de soumission/imagerie S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
-
Assemblage d’appareils
- Connectez le sac Douglas(figure 1, #1) à la soupape à trois voies (#3) à un port d’entrée sélectif via le tube de 35 mm de diamètre intérieur (#2; voir Tableau des matériaux)avec adaptateur (#2). Cette combinaison s’appellera « Unité de contrôle de l’air », comme le montre la figure 1.
- Connectez la valve bidirectionnel non respirante (#6) au connecteur d’articulation du coude (#7) au port buccale de la valve non respirante. Former la connexion à l’aide d’un tube en caoutchouc (#5) équipé d’un adaptateur (#4).
- Connectez l’articulation du coude au tube de livraison de gaz (#8). Cette configuration, y compris la soupape de non-rebreathing (#6), les tubes internes (#5), les adaptateurs (#4), l’articulation du coude (#7) et le tube de livraison de gaz (#8) s’appelleront l'« unité de non-rebreathing ».
REMARQUE: Réduisez la quantité d’espace mort entre la bouche du sujet et le diaphragme de la valve bidirectionnel non respirante (#6). - Connectez l’unité de contrôle de l’air au port de sortie de la soupape à trois voies (#3) à l’unité de non-réfrigération au port d’entrée de la soupape bidirectionnel sans rebre gainage (#6). Faire la connexion à l’aide de tubes en caoutchouc supplémentaires (#5) et adaptateurs (#4) comme ceux décrits plus tôt qui permettent aux morceaux d’être insérés les uns dans les autres.
- Sceller toutes les connexions lâches en enveloppant les joints avec du ruban adhésif pour assurer un ajustement hermétique.
- Connectez le tube de livraison de gaz (#8) à son extrémité ouverte à un embout buccal (#9) comme le montre l’unité des dispositifs de sujet/imagerie de la figure 1.
REMARQUE: Cette étape (1.1.6) peut être reportée jusqu’à ce que les essais en question soient prêts à commencer (étape 3.5).
-
Préparation de l’unité de contrôle de l’air pour le gaz non-rebreathing
- Isolez l’unité de contrôle de l’air en la déconnectant de tout tube interne (#5) ou adaptateurs (#4) si elle n’est pas déjà séparée.
- Assurez-vous que le sac Douglas (#1) est vide ou vide le sac Douglas (#1) de tout air en roulant systématiquement le sac de l’extrémité distale vers le port d’entrée du sac avec la soupape à trois voies (#3) réglée à la configuration 1 comme le montre la figure 1.
- Remplir le sac Douglas (#1) avec le mélange de gaz approprié.
- Si l’on ne veut que le non-rebreathing en espace d’air, réglez la soupape à trois voies à la configuration 2 (indiquée à la figure 1) et ne remplissez pas le sac Douglas (#1). Dans le cas contraire, continuez avec les étapes qui composent l’étape 1.2.3.
- Connectez l’unité de contrôle de l’air (indiquée dans la figure 1) au point de sortie de la soupape à trois voies (#3) à une bouteille de gaz (contenant le mélange d’air souhaité) à l’aide des adaptateurs et des tubes appropriés. Utilisez un adaptateur de manchette pour monter un tube de remplissage de gaz de 1/8 po au diamètre externe de la soupape à trois voies (#3).
- Réglez l’assemblage de soupapes à trois voies à la configuration 1 (comme indiqué à la figure 1) pour permettre au gaz prévu de s’écouler du cylindre de stockage dans le sac Douglas (#1). Ouvrez la bouteille de gaz.
- Une fois que le sac Douglas (#1) est rempli au volume prévu (généralement à moitié rempli), fermez la prise de bouteille de gaz et définissez la soupape à trois voies à la configuration 2, qui isole le gaz dans le sac Douglas (#1). Déconnectez l’unité de contrôle de l’air de tout tuyauterie utilisé pour remplir le sac Douglas (#1).
2. Préparer le sujet de l’imagerie
- Après le consentement du sujet à participer à l’étude, placez le sujet derrière le dispositif d’imagerie OCTA. Expliquez les procédures de test au sujet.
- Confirmer les antécédents médicaux du sujet pour s’assurer que le sujet n’a pas d’affections médicales existantes qui augmentent le risque de participer à l’étude.
REMARQUE: Les maladies cardiovasculaires ou pulmonaires préexistantes sont des facteurs de risque pour lesquels les sujets peuvent être exclus de la participation. Il est essentiel que le sujet comprenne qu’il peut arrêter la procédure à tout moment pour quelque raison que ce soit, comme se sentir étourdi ou un inconfort inattendu supplémentaire. - Déterminez l’œil à évaluer selon le protocole d’essai. Un œil seulement peut être photographié pour limiter le temps d’essai et minimiser les malaises potentiels du gaz non-rebreathing.
- Considérez la dilatation des yeux si le sujet a une taille d’élève d’environ 2,5 mm ou moins. Bien que la dilatation ne soit pas obligatoire, elle augmente les chances d’acquérir des images de bonne qualité. Pour dilater, inculquer une goutte chacun de 0,5% proparacaine hydrochlorure solution ophtalmique, 1% solution ophtalmique tropiqueamide et 2,5% phenylephrine hydrochlorure ophtalmique solution. La dilatation complète doit se produire dans les 10-15 min.
3. Expérience de provocation au gaz et acquisition d’images
- Créez un profil pour le patient dans la machine OCTA.
- Portez des gants.
- Essuyez la tête et le menton OCTA avec un écouvillonnage d’alcool pour désinfecter la configuration.
- Libérez l’embout buccal (#9) de son emballage stérile.
REMARQUE: S’abstenir de toucher l’embout buccal autant que possible que ce composant établit un contact direct avec la muqueuse de la bouche du sujet - Connectez l’embout buccal (#9) au tube de livraison de gaz (#8)
- Placez un oxymètre d’impulsion sur le doigt des sujets et commencez à surveiller les niveaux de saturation et d’impulsion d’oxygène.
REMARQUE: Une fois que le sujet commence à respirer le mélange d’air désiré, l’oxymètre de pouls doit être surveillé en permanence par l’examinateur. Si la saturation en oxygène du sujet tombe en dessous de 94 %, l’expérience doit être arrêtée, par mesure de précaution de sécurité, et le sujet observé jusqu’à ce qu’ils retournent à la ligne de base. - Ajuster la hauteur de la configuration OCTA afin que le sujet peut facilement reposer leur menton sur le menton (#11) sans surextendre ou fléchir leur cou.
- Bouclez le tube de livraison de gaz (#8) avec l’attache de l’embout buccal (#9) par la tête et le menton reposez-vous avec l’embout buccal (#9) face au patient. Faites passer la boucle de tubes à travers la machine oppposite le côté de l’œil que le sujet est d’avoir photographié.
- Insérez l’embout buccal dans la bouche du patient. Encouragez le sujet à pratiquer la respiration par la configuration de non-rebreathing pour créer la familiarité avec l’appareil. Assurez-vous que le sujet respire profondément pour faciliter l’échange de gaz.
- Placez le coup de nez (#10) sur le sujet pour s’assurer qu’ils respirent par l’embout buccal.
- Conservez la soupape à trois voies sur la configuration 2 ou changez-la en Configuration 1 selon que les images sont acquises pour l’exposition à l’air de la pièce ou à un mélange de gaz spécifique, respectivement. Pour référence future, notez l’heure comme le début de l’inhalation de gaz.
- Demandez au sujet de placer leur menton sur la partie droite ou gauche du menton (#11) selon l’œil sélectionné pour l’imagerie.
- Assurez-vous qu’ils bougent la tête vers l’avant jusqu’à ce que leur front soit en contact ferme avec l’appuie-tête (#11).
- Capturez l’analyse d’intérêt de l’OCTA telle que déterminée par le protocole d’essai. Dans cette étude, trois images de 3 mm x 3 mm centrées sur le fovea ont été capturées après 1 min de respiration gazeuse.
- Demandez au sujet de garder la tête tournée vers l’avant et encore tout en fixant sur la cible au centre de leur vue
- Dans l’image en direct vue dans la vue de l’iris, centrez l’analyse.
- Mettre l’iris au point en déplaçant le menton à l’aide des flèches gauche-droite.
- Assurez-vous que la trempette foveal est centrée dans l’analyse OCT, qui devrait se produire par défaut.
- Prenez une image. La numérisation durera habituellement plusieurs secondes sur une machine OCTA.
- Afficher l’image OCTA après l’achèvement de l’analyse et s’assurer qu’il est de qualité adéquate. La puissance du signal devrait être de 7 ou mieux sur une échelle de 10 points fournie par le fabricant OCTA.
- Sélectionnez enregistrer ou rescan l’œil.
- Répétez les étapes 3.14.1-3.14.7 pour autant d’analyses désirées.
- Laissez le sujet s’asseoir à partir de la machine. Retirez le coup de nez (#10) et l’embout buccal (#9) lorsqu’il n’y a plus de balayages de l’œil avec ce mélange de gaz.
- Autoriser les sujets à une pause de 2 minutes avant de commencer des expériences de provocation au gaz CO2.
- Remplissez le sac Douglas avec le premier mélange d’air désiré (composé de 5 % de CO2,21 % d’oxygène et 74 % d’azote) tel que spécifié à l’étape 1.2. La soupape à trois voies sera dans la configuration 2 après cette étape.
- Installation complète de l’appareil de non-réfrigération au gaz en connectant l’unité de contrôle aérien à l’unité de non-réfrigération, comme le montre la figure 1 et décrite à l’étape 1.1.4. Assurez-vous que toutes les articulations sont étanches à l’air avec du ruban adhésif.
- Répétez les étapes 3.9-3.14, mais réglez maintenant la soupape à trois voies à la configuration 1 lorsqu’elle est dirigée dans l’étape 3.11.
- Donnez aux sujets une pause de 10 minutes après la provocation au gaz CO2 pour permettre un retour à la ligne de base.
- Pendant que le sujet est en pause, remplissez le sac Douglas avec 100% O2 selon l’étape 1.2.
- Répétez les étapes 3.17-3.18 pour effectuer l’expérience dans des conditions de provocation au gaz 100% O2.
4. Nettoyage expérimental
- Jetez les éléments jetables de la configuration : l’embout buccal du sujet (#9) et le clip de nez (#10).
- Nettoyer le repose-tête et le menton (#11) à l’aide d’un écouvillonnage d’alcool. Essuyez la chaise en question, la table OCTA et les poignées OCTA avec une lingette désinfectante pour enlever toute salive errante.
- Déconnectez la configuration dans ses composants de base , l’unité de contrôle de l’air et l’unité de non-réfrigération, à la soupape à trois voies (#3).
- Comme aucun air expiré du sujet n’aurait dû atteindre les éléments de l’unité de contrôle de l’air, videz le sac Douglas selon l’étape 1.2.2 et placez-le dans un endroit pour une récupération future. Déconnectez le tube propre (#2) avec adaptateur (#2MD) et la soupape à trois voies (#3) du sac Douglas si désiré pour un rangement plus facile. Cela complète le nettoyage de l’unité de contrôle de l’air.
- Retirez le tube de livraison de gaz (#8) de l’unité de non-réfrigération en la déconnectant de l’articulation du coude (#7). Déconnectez les adaptateurs de tubes en caoutchouc (#5) et de tubes (#4), de la soupape bidirectionnel non respirante (#6). Ensuite, faites la même chose de l’articulation du coude (#7) en enlevant le ruban adhésif et en détachant les pièces en les démontant.
REMARQUE: Un nettoyage plus complet de la valve bidirectionnelle sans rebreathing peut être facilité en la démontant pour enlever les diaphragmes internes pour des soins supplémentaires. -
Préparer un bain désinfectant pour le nettoyage des composants réutilisables
- Remplissez un contenant suffisamment grand pour submerger le tube de livraison de gaz (#8) avec un désinfectant détergent bien dilué et bien mélangé. Dans ce cas, diluer le détergent avec de l’eau à un rapport de 1:6425.
- Faire tremper le tube de livraison de gaz (#8), la soupape bidirectionnel non rébreau (#6), l’articulation du coude (#7), les tubes en caoutchouc (#5) et les adaptateurs de tubes (#4) dans le bain désinfectant préparé pendant au moins 10 minutes.
- Retirer toutes les parties après la fin du bain et les rincer soigneusement avec de l’eau.
- Placez-les sur un essuie-tout sur un comptoir propre pour être séchés à l’air.
- Une fois le séchage à l’air terminé, disposer du papier absorbant et placer tous les composants à l’extérieur pour le stockage.
5. OCTA Data Export and Analysis
-
Exportation de données OCTA
- Exporter des données OCTA en insérant un dispositif multimédia amovible de choix dans l’ordinateur OCTA. Trouvez le sujet et l’analyse d’intérêt.
- Sélectionnez Export pour créer un dossier zip contenant les données du sujet d’intérêt dans un format .bmp sur l’appareil multimédia amovible.
-
Analyse des données de l’OCTA
- Organisez les données OCTA sur un ordinateur de laboratoire avec la possibilité d’effectuer des analyses et un traitement d’image supplémentaires.
- Utilisez un script personnalisé pour supprimer le bruit avec une technique globale de seuil et effectuer l’extraction de fonctionnalités supplémentaires. Binarize et squeletter les images OCTA.
- Sur les images post-traitées, calculer la densité squelette du navire (VSD)19,26, une mesure sans dimension de la longueur linéaire totale des navires dans une image calculée par l’équation suivante effectuée sur une image squelettée binarisée de l’OCTA :
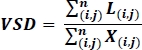
où i et j se réfèrent à la coordonnées pixels (i,j), L(i,j) se réfère à des pixels blancs représentant la décoration, X(i,j) se réfère à tous les pixels, et n se réfère aux dimensions de la gamme de pixels, qui peut être supposé être n x x n pixels19,26. Le dénominateur de cette équation représente le nombre total de pixels qui est calculé comme écrit à partir de l’image squelettée, mais peut être considéré comme représentant la zone physique de l’image entière.
Access restricted. Please log in or start a trial to view this content.
Résultats
La sortie de cette expérience se compose des lectures manuelles prises à partir de l’oxymètre d’impulsion, le moment noté pour l’exposition au gaz ou la numérisation d’OCTA et les données brutes d’imagerie OCTA. Une image OCTA se compose des balayages B de l’OCT et du signal de décoration associé à chaque balayage B. Les paramètres de données sont donnés par les spécifications de l’appareil. Une plate-forme laser à source balayée OCTA machine avec une longueur d’onde centrale de 1040-1060 n...
Access restricted. Please log in or start a trial to view this content.
Discussion
La méthodologie que vient de décrire est le protocole complet d’une expérience de provocation respiratoire au gaz qui permet de mesurer le RVR d’un sujet dans un environnement contrôlé à des délais spécifiques sans modification du dispositif d’imagerie OCTA et un minimum d’inconfort ou de risque pour le sujet. Cette configuration est décrite d’une manière qui permet des modifications faciles pour répondre aux besoins du chercheur. Il peut accueillir des tubes supplémentaires pour s’adapter à diff...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Carl Zeiss Meditec a fourni des subventions, de l’équipement et un soutien financier à L’AHK liés au sujet de cet article.
Remerciements
Ce travail a été soutenu par NIH K08EY027006, R01EY030564, UH3NS100614, Subventions de recherche de Carl Zeiss Meditec Inc (Dublin, CA) et Sans restriction Department Funding from Research to Prevent Blindness (New York, NY).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 5% CO2 gas [5% CO2, 21% O2, 74% N2] (Compressed) | Institution Dependent (Praxair) | ||
| Bacdown Disinfectant Detergent | Decon Labs | 8001 | https://deconlabs.com/products/disinfectant-bdd/ |
| Clean-Bor Tubes (35 mm Inner Diameter) | Vacumed | 1011-108 | http://www.vacumed.com/zcom/product/Product.do?compid=27&skuid=1197 |
| Cuff adapter for Douglas bag filling | Vacumed | 22254 | http://www.vacumed.com/zcom/product/Product.do?compid=27&prodid=343 |
| Douglas bag (200 L capacity) | Harvard Apparatus | 500942 | https://www.harvardapparatus.com/douglas-bag.html |
| Elbow Joint (Inner Diameter 19 mm/Outer Diameter 22 mm), Modified in House | |||
| Fingertip Pulse Oximeter (Pro-Series) | CMS | CMS 500DL | https://www.walmart.com/ip/Pro-Series-CMS-500DL-Fingertip-Pulse-Oximeter-Blood-Oxygen-Saturation-Monitor-with-silicon-cover-batteries-and-lanyard/479049154 |
| Gas Delivery Tube (22 mm Inner Diameter) Modified in House | |||
| Gas filling tube (1/8" for compressed gas) | |||
| Hydrogen Peroxide Cleaner Disinfectant Wipes | Clorox Healthcare | 30824 | https://www.cloroxpro.com/products/clorox-healthcare/hydrogen-peroxide-cleaner-disinfectants/?gclid=EAIaIQobChMIk-KG4vi15QIVcRh9Ch0NNwLPEAAYASAAEgJIa_D_BwE&gclsrc=aw.ds |
| Lubricant Eye Drops | Refresh | Refresh Plus | https://www.refreshbrand.com/Products/refresh-plus |
| Manual Directional Control Valves: Three-Way T-Shape Stopcock Type (Inner Diameter 28.6 mm, Outer Diameter 35 mm) | Hans Rudolph | 2100C Series | www.rudolphkc.com |
| Medical O2 (Compressed) | Institution Dependent | ||
| Mouth piece (Silicone, Model #9061) | Hans Rudolph | 602076 | www.rudolphkc.com |
| OCTA Imaging Device (PLEX Elite 9000) | Carl Zeiss Meditec, Dublin, CA, USA | https://www.zeiss.com/meditec/int/product-portfolio/optical-coherence-tomography-devices/plex-elite-9000-swept-source-oct.html | |
| Phenylephrine Hydrochloride Ophthalmic Solution, USP 2.5% | Paragon Bioteck, Inc | NDC 42702-102-15 | https://paragonbioteck.com/products/diagnostics/phenylephrine-hydrochloride-ophthalmic-solution-usp-2-5/ |
| Plastic Nose Clip Sterile Foam CS100 | Sklar Sterile | 96-2951 | https://www.sklarcorp.com/disposables/plastic/plastic-nose-clip-sterile-foam-box-of-100.html |
| Proparacaine Hydrochloride Ophthalmic Solution, USP .5% | Bausch + Lomb | NDC 24208-730-06 | https://www.bausch.com/ecp/our-products/rx-pharmaceuticals/generics |
| Regulator (tank dependent- 5% CO2: Fisherbrand Mulitstage Gas Cylinder Regulators) | Genstar Technologies Company | 10575150 | https://www.fishersci.com/shop/products/fisherbrand-multistage-cylinder-regulators-22/10575150?keyword=true |
| Regulator (tank dependent- Oxygen: Fisherbrand Multistage Gas Cylinder Regulators) | Genstar Technologies Company | 10575145 | https://www.fishersci.com/shop/products/fisherbrand-multistage-cylinder-regulators-22/10575145?keyword=true |
| Rubber Tubing (Inner diameter 19 mm, Outer diameter 27 mm), Made in House | |||
| Sealing tape- Parafilm Wrap (2" Wide) | Cole Parmer | PM992 | https://www.coleparmer.com/i/parafilm-pm992-wrap-2-wide-250-ft-roll/0672050?PubID=VV&persist=True&ip=no&gclid=EAIaIQobChMInY3vqomz5QIVfyCtBh1VSg64EAAYASAAEgJ9n_D_BwE |
| Sterile Alcohol Prep Pads | Medline | MDS090670 | https://www.medline.com/product/Sterile-Alcohol-Prep-Pads/Swab-Pads/Z05-PF03816 |
| Tropicamide Ophthalmic Solution, USP 1% | Akorn | NDC 17478-102-12 | http://www.akorn.com/prod_detail.php?ndc=17478-102-12 |
| Tubing Adapter, Made in House | |||
| Two-way non-rebreathing valve (2600 Series- Inner Diameter 28.6 mm, Outer Diameter 35 mm) | Hans Rudolph | 2600 Series, UM-112078 | www.rudolphkc.com |
Références
- Country, M. W. Retinal metabolism: A comparative look at energetics in the retina. Brain Research. 1672, 50-57 (2017).
- Ashimatey, B. S., Green, K. M., Chu, Z., Wang, R. K., Kashani, A. H. Impaired Retinal Vascular Reactivity in Diabetic Retinopathy as Assessed by Optical Coherence Tomography Angiography. Investigative Ophthalmology & Visual Science. 60 (7), 2468(2019).
- Hickam, J. B. M. D., Frayser, R. P. D. Studies of the Retinal Circulation in Man: Observations on Vessel Diameter, Arteriovenous Oxygen Difference, and Mean Circulation Time. Circulation. 33 (2), 302-316 (1966).
- Dorner, G. T., Garhoefer, G., Zawinka, C., Kiss, B., Schmetterer, L. Response of Retinal Blood Flow to CO2 -Breathing in Humans. European Journal of Ophthalmology. 12 (6), 459-466 (2002).
- Linsenmeier, R. A., Zhang, H. F. Retinal oxygen: from animals to humans. Progress in Retinal and Eye Research. 58, 115-151 (2017).
- Eliakim, M., Mor, I., Michaelson, I. C. Assessment of pharmacologic effects on the retinal circulation of hypertensive subjects by a quantitative method. Microvascular Research. 4 (4), 374-383 (1972).
- Gilmore, E. D., et al. Retinal arteriolar hemodynamic response to an acute hyperglycemic provocation in early and sight-threatening diabetic retinopathy. Microvascular Research. 73 (3), 191-197 (2007).
- Hickam, J. B., Sieker, H. O. Retinal Vascular Reactivity in Patients with Diabetes Mellitus and with Atherosclerosis. Circulation. 22 (2), 243-246 (1960).
- Gilmore, E. D., et al. Retinal Arteriolar Diameter, Blood Velocity, and Blood Flow Response to an Isocapnic Hyperoxic Provocation in Early Sight-Threatening Diabetic Retinopathy. Investigative Ophthalmology & Visual Science. 48 (4), 1744(2007).
- Garhofer, G. Reduced response of retinal vessel diameters to flicker stimulation in patients with diabetes. British Journal of Ophthalmology. 88 (7), 887-891 (2004).
- Felder, A. E., Wanek, J., Blair, N. P., Shahidi, M. Inner Retinal Oxygen Extraction Fraction in Response to Light Flicker Stimulation in Humans. Investigative Ophthalmology & Visual Science. 56 (11), 6633-6637 (2015).
- Rose, K., Flanagan, J. G., Patel, S. R., Cheng, R., Hudson, C. Retinal Blood Flow and Vascular Reactivity in Chronic Smokers. Investigative Ophthalmology & Visual Science. 55 (7), 4266(2014).
- Omae, T., Nagaoka, T., Yoshida, A. Effects of Habitual Cigarette Smoking on Retinal Circulation in Patients With Type 2 Diabetes. Investigative Ophthalmology & Visual Science. 57 (3), 1345(2016).
- Pusparajah, P., Lee, L. H., Abdul Kadir, K. Molecular Markers of Diabetic Retinopathy: Potential Screening Tool of the Future. Frontiers in Physiology. 7, (2016).
- Hammer, M., Vilser, W., Riemer, T., Schweitzer, D. Retinal vessel oximetry-calibration, compensation for vessel diameter and fundus pigmentation, and reproducibility. Journal of Biomedical Optics. 13 (5), 054015(2008).
- Gilmore, E. D., Hudson, C., Preiss, D., Fisher, J. Retinal arteriolar diameter, blood velocity, and blood flow response to an isocapnic hyperoxic provocation. American Journal of Physiology-Heart and Circulatory Physiology. 288 (6), 2912-2917 (2005).
- Duan, A., Bedggood, P. A., Metha, A. B., Bui, B. V. Reactivity in the human retinal microvasculature measured during acute gas breathing provocations. Scientific Reports. 7 (1), 2113(2017).
- Burns, S. A., Elsner, A. E., Sapoznik, K. A., Warner, R. L., Gast, T. J. Adaptive optics imaging of the human retina. Progress in Retinal and Eye Research. 68, 1-30 (2019).
- Kim, A. Y., Chu, Z., Shahidzadeh, A., Wang, R. K., Puliafito, C. A., Kashani, A. H. Quantifying Microvascular Density and Morphology in Diabetic Retinopathy Using Spectral-Domain Optical Coherence Tomography Angiography. Investigative Ophthalmology & Visual Science. 57 (9), (2016).
- Koulisis, N., et al. Quantitative microvascular analysis of retinal venous occlusions by spectral domain optical coherence tomography angiography. PLOS ONE. 12 (4), 0176404(2017).
- Kim, A. Y., et al. Quantifying Retinal Microvascular Changes in Uveitis Using Spectral-Domain Optical Coherence Tomography Angiography. American Journal of Ophthalmology. 171, 101-112 (2016).
- Kashani, A. H., et al. Optical coherence tomography angiography: A comprehensive review of current methods and clinical applications. Progress in Retinal and Eye Research. 60, 66-100 (2017).
- Yu, D. Y., et al. Retinal capillary perfusion: Spatial and temporal heterogeneity. Progress in Retinal and Eye Research. 70, 23-54 (2019).
- Tayyari, F., et al. The Relationship between Retinal Vascular Reactivity and Arteriolar Diameter in Response to Metabolic Provocation. Investigative Ophthalmology & Visual Science. 50 (10), 4814(2009).
- Lu, H., Liu, P., Yezhuvath, U., Cheng, Y., Marshall, O., Ge, Y. MRI Mapping of Cerebrovascular Reactivity via Gas Inhalation Challenges. Journal of Visualized Experiments. (94), e52306(2014).
- Reif, R., Qin, J., An, L., Zhi, Z., Dziennis, S., Wang, R. Quantifying Optical Microangiography Images Obtained from a Spectral Domain Optical Coherence Tomography System. International Journal of Biomedical Imaging. 2012, 1-11 (2012).
- Olafsdottir, O. B., Eliasdottir, T. S., Kristjansdottir, J. V., Hardarson, S. H., Stefánsson, E. Retinal Vessel Oxygen Saturation during 100% Oxygen Breathing in Healthy Individuals. PLOS ONE. 10 (6), 0128780(2015).
- Kiss, B., et al. Retinal Blood Flow during Hyperoxia in Humans Revisited: Concerted Results Using Different Measurement Techniques. Microvascular Research. 64 (1), 75-85 (2002).
- Yezhuvath, U. S., Lewis-Amezcua, K., Varghese, R., Xiao, G., Lu, H. On the assessment of cerebrovascular reactivity using hypercapnia BOLD MRI. NMR in biomedicine. 22 (7), 779-786 (2009).
- Hardarson, S. H., et al. Automatic Retinal Oximetry. Investigative Ophthalmology & Visual Science. 47 (11), 5011(2006).
- Sousa, D. C., Leal, I., Moreira, S., Dionísio, P., Abegão Pinto, L., Marques-Neves, C. Hypoxia challenge test and retinal circulation changes - a study using ocular coherence tomography angiography. Acta Ophthalmologica. 96 (3), 315-319 (2018).
- Slessarev, M., Somogyi, R., Preiss, D., Vesely, A., Sasano, H., Fisher, J. A. Efficiency of oxygen administration: Sequential gas delivery versus "flow into a cone" methods. Critical Care Medicine. 34 (3), 829-834 (2006).
- Gilmore, E. D., Hudson, C., Venkataraman, S. T., Preiss, D., Fisher, J. Comparison of Different Hyperoxic Paradigms to Induce Vasoconstriction: Implications for the Investigation of Retinal Vascular Reactivity. Investigative Ophthalmology & Visual Science. 45 (9), 3207(2004).
- Shahidi, A. M., Patel, S. R., Huang, D., Tan, O., Flanagan, J. G., Hudson, C. Assessment of total retinal blood flow using Doppler Fourier Domain Optical Coherence Tomography during systemic hypercapnia and hypocapnia. Physiological Reports. 2 (7), 12046(2014).
- Maleki, N., et al. The Effect of Hypercarbia and Hyperoxia on the Total Blood Flow to the Retina as Assessed by Magnetic Resonance Imaging. Investigative Ophthalmology & Visual Science. 52 (9), 6867(2011).
- Smit, B., Smulders, Y. M., vander Wouden, J. C., Oudemans-van Straaten, H. M., Spoelstra-de Man, A. M. E. Hemodynamic effects of acute hyperoxia: systematic review and meta-analysis. Critical Care. 22 (1), 45(2018).
- Piccolino, F. P., Cagini, C., Fruttini, D., Nicolò, M., Eandi, C. M., Tito, S. Retinal Vascular Reactivity in Central Serous Chorioretinopathy. Investigative Ophthalmology & Visual Science. 59 (11), 4425(2018).
- Sousa, D. C., et al. A Protocol to Evaluate Retinal Vascular Response Using Optical Coherence Tomography Angiography. Frontiers in Neuroscience. 13, 566(2019).
- Robinson, F., Riva, C. E., Grunwald, J. E., Petrig, B. L., Sinclair, S. H. Retinal Blood Flow Autoregulation in Response to on Acute Increase in Blood Pressure. Investigative Ophthalmology & Visual Science. 27 (5), 5(1986).
- Gherghel, D., Hosking, S. L., Cunliffe, I. A. Abnormal Systemic and Ocular Vascular Response to Temperature Provocation in Primary Open-Angle Glaucoma Patients: A Case for Autonomic Failure. Investigative Ophthalmology & Visual Science. 45 (10), 3546(2004).
- You, Q., et al. Reproducibility of vessel density measurement with Optical Coherence Tomography Angiography in eyes with and without retinopathy. Retina. 37 (8), 1475-1482 (2017).
- Lei, J., et al. Repeatability and Reproducibility of Superficial Macular Retinal Vessel Density Measurements Using Optical Coherence Tomography Angiography En Face Images. JAMA Ophthalmology. 135 (10), 1092(2017).
- Czakó, C., et al. Intrasession and Between-Visit Variability of Retinal Vessel Density Values Measured with OCT Angiography in Diabetic Patients. Scientific Reports. 8 (1), 10598(2018).
- Field, A. S., Laurienti, P. J., Yen, Y. F., Burdette, J. H., Moody, D. M. Dietary Caffeine Consumption and Withdrawal: Confounding Variables in Quantitative Cerebral Perfusion Studies. Radiology. 227 (1), 129-135 (2003).
- Baek, S. U., et al. Diurnal change of retinal vessel density and mean ocular perfusion pressure in patients with open-angle glaucoma. PLOS ONE. 14 (4), 0215684(2019).
- Müller, V. C., Storp, J. J., Kerschke, L., Nelis, P., Eter, N., Alnawaiseh, M. Diurnal variations in flow density measured using optical coherence tomography angiography and the impact of heart rate, mean arterial pressure and intraocular pressure on flow density in primary open-angle glaucoma patients. Acta Ophthalmologica. 97 (6), (2019).
- Sarwar, S., et al. Diurnal variation of choriocapillaris vessel flow density in normal subjects measured using optical coherence tomography angiography. International Journal of Retina and Vitreous. 4 (1), 37(2018).
- Liu, P., De Vis, J. B., Lu, H. Cerebrovascular reactivity (CVR) MRI with CO2 challenge: A technical review. NeuroImage. 187, 104-115 (2019).
- Ting, D. S. W., et al. Optical Coherence Tomographic Angiography in Type 2 Diabetes and Diabetic Retinopathy. JAMA Ophthalmology. 135 (4), 306(2017).
- Spaide, R. F., Fujimoto, J. G., Waheed, N. K., Sadda, S. R., Staurenghi, G. Optical coherence tomography angiography. Progress in retinal and eye research. 64, 1-55 (2018).
- An, D., et al. Quantitative comparisons between optical coherence tomography angiography and matched histology in the human eye. Experimental Eye Research. 170, 13-19 (2018).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon