このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
光コヘレンス断層撮影解剖学によるレチナル血管反応性
要約
本稿では、ガス呼吸挑発技術を用いてヒト被験者と共に生体内での筋血管系反応性を測定し、画像を取得しながら血管刺激を行う方法について説明する。
要約
このレチナへの血管供給は、血管収縮および血管拡張を通じて動的に適応し、その代謝要求に対応することが示されている。網膜血管反応性(RVR)と呼ばれるこのプロセスは、神経血管結合によって媒介され、これは糖尿病性網膜症などの網膜血管疾患において非常に早く損なわれる。したがって、血管機能を評価する臨床的に実行可能な方法は、研究および臨床現場の両方に有意な関心を持つ可能性がある。近年、毛細管レベルでの眼血管構造のインビボイメージングは、非侵襲的で最小限のリスクと毛細管レベル分解能を有する無侵襲的リスクおよび色無血管造影法である光学コヘレンス断層造影血管造影(OCTA)のFDA承認により可能になっている。同時に、RVRの生理学的および病理学的変化は、いくつかの研究者によって示されている。この原稿に示されている方法は臨床画像のプロシージャまたは装置への変更のための必要性なしでOCTAを使用してRVRを調査するように設計されている。これは、過カプニックまたは高OXOX性条件への暴露中に、レチナおよびレチナル血管系のリアルタイムイメージングを示す。試験は、被験者の不快感やリスクを最小限に抑えて、30分以内に2人の人員で簡単に行われます。この方法は、他の眼科画像装置に適応可能であり、用途は、混合ガスおよび患者集団の組成に基づいて変化し得る。この方法の強みは、生体内のヒト被験者における毛細血管レベルにおける血管機能の筋機能の調査を可能にすることです。この方法の制限は、主に、OCTAおよびイメージングアーティファクトおよび制限されたダイナミックレンジを含む他のレチン学的イメージング方法のものである。この方法から得られた結果は、10月およびOCTA画像のレティナである。これらの画像は、市販のOCTまたはOCTAデバイスで可能な分析に適しています。しかしながら、一般的な方法は、眼科画像の任意の形態に適合させることができる。
概要
このレチナの代謝需要は、細動脈、毛細血管および小胞1の十分に調節されたシステムによって提供される酸素の適切かつ一定の供給に依存している。いくつかの研究は、より大口径のヒトの眼科の機能は、様々な生理学的22、3、4、53,4,5および薬理学的66、77刺激で生体内で評価することができることを実証した。また、この血管系の異常機能は、網膜血管反応性(RVR)が初期段階でも減衰することが示されている糖尿病網膜網膜症などの網膜網膜症における異常な機能が8、9、9かついずれもガス挑発9とちらつき光実験55、10、1110,11の両方を通して減少することが示されている。喫煙などの血管のレチンタル危険因子も、障害のあるRVR12および腎血流13と相関している。これらの知見は、疾患プロセスの比較的遅れて後期に起こる疾患の臨床症状および疾患の証明された早期臨床マーカーが14を欠いているため重要である。したがって、RVRを評価することは、レチン性疾患を開始または悪化させる可能性のある異常の早期評価に対する血管完全性の有用な尺度を提供することができる。
以前のRVR実験は、通常、レーザ血流計9や眼管カメラなどの装置に依存しており、眼下画像取得用に特殊フィルタ15を搭載していた。しかし、これらの技術は、ガス、微量栄養素および分子交換が起こる場所ではない動脈16および小胞15のような大口径の血管のために最適化されている。より最近の研究では、適応光学画像17を用いて毛細血管のRVRを定量化することができたが、空間分解能が向上したにもかかわらず、これらの画像はフィールドサイズが小さく、臨床使用に対してFDAが承認されていない18。
近年の光学コヘレンス断層撮影血管造影(OCTA)の出現により、ヒト患者および生体内の被験者における毛細血管レベルの変化を評価するFDA承認、非侵襲的、染色レス血管造影法が提供された。OCTAは、糖尿病性網膜症19などの網膜血管疾患における毛細血管灌流の障害を評価するための有効なツールとして臨床現場で広く受け入れられている、網膜静脈閉塞20、血管炎21および他の多くの22。したがって、OCTAは、臨床現場で重要な空間的および時間的異質性23ならびに病理学的変化を有することができる毛細管レベル変化の評価に優れた機会を提供する。3,我々のグループは最近、OCTAが毛細管レベル2のレチナル血管の応答性を、腎血管収縮刺激である216、24、および二酸化炭素である、内毛管レベル2の生理学的変化に定量化できることを実証16,24した。
本稿の目的は、読者がOCTAを用いて小さな細動脈および毛細血管床の陰部血管反応性を評価することを可能にするプロトコルを記述することです。この方法は、磁気共鳴画像法による脳血管反応性の測定について説明したLu et al.25で提示されたものから適応される。本手法は、OCTAイメージング2の間に開発され使用されたが、比較的単純で明白な修正を伴う他の画像診断装置に適用可能である。
プロトコル
この研究は、南カリフォルニア大学機関審査委員会によって承認され、ヘルシンキ宣言の原則に従った.
ガス非再呼吸装置の設定
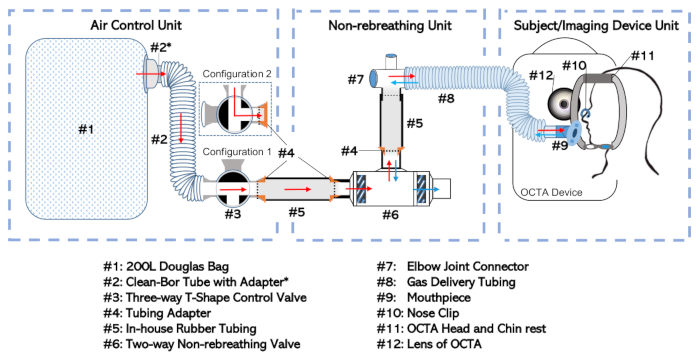
図1:非再呼吸装置の図。完全なセットアップは、その機能とそれらが独立して処理される頻度に応じて3つの別々のユニットに分割されています。これらには、空気制御ユニット、非呼吸ユニット、および対象/画像デバイスユニットは、この図のより大きなバージョンを表示するには、ここをクリックしてください。
-
装置アセンブリ
- ダグラスバッグ(図1、#1)を35mm内径チューブを介して選択方向の入口ポート(#3)に3方向バルブ(#3;#2;材料表を参照)をアダプタ(#2*)で接続します。この組み合わせは、図 1に示すように「エア コントロール ユニット」と呼ばれます。
- 双方向の非再呼吸バルブ(#6)を、非再呼吸バルブの口口口口口口口口の肘関節コネクタ(#7)に接続します。アダプター(#4)を取り付けたゴムチューブ(#5)を使用して接続を形成します。
- 肘関節をガス供給チューブに接続します(#8)。このセットアップは、非再呼吸弁(#6)、社内チューブ(#5)、アダプタ(#4)、肘関節(#7)、ガス送出チューブ(#8)を含む「非再呼吸ユニット」と呼ばれます。
注:被験者の口と二方向の非呼吸弁の横隔膜(#6)の間のデッドスペースの量を最小限に抑える。 - 三方弁(#3)の出口口にあるエアコントロールユニットを、双方向の非再呼吸バルブ(#6)の入口口の非再呼吸ユニットに接続します。先に説明したラバーチューブ(#5)とアダプタ(#4)を使用して、互いに挿入できるようにします。
- 密閉性を確保するために、シールテープでジョイントを包むことによって、すべての緩い接続をシールします。
- 図 1の[対象/イメージング デバイス ユニット]に示すように、開いた端にあるガス送出チューブ(#8)をマウスピース(#9)に接続します。
注:このステップ (1.1.6) は、対象テストの開始準備ができるまで延期できます (ステップ 3.5)。
-
ガスの非再呼吸のための空気制御装置の準備
- 空気制御ユニットを、社内のチューブ(#5)またはアダプタ(#4)から外して分離します(まだ分離されていない場合)。
- ダグラスバッグ(#1)が、図1に示すように、3方向バルブ(#3)を設定して遠位端からバッグの入口ポートに向かって袋を体系的に巻き上げて、任意の空気のダグラスバッグ(#1)を空にするか空にします。
- ダグラスバッグ(#1)に適切なガス混合物を充填します。
- 部屋空気の非再呼吸のみを意図している場合は、3 方向バルブをコンフィギュレーション 2 (図1参照) に設定し、ダグラス バッグ (#1) を満たしません。それ以外の場合は、ステップ 1.2.3 を構成するステップを続行します。
- 三方弁(#3)の出口口にあるエアコントロールユニット(図1)を適切なアダプタとチューブを使用してガスボンベ(所望の空気混合液を含む)に接続します。カフアダプタを使用して、3方向バルブの外径に1/8インチガス充填チューブを取り付けます(#3)。
- 3 方向バルブ アセンブリをコンフィギュレーション 1 に設定し(図 1を参照)、目的のガスが貯蔵用シリンダからダグラス バッグに流れるようにします(#1)。ガスボンベを開きます。
- ダグラスバッグ(#1)が目的の容積(通常は半分充填)に充填されたら、ガスボンベ出口を閉じ、3方向バルブをコンフィギュレーション2に設定し、ダグラスバッグ内のガスを分離します(#1)。ダグラスバッグを充填するために使用されるチューブからエアコントロールユニットを取り外します(#1)。
2. 画像処理のための対象の準備
- 被験者が研究に参加することに同意した後、OCTAイメージング装置の後ろに被験者を座る。被験者にテスト手順を説明する。
- 被験者の病歴を確認して、被験者が研究に参加するリスクを高める既存の病状がないことを確認する。
注:既存の心血管疾患または肺疾患は、被験者が参加から除外される可能性のある危険因子である。被験者は、立ちくらみを感じたり、予期せぬ不快感を感じたりするなど、いつでも手順を停止できることを理解することが不可欠です。 - テストプロトコルに従って評価する目を決定します。1つの目だけを、試験時間を制限し、ガスの不呼吸からの潜在的な不快感を最小限に抑えるために画像化することができる。
- 被検者の瞳孔サイズが約2.5mm以下の場合は、眼拡張を検討する。拡張は必須ではありませんが、良質の画像を取得する可能性を高めます。蒸留するために、0.5%プロパラカイン塩酸塩眼液、1%トロピックアミドオフサルミック溶液、および2.5%フェニレフリン塩酸塩眼球溶液をそれぞれ1滴ずつ植え付ける。完全拡張は10〜15分以内に起こるはずです。
3. ガス挑発実験と画像獲得
- OCTA マシンで患者のプロファイルを作成します。
- 手袋を着用してください。
- セットアップを消毒するためにアルコール綿棒でOCTAの頭と顎の休息を拭き取ります。
- 無菌包装からマウスピース(#9)を解放します。
注:このコンポーネントは、被検者の口の粘液の内層に直接接触するので、マウスピースにできるだけ触れないようにしてください - マウスピース(#9)をガス送出チューブ(#8)に接続します。
- 被験者の指にパルスオキシメーターを置き、酸素飽和度と脈拍の監視を開始します。
注:被験者が望ましい空気混合物を呼吸し始めたら、パルスオキシメータは審査官によって継続的に監視されるべきである。被験者の酸素飽和度が94%を下回った場合、実験は安全上の予防措置として停止し、被験者はベースラインに戻るまで観察すべきである。 - OCTA の設定の高さを調整して、被験者が首を伸ばしたり曲げたりすることなく、あごを簡単にあごの上に置くことができるように (#11) します。
- 患者に向かい合ったマウスピース(#9)で、マウスピース(#9)を通して口付け(#9)を通してガス送出チューブ(#8)をループします。被写体が画像化している眼の側面を機械のopppositeを通してチューブループを持っています。
- マウスピースを患者の口に挿入します。装置に精通するために、再呼吸以外のセットアップを通して呼吸を練習するように被験者を奨励します。被験者がガス交換を容易にするために深呼吸を行うことを確認してください。
- マウスピースを通して呼吸していることを確認するために、被験者に鼻クリップ(#10)を置きます。
- 構成 2 の 3 方向バルブを保持するか、または画像が部屋の空気または特定の混合ガスへの露出のために取得されているかどうかに応じて、構成 1 に変更します。今後の参考のために、ガス吸入の開始時刻に注意してください。
- 画像撮影用に選択された目に従って、被験者にチンレスト(#11)の右または左のセクションにあごを配置してもらいます。
- 額がヘッドレスト(#11)としっかりと接触するまで、彼らは頭を前方に動かしてください。
- テスト プロトコルによって決定された、対象の OCTA スキャンをキャプチャします。本研究では、1分のガス呼吸後に、窩を中心とした3つの3mm x 3mm画像を撮影した。
- 被写体は、彼らの視界の中心にターゲットに固定しながら、前方に、まだ頭を維持しています
- 虹彩ビューで見られるライブ画像では、スキャンを中央に配置します。
- 左右の矢印を使用して、チンレストを押し出してアイリスをフォーカスします。
- 既定で発生する必要があります OCT スキャンで、子葉ディップが中央に配置されていることを確認します。
- 画像を撮る。通常、OCTA マシンではスキャンが数秒続きます。
- スキャン完了後に OCTA イメージを表示し、適切な品質であることを確認します。信号強度は、OCTA メーカーが提供する 10 ポイント スケールで 7 以上である必要があります。
- [保存]を選択するか、目を再スキャンします。
- 必要なスキャンの数が多いように、手順 3.14.1 ~ 3.14.7 を繰り返します。
- 被験者がマシンから後ろに座ることを許可します。この混合ガスで目のスキャンが必要ない場合は、鼻クリップ(#10)とマウスピース(#9)を取り外します。
- 被験者にCO2ガス挑発実験を開始する前に2分の休憩を許可する。
- ステップ1.2で指定した最初の必要な空気混合物 (5% CO 2、21% 酸素および 74% 窒素からなる) でダグラスバッグを充填します。3 方向バルブは、このステップの後にコンフィギュレーション 2 になります。
- 図1に示すように、およびステップ1.1.4で説明したように、空気制御ユニットを非再呼吸ユニットに接続することによって、ガスの非再呼吸装置のセットアップを完了する。すべてのジョイントが密閉テープで気密であることを確認してください。
- ステップ 3.9 から 3.14 を繰り返しますが、ステップ 3.11 で指示された場合は、3 方向バルブをコンフィギュレーション 1 に設定します。
- 被験者にCO2ガス挑発の後に10分の休憩を与え、ベースラインに戻ることを可能にする。
- 被験者が休憩中である間、ステップ1.2に従ってダグラスバッグに2100%O2を充填します。
- ステップ 3.17 ~ 3.18 を繰り返して、100% O2ガスの挑発条件下で実験を実行します。
4. 実験的なクリーンアップ
- 設定の使い捨て要素を破棄します:被写体のマウスピース(#9)と鼻クリップ(#10)。
- アルコール綿棒を使用して頭と顎の休息(#11)をきれいにします。対象椅子、OCTAテーブル、OCTAハンドルを消毒用ワイプで拭き取り、誤った唾液を取り除きます。
- 3方向バルブ(#3)で、設定をベースコンポーネント(エアコントロールユニットと非再呼吸ユニット)に取り外します。
- 被写体から吐き出された空気は空気制御ユニットの要素に届かないように、ステップ1.2.2に従ってダグラスバッグを空にし、将来の検索のために場所に置きます。必要に応じて、クリーニングボルチューブ(#2)をアダプタ(#2*)と3方向バルブ(#3)で取り外し、より簡単に保管できるようにします。これで、エアコントロールユニットのクリーンアップが完了します。
- 肘関節からガスを取り外して、非呼吸ユニットからガス送出チューブ(#8)を取り除きます(#7)。社内ゴムチューブ(#5)とチューブアダプタ(#4)を双方向の非再呼吸バルブ(#6)から取り外します。次に、シールテープを取り外し、それらを引き離すことによって部品を取り外すことによって、肘の関節(#7)から同じことを行います。
注:二方向非再呼吸弁のより広範な洗浄は、追加のケアのために内部ダイヤフラムを除去するためにそれを分解することによって容易にすることができる。 -
再利用可能なコンポーネントのクリーンアップ用に消毒浴場を用意する
- ガス送出チューブ(#8)を適切に希釈し、よく混合した洗剤消毒剤で水没するのに十分な大きさの容器を充填します。この場合、水で洗剤を1:6425の比率に希釈します。
- ガス送出チューブ(#8)、双方向の非呼吸弁(#6)、肘関節(#7)、社内ゴムチューブ(#5)、チューブアダプター(#4)を、少なくとも10分間、準備された消毒槽に浸します。
- お風呂が終わった後、すべての部分を取り除き、水で十分に洗い流します。
- 清潔なカウンタートップにペーパータオルの上に置き、空気乾燥させます。
- 空気乾燥が完了したら、ペーパータオルを処分し、すべての部品を保管のために離します。
5. OCTAデータのエクスポートと分析
-
OCTA データエクスポート
- OCTA コンピュータに選択したリムーバブル メディア デバイスを挿入して、OCTA データをエクスポートします。対象の件名とスキャンを検索します。
- [エクスポート]を選択して、対象となるデータの件名を .bmp 形式で含む zip フォルダをリムーバブル メディア デバイスに作成します。
-
OCTA データ分析
- 追加の画像解析と処理を実行する能力を持つ実験室のコンピュータ上のOCTAデータを整理します。
- カスタム スクリプトを使用して、グローバルなしきい値技術でノイズを抑制し、追加の機能抽出を実行します。OCTA イメージをビナライズしてスケルトン化します。
- 後処理された画像上で、容器のスケルトン密度(VSD)19,26、OCTAの二項化された骨格化された画像に対して次の式で計算された画像内の容器の全線形長の無次元の尺度を計算します。19,26
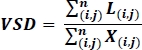
ここで、iとjは、ピクセル座標(i,j),L(i,j)Li,jは非相関を表す白色のピクセルを指し、X(i,j)はi,j全てのピクセルを指し、nはピクセル配列の次元を指し、n x nピクセル19,26,26と仮定することができる。 Xこの式の分母は、スケルトン化された画像から書き込まれたものとして計算されるピクセルの総数を表しますが、画像全体の物理的領域を表すものと考えることができます。
結果
この実験からの出力は、パルスオキシメータから取られた手動測定値、ガス暴露またはOCTAスキャンのために記録されたタイミングと生のOCTA画像データで構成されています。OCTA 画像は、OCT B スキャンと、各 B スキャンに関連付けられた非相関信号で構成されます。データパラメータは、デバイスの仕様によって与えられます。中心波長1040~1060nmのスイープソースレーザープラットフォームOCTA...
ディスカッション
前述の方法論は、OCTA撮像装置に変更を加えず、被検者に対する不快感やリスクを最小限に抑え、特定の時点で被検者のRVRを制御された環境で測定することを可能にするガス呼吸挑発実験の完全なプロトコルである。この設定は研究者のニーズに合わせて簡単に変更を可能にする方法で説明されています。それは別の医院の部屋に合うために追加の管を収容することができ、そのような社内の...
開示事項
カール・ツァイス・メディテックは、この記事のトピックに関連するAHKに助成金、設備、財政支援を提供しています。
謝辞
この研究は、NIH K08EY027006、R01EY030564、UH3NS100614、カール・ツァイス・メディテック社(ダブリン、CA)からの研究助成金、失明防止のための研究からの無制限部門資金(ニューヨーク、ニューヨーク)によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 5% CO2 gas [5% CO2, 21% O2, 74% N2] (Compressed) | Institution Dependent (Praxair) | ||
| Bacdown Disinfectant Detergent | Decon Labs | 8001 | https://deconlabs.com/products/disinfectant-bdd/ |
| Clean-Bor Tubes (35 mm Inner Diameter) | Vacumed | 1011-108 | http://www.vacumed.com/zcom/product/Product.do?compid=27&skuid=1197 |
| Cuff adapter for Douglas bag filling | Vacumed | 22254 | http://www.vacumed.com/zcom/product/Product.do?compid=27&prodid=343 |
| Douglas bag (200 L capacity) | Harvard Apparatus | 500942 | https://www.harvardapparatus.com/douglas-bag.html |
| Elbow Joint (Inner Diameter 19 mm/Outer Diameter 22 mm), Modified in House | |||
| Fingertip Pulse Oximeter (Pro-Series) | CMS | CMS 500DL | https://www.walmart.com/ip/Pro-Series-CMS-500DL-Fingertip-Pulse-Oximeter-Blood-Oxygen-Saturation-Monitor-with-silicon-cover-batteries-and-lanyard/479049154 |
| Gas Delivery Tube (22 mm Inner Diameter) Modified in House | |||
| Gas filling tube (1/8" for compressed gas) | |||
| Hydrogen Peroxide Cleaner Disinfectant Wipes | Clorox Healthcare | 30824 | https://www.cloroxpro.com/products/clorox-healthcare/hydrogen-peroxide-cleaner-disinfectants/?gclid=EAIaIQobChMIk-KG4vi15QIVcRh9Ch0NNwLPEAAYASAAEgJIa_D_BwE&gclsrc=aw.ds |
| Lubricant Eye Drops | Refresh | Refresh Plus | https://www.refreshbrand.com/Products/refresh-plus |
| Manual Directional Control Valves: Three-Way T-Shape Stopcock Type (Inner Diameter 28.6 mm, Outer Diameter 35 mm) | Hans Rudolph | 2100C Series | www.rudolphkc.com |
| Medical O2 (Compressed) | Institution Dependent | ||
| Mouth piece (Silicone, Model #9061) | Hans Rudolph | 602076 | www.rudolphkc.com |
| OCTA Imaging Device (PLEX Elite 9000) | Carl Zeiss Meditec, Dublin, CA, USA | https://www.zeiss.com/meditec/int/product-portfolio/optical-coherence-tomography-devices/plex-elite-9000-swept-source-oct.html | |
| Phenylephrine Hydrochloride Ophthalmic Solution, USP 2.5% | Paragon Bioteck, Inc | NDC 42702-102-15 | https://paragonbioteck.com/products/diagnostics/phenylephrine-hydrochloride-ophthalmic-solution-usp-2-5/ |
| Plastic Nose Clip Sterile Foam CS100 | Sklar Sterile | 96-2951 | https://www.sklarcorp.com/disposables/plastic/plastic-nose-clip-sterile-foam-box-of-100.html |
| Proparacaine Hydrochloride Ophthalmic Solution, USP .5% | Bausch + Lomb | NDC 24208-730-06 | https://www.bausch.com/ecp/our-products/rx-pharmaceuticals/generics |
| Regulator (tank dependent- 5% CO2: Fisherbrand Mulitstage Gas Cylinder Regulators) | Genstar Technologies Company | 10575150 | https://www.fishersci.com/shop/products/fisherbrand-multistage-cylinder-regulators-22/10575150?keyword=true |
| Regulator (tank dependent- Oxygen: Fisherbrand Multistage Gas Cylinder Regulators) | Genstar Technologies Company | 10575145 | https://www.fishersci.com/shop/products/fisherbrand-multistage-cylinder-regulators-22/10575145?keyword=true |
| Rubber Tubing (Inner diameter 19 mm, Outer diameter 27 mm), Made in House | |||
| Sealing tape- Parafilm Wrap (2" Wide) | Cole Parmer | PM992 | https://www.coleparmer.com/i/parafilm-pm992-wrap-2-wide-250-ft-roll/0672050?PubID=VV&persist=True&ip=no&gclid=EAIaIQobChMInY3vqomz5QIVfyCtBh1VSg64EAAYASAAEgJ9n_D_BwE |
| Sterile Alcohol Prep Pads | Medline | MDS090670 | https://www.medline.com/product/Sterile-Alcohol-Prep-Pads/Swab-Pads/Z05-PF03816 |
| Tropicamide Ophthalmic Solution, USP 1% | Akorn | NDC 17478-102-12 | http://www.akorn.com/prod_detail.php?ndc=17478-102-12 |
| Tubing Adapter, Made in House | |||
| Two-way non-rebreathing valve (2600 Series- Inner Diameter 28.6 mm, Outer Diameter 35 mm) | Hans Rudolph | 2600 Series, UM-112078 | www.rudolphkc.com |
参考文献
- Country, M. W. Retinal metabolism: A comparative look at energetics in the retina. Brain Research. 1672, 50-57 (2017).
- Ashimatey, B. S., Green, K. M., Chu, Z., Wang, R. K., Kashani, A. H. Impaired Retinal Vascular Reactivity in Diabetic Retinopathy as Assessed by Optical Coherence Tomography Angiography. Investigative Ophthalmology & Visual Science. 60 (7), 2468 (2019).
- Hickam, J. B. M. D., Frayser, R. P. D. Studies of the Retinal Circulation in Man: Observations on Vessel Diameter, Arteriovenous Oxygen Difference, and Mean Circulation Time. Circulation. 33 (2), 302-316 (1966).
- Dorner, G. T., Garhoefer, G., Zawinka, C., Kiss, B., Schmetterer, L. Response of Retinal Blood Flow to CO2 -Breathing in Humans. European Journal of Ophthalmology. 12 (6), 459-466 (2002).
- Linsenmeier, R. A., Zhang, H. F. Retinal oxygen: from animals to humans. Progress in Retinal and Eye Research. 58, 115-151 (2017).
- Eliakim, M., Mor, I., Michaelson, I. C. Assessment of pharmacologic effects on the retinal circulation of hypertensive subjects by a quantitative method. Microvascular Research. 4 (4), 374-383 (1972).
- Gilmore, E. D., et al. Retinal arteriolar hemodynamic response to an acute hyperglycemic provocation in early and sight-threatening diabetic retinopathy. Microvascular Research. 73 (3), 191-197 (2007).
- Hickam, J. B., Sieker, H. O. Retinal Vascular Reactivity in Patients with Diabetes Mellitus and with Atherosclerosis. Circulation. 22 (2), 243-246 (1960).
- Gilmore, E. D., et al. Retinal Arteriolar Diameter, Blood Velocity, and Blood Flow Response to an Isocapnic Hyperoxic Provocation in Early Sight-Threatening Diabetic Retinopathy. Investigative Ophthalmology & Visual Science. 48 (4), 1744 (2007).
- Garhofer, G. Reduced response of retinal vessel diameters to flicker stimulation in patients with diabetes. British Journal of Ophthalmology. 88 (7), 887-891 (2004).
- Felder, A. E., Wanek, J., Blair, N. P., Shahidi, M. Inner Retinal Oxygen Extraction Fraction in Response to Light Flicker Stimulation in Humans. Investigative Ophthalmology & Visual Science. 56 (11), 6633-6637 (2015).
- Rose, K., Flanagan, J. G., Patel, S. R., Cheng, R., Hudson, C. Retinal Blood Flow and Vascular Reactivity in Chronic Smokers. Investigative Ophthalmology & Visual Science. 55 (7), 4266 (2014).
- Omae, T., Nagaoka, T., Yoshida, A. Effects of Habitual Cigarette Smoking on Retinal Circulation in Patients With Type 2 Diabetes. Investigative Ophthalmology & Visual Science. 57 (3), 1345 (2016).
- Pusparajah, P., Lee, L. H., Abdul Kadir, K. Molecular Markers of Diabetic Retinopathy: Potential Screening Tool of the Future. Frontiers in Physiology. 7, (2016).
- Hammer, M., Vilser, W., Riemer, T., Schweitzer, D. Retinal vessel oximetry-calibration, compensation for vessel diameter and fundus pigmentation, and reproducibility. Journal of Biomedical Optics. 13 (5), 054015 (2008).
- Gilmore, E. D., Hudson, C., Preiss, D., Fisher, J. Retinal arteriolar diameter, blood velocity, and blood flow response to an isocapnic hyperoxic provocation. American Journal of Physiology-Heart and Circulatory Physiology. 288 (6), 2912-2917 (2005).
- Duan, A., Bedggood, P. A., Metha, A. B., Bui, B. V. Reactivity in the human retinal microvasculature measured during acute gas breathing provocations. Scientific Reports. 7 (1), 2113 (2017).
- Burns, S. A., Elsner, A. E., Sapoznik, K. A., Warner, R. L., Gast, T. J. Adaptive optics imaging of the human retina. Progress in Retinal and Eye Research. 68, 1-30 (2019).
- Kim, A. Y., Chu, Z., Shahidzadeh, A., Wang, R. K., Puliafito, C. A., Kashani, A. H. Quantifying Microvascular Density and Morphology in Diabetic Retinopathy Using Spectral-Domain Optical Coherence Tomography Angiography. Investigative Ophthalmology & Visual Science. 57 (9), (2016).
- Koulisis, N., et al. Quantitative microvascular analysis of retinal venous occlusions by spectral domain optical coherence tomography angiography. PLOS ONE. 12 (4), 0176404 (2017).
- Kim, A. Y., et al. Quantifying Retinal Microvascular Changes in Uveitis Using Spectral-Domain Optical Coherence Tomography Angiography. American Journal of Ophthalmology. 171, 101-112 (2016).
- Kashani, A. H., et al. Optical coherence tomography angiography: A comprehensive review of current methods and clinical applications. Progress in Retinal and Eye Research. 60, 66-100 (2017).
- Yu, D. Y., et al. Retinal capillary perfusion: Spatial and temporal heterogeneity. Progress in Retinal and Eye Research. 70, 23-54 (2019).
- Tayyari, F., et al. The Relationship between Retinal Vascular Reactivity and Arteriolar Diameter in Response to Metabolic Provocation. Investigative Ophthalmology & Visual Science. 50 (10), 4814 (2009).
- Lu, H., Liu, P., Yezhuvath, U., Cheng, Y., Marshall, O., Ge, Y. MRI Mapping of Cerebrovascular Reactivity via Gas Inhalation Challenges. Journal of Visualized Experiments. (94), e52306 (2014).
- Reif, R., Qin, J., An, L., Zhi, Z., Dziennis, S., Wang, R. Quantifying Optical Microangiography Images Obtained from a Spectral Domain Optical Coherence Tomography System. International Journal of Biomedical Imaging. 2012, 1-11 (2012).
- Olafsdottir, O. B., Eliasdottir, T. S., Kristjansdottir, J. V., Hardarson, S. H., Stefánsson, E. Retinal Vessel Oxygen Saturation during 100% Oxygen Breathing in Healthy Individuals. PLOS ONE. 10 (6), 0128780 (2015).
- Kiss, B., et al. Retinal Blood Flow during Hyperoxia in Humans Revisited: Concerted Results Using Different Measurement Techniques. Microvascular Research. 64 (1), 75-85 (2002).
- Yezhuvath, U. S., Lewis-Amezcua, K., Varghese, R., Xiao, G., Lu, H. On the assessment of cerebrovascular reactivity using hypercapnia BOLD MRI. NMR in biomedicine. 22 (7), 779-786 (2009).
- Hardarson, S. H., et al. Automatic Retinal Oximetry. Investigative Ophthalmology & Visual Science. 47 (11), 5011 (2006).
- Sousa, D. C., Leal, I., Moreira, S., Dionísio, P., Abegão Pinto, L., Marques-Neves, C. Hypoxia challenge test and retinal circulation changes - a study using ocular coherence tomography angiography. Acta Ophthalmologica. 96 (3), 315-319 (2018).
- Slessarev, M., Somogyi, R., Preiss, D., Vesely, A., Sasano, H., Fisher, J. A. Efficiency of oxygen administration: Sequential gas delivery versus "flow into a cone" methods. Critical Care Medicine. 34 (3), 829-834 (2006).
- Gilmore, E. D., Hudson, C., Venkataraman, S. T., Preiss, D., Fisher, J. Comparison of Different Hyperoxic Paradigms to Induce Vasoconstriction: Implications for the Investigation of Retinal Vascular Reactivity. Investigative Ophthalmology & Visual Science. 45 (9), 3207 (2004).
- Shahidi, A. M., Patel, S. R., Huang, D., Tan, O., Flanagan, J. G., Hudson, C. Assessment of total retinal blood flow using Doppler Fourier Domain Optical Coherence Tomography during systemic hypercapnia and hypocapnia. Physiological Reports. 2 (7), 12046 (2014).
- Maleki, N., et al. The Effect of Hypercarbia and Hyperoxia on the Total Blood Flow to the Retina as Assessed by Magnetic Resonance Imaging. Investigative Ophthalmology & Visual Science. 52 (9), 6867 (2011).
- Smit, B., Smulders, Y. M., vander Wouden, J. C., Oudemans-van Straaten, H. M., Spoelstra-de Man, A. M. E. Hemodynamic effects of acute hyperoxia: systematic review and meta-analysis. Critical Care. 22 (1), 45 (2018).
- Piccolino, F. P., Cagini, C., Fruttini, D., Nicolò, M., Eandi, C. M., Tito, S. Retinal Vascular Reactivity in Central Serous Chorioretinopathy. Investigative Ophthalmology & Visual Science. 59 (11), 4425 (2018).
- Sousa, D. C., et al. A Protocol to Evaluate Retinal Vascular Response Using Optical Coherence Tomography Angiography. Frontiers in Neuroscience. 13, 566 (2019).
- Robinson, F., Riva, C. E., Grunwald, J. E., Petrig, B. L., Sinclair, S. H. Retinal Blood Flow Autoregulation in Response to on Acute Increase in Blood Pressure. Investigative Ophthalmology & Visual Science. 27 (5), 5 (1986).
- Gherghel, D., Hosking, S. L., Cunliffe, I. A. Abnormal Systemic and Ocular Vascular Response to Temperature Provocation in Primary Open-Angle Glaucoma Patients: A Case for Autonomic Failure. Investigative Ophthalmology & Visual Science. 45 (10), 3546 (2004).
- You, Q., et al. Reproducibility of vessel density measurement with Optical Coherence Tomography Angiography in eyes with and without retinopathy. Retina. 37 (8), 1475-1482 (2017).
- Lei, J., et al. Repeatability and Reproducibility of Superficial Macular Retinal Vessel Density Measurements Using Optical Coherence Tomography Angiography En Face Images. JAMA Ophthalmology. 135 (10), 1092 (2017).
- Czakó, C., et al. Intrasession and Between-Visit Variability of Retinal Vessel Density Values Measured with OCT Angiography in Diabetic Patients. Scientific Reports. 8 (1), 10598 (2018).
- Field, A. S., Laurienti, P. J., Yen, Y. F., Burdette, J. H., Moody, D. M. Dietary Caffeine Consumption and Withdrawal: Confounding Variables in Quantitative Cerebral Perfusion Studies. Radiology. 227 (1), 129-135 (2003).
- Baek, S. U., et al. Diurnal change of retinal vessel density and mean ocular perfusion pressure in patients with open-angle glaucoma. PLOS ONE. 14 (4), 0215684 (2019).
- Müller, V. C., Storp, J. J., Kerschke, L., Nelis, P., Eter, N., Alnawaiseh, M. Diurnal variations in flow density measured using optical coherence tomography angiography and the impact of heart rate, mean arterial pressure and intraocular pressure on flow density in primary open-angle glaucoma patients. Acta Ophthalmologica. 97 (6), (2019).
- Sarwar, S., et al. Diurnal variation of choriocapillaris vessel flow density in normal subjects measured using optical coherence tomography angiography. International Journal of Retina and Vitreous. 4 (1), 37 (2018).
- Liu, P., De Vis, J. B., Lu, H. Cerebrovascular reactivity (CVR) MRI with CO2 challenge: A technical review. NeuroImage. 187, 104-115 (2019).
- Ting, D. S. W., et al. Optical Coherence Tomographic Angiography in Type 2 Diabetes and Diabetic Retinopathy. JAMA Ophthalmology. 135 (4), 306 (2017).
- Spaide, R. F., Fujimoto, J. G., Waheed, N. K., Sadda, S. R., Staurenghi, G. Optical coherence tomography angiography. Progress in retinal and eye research. 64, 1-55 (2018).
- An, D., et al. Quantitative comparisons between optical coherence tomography angiography and matched histology in the human eye. Experimental Eye Research. 170, 13-19 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved