Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Retinale Vaskuläre Reaktivität nach der optischen Kohärenztomographie Angiographie
In diesem Artikel
Zusammenfassung
Dieser Artikel beschreibt eine Methode zur Messung der retinalen Vaskulaturreaktivität in vivo mit menschlichen Probanden, die eine Gasatmungsprovokationstechnik verwenden, um vasoaktive Reize zu liefern und dabei Netzhautbilder zu erfassen.
Zusammenfassung
Es hat sich gezeigt, dass sich die vaskuläre Versorgung der Netzhaut dynamisch durch Vasokonstriktion und Vasodilatation an die metabolischen Anforderungen der Netzhaut anpasst. Dieser Prozess, der als retinale vaskuläre Reaktivität (RVR) bezeichnet wird, wird durch neurovaskuläre Kopplung vermittelt, die sehr früh bei netzretinalen Gefäßerkrankungen wie diabetischer Retinopathie beeinträchtigt wird. Daher kann eine klinisch durchführbare Methode zur Beurteilung der Gefäßfunktion sowohl in der Forschung als auch in der klinischen Umgebung von erheblichem Interesse sein. Kürzlich wurde die In-vivo-Bildgebung der Netzhautvaskulatur auf Kapillarebene durch die FDA-Zulassung der optischen Kohärenztomographie (OCTA), einer nichtinvasiven, minimalen Risiko- und Farbstoff-Angiographie-Methode mit Kapillar-Auflösung, ermöglicht. Gleichzeitig haben mehrere Forscher physiologische und pathologische Veränderungen im RVR gezeigt. Die in diesem Manuskript gezeigte Methode wurde entwickelt, um RVR mit OCTA zu untersuchen, ohne dass Änderungen an den klinischen bildgebenden Verfahren oder Geräten erforderlich sind. Es zeigt Echtzeit-Bildgebung der Netzhaut und Netzhaut vaskulatur während der Exposition gegenüber hyperkapnischen oder hyperoxischen Bedingungen. Die Prüfung wird leicht mit zwei Mitarbeitern in weniger als 30 min mit minimalem Fachbeschwerden oder Risiko durchgeführt. Diese Methode ist an andere ophthalmologische Bildgebungsgeräte anpassbar und die Anwendungen können je nach Zusammensetzung des Gasgemisches und patientenbezogener Patienten variieren. Eine Stärke dieser Methode ist, dass es eine Untersuchung der retinalen Vaskulärfunktion auf Kapillarebene bei menschlichen Probanden in vivo ermöglicht. Einschränkungen dieser Methode sind weitgehend die von OCTA und anderen retinalen Bildgebungsmethoden einschließlich bildgebender Artefakte und einem eingeschränkten Dynamikbereich. Die Ergebnisse der Methode sind OCT- und OCTA-Bilder der Netzhaut. Diese Bilder sind für jede Analyse zugänglich, die auf handelsüblichen OCT- oder OCTA-Geräten möglich ist. Die allgemeine Methode kann jedoch an jede Form der ophthalmologischen Bildgebung angepasst werden.
Einleitung
Der metabolische Bedarf der Netzhaut ist abhängig von einer ausreichenden und konstanten Sauerstoffversorgung durch ein gut reguliertes System von Arteriolen, Kapillaren und Venulen1. Mehrere Studien haben gezeigt, dass die Funktion von großkalibrigen menschlichen Netzhautgefäßen in vivo mit verschiedenen physiologischen2,3,4,5 und pharmakologischen6,,7 Reizen beurteilt werden kann. Darüber hinaus ist die abnormale Funktion dieses Gefäßsystems bei retinalen Gefäßerkrankungen wie der diabetischen Retinopathie weit verbreitet, bei der sich gezeigt hat, dass die retinale vaskuläre Reaktivität (RVR) bereits in den frühesten Stadien8,9 durch Gasprovokation9 und flackernde Lichtexperimente5,10,11abgeschwächt wurde. Retinale vaskuläre Risikofaktoren wie Rauchen wurden auch mit eingeschränktem RVR12 und retinalen Blutfluss13korreliert. Diese Ergebnisse sind wichtig, da die klinischen Symptome der retinalen Gefäßerkrankung relativ spät im Krankheitsprozess auftreten und nachgewiesene frühe klinische Marker der Krankheit fehlen14. So kann die Beurteilung von RVR nützliche Messgrößen für die Gefäßintegrität für die frühzeitige Beurteilung von Anomalien liefern, die netzhautdegenerative Erkrankungen initiieren oder verschlimmern können.
Frühere RVR-Experimente stützten sich in der Regel auf Geräte wie ein Laser-Blutdurchflussmessgerät9 oder Funduskameras, die mit speziellen Filtern15 für die Netzhautbildaufnahme ausgestattet waren. Diese Technologien sind jedoch für Gefäße mit größerem Durchmesser wie Arteriole16 und Venules15optimiert, bei denen gas-, mikronährstoffs und molekularer Austausch nicht stattfindet. Eine neuere Studie war in der Lage, den RVR von Kapillaren mit adaptiver Optik Bildgebung17zu quantifizieren, aber trotz der verbesserten räumlichen Auflösung, diese Bilder haben eine kleinere Feldgröße und sind nicht FDA für den klinischen Einsatz zugelassen18.
Das jüngste Aufkommen der optischen Kohärenztomographie (OCTA) hat eine FDA-zugelassene, nichtinvasive und farbstofflose angiographische Methode zur Beurteilung von Kapillarniveauveränderungen bei menschlichen Patienten und Probanden in vivogeliefert. OCTA ist in der klinischen Praxis weithin als wirksames Werkzeug zur Beurteilung von Beeinträchtigungen bei Kapillarperfusion bei retinalen Gefäßerkrankungen wie diabetischer Retinopathie19, retinalen venösen Okklusionen20, Vaskulitis21 und vielen anderen22. OCTA bietet daher eine ausgezeichnete Gelegenheit zur Bewertung von Kapillarniveauveränderungen, die signifikante räumliche und zeitliche Heterogenität23 sowie pathologische Veränderungen in einem klinischen Umfeld aufweisen können. Unsere Gruppe hat vor kurzem gezeigt, dass OCTA verwendet werden kann, um die Reaktionsfähigkeit von Netzhautgefäßen auf der Kapillarebene2 auf physiologische Veränderungen des inspirierten Sauerstoffs zu quantifizieren, der ein retinaler vasokonstriktiver Stimulus16,24und Kohlendioxid ist, das ein retinaler vasodilatorischen Stimulusist 3,5.
Das Ziel dieses Artikels ist es, ein Protokoll zu beschreiben, das es dem Leser ermöglicht, die retinale vaskuläre Reaktivität der kleineren Arteriolen und Kapillarbetten mit OCTA zu beurteilen. Die Methoden sind an die in Lu et al.25 vorgestellten angepasst, die die Messung der zerebrovaskulären Reaktivität mit Magnetresonanztomographie beschrieben. Obwohl die vorliegenden Methoden während der OCTA-Bildgebung2entwickelt und verwendet wurden, sind sie auf andere retinale Bildgebungsgeräte mit relativ einfachen und offensichtlichen Modifikationen anwendbar.
Protokoll
Diese Studie wurde vom Institutional Review Board der University of Southern California genehmigt und hielt sich an die Grundsätze der Erklärung von Helsinki.
1. Einrichtung von Gas-Nicht-Rebreathing-Geräten
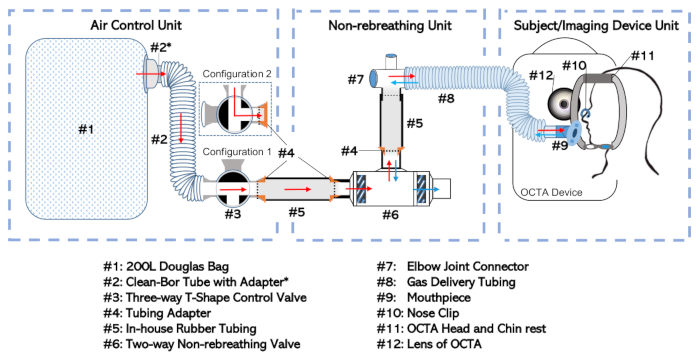
Abbildung 1: Diagramm des Nicht-Rebreathing-Geräts. Die vollständige Einrichtung wurde je nach Funktion und Häufigkeit, mit der sie unabhängig behandelt werden, in drei separate Einheiten aufgeteilt. Dazu gehören: die Luftkontrolleinheit, die Nicht-Rebreathing-Einheit und die Betreff-/Imaging-Geräteeinheit Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
-
Apparatemontage
- Schließen Sie den Douglas-Beutel(Abbildung 1, #1) an einem selektiven Einlassanschluss über das 35 mm Innendurchmesserrohr (#2; siehe Materialtabelle) mit Adapter (#2*) an das Dreiwegeventil (#3) an. Diese Kombination wird als "Luftkontrolleinheit" bezeichnet, wie in Abbildung 1dargestellt.
- Schließen Sie das Zweiweg-Nicht-Rebreathing-Ventil (#6) an den Ellenbogengelenkstecker (#7) am Mundanschluss des Nicht-Rebreathing-Ventils an. Bilden Sie die Verbindung mit einem Gummirohr (#5), das mit einem Adapter (#4) ausgestattet ist.
- Verbinden Sie das Ellenbogengelenk mit dem Gasförderschlauch (#8). Dieses Setup, einschließlich der Nicht-Rebreathing-Ventil (#6), in-house-Schläuche (#5), Adapter (#4), Ellenbogengelenk (#7), und Gas-Lieferschläuche (#8) wird die "Nicht-Rebreathing-Einheit" genannt werden.
HINWEIS: Minimieren Sie die Menge des Totraums zwischen dem Mund des Subjekts und dem Zwerchfell des Zwei-Wege-Nicht-Rebreathing-Ventils (#6). - Schließen Sie die Luftleiteinheit am Auslassanschluss des Dreiwegeventils (#3) an die Nicht-Rebreathing-Einheit am Einlassanschluss des Zweiweg-Nicht-Rebreathing-Ventils (#6) an. Stellen Sie die Verbindung mit zusätzlichen Gummischläuchen (#5) und Adaptern (#4) her, wie sie zuvor beschrieben wurden und die das Einsetzen der Teile ineinander ermöglichen.
- Versiegeln Sie alle losen Verbindungen, indem Sie die Gelenke mit Dichtband umwickeln, um eine hermetische Passform zu gewährleisten.
- Schließen Sie den Gasförderschlauch (#8) an seinem offenen Ende an ein Mundstück (#9) an, wie in der Referats-/Imaging-Geräteeinheit in Abbildung 1dargestellt.
HINWEIS: Dieser Schritt (1.1.6) kann verschoben werden, bis die Testphase des Antragstellers beginnen kann (Schritt 3.5).
-
Vorbereitung der Luftkontrolleinheit für gasfreie Atmung
- Isolieren Sie die Luftkontrolleinheit, indem Sie sie von internen Schläuchen (#5) oder Adaptern (#4) trennen, wenn sie nicht bereits getrennt ist.
- Stellen Sie sicher, dass der Douglas-Beutel (#1) leer ist oder den Douglas-Beutel (#1) von luftiger Luft leer ist, indem Sie den Beutel systematisch vom distalen Ende in Richtung des Einlassanschlusses des Beutels aufrollen, wobei das Dreiwegeventil (#3) auf Konfiguration 1 eingestellt ist, wie in Abbildung 1dargestellt.
- Füllen Sie den Douglas-Beutel (#1) mit dem entsprechenden Gasgemisch.
- Wenn nur Raumluft-Nicht-Rebreathing vorgesehen ist, stellen Sie das Drei-Wege-Ventil auf Konfiguration 2 (siehe Abbildung 1) und füllen Sie den Douglas-Beutel (#1 nicht. Fahren Sie andernfalls mit den Schritten fort, die Schritt 1.2.3 umfassen.
- Schließen Sie die Luftleiteinheit (siehe Abbildung 1) am Auslassanschluss des Dreiwegeventils (#3) mit den entsprechenden Adaptern und Schläuchen an eine Gasflasche (mit dem gewünschten Luftgemisch) an. Verwenden Sie einen Manschettenadapter, um ein 1/8" Gasfüllrohr am Außendurchmesser des Dreiwegeventils (#3) zu montieren.
- Stellen Sie die Drei-Wege-Ventilbaugruppe auf Konfiguration 1 (siehe Abbildung 1) ein, damit das vorgesehene Gas aus dem Speicherzylinder in den Douglas-Beutel (#1) fließen kann. Öffnen Sie die Gasflasche.
- Sobald der Douglas-Beutel (#1) auf das vorgesehene Volumen (in der Regel halb gefüllt) gefüllt ist, schließen Sie den Gasflaschenauslass und stellen Sie das Dreiwegeventil auf Konfiguration 2, das das Gas im Douglas-Beutel (#1) isoliert. Trennen Sie die Luftkontrolleinheit von allen Schläuchen, die zum Befüllen des Douglas-Beutels (#1) verwendet werden.
2. Vorbereitung des Themas für die Bildgebung
- Nachdem der Antragsteller der Teilnahme an der Studie zugestimmt hat, setzen Sie sich hinter das OCTA-Bildgebungsgerät. Erläutern Sie dem Thema die Testverfahren.
- Bestätigen Sie die Krankengeschichte des Fachs, um sicherzustellen, dass das Thema keine bestehenden Erkrankungen hat, die das Risiko der Teilnahme an der Studie erhöhen.
HINWEIS: Bereits bestehende Herz-Kreislauf- oder Lungenerkrankungen sind Risikofaktoren, für die Probanden von der Teilnahme ausgeschlossen werden können. Es ist wichtig, dass das Subjekt versteht, dass sie das Verfahren jederzeit aus irgendeinem Grund wie gefühlsbehellt oder einige zusätzliche unerwartete Beschwerden stoppen können. - Bestimmen Sie das zu bewertende Auge gemäß dem Testprotokoll. Ein Auge kann nur abgebildet werden, um die Testzeit zu begrenzen und die potenziellen Beschwerden durch das Nicht-Rebreathing des Gases zu minimieren.
- Betrachten Sie die Augendilatation, wenn das Subjekt eine Pupillengröße von etwa 2,5 mm oder weniger hat. Obwohl die Dilatation nicht obligatorisch ist, erhöht sie die Chancen, qualitativ hochwertige Bilder zu erwerben. Zur Deperatierung, instillieren Sie jeweils einen Tropfen von 0,5% proparacaine hydrochlorid-ophthalmologische Lösung, 1% Tropicamid-Ophthalmische Lösung und 2,5% Phenylephrinhydrochlorid-Ophthalmologische Lösung. Die vollständige Dilatation sollte innerhalb von 10–15 min erfolgen.
3. Gasprovokationsexperiment und Bildaufnahme
- Erstellen Sie ein Profil für den Patienten in der OCTA-Maschine.
- Tragen Sie Handschuhe.
- Wischen Sie den OCTA Kopf und Kinnrest mit einem Alkoholtupfer ab, um das Setup zu desinfizieren.
- Befreien Sie das Mundstück (#9) von seiner sterilen Verpackung.
HINWEIS: Verzichten Sie darauf, das Mundstück so weit wie möglich zu berühren, da diese Komponente direkten Kontakt mit der Schleimschleimhaut des Mundes des Subjekts herstellt. - Verbinden Sie das Mundstück (#9) mit Gasförderschläuchen (#8)
- Legen Sie ein Pulsoximeter auf den Finger der Probanden und beginnen Sie mit der Überwachung der Sauerstoffsättigung und des Pulses.
HINWEIS: Sobald der Betreffende mit dem Einatmen des gewünschten Luftgemisches beginnt, sollte das Pulsoximeter vom Prüfer kontinuierlich überwacht werden. Wenn die Sauerstoffsättigung des Subjekts unter 94% fällt, sollte das Experiment aus Sicherheitsgründen abgebrochen und das Subjekt beobachtet werden, bis sie zum Ausgangswert zurückkehren. - Passen Sie die Höhe des OCTA-Setups so an, dass das Subjekt sein Kinn leicht auf der Kinnlehne (#11) ausruhen kann, ohne den Hals zu überdehnen oder zu beugen.
- Schleifen Sie den Gasförderschlauch (#8) mit Mundstück (#9) Befestigung durch den Kopf und Kinnstütze mit dem Mundstück (#9) dem Patienten zugewandt. Lassen Sie die Schlauchschlaufe durch die Maschine oppposite die Seite des Auges, dass das Motiv abgebildet hat.
- Legen Sie das Mundstück in den Mund des Patienten. Ermutigen Sie das Subjekt, das Atmen durch das Nicht-Rebreathing-Setup zu üben, um Vertrautheit mit dem Gerät zu schaffen. Stellen Sie sicher, dass das Motiv tief durchatmet, um den Gasaustausch zu erleichtern.
- Legen Sie den Nasenclip (#10) auf das Motiv, um sicherzustellen, dass sie durch das Mundstück atmen.
- Halten Sie das Drei-Wege-Ventil in Konfiguration 2 oder ändern Sie es auf Konfiguration 1, je nachdem, ob Bilder für die Exposition gegenüber Raumluft bzw. einem bestimmten Gasgemisch aufgenommen werden. Für zukünftige Referenzen, beachten Sie die Zeit als Beginn der Gasinhalation.
- Lassen Sie das Subjekt ihr Kinn auf den rechten oder linken Abschnitt der Kinnlehne (#11) legen, entsprechend dem Auge, das für die Bildgebung ausgewählt wurde.
- Stellen Sie sicher, dass sie ihren Kopf nach vorne bewegen, bis ihre Stirn in festem Kontakt mit der Kopfstütze (#11 ist.
- Erfassen Sie den OCTA-Scan von Interesse, wie durch das Testprotokoll bestimmt. In dieser Studie wurden drei 3 mm x 3 mm Bilder, die auf der Fovea zentriert sind, nach 1 min Gasatmung aufgenommen.
- Lassen Sie das Subjekt den Kopf nach vorne und still halten, während Sie sich auf das Ziel in der Mitte ihrer Ansicht fixieren.
- Zentrieren Sie den Scan in der Live-Ansicht in der Irisansicht.
- Bringen Sie die Iris in den Fokus, indem Sie die Kinnlehne mit den Pfeilen von links nach rechts ein- oder ausbewegen.
- Stellen Sie sicher, dass der Foveal-Dip im OCT-Scan zentriert ist, was standardmäßig erfolgen sollte.
- Nehmen Sie ein Bild auf. Das Scannen dauert in der Regel einige Sekunden auf einem OCTA-Computer.
- Zeigen Sie das OCTA-Bild nach Abschluss des Scans an und stellen Sie sicher, dass es von ausreichender Qualität ist. Die Signalstärke sollte auf einer 10-Punkte-Skala des OCTA-Herstellers 7 oder besser sein.
- Wählen Sie Speichern oder scannen Sie das Auge erneut.
- Wiederholen Sie die Schritte 3.14.1–3.14.7 für so viele Scans, wie gewünscht.
- Lassen Sie das Motiv sich von der Maschine zurücklehnen. Entfernen Sie den Nasenclip (#10) und das Mundstück (#9), wenn keine Scans des Auges mit diesem Gasgemisch mehr erforderlich sind.
- Erlauben Sie den Probanden eine2 2-min Pause, bevor Sie CO2-Gasprovokationsexperimente starten.
- Füllen Sie den Douglas-Beutel mit dem ersten gewünschten Luftgemisch (bestehend aus 5%CO2,21% Sauerstoff und 74% Stickstoff) gemäß Schritt 1.2. Das Dreiwegeventil wird nach diesem Schritt in Konfiguration 2 sein.
- KompletteS Gas-Nicht-Rebreathing-Gerät Setup durch Anschluss der Luftkontrolleinheit an die Nicht-Rebreathing-Einheit, wie in Abbildung 1 dargestellt und in Schritt 1.1.4 beschrieben. Stellen Sie sicher, dass alle Verbindungen mit Dichtband luftdicht sind.
- Wiederholen Sie die Schritte 3.9–3.14, stellen Sie nun jedoch das Drei-Wege-Ventil auf Konfiguration 1, wenn es in Schritt 3.11 gerichtet ist.
- Geben Sie den Probanden eine 10 min Pause nach derCO2-Gasprovokation, um eine Rückkehr zur Basislinie zu ermöglichen.
- Während das Thema in der Pause ist, füllen Sie den Douglas-Beutel mit 100% O2 nach Schritt 1.2.
- Wiederholen Sie die Schritte 3.17–3.18, um das Experiment unter 100%O2 Gasprovokationsbedingungen durchzuführen.
4. Experimentelle Aufräumarbeiten
- Entsorgen Sie die Einwegelemente des Setups: das Mundstück (#9) und den Nasenclip (#10).
- Reinigen Sie kopf- und Kinnrest (#11) mit einem Alkoholtupfer. Wischen Sie den Themenstuhl, den OCTA-Tisch und die OCTA-Griffe mit einem Desinfektionsmittelwisch, um fehlerhaften Speichel zu entfernen.
- Trennen Sie das Setup am Dreiwegeventil (#3) in die Basiskomponenten – die Luftsteuereinheit und die Nichtatmungseinheit).
- Da keine vom Motiv ausgeatmete Luft die Elemente der Luftleiteinheit erreicht haben sollte, entleeren Sie den Douglas-Beutel nach Schritt 1.2.2 und platzieren Sie an einem Ort für zukünftige Seokation. Trennen Sie das Reinborrohr (#2) mit Adapter (#2*) und Dreiwegeventil (#3) aus dem Douglas-Beutel, wenn dies für eine einfachere Lagerung gewünscht wird. Damit ist die Reinigung der Air Control Unit abgeschlossen.
- Entfernen Sie den Gasförderschlauch (#8) aus der Nicht-Rebreathing-Einheit, indem Sie ihn vom Ellenbogengelenk (#7 trennen. Trennen Sie die hauseigenen Gummischläuche (#5) und Schlauchadapter (#4) vom zweiseitig-nicht-rebreathing-Ventil (#6). Dann tun Sie das gleiche aus dem Ellenbogengelenk (#7), indem Sie das Dichtband entfernen und die Teile lösen, indem Sie sie auseinanderziehen.
HINWEIS: Eine umfassendere Reinigung des Zwei-Wege-Nicht-Rebreathing-Ventils kann durch Demontage erleichtert werden, um die internen Membranen für zusätzliche Pflege zu entfernen. -
Vorbereiten eines Desinfektionsbades zur Reinigung der wiederverwendbaren Komponenten
- Füllen Sie einen Behälter groß genug, um die Gasförderschläuche (#8) mit einem entsprechend verdünnten und gut gemischten Reinigungsmitteldesinfektionsmittel zu untertauchen. In diesem Fall das Waschmittel mit Wasser auf ein Verhältnis von 1:6425verdünnen.
- Die Gasförderschläuche (#8), das Zweiweg-Nicht-Rebreathing-Ventil (#6), das Ellenbogengelenk (#7), die hauseigenen Gummischläuche (#5) und die Schlauchadapter (#4) im vorbereiteten Desinfektionsbad mindestens 10 min.
- Entfernen Sie alle Teile, nachdem das Bad vorbei ist, und spülen Sie sie gründlich mit Wasser ab.
- Legen Sie sie auf ein Papiertuch auf eine saubere Arbeitsplatte, um luftgetrocknet zu werden.
- Nach Abschluss der Lufttrocknung das Papiertuch entsorgen und alle Komponenten zur Lagerung entsorgen.
5. OCTA-Datenexport und -Analyse
-
OCTA-Datenexport
- Exportieren Sie OCTA-Daten, indem Sie ein Wechselmedium der Wahl in den OCTA-Computer einfügen. Finden Sie das Thema und Scan von Interesse.
- Wählen Sie Exportieren aus, um einen ZIP-Ordner zu erstellen, der die Daten des Betreffenden gegenstandsimbereich im BMP-Format auf dem Wechselmediengerät enthält.
-
OCTA-Datenanalyse
- Organisieren Sie die OCTA-Daten auf einem Laborcomputer mit der Möglichkeit, zusätzliche Bildanalyse und -verarbeitung durchzuführen.
- Verwenden Sie ein benutzerdefiniertes Skript, um Rauschen mit einer globalen Schwellenwerttechnik zu unterdrücken und zusätzliche Feature-Extraktionen durchzuführen. Binarisieren und skelettieren Sie die OCTA-Bilder.
- Berechnen Sie auf den nachbearbeiteten Bildern die Behälterskelettdichte (VSD)19,26, ein bemaßungsloses Maß für die gesamte lineare Länge der Gefäße in einem Bild, berechnet durch die folgende Gleichung, die auf einem binarisierten skelettierten Bild der OCTA durchgeführt wird:
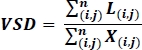
wobei i und j auf Pixelkoordinate (i,j), L(i,j) bezieht sich auf weiße Pixel, die Dekorrelation darstellen, Bezieht sich X(i,j) auf alle Pixel und n auf die Dimensionen des Pixelarrays, das als n x n Pixel19,26angenommen werden kann. Der Nenner dieser Gleichung stellt die Gesamtzahl der Pixel dar, die wie aus dem skelettierten Bild geschrieben berechnet wird, aber als Darstellung des physischen Bereichs des gesamten Bildes betrachtet werden kann.
Ergebnisse
Der Ausgang dieses Experiments besteht aus den manuellen Messwerten des Pulsoximeters, dem für die Gasexposition oder OCTA-Scanning festgestellten Timing und den rohen OCTA-Bilddaten. Ein OCTA-Bild besteht aus den OCT-B-Scans und dem Dekorrelationssignal, das jedem B-Scan zugeordnet ist. Die Datenparameter werden durch die Spezifikationen des Geräts angegeben. Es wurde eine gefegte Laserplattform OCTA-Maschine mit einer zentralen Wellenlänge von 1040–1060 nm eingesetzt. Die Bilder bieten eine Querauflösung von 20 m...
Diskussion
Die soeben beschriebene Methodik ist das komplette Protokoll für ein Gasatmungsprovokationsexperiment, das die Messung des RVR eines Subjekts in einer kontrollierten Umgebung zu bestimmten Zeitpunkten ohne Änderungen am OCTA-Bildgebungsgerät und minimalen Beschwerden oder Risiken für das Subjekt ermöglicht. Dieses Setup wird so beschrieben, dass einfache Änderungen an die Bedürfnisse des Forschers zugeschnitten werden können. Es kann zusätzliche Schläuche aufnehmen, um verschiedene Klinikräume zu passen und be...
Offenlegungen
Carl Zeiss Meditec hat AHK Im Zusammenhang mit dem Thema dieses Artikels Fördergelder, Ausrüstung und finanzielle Unterstützung zur Verfügung gestellt.
Danksagungen
Diese Arbeit wurde unterstützt von NIH K08EY027006, R01EY030564, UH3NS100614, Research Grants from Carl Zeiss Meditec Inc (Dublin, CA) and Unrestricted Department Funding from Research to Prevent Blindness (New York, NY).
Materialien
| Name | Company | Catalog Number | Comments |
| 5% CO2 gas [5% CO2, 21% O2, 74% N2] (Compressed) | Institution Dependent (Praxair) | ||
| Bacdown Disinfectant Detergent | Decon Labs | 8001 | https://deconlabs.com/products/disinfectant-bdd/ |
| Clean-Bor Tubes (35 mm Inner Diameter) | Vacumed | 1011-108 | http://www.vacumed.com/zcom/product/Product.do?compid=27&skuid=1197 |
| Cuff adapter for Douglas bag filling | Vacumed | 22254 | http://www.vacumed.com/zcom/product/Product.do?compid=27&prodid=343 |
| Douglas bag (200 L capacity) | Harvard Apparatus | 500942 | https://www.harvardapparatus.com/douglas-bag.html |
| Elbow Joint (Inner Diameter 19 mm/Outer Diameter 22 mm), Modified in House | |||
| Fingertip Pulse Oximeter (Pro-Series) | CMS | CMS 500DL | https://www.walmart.com/ip/Pro-Series-CMS-500DL-Fingertip-Pulse-Oximeter-Blood-Oxygen-Saturation-Monitor-with-silicon-cover-batteries-and-lanyard/479049154 |
| Gas Delivery Tube (22 mm Inner Diameter) Modified in House | |||
| Gas filling tube (1/8" for compressed gas) | |||
| Hydrogen Peroxide Cleaner Disinfectant Wipes | Clorox Healthcare | 30824 | https://www.cloroxpro.com/products/clorox-healthcare/hydrogen-peroxide-cleaner-disinfectants/?gclid=EAIaIQobChMIk-KG4vi15QIVcRh9Ch0NNwLPEAAYASAAEgJIa_D_BwE&gclsrc=aw.ds |
| Lubricant Eye Drops | Refresh | Refresh Plus | https://www.refreshbrand.com/Products/refresh-plus |
| Manual Directional Control Valves: Three-Way T-Shape Stopcock Type (Inner Diameter 28.6 mm, Outer Diameter 35 mm) | Hans Rudolph | 2100C Series | www.rudolphkc.com |
| Medical O2 (Compressed) | Institution Dependent | ||
| Mouth piece (Silicone, Model #9061) | Hans Rudolph | 602076 | www.rudolphkc.com |
| OCTA Imaging Device (PLEX Elite 9000) | Carl Zeiss Meditec, Dublin, CA, USA | https://www.zeiss.com/meditec/int/product-portfolio/optical-coherence-tomography-devices/plex-elite-9000-swept-source-oct.html | |
| Phenylephrine Hydrochloride Ophthalmic Solution, USP 2.5% | Paragon Bioteck, Inc | NDC 42702-102-15 | https://paragonbioteck.com/products/diagnostics/phenylephrine-hydrochloride-ophthalmic-solution-usp-2-5/ |
| Plastic Nose Clip Sterile Foam CS100 | Sklar Sterile | 96-2951 | https://www.sklarcorp.com/disposables/plastic/plastic-nose-clip-sterile-foam-box-of-100.html |
| Proparacaine Hydrochloride Ophthalmic Solution, USP .5% | Bausch + Lomb | NDC 24208-730-06 | https://www.bausch.com/ecp/our-products/rx-pharmaceuticals/generics |
| Regulator (tank dependent- 5% CO2: Fisherbrand Mulitstage Gas Cylinder Regulators) | Genstar Technologies Company | 10575150 | https://www.fishersci.com/shop/products/fisherbrand-multistage-cylinder-regulators-22/10575150?keyword=true |
| Regulator (tank dependent- Oxygen: Fisherbrand Multistage Gas Cylinder Regulators) | Genstar Technologies Company | 10575145 | https://www.fishersci.com/shop/products/fisherbrand-multistage-cylinder-regulators-22/10575145?keyword=true |
| Rubber Tubing (Inner diameter 19 mm, Outer diameter 27 mm), Made in House | |||
| Sealing tape- Parafilm Wrap (2" Wide) | Cole Parmer | PM992 | https://www.coleparmer.com/i/parafilm-pm992-wrap-2-wide-250-ft-roll/0672050?PubID=VV&persist=True&ip=no&gclid=EAIaIQobChMInY3vqomz5QIVfyCtBh1VSg64EAAYASAAEgJ9n_D_BwE |
| Sterile Alcohol Prep Pads | Medline | MDS090670 | https://www.medline.com/product/Sterile-Alcohol-Prep-Pads/Swab-Pads/Z05-PF03816 |
| Tropicamide Ophthalmic Solution, USP 1% | Akorn | NDC 17478-102-12 | http://www.akorn.com/prod_detail.php?ndc=17478-102-12 |
| Tubing Adapter, Made in House | |||
| Two-way non-rebreathing valve (2600 Series- Inner Diameter 28.6 mm, Outer Diameter 35 mm) | Hans Rudolph | 2600 Series, UM-112078 | www.rudolphkc.com |
Referenzen
- Country, M. W. Retinal metabolism: A comparative look at energetics in the retina. Brain Research. 1672, 50-57 (2017).
- Ashimatey, B. S., Green, K. M., Chu, Z., Wang, R. K., Kashani, A. H. Impaired Retinal Vascular Reactivity in Diabetic Retinopathy as Assessed by Optical Coherence Tomography Angiography. Investigative Ophthalmology & Visual Science. 60 (7), 2468 (2019).
- Hickam, J. B. M. D., Frayser, R. P. D. Studies of the Retinal Circulation in Man: Observations on Vessel Diameter, Arteriovenous Oxygen Difference, and Mean Circulation Time. Circulation. 33 (2), 302-316 (1966).
- Dorner, G. T., Garhoefer, G., Zawinka, C., Kiss, B., Schmetterer, L. Response of Retinal Blood Flow to CO2 -Breathing in Humans. European Journal of Ophthalmology. 12 (6), 459-466 (2002).
- Linsenmeier, R. A., Zhang, H. F. Retinal oxygen: from animals to humans. Progress in Retinal and Eye Research. 58, 115-151 (2017).
- Eliakim, M., Mor, I., Michaelson, I. C. Assessment of pharmacologic effects on the retinal circulation of hypertensive subjects by a quantitative method. Microvascular Research. 4 (4), 374-383 (1972).
- Gilmore, E. D., et al. Retinal arteriolar hemodynamic response to an acute hyperglycemic provocation in early and sight-threatening diabetic retinopathy. Microvascular Research. 73 (3), 191-197 (2007).
- Hickam, J. B., Sieker, H. O. Retinal Vascular Reactivity in Patients with Diabetes Mellitus and with Atherosclerosis. Circulation. 22 (2), 243-246 (1960).
- Gilmore, E. D., et al. Retinal Arteriolar Diameter, Blood Velocity, and Blood Flow Response to an Isocapnic Hyperoxic Provocation in Early Sight-Threatening Diabetic Retinopathy. Investigative Ophthalmology & Visual Science. 48 (4), 1744 (2007).
- Garhofer, G. Reduced response of retinal vessel diameters to flicker stimulation in patients with diabetes. British Journal of Ophthalmology. 88 (7), 887-891 (2004).
- Felder, A. E., Wanek, J., Blair, N. P., Shahidi, M. Inner Retinal Oxygen Extraction Fraction in Response to Light Flicker Stimulation in Humans. Investigative Ophthalmology & Visual Science. 56 (11), 6633-6637 (2015).
- Rose, K., Flanagan, J. G., Patel, S. R., Cheng, R., Hudson, C. Retinal Blood Flow and Vascular Reactivity in Chronic Smokers. Investigative Ophthalmology & Visual Science. 55 (7), 4266 (2014).
- Omae, T., Nagaoka, T., Yoshida, A. Effects of Habitual Cigarette Smoking on Retinal Circulation in Patients With Type 2 Diabetes. Investigative Ophthalmology & Visual Science. 57 (3), 1345 (2016).
- Pusparajah, P., Lee, L. H., Abdul Kadir, K. Molecular Markers of Diabetic Retinopathy: Potential Screening Tool of the Future. Frontiers in Physiology. 7, (2016).
- Hammer, M., Vilser, W., Riemer, T., Schweitzer, D. Retinal vessel oximetry-calibration, compensation for vessel diameter and fundus pigmentation, and reproducibility. Journal of Biomedical Optics. 13 (5), 054015 (2008).
- Gilmore, E. D., Hudson, C., Preiss, D., Fisher, J. Retinal arteriolar diameter, blood velocity, and blood flow response to an isocapnic hyperoxic provocation. American Journal of Physiology-Heart and Circulatory Physiology. 288 (6), 2912-2917 (2005).
- Duan, A., Bedggood, P. A., Metha, A. B., Bui, B. V. Reactivity in the human retinal microvasculature measured during acute gas breathing provocations. Scientific Reports. 7 (1), 2113 (2017).
- Burns, S. A., Elsner, A. E., Sapoznik, K. A., Warner, R. L., Gast, T. J. Adaptive optics imaging of the human retina. Progress in Retinal and Eye Research. 68, 1-30 (2019).
- Kim, A. Y., Chu, Z., Shahidzadeh, A., Wang, R. K., Puliafito, C. A., Kashani, A. H. Quantifying Microvascular Density and Morphology in Diabetic Retinopathy Using Spectral-Domain Optical Coherence Tomography Angiography. Investigative Ophthalmology & Visual Science. 57 (9), (2016).
- Koulisis, N., et al. Quantitative microvascular analysis of retinal venous occlusions by spectral domain optical coherence tomography angiography. PLOS ONE. 12 (4), 0176404 (2017).
- Kim, A. Y., et al. Quantifying Retinal Microvascular Changes in Uveitis Using Spectral-Domain Optical Coherence Tomography Angiography. American Journal of Ophthalmology. 171, 101-112 (2016).
- Kashani, A. H., et al. Optical coherence tomography angiography: A comprehensive review of current methods and clinical applications. Progress in Retinal and Eye Research. 60, 66-100 (2017).
- Yu, D. Y., et al. Retinal capillary perfusion: Spatial and temporal heterogeneity. Progress in Retinal and Eye Research. 70, 23-54 (2019).
- Tayyari, F., et al. The Relationship between Retinal Vascular Reactivity and Arteriolar Diameter in Response to Metabolic Provocation. Investigative Ophthalmology & Visual Science. 50 (10), 4814 (2009).
- Lu, H., Liu, P., Yezhuvath, U., Cheng, Y., Marshall, O., Ge, Y. MRI Mapping of Cerebrovascular Reactivity via Gas Inhalation Challenges. Journal of Visualized Experiments. (94), e52306 (2014).
- Reif, R., Qin, J., An, L., Zhi, Z., Dziennis, S., Wang, R. Quantifying Optical Microangiography Images Obtained from a Spectral Domain Optical Coherence Tomography System. International Journal of Biomedical Imaging. 2012, 1-11 (2012).
- Olafsdottir, O. B., Eliasdottir, T. S., Kristjansdottir, J. V., Hardarson, S. H., Stefánsson, E. Retinal Vessel Oxygen Saturation during 100% Oxygen Breathing in Healthy Individuals. PLOS ONE. 10 (6), 0128780 (2015).
- Kiss, B., et al. Retinal Blood Flow during Hyperoxia in Humans Revisited: Concerted Results Using Different Measurement Techniques. Microvascular Research. 64 (1), 75-85 (2002).
- Yezhuvath, U. S., Lewis-Amezcua, K., Varghese, R., Xiao, G., Lu, H. On the assessment of cerebrovascular reactivity using hypercapnia BOLD MRI. NMR in biomedicine. 22 (7), 779-786 (2009).
- Hardarson, S. H., et al. Automatic Retinal Oximetry. Investigative Ophthalmology & Visual Science. 47 (11), 5011 (2006).
- Sousa, D. C., Leal, I., Moreira, S., Dionísio, P., Abegão Pinto, L., Marques-Neves, C. Hypoxia challenge test and retinal circulation changes - a study using ocular coherence tomography angiography. Acta Ophthalmologica. 96 (3), 315-319 (2018).
- Slessarev, M., Somogyi, R., Preiss, D., Vesely, A., Sasano, H., Fisher, J. A. Efficiency of oxygen administration: Sequential gas delivery versus "flow into a cone" methods. Critical Care Medicine. 34 (3), 829-834 (2006).
- Gilmore, E. D., Hudson, C., Venkataraman, S. T., Preiss, D., Fisher, J. Comparison of Different Hyperoxic Paradigms to Induce Vasoconstriction: Implications for the Investigation of Retinal Vascular Reactivity. Investigative Ophthalmology & Visual Science. 45 (9), 3207 (2004).
- Shahidi, A. M., Patel, S. R., Huang, D., Tan, O., Flanagan, J. G., Hudson, C. Assessment of total retinal blood flow using Doppler Fourier Domain Optical Coherence Tomography during systemic hypercapnia and hypocapnia. Physiological Reports. 2 (7), 12046 (2014).
- Maleki, N., et al. The Effect of Hypercarbia and Hyperoxia on the Total Blood Flow to the Retina as Assessed by Magnetic Resonance Imaging. Investigative Ophthalmology & Visual Science. 52 (9), 6867 (2011).
- Smit, B., Smulders, Y. M., vander Wouden, J. C., Oudemans-van Straaten, H. M., Spoelstra-de Man, A. M. E. Hemodynamic effects of acute hyperoxia: systematic review and meta-analysis. Critical Care. 22 (1), 45 (2018).
- Piccolino, F. P., Cagini, C., Fruttini, D., Nicolò, M., Eandi, C. M., Tito, S. Retinal Vascular Reactivity in Central Serous Chorioretinopathy. Investigative Ophthalmology & Visual Science. 59 (11), 4425 (2018).
- Sousa, D. C., et al. A Protocol to Evaluate Retinal Vascular Response Using Optical Coherence Tomography Angiography. Frontiers in Neuroscience. 13, 566 (2019).
- Robinson, F., Riva, C. E., Grunwald, J. E., Petrig, B. L., Sinclair, S. H. Retinal Blood Flow Autoregulation in Response to on Acute Increase in Blood Pressure. Investigative Ophthalmology & Visual Science. 27 (5), 5 (1986).
- Gherghel, D., Hosking, S. L., Cunliffe, I. A. Abnormal Systemic and Ocular Vascular Response to Temperature Provocation in Primary Open-Angle Glaucoma Patients: A Case for Autonomic Failure. Investigative Ophthalmology & Visual Science. 45 (10), 3546 (2004).
- You, Q., et al. Reproducibility of vessel density measurement with Optical Coherence Tomography Angiography in eyes with and without retinopathy. Retina. 37 (8), 1475-1482 (2017).
- Lei, J., et al. Repeatability and Reproducibility of Superficial Macular Retinal Vessel Density Measurements Using Optical Coherence Tomography Angiography En Face Images. JAMA Ophthalmology. 135 (10), 1092 (2017).
- Czakó, C., et al. Intrasession and Between-Visit Variability of Retinal Vessel Density Values Measured with OCT Angiography in Diabetic Patients. Scientific Reports. 8 (1), 10598 (2018).
- Field, A. S., Laurienti, P. J., Yen, Y. F., Burdette, J. H., Moody, D. M. Dietary Caffeine Consumption and Withdrawal: Confounding Variables in Quantitative Cerebral Perfusion Studies. Radiology. 227 (1), 129-135 (2003).
- Baek, S. U., et al. Diurnal change of retinal vessel density and mean ocular perfusion pressure in patients with open-angle glaucoma. PLOS ONE. 14 (4), 0215684 (2019).
- Müller, V. C., Storp, J. J., Kerschke, L., Nelis, P., Eter, N., Alnawaiseh, M. Diurnal variations in flow density measured using optical coherence tomography angiography and the impact of heart rate, mean arterial pressure and intraocular pressure on flow density in primary open-angle glaucoma patients. Acta Ophthalmologica. 97 (6), (2019).
- Sarwar, S., et al. Diurnal variation of choriocapillaris vessel flow density in normal subjects measured using optical coherence tomography angiography. International Journal of Retina and Vitreous. 4 (1), 37 (2018).
- Liu, P., De Vis, J. B., Lu, H. Cerebrovascular reactivity (CVR) MRI with CO2 challenge: A technical review. NeuroImage. 187, 104-115 (2019).
- Ting, D. S. W., et al. Optical Coherence Tomographic Angiography in Type 2 Diabetes and Diabetic Retinopathy. JAMA Ophthalmology. 135 (4), 306 (2017).
- Spaide, R. F., Fujimoto, J. G., Waheed, N. K., Sadda, S. R., Staurenghi, G. Optical coherence tomography angiography. Progress in retinal and eye research. 64, 1-55 (2018).
- An, D., et al. Quantitative comparisons between optical coherence tomography angiography and matched histology in the human eye. Experimental Eye Research. 170, 13-19 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten