Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Optik Koherens Tomografi Anjiyografi ile Değerlendirilen Retinal Vasküler Reaktivite
Bu Makalede
Özet
Bu makalede, retinal görüntüler elde ederken vazoaktif uyaranlar sunmak için bir gaz solunum provokasyon tekniği kullanarak insan denekler ile in vivo retinal vaskülatür reaktivitesini ölçmek için bir yöntem açıklanmıştır.
Özet
Retinaya vasküler kaynağın vazokonstriksiyon ve vazodilatasyon yoluyla retinanın metabolik taleplerini karşılamak için dinamik olarak adapte olduğu gösterilmiştir. Retinal vasküler reaktivite (RVR) olarak adlandırılan bu süreç, diyabetik retinopati gibi retinal vasküler hastalıklarda çok erken bozulan nörovasküler kaplin ile aracılık edilir. Bu nedenle, vasküler fonksiyon değerlendirmek klinik olarak uygulanabilir bir yöntem hem araştırma hem de klinik ortamlarda önemli ilgi olabilir. Son zamanlarda kapiller düzeyde retinal vaskülatürin in vivo görüntülemesi, kapiller düzey çözünürlüğü ile noninvaziv, minimal risk ve boyasız anjiyografi yöntemi olan optik koherens tomografi anjiyografisinin (OCTA) FDA onayı ile mümkün olmuştur. Aynı anda, RVR fizyolojik ve patolojik değişiklikler çeşitli araştırmacılar tarafından gösterilmiştir. Bu el yazmasında gösterilen yöntem, klinik görüntüleme prosedürlerinde veya cihazda değişiklik yapmaya gerek kalmadan OCTA kullanılarak RVR'ı araştırmak üzere tasarlanmıştır. Hiperkapnik veya hiperoksik durumlara maruz kalma sırasında retina ve retinal vaskülatürgerçek zamanlı görüntüleme gösterir. Sınav en az konu rahatsızlık veya risk ile 30 dk altında iki personel ile kolayca yapılır. Bu yöntem diğer oftalmik görüntüleme cihazlarına uyarlanabilir ve uygulamalar gaz karışımının bileşimine ve hasta popülasyonuna bağlı olarak değişebilir. Bu yöntemin bir gücü, in vivo insan deneklerde kapiller düzeyde retinal vasküler fonksiyonun araştırılmasıiçin izin olmasıdır. Bu yöntemin sınırlamaları büyük ölçüde OCTA ve görüntüleme yapıları ve sınırlı dinamik aralık da dahil olmak üzere diğer retinagörüntüleme yöntemlerivardır. Yöntemden elde edilen sonuçlar retinanın OCT ve OCTA görüntüleridir. Bu görüntüler, ticari olarak kullanılabilen OCT veya OCTA cihazlarında mümkün olan tüm analizler için uygundur. Genel yöntem, ancak, oftalmik görüntüleme herhangi bir şekilde adapte edilebilir.
Giriş
Retinanın metabolik talebi, arteriyol, kılcal damarlar ve venüllerden oluşan iyi düzenlenmiş bir sistem tarafından sağlanan yeterli ve sürekli oksijen kaynağına bağlıdır1. Çeşitli çalışmalar, daha büyük kalibreli insan retinal damarların,fonksiyonu çeşitli fizyolojik2,3,4,5 ve farmakolojik6,,7 uyaranile in vivo değerlendirilebilir göstermiştir. Buna ek olarak, bu vasküler sistemin anormal fonksiyonu retinal vasküler reaktivite (RVR) erken aşamalarında bile zayıflatılmış olduğu gösterilmiştir diyabetik retinopati gibi retinal vasküler hastalıklarda yaygındır8,9 hem gaz provokasyon u ğla9 ve titreşen ışık deneyleri ile5,10,11. Sigara gibi retinal vasküler risk faktörleri de bozulmuş RVR12 ve retinal kan akımı ile ilişkili olmuştur13. Retinal vasküler hastalığın klinik semptomları hastalık sürecinde nispeten geç ortaya çıkalı ve hastalığın kanıtlanmış erken klinik belirteçleri14eksik olduğundan bu bulgular önemlidir. Böylece, RVR değerlendirilmesi retinade dejeneratif hastalıkları başlatabilir veya alevlendirebilir anormalliklerin erken değerlendirilmesi için vasküler bütünlük yararlı önlemler sağlayabilir.
Önceki RVR deneyleri genellikle lazer kan akış ölçer9 veya retina görüntü edinimi için özel filtreler15 ile donatılmış fundus kameralar gibi cihazlara dayanıyordu. Ancak, bu teknolojiler arteriyol16 ve venules15gibi büyük çaplı damarlar için optimize edilmistir, hangi gaz, mikrobesin ve moleküler değişim meydana değildir. Daha yeni bir çalışma da uyarlanabilir optik görüntüleme kullanarak kılcal damarların RVR ölçmek başardı17, ama geliştirilmiş mekansal çözünürlüğe rağmen, Bu görüntüler daha küçük bir alan boyutuvar ve klinik kullanım için FDA onaylı değildir18.
Optik koherens tomografi anjiyografi (OCTA) son gelişi, insan hasta ve in vivo deneklerde kapiller seviye değişiklikleri değerlendirmek bir FDA onaylı, noninvaziv ve boyasız anjiyografik yöntemsağlamıştır. OCTA yaygın diyabetik retinopati gibi retinal vasküler hastalıklarda kapiller perfüzyon bozukluğu değerlendirmek için etkili bir araç olarak klinik uygulamada kabul edilir19, retinal venöz oklüzyonlar20, vaskülit21 ve diğerleri22. Bu nedenle OCTA, klinik ortamda önemli uzamsal ve zamansal heterojenlik23'ün yanı sıra patolojik değişikliklere sahip olabilecek kılcal seviye değişikliklerinin değerlendirilmesi için mükemmel bir fırsat sunmaktadır. Grubumuz son zamanlarda OCTA bir retina vazodilatar uyarıcı olan bir retina vazokonstrik uyarıcı16,,24,ve karbondioksit, bir retina vazodilatif uyarıcı olan ilham oksijen fizyolojik değişikliklere kılcal düzeyde2 retinal damarların duyarlılığı ölçmek için kullanılabilir olduğunu gösterdi3,5.
Bu makalenin amacı, okuyucunun OKTA kullanarak küçük arteriollerin retinal vasküler reaktivitesini ve kılcal yatağı değerlendirmesini sağlayacak bir protokolü tanımlamaktır. Yöntemler, manyetik rezonans görüntüleme ile serebrovasküler reaktivite ölçümlerini tanımlayan Lu ve ark.25'te sunulan yöntemlerden uyarlanmıştır. Mevcut yöntemler OCTA görüntüleme2sırasında geliştirilmiş ve kullanılmış olsa da, nispeten basit ve belirgin modifikasyonları ile diğer retinal görüntüleme cihazları için geçerlidir.
Access restricted. Please log in or start a trial to view this content.
Protokol
Bu çalışma Güney Kaliforniya Üniversitesi Kurumsal İnceleme Kurulu tarafından onaylanmıştır ve Helsinki Bildirgesi'nin ilkelerine bağlı kalmıştır.
1. Gaz Rebreathing Aparatlarının Kurulumu
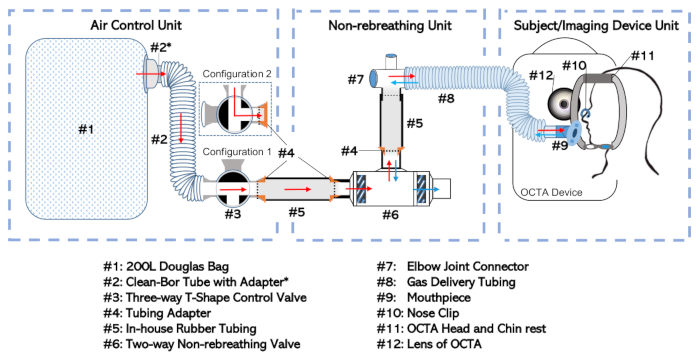
Şekil 1: Rebreathing olmayan cihazların diyagramı. Tam kurulum, işlevlerine ve bağımsız olarak ele alınma sıklığına göre üç ayrı birime ayrılmıştır. Bunlar: Hava Kontrol Ünitesi, Yeniden Nefes Alamayan Birim ve Konu/Görüntüleme Cihazı Birimi Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayınız.
-
Aparat montajı
- Douglas çantasını(Şekil 1,#1) 35 mm iç çaplı tüp (#2; bkz. Malzeme Tablosu)ile seçici giriş portundaki üç yönlü valf (#3) adaptörlü (#2*) bağlayın. Bu kombinasyon Şekil 1'degösterildiği gibi "Hava Kontrol Ünitesi" olarak adlandırılacaktır.
- İki yönlü rebreathing valfini (#6) geri nefes alamayan vananın ağız portundaki dirsek eklem konektörüne (#7) bağlayın. Adaptör (#4) ile donatılmış bir kauçuk tüp (#5) kullanarak bağlantıyı kurun.
- Dirsek eklemini gaz dağıtım borularına bağlayın (#8). Rebreathing valf (#6), şirket içi tüp (#5), adaptörler (#4), dirsek eklemi (#7) ve gaz dağıtım borusu (#8) dahil olmak üzere bu kurulum "Non-rebreathing Unit" olarak adlandırılacaktır.
NOT: Deneğin ağzı ile iki yönlü nefes alamayan valfin diyaframı arasındaki ölü boşluk miktarını en aza indirin (#6). - Üç yönlü valfin çıkış noktasındaki Hava Kontrol Ünitesini (#3) iki yönlü yeniden nefes alamayan valfin giriş portundaki yeniden nefes alamayan üniteye (#6) bağlayın. Parçaların birbirine sokulmasını sağlayan daha önce açıklananek kauçuk boru (#5) ve adaptörleri (#4) kullanarak bağlantıyı kurun.
- Hermetik bir uyum sağlamak için sızdırmazbant ile eklem sararak tüm gevşek bağlantıları mühürleyin.
- Gaz dağıtım borusu (#8) açık ucundaki ağızlık (#9) için Şekil 1'inKonu/Görüntüleme Cihaz Birimi'nde gösterildiği gibi bağlayın.
NOT: Bu adım (1.1.6) konu testi başlamaya hazır olana kadar ertelenebilir (Adım 3.5).
-
Gaz ın tekrar nefes almaması için Hava Kontrol Ünitesinin hazırlanması
- Hava Kontrol Ünitesi'ni, zaten ayrılmamışsa, şirket içi herhangi bir tüp (#5) veya bağdaştırıcılardan (#4) ayırarak izole edin.
- Douglas çanta (#1) boş veya boş herhangi bir hava douglas çanta (#1) sistematik distal ucundan üç yönlü vana ile çanta giriş portu doğru çanta haddeleme Figure 1tarafından (#3) Şekil 1'de gösterildiği gibi Configuration 1 ayarlanmış olduğundan emin olun.
- Uygun gaz karışımı ile Douglas çanta (#1) doldurun.
- Sadece oda havası yeniden nefes almaması amaçlanıyorsa, üç yönlü valfi Configuration 2'ye ayarlayın (Şekil 1'degösterilmiştir) ve Douglas çantasını doldurmayın (#1). Aksi takdirde Adım 1.2.3'ten oluşan adımlarla devam edin.
- Hava Kontrol Ünitesi'ni (Şekil 1'degösterilmiştir) üç yönlü valfin çıkış portuna (#3) uygun adaptörleri ve boruları kullanarak bir gaz silindirine (istenilen hava karışımını içeren) bağlayın. Üç yönlü vananın (#3) dış çapına 1/8" gaz dolum tüpü takmak için bir manşet adaptörü kullanın.
- Amaçlanan gazın depolama silindirinden Douglas çantasına (#1) akmasını sağlamak için üç yönlü valf tertibatını Configuration 1 'e ayarlayın (Şekil 1'degösterildiği gibi). Gaz silindirini aç.
- Douglas çanta (#1) amaçlanan hacmi (genellikle yarım dolu) doldurulur sonra, gaz silindir çıkışı kapatın ve Yapılandırma için üç yönlü vana ayarlayın 2, Hangi Douglas çanta içinde gaz izole (#1). Hava Kontrol Ünitesi'ni Douglas çantasını doldurmak için kullanılan herhangi bir tüpten (#1) kesin.
2. Konuyu Görüntülemeye Hazırlama
- Denek çalışmaya katılmayı kabul ettikten sonra, konuyu OCTA görüntüleme cihazının arkasına oturun. Test yordamlarını konuya açıklayın.
- Deneğin çalışmaya katılma riskini artıran mevcut tıbbi bir rahatsızlığı olmadığından emin olmak için deneğin tıbbi geçmişini doğrulayın.
NOT: Önceden var olan kardiyovasküler veya pulmoner hastalıklar, deneklerin katılmadığı risk faktörleridir. Bu konu gibi sersemlemiş ya da bazı ek beklenmedik rahatsızlık hissi gibi herhangi bir nedenle herhangi bir zamanda prosedürü durdurabilirsiniz anlamak esastır. - Test protokolüne göre değerlendirilecek gözü belirleyin. Test süresini sınırlamak ve gazın yeniden nefes almamasından kaynaklanan olası rahatsızlıkları en aza indirmek için sadece bir göz görüntülenebilir.
- Deneğin göz bebeği boyutu yaklaşık 2,5 mm veya daha az ise göz genişlemesini göz önünde bulundurun. Genişleme zorunlu olmasa da, kaliteli görüntüler elde etme şansını artırır. Dilate için, bir damla aşılamak 0.5% propaine hidroklorür oftalmik çözelti, 1% tropikamid oftalmik çözelti ve 2.5% fenilefrin hidroklorür oftalmik çözelti. Tam dilatasyon 10-15 dakika içinde meydana gelmelidir.
3. Gaz Provokasyon Deneyi ve Görüntü Edinimi
- OCTA makinesindeki hasta için bir profil oluşturun.
- Eldiven giy.
- Kurulum dezenfekte etmek için bir alkol bezi ile OCTA baş ve çene dinlenme aşağı silin.
- Ağızlığı (#9) steril ambalajından boşaltın.
NOT: Bu bileşen konunun ağız mukus astarı ile doğrudan temas yapar gibi ağızlık mümkün olduğunca dokunmaktan kaçının - Ağızlığı (#9) gaz dağıtım borularına bağlayın (#8)
- Deneklerin parmağına bir nabız oksimetresi yerleştirin ve oksijen doygunluk seviyelerini ve nabzını izlemeye başlayın.
NOT: Denek istenilen hava karışımını solamaz olarak solumeye başladıktan sonra, nabız oksimetresi sürekli olarak sınav tarafından izlenmelidir. Deneğin oksijen doygunluğu %94'ün altına düşerse, deney bir güvenlik önlemi olarak durdurulmalı ve denek taban çizgisine dönene kadar gözlendirilmelidir. - OCTA kurulumunun yüksekliğini, nesnenin çenesini çenesini (#11) boyunlarını uzatmadan veya esnetmeden kolayca dinlendirebileceği şekilde ayarlayın.
- Gaz dağıtım borusu (#8) ağızlık (#9) eki ile ağızlık ve çene istirahati ile ağızlık (#9) hastaya bakacak şekilde geçirin. Makine oppposite üzerinden konu görüntülenmiş olan gözün yan boru döngü var.
- Ağızlığı hastanın ağzına takın. Cihaza aşinalık yaratmak için deneği yeniden nefes alamayan kurulum aracılığıyla nefes almaya teşvik edin. Gaz değişimini kolaylaştırmak için deneğin derin nefes aldığından emin olun.
- Ağızlıktan nefes aldıklarından emin olmak için burun tonlarını (#10) konuya yerleştirin.
- Üç yönlü valfi Configuration 2'de tutun veya görüntülerin oda havasına veya belirli bir gaz karışımına maruz kalmak için edinilip edinilemediğine bağlı olarak Configuration 1 olarak değiştirin. İleride referans için, gaz teneffüs başlangıcı olarak zaman unutmayın.
- Deneğin çenesini görüntüleme için seçilen göze göre çenesinin sağ veya sol kısmına (#11) yerleştirmesini sağlar.
- Alnı başlıkla (#11) sıkı temas edene kadar başlarını ileri doğru hareket ettirin.
- Test protokolü tarafından belirlenen ILGI OCTA tonu yakalayın. Bu çalışmada fovea merkezli 3 mm x 3 mm'lik üç görüntü 1 dk gaz soluma dan sonra ele geçirilmiştir.
- Deneğin, görüşlerinin merkezindeki hedefe sabitlenme sırasında başını öne ve hareketsiz bir şekilde sabitletmelerini önlsürtün
- Iris görünümünde görülen canlı görüntüde, tazyiki ortaleyin.
- Sol-sağ okları kullanarak çene sini içeri veya dışarı taşıyarak irisi odak haline getirin.
- Foveal daldırma nın, varsayılan olarak gerçekleşmesi gereken OCT tamasında ortalanmış olduğundan emin olun.
- Bir görüntü çek. Tarama genellikle bir OCTA makinede birkaç saniye sürer.
- Tama tamamlandıktan sonra OCTA görüntüsünü görüntüleyin ve yeterli kalitede olduğundan emin olun. Sinyal mukavemeti, OCTA üreticisi tarafından sağlanan 10 puanlık bir ölçekte 7 veya daha iyi olmalıdır.
- Gözü kaydet veya rescan'ı seçin.
- Birçok tarama istendiği gibi 3.14.1-3.14.7 adımlarını tekrarlayın.
- Nesnenin makineden geri dönmesine izin verin. Bu gaz karışımı ile gözün daha fazla tarama gerekmediğinde burun klipsi (#10) ve ağızlık (#9) çıkarın.
- CO2 gaz provokasyon deneylerini başlatmadan önce deneklere 2 dk ara verin.
- Douglas çantasını adım 1.2'de belirtildiği gibi ilk istenilen hava karışımını (%5 CO2,%21 oksijen ve %74 azotiçeren) doldurun. Üç yönlü valf bu adımdan sonra Configuration 2'de olacaktır.
- Hava Kontrol Ünitesi'ni Şekil 1'de gösterildiği ve 1.1.4 adımında açıklandığı şekilde yeniden nefes almama ünitesine bağlayarak gaz geri alamayan cihaz kurulumlarını tamamlayın. Sızdırmazlık bandı ile tüm eklemlerin hava geçirmez olduğundan emin olun.
- Adımları 3.9-3.14'ü tekrarlayın, ancak şimdi adım 3.11'de yönlendirildiğinde üç yönlü valfi Configuration 1 olarak ayarlayın.
- Taban çizgisine geri dönüş sağlamak için co2 gaz provokasyonundan sonra deneklere 10 dakika mola verin.
- Konu mola iken, adım 1.2 göre% 100 O2 ile Douglas çanta doldurun.
- Deneyi %100 O2 gaz provokasyon uğrama koşulları altında gerçekleştirmek için 3.17-3.18 adımlarını tekrarlayın.
4. Deneysel Temizlik
- Kurulumun tek kullanımlık öğelerini atın: nesnenin ağızlık (#9) ve burun klipsi (#10).
- Bir alkol bezi kullanarak baş ve çene istirahatini (#11) temizleyin. Herhangi bir hatalı tükürük kaldırmak için bir dezenfektan silme ile konu sandalye, OCTA tablo ve OCTA kolları silin.
- Üç yönlü valf (#3) ile kurulumu temel bileşenlerine (Hava Kontrol Ünitesi ve Yeniden Nefes Alamayan Ünite) ile birleştirin.
- Konudan hava solunmayan hava nın Hava Kontrol Ünitesi'nin elemanlarına ulaşması gerektiğinden, Douglas çantasını 1.2.2 adıma göre boşaltın ve ileride geri alınacak bir yere yerleştirin. Daha kolay depolama için istenirse, temizleme borusu (#2) adaptör (#2*) ve üç yönlü valf (#3) ile Douglas çantasından koparın. Bu, Hava Kontrol Ünitesi'ni temizler.
- Dirsek ekleminden (#7) bağlantısını keserek gaz dağıtım borularını (#8) tekrar nefes almama ünitesinden çıkarın. Şirket içi kauçuk boru (#5) ve boru adaptörlerini (#4) iki yönlü yeniden nefes alamayan valften (#6) çıkar. Daha sonra sızdırmazlık bandını çıkararak ve parçaları ayırarak parçalar ayırarak dirsek ekleminden (#7) aynı şeyi yapın.
NOT: İki yönlü rebreathing valfinin daha kapsamlı temizliği, ek bakım için dahili diyaframları çıkarmak için sökülerek kolaylaştırılabilir. -
Yeniden kullanılabilir bileşenlerin temizlenmesi için bir dezenfektan banyosu hazırlayın
- Gaz dağıtım borusu (#8) uygun seyreltilmiş ve iyi karışık deterjan dezenfektan ile batırmak için yeterince büyük bir konteyner doldurun. Bu durumda deterjanı su ile seyrelterek 1:6425oranında seyreltin.
- Gaz dağıtım borusunu (#8), iki yönlü nefes almama valfini (#6), dirsek eklemini (#7), şirket içi kauçuk boruları (#5) ve boru adaptörlerini (#4) en az 10 dakika boyunca hazırlanan dezenfektan banyosunda bekletin.
- Banyo bittikten sonra tüm parçaları çıkarın ve iyice su ile durulayın.
- Hava yla kurutulması için temiz bir tezgahın üzerine kağıt havlu üzerine yerleştirin.
- Hava kurutma tamamlandıktan sonra, kağıt havluyu atın ve tüm bileşenleri depolama için uzağa yerleştirin.
5. OCTA Veri İhracatı ve Analizi
-
OCTA veri ihracatı
- OCTA bilgisayarına tercih edilen çıkarılabilir bir ortam aygıtı ekleyerek OCTA verilerini dışa aktarın. Konuyu bulun ve ilgiyi tarayıp tarayıp çıkarın.
- Çıkarılabilir ortam aygıtında .bmp biçiminde ilgi alanı verilerini içeren bir zip klasörü oluşturmak için Dışa Aktar'ı seçin.
-
OCTA veri analizi
- EK görüntü analizi ve işleme gerçekleştirebilme özelliğine sahip bir laboratuvar bilgisayarında OCTA verilerini düzenleyin.
- Genel eşik tekniğiyle gürültüyü bastırmak ve ek özellik çıkarma gerçekleştirmek için özel bir komut dosyası kullanın. Binarize ve OCTA görüntüleri iskeletize.
- İşlenen görüntülerde, damar iskelet yoğunluğunu (VSD)19,26, OCTA'nın binarize iskeletleştirilmiş görüntüsü üzerinde gerçekleştirilen aşağıdaki denklemle hesaplanan bir görüntüdeki damarların toplam doğrusal uzunluğunun boyutsuz bir ölçüsünü hesaplayın:
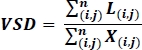
i i ve j piksel koordinatı anlamına gelir (i,j), L(i,j) dekoreş temsil eden beyaz pikselanlamına gelir, X(i,j) tüm pikselleri ifade eder ve n piksel dizisinin boyutlarını ifade eder, n x n piksel19,26olarak kabul edilebilir . Bu denklemin paydası, iskeletleştirilmiş görüntüden yazıldığı gibi hesaplanan, ancak görüntünün tamamının fiziksel alanını temsil ettiği düşünülebilir toplam piksel sayısını temsil eder.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Bu deneyden elde edilen çıktı, darbe oksimetresinden alınan manuel okumalar, gaz maruziyeti veya OCTA taraması için belirtilen zamanlama ve ham OCTA görüntüleme verilerinden oluşur. BIR OCTA görüntüsü, OCT B-taramaları ve her B-taraması ile ilişkili dekoreş sinyalinden oluşur. Veri parametreleri cihazın özellikleri ile verilir. Merkezi dalga boyuna sahip 1040-1060 nm'lik bir kaynak lazer platformu OCTA makinesi kullanılmıştır. Görüntüler 20 μm enine çözünürlük ve 6,3 m optik eksenel çö...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Metodoloji sadece açıklanan bir gaz solunum provokasyon deneyi için tam bir protokol olduğunu oktama görüntüleme cihazı ve en az rahatsızlık veya risk konu için hiçbir değişiklik ile belirli zaman noktalarında kontrollü bir ortamda bir denek RVR ölçümü sağlar. Bu kurulum, araştırmacının ihtiyaçlarına uygun kolay değişikliklere olanak sağlayacak şekilde açıklanmıştır. Farklı klinik odalarına uyacak ek borular barındırabilir ve şirket içi tüp veya dirsek eklemi gibi bazı unsurlar...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Carl Zeiss Meditec, bu makalenin konusuyla ilgili olarak AHK'ya hibe fonu, ekipman ve mali destek sağlamıştır.
Teşekkürler
Bu çalışma NIH K08EY027006, R01EY030564, UH3NS100614, Carl Zeiss Meditec Inc (Dublin, CA) ve Körlüğü Önlemek Için Araştırmadan Sınırsız Bölüm Finansmanı (New York, NY) tarafından desteklenmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 5% CO2 gas [5% CO2, 21% O2, 74% N2] (Compressed) | Institution Dependent (Praxair) | ||
| Bacdown Disinfectant Detergent | Decon Labs | 8001 | https://deconlabs.com/products/disinfectant-bdd/ |
| Clean-Bor Tubes (35 mm Inner Diameter) | Vacumed | 1011-108 | http://www.vacumed.com/zcom/product/Product.do?compid=27&skuid=1197 |
| Cuff adapter for Douglas bag filling | Vacumed | 22254 | http://www.vacumed.com/zcom/product/Product.do?compid=27&prodid=343 |
| Douglas bag (200 L capacity) | Harvard Apparatus | 500942 | https://www.harvardapparatus.com/douglas-bag.html |
| Elbow Joint (Inner Diameter 19 mm/Outer Diameter 22 mm), Modified in House | |||
| Fingertip Pulse Oximeter (Pro-Series) | CMS | CMS 500DL | https://www.walmart.com/ip/Pro-Series-CMS-500DL-Fingertip-Pulse-Oximeter-Blood-Oxygen-Saturation-Monitor-with-silicon-cover-batteries-and-lanyard/479049154 |
| Gas Delivery Tube (22 mm Inner Diameter) Modified in House | |||
| Gas filling tube (1/8" for compressed gas) | |||
| Hydrogen Peroxide Cleaner Disinfectant Wipes | Clorox Healthcare | 30824 | https://www.cloroxpro.com/products/clorox-healthcare/hydrogen-peroxide-cleaner-disinfectants/?gclid=EAIaIQobChMIk-KG4vi15QIVcRh9Ch0NNwLPEAAYASAAEgJIa_D_BwE&gclsrc=aw.ds |
| Lubricant Eye Drops | Refresh | Refresh Plus | https://www.refreshbrand.com/Products/refresh-plus |
| Manual Directional Control Valves: Three-Way T-Shape Stopcock Type (Inner Diameter 28.6 mm, Outer Diameter 35 mm) | Hans Rudolph | 2100C Series | www.rudolphkc.com |
| Medical O2 (Compressed) | Institution Dependent | ||
| Mouth piece (Silicone, Model #9061) | Hans Rudolph | 602076 | www.rudolphkc.com |
| OCTA Imaging Device (PLEX Elite 9000) | Carl Zeiss Meditec, Dublin, CA, USA | https://www.zeiss.com/meditec/int/product-portfolio/optical-coherence-tomography-devices/plex-elite-9000-swept-source-oct.html | |
| Phenylephrine Hydrochloride Ophthalmic Solution, USP 2.5% | Paragon Bioteck, Inc | NDC 42702-102-15 | https://paragonbioteck.com/products/diagnostics/phenylephrine-hydrochloride-ophthalmic-solution-usp-2-5/ |
| Plastic Nose Clip Sterile Foam CS100 | Sklar Sterile | 96-2951 | https://www.sklarcorp.com/disposables/plastic/plastic-nose-clip-sterile-foam-box-of-100.html |
| Proparacaine Hydrochloride Ophthalmic Solution, USP .5% | Bausch + Lomb | NDC 24208-730-06 | https://www.bausch.com/ecp/our-products/rx-pharmaceuticals/generics |
| Regulator (tank dependent- 5% CO2: Fisherbrand Mulitstage Gas Cylinder Regulators) | Genstar Technologies Company | 10575150 | https://www.fishersci.com/shop/products/fisherbrand-multistage-cylinder-regulators-22/10575150?keyword=true |
| Regulator (tank dependent- Oxygen: Fisherbrand Multistage Gas Cylinder Regulators) | Genstar Technologies Company | 10575145 | https://www.fishersci.com/shop/products/fisherbrand-multistage-cylinder-regulators-22/10575145?keyword=true |
| Rubber Tubing (Inner diameter 19 mm, Outer diameter 27 mm), Made in House | |||
| Sealing tape- Parafilm Wrap (2" Wide) | Cole Parmer | PM992 | https://www.coleparmer.com/i/parafilm-pm992-wrap-2-wide-250-ft-roll/0672050?PubID=VV&persist=True&ip=no&gclid=EAIaIQobChMInY3vqomz5QIVfyCtBh1VSg64EAAYASAAEgJ9n_D_BwE |
| Sterile Alcohol Prep Pads | Medline | MDS090670 | https://www.medline.com/product/Sterile-Alcohol-Prep-Pads/Swab-Pads/Z05-PF03816 |
| Tropicamide Ophthalmic Solution, USP 1% | Akorn | NDC 17478-102-12 | http://www.akorn.com/prod_detail.php?ndc=17478-102-12 |
| Tubing Adapter, Made in House | |||
| Two-way non-rebreathing valve (2600 Series- Inner Diameter 28.6 mm, Outer Diameter 35 mm) | Hans Rudolph | 2600 Series, UM-112078 | www.rudolphkc.com |
Referanslar
- Country, M. W. Retinal metabolism: A comparative look at energetics in the retina. Brain Research. 1672, 50-57 (2017).
- Ashimatey, B. S., Green, K. M., Chu, Z., Wang, R. K., Kashani, A. H. Impaired Retinal Vascular Reactivity in Diabetic Retinopathy as Assessed by Optical Coherence Tomography Angiography. Investigative Ophthalmology & Visual Science. 60 (7), 2468(2019).
- Hickam, J. B. M. D., Frayser, R. P. D. Studies of the Retinal Circulation in Man: Observations on Vessel Diameter, Arteriovenous Oxygen Difference, and Mean Circulation Time. Circulation. 33 (2), 302-316 (1966).
- Dorner, G. T., Garhoefer, G., Zawinka, C., Kiss, B., Schmetterer, L. Response of Retinal Blood Flow to CO2 -Breathing in Humans. European Journal of Ophthalmology. 12 (6), 459-466 (2002).
- Linsenmeier, R. A., Zhang, H. F. Retinal oxygen: from animals to humans. Progress in Retinal and Eye Research. 58, 115-151 (2017).
- Eliakim, M., Mor, I., Michaelson, I. C. Assessment of pharmacologic effects on the retinal circulation of hypertensive subjects by a quantitative method. Microvascular Research. 4 (4), 374-383 (1972).
- Gilmore, E. D., et al. Retinal arteriolar hemodynamic response to an acute hyperglycemic provocation in early and sight-threatening diabetic retinopathy. Microvascular Research. 73 (3), 191-197 (2007).
- Hickam, J. B., Sieker, H. O. Retinal Vascular Reactivity in Patients with Diabetes Mellitus and with Atherosclerosis. Circulation. 22 (2), 243-246 (1960).
- Gilmore, E. D., et al. Retinal Arteriolar Diameter, Blood Velocity, and Blood Flow Response to an Isocapnic Hyperoxic Provocation in Early Sight-Threatening Diabetic Retinopathy. Investigative Ophthalmology & Visual Science. 48 (4), 1744(2007).
- Garhofer, G. Reduced response of retinal vessel diameters to flicker stimulation in patients with diabetes. British Journal of Ophthalmology. 88 (7), 887-891 (2004).
- Felder, A. E., Wanek, J., Blair, N. P., Shahidi, M. Inner Retinal Oxygen Extraction Fraction in Response to Light Flicker Stimulation in Humans. Investigative Ophthalmology & Visual Science. 56 (11), 6633-6637 (2015).
- Rose, K., Flanagan, J. G., Patel, S. R., Cheng, R., Hudson, C. Retinal Blood Flow and Vascular Reactivity in Chronic Smokers. Investigative Ophthalmology & Visual Science. 55 (7), 4266(2014).
- Omae, T., Nagaoka, T., Yoshida, A. Effects of Habitual Cigarette Smoking on Retinal Circulation in Patients With Type 2 Diabetes. Investigative Ophthalmology & Visual Science. 57 (3), 1345(2016).
- Pusparajah, P., Lee, L. H., Abdul Kadir, K. Molecular Markers of Diabetic Retinopathy: Potential Screening Tool of the Future. Frontiers in Physiology. 7, (2016).
- Hammer, M., Vilser, W., Riemer, T., Schweitzer, D. Retinal vessel oximetry-calibration, compensation for vessel diameter and fundus pigmentation, and reproducibility. Journal of Biomedical Optics. 13 (5), 054015(2008).
- Gilmore, E. D., Hudson, C., Preiss, D., Fisher, J. Retinal arteriolar diameter, blood velocity, and blood flow response to an isocapnic hyperoxic provocation. American Journal of Physiology-Heart and Circulatory Physiology. 288 (6), 2912-2917 (2005).
- Duan, A., Bedggood, P. A., Metha, A. B., Bui, B. V. Reactivity in the human retinal microvasculature measured during acute gas breathing provocations. Scientific Reports. 7 (1), 2113(2017).
- Burns, S. A., Elsner, A. E., Sapoznik, K. A., Warner, R. L., Gast, T. J. Adaptive optics imaging of the human retina. Progress in Retinal and Eye Research. 68, 1-30 (2019).
- Kim, A. Y., Chu, Z., Shahidzadeh, A., Wang, R. K., Puliafito, C. A., Kashani, A. H. Quantifying Microvascular Density and Morphology in Diabetic Retinopathy Using Spectral-Domain Optical Coherence Tomography Angiography. Investigative Ophthalmology & Visual Science. 57 (9), (2016).
- Koulisis, N., et al. Quantitative microvascular analysis of retinal venous occlusions by spectral domain optical coherence tomography angiography. PLOS ONE. 12 (4), 0176404(2017).
- Kim, A. Y., et al. Quantifying Retinal Microvascular Changes in Uveitis Using Spectral-Domain Optical Coherence Tomography Angiography. American Journal of Ophthalmology. 171, 101-112 (2016).
- Kashani, A. H., et al. Optical coherence tomography angiography: A comprehensive review of current methods and clinical applications. Progress in Retinal and Eye Research. 60, 66-100 (2017).
- Yu, D. Y., et al. Retinal capillary perfusion: Spatial and temporal heterogeneity. Progress in Retinal and Eye Research. 70, 23-54 (2019).
- Tayyari, F., et al. The Relationship between Retinal Vascular Reactivity and Arteriolar Diameter in Response to Metabolic Provocation. Investigative Ophthalmology & Visual Science. 50 (10), 4814(2009).
- Lu, H., Liu, P., Yezhuvath, U., Cheng, Y., Marshall, O., Ge, Y. MRI Mapping of Cerebrovascular Reactivity via Gas Inhalation Challenges. Journal of Visualized Experiments. (94), e52306(2014).
- Reif, R., Qin, J., An, L., Zhi, Z., Dziennis, S., Wang, R. Quantifying Optical Microangiography Images Obtained from a Spectral Domain Optical Coherence Tomography System. International Journal of Biomedical Imaging. 2012, 1-11 (2012).
- Olafsdottir, O. B., Eliasdottir, T. S., Kristjansdottir, J. V., Hardarson, S. H., Stefánsson, E. Retinal Vessel Oxygen Saturation during 100% Oxygen Breathing in Healthy Individuals. PLOS ONE. 10 (6), 0128780(2015).
- Kiss, B., et al. Retinal Blood Flow during Hyperoxia in Humans Revisited: Concerted Results Using Different Measurement Techniques. Microvascular Research. 64 (1), 75-85 (2002).
- Yezhuvath, U. S., Lewis-Amezcua, K., Varghese, R., Xiao, G., Lu, H. On the assessment of cerebrovascular reactivity using hypercapnia BOLD MRI. NMR in biomedicine. 22 (7), 779-786 (2009).
- Hardarson, S. H., et al. Automatic Retinal Oximetry. Investigative Ophthalmology & Visual Science. 47 (11), 5011(2006).
- Sousa, D. C., Leal, I., Moreira, S., Dionísio, P., Abegão Pinto, L., Marques-Neves, C. Hypoxia challenge test and retinal circulation changes - a study using ocular coherence tomography angiography. Acta Ophthalmologica. 96 (3), 315-319 (2018).
- Slessarev, M., Somogyi, R., Preiss, D., Vesely, A., Sasano, H., Fisher, J. A. Efficiency of oxygen administration: Sequential gas delivery versus "flow into a cone" methods. Critical Care Medicine. 34 (3), 829-834 (2006).
- Gilmore, E. D., Hudson, C., Venkataraman, S. T., Preiss, D., Fisher, J. Comparison of Different Hyperoxic Paradigms to Induce Vasoconstriction: Implications for the Investigation of Retinal Vascular Reactivity. Investigative Ophthalmology & Visual Science. 45 (9), 3207(2004).
- Shahidi, A. M., Patel, S. R., Huang, D., Tan, O., Flanagan, J. G., Hudson, C. Assessment of total retinal blood flow using Doppler Fourier Domain Optical Coherence Tomography during systemic hypercapnia and hypocapnia. Physiological Reports. 2 (7), 12046(2014).
- Maleki, N., et al. The Effect of Hypercarbia and Hyperoxia on the Total Blood Flow to the Retina as Assessed by Magnetic Resonance Imaging. Investigative Ophthalmology & Visual Science. 52 (9), 6867(2011).
- Smit, B., Smulders, Y. M., vander Wouden, J. C., Oudemans-van Straaten, H. M., Spoelstra-de Man, A. M. E. Hemodynamic effects of acute hyperoxia: systematic review and meta-analysis. Critical Care. 22 (1), 45(2018).
- Piccolino, F. P., Cagini, C., Fruttini, D., Nicolò, M., Eandi, C. M., Tito, S. Retinal Vascular Reactivity in Central Serous Chorioretinopathy. Investigative Ophthalmology & Visual Science. 59 (11), 4425(2018).
- Sousa, D. C., et al. A Protocol to Evaluate Retinal Vascular Response Using Optical Coherence Tomography Angiography. Frontiers in Neuroscience. 13, 566(2019).
- Robinson, F., Riva, C. E., Grunwald, J. E., Petrig, B. L., Sinclair, S. H. Retinal Blood Flow Autoregulation in Response to on Acute Increase in Blood Pressure. Investigative Ophthalmology & Visual Science. 27 (5), 5(1986).
- Gherghel, D., Hosking, S. L., Cunliffe, I. A. Abnormal Systemic and Ocular Vascular Response to Temperature Provocation in Primary Open-Angle Glaucoma Patients: A Case for Autonomic Failure. Investigative Ophthalmology & Visual Science. 45 (10), 3546(2004).
- You, Q., et al. Reproducibility of vessel density measurement with Optical Coherence Tomography Angiography in eyes with and without retinopathy. Retina. 37 (8), 1475-1482 (2017).
- Lei, J., et al. Repeatability and Reproducibility of Superficial Macular Retinal Vessel Density Measurements Using Optical Coherence Tomography Angiography En Face Images. JAMA Ophthalmology. 135 (10), 1092(2017).
- Czakó, C., et al. Intrasession and Between-Visit Variability of Retinal Vessel Density Values Measured with OCT Angiography in Diabetic Patients. Scientific Reports. 8 (1), 10598(2018).
- Field, A. S., Laurienti, P. J., Yen, Y. F., Burdette, J. H., Moody, D. M. Dietary Caffeine Consumption and Withdrawal: Confounding Variables in Quantitative Cerebral Perfusion Studies. Radiology. 227 (1), 129-135 (2003).
- Baek, S. U., et al. Diurnal change of retinal vessel density and mean ocular perfusion pressure in patients with open-angle glaucoma. PLOS ONE. 14 (4), 0215684(2019).
- Müller, V. C., Storp, J. J., Kerschke, L., Nelis, P., Eter, N., Alnawaiseh, M. Diurnal variations in flow density measured using optical coherence tomography angiography and the impact of heart rate, mean arterial pressure and intraocular pressure on flow density in primary open-angle glaucoma patients. Acta Ophthalmologica. 97 (6), (2019).
- Sarwar, S., et al. Diurnal variation of choriocapillaris vessel flow density in normal subjects measured using optical coherence tomography angiography. International Journal of Retina and Vitreous. 4 (1), 37(2018).
- Liu, P., De Vis, J. B., Lu, H. Cerebrovascular reactivity (CVR) MRI with CO2 challenge: A technical review. NeuroImage. 187, 104-115 (2019).
- Ting, D. S. W., et al. Optical Coherence Tomographic Angiography in Type 2 Diabetes and Diabetic Retinopathy. JAMA Ophthalmology. 135 (4), 306(2017).
- Spaide, R. F., Fujimoto, J. G., Waheed, N. K., Sadda, S. R., Staurenghi, G. Optical coherence tomography angiography. Progress in retinal and eye research. 64, 1-55 (2018).
- An, D., et al. Quantitative comparisons between optical coherence tomography angiography and matched histology in the human eye. Experimental Eye Research. 170, 13-19 (2018).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır