需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
光相一致性断层扫描血管造影评估的视网膜血管反应
摘要
本文介绍了一种测量视网膜血管反应的方法,该方法使用气体呼吸刺激技术在获取视网膜图像的同时,为人类受试者测量体内视网膜血管反应反应。
摘要
视网膜的血管供应已被证明通过血管收缩和血管扩张动态适应,以适应视网膜的代谢需求。这个过程,称为视网膜血管反应(RVR),由神经血管耦合进行调解,神经血管耦合在视网膜血管疾病(如糖尿病视网膜病变)中很早就受损。因此,一种临床上可行的血管功能评估方法在研究和临床环境中可能都引起很大的兴趣。最近,经FDA批准光学相干断层扫描血管造影(OCTA),这是一种非侵入性、最小风险和无染料血管造影方法,具有毛细血管水平分辨率,从而在毛细管水平上对视网膜血管图进行体内成像。同时,几位研究者也显示了RVR的生理和病理变化。本手稿中所示的方法旨在使用 OCTA 研究 RVR,无需更改临床成像程序或设备。它演示了视网膜和视网膜血管在暴露于高卡普或超氧化物条件下的实时成像。考试在 30 分钟内轻松进行,两名人员在 30 分钟内轻松进行,但主题不适或风险最小。该方法适用于其他眼科成像设备,应用可能因气体混合物和患者群的组成而异。这种方法的一个优势是,它允许在体内的人类受试者的毛细血管功能下研究视网膜血管功能。此方法的局限性主要是 OCTA 和其他视网膜成像方法(包括成像伪像和受限的动态范围)。该方法的结果为视网膜的OCT和OCTA图像。这些图像适用于在商用 OCT 或 OCTA 设备上可能进行的任何分析。然而,一般方法可以适应任何形式的眼科成像。
引言
视网膜的代谢需求取决于由动脉、毛细血管和静脉1调节良好的系统提供的充足和持续的氧气供应。几项研究表明,大口径人类视网膜血管的功能可以在体内评估各种生理22,3,4,53,4,5和药理学66,77刺激。此外,这种血管系统的异常功能在视网膜血管疾病中很常见,如糖尿病视网膜病变,视网膜血管反应性(RVR)即使在其早期阶段88、99通过气体刺激9和闪烁光实验5,5、10、11,11都得到衰减。视网膜血管危险因素,如吸烟也与RVR12和视网膜血流13受损有关。这些发现是重要的,因为视网膜血管疾病的临床症状发生在疾病过程相对较晚,并证明疾病的早期临床标志缺乏14。因此,评估RVR可以为早期评估可能引发或加重视网膜退行性疾病的异常提供有用的血管完整性测量。
以前的RVR实验通常依赖于激光血流计9或装有特殊滤镜15的玻璃相机等设备进行视网膜图像采集。然而,这些技术针对直径较大的血管进行了优化,如Arterioles16和静脉15,这些血管不是气体、微量营养素和分子交换发生的地方。最近的一项研究能够量化毛细血管的RVR使用自适应光学成像17,但尽管提高了空间分辨率,这些图像有一个较小的场大小,并没有FDA批准临床使用18。
光学相干断层扫描血管造影(OCTA)最近出现,为FDA提供了一种经FDA批准的非侵入性和无染料血管造影方法,用于评估人类患者和受试者体内毛细血管水平变化。OCTA在临床实践中被广泛接受,作为评估视网膜血管疾病(如糖尿病视网膜病变19,视网膜静脉闭塞20,血管炎21和许多其他22个)毛细血管灌注损伤的有效工具。因此,OCTA为评估毛细管水平变化提供了绝佳的机会,在临床环境中,毛细管水平变化可有显著的空间和时间异质性23以及病理变化。我们小组最近证明,OCTA可用于量化毛细管2级视网膜血管对灵感氧生理变化的反应,这是视网膜血管收缩刺激16、24,24和二氧化碳,这是视网膜血管扩张刺激33,5。5
本文的目的是描述一种协议,使读者能够使用OCTA评估较小的动脉和毛细管床的视网膜血管反应。这些方法与Lu等人25中介绍的方法进行了调整,后者描述了脑血管反应与磁共振成像的测量。虽然本文采用于OCTA成像2期间开发和使用的方法,但适用于具有相对简单和明显修改的其他视网膜成像设备。
研究方案
这项研究得到了南加州大学机构审查委员会的批准,并遵循了《赫尔辛基宣言》的原则。
1. 气体非再呼吸装置的安装
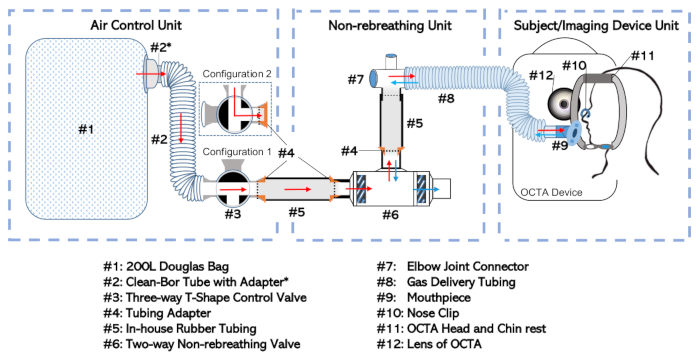
图1:非呼吸器图。完整设置已根据其功能和独立处理的频率分成三个独立的单元。其中包括:空气控制单元、非呼吸单元和主题/成像设备单元,请单击此处查看此图形的较大版本。
-
设备组件
- 通过带适配器(#2*)的35 mm内径管(#2;参见材料表),将道格拉斯袋(图1、#1)连接到选择性进气口的三通阀(#3)。此组合将称为"空气控制单元",如图 1所示。
- 将双向非呼吸阀 (#6) 连接到非呼吸阀口口处的弯头接头 (#7)。使用装有适配器(#4)的橡胶管(#5)形成连接。
- 将弯头接头连接到气体输送管(#8)。此设置,包括非呼吸阀 (#6)、内部管(#5)、适配器(#4)、弯头接头(#7)和气体输送管(#8)将称为"非呼吸单元"。
注:最小化受试者的嘴和双向非呼吸阀(#6)的隔膜之间的死空间量。 - 将三向阀 (#3) 出口口的空气控制单元连接到双向非呼吸阀 (#6) 进气口处的非再呼吸单元。使用额外的橡胶管 (#5) 和适配器 (#4) 进行连接,如前面所述,允许将这些部件插入彼此。
- 用密封胶带包裹接头,密封所有松动的连接,以确保密封配合。
- 将开口端的气体输送管(#8)连接到喉舌(#9),如图1的"主体/成像设备单元"所示。
注:此步骤 (1.1.6) 可以推迟到主题测试准备就绪(步骤 3.5)。
-
气体不呼吸空气控制单元的准备
- 如果空气控制单元尚未分离,则将其与任何内部管(#5)或适配器 (#4)断开,从而隔离空气控制单元。
- 确保道格拉斯袋 (#1) 是空的或空的道格拉斯袋 (#1) 的任何空气,系统地将袋子从远端滚动到袋的进港端口,三向阀 (#3) 设置为配置 1,如图1所示 。
- 用适当的气体混合物填充道格拉斯袋(#1)。
- 如果仅打算进行室空气非呼吸,请将三向阀设置为配置 2(如图 1所示),并且不要填充道格拉斯包(#1)。否则,继续执行包含步骤 1.2.3 的步骤。
- 使用适当的适配器和管将三向阀(#3)出口口的空气控制单元(如图1)连接到气瓶(包含所需的空气混合物)。使用袖口适配器将 1/8" 气体加注管安装到三向阀(#3)的外径上。
- 将三向阀组件设置为配置 1(如图1所示),以便预期气体从存储油缸流入道格拉斯袋(#1)。打开气瓶。
- 一旦道格拉斯袋(#1)充满到预定体积(通常半填充),关闭气瓶出口,并将三向阀设置为配置 2,从而隔离道格拉斯袋中的气体(#1)。断开空气控制单元与用于填充道格拉斯包(#1)的任何管道。
2. 准备成像主题
- 在受试者同意参与研究后,将主题置于 OCTA 成像设备后面。向主题解释测试程序。
- 确认受试者的病史,以确保受试者没有增加参与研究风险的现有医疗条件。
注:预先存在的心血管或肺病是风险因素,受试者可能被排除在参与之外。至关重要的是,受试者必须明白,他们可以随时停止手术的任何原因,如感觉头晕或一些额外的意外不适。 - 根据测试协议确定要评估的眼睛。只能用一只眼睛进行成像,以限制测试时间,并尽量减少气体非呼吸的潜在不适。
- 如果受试者的孔径约为 2.5 mm 或更少,请考虑眼睛扩张。虽然扩张不是强制性的,但它提高了获得高质量图像的机会。要进行调热,将盐酸化蛋白溶液、1%热带酰胺眼科溶液和2.5%盐酸乙酸乙酸眼溶液各加入一滴。完全扩张应在 10-15 分钟内发生。
3. 气体挑衅实验和图像采集
- 在 OCTA 机器中为患者创建配置文件。
- 戴手套。
- 用酒精拭子擦拭 OCTA 头部和下巴,对设置进行消毒。
- 将喉舌(#9)从无菌包装中释放出来。
注:避免尽可能接触喉舌,因为此组件直接接触主体嘴的粘液衬里 - 将喉舌(#9)连接到气体输送管(#8)
- 将脉冲氧仪放在受试者的手指上,开始监测氧饱和度水平和脉搏。
注:一旦受试者开始呼吸所需的空气混合物,脉搏氧仪应持续监测由检查官。如果受试者的氧饱和度降至94%以下,作为安全预防措施,应停止实验,并且受试者观察,直到他们回到基线。 - 调整 OCTA 设置的高度,以便受试者可以轻松地将下巴放在下巴 (#11) 上,而不会过度伸展或弯曲颈部。
- 用喉舌(#9)附件将气体输送管(#8)圈过头部,下巴与面向患者的喉舌(#9)一起休息。让管道循环穿过机器,观察被拍摄对象眼睛的一侧。
- 将喉舌插入患者嘴里。鼓励受试者通过非呼吸装置练习呼吸,以创造对仪器的熟悉。确保受试者深呼吸,以方便气体交换。
- 将鼻夹(#10)放在主体上,以确保它们通过喉舌呼吸。
- 将三向阀保持在配置 2 上,或将其更改为配置 1,具体取决于是否分别获取图像以暴露于室内空气或特定气体混合物。供将来参考,请注意气体吸入的开始时间。
- 让受试者根据为成像选择的眼睛将下巴放在下巴(#11)的右侧或左侧。
- 确保头部向前移动,直到前额与头枕(#11)牢固接触。
- 捕获由测试协议确定的对 OCTA 扫描。在这项研究中,在呼吸1分钟气体后,捕获了三张以福韦亚为中心的3个3毫米×3毫米图像。
- 让主体保持头部向前,同时将目标固定在他们观点的中心
- 在虹膜视图中看到的实时图像中,将扫描居中。
- 使用左右箭头将缝隙移入或移出,使光圈成为焦点。
- 确保叶子凹陷位于 OCT 扫描的中心,默认情况下应发生这种情况。
- 拍摄图像。扫描通常在 OCTA 计算机上持续几秒钟。
- 扫描完成后查看 OCTA 图像,并确保其质量充足。在 OCTA 制造商提供的 10 点刻度上,信号强度应为 7 或更高。
- 选择保存或重新扫描眼睛。
- 重复步骤 3.14.1_3.14.7,因为需要多次扫描。
- 让主体从机器上坐回。不需要用这种气体混合物扫描眼睛时,拆下鼻夹(#10)和喉舌(#9)。
- 在开始CO2气体挑衅实验之前,让受试者休息2分钟。
- 在步骤 1.2 中指定的第一个所需空气混合物(2包括 5% CO 2、21% 氧气和 74% 氮气)填充道格拉斯袋。此步骤后,三向阀将位于配置 2 中。
- 通过将空气控制单元连接到非呼吸单元,完成气体非呼吸装置的设置,如图1所示,步骤 1.1.4 中所述。确保所有接头均用密封胶带密封。
- 重复步骤 3.9_3.14,但现在在步骤 3.11 中定向时,将三向阀设置为配置 1。
- 在 CO2气体挑衅后,给受试者 10 分钟的休息时间,以便返回基线。
- 当主体处于中断时,根据步骤 1.2 将道格拉斯包填 100% O2。
- 重复步骤 3.17~3.18,在 100% O2气体挑衅条件下执行实验。
4. 实验性清理
- 丢弃设置的一次性元素:主体的喉舌(#9)和鼻夹(#10)。
- 用酒精拭子清洁头部和下巴休息(#11)。用消毒抹布擦拭主题椅子、OCTA 桌和 OCTA 手柄,去除任何错误的唾液。
- 将装置断开到三向阀 (#3) 处的基本部件(空气控制单元和非再呼吸单元)。
- 由于从受试者呼出的空气应该到达空气控制单元的元素,因此根据步骤 1.2.2 清空道格拉斯包,并放置在一个位置供将来检索。如果需要,请用适配器 (#2+) 和三向阀(#3)将清洁管(#2)与道格拉斯袋(#3)断开,以便更容易存放。这将完成空气控制单元的清理。
- 断开非呼吸单元的气体输送管(#8)(#7)。断开内部橡胶管 (#5) 和管管适配器 (#4),从双向非呼吸阀 (#6)。然后,通过拆下密封胶带并将零件分开,从弯头接头(#7)中执行相同的操作。
注:通过拆卸双向非呼吸阀以去除内部隔膜以进行额外护理,可以促进双向非呼吸阀的更广泛清洁。 -
准备消毒浴,以清理可重复使用的部件
- 将足够大的容器装满,用适当稀释且混合良好的洗涤剂消毒剂将气体输送管(#8)浸入水中。在这种情况下,用水稀释洗涤剂的比率为1:6425。
- 将气体输送管(#8)、双向非呼吸阀(#6)、肘部接头(#7)、内部橡胶管(#5)和管管适配器(#4)浸泡在准备好的消毒浴中至少 10 分钟。
- 洗完澡后,取出所有部位,用水彻底冲洗。
- 将它们放在干净的台面上的纸巾上,以便进行空气干燥。
- 空气干燥完成后,处理纸巾并放置所有部件存放。
5. OCTA 数据导出和分析
-
OCTA 数据导出
- 通过将选择的可移动媒体设备插入 OCTA 计算机来导出 OCTA 数据。查找主题并扫描感兴趣的主题。
- 选择"导出"可创建一个 zip 文件夹,其中包含可移动媒体设备上的 .bmp 格式感兴趣的数据主体。
-
OCTA 数据分析
- 在实验室计算机上组织 OCTA 数据,能够执行额外的图像分析和处理。
- 使用自定义脚本使用全局阈值技术抑制噪声,并执行其他特征提取。将 OCTA 图像进行双化并骨架化。
- 在经过处理后的图像上,计算容器骨架密度(VSD)19、26,这是一个无维测量的船舶总线性长度的图像,由以下方程计算在OCTA的二分化骨架图像上执行:19,26
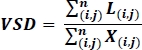
其中 i和j指像素坐标 (i, j), L(i, j)指表示不相关的白色像素, X(i, j)指所有像素, n指像素数组的尺寸, 可以假定为n x n像素19,,26。此方程的分母表示从骨架图像中计算的像素总数,但可以视为表示整个图像的物理区域。
结果
本实验的输出包括从脉冲氧仪获取的手动读数、气体暴露或OCTA扫描的定时以及原始的OCTA成像数据。OCTA 图像由 OCT B 扫描和与每个 B 扫描关联的非相关信号组成。数据参数由设备的规格给出。使用了一台集中波长为1040~1060nm的扫描源激光平台OCTA机。这些图像提供20μm的横向分辨率,光学轴向分辨率为6.3μm。通常,OCTA 数据以 2D 面带格式显示,如代表图 2所示。有许多指标可用?...
讨论
刚才描述的方法是气体呼吸挑衅实验的完整协议,允许在特定时间点的受控环境中测量受试者的RVR,无需修改OCTA成像装置,并且对受试者的不适或风险最小。此设置的描述方式允许轻松修改以满足研究人员的需求。它可以容纳额外的管道,以适应不同的诊所房间和某些元素,如内部管或肘关节可能被省略或替代与其他组件。图 1显示了设置的关键部分(空气控制单元、非呼?...
披露声明
卡尔蔡司麦迪泰克为AHK提供了与本文主题相关的赠款、设备和财政支持。
致谢
这项工作得到了NIH K08EY027006、R01EY030564、UH3NS100614、卡尔蔡司梅迪克公司(加利福尼亚州都柏林)的研究资助和预防失明研究(纽约,纽约)的无限制部门资助。
材料
| Name | Company | Catalog Number | Comments |
| 5% CO2 gas [5% CO2, 21% O2, 74% N2] (Compressed) | Institution Dependent (Praxair) | ||
| Bacdown Disinfectant Detergent | Decon Labs | 8001 | https://deconlabs.com/products/disinfectant-bdd/ |
| Clean-Bor Tubes (35 mm Inner Diameter) | Vacumed | 1011-108 | http://www.vacumed.com/zcom/product/Product.do?compid=27&skuid=1197 |
| Cuff adapter for Douglas bag filling | Vacumed | 22254 | http://www.vacumed.com/zcom/product/Product.do?compid=27&prodid=343 |
| Douglas bag (200 L capacity) | Harvard Apparatus | 500942 | https://www.harvardapparatus.com/douglas-bag.html |
| Elbow Joint (Inner Diameter 19 mm/Outer Diameter 22 mm), Modified in House | |||
| Fingertip Pulse Oximeter (Pro-Series) | CMS | CMS 500DL | https://www.walmart.com/ip/Pro-Series-CMS-500DL-Fingertip-Pulse-Oximeter-Blood-Oxygen-Saturation-Monitor-with-silicon-cover-batteries-and-lanyard/479049154 |
| Gas Delivery Tube (22 mm Inner Diameter) Modified in House | |||
| Gas filling tube (1/8" for compressed gas) | |||
| Hydrogen Peroxide Cleaner Disinfectant Wipes | Clorox Healthcare | 30824 | https://www.cloroxpro.com/products/clorox-healthcare/hydrogen-peroxide-cleaner-disinfectants/?gclid=EAIaIQobChMIk-KG4vi15QIVcRh9Ch0NNwLPEAAYASAAEgJIa_D_BwE&gclsrc=aw.ds |
| Lubricant Eye Drops | Refresh | Refresh Plus | https://www.refreshbrand.com/Products/refresh-plus |
| Manual Directional Control Valves: Three-Way T-Shape Stopcock Type (Inner Diameter 28.6 mm, Outer Diameter 35 mm) | Hans Rudolph | 2100C Series | www.rudolphkc.com |
| Medical O2 (Compressed) | Institution Dependent | ||
| Mouth piece (Silicone, Model #9061) | Hans Rudolph | 602076 | www.rudolphkc.com |
| OCTA Imaging Device (PLEX Elite 9000) | Carl Zeiss Meditec, Dublin, CA, USA | https://www.zeiss.com/meditec/int/product-portfolio/optical-coherence-tomography-devices/plex-elite-9000-swept-source-oct.html | |
| Phenylephrine Hydrochloride Ophthalmic Solution, USP 2.5% | Paragon Bioteck, Inc | NDC 42702-102-15 | https://paragonbioteck.com/products/diagnostics/phenylephrine-hydrochloride-ophthalmic-solution-usp-2-5/ |
| Plastic Nose Clip Sterile Foam CS100 | Sklar Sterile | 96-2951 | https://www.sklarcorp.com/disposables/plastic/plastic-nose-clip-sterile-foam-box-of-100.html |
| Proparacaine Hydrochloride Ophthalmic Solution, USP .5% | Bausch + Lomb | NDC 24208-730-06 | https://www.bausch.com/ecp/our-products/rx-pharmaceuticals/generics |
| Regulator (tank dependent- 5% CO2: Fisherbrand Mulitstage Gas Cylinder Regulators) | Genstar Technologies Company | 10575150 | https://www.fishersci.com/shop/products/fisherbrand-multistage-cylinder-regulators-22/10575150?keyword=true |
| Regulator (tank dependent- Oxygen: Fisherbrand Multistage Gas Cylinder Regulators) | Genstar Technologies Company | 10575145 | https://www.fishersci.com/shop/products/fisherbrand-multistage-cylinder-regulators-22/10575145?keyword=true |
| Rubber Tubing (Inner diameter 19 mm, Outer diameter 27 mm), Made in House | |||
| Sealing tape- Parafilm Wrap (2" Wide) | Cole Parmer | PM992 | https://www.coleparmer.com/i/parafilm-pm992-wrap-2-wide-250-ft-roll/0672050?PubID=VV&persist=True&ip=no&gclid=EAIaIQobChMInY3vqomz5QIVfyCtBh1VSg64EAAYASAAEgJ9n_D_BwE |
| Sterile Alcohol Prep Pads | Medline | MDS090670 | https://www.medline.com/product/Sterile-Alcohol-Prep-Pads/Swab-Pads/Z05-PF03816 |
| Tropicamide Ophthalmic Solution, USP 1% | Akorn | NDC 17478-102-12 | http://www.akorn.com/prod_detail.php?ndc=17478-102-12 |
| Tubing Adapter, Made in House | |||
| Two-way non-rebreathing valve (2600 Series- Inner Diameter 28.6 mm, Outer Diameter 35 mm) | Hans Rudolph | 2600 Series, UM-112078 | www.rudolphkc.com |
参考文献
- Country, M. W. Retinal metabolism: A comparative look at energetics in the retina. Brain Research. 1672, 50-57 (2017).
- Ashimatey, B. S., Green, K. M., Chu, Z., Wang, R. K., Kashani, A. H. Impaired Retinal Vascular Reactivity in Diabetic Retinopathy as Assessed by Optical Coherence Tomography Angiography. Investigative Ophthalmology & Visual Science. 60 (7), 2468 (2019).
- Hickam, J. B. M. D., Frayser, R. P. D. Studies of the Retinal Circulation in Man: Observations on Vessel Diameter, Arteriovenous Oxygen Difference, and Mean Circulation Time. Circulation. 33 (2), 302-316 (1966).
- Dorner, G. T., Garhoefer, G., Zawinka, C., Kiss, B., Schmetterer, L. Response of Retinal Blood Flow to CO2 -Breathing in Humans. European Journal of Ophthalmology. 12 (6), 459-466 (2002).
- Linsenmeier, R. A., Zhang, H. F. Retinal oxygen: from animals to humans. Progress in Retinal and Eye Research. 58, 115-151 (2017).
- Eliakim, M., Mor, I., Michaelson, I. C. Assessment of pharmacologic effects on the retinal circulation of hypertensive subjects by a quantitative method. Microvascular Research. 4 (4), 374-383 (1972).
- Gilmore, E. D., et al. Retinal arteriolar hemodynamic response to an acute hyperglycemic provocation in early and sight-threatening diabetic retinopathy. Microvascular Research. 73 (3), 191-197 (2007).
- Hickam, J. B., Sieker, H. O. Retinal Vascular Reactivity in Patients with Diabetes Mellitus and with Atherosclerosis. Circulation. 22 (2), 243-246 (1960).
- Gilmore, E. D., et al. Retinal Arteriolar Diameter, Blood Velocity, and Blood Flow Response to an Isocapnic Hyperoxic Provocation in Early Sight-Threatening Diabetic Retinopathy. Investigative Ophthalmology & Visual Science. 48 (4), 1744 (2007).
- Garhofer, G. Reduced response of retinal vessel diameters to flicker stimulation in patients with diabetes. British Journal of Ophthalmology. 88 (7), 887-891 (2004).
- Felder, A. E., Wanek, J., Blair, N. P., Shahidi, M. Inner Retinal Oxygen Extraction Fraction in Response to Light Flicker Stimulation in Humans. Investigative Ophthalmology & Visual Science. 56 (11), 6633-6637 (2015).
- Rose, K., Flanagan, J. G., Patel, S. R., Cheng, R., Hudson, C. Retinal Blood Flow and Vascular Reactivity in Chronic Smokers. Investigative Ophthalmology & Visual Science. 55 (7), 4266 (2014).
- Omae, T., Nagaoka, T., Yoshida, A. Effects of Habitual Cigarette Smoking on Retinal Circulation in Patients With Type 2 Diabetes. Investigative Ophthalmology & Visual Science. 57 (3), 1345 (2016).
- Pusparajah, P., Lee, L. H., Abdul Kadir, K. Molecular Markers of Diabetic Retinopathy: Potential Screening Tool of the Future. Frontiers in Physiology. 7, (2016).
- Hammer, M., Vilser, W., Riemer, T., Schweitzer, D. Retinal vessel oximetry-calibration, compensation for vessel diameter and fundus pigmentation, and reproducibility. Journal of Biomedical Optics. 13 (5), 054015 (2008).
- Gilmore, E. D., Hudson, C., Preiss, D., Fisher, J. Retinal arteriolar diameter, blood velocity, and blood flow response to an isocapnic hyperoxic provocation. American Journal of Physiology-Heart and Circulatory Physiology. 288 (6), 2912-2917 (2005).
- Duan, A., Bedggood, P. A., Metha, A. B., Bui, B. V. Reactivity in the human retinal microvasculature measured during acute gas breathing provocations. Scientific Reports. 7 (1), 2113 (2017).
- Burns, S. A., Elsner, A. E., Sapoznik, K. A., Warner, R. L., Gast, T. J. Adaptive optics imaging of the human retina. Progress in Retinal and Eye Research. 68, 1-30 (2019).
- Kim, A. Y., Chu, Z., Shahidzadeh, A., Wang, R. K., Puliafito, C. A., Kashani, A. H. Quantifying Microvascular Density and Morphology in Diabetic Retinopathy Using Spectral-Domain Optical Coherence Tomography Angiography. Investigative Ophthalmology & Visual Science. 57 (9), (2016).
- Koulisis, N., et al. Quantitative microvascular analysis of retinal venous occlusions by spectral domain optical coherence tomography angiography. PLOS ONE. 12 (4), 0176404 (2017).
- Kim, A. Y., et al. Quantifying Retinal Microvascular Changes in Uveitis Using Spectral-Domain Optical Coherence Tomography Angiography. American Journal of Ophthalmology. 171, 101-112 (2016).
- Kashani, A. H., et al. Optical coherence tomography angiography: A comprehensive review of current methods and clinical applications. Progress in Retinal and Eye Research. 60, 66-100 (2017).
- Yu, D. Y., et al. Retinal capillary perfusion: Spatial and temporal heterogeneity. Progress in Retinal and Eye Research. 70, 23-54 (2019).
- Tayyari, F., et al. The Relationship between Retinal Vascular Reactivity and Arteriolar Diameter in Response to Metabolic Provocation. Investigative Ophthalmology & Visual Science. 50 (10), 4814 (2009).
- Lu, H., Liu, P., Yezhuvath, U., Cheng, Y., Marshall, O., Ge, Y. MRI Mapping of Cerebrovascular Reactivity via Gas Inhalation Challenges. Journal of Visualized Experiments. (94), e52306 (2014).
- Reif, R., Qin, J., An, L., Zhi, Z., Dziennis, S., Wang, R. Quantifying Optical Microangiography Images Obtained from a Spectral Domain Optical Coherence Tomography System. International Journal of Biomedical Imaging. 2012, 1-11 (2012).
- Olafsdottir, O. B., Eliasdottir, T. S., Kristjansdottir, J. V., Hardarson, S. H., Stefánsson, E. Retinal Vessel Oxygen Saturation during 100% Oxygen Breathing in Healthy Individuals. PLOS ONE. 10 (6), 0128780 (2015).
- Kiss, B., et al. Retinal Blood Flow during Hyperoxia in Humans Revisited: Concerted Results Using Different Measurement Techniques. Microvascular Research. 64 (1), 75-85 (2002).
- Yezhuvath, U. S., Lewis-Amezcua, K., Varghese, R., Xiao, G., Lu, H. On the assessment of cerebrovascular reactivity using hypercapnia BOLD MRI. NMR in biomedicine. 22 (7), 779-786 (2009).
- Hardarson, S. H., et al. Automatic Retinal Oximetry. Investigative Ophthalmology & Visual Science. 47 (11), 5011 (2006).
- Sousa, D. C., Leal, I., Moreira, S., Dionísio, P., Abegão Pinto, L., Marques-Neves, C. Hypoxia challenge test and retinal circulation changes - a study using ocular coherence tomography angiography. Acta Ophthalmologica. 96 (3), 315-319 (2018).
- Slessarev, M., Somogyi, R., Preiss, D., Vesely, A., Sasano, H., Fisher, J. A. Efficiency of oxygen administration: Sequential gas delivery versus "flow into a cone" methods. Critical Care Medicine. 34 (3), 829-834 (2006).
- Gilmore, E. D., Hudson, C., Venkataraman, S. T., Preiss, D., Fisher, J. Comparison of Different Hyperoxic Paradigms to Induce Vasoconstriction: Implications for the Investigation of Retinal Vascular Reactivity. Investigative Ophthalmology & Visual Science. 45 (9), 3207 (2004).
- Shahidi, A. M., Patel, S. R., Huang, D., Tan, O., Flanagan, J. G., Hudson, C. Assessment of total retinal blood flow using Doppler Fourier Domain Optical Coherence Tomography during systemic hypercapnia and hypocapnia. Physiological Reports. 2 (7), 12046 (2014).
- Maleki, N., et al. The Effect of Hypercarbia and Hyperoxia on the Total Blood Flow to the Retina as Assessed by Magnetic Resonance Imaging. Investigative Ophthalmology & Visual Science. 52 (9), 6867 (2011).
- Smit, B., Smulders, Y. M., vander Wouden, J. C., Oudemans-van Straaten, H. M., Spoelstra-de Man, A. M. E. Hemodynamic effects of acute hyperoxia: systematic review and meta-analysis. Critical Care. 22 (1), 45 (2018).
- Piccolino, F. P., Cagini, C., Fruttini, D., Nicolò, M., Eandi, C. M., Tito, S. Retinal Vascular Reactivity in Central Serous Chorioretinopathy. Investigative Ophthalmology & Visual Science. 59 (11), 4425 (2018).
- Sousa, D. C., et al. A Protocol to Evaluate Retinal Vascular Response Using Optical Coherence Tomography Angiography. Frontiers in Neuroscience. 13, 566 (2019).
- Robinson, F., Riva, C. E., Grunwald, J. E., Petrig, B. L., Sinclair, S. H. Retinal Blood Flow Autoregulation in Response to on Acute Increase in Blood Pressure. Investigative Ophthalmology & Visual Science. 27 (5), 5 (1986).
- Gherghel, D., Hosking, S. L., Cunliffe, I. A. Abnormal Systemic and Ocular Vascular Response to Temperature Provocation in Primary Open-Angle Glaucoma Patients: A Case for Autonomic Failure. Investigative Ophthalmology & Visual Science. 45 (10), 3546 (2004).
- You, Q., et al. Reproducibility of vessel density measurement with Optical Coherence Tomography Angiography in eyes with and without retinopathy. Retina. 37 (8), 1475-1482 (2017).
- Lei, J., et al. Repeatability and Reproducibility of Superficial Macular Retinal Vessel Density Measurements Using Optical Coherence Tomography Angiography En Face Images. JAMA Ophthalmology. 135 (10), 1092 (2017).
- Czakó, C., et al. Intrasession and Between-Visit Variability of Retinal Vessel Density Values Measured with OCT Angiography in Diabetic Patients. Scientific Reports. 8 (1), 10598 (2018).
- Field, A. S., Laurienti, P. J., Yen, Y. F., Burdette, J. H., Moody, D. M. Dietary Caffeine Consumption and Withdrawal: Confounding Variables in Quantitative Cerebral Perfusion Studies. Radiology. 227 (1), 129-135 (2003).
- Baek, S. U., et al. Diurnal change of retinal vessel density and mean ocular perfusion pressure in patients with open-angle glaucoma. PLOS ONE. 14 (4), 0215684 (2019).
- Müller, V. C., Storp, J. J., Kerschke, L., Nelis, P., Eter, N., Alnawaiseh, M. Diurnal variations in flow density measured using optical coherence tomography angiography and the impact of heart rate, mean arterial pressure and intraocular pressure on flow density in primary open-angle glaucoma patients. Acta Ophthalmologica. 97 (6), (2019).
- Sarwar, S., et al. Diurnal variation of choriocapillaris vessel flow density in normal subjects measured using optical coherence tomography angiography. International Journal of Retina and Vitreous. 4 (1), 37 (2018).
- Liu, P., De Vis, J. B., Lu, H. Cerebrovascular reactivity (CVR) MRI with CO2 challenge: A technical review. NeuroImage. 187, 104-115 (2019).
- Ting, D. S. W., et al. Optical Coherence Tomographic Angiography in Type 2 Diabetes and Diabetic Retinopathy. JAMA Ophthalmology. 135 (4), 306 (2017).
- Spaide, R. F., Fujimoto, J. G., Waheed, N. K., Sadda, S. R., Staurenghi, G. Optical coherence tomography angiography. Progress in retinal and eye research. 64, 1-55 (2018).
- An, D., et al. Quantitative comparisons between optical coherence tomography angiography and matched histology in the human eye. Experimental Eye Research. 170, 13-19 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。