Method Article
التحكم في مورفولوجيا البوليمر المغزول كهربائيا لهندسة الأنسجة الذي تم إثباته باستخدام خط خلية hepG2
In This Article
Summary
توفر هذه الطريقة الوسائل لاختبار أشكال ألياف بولي كابرولاكتون المختلفة وطبوغرافيا لغرض هندسة الأنسجة. يتم تصنيع الألياف الصغيرة والكبيرة باتجاهات عشوائية ، واتجاهات محاذاة ، وكذلك هياكل مسامية مغزولة كهربائيا بالتبريد وتستخدم كمنصات لزراعة الخلايا.
Abstract
يتيح الغزل الكهربائي للباحثين الفرصة لتصنيع ألياف بوليمر دقيقة إلى نانوية قابلة للتكرار. تعتبر البنية الليفية ثلاثية الأبعاد للبوليمرات الكهربائية تقليد هيكلي للمصفوفة خارج الخلية (ECM). ومن ثم ، فقد تم التحقيق في الألياف الكهربائية المصنعة من البوليمرات المتوافقة حيويا على نطاق واسع من قبل باحثي هندسة الأنسجة لدورها المحتمل كوحدة كهربية مركزية اصطناعية لتوجيه نمو الأنسجة في المختبر وفي الجسم الحي. جميع الخلايا حساسة بشكل حاد لبيئتها الميكانيكية. وقد ثبت ذلك من خلال اكتشاف مسارات متعددة للنقل الميكانيكي مرتبطة ارتباطا جوهريا بخيوط الأكتين الهيكلية الخلوية. يعمل الهيكل الخلوي كجهاز استشعار ميكانيكي يمكنه توجيه وظائف الخلية المضيفة وتمايزها اعتمادا على صلابة وتشكل ركيزتها. يمكن ضبط الألياف الكهربائية من حيث حجم الألياف والتشكل لتعديل البيئة الميكانيكية بسهولة داخل سقالة بوليمر ليفية. هنا ، يتم وصف طرق الغزل الكهربائي بولي كابرولاكتون (PCL) لثلاثة أشكال متميزة بقطرين مختلفين من الألياف. تتكون فئات الألياف المورفولوجية من ألياف موجهة عشوائيا ، وألياف محاذاة ، وألياف مسامية مغزولة بالتبريد ، بأقطار 1 ميكرومتر و 5 ميكرومتر. تم اقتراح الطرق المفصلة في هذه الدراسة كمنصة للتحقيق في تأثير بنية الألياف الكهربائية على توليد الأنسجة. سيسمح فهم هذه التأثيرات للباحثين بتحسين الخواص الميكانيكية للألياف الكهربائية وإظهار إمكانات هذه التكنولوجيا بشكل أكثر شمولا.
Introduction
تطورت طرق هندسة الأنسجة على مدى العقود الأخيرة لتزويد الخلايا ببيئة محاكاة حيوية من أجل تشجيع تجديد الأنسجة بنجاح ، سواء لنماذج الأنسجة في المختبر أو لتقنيات التجدد في الجسم الحي. تشجع هذه الطرق عادة الخلايا على تكوين مجاميع ثلاثية الأبعاد ، إما بمفردها أو باستخدام سقالة توجيهية1. يمكن تصنيع السقالات على شكل هياكل نانوية / مجهرية من البوليمر المسامية أو الليفية ، أو كهيدروجيلات عالية الامتصاص للماء2،3،4. الغزل الكهربائي للبوليمر هو تقنية تصنيع شائعة تنتج مصفوفات ألياف بوليمر نانوية غير منسوجة يمكنها محاكاة البنية الليفية للمصفوفة الأصلية خارج الخلية (ECM)5. العديد من البوليمرات المتوافقة حيويا قابلة للتطبيق على عملية الغزل الكهربائي. ومن ثم ، فإن الألياف المغزولة كهربائيا هي وسيلة شائعة لتسهيل تجديد الأنسجة6،7،8. تم استخدام الألياف الكهربائية في زراعة مجموعة من الأنسجة ، مما يدل على وسيلة واعدة لمنصات السقالات غير المكلفة والقابلة للتكرار9،10،11،12،13.
الخلايا لديها حساسية حادة تجاه محيطها الميكانيكي. سلطت الأبحاث السابقة الضوء على هذه العلاقة المهمة ، التي تسمى النقل الميكانيكي ، والتي يمكن أن تؤثر على وظيفة الخلية ، ومورفولوجيا ، والتمايز14،15. يتكون أساس الهيكل الخلوي حقيقيات النواة من الأكتين الخيطي ويلعب أدوارا ميكانيكية رئيسية في الانقسام الخلوي والالتصاق والهجرة والانكماش والتشكل. يتم التلاعب به بواسطة محفزات ميكانيكية خارجية عن طريق الاتصال بالبروتينات السطحية خارج الخلية16،17،18. تم إثبات التأثير المورفولوجي على تمايز الخلايا الجذعية في العديد من الدراسات عن طريق تغيير شكل الركيزة القابلة للربط ، والتي تكون قادرة بعد ذلك على التحكم في شكل الخلية وتوجيه عملية التمايز19،20. علاوة على ذلك ، فإن صلابة الركيزة التي ترتبط بها الخلايا تؤثر أيضا على مصير الخلايا الجذعية والنسب21،22. بصرف النظر عن الخلايا الجذعية ، لوحظ أيضا أن هذه التأثيرات تؤثر على الخلايا من سلالات مختلفة23،24. أظهرت طرق هندسة الأنسجة ثلاثية الأبعاد نتائج مشابهة لتلك الموجودة في دراسات النقل الميكانيكي ثنائية الأبعاد مع كل من الهلاميات المائية والسقالات الليفية25،26،27. علاوة على ذلك ، يتم توصيل ميكانيكا الركيزة من خلال مجاميع الخلايا ثلاثية الأبعاد عبر إشارات الخليةالخلوية 28. تلعب ميكانيكا المواد دورا مهما في توجيه الوظائف الخلوية ، وبالتالي يجب أن تكون عاملا رئيسيا في تصميم السقالات للأنسجة الهندسية.
الهدف من هذه الطريقة هو فهم تأثيرات حجم ألياف بولي كابرولاكتون (PCL) ومورفولوجيا على مزارع الخلايا في المختبر. تم تكييف الطريقة من الأبحاث السابقة التي ركزت على هندسة أنسجةالكلى 9. يتم تقديم بروتوكول أكثر تفصيلا خطوة بخطوة هنا من أجل تسهيل إعادة بناء السقالة وتطوير طريقة موحدة تنطبق على جميع أنواع الخلايا. تم بناء ست مجموعات من السقالات بهذه الطريقة: ثلاث منها ألياف كبيرة 5 ميكرومتر (LG) وثلاثة ألياف صغيرة أخرى 1 ميكرومتر (SM) ، باستخدام تركيزات PCL مختلفة. يوجد ضمن مجموعات LG و SM هذه ثلاثة تركيبات مورفولوجية مختلفة: الألياف العشوائية (RA) ، والألياف المحاذاة (AL) ، والألياف المبردة المسامية (CR). تحتوي مجموعات السقالات هذه على هياكل مختلفة بطبيعتها ، وبالتالي توفر بيئات ميكانيكية محلية فريدة تلتصق بها الخلايا. لإثبات التأثير المورفولوجي الذي يقدمه هذا للخلايا ، تم زرع خط خلية hepG2 على كل مجموعة من السقالات كدراسة تمثيلية. يتم تقديم هذه الطريقة كتحليل أساسي لتصميم سقالة كهربائية لجميع أنواع الخلايا من الخلايا الجذعية إلى خطوط الخلايا والخلايا الأولية.
Protocol
1. إعداد الحل
- ألياف كبيرة (عشوائية ومحاذاة ومبردة)
- قم بإعداد نسبة 5: 1 من الكلوروفورم والميثانول عن طريق خلط 50 مل من الكلوروفورم و 10 مل من الميثانول في زجاجة زجاجية مقاومة للمذيبات باستخدام ماصة زجاجية مصلية.
تنبيه: الكلوروفورم والميثانول مذيبان سامان ويجب إجراء الخلط في غطاء الدخان. - لإنشاء محلول 19 واط / حجم ٪ من PCL في الكلوروفورم 5: 1: الميثانول ، قم بوزن 1.9 جم من PCL وأضفه إلى 10 مل من الكلوروفورم 5: 1: الميثانول في قارورة زجاجية مقاومة للمذيبات. أغلق القارورة مرتين باستخدام فيلم البارافين واترك القارورة على الأسطوانة طوال الليل للسماح ل PCL بالذوبان تماما.
تنبيه: يجب إجراء الخلط في غطاء الدخان.
- قم بإعداد نسبة 5: 1 من الكلوروفورم والميثانول عن طريق خلط 50 مل من الكلوروفورم و 10 مل من الميثانول في زجاجة زجاجية مقاومة للمذيبات باستخدام ماصة زجاجية مصلية.
- ألياف صغيرة (عشوائية ومحاذاة)
- لتحضير محلول 7 واط / حجم ٪ من PCL في سداسي فلورو إيزوبروبانول (HFIP) ، قم بوزن 0.7 جم من PCL واخلطه مع 10 مل من HFIP في قارورة زجاجية مقاومة للمذيبات. أغلق القارورة مرتين باستخدام فيلم البارافين واتركها على الأسطوانة طوال الليل للسماح ل PCL بالذوبان تماما.
تنبيه: HFIP شديد السمية ويجب إجراء الخلط في غطاء الدخان.
- لتحضير محلول 7 واط / حجم ٪ من PCL في سداسي فلورو إيزوبروبانول (HFIP) ، قم بوزن 0.7 جم من PCL واخلطه مع 10 مل من HFIP في قارورة زجاجية مقاومة للمذيبات. أغلق القارورة مرتين باستخدام فيلم البارافين واتركها على الأسطوانة طوال الليل للسماح ل PCL بالذوبان تماما.
- ألياف مبردة صغيرة
تنبيه: يجب إجراء الخلط في غطاء الدخان.- قم بإعداد نسبة 3: 1 من الكلوروفورم والميثانول عن طريق خلط 30 مل من الكلوروفورم و 10 مل من الميثانول في زجاجة زجاجية مقاومة للمذيبات باستخدام ماصة مصلية زجاجية.
- لإنشاء محلول 14 واط / حجم ٪ من PCL في 3: 1 الكلوروفورم: الميثانول ، قم بوزن 1.4 جم من PCL وأضفه إلى 10 مل من الكلوروفورم 3: 1: الميثانول في قارورة زجاجية مقاومة للمذيبات. أغلق القارورة مرتين باستخدام فيلم البارافين واتركها على الأسطوانة طوال الليل للسماح ل PCL بالذوبان تماما.
2. إعداد الغزل الكهربائي
ملاحظة: يجب ضبط المعلمات قبل البدء في عملية الغزل الكهربائي.
- حجم الإبرة ووضعها
- بالنسبة للألياف الكبيرة (العشوائية والمحاذاة والمبردة) ، استخدم إبرة نحاسية 1 مم OD / 0.8 مم وضع الإبرة على بعد 230 مم من سطح المغزل.
- بالنسبة للألياف الصغيرة ، استخدم إبرة نحاسية مقاس 1 مم OD / 0.4 مم وضع الإبرة على بعد 15 مم من سطح المغزل.
- حركة الإبرة الجانبية
ملاحظة: تم تصنيع السقالات المفصلة في الشكل 1 بإبرة اجتياز 100 مم بسرعة 50 مم / ثانية ، مع حركة متكررة إلى اليسار واليمين طوال العملية.- لضبط الحركة الجانبية ، اضغط على الحركة | TNS 1 واضبط موضع البدء [مم] على -50، والمسافة [مم] إلى 100، والسرعة [مم/ثانية] إلى 50 وتأخير الدوران [مللي ثانية] إلى 750.
- معدل تدفق مضخة الحقنة
- بالنسبة للألياف الكبيرة (العشوائية والمحاذاة والمبردة) ، اضغط على علامة التبويب Material في واجهة المستخدم واضبط مضخة الحقنة على 4 مل / ساعة.
- بالنسبة للألياف الصغيرة (العشوائية والمحاذاة) ، اضبط مضخة الحقنة على 0.8 مل / ساعة.
- بالنسبة للألياف المبردة الصغيرة ، اضبط مضخة الحقنة على 2.5 مل / ساعة.
- إعدادات الجهد
- بالنسبة للألياف الكبيرة ، اضبط جهد الإبرة على +15 كيلو فولت وجهد المغزل عند -4 كيلو فولت عن طريق الضغط على علامة التبويب الجهد في واجهة المستخدم وتغيير قيم الجهد الموجب والسالب.
- بالنسبة للألياف الصغيرة (العشوائية والمحاذاة) ، اضبط جهد الإبرة على +17 كيلو فولت وجهد المغزل عند -4 كيلو فولت.
- بالنسبة للألياف المبردة الصغيرة ، اضبط جهد الإبرة على +18 كيلو فولت وجهد المغزل عند -4 كيلو فولت.
- دوران مغزل (ألياف كبيرة وصغيرة)
- للألياف العشوائية ، اضغط على الحركة | استهدف واضبط سرعة دوران المغزل على 250 دورة في الدقيقة.
- بالنسبة للألياف المحاذاة ، اضبط سرعة دوران المغزل على 1,800 دورة في الدقيقة.
- بالنسبة للألياف المبردة ، اضبط سرعة دوران المغزل على 180 دورة في الدقيقة.
3. الغزل الكهربائي للألياف العشوائية والمحاذاة (الألياف الكبيرة والصغيرة)
- أدخل الإبرة (راجع القسم 2.1 للحصول على معلومات حول حجم الإبرة وموضعها) في أنبوب PTFE ذو تجويف 1 مم وقم بتثبيته داخل حامل الإبرة الكهربائي.
- تحت غطاء الدخان ، انقل 10 مل من محلول البوليمر إلى حقنة بولي بروبيلين أو زجاج (مقاوم للمذيبات). تأكد من إزالة أي فقاعات عن طريق ترك المحقنة تقف قبل التحضير.
- قم بتوصيل المحقنة بالإبرة عبر أنبوب PTFE وقم بتأمين المحقنة داخل مضخة المحقنة. بمجرد الاتصال ، قم بتجهيز أنبوب PTFE عن طريق الضغط على مكبس المحقنة وملء الأنبوب بمحلول البوليمر.
- لف المغزل بورق الألمنيوم وثبته على جهاز دوران المغزل.
- قم بتشغيل دوران المغزل بالضغط على الحركة | الهدف | قم بتدوير مضخة الحقنة بالضغط على المواد | ابدأ المضخة 1.
- عندما تتشكل حبة صغيرة من البوليمر في نهاية الإبرة ، قم بتشغيل الجهد بالضغط على تنشيط الجهد العالي. يجب بعد ذلك أن تنبعث نفاثة من البوليمر من نتوء مخروطي لمحلول البوليمر ، يسمى مخروط تايلور. افحص المغزل لتأكيد ترسب الألياف على سطح المغزل.
- قم بتشغيل عملية الغزل الكهربائي حتى يتم الكمية المطلوبة من محلول PCL بالكهرباء.
ملاحظة: بالنسبة للسقالات المعروضة في الشكل 1 ، تم غزل 4 مل من المحلول. - بمجرد انتهاء الغزل الكهربائي ، قم بإزالة ورق الألمنيوم المغطى بالألياف من المغزل واتركه في خزانة الدخان طوال الليل للسماح بتبخر المذيبات الزائدة.
- بعد التبخر ، قم بتخزين الألياف في درجة حرارة الغرفة (RT).
4. الغزل الكهربائي للألياف المبردة
- للغزل الكهربائي المبرد ، استخدم مغزل الغزل بالتبريد. كرر الخطوات 3.1-3.3 ثم تابع الخطوات التالية.
- لف المغزل بورق الألمنيوم.
- املأ المغزل بحبيبات الثلج الجاف. قم بتثبيت غطاء مغزل الغزل بالتبريد على المغزل للتأكد من أن الثلج الجاف لا يمكنه الهروب من المغزل ولكن الضغط يمكن أن يهرب. يجب أن تتشكل بلورات الجليد على سطح المغزل على الفور تقريبا.
تنبيه: استخدم القفازات الواقية عند التعامل مع الثلج الجاف لتجنب الحروق الباردة. - قم بتثبيت المغزل على جهاز تدوير المغزل وقم بتشغيل دوران المغزل على الفور بالضغط على الحركة | الهدف | قم بتدوير مضخة الحقنة بالضغط على المواد | ابدأ المضخة 1.
- بمجرد تشكيل حبة من البوليمر في نهاية الإبرة ، قم بتشغيل الجهد بالضغط على تنشيط الجهد العالي. يجب بعد ذلك أن تنبعث نفاثة من البوليمر من نتوء مخروطي لمحلول البوليمر (أي مخروط تايلور). افحص المغزل لتأكيد ترسب الألياف على سطح المغزل.
- بعد 1 ساعة من الغزل الكهربائي ، أوقف العملية مؤقتا بالضغط على STOP ALL وقم بتعبئة المغزل بالثلج الجاف. تأكد من الحماية الكافية من بخار المذيبات أثناء إعادة تعبئة المغزل. قم بإجراء ذلك لمدة 3x لمدة 4 ساعات من وقت الغزل الكهربائي.
ملاحظة: يمكن استئناف الغزل الكهربائي بتكرار الخطوتين 4.4 و 4.5. - بمجرد انتهاء الغزل الكهربائي ، قم بإزالة المغزل بعناية وضعه على الفور في مجفف التجميد لمدة 24 ساعة لتسامي بلورات الجليد على سطح المغزل.
- بعد التسامي ، قم بإزالة الرقاقة المغطاة بالألياف من المغزل وتخزينها في RT ، مع الحرص على تجنب التكسير.
5. اللكم السقالة
- قم بثقب السقالات من ورقة الألياف باستخدام لكمة خزعة مقاس 10-12 مم. إذا ظلت الألياف ملتصقة بورق الألمنيوم ، ضع السقالات في 70٪ من الإيثانول لتسهيل الانفصال.
6. التعقيم وطلاء البلازما
- ضع السقالات (1 سقالة لكل بئر) في طبق 24 أو 48 بئر واغسلها 3 مرات في 70٪ إيثانول. اتركيه مغمورا في الغسيل النهائي ، وضعيه في فريزر -80 درجة مئوية ، واتركيه يتجمد.
- بمجرد التجميد ، ضع الطبق في مجفف التجميد وقم بتجفيده لمدة 24 ساعة. يمكن الآن طلاء السقالات المجففة بالبلازما.
ملاحظة: إذا لم يكن هناك وصول إلى طلاء البلازما ، فقم بغمر السقالات في 1٪ مضاد حيوي ومضاد للفطريات (مضاد للفطريات) في محلول ملحي مخزن بالفوسفات (PBS) واتركه لتحتضن عند 37 درجة مئوية طوال الليل. - ضع اللوحة في حجرة البلازما وقم بإزالة الغطاء. قم بتشغيل آلة طلاء البلازما بقوة 500 mTorr وطاقة تردد راديوي متوسط (RF) لمدة 30 ثانية.
- بعد طلاء البلازما ، اغمر السقالات في 1 مل من PBS و 1٪ Anti-Anti. يجب أن تمتص السقالات محلول PBS بسهولة.
ملاحظة: السقالات جاهزة الآن للبذر بالخلايا.
7. تحضير وبذر الخلايا
ملاحظة: تقنية زراعة الخلايا الأساسية الواردة أدناه مخصصة لخلايا hepg2 المستخدمة لأغراض العرض التوضيحي في النتائج التمثيلية. يمكن تطبيق هذه المبادئ على أي نوع من الخلايا الملتصقة. ومع ذلك ، قد تتطلب الخلايا المختلفة مواد مختلفة وعمليات مختلفة. يجب أن يتم التعامل مع الخلايا في خزانة السلامة البيولوجية ، باتباع تقنية التعقيم.
- خذ 1 × 106 خلايا سداعي السويساج 2 المحفوظة بالتبريد والبذور في قارورة زراعة خلايا T75 مع 12 مل من الوسائط الكاملة التي تتكون من الحد الأدنى من الوسائط الأساسية (EMEM) من Eagle مع 10٪ مصل بقري للجنين ، و 100 وحدة / مل من البنسلين والستربتومايسين ، و 5 ملي من الجلوتامين ، و 1٪ من الأحماض الأمينية غير الأساسية.
- بمجرد أن تصل الخلايا إلى 80٪ من التقاء ، افصل الخلايا عن قارورة المزرعة عن طريق غسل 3x في PBS واحتضانها في 2 مل من التربسين عند 37 درجة مئوية لمدة 4 دقائق. بعد النقر على القارورة ، يجب فصل الخلايا.
- قم بإلغاء تنشيط التربسين عن طريق إضافة 8 مل من الوسائط الكاملة. انقل معلق الخلية إلى أنبوب سعة 15 مل وقم بتدوير الخلايا في جهاز طرد مركزي عند 120 × جم لمدة 5 دقائق.
- قم بإزالة المادة الطافية فوق حبيبات الخلية بماصة شفاطية واستبدلها ب 5 مل من الوسائط الكاملة. أعد تعليق الخلايا عن طريق سحب العينات لأعلى ولأسفل باستخدام ماصة مصلية سعة 5 مل.
- احسب تعليق الخلية الناتج عبر طريقة استبعاد التريبان الأزرق. خذ 100 ميكرولتر من تعليق الخلية وأضفه إلى 100 ميكرولتر من التريبان الأزرق في قارورة سعة 1.5 مل. أدخل الخليط على مقياس كثافة الدم تحت غطاء زجاجي واحسب الخلايا تحت المجهر.
- اضبط تركيز الخلية على 2.6 × 106 خلايا / مل عن طريق إضافة أو إزالة وسائط كاملة. لإزالة الوسائط ، خلايا الطرد المركزي عند 220 × جم لمدة 5 دقائق ، قم بإزالة الوسائط المطلوبة ، وإعادة تعليق الخلايا.
- استنشق 1٪ Anti-Anti في PBS من لوحة البئر وبذرة 50 ميكرولتر من 2.6 × 106 خلايا / مل معلق الخلية على سطح السقالة باستخدام ماصة 200 ميكرولتر.
- اسمح للخلايا بالالتصاق تحت الحضانة عند 37 درجة مئوية و 5٪ ثاني أكسيد الكربون2 لمدة 1-3 ساعة ، مع التأكد من عدم جفافها. بمجرد توصيلها ، أضف 300 ميكرولتر (للوحة 48 بئر) أو 500 ميكرولتر (للوحة 24 بئر) من وسط الاستزراع واحتضانها عند 37 درجة مئوية و 5٪ ثاني أكسيدالكربون 2.
ملاحظة: يمكن استخدام تقنيات زراعة الخلايا القياسية من هنا حتى مزيد من التحليل الوظيفي.
النتائج
يوضح الشكل 1 صور المجهر الإلكتروني الماسح (SEM) لكل من الألياف الصغيرة (~ 1 ميكرومتر) والكبيرة (~ 5 ميكرومتر) المصنعة من محاليل PCL. كانت الألياف مطلية بالرش بالذهب البلاديوم (60:40) لمدة 30 ثانية باستخدام طلاء الرش قبل تصوير SEM. تم إنتاج ألياف كبيرة باستخدام تركيز عال 19 واط / حجم ٪ من PCL في محلول 5: 1 من الكلوروفورم والميثانول لإنشاء محلول PCL عالي اللزوجة. ثم تم نسج هذا المحلول عالي اللزوجة بمعدل تدفق مرتفع لإصدار خيط كبير من محلول البوليمر داخل المجال الكهربائي. لذلك ، كانت المسافة الكبيرة 230 مم بين الإبرة والمغزل ضرورية لضمان التبخر الفعال للمذيب قبل الترسيب على المغزل. على العكس من ذلك ، تم إنتاج ألياف أصغر باستخدام تركيز منخفض 7 واط / حجم ٪ من PCL في HFIP لإنشاء محلول PCL منخفض اللزوجة. يضمن الغزل الكهربائي لمحلول PCL منخفض اللزوجة بمعدل تدفق منخفض انبعاث خيط أرق من محلول PCL من الإبرة داخل المجال الكهربائي. سهل الخيط الرقيق تبخر أسرع للمذيب ويجب أن تكون الإبرة أقرب إلى المغزل عند 70 مم لضمان ترسب مستقر للألياف. بالنسبة للغزل الكهربائي للألياف المبردة الصغيرة ، كان تغيير محلول PCL ضروريا لتحقيق بروتوكول موثوق. أدى PCL في HFIP الكهربائي على المغزل المبرد بشكل متكرر إلى تفكك هيكل ألياف. أدى الغزل الكهربائي بتركيز 14 واط / حجم٪ PCL في 3: 1 ميثانول الكلوروفورم إلى حل هذه المشكلة. ومع ذلك ، أدى هذا إلى تباين أكبر في حجم الألياف في جميع أنحاء السقالة. تم تحليل مدى محاذاة الألياف (نصف قطر الألياف واتجاهها) لكل سقالة من خلال المكون الإضافي ImageJ DiameterJ29 ويظهر في الشكل 2 والشكل 3.

الشكل 1: صور SEM توضح الصفات المورفولوجية لكل مجموعة سقالات. يظهر الصف العلوي الألياف الصغيرة والصف السفلي الألياف الكبيرة. يتم سرد المجموعات المورفولوجية من اليسار إلى اليمين على أنها ألياف عشوائية وألياف محاذاة وألياف مبردة ، على التوالي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
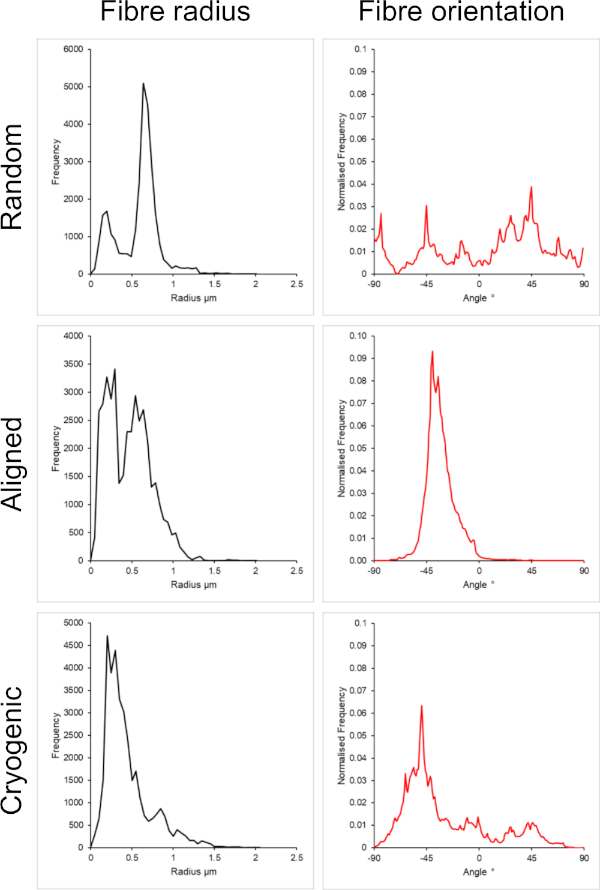
الشكل 2: بيانات نصف قطر الألياف (يسار) واتجاه الألياف (يمين) من المكون الإضافي DiameterJ لمجموعة صغيرة من الألياف. تم سرد التشكل من أعلى إلى أسفل كألياف عشوائية وألياف محاذاة وألياف مبردة ، على التوالي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
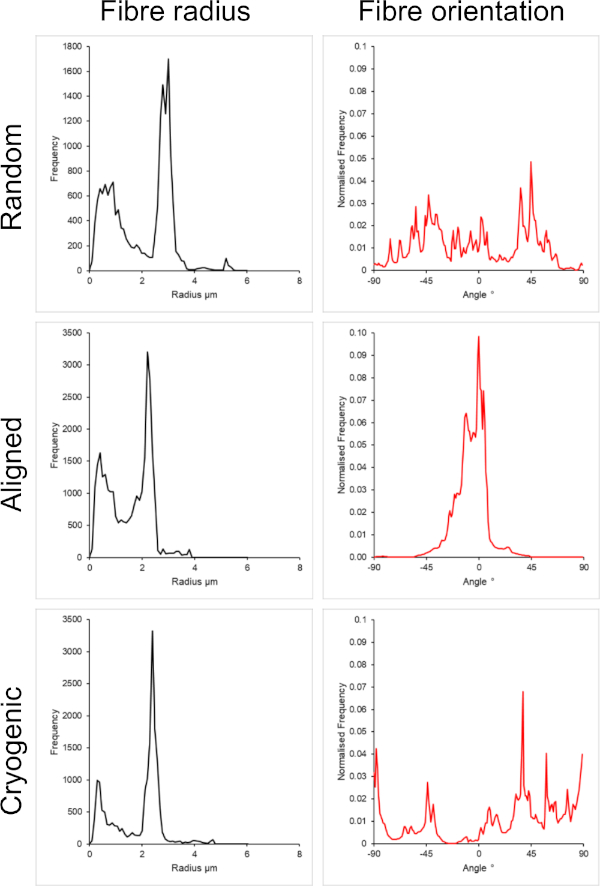
الشكل 3: بيانات نصف قطر الألياف (يسار) واتجاه الألياف (يمين) من المكون الإضافي DiameterJ لمجموعة كبيرة من الألياف. تم سرد التشكل من أعلى إلى أسفل كألياف عشوائية وألياف محاذاة وألياف مبردة ، على التوالي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
قدمت لنا هذه الطريقة مجموعة من السقالات ذات ستة خصائص شد مختلفة بشكل واضح كما هو محدد باستخدام آلة اختبار الشد وفقا للطرق الموصوفةسابقا 9. كما هو موضح في الجدول 1 ، يتراوح مقياس Youngs 'Moduli من 46.94 ± 3.48 ميجا باسكال في الألياف المحاذاة الكبيرة إلى 0.20 ± 0.01 ميجا باسكال في الألياف المبردة الكبيرة. تتراوح قيم صلابة الأنسجة الفسيولوجية من 100 باسكال (الأنسجة العصبية) إلى 2-4 GPa (أنسجة العظام) 30. كانت جميع قيم صلابة السقالة المذكورة هنا ضمن هذا النطاق.
| سقاله | معامل يونغز (MPa) للإجهاد٪ | ||||
| 0–2% | 2–4% | 4–6% | 6–8% | 8–10% | |
| ن خ. را | 11.14 ± 2.13 | 9.31 ± 0.43 | 6.75 ± 0.64 | 4.75 ± 0.59 | 3.32 ± 0.40 |
| ن خ. آل | 27.94 ± 8.63 | 28.27 ± 7.36 | 16.34 ± 4.87 | 9.10 ± 3.75 | 5.85 ± 3.11 |
| ن خ. كر | 0.27 ± 0.11 | 0.31 ± 0.44 | 0.31 ± 0.65 | 0.29 ± 0.59 | 0.26 ± 0.40 |
| ال جي. را | 9.23 ± 0.78 | 8.22 ± 0.87 | 5.96 ± 0.68 | 3.96 ± 0.59 | 2.63 ± 0.45 |
| ال جي. آل | 46.94 ± 3.48 | 38.03 ± 2.46 | 27.69 ± 1.22 | 16.10 ± 1.61 | 7.87 ± 1.32 |
| ال جي. كر | 0.20 ± 0.01 | 0.16 ± 0.01 | 0.12 ± 0.01 | 0.10 ± 0.01 | 0.09 ± 0.01 |
الجدول 1: بيانات اختبار الشد لكل مجموعة سقالات على فترات 2٪ إجهاد. ن خ. RA = عشوائي صغير ، SM. AL = محاذاة صغيرة ، SM. CR = مبردة صغيرة ، LG. RA = عشوائي كبير ، LG. AL = محاذاة كبيرة ، و LG. CR = مبردة كبيرة. البيانات المعروضة كمتوسط ± SD ، ن = 5.
يوضح الشكل 4 تلطيخ DAPI والفالويد المستخدم لتصور التشكل الخلوي. تم تحديد طريقة التلوين المستخدمة في الأدبيات11،12. تم الحصول على الصور باستخدام مجهر (جدول المواد) بهدف تكبير 40x. تظهر الصور أن الألياف المحاذاة التي تنتجها هذه الطريقة أطال مورفولوجيا خلية hepG2 ووجهت الخلايا المتكاثرة على طول الألياف ، مما يخلق اتجاهيا داخل ثقافة الخلية. في المقابل ، لم تظهر خلايا hepG2 على ألياف عشوائية التكاثر الاتجاهي والاستطالة التي لوحظت في الهياكل المحاذاة. على الهياكل العشوائية ، عرضت خلايا hepG2 مورفولوجيا أكثر انتظاما مع نتوءات ممتدة مرتبطة بألياف PCL المحيطة.
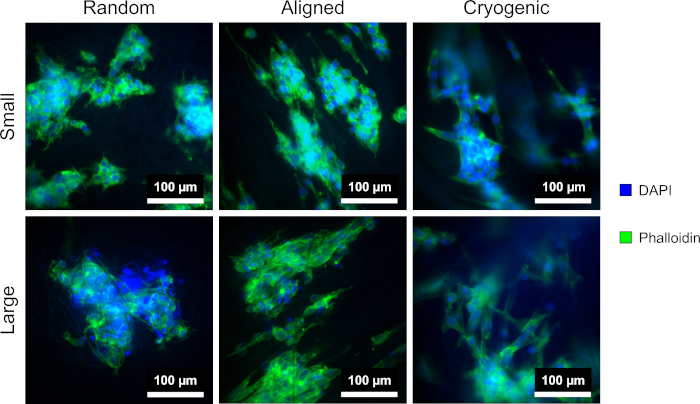
الشكل 4: DAPI (أزرق) والفالودين (الأخضر) ملطخة بخلايا hepG2 على أشكال السقالات المختلفة: عشوائية (يسار) ، محاذاة (وسط) ، ومبردة (يمين). يظهر الصف العلوي أليافا صغيرة ويظهر الصف السفلي أليافا كبيرة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تم تحقيق إنشاء أحجام مختلفة من الألياف باستخدام مزيج من المذيبات المختلفة وتركيزات PCL ومعلمات الغزل الكهربائي. يؤثر نوع البوليمر ووزنه الجزيئي والمذيب بشدة على اللزوجة وخصائص الشحنة للمحلول الناتج ، وبالتالي يكون له تأثير قوي على خصائص الغزل الكهربائي31. تخضع الفولتية المعروضة في هذه الطريقة للتغيير بناء على الظروف التي يتم فيها إجراء الغزل الكهربائي. تؤثر درجة الحرارة والرطوبة على سلوك عملية الغزل الكهربائي32. لذلك ، ينصح القارئ بالاستعداد لتغيير الجهد لمواجهة أي عوائق وتحقيق مخروط تايلور مستقر. يوصى بإيواء الدوار الكهربائي داخل حاوية تحكم بيئية لتقليل التباين من دفعة إلى دفعة في عملية الغزل الكهربائي.
يمكن تحقيق الأشكال المختلفة المعروضة في هذه الطريقة بسبب قدرات جهاز الغزل الكهربائي IME. مغزل متغير السرعة ضروري للتحكم في محاذاة الألياف. ينتج عن دوران المغزل عند عدد دورات منخفض في الدقيقة (<250 دورة في الدقيقة) أليافا موجهة بشكل عشوائي بسبب سلوك نفاثة البوليمر. عندما ينبعث محلول البوليمر المشحون من الإبرة ، فإن الشحنات الداخلية والقوى الديناميكية الهوائية تحفز تأثير جلد فوضوي يستخدم لوضع ترتيب فوضوي للألياف على المغزل33،34. يمكن التغلب على تأثير الجلد هذا عن طريق زيادة سرعة دوران المغزل فوق 1,800 دورة في الدقيقة. تظهر الألياف المودعة على مثل هذا المغزل العالي في الدقيقة بنية محاذاة لأن سرعة السطح كافية لمواجهة أي حركة عرضية تظهرها ألياف الجلد بشكل فعال. من المهم ملاحظة أنه عند استخدام سرعات مغزل عالية ، فمن المحتمل أن يؤدي ذلك إلى تعطيل الهواء المحيط ، مما قد يكون له تأثير سلبي على إنتاج مخروط تايلور المستقر.
يتم إنتاج السقالات المبردة عالية المسامية عن طريق ملء المغزل بالثلج الجاف عند -78.5 درجة مئوية. هذا يقلل من درجة حرارة المغزل ويعزز تكثيف وتجميد قطرات الماء على السطح. تظهر البلورات المتكونة قمما تنبثق من سطح المغزل وتترسب الألياف في جميع أنحاء القمم. بمجرد أن يتم تسامي بلورات الجليد ، يبقى هيكل مسامي من الألياف على المغزل35،36. يحد وزن وهشاشة البلورات من القدرة على إنشاء ألياف محاذاة مسامية ، حيث تؤدي سرعات المغزل العالية جدا (>250 دورة في الدقيقة) إلى انفصال البلورات والألياف عن المغزل بسبب القوى الجاذبية والديناميكية الهوائية المفرطة. من الممكن مواجهة صعوبات في هذه الطريقة بسبب هشاشة الهياكل المتكونة. يجب توخي الحذر عند التعامل مع المغزل وأيضا عند التعامل مع السقالات بعد ذلك ، لأن الهياكل عرضة للتسطيح عند عصرها وطيها عند إزالتها من السوائل. هناك أيضا احتمال أن تتعطل المحاليل التي تدور بالكهرباء بنجاح بدون مغزل المبرد بشكل قاتل بسبب تغير درجة الحرارة والهياكل البلورية. عند الدوران بالتبريد ، تعتمد كمية الجليد المتكونة على سطح المغزل بشكل كبير على الرطوبة ، مما ينتج عنه تباين في النتيجة النهائية. لذلك يوصى بشدة باحتواء عملية الغزل الكهربائي داخل حاوية التحكم البيئي.
لتقييم الأداء الخلوي على هذه السقالات ، من الضروري تعقيم المادة مسبقا. هناك العديد من الخيارات المتاحة لتعقيم البوليمرات ، بما في ذلك الطرق الكيميائية وطرق الإشعاع والطرق القائمة على الحرارة37،38. من المهم تقييم فعالية كل طريقة ومدى ملاءمتها لكل من استخدام المادة والمادة نفسها. يستخدم هذا البروتوكول التعقيم في 70٪ من الإيثانول قبل التجميد ، ومعالجة البلازما ، والغمر في محلول مضاد بنسبة 1٪. يسمح استخدام الإيثانول بتشويه البروتينات والكائنات الحية الدقيقة وتجفيفها مع عدم تعطيل مادة PCL37. قد يؤدي استخدام مذيبات أقوى إلى انحلال PCL. تم دمج طلاء البلازما في هذه الطريقة في المقام الأول لزيادة ماء PCL ، وهو معروف بأنه كاره للماء ، وتحسين ارتباط الخلية39،40. بشكل ملائم ، يعمل هذا أيضا كخطوة تعقيم ثانوية ، ولكن يجب توخي الحذر للحفاظ على السقالات في بيئة معقمة قبل وبعد العلاج بالبلازما. أثبتت هذه الطريقة أنها مناسبة للدراسات المختبرية مع الوسائط المعالجة بالمضادات الحيوية. ومع ذلك ، بالنسبة للتطبيقات في الجسم الحي ، يجب النظر في خيارات أكثر قوة مثل أكسيد الإيثيلين (EtO) والتعرض لجاما. بمجرد إجراء التعقيم ، يمكن زرع الخلايا على السقالة ويمكن تطبيق تقنيات زراعة الخلايا القياسية لتشكيل مزارع الخلايا ثلاثية الأبعاد في المختبر.
من المهم ملاحظة أن قيم الصلابة يجب أن تعزى إلى الهياكل المجهرية المختلفة المتكونة داخل السقالات. تظل المادة السائبة (PCL) ثابتة بين السقالات. لذلك ، لا تتغير صلابة المواد السائبة بين المجموعات. تظهر السقالات المبردة صلابة أقل بكثير من المجموعات الأخرى بسبب انخفاض الاتصال داخل مصفوفة الألياف ، والتي يمكن رؤيتها في الجدول 1. يعتقد أن الاتصال المنخفض يؤدي إلى تشوه أكثر انحناء مهيمن على عكس التشوه السائد بالتمدد داخل البنية الليفية41. ومن المثير للاهتمام أن صلابة السقالة لا تعتمد بشكل كبير على حجم الألياف في المجموعات العشوائية والمبردة. ومع ذلك ، فإن الصلابة الطولية للألياف المحاذاة تظهر اعتمادا أعلى بكثير على حجم الألياف مع معامل يونغز عند 0-2٪ سلالة تبلغ 27.94 ± 8.63 ميجا باسكال للألياف الصغيرة و 46.94 ± 3.48 ميجا باسكال للألياف الكبيرة. نظرا لطبيعة التمدد لاختبار الشد ، فإن هذا يعني كثافة PCL السائبة أعلى داخل المقطع العرضي الطولي. من الضروري التأكيد على أن البيانات الميكانيكية المعروضة هنا هي لقطة ميكانيكية كبيرة الحجم للبنى الليفية. سيكون من المفيد التوصيف الميكانيكي الدقيق الإضافي لفهم التأثيرات الميكانيكية على مقياس الخلية بشكل كامل.
تم تضمين كل من البنى العشوائية والمحاذاة في هذه الطريقة لتقديم مقارنة بين الأشكال المتناحية. يمكن ملاحظة مدى محاذاة الألياف في صور SEM في الشكل 2 وتحليلات الألياف المعروضة في الشكل 2 والشكل 3. لوحظت خصائص متباينة الخواص في جميع أنحاء العديد من الأنسجة في الجسم. على وجه الخصوص, ويلاحظ هذا عادة في الهياكل الخلوية محاذاة مثل تلك الموجودة في العضلات والأنسجة العصبية. توفر هياكل الألياف البوليمرية المحاذاة القدرة على تلخيص هذه الهياكل المحاذاة في المختبر42،43. كما هو موضح من قبل ، فإن وظيفة الخلية حساسة للتغيرات المورفولوجية والميكانيكية ، لذلك يجب إجراء مزيد من التحليل الوظيفي على الخلايا المرتبطة بالسقالات لتحديد التأثير البيولوجي لكل نوع من أنواع السقالات.
بالمقارنة مع تقنيات تصنيع السقالات الأخرى الموجودة ، توفر هذه الطريقة طريقة بسيطة لإنتاج هياكل سقالات دقيقة الحجم مع تحكم عال نسبيا في الخواص الميكانيكية والتشكل. يسمح تصنيع سقالة PCL البديلة مثل فصل الطور ، وترشيح الملح ، ورغوة الغاز بالتحكم المورفولوجي من حيث مساحة الفراغ وحجم المسام. ومع ذلك ، تظل المسام والهندسة الهيكلية كما هيإلى حد كبير 44،45،46،47. لذلك ، لا يمكن تغيير الصفات مثل مستوى الخواص بسهولة مقارنة بالغزل الكهربائي. توفر مواد الهيدروجيل ، الشائعة في إنتاج السقالات ، الوسائل لتغيير صلابة ركيزة البوليمر من خلال تغيير مستوى سلاسل البوليمر المتشابكة48. من الممكن أيضا الطباعة ثلاثية الأبعاد عبر مجموعة متنوعة من الطرق ، مما يوفر تحكما ممتازا في التشكل49. ومع ذلك ، فإن تحقيق دقة مقياس الغزل الكهربائي في مواد الهيدروجيل المتوافقة حيويا لا يزال يمثل تحديا يجب تنفيذه عمليا50،51. ظهرت السقالات الكهربائية بشكل شائع في أبحاث هندسة الأنسجة طوال العقد الماضي ، ويتم دائما استكشاف إدخال مواد وتطبيقات جديدة بأنواع مختلفة من الخلايا. في حين أن المواد الجديدة قيد التطوير باستمرار لغرض السقالات الكهربائية ، لا تزال هناك فرص لمزيد من التوصيف البيولوجي لمواد وطرق الغزل الكهربائي الحالية. تم اقتراح الطريقة الموصوفة كطريقة لتسهيل الدراسة البيولوجية في المختبر ، لأنها قابلة للتطبيق بشكل مباشر على تقنيات زراعة الخلايا الأساسية.
Acknowledgements
تم دعم هذا العمل من قبل منحة مجلس أبحاث العلوم الهندسية والفيزيائية المرجع: EP / N509644/1 ، ومرجع منحة UKRMPII: MR / L022974 / 1 ومرجع منحة MRC CCBN: MR / L012766 / 1. يود المؤلفون أن يقدروا الدكتورة أليسون ماكدونالد والدكتور ديفيد كيلي (COIL) للمساعدة في التصوير المجهري وتسهيله والبروفيسور أليستير إلفيك للوصول إلى مرافق المختبر (معهد الهندسة الحيوية).
Materials
| Name | Company | Catalog Number | Comments |
| 10 mm biopsy punch | Acuderm | P1025 | |
| 15 mL Falcon tube | Thermo-scientific | 339650 | |
| 20 mL glass vial | Fisherbrand | 11513542 | |
| 48 well cell culture plate | Greiner Bio-one | 677180 | |
| Anti-Anti 100X | Gibco | 15240062 | |
| Chloroform | Acros Organics | 13029236 | |
| DAPI | Sigma-aldrich | D9542 | |
| Eagles Minimum Essential Media | Gibco | 11090081 | |
| Electrospinner | IME Technologies | EC-DIG | |
| Fetal Bovine Serum | GE Healthcare | SH30071.03 | |
| Gold-Palladium Sputter coater | Emscope | SC500A | |
| HepG2 cell line | Sigma-aldrich | 85011430 | |
| Hexafluoroisopropanol (HFIP) | Manchester Organics | G26383 | |
| L-Glutamine 200 mM | Gibco | 25030081 | |
| MEM Non-essential Amino Acids | Gibco | 11140050 | |
| Methanol | Acros Organics | 11984591 | |
| Penicillin-Streptomycin 10,000 U/mL | Gibco | 15140122 | |
| Phalloidin | Abcam | ab176754 | |
| Phosphate Buffered Saline (PBS) | Sigma-aldrich | P4417-100TAB | |
| Plasma coater | Harrick Plasma | PDC-002 | |
| Polycaprolactone (Avg. MW 80,000) | Sigma-aldrich | 440744 | |
| PTFE Syringe | Fisherbrand | 12941031 | |
| Scanning Electron Microscope | Hitachi | S4700 | |
| T75 Culture Flask | Corning | CLS430641 | |
| Trypan blue (0.4%) | Gibco | 15250061 |
References
- Akter, F. Principles of Tissue Engineering. Tissue Engineering Made Easy. Akter, F. , Academic Press. London, UK. 3-16 (2016).
- Van Vlierberghe, S., Dubruel, P., Schacht, E. Biopolymer-Based Hydrogels as Scaffolds for Tissue Engineering Applications: A Review. Biomacromolecules. 12 (5), 1387-1408 (2011).
- Murugan, R., Ramakrishna, S. Nano-featured scaffolds for tissue engineering: A review of spinning methodologies. Tissue Engineering. 12 (3), 435-447 (2006).
- Hollister, S. J. Porous scaffold design for tissue engineering. Nature Materials. 4 (7), 518-524 (2005).
- Jun, I., Han, H. S., Edwards, J. R., Jeon, H. Electrospun fibrous scaffolds for tissue engineering: Viewpoints on architecture and fabrication. International Journal of Molecular Sciences. 19 (3), E745(2018).
- Rashidi, H., et al. 3D human liver tissue from pluripotent stem cells displays stable phenotype in vitro and supports compromised liver function in vivo. Archives of Toxicology. 92 (10), 3117-3129 (2018).
- Grant, R., Hay, D. C., Callanan, A. A Drug-Induced Hybrid Electrospun Poly-Capro-Lactone: Cell-Derived Extracellular Matrix Scaffold for Liver Tissue Engineering. Tissue Engineering Part A. 23 (13-14), 650-662 (2017).
- Munir, N., McDonald, A., Callanan, A. A combinatorial approach: Cryo-printing and electrospinning hybrid scaffolds for cartilage tissue engineering. Bioprinting. 16, e00056(2019).
- Burton, T. P., Corcoran, A., Callanan, A. The effect of electrospun polycaprolactone scaffold morphology on human kidney epithelial cells. Biomedical Materials. 13 (1), 015006(2018).
- Reid, J. A., Callanan, A. Influence of aorta extracellular matrix in electrospun polycaprolactone scaffolds. Journal of Applied Polymer Science. 136 (44), 48181(2019).
- Grant, R., Hallett, J., Forbes, S., Hay, D., Callanan, A. Blended electrospinning with human liver extracellular matrix for engineering new hepatic microenvironments. Scientific Reports. 9 (1), 6293(2019).
- Grant, R., Hay, D., Callanan, A. From scaffold to structure: The synthetic production of cell derived extracellular matrix for liver tissue engineering. Biomedical Physics and Engineering Express. 4 (6), 065015(2018).
- Reid, J. A., Callanan, A. Hybrid cardiovascular sourced extracellular matrix scaffolds as possible platforms for vascular tissue engineering. Journal of Biomedical Materials Research Part B: Applied Biomaterials. , 1-15 (2019).
- Chen, C. S. Mechanotransduction - A field pulling together? Journal of Cell Science. 121 (20), 3285-3292 (2008).
- Wang, N. Review of cellular mechanotransduction. Journal of Physics D: Applied Physics. 50 (23), 233002(2017).
- Fan, Y. L., Zhao, H. C., Li, B., Zhao, Z. L., Feng, X. Q. Mechanical Roles of F-Actin in the Differentiation of Stem Cells: A Review. ACS Biomaterials Science and Engineering. 5 (8), 3788-3801 (2019).
- Davidson, A. J., Wood, W. Unravelling the Actin Cytoskeleton: A New Competitive Edge. Trends in Cell Biology. 26 (8), 569-576 (2016).
- Blanchoin, L., Boujemaa-Paterski, R., Sykes, C., Plastino, J. Actin dynamics, architecture, and mechanics in cell motility. Physiological Reviews. 94 (1), 235-263 (2014).
- Guvendiren, M., Burdick, J. A. The control of stem cell morphology and differentiation by hydrogel surface wrinkles. Biomaterials. 31 (25), 6511-6518 (2010).
- Wan, L. Q., et al. Geometric control of human stem cell morphology and differentiation. Integrative Biology. 2 (7-8), 346(2010).
- Park, J. S., et al. The effect of matrix stiffness on the differentiation of mesenchymal stem cells in response to TGF-β. Biomaterials. 32 (16), 3921-3930 (2011).
- Evans, N., et al. Substrate stiffness affects early differentiation events in embryonic stem cells. European Cells and Materials. 18, 1-14 (2009).
- Stukel, J. M., Willits, R. K. Mechanotransduction of Neural Cells Through Cell-Substrate Interactions. Tissue Engineering Part B: Reviews. 22 (3), 173-182 (2016).
- Charbonier, F. W., Zamani, M., Huang, N. F. Endothelial Cell Mechanotransduction in the Dynamic Vascular Environment. Advanced Biosystems. 3 (2), 1800252(2019).
- Nyitray, C. E., Chavez, M. G., Desai, T. A. Compliant 3D Microenvironment Improves β-Cell Cluster Insulin Expression Through Mechanosensing and β-Catenin Signaling. Tissue Engineering Part A. 20 (13-14), 1888-1895 (2014).
- Baker, B. M., et al. Cell-mediated fiber recruitment drives extracellular matrix mechanosensing in engineered fibrillar microenvironments. Nature Materials. 14 (12), 1262-1268 (2015).
- Evans, N. D., Gentleman, E. The role of material structure and mechanical properties in cell-matrix interactions. Journal of Materials Chemistry B. 2 (17), 2345(2014).
- Tusan, C. G., et al. Collective Cell Behavior in Mechanosensing of Substrate Thickness. Biophysical Journal. 114 (11), 2743-2755 (2018).
- Hotaling, N. A., Bharti, K., Kriel, H., Simon, C. G. DiameterJ: A validated open source nanofiber diameter measurement tool. Biomaterials. 61, 327-338 (2015).
- Cox, T. R., Erler, J. T. Remodeling and homeostasis of the extracellular matrix: Implications for fibrotic diseases and cancer. DMM Disease Models and Mechanisms. 4 (2), 165-178 (2011).
- Haider, A., Haider, S., Kang, I. K. A comprehensive review summarizing the effect of electrospinning parameters and potential applications of nanofibers in biomedical and biotechnology. Arabian Journal of Chemistry. 11 (8), 1165-1188 (2018).
- De Vrieze, S., et al. The effect of temperature and humidity on electrospinning. Journal of Materials Science. 44 (5), 1357-1362 (2009).
- Hohman, M. M., Shin, M., Rutledge, G., Brenner, M. P. Electrospinning and electrically forced jets I. Stability theory. Physics of Fluids. 13 (8), 2201-2220 (2001).
- Yarin, A. L., Koombhongse, S., Reneker, D. H. Bending instability in electrospinning of nanofibers. Journal of Applied Physics. 89 (5), 3018-3026 (2001).
- Feltz, K. P., Kalaf, E. A. G., Chen, C., Martin, R. S., Sell, S. A. A review of electrospinning manipulation techniques to direct fiber deposition and maximize pore size. Electrospinning. 1, 46-61 (2017).
- Simonet, M., Schneider, O. D., Neuenschwander, P., Stark, W. J. Ultraporous 3D polymer meshes by low-temperature electrospinning: Use of ice crystals as a removable void template. Polymer Engineering & Science. 47 (12), 2020-2026 (2007).
- Dai, Z., Ronholm, J., Tian, Y., Sethi, B., Cao, X. Sterilization techniques for biodegradable scaffolds in tissue engineering applications. Journal of Tissue Engineering. 7, 204173141664881(2016).
- Rogers, W. J. Sterilisation techniques for polymers. Sterilisation of Biomaterials and Medical Devices. Lerouge, S., Simmons, A. , Elsevier Science. Amsterdam, Netherlands. 151-211 (2012).
- Jokinen, V., Suvanto, P., Franssila, S. Oxygen and nitrogen plasma hydrophilization and hydrophobic recovery of polymers. Biomicrofluidics. 6 (1), 16501(2012).
- Recek, N., et al. Cell Adhesion on Polycaprolactone Modified by Plasma Treatment. International Journal of Polymer Science. 2016, 1-9 (2016).
- Fleck, N. A., Deshpande, V. S., Ashby, M. F. Micro-architectured materials: Past, present and future. Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. 466 (2121), 2495-2516 (2010).
- Cooper, A., Bhattarai, N., Zhang, M. Fabrication and cellular compatibility of aligned chitosan-PCL fibers for nerve tissue regeneration. Carbohydrate Polymers. 85 (1), 149-156 (2011).
- Patel, K. H., et al. Aligned nanofibers of decellularized muscle ECM support myogenic activity in primary satellite cells in vitro. Biomedical Materials. 14 (3), 035010(2019).
- Wang, L., et al. Fabrication of open-porous PCL/PLA tissue engineering scaffolds and the relationship of foaming process, morphology, and mechanical behavior. Polymers for Advanced Technologies. 30 (10), 2539-2548 (2019).
- Sartore, L., Inverardi, N., Pandini, S., Bignotti, F., Chiellini, F. PLA/PCL-based foams as scaffolds for tissue engineering applications. Materials Today: Proceedings. 7, 410-417 (2019).
- Munir, N., Callanan, A. Novel phase separated polycaprolactone/collagen scaffolds for cartilage tissue engineering. Biomedical Materials (Bristol). 13 (5), 051001(2018).
- Wang, W., et al. Fabrication of heterogeneous porous bilayered nanofibrous vascular grafts by two-step phase separation technique. Acta Biomaterialia. 79, 168-181 (2018).
- Kim, C., et al. Stem Cell Mechanosensation on Gelatin Methacryloyl (GelMA) Stiffness Gradient Hydrogels. Annals of Biomedical Engineering. 48 (2), 893-902 (2019).
- Chen, Z., et al. 3D Printing of Multifunctional Hydrogels. Advanced Functional Materials. 29 (20), 1900971(2019).
- Lee, J. M., Ng, W. L., Yeong, W. Y. Resolution and shape in bioprinting: Strategizing towards complex tissue and organ printing. Applied Physics Reviews. 6, 011307(2019).
- Zimmermann, R., et al. High resolution bioprinting of multi-component hydrogels. Biofabrication. 11 (4), 045008(2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved