Method Article
Dimostrazione del controllo della morfologia del polimero elettrofilato per l'ingegneria tissutale utilizzando una linea cellulare hepG2
In questo articolo
Riepilogo
Questo metodo fornisce i mezzi per testare diverse morfologie e topografie di fibre di policaprolattone ai fini dell'ingegneria tissutale. Le fibre piccole e grandi sono fabbricate con orientamenti casuali, orientamenti allineati e anche strutture porose elettrofilate criogenicamente e utilizzate come piattaforme per la coltura cellulare.
Abstract
L'elettrofilatura offre ai ricercatori l'opportunità di fabbricare fibre polimeriche riproducibili su scala micro e nanometrica. L'architettura fibrosa 3D dei polimeri elettrofilati è considerata un'imitazione strutturale della matrice extracellulare (ECM). Pertanto, le fibre elettrofilate fabbricate con polimeri biocompatibili sono state ampiamente studiate dai ricercatori di ingegneria tissutale per il loro potenziale ruolo come ECM artificiale per guidare la crescita dei tessuti sia in vitro che in vivo. Tutte le cellule sono acutamente sensibili al loro ambiente meccanico. Ciò è stato dimostrato dalla scoperta di molteplici vie di meccanotrasduzione intrinsecamente legate ai filamenti di actina del citoscheletro. Il citoscheletro funge da sensore meccanico in grado di dirigere la funzionalità e la differenziazione della cellula ospite a seconda della rigidità e della morfologia del suo substrato. Le fibre elettrofilate possono essere regolate sia in termini di dimensioni che di morfologia delle fibre per modulare facilmente l'ambiente meccanico all'interno di un'impalcatura polimerica fibrosa. Qui vengono descritti i metodi per l'elettrofilatura del policaprolattone (PCL) per tre morfologie distinte a due diversi diametri di fibra. Le categorie di fibre morfologiche sono costituite da fibre orientate in modo casuale, fibre allineate e fibre porose filate criogenicamente, con diametri di 1 μm e 5 μm. I metodi descritti in questo studio sono proposti come piattaforma per studiare l'effetto dell'architettura delle fibre elettrofilate sulla generazione di tessuti. La comprensione di questi effetti consentirà ai ricercatori di ottimizzare le proprietà meccaniche delle fibre elettrofilate e di dimostrare il potenziale di questa tecnologia in modo più approfondito.
Introduzione
Negli ultimi decenni si sono sviluppati metodi di ingegneria tissutale per fornire alle cellule un ambiente biomimetico al fine di incoraggiare il successo della rigenerazione tissutale, sia per i modelli di tessuto in vitro che per le tecniche rigenerative in vivo. Questi metodi in genere incoraggiano le cellule a formare aggregati 3D, da sole o con l'uso di un'impalcatura guida. Gli scaffold possono essere fabbricati come nano/microstrutture polimeriche porose o fibrose, o come idrogel altamente assorbenti d'acqua 2,3,4. L'elettrofilatura dei polimeri è una tecnica di fabbricazione comune che produce matrici di fibre polimeriche non tessute su scala nanometrica in grado di imitare l'architettura fibrosa della matrice extracellulare nativa (ECM)5. Molteplici polimeri biocompatibili sono applicabili al processo di elettrofilatura; Pertanto, le fibre elettrofilate sono un mezzo popolare per facilitare la rigenerazione dei tessuti 6,7,8. Le fibre elettrofilate sono state utilizzate nella coltura di una vasta gamma di tessuti, dimostrando una strada promettente per piattaforme di scaffold economiche e riproducibili 9,10,11,12,13.
Le cellule hanno un'acuta sensibilità verso l'ambiente meccanico che le circonda. Ricerche precedenti hanno evidenziato questa importante relazione, chiamata meccanotrasduzione, che può influenzare la funzione, la morfologia e la differenziazione cellulare14,15. La base del citoscheletro cellulare eucariotico è costituita da actina filamentosa e svolge ruoli meccanici chiave nella divisione, aderenza, migrazione, contrazione e morfologia cellulare. Viene manipolato da stimoli meccanici esterni tramite la connessione con le proteine di superficie extracellulari 16,17,18. L'influenza morfologica sul differenziamento delle cellule staminali è stata dimostrata in numerosi studi alterando la forma di un substrato attaccabile, che è quindi in grado di controllare la forma cellulare e dirigere il processo di differenziamento19,20. Inoltre, la rigidità del substrato su cui si attaccano le cellule influenza anche il destino e il lignaggio delle cellule staminali21,22. Oltre alle cellule staminali, è stato osservato che questi effetti colpiscono anche cellule di diversi lignaggi23,24. I metodi tridimensionali di ingegneria tissutale hanno mostrato risultati simili a quelli trovati negli studi di meccanotrasduzione 2D con idrogel e scaffold fibrillari 25,26,27. Inoltre, la meccanica del substrato viene comunicata attraverso aggregati cellulari 3D tramite la segnalazione cellula-cellula28. La meccanica dei materiali svolge un ruolo cruciale nel dirigere la funzionalità cellulare e quindi dovrebbe essere un fattore importante nella progettazione di scaffold per tessuti ingegnerizzati.
L'obiettivo di questo metodo è comprendere gli effetti delle dimensioni e della morfologia delle fibre di policaprolattone elettrofilato (PCL) sulle colture cellulari in vitro. Il metodo è adattato da precedenti ricerche incentrate sull'ingegneria del tessuto renale9. Qui viene offerto un protocollo passo-passo più dettagliato al fine di facilitare la ricostruzione dello scaffold e sviluppare un metodo standardizzato applicabile a tutti i tipi di cellule. Con questo metodo sono stati costruiti sei gruppi di scaffold: tre sono grandi fibre da 5 μm (LG) e gli altri tre piccole fibre da 1 μm (SM), utilizzando diverse concentrazioni di PCL. All'interno di questi gruppi LG e SM ci sono tre diverse costruzioni morfologiche: fibre casuali (RA), fibre allineate (AL) e fibre criogeniche porose (CR). Questi gruppi di scaffold hanno tutti strutture intrinsecamente diverse e quindi forniscono ambienti meccanici locali unici su cui si attaccano le cellule. Per dimostrare l'effetto morfologico che ciò fornisce alle cellule, la linea cellulare hepG2 è stata seminata su ciascun gruppo di scaffold come studio rappresentativo. Questo metodo viene offerto come analisi di base per la progettazione di scaffold elettrofilati per tutti i tipi di cellule, dalle cellule staminali alle linee cellulari e alle cellule primarie.
Protocollo
1. Preparazione della soluzione
- Fibre grandi (casuali, allineate e criogeniche)
- Preparare un rapporto 5:1 di cloroformio e metanolo mescolando 50 mL di cloroformio e 10 mL di metanolo in un flacone di vetro a prova di solvente utilizzando una pipetta sierologica di vetro.
ATTENZIONE: Il cloroformio e il metanolo sono solventi tossici e la miscelazione deve essere effettuata in una cappa aspirante. - Per creare una soluzione 19 p/v% di PCL in cloroformio:metanolo 5:1, pesare 1,9 g di PCL e aggiungere a 10 mL di cloroformio:metanolo 5:1 in una fiala di vetro a prova di solvente. Sigillare due volte la fiala con una pellicola di paraffina e lasciare la fiala su un rullo per una notte per consentire al PCL di dissolversi completamente.
ATTENZIONE: La miscelazione deve essere condotta in una cappa aspirante.
- Preparare un rapporto 5:1 di cloroformio e metanolo mescolando 50 mL di cloroformio e 10 mL di metanolo in un flacone di vetro a prova di solvente utilizzando una pipetta sierologica di vetro.
- Fibre piccole (casuali e allineate)
- Per preparare una soluzione al 7 p/v% di PCL in esafluoroisopropanolo (HFIP), pesare 0,7 g di PCL e miscelare con 10 mL di HFIP in un flaconcino di vetro a prova di solvente. Sigillare due volte la fiala con un film di paraffina e lasciarla su un rullo per una notte per consentire al PCL di dissolversi completamente.
ATTENZIONE: L'HFIP è altamente tossico e la miscelazione deve essere condotta in una cappa aspirante.
- Per preparare una soluzione al 7 p/v% di PCL in esafluoroisopropanolo (HFIP), pesare 0,7 g di PCL e miscelare con 10 mL di HFIP in un flaconcino di vetro a prova di solvente. Sigillare due volte la fiala con un film di paraffina e lasciarla su un rullo per una notte per consentire al PCL di dissolversi completamente.
- Piccole fibre criogeniche
ATTENZIONE: La miscelazione deve essere condotta in una cappa aspirante.- Preparare un rapporto 3:1 di cloroformio e metanolo mescolando 30 mL di cloroformio e 10 mL di metanolo in un flacone di vetro a prova di solvente utilizzando una pipetta sierologica di vetro.
- Per creare una soluzione 14 p/v% di PCL in cloroformio:metanolo 3:1, pesare 1,4 g di PCL e aggiungere a 10 mL di cloroformio:metanolo 3:1 in un flaconcino di vetro resistente ai solventi. Sigillare due volte la fiala con un film di paraffina e lasciarla su un rullo per una notte per consentire al PCL di dissolversi completamente.
2. Configurazione elettrofilante
NOTA: I parametri devono essere impostati prima di iniziare il processo di elettrofilatura.
- Dimensione e posizionamento dell'ago
- Per fibre di grandi dimensioni (casuali, allineate e criogeniche) utilizzare un ago in ottone con diametro esterno di 1 mm/ID di 0,8 mm e posizionare l'ago a 230 mm di distanza dalla superficie del mandrino.
- Per le fibre piccole, utilizzare un ago in ottone con diametro esterno di 1 mm/diametro interno di 0,4 mm e posizionare l'ago a 15 mm di distanza dalla superficie del mandrino.
- Movimento laterale dell'ago
NOTA: Gli scaffold descritti nella Figura 1 sono stati fabbricati con una traslazione dell'ago di 100 mm a 50 mm/s, con movimento ripetuto a sinistra e a destra durante tutto il processo.- Per impostare il movimento laterale, premere Movimento | TNS 1 e impostare la posizione di avvio [mm] su -50, la distanza [mm] su 100, la velocità [mm/s] su 50 e il ritardo di rotazione [ms] su 750.
- Portata della pompa a siringa
- Per fibre di grandi dimensioni (casuali, allineate e criogeniche), premere la scheda Materiale sull'interfaccia utente e impostare la pompa a siringa su 4 ml/h.
- Per fibre piccole (casuali e allineate), impostare la pompa a siringa su 0,8 ml/h.
- Per piccole fibre criogeniche, impostare la pompa a siringa a 2,5 mL/h.
- Impostazioni di tensione
- Per le fibre grandi, impostare la tensione dell'ago a +15 kV e la tensione del mandrino a -4 kV premendo la scheda Tensione sull'interfaccia utente e modificando i valori di tensione positiva e negativa.
- Per le fibre piccole (casuali e allineate), impostare la tensione dell'ago a +17 kV e la tensione del mandrino a -4 kV.
- Per le piccole fibre criogeniche, impostare la tensione dell'ago a +18 kV e la tensione del mandrino a -4 kV.
- Rotazione del mandrino (fibre grandi e piccole)
- Per fibre casuali, premere Movimento | Puntare e impostare la velocità di rotazione del mandrino a 250 giri/min.
- Per le fibre allineate, impostare la velocità di rotazione del mandrino su 1.800 giri/min.
- Per le fibre criogeniche, impostare la velocità di rotazione del mandrino su 180 giri/min.
3. Elettrofilatura di fibre casuali e allineate (fibre grandi e piccole)
- Inserire l'ago (fare riferimento alla sezione 2.1 per informazioni sulle dimensioni e il posizionamento dell'ago) in un tubo in PTFE con foro di 1 mm e fissarlo all'interno del supporto dell'ago dell'elettrofilatore.
- Sotto una cappa aspirante, trasferire i 10 mL di soluzione polimerica in una siringa di polipropilene o di vetro (a prova di solvente). Assicurati di rimuovere eventuali bolle lasciando riposare la siringa prima dell'adescamento.
- Collegare la siringa all'ago tramite il tubo in PTFE e fissare la siringa all'interno della pompa a siringa. Una volta collegato, adescare il tubo in PTFE premendo lo stantuffo della siringa e riempiendo il tubo con una soluzione polimerica.
- Avvolgere il mandrino in un foglio di alluminio e fissarlo sul dispositivo di rotazione del mandrino.
- Attivare la rotazione del mandrino premendo Movimento | Obiettivo | Ruotare e la pompa a siringa premendo Materiale | Avviare la pompa 1.
- Quando si è formata una piccola goccia di polimero all'estremità dell'ago, accendere la tensione premendo ACTIVATE HIGH VOLTAGE. Un getto di polimero dovrebbe quindi essere emesso da una sporgenza conica della soluzione polimerica, chiamata cono di Taylor. Controllare il mandrino per confermare la deposizione di fibre sulla superficie del mandrino.
- Eseguire il processo di elettrofilatura fino a quando non viene elettrofilata la quantità desiderata di soluzione PCL.
NOTA: Per gli scaffold presentati nella Figura 1, 4 mL di soluzione sono stati elettrofilati. - Una volta terminata l'elettrofilatura, rimuovere il foglio di alluminio ricoperto dalla fibra dal mandrino e lasciarlo in una cappa per una notte per consentire l'evaporazione del solvente in eccesso.
- Dopo l'evaporazione, conservare le fibre a temperatura ambiente (RT).
4. Elettrofilatura di fibre criogeniche
- Per l'elettrofilatura criogenica, utilizzare il mandrino crio-rotante. Ripetere i passaggi 3.1-3.3, quindi procedere con i passaggi seguenti.
- Avvolgere il mandrino in un foglio di alluminio.
- Riempire il mandrino con pellet di ghiaccio secco. Fissare il coperchio del mandrino crio-rotante sul mandrino per assicurarsi che il ghiaccio secco non possa fuoriuscire dal mandrino ma la pressione possa fuoriuscire. I cristalli di ghiaccio dovrebbero formarsi sulla superficie del mandrino quasi immediatamente.
ATTENZIONE: Utilizzare guanti protettivi quando si maneggia il ghiaccio secco per evitare ustioni da freddo. - Fissare il mandrino sul dispositivo di rotazione del mandrino e attivare immediatamente la rotazione del mandrino premendo Movimento | Obiettivo | Ruotare e la pompa a siringa premendo Materiale | Avviare la pompa 1.
- Una volta che si è formata una goccia di polimero all'estremità dell'ago, accendere la tensione premendo ACTIVATE HIGH VOLTAGE. Un getto di polimero dovrebbe quindi essere emesso da una sporgenza conica della soluzione polimerica (cioè il cono di Taylor). Controllare il mandrino per confermare la deposizione di fibre sulla superficie del mandrino.
- Dopo 1 ora di elettrofilatura, mettere in pausa il processo premendo STOP ALL e rabboccare il mandrino con ghiaccio secco. Garantire un'adeguata protezione dai vapori di solvente durante il riempimento del mandrino. Eseguire questa operazione per un totale di 3 volte per un totale di 4 ore di tempo di elettrofilatura.
NOTA: L'elettrofilatura può essere ripresa ripetendo i passaggi 4.4 e 4.5. - Una volta terminata l'elettrofilatura, rimuovere con cura il mandrino e metterlo immediatamente in un liofilizzatore per 24 ore per sublimare i cristalli di ghiaccio sulla superficie del mandrino.
- Dopo la sublimazione, rimuovere la pellicola ricoperta di fibre dal mandrino e conservarla presso RT, facendo attenzione a evitare schiacciamenti.
5. Punzonatura dell'impalcatura
- Perforare gli scaffold dal foglio di fibre utilizzando un punzone per biopsia da 10-12 mm. Se le fibre rimangono aderenti al foglio di alluminio, posizionare i ponteggi in etanolo al 70% per facilitare il distacco.
6. Sterilizzazione e rivestimento al plasma
- Posizionare gli scaffold (1 impalcatura per pozzetto) in una piastra da 24 o 48 pozzetti e lavarli 3 volte in etanolo al 70%. Lasciare immergere nel lavaggio finale, mettere in congelatore a -80 °C e lasciare congelare.
- Una volta congelato, mettere il piatto in un liofilizzatore e liofilizzare per 24 ore. Gli scaffold essiccati possono ora essere rivestiti al plasma.
NOTA: Se non è possibile accedere a un rivestitore di plasma, immergere gli scaffold in antibiotico-antimicotico all'1% (Anti-Anti) in soluzione salina tamponata con fosfato (PBS) e lasciare incubare a 37 °C per una notte. - Posizionare la piastra nella camera del plasma e rimuovere il coperchio. Far funzionare il rivestimento al plasma a 500 mTorr e media potenza a radiofrequenza (RF) per 30 s.
- Dopo il rivestimento al plasma, immergere gli scaffold in 1 mL di PBS e 1% Anti-Anti. Gli scaffold dovrebbero assorbire prontamente la soluzione di PBS.
NOTA: Gli scaffold sono ora pronti per essere seminati con le cellule.
7. Preparazione e semina delle cellule
NOTA: La tecnica di base della coltura cellulare fornita di seguito è per le cellule hepg2 utilizzate a scopo dimostrativo nei risultati rappresentativi. Questi principi possono essere applicati a qualsiasi tipo di cellula aderente; Tuttavia, celle diverse possono richiedere materiali e processi diversi. La manipolazione delle cellule deve essere effettuata in una cappa di sicurezza biologica, seguendo una tecnica asettica.
- Prelevare 1 x 106 cellule hepg2 crioconservate e seminarle in un pallone di coltura cellulare T75 con 12 mL di terreno completo costituito da terreno minimo essenziale di Eagle (EMEM) integrato con il 10% di siero fetale bovino, 100 U/mL di penicillina-streptomicina, 5 mM di L-glutammina e l'1% di aminoacidi non essenziali.
- Una volta che le cellule hanno raggiunto l'80% di confluenza, staccare le cellule dal pallone di coltura lavandole 3 volte in PBS e incubandole in 2 mL di tripsina a 37 °C per 4 minuti. Dopo aver toccato il pallone, le celle dovrebbero staccarsi.
- Disattivare la tripsina aggiungendo 8 ml di terreno completo. Trasferire la sospensione cellulare in una provetta da 15 mL e centrifugare le cellule in una centrifuga a 120 x g per 5 minuti.
- Rimuovere il surnatante sopra il pellet cellulare con una pipetta di aspirazione e sostituirlo con 5 mL di terreno completo. Risospendere le cellule pipettando su e giù con una pipetta sierologica da 5 mL.
- Contare la sospensione cellulare risultante con il metodo di esclusione del blu di tripano. Prelevare 100 μL di sospensione cellulare e aggiungere a 100 μL di blu di tripano in un flaconcino da 1,5 mL. Introdurre la miscela su un emocitometro sotto un vetrino coprioggetti e contare le cellule al microscopio.
- Regolare la concentrazione delle cellule a 2,6 x 106 cellule/mL aggiungendo o rimuovendo il terreno completo. Per rimuovere il terreno, centrifugare le cellule a 220 x g per 5 minuti, rimuovere il terreno necessario e risospendere le cellule.
- Aspirare l'1% di Anti-Anti in PBS dalla piastra a pozzetti e seminare 50 μL di sospensione cellulare da 2,6 x 106 cellule/mL sulla superficie dell'impalcatura utilizzando una pipetta da 200 μL.
- Lasciare che le cellule si attacchino durante l'incubazione a 37 °C e al 5% di CO2 per 1-3 ore, assicurandosi che non si secchino. Una volta fissato, aggiungere 300 μl (per una piastra da 48 pozzetti) o 500 μl (per una piastra da 24 pozzetti) di terreno di coltura e incubare a 37 °C e 5% di CO2.
NOTA: Le tecniche standard di coltura cellulare possono essere utilizzate da qui fino a ulteriori analisi funzionali.
Risultati
La Figura 1 mostra le immagini al microscopio elettronico a scansione (SEM) di fibre piccole (~1 μm) e grandi (~5 μm) fabbricate da soluzioni PCL. Le fibre sono state rivestite con oro-palladio (60:40) per 30 secondi utilizzando un rivestimento per polverizzazione catodica prima dell'imaging SEM. Le fibre di grandi dimensioni sono state prodotte utilizzando un'elevata concentrazione di PCL del 19 p/v% in una soluzione 5:1 di cloroformio e metanolo per creare una soluzione di PCL ad alta viscosità. Questa soluzione ad alta viscosità è stata poi elettrofilata ad alta portata per emettere un grande filo di soluzione polimerica all'interno del campo elettrico. Pertanto, era necessaria un'ampia distanza di 230 mm tra l'ago e il mandrino per garantire un'efficace evaporazione del solvente prima della deposizione sul mandrino. Al contrario, le fibre più piccole sono state prodotte utilizzando una bassa concentrazione di PCL del 7 w/v% in HFIP per creare una soluzione PCL a bassa viscosità. L'elettrofilatura della soluzione PCL a bassa viscosità a bassa velocità di flusso ha assicurato che un filo più sottile di soluzione PCL venisse emesso dall'ago all'interno del campo elettrico. Il filo più sottile facilitava una più rapida evaporazione del solvente e l'ago doveva essere più vicino al mandrino a 70 mm per garantire una deposizione stabile delle fibre. Per l'elettrofilatura di piccole fibre criogeniche, è stato necessario modificare la soluzione PCL per ottenere un protocollo affidabile. Il PCL in HFIP elettrofilato sul mandrino criogenico ha provocato ripetutamente una struttura di fibre disintegrata. L'elettrofilatura di una concentrazione di PCL del 14 w/v% in metanolo cloroformio 3:1 ha risolto questo problema; Tuttavia, questo ha creato una variazione maggiore nella dimensione delle fibre in tutta l'impalcatura. L'entità dell'allineamento delle fibre (raggio e orientamento delle fibre) per ciascuna impalcatura è stata analizzata tramite il plug-in ImageJ DiameterJ29 e mostrata nella Figura 2 e nella Figura 3.

Figura 1: Immagini SEM che mostrano le qualità morfologiche di ciascun gruppo di scaffold . La riga superiore mostra le fibre piccole e la riga inferiore le fibre grandi. I gruppi morfologici sono elencati da sinistra a destra rispettivamente come fibre casuali, fibre allineate e fibre criogeniche. Clicca qui per visualizzare una versione più grande di questa figura.
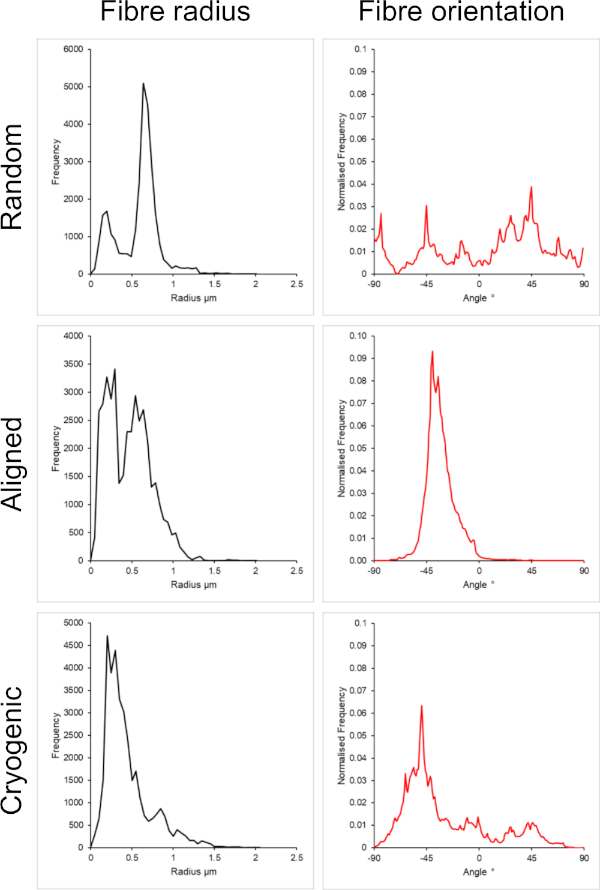
Figura 2: Dati relativi al raggio della fibra (a sinistra) e all'orientamento della fibra (a destra) dal plug-in DiameterJ per il piccolo insieme di fibre. Morfologia elencata dall'alto verso il basso come fibre casuali, fibre allineate e fibre criogeniche, rispettivamente. Clicca qui per visualizzare una versione più grande di questa figura.
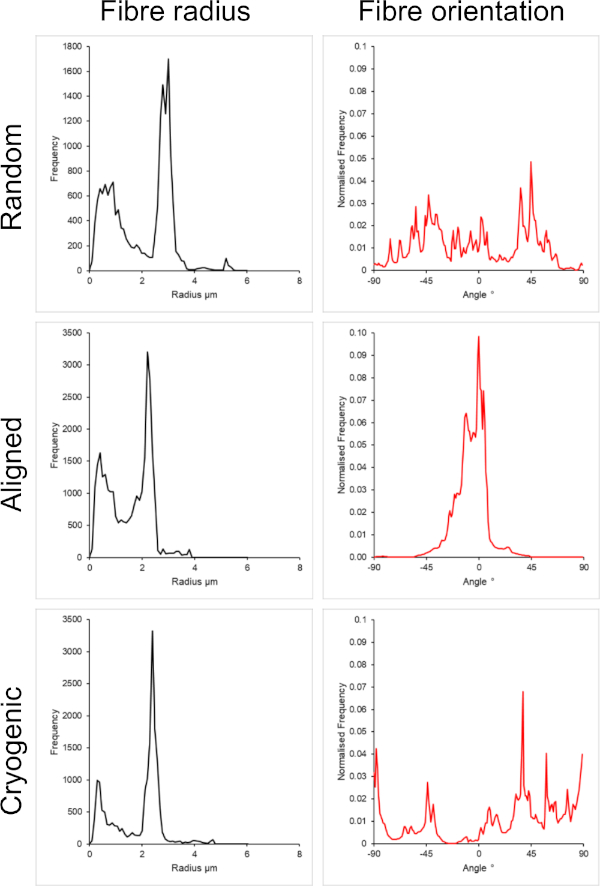
Figura 3: Dati relativi al raggio (a sinistra) e all'orientamento della fibra (a destra) dal plug-in DiameterJ per l'ampio set di fibre. Morfologia elencata dall'alto verso il basso come fibre casuali, fibre allineate e fibre criogeniche, rispettivamente. Clicca qui per visualizzare una versione più grande di questa figura.
Questo metodo ci ha offerto una serie di scaffold con sei proprietà di trazione nettamente diverse determinate utilizzando una macchina per prove di trazione secondo i metodi precedentemente descritti9. Come mostrato nella Tabella 1 , i moduli di Youngs su macroscala variano da 46,94 ± 3,48 MPa nelle grandi fibre allineate a 0,20 ± 0,01 MPa nelle grandi fibre criogeniche. I valori fisiologici di rigidità tissutale variano da 100 Pa (tessuto neurale) a 2-4 GPa (tessuto osseo)30; Tutti i valori di rigidità dell'impalcatura qui riportati rientravano in questo intervallo.
| Patibolo | Modulo di Young (MPa) per la deformazione% | ||||
| 0–2% | 2–4% | 4–6% | 6–8% | 8–10% | |
| SM. RA | 11.14 ± 2.13 | 9.31 ± 0.43 | 6,75 ± 0,64 | 4,75 ± 0,59 | 3,32 ± 0,40 |
| SM. ALE | 27.94 ± 8.63 | 28.27 ± 7.36 | 16.34 ± 4.87 | 9.10 ± 3.75 | 5.85 ± 3.11 |
| SM. CR | 0,27 ± 0,11 | 0,31 ± 0,44 | 0,31 ± 0,65 | 0,29 ± 0,59 | 0,26 ± 0,40 |
| LG. RA | 9,23 ± 0,78 | 8,22 ± 0,87 | 5,96 ± 0,68 | 3,96 ± 0,59 | 2,63 ± 0,45 |
| LG. ALE | 46,94 ± 3,48 | 38.03 ± 2.46 | 27,69 ± 1,22 | 16.10 ± 1.61 | 7,87 ± 1,32 |
| LG. CR | 0,20 ± 0,01 | 0,16 ± 0,01 | 0,12 ± 0,01 | 0,10 ± 0,01 | 0,09 ± 0,01 |
Tabella 1: Dati delle prove di trazione per ciascun gruppo di scaffold a intervalli del 2% di deformazione. SM. RA = Piccolo casuale, SM. AL = Piccolo allineato, SM. CR = Piccolo criogenico, LG. RA = Grande casuale, LG. AL = Grande allineato e LG. CR = Criogenico di grandi dimensioni. Dati presentati come media ± SD, n = 5.
La Figura 4 mostra la colorazione DAPI e falloidina utilizzata per visualizzare la morfologia cellulare. Il metodo di colorazione utilizzato è stabilito in letteratura11,12. Le immagini sono state ottenute utilizzando un microscopio (Table of Materials) con un obiettivo di ingrandimento 40x. Le immagini mostrano che le fibre allineate prodotte con questo metodo allungano la morfologia cellulare hepG2 e dirigono le cellule proliferanti lungo la lunghezza delle fibre, creando direzionalità all'interno della coltura cellulare. Al contrario, le cellule hepG2 su fibre casuali non hanno mostrato la proliferazione direzionale e l'allungamento osservati nelle strutture allineate. Sulle strutture casuali, le cellule hepG2 hanno mostrato una morfologia più regolare con sporgenze estese che si attaccano alle fibre PCL circostanti.
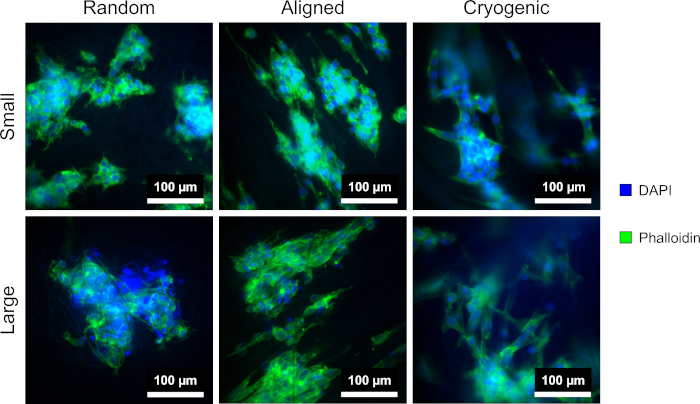
Figura 4: Cellule hepG2 colorate con DAPI (blu) e falloidina (verde) sulle diverse morfologie dell'impalcatura: casuale (a sinistra), allineata (al centro) e criogenica (a destra). La riga superiore mostra le fibre piccole e la riga inferiore mostra le fibre grandi. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
La creazione di fibre di diverse dimensioni è stata ottenuta utilizzando una combinazione di diversi solventi, concentrazioni di PCL e parametri di elettrofilatura. Il tipo di polimero, il suo peso molecolare e il solvente influenzano fortemente la viscosità e le proprietà di carica della soluzione risultante e quindi hanno una forte influenza sulle proprietà di elettrofilatura31. Le tensioni visualizzate in questo metodo sono soggette a modifiche in base alle condizioni in cui viene condotta l'elettrofilatura. La temperatura e l'umidità influenzano il comportamento del processo di elettrofilatura32. Pertanto, si consiglia al lettore di essere pronto a modificare la tensione per contrastare eventuali ostacoli e ottenere un cono di Taylor stabile. Si consiglia di alloggiare l'elettrofilatore all'interno di un involucro di controllo ambientale per ridurre la variabilità da lotto a lotto nel processo di elettrofilatura.
Ottenere le diverse morfologie presentate in questo metodo è possibile grazie alle capacità del dispositivo di elettrofilatura IME. Un mandrino a velocità variabile è essenziale per controllare l'allineamento delle fibre. La rotazione del mandrino a un basso numero di giri (<250 giri/min) produce fibre orientate in modo casuale a causa del comportamento del getto del polimero. Quando la soluzione polimerica carica viene emessa dall'ago, le cariche interne e le forze aerodinamiche inducono un effetto di frusta caotico che viene utilizzato per stendere una disposizione caotica delle fibre sul mandrino 33,34. Questo effetto di frusta può essere superato aumentando la velocità di rotazione del mandrino oltre i 1.800 giri/min. Le fibre depositate su un mandrino ad alto numero di giri presentano una struttura allineata perché la velocità superficiale è sufficiente per contrastare efficacemente qualsiasi movimento trasversale esibito dalla fibra di frusta. È importante notare che quando si utilizzano velocità elevate del mandrino, è probabile che si interrompa l'aria circostante, il che può avere un effetto negativo sulla produzione di un cono di Taylor stabile.
Gli scaffold criogenici altamente porosi vengono prodotti riempiendo il mandrino con ghiaccio secco a -78,5 °C. Ciò riduce la temperatura del mandrino e favorisce la condensazione e il congelamento delle goccioline d'acqua sulla superficie. I cristalli formati mostrano picchi che emergono dalla superficie del mandrino e le fibre si depositano in tutti i picchi. Una volta che i cristalli di ghiaccio sono sublimati, sul mandrino rimane una struttura porosa di fibre35,36. Il peso e la fragilità dei cristalli limitano la capacità di creare fibre porose allineate, poiché velocità del mandrino troppo elevate (>250 giri/min) provocano il distacco dei cristalli e delle fibre dal mandrino a causa di eccessive forze centripete e aerodinamiche. È possibile incontrare difficoltà con questo metodo a causa della fragilità delle strutture formate. È necessario prestare attenzione quando si maneggia il mandrino e anche quando si maneggiano i ponteggi in seguito, perché le strutture tendono ad essere appiattite quando vengono schiacciate e piegate quando vengono rimosse dai liquidi. C'è anche la possibilità che le soluzioni che eseguono l'elettrofilatura con successo senza il mandrino criogenico possano essere fatalmente interrotte dal cambiamento di temperatura e dalle strutture cristalline. Durante la criofilatura, la quantità di ghiaccio che si forma sulla superficie del mandrino dipende fortemente dall'umidità, producendo variabilità nel risultato finale. Si consiglia quindi vivamente di contenere il processo di elettrofilatura all'interno di una cabina di controllo ambientale.
Per valutare le prestazioni cellulari su questi scaffold è necessario sterilizzare preventivamente il materiale. Ci sono molte opzioni disponibili per la sterilizzazione dei polimeri, inclusi metodi chimici, metodi di radiazione e metodi basati sul calore37,38. È importante valutare l'efficacia di ciascun metodo e l'idoneità sia per l'uso del materiale che per il materiale stesso. Questo protocollo utilizza la sterilizzazione in etanolo al 70% prima della liofilizzazione, il trattamento al plasma e l'immersione in una soluzione anti-anti all'1%. L'uso dell'etanolo consente di denaturare e disidratare proteine e microrganismi senza interrompere il materiale PCL37. L'uso di solventi più forti può provocare la dissoluzione del LCP. Il rivestimento al plasma è stato incorporato in questo metodo principalmente per aumentare l'idrofilia del PCL, che è notoriamente idrofobo, e migliorare l'attacco cellulare39,40. Convenientemente, questo funziona anche come fase di sterilizzazione secondaria, ma è necessario prestare attenzione a mantenere gli scaffold in un ambiente sterile prima e dopo il trattamento al plasma. Questo metodo si è dimostrato adatto per studi in vitro con terreni trattati con antibiotici. Tuttavia, per le applicazioni in vivo, è necessario prendere in considerazione opzioni più robuste come l'ossido di etilene (EtO) e l'esposizione ai raggi gamma. Una volta eseguita la sterilizzazione, le cellule possono essere seminate sullo scaffold e possono essere applicate tecniche di coltura cellulare standard per formare colture cellulari 3D in vitro.
È importante notare che i valori di rigidezza devono essere attribuiti alle diverse microstrutture formate all'interno degli scaffold. Il materiale sfuso (PCL) rimane costante tra gli scaffold. Pertanto, la rigidità del materiale sfuso non cambia tra i gruppi. Gli scaffold criogenici mostrano una rigidità molto inferiore rispetto agli altri gruppi a causa della ridotta connettività all'interno della matrice di fibre, che può essere vista nella Tabella 1. Si ritiene che la ridotta connettività induca una deformazione più dominante alla flessione rispetto alla deformazione dominante allo stiramento all'interno della struttura fibrosa41. È interessante notare che la rigidità dell'impalcatura non dipende fortemente dalla dimensione delle fibre nei gruppi casuali e criogenici. Tuttavia, la rigidità longitudinale delle fibre allineate mostra una dipendenza significativamente maggiore dalla dimensione delle fibre con il modulo di Young allo 0-2% di deformazione di 27,94 ± 8,63 MPa per le fibre piccole e 46,94 ± 3,48 MPa per le fibre grandi. A causa della natura di allungamento della prova di trazione, ciò implica una maggiore densità di PCL di massa all'interno della sezione trasversale longitudinale. È necessario ribadire che i dati meccanici qui presentati sono un'istantanea meccanica su macroscala delle architetture fibrose. Un'ulteriore caratterizzazione micromeccanica sarebbe utile per comprendere appieno le influenze meccaniche sulla scala cellulare.
In questo metodo sono state incluse sia architetture casuali che allineate per fornire un confronto tra morfologie isotrope e anisotrope. L'entità dell'allineamento delle fibre può essere osservata nelle immagini SEM della Figura 2 e nelle analisi delle fibre presentate nella Figura 2 e nella Figura 3. Le proprietà anisotrope sono osservate in molti dei tessuti del corpo. In particolare, questo è comunemente osservato in strutture cellulari allineate come quelle che si trovano nei tessuti muscolari e nervosi. Le strutture in fibra polimerica allineate offrono la capacità di ricapitolare queste strutture allineate in vitro42,43. Come descritto in precedenza, la funzione cellulare è sensibile ai cambiamenti morfologici e meccanici, quindi è necessario condurre ulteriori analisi funzionali sulle cellule legate allo scaffold per determinare l'influenza biologica di ciascun tipo di scaffold .
Rispetto ad altre tecniche di fabbricazione di scaffold esistenti, questo metodo fornisce un modo semplice per produrre strutture di scaffold su microscala con un controllo relativamente elevato sulle proprietà meccaniche e sulla morfologia. La fabbricazione alternativa di scaffold PCL come la separazione di fase, la lisciviazione salina e la schiumatura di gas consentono il controllo morfologico in termini di spazio vuoto e dimensione dei pori. Tuttavia, i pori e la geometria strutturale rimangono in gran parte gli stessi 44,45,46,47. Pertanto, qualità come il livello di isotropia non possono essere modificate così facilmente rispetto all'elettrofilatura. I materiali idrogel, popolari per la produzione di scaffold forniscono i mezzi per alterare la rigidità del substrato polimerico attraverso l'alterazione del livello delle catene polimeriche reticolate48. È anche possibile stampare in 3D tramite una varietà di metodi, fornendo un eccellente controllo sulla morfologia49. Tuttavia, il raggiungimento della risoluzione della scala di elettrofilatura nei materiali biocompatibili in idrogel rimane una sfida da implementare praticamente50,51. Gli scaffold elettrofilati sono stati comunemente utilizzati nella ricerca sull'ingegneria tissutale nell'ultimo decennio e l'introduzione di nuovi materiali e applicazioni con diversi tipi di cellule è sempre in fase di esplorazione. Mentre nuovi materiali sono costantemente in fase di sviluppo ai fini degli scaffold di elettrofilatura, rimangono opportunità per un'ulteriore caratterizzazione biologica dei materiali e dei metodi di elettrofilatura esistenti. Il metodo descritto si propone come metodo per facilitare lo studio biologico in vitro, in quanto è direttamente applicabile alle tecniche di base di coltura cellulare.
Riconoscimenti
Questo lavoro è stato sostenuto dal Engineering and Physical Sciences Research Council Grant Ref: EP/N509644/1, dal Grant UKRMPII Ref: MR/L022974/1 e dal MRC CCBN Grant Ref: MR/L012766/1. Gli autori ringraziano la Dott.ssa Alison McDonald e il Dott. David Kelly (COIL) per l'assistenza e la facilitazione dell'imaging al microscopio e il Prof. Alistair Elfick per l'accesso alle strutture di laboratorio (Institute for Bioengineering).
Materiali
| Name | Company | Catalog Number | Comments |
| 10 mm biopsy punch | Acuderm | P1025 | |
| 15 mL Falcon tube | Thermo-scientific | 339650 | |
| 20 mL glass vial | Fisherbrand | 11513542 | |
| 48 well cell culture plate | Greiner Bio-one | 677180 | |
| Anti-Anti 100X | Gibco | 15240062 | |
| Chloroform | Acros Organics | 13029236 | |
| DAPI | Sigma-aldrich | D9542 | |
| Eagles Minimum Essential Media | Gibco | 11090081 | |
| Electrospinner | IME Technologies | EC-DIG | |
| Fetal Bovine Serum | GE Healthcare | SH30071.03 | |
| Gold-Palladium Sputter coater | Emscope | SC500A | |
| HepG2 cell line | Sigma-aldrich | 85011430 | |
| Hexafluoroisopropanol (HFIP) | Manchester Organics | G26383 | |
| L-Glutamine 200 mM | Gibco | 25030081 | |
| MEM Non-essential Amino Acids | Gibco | 11140050 | |
| Methanol | Acros Organics | 11984591 | |
| Penicillin-Streptomycin 10,000 U/mL | Gibco | 15140122 | |
| Phalloidin | Abcam | ab176754 | |
| Phosphate Buffered Saline (PBS) | Sigma-aldrich | P4417-100TAB | |
| Plasma coater | Harrick Plasma | PDC-002 | |
| Polycaprolactone (Avg. MW 80,000) | Sigma-aldrich | 440744 | |
| PTFE Syringe | Fisherbrand | 12941031 | |
| Scanning Electron Microscope | Hitachi | S4700 | |
| T75 Culture Flask | Corning | CLS430641 | |
| Trypan blue (0.4%) | Gibco | 15250061 |
Riferimenti
- Akter, F. Principles of Tissue Engineering. Tissue Engineering Made Easy. Akter, F. , Academic Press. London, UK. 3-16 (2016).
- Van Vlierberghe, S., Dubruel, P., Schacht, E. Biopolymer-Based Hydrogels as Scaffolds for Tissue Engineering Applications: A Review. Biomacromolecules. 12 (5), 1387-1408 (2011).
- Murugan, R., Ramakrishna, S. Nano-featured scaffolds for tissue engineering: A review of spinning methodologies. Tissue Engineering. 12 (3), 435-447 (2006).
- Hollister, S. J. Porous scaffold design for tissue engineering. Nature Materials. 4 (7), 518-524 (2005).
- Jun, I., Han, H. S., Edwards, J. R., Jeon, H. Electrospun fibrous scaffolds for tissue engineering: Viewpoints on architecture and fabrication. International Journal of Molecular Sciences. 19 (3), E745(2018).
- Rashidi, H., et al. 3D human liver tissue from pluripotent stem cells displays stable phenotype in vitro and supports compromised liver function in vivo. Archives of Toxicology. 92 (10), 3117-3129 (2018).
- Grant, R., Hay, D. C., Callanan, A. A Drug-Induced Hybrid Electrospun Poly-Capro-Lactone: Cell-Derived Extracellular Matrix Scaffold for Liver Tissue Engineering. Tissue Engineering Part A. 23 (13-14), 650-662 (2017).
- Munir, N., McDonald, A., Callanan, A. A combinatorial approach: Cryo-printing and electrospinning hybrid scaffolds for cartilage tissue engineering. Bioprinting. 16, e00056(2019).
- Burton, T. P., Corcoran, A., Callanan, A. The effect of electrospun polycaprolactone scaffold morphology on human kidney epithelial cells. Biomedical Materials. 13 (1), 015006(2018).
- Reid, J. A., Callanan, A. Influence of aorta extracellular matrix in electrospun polycaprolactone scaffolds. Journal of Applied Polymer Science. 136 (44), 48181(2019).
- Grant, R., Hallett, J., Forbes, S., Hay, D., Callanan, A. Blended electrospinning with human liver extracellular matrix for engineering new hepatic microenvironments. Scientific Reports. 9 (1), 6293(2019).
- Grant, R., Hay, D., Callanan, A. From scaffold to structure: The synthetic production of cell derived extracellular matrix for liver tissue engineering. Biomedical Physics and Engineering Express. 4 (6), 065015(2018).
- Reid, J. A., Callanan, A. Hybrid cardiovascular sourced extracellular matrix scaffolds as possible platforms for vascular tissue engineering. Journal of Biomedical Materials Research Part B: Applied Biomaterials. , 1-15 (2019).
- Chen, C. S. Mechanotransduction - A field pulling together? Journal of Cell Science. 121 (20), 3285-3292 (2008).
- Wang, N. Review of cellular mechanotransduction. Journal of Physics D: Applied Physics. 50 (23), 233002(2017).
- Fan, Y. L., Zhao, H. C., Li, B., Zhao, Z. L., Feng, X. Q. Mechanical Roles of F-Actin in the Differentiation of Stem Cells: A Review. ACS Biomaterials Science and Engineering. 5 (8), 3788-3801 (2019).
- Davidson, A. J., Wood, W. Unravelling the Actin Cytoskeleton: A New Competitive Edge. Trends in Cell Biology. 26 (8), 569-576 (2016).
- Blanchoin, L., Boujemaa-Paterski, R., Sykes, C., Plastino, J. Actin dynamics, architecture, and mechanics in cell motility. Physiological Reviews. 94 (1), 235-263 (2014).
- Guvendiren, M., Burdick, J. A. The control of stem cell morphology and differentiation by hydrogel surface wrinkles. Biomaterials. 31 (25), 6511-6518 (2010).
- Wan, L. Q., et al. Geometric control of human stem cell morphology and differentiation. Integrative Biology. 2 (7-8), 346(2010).
- Park, J. S., et al. The effect of matrix stiffness on the differentiation of mesenchymal stem cells in response to TGF-β. Biomaterials. 32 (16), 3921-3930 (2011).
- Evans, N., et al. Substrate stiffness affects early differentiation events in embryonic stem cells. European Cells and Materials. 18, 1-14 (2009).
- Stukel, J. M., Willits, R. K. Mechanotransduction of Neural Cells Through Cell-Substrate Interactions. Tissue Engineering Part B: Reviews. 22 (3), 173-182 (2016).
- Charbonier, F. W., Zamani, M., Huang, N. F. Endothelial Cell Mechanotransduction in the Dynamic Vascular Environment. Advanced Biosystems. 3 (2), 1800252(2019).
- Nyitray, C. E., Chavez, M. G., Desai, T. A. Compliant 3D Microenvironment Improves β-Cell Cluster Insulin Expression Through Mechanosensing and β-Catenin Signaling. Tissue Engineering Part A. 20 (13-14), 1888-1895 (2014).
- Baker, B. M., et al. Cell-mediated fiber recruitment drives extracellular matrix mechanosensing in engineered fibrillar microenvironments. Nature Materials. 14 (12), 1262-1268 (2015).
- Evans, N. D., Gentleman, E. The role of material structure and mechanical properties in cell-matrix interactions. Journal of Materials Chemistry B. 2 (17), 2345(2014).
- Tusan, C. G., et al. Collective Cell Behavior in Mechanosensing of Substrate Thickness. Biophysical Journal. 114 (11), 2743-2755 (2018).
- Hotaling, N. A., Bharti, K., Kriel, H., Simon, C. G. DiameterJ: A validated open source nanofiber diameter measurement tool. Biomaterials. 61, 327-338 (2015).
- Cox, T. R., Erler, J. T. Remodeling and homeostasis of the extracellular matrix: Implications for fibrotic diseases and cancer. DMM Disease Models and Mechanisms. 4 (2), 165-178 (2011).
- Haider, A., Haider, S., Kang, I. K. A comprehensive review summarizing the effect of electrospinning parameters and potential applications of nanofibers in biomedical and biotechnology. Arabian Journal of Chemistry. 11 (8), 1165-1188 (2018).
- De Vrieze, S., et al. The effect of temperature and humidity on electrospinning. Journal of Materials Science. 44 (5), 1357-1362 (2009).
- Hohman, M. M., Shin, M., Rutledge, G., Brenner, M. P. Electrospinning and electrically forced jets I. Stability theory. Physics of Fluids. 13 (8), 2201-2220 (2001).
- Yarin, A. L., Koombhongse, S., Reneker, D. H. Bending instability in electrospinning of nanofibers. Journal of Applied Physics. 89 (5), 3018-3026 (2001).
- Feltz, K. P., Kalaf, E. A. G., Chen, C., Martin, R. S., Sell, S. A. A review of electrospinning manipulation techniques to direct fiber deposition and maximize pore size. Electrospinning. 1, 46-61 (2017).
- Simonet, M., Schneider, O. D., Neuenschwander, P., Stark, W. J. Ultraporous 3D polymer meshes by low-temperature electrospinning: Use of ice crystals as a removable void template. Polymer Engineering & Science. 47 (12), 2020-2026 (2007).
- Dai, Z., Ronholm, J., Tian, Y., Sethi, B., Cao, X. Sterilization techniques for biodegradable scaffolds in tissue engineering applications. Journal of Tissue Engineering. 7, 204173141664881(2016).
- Rogers, W. J. Sterilisation techniques for polymers. Sterilisation of Biomaterials and Medical Devices. Lerouge, S., Simmons, A. , Elsevier Science. Amsterdam, Netherlands. 151-211 (2012).
- Jokinen, V., Suvanto, P., Franssila, S. Oxygen and nitrogen plasma hydrophilization and hydrophobic recovery of polymers. Biomicrofluidics. 6 (1), 16501(2012).
- Recek, N., et al. Cell Adhesion on Polycaprolactone Modified by Plasma Treatment. International Journal of Polymer Science. 2016, 1-9 (2016).
- Fleck, N. A., Deshpande, V. S., Ashby, M. F. Micro-architectured materials: Past, present and future. Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. 466 (2121), 2495-2516 (2010).
- Cooper, A., Bhattarai, N., Zhang, M. Fabrication and cellular compatibility of aligned chitosan-PCL fibers for nerve tissue regeneration. Carbohydrate Polymers. 85 (1), 149-156 (2011).
- Patel, K. H., et al. Aligned nanofibers of decellularized muscle ECM support myogenic activity in primary satellite cells in vitro. Biomedical Materials. 14 (3), 035010(2019).
- Wang, L., et al. Fabrication of open-porous PCL/PLA tissue engineering scaffolds and the relationship of foaming process, morphology, and mechanical behavior. Polymers for Advanced Technologies. 30 (10), 2539-2548 (2019).
- Sartore, L., Inverardi, N., Pandini, S., Bignotti, F., Chiellini, F. PLA/PCL-based foams as scaffolds for tissue engineering applications. Materials Today: Proceedings. 7, 410-417 (2019).
- Munir, N., Callanan, A. Novel phase separated polycaprolactone/collagen scaffolds for cartilage tissue engineering. Biomedical Materials (Bristol). 13 (5), 051001(2018).
- Wang, W., et al. Fabrication of heterogeneous porous bilayered nanofibrous vascular grafts by two-step phase separation technique. Acta Biomaterialia. 79, 168-181 (2018).
- Kim, C., et al. Stem Cell Mechanosensation on Gelatin Methacryloyl (GelMA) Stiffness Gradient Hydrogels. Annals of Biomedical Engineering. 48 (2), 893-902 (2019).
- Chen, Z., et al. 3D Printing of Multifunctional Hydrogels. Advanced Functional Materials. 29 (20), 1900971(2019).
- Lee, J. M., Ng, W. L., Yeong, W. Y. Resolution and shape in bioprinting: Strategizing towards complex tissue and organ printing. Applied Physics Reviews. 6, 011307(2019).
- Zimmermann, R., et al. High resolution bioprinting of multi-component hydrogels. Biofabrication. 11 (4), 045008(2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon