Method Article
Kontrolle der Morphologie elektrogesponnener Polymere für das Tissue Engineering anhand der hepG2-Zelllinie
In diesem Artikel
Zusammenfassung
Diese Methode bietet die Möglichkeit, verschiedene Morphologien und Topographien von Polycaprolacton-Fasern zum Zwecke des Tissue Engineering zu testen. Kleine und große Fasern werden mit zufälligen Orientierungen, ausgerichteten Orientierungen und auch porösen, kryogenisch elektrogesponnenen Strukturen hergestellt und als Plattformen für Zellkulturen verwendet.
Zusammenfassung
Das Elektrospinnen bietet Forschern die Möglichkeit, reproduzierbare Polymerfasern im Mikro- bis Nanobereich herzustellen. Die 3D-Faserarchitektur von elektrogesponnenen Polymeren gilt als strukturelle Nachahmung der extrazellulären Matrix (ECM). Daher wurden elektrogesponnene Fasern, die aus biokompatiblen Polymeren hergestellt werden, von Tissue-Engineering-Forschern umfassend auf ihre potenzielle Rolle als künstliche EZM zur Steuerung des Gewebewachstums sowohl in vitro als auch in vivo untersucht. Alle Zellen reagieren sehr empfindlich auf ihre mechanische Umgebung. Dies wurde durch die Entdeckung mehrerer Mechanotransduktionswege gezeigt, die intrinsisch mit den Aktinfilamenten des Zytoskeletts verbunden sind. Das Zytoskelett fungiert als mechanischer Sensor, der die Funktionalität und Differenzierung der Wirtszelle in Abhängigkeit von der Steifigkeit und Morphologie ihres Substrats steuern kann. Elektrogesponnene Fasern können sowohl in Bezug auf die Fasergröße als auch auf die Morphologie abgestimmt werden, um die mechanische Umgebung innerhalb eines faserigen Polymergerüsts leicht zu modulieren. Hier werden Methoden zum Elektrospinnen von Polycaprolacton (PCL) für drei verschiedene Morphologien bei zwei verschiedenen Faserdurchmessern beschrieben. Die morphologischen Faserkategorien bestehen aus zufällig orientierten Fasern, ausgerichteten Fasern und porösen kryogenisch gesponnenen Fasern mit Durchmessern von 1 μm und 5 μm. Die in dieser Studie beschriebenen Methoden werden als Plattform zur Untersuchung der Wirkung der elektrogesponnenen Faserarchitektur auf die Gewebebildung vorgeschlagen. Das Verständnis dieser Effekte wird es den Forschern ermöglichen, die mechanischen Eigenschaften von elektrogesponnenen Fasern zu optimieren und das Potenzial dieser Technologie gründlicher zu demonstrieren.
Einleitung
In den letzten Jahrzehnten haben sich Tissue-Engineering-Methoden entwickelt, um Zellen eine biomimetische Umgebung zu bieten, um eine erfolgreiche Geweberegeneration zu fördern, sowohl für In-vitro-Gewebemodelle als auch für in vivo-regenerative Techniken. Diese Methoden regen typischerweise Zellen dazu an, 3D-Aggregate zu bilden, entweder allein oder unter Verwendung eines Leitgerüsts1. Gerüste können als poröse oder faserige Polymer-Nano-/Mikrostrukturen oder als stark wasserabsorbierende Hydrogele hergestellt werden 2,3,4. Das Polymer-Elektrospinnen ist eine gängige Herstellungstechnik, die unvliesige nanomikroskalige Polymerfasermatrizen liefert, die die faserige Architektur der nativen extrazellulären Matrix (ECM) nachahmen können5. Mehrere biokompatible Polymere sind für den Elektrospinnprozess anwendbar; Daher sind elektrogesponnene Fasern ein beliebtes Medium, um die Geweberegeneration zu erleichtern 6,7,8. Elektrogesponnene Fasern wurden in der Kultur einer Reihe von Geweben verwendet und zeigen einen vielversprechenden Weg für kostengünstige und reproduzierbare Gerüstplattformen 9,10,11,12,13.
Zellen haben eine ausgeprägte Sensibilität gegenüber ihrer mechanischen Umgebung. Frühere Forschungen haben diese wichtige Beziehung hervorgehoben, die als Mechanotransduktion bezeichnet wird und die Zellfunktion, Morphologie und Differenzierung beeinflussen kann 14,15. Die Basis des eukaryotischen zellulären Zytoskeletts besteht aus filamentösem Aktin und spielt eine wichtige mechanische Rolle bei der Zellteilung, Adhäsion, Migration, Kontraktion und Morphologie. Es wird durch äußere mechanische Reize über die Verbindung mit extrazellulären Oberflächenproteinenmanipuliert 16,17,18. Der morphologische Einfluss auf die Differenzierung von Stammzellen wurde in zahlreichen Studien nachgewiesen, indem die Form eines anhaftbaren Substrats verändert wurde, das dann in der Lage ist, die Zellform zu kontrollieren und den Differenzierungsprozess zu steuern19,20. Darüber hinaus beeinflusst auch die Steifigkeit des Substrats, an dem sich die Zellen festsetzen, das Schicksal und die Abstammung der Stammzellen21,22. Abgesehen von Stammzellen wurde beobachtet, dass diese Effekte auch Zellen verschiedener Abstammungslinien betreffen 23,24. Dreidimensionale Tissue-Engineering-Methoden haben Ergebnisse gezeigt, die denen ähneln, die in 2D-Mechanotransduktionsstudien sowohl mit Hydrogelen als auch mit fibrillären Gerüsten gefunden wurden 25,26,27. Darüber hinaus wird die Substratmechanik durch 3D-Zellaggregate über die Zell-Zell-Signalgebung28 kommuniziert. Die Materialmechanik spielt eine entscheidende Rolle bei der Steuerung der zellulären Funktionalität und sollte daher ein wichtiger Faktor bei der Konstruktion von Gerüsten für künstlich hergestellte Gewebe sein.
Das Ziel dieser Methode ist es, die Auswirkungen der Größe und Morphologie von elektrogesponnenen Polycaprolacton (PCL)-Fasern auf in vitro Zellkulturen zu verstehen. Die Methode ist eine Adaption früherer Forschungen, die sich auf das Tissue Engineering von Nierenkonzentrierten 9. Hier wird ein detaillierteres Schritt-für-Schritt-Protokoll angeboten, um die Gerüstrekonstruktion zu erleichtern und eine standardisierte Methode zu entwickeln, die auf alle Zelltypen anwendbar ist. Mit dieser Methode wurden sechs Gruppen von Gerüsten konstruiert: drei sind große 5 μm Fasern (LG) und die anderen drei kleine 1 μm Fasern (SM) mit unterschiedlichen PCL-Konzentrationen. Innerhalb dieser LG- und SM-Gruppen gibt es drei verschiedene morphologische Konstruktionen: zufällige Fasern (RA), ausgerichtete Fasern (AL) und poröse kryogene Fasern (CR). Diese Gerüstgruppen haben alle von Natur aus unterschiedliche Strukturen und bieten daher einzigartige lokale mechanische Umgebungen, an denen sich Zellen anheften. Um den morphologischen Effekt auf die Zellen zu demonstrieren, wurde die hepG2-Zelllinie als repräsentative Studie auf jede Gruppe von Gerüsten ausgesät. Diese Methode wird als Basisanalyse für das Design von elektrogesponnenen Gerüsten für alle Zelltypen von Stammzellen über Zelllinien bis hin zu Primärzellen angeboten.
Protokoll
1. Vorbereitung der Lösung
- Große (zufällige, ausgerichtete und kryogene) Fasern
- Bereiten Sie ein Verhältnis von 5:1 von Chloroform und Methanol vor, indem Sie 50 mL Chloroform und 10 mL Methanol in einer lösungsmittelbeständigen Glasflasche mit einer serologischen Glaspipette mischen.
ACHTUNG: Chloroform und Methanol sind giftige Lösungsmittel und das Mischen muss in einem Abzug erfolgen. - Um eine 19 w/v% PCL-Lösung in 5:1 Chloroform:Methanol herzustellen, wiegen Sie 1,9 g PCL und geben Sie 10 ml 5:1 Chloroform:Methanol in ein lösungsmittelbeständiges Glasfläschchen. Verschließen Sie die Durchstechflasche doppelt mit Paraffinfolie und lassen Sie die Durchstechflasche über Nacht auf einer Walze, damit sich das PCL vollständig auflösen kann.
ACHTUNG: Das Mischen muss in einem Abzug erfolgen.
- Bereiten Sie ein Verhältnis von 5:1 von Chloroform und Methanol vor, indem Sie 50 mL Chloroform und 10 mL Methanol in einer lösungsmittelbeständigen Glasflasche mit einer serologischen Glaspipette mischen.
- Kleine (zufällige und ausgerichtete) Fasern
- Zur Herstellung einer 7 w/v%-Lösung von PCL in Hexafluorisopropanol (HFIP) wiegen Sie 0,7 g PCL und mischen Sie es mit 10 ml HFIP in einem lösungsmittelsicheren Glasfläschchen. Verschließen Sie die Durchstechflasche doppelt mit Paraffinfolie und lassen Sie sie über Nacht auf einer Walze, damit sich das PCL vollständig auflösen kann.
ACHTUNG: HFIP ist hochgiftig und das Mischen muss in einem Abzug erfolgen.
- Zur Herstellung einer 7 w/v%-Lösung von PCL in Hexafluorisopropanol (HFIP) wiegen Sie 0,7 g PCL und mischen Sie es mit 10 ml HFIP in einem lösungsmittelsicheren Glasfläschchen. Verschließen Sie die Durchstechflasche doppelt mit Paraffinfolie und lassen Sie sie über Nacht auf einer Walze, damit sich das PCL vollständig auflösen kann.
- Kleine kryogene Fasern
ACHTUNG: Das Mischen muss in einem Abzug erfolgen.- Bereiten Sie ein Verhältnis von Chloroform und Methanol im Verhältnis 3:1 vor, indem Sie 30 mL Chloroform und 10 mL Methanol in einer lösungsmittelsicheren Glasflasche mit einer serologischen Glaspipette mischen.
- Um eine 14 w/v% PCL-Lösung in 3:1 Chloroform:Methanol herzustellen, wiegen Sie 1,4 g PCL und geben Sie 10 ml 3:1 Chloroform:Methanol in ein lösungsmittelbeständiges Glasfläschchen. Verschließen Sie die Durchstechflasche doppelt mit Paraffinfolie und lassen Sie sie über Nacht auf einer Walze, damit sich das PCL vollständig auflösen kann.
2. Aufbau des Elektrospinnens
HINWEIS: Die Parameter müssen eingestellt werden, bevor der Elektrospinnvorgang gestartet wird.
- Nadelstärke und -platzierung
- Verwenden Sie für große Fasern (zufällig, ausgerichtet und kryogen) eine Messingnadel mit einem Außendurchmesser von 1 mm / 0,8 mm ID und platzieren Sie die Nadel 230 mm von der Dornoberfläche entfernt.
- Verwenden Sie für kleine Fasern eine Messingnadel mit einem Außendurchmesser von 1 mm / 0,4 mm ID und platzieren Sie die Nadel 15 mm von der Dornoberfläche entfernt.
- Seitliche Nadelbewegung
HINWEIS: Die in Abbildung 1 beschriebenen Gerüste wurden mit einem Nadelverfahrweg von 100 mm bei 50 mm/s hergestellt, wobei während des gesamten Prozesses wiederholte Bewegungen nach links und rechts ausgeführt wurden.- Um die Querbewegung einzustellen, drücken Sie Bewegung | TNS 1 und stellen Sie die Startposition [mm] auf -50, die Entfernung [mm] auf 100, die Geschwindigkeit [mm/s] auf 50 und die Drehverzögerung [ms] auf 750 ein.
- Durchflussmenge der Spritzenpumpe
- Bei großen Fasern (zufällig, ausgerichtet und kryogen) drücken Sie auf der Benutzeroberfläche auf die Registerkarte Material und stellen Sie die Spritzenpumpe auf 4 mL/h ein.
- Bei kleinen (zufälligen und ausgerichteten) Fasern stellen Sie die Spritzenpumpe auf 0,8 mL/h ein.
- Bei kleinen kryogenen Fasern stellen Sie die Spritzenpumpe auf 2,5 mL/h ein.
- Spannungseinstellungen
- Stellen Sie für die großen Fasern die Nadelspannung auf +15 kV und die Dornspannung auf -4 kV ein, indem Sie auf der Benutzeroberfläche auf die Registerkarte Spannung drücken und die positiven und negativen Spannungswerte ändern.
- Für die kleinen (zufälligen und ausgerichteten) Fasern stellen Sie die Nadelspannung auf +17 kV und die Dornspannung auf -4 kV ein.
- Für die kleinen kryogenen Fasern stellen Sie die Nadelspannung auf +18 kV und die Dornspannung auf -4 kV ein.
- Dornrotation (große und kleine Fasern)
- Für zufällige Fasern drücken Sie auf Motion | Die Dorndrehzahl auf 250 U/min einstellen und einstellen.
- Stellen Sie für ausgerichtete Fasern die Dorndrehzahl auf 1.800 U/min ein.
- Für kryogene Fasern stellen Sie die Dorndrehzahl auf 180 U/min ein.
3. Elektrospinnen von zufälligen und ausgerichteten Fasern (große und kleine Fasern)
- Führen Sie die Nadel (Informationen zur Nadelgröße und -platzierung finden Sie in Abschnitt 2.1) in einen PTFE-Schlauch mit 1 mm Bohrung ein und befestigen Sie sie im Nadelhalter des Elektrospinners.
- Füllen Sie die 10 ml Polymerlösung unter einem Abzug in eine Spritze aus Polypropylen oder Glas (lösungsmittelfest) um. Achten Sie darauf, alle Blasen zu entfernen, indem Sie die Spritze stehen lassen, bevor Sie sie anzünden.
- Verbinden Sie die Spritze über den PTFE-Schlauch mit der Nadel und sichern Sie die Spritze in der Spritzenpumpe. Nach dem Anschließen grundieren Sie den PTFE-Schlauch, indem Sie den Spritzenkolben zusammendrücken und den Schlauch mit Polymerlösung füllen.
- Wickeln Sie den Dorn in Alufolie ein und befestigen Sie ihn an der Dorndrehvorrichtung.
- Schalten Sie die Dorndrehung ein, indem Sie die Tastenkombination Bewegung | Ziel | Drehen Sie die Spritzenpumpe durch Drücken Material | Starten Sie Pumpe 1.
- Wenn sich am Ende der Nadel eine kleine Polymerkügelchen gebildet hat, schalten Sie die Spannung ein, indem Sie ACTIVATE HIGH VOLTAGE drücken. Ein Polymerstrahl sollte dann von einem konischen Vorsprung der Polymerlösung emittiert werden, der als Taylor-Kegel bezeichnet wird. Überprüfen Sie den Dorn, um die Faserablagerung auf der Dornoberfläche zu bestätigen.
- Führen Sie den Elektrospinnprozess durch, bis die gewünschte Menge PCL-Lösung elektrogesponnen ist.
HINWEIS: Für die in Abbildung 1 dargestellten Gerüste wurden 4 ml Lösung elektrogesponnen. - Sobald das Elektrospinnen beendet ist, entfernen Sie die mit der Faser bedeckte Aluminiumfolie vom Dorn und lassen Sie sie über Nacht in einem Abzug, damit das Lösungsmittel überschüssig verdunsten kann.
- Lagern Sie die Fasern nach dem Verdampfen bei Raumtemperatur (RT).
4. Elektrospinnen von kryogenen Fasern
- Für das kryogene Elektrospinnen verwenden Sie den Kryospinndorn. Wiederholen Sie die Schritte 3.1 bis 3.3 und fahren Sie dann mit den folgenden Schritten fort.
- Wickeln Sie den Dorn in Alufolie ein.
- Füllen Sie den Dorn mit Trockeneispellets. Befestigen Sie die Kryo-Spinndornabdeckung auf dem Dorn, um sicherzustellen, dass Trockeneis nicht aus dem Dorn entweichen kann, aber der Druck entweichen kann. Fast sofort sollten sich Eiskristalle auf der Oberfläche des Dorns bilden.
ACHTUNG: Verwenden Sie beim Umgang mit Trockeneis Schutzhandschuhe, um Kälteverbrennungen zu vermeiden. - Befestigen Sie den Dorn an der Dorndrehvorrichtung und schalten Sie die Dorndrehung sofort ein, indem Sie die Taste Bewegung | Ziel | Drehen Sie die Spritzenpumpe durch Drücken Material | Starten Sie Pumpe 1.
- Sobald sich am Ende der Nadel eine Polymerperle gebildet hat, schalten Sie die Spannung ein, indem Sie ACTIVATE HIGH VOLTAGE drücken. Ein Polymerstrahl sollte dann von einem konischen Vorsprung der Polymerlösung (d. h. dem Taylor-Kegel) emittiert werden. Überprüfen Sie den Dorn, um die Faserablagerung auf der Dornoberfläche zu bestätigen.
- Nach 1 h Elektrospinnen unterbrechen Sie den Vorgang, indem Sie STOP ALL drücken und den Dorn mit Trockeneis auffüllen. Sorgen Sie für einen ausreichenden Schutz vor Lösungsmitteldämpfen beim Nachfüllen des Dorns. Führen Sie dies insgesamt 3x für 4 Stunden Elektrospinnzeit durch.
HINWEIS: Das Elektrospinnen kann durch Wiederholen der Schritte 4.4 und 4.5 fortgesetzt werden. - Sobald das Elektrospinnen beendet ist, entfernen Sie den Dorn vorsichtig und legen Sie ihn sofort für 24 Stunden in einen Gefriertrockner, um die Eiskristalle auf der Dornoberfläche zu sublimieren.
- Nach der Sublimation die faserbedeckte Folie vom Dorn entfernen und bei RT lagern, wobei darauf zu achten ist, dass sie nicht zerquetscht wird.
5. Gerüst-Stanzen
- Stanzen Sie Gerüste aus der Faserplatte mit einem 10-12 mm Biopsiestempel. Wenn die Fasern an der Aluminiumfolie haften bleiben, legen Sie die Gerüste in 70%iges Ethanol, um das Ablösen zu erleichtern.
6. Sterilisation und Plasmabeschichtung
- Legen Sie die Gerüste (1 Gerüst pro Vertiefung) in eine 24- oder 48-Well-Platte und waschen Sie sie 3x in 70%igem Ethanol. In der letzten Wäsche untergehen lassen, in den -80 °C Gefrierschrank stellen und einfrieren lassen.
- Nach dem Einfrieren die Platte in einen Gefriertrockner geben und 24 Stunden lang lyophilisieren. Die getrockneten Gerüste können nun plasmabeschichtet werden.
HINWEIS: Wenn kein Zugang zu einem Plasmabeschichter besteht, tauchen Sie die Gerüste in 1 % Antibiotikum-Antimykotikum (Anti-Anti) in phosphatgepufferte Kochsalzlösung (PBS) und lassen Sie sie über Nacht bei 37 °C inkubieren. - Legen Sie die Platte in die Plasmakammer und nehmen Sie den Deckel ab. Lassen Sie den Plasmacoater 30 s lang bei 500 mTorr und mittlerer Hochfrequenzleistung (RF) laufen.
- Tauchen Sie die Gerüste nach der Plasmabeschichtung in 1 ml PBS und 1 % Anti-Anti. Die Gerüste sollten die PBS-Lösung leicht aufnehmen.
HINWEIS: Die Gerüste können jetzt mit Zellen bestückt werden.
7. Vorbereitung und Aussaat der Zellen
HINWEIS: Die unten angegebene grundlegende Zellkulturtechnik gilt für die hepg2-Zellen, die zu Demonstrationszwecken in den repräsentativen Ergebnissen verwendet werden. Diese Prinzipien können auf jeden adhärenten Zelltyp angewendet werden; Unterschiedliche Zellen können jedoch unterschiedliche Materialien und unterschiedliche Prozesse erfordern. Die Handhabung der Zellen muss in einer biologischen Sicherheitswerkbank nach aseptischer Technik durchgeführt werden.
- Nehmen Sie 1 x 106 kryokonservierte hepg2-Zellen und säen Sie sie in einen T75-Zellkulturkolben mit 12 ml vollständigem Medium, bestehend aus Eagle's Minimum Essential Media (EMEM), ergänzt mit 10 % fötalem Rinderserum, 100 U/ml Penicillin-Streptomycin, 5 mM L-Glutamin und 1 % nichtessentiellen Aminosäuren.
- Sobald die Zellen eine Konfluenz von 80 % erreicht haben, lösen Sie die Zellen aus dem Kulturkolben, indem Sie sie 3x in PBS waschen und 4 Minuten lang in 2 ml Trypsin bei 37 °C inkubieren. Nach dem Klopfen auf den Kolben sollten sich die Zellen lösen.
- Deaktivieren Sie das Trypsin, indem Sie 8 mL des vollständigen Mediums hinzufügen. Übertragen Sie die Zellsuspension in ein 15-ml-Röhrchen und schleudern Sie die Zellen in einer Zentrifuge bei 120 x g für 5 min.
- Entfernen Sie den Überstand über dem Küvettenpellet mit einer Ansaugpipette und ersetzen Sie ihn durch 5 mL vollständiges Medium. Resuspendieren Sie die Zellen, indem Sie mit einer serologischen 5-ml-Pipette auf und ab pipettieren.
- Zählen Sie die resultierende Zellsuspension mit der Trypanblau-Ausschlussmethode. Nehmen Sie 100 μl Zellsuspension und fügen Sie sie zu 100 μl Trypanblau in einer 1,5-ml-Durchstechflasche hinzu. Geben Sie die Mischung auf ein Hämozytometer unter einem Glasdeckglas und zählen Sie die Zellen unter einem Mikroskop.
- Stellen Sie die Zellkonzentration auf 2,6 x 106 Zellen/ml ein, indem Sie das gesamte Medium hinzufügen oder entfernen. Um das Medium zu entfernen, zentrifugieren Sie die Zellen 5 Minuten lang bei 220 x g , entfernen Sie das erforderliche Medium und resuspendieren Sie die Zellen.
- Aspirieren Sie das 1%ige Anti-Anti in PBS aus der Well-Platte und säen Sie mit einer 200-μl-Pipette 50 μl mit 2,6 x 106 Zellen/ml-Zellsuspension auf die Gerüstoberfläche.
- Lassen Sie die Zellen unter Inkubation bei 37 °C und 5 % CO2 1-3 h lang anheften, wobei darauf zu achten ist, dass sie nicht austrocknen. Nach dem Anbringen 300 μl (für eine 48-Well-Platte) oder 500 μl (für eine 24-Well-Platte) Nährmedium hinzufügen und bei 37 °C und 5 % CO2 inkubieren.
HINWEIS: Von hier aus können Standard-Zellkulturtechniken bis zur weiteren Funktionsanalyse verwendet werden.
Ergebnisse
Abbildung 1 zeigt Rasterelektronenmikroskopische (REM) Bilder von kleinen (~1 μm) und großen Fasern (~5 μm), die aus PCL-Lösungen hergestellt wurden. Die Fasern wurden vor der REM-Bildgebung 30 s lang mit einem Sputter-Coater mit Gold-Palladium (60:40) gesputtert. Große Fasern wurden mit einer hohen PCL-Konzentration von 19 w/v% in einer 5:1-Lösung aus Chloroform und Methanol hergestellt, um eine hochviskose PCL-Lösung zu erzeugen. Diese hochviskose Lösung wurde dann mit einer hohen Durchflussrate elektrogesponnen, um einen großen Faden aus Polymerlösung innerhalb des elektrischen Feldes zu emittieren. Daher war ein großer Abstand von 230 mm zwischen der Nadel und dem Dorn erforderlich, um eine effektive Verdampfung des Lösungsmittels vor der Abscheidung auf dem Dorn zu gewährleisten. Umgekehrt wurden kleinere Fasern mit einer niedrigen PCL-Konzentration von 7 w/v% in HFIP hergestellt, um eine niedrigviskose PCL-Lösung zu erzeugen. Das Elektrospinnen der niedrigviskosen PCL-Lösung bei einer niedrigen Durchflussrate stellte sicher, dass ein dünnerer Faden der PCL-Lösung innerhalb des elektrischen Feldes von der Nadel emittiert wurde. Der dünnere Faden ermöglichte eine schnellere Verdunstung des Lösungsmittels und die Nadel musste mit 70 mm näher am Dorn liegen, um eine stabile Abscheidung der Fasern zu gewährleisten. Für das Elektrospinnen kleiner kryogener Fasern war eine Änderung der PCL-Lösung notwendig, um ein zuverlässiges Protokoll zu erreichen. PCL in HFIP, das auf den kryogenen Dorn elektrogesponnen wurde, führte wiederholt zu einer desintegrierten Faserstruktur. Das Elektrospinnen einer PCL-Konzentration von 14 w/v% in 3:1 Chloroform-Methanol löste dieses Problem; Dies führte jedoch zu einer größeren Variation der Fasergröße im gesamten Gerüst. Das Ausmaß der Faserausrichtung (Faserradius und -ausrichtung) für jedes Gerüst wurde mit dem ImageJ DiameterJ-Plugin29 analysiert und in Abbildung 2 und Abbildung 3 dargestellt.

Abbildung 1: REM-Bilder, die die morphologischen Eigenschaften der einzelnen Gerüstgruppen zeigen. Die obere Reihe zeigt die kleinen Fasern und die untere Reihe die großen Fasern. Morphologische Gruppen werden von links nach rechts als zufällige Fasern, ausgerichtete Fasern bzw. kryogene Fasern aufgeführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
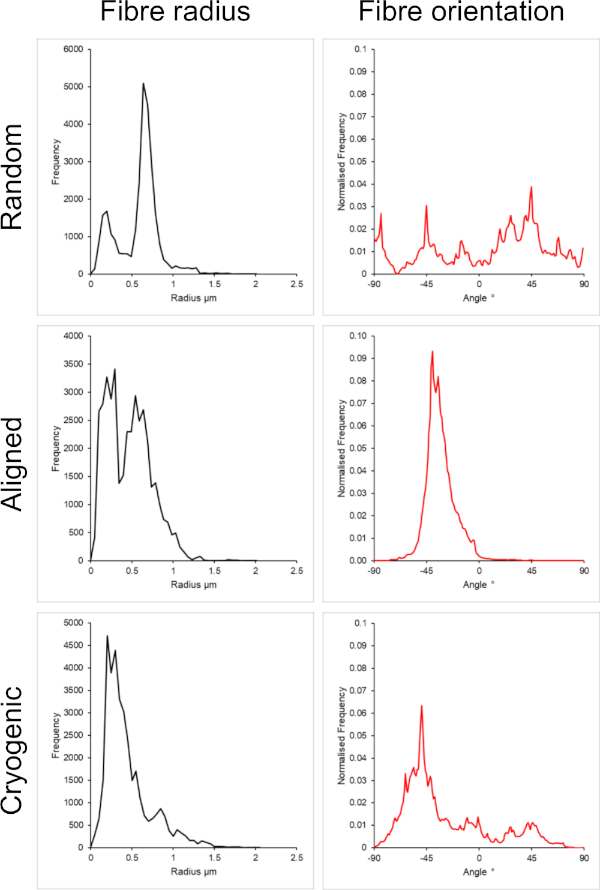
Abbildung 2: Daten zum Faserradius (links) und zur Faserausrichtung (rechts) aus dem DiameterJ-Plug-in für den kleinen Satz von Fasern. Die Morphologie wird von oben nach unten als zufällige Fasern, ausgerichtete Fasern bzw. kryogene Fasern aufgeführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
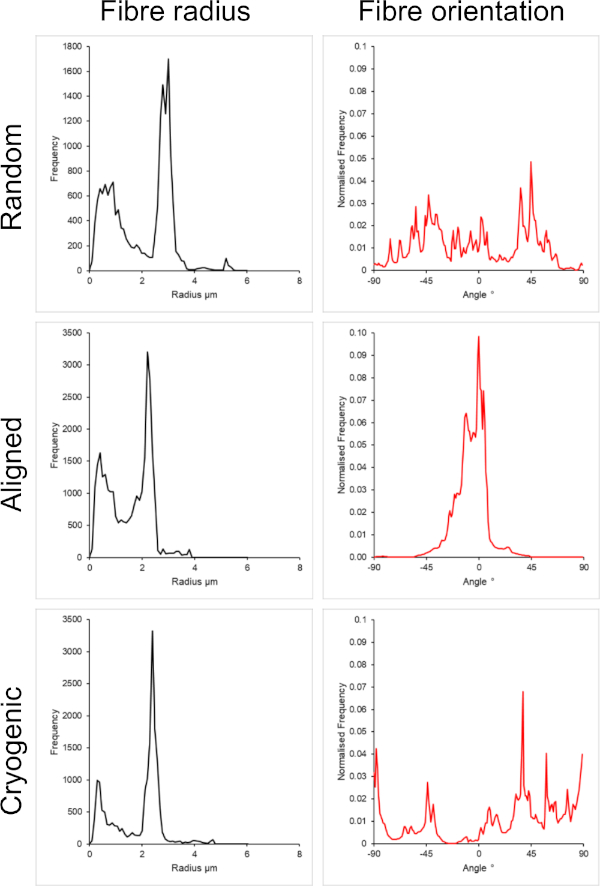
Abbildung 3: Daten zum Faserradius (links) und zur Faserausrichtung (rechts) aus dem DiameterJ-Plug-in für die große Anzahl von Fasern. Die Morphologie wird von oben nach unten als zufällige Fasern, ausgerichtete Fasern bzw. kryogene Fasern aufgeführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Dieses Verfahren bot uns einen Satz Gerüste mit sechs deutlich unterschiedlichen Zugeigenschaften, die mit einer Zugprüfmaschine nach den zuvor beschriebenen Methoden9 bestimmt wurden. Wie in Tabelle 1 gezeigt, reichen die makroskaligen Youngs-Module von 46,94 ± 3,48 MPa in den großen ausgerichteten Fasern bis zu 0,20 ± 0,01 MPa in den großen kryogenen Fasern. Die physiologischen Gewebesteifigkeitswerte reichen von 100 Pa (Nervengewebe) bis 2-4 GPa (Knochengewebe)30; Alle hier angegebenen Gerüststeifigkeitswerte lagen innerhalb dieses Bereichs.
| Gerüst | Elastizitätsmodul (MPa) für die Dehnung% | ||||
| 0–2% | 2–4% | 4–6% | 6–8% | 8–10% | |
| SM. RA | 11.14 ± 2.13 Uhr | 9,31 ± 0,43 | 6,75 ± 0,64 | 4,75 ± 0,59 | 3,32 ± 0,40 |
| SM. AL | 27.94 ± 8.63 | 28.27 ± 7.36 Uhr | 16.34 ± 4.87 | 9.10 ± 3.75 | 5.85 ± 3.11 |
| SM. CR | 0,27 ± 0,11 | 0,31 ± 0,44 | 0,31 ± 0,65 | 0,29 ± 0,59 | 0,26 ± 0,40 |
| LG. RA | 9,23 ± 0,78 | 8,22 ± 0,87 | 5,96 ± 0,68 | 3,96 ± 0,59 | 2,63 ± 0,45 |
| LG. AL | 46,94 ± 3,48 | 38.03 ± 2.46 | 27.69 ± 1.22 | 16.10 ± 1.61 | 7,87 ± 1,32 |
| LG. CR | 0,20 ± 0,01 | 0,16 ± 0,01 | 0,12 ± 0,01 | 0,10 ± 0,01 | 0,09 ± 0,01 |
Tabelle 1: Zugversuchsdaten für jede Gerüstgruppe in Abständen von 2 % Dehnung. SM. RA = Kleiner Zufall, SM. AL = Klein ausgerichtet, SM. CR = Klein kryogen, LG. RA = Großer Zufall, LG. AL = Groß ausgerichtet und LG. CR = Großkryogen. Die Daten werden als Mittelwert ± SD dargestellt, n = 5.
Abbildung 4 zeigt die DAPI- und Phalloidin-Färbung, die zur Visualisierung der zellulären Morphologie verwendet wird. Die verwendete Färbemethode ist in der Literatur etabliert11,12. Die Bilder wurden mit einem Mikroskop (Table of Materials) mit einem Objektiv mit 40-facher Vergrößerung aufgenommen. Die Bilder zeigen, dass die mit dieser Methode hergestellten ausgerichteten Fasern die Morphologie der hepG2-Zellen verlängerten und proliferierende Zellen entlang der Länge der Fasern lenkten, wodurch eine Richtungsabhängigkeit innerhalb der Zellkultur entstand. Im Gegensatz dazu zeigten die hepG2-Zellen auf zufälligen Fasern nicht die gerichtete Proliferation und Elongation, die in den ausgerichteten Strukturen beobachtet wurde. In den zufälligen Strukturen zeigten die hepG2-Zellen eine regelmäßigere Morphologie mit ausgedehnten Ausstülpungen, die sich an die umgebenden PCL-Fasern anheften.
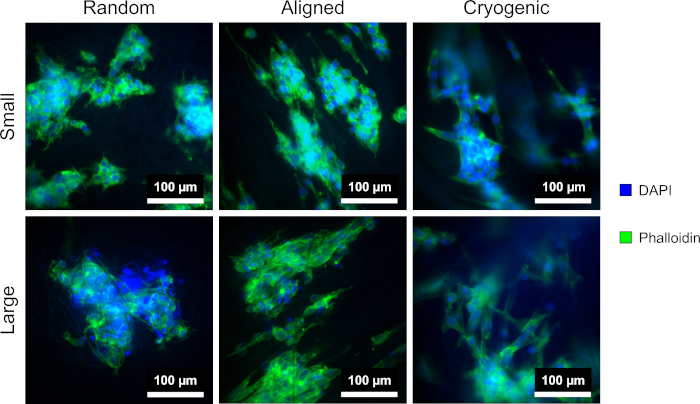
Abbildung 4: DAPI (blau) und Phalloidin (grün) gefärbte hepG2-Zellen auf den verschiedenen Gerüstmorphologien: zufällig (links), ausgerichtet (Mitte) und kryogen (rechts). Die obere Reihe zeigt kleine Fasern und die untere Reihe zeigt große Fasern. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die Herstellung unterschiedlicher Fasergrößen wurde durch eine Kombination verschiedener Lösungsmittel, PCL-Konzentrationen und Elektrospinnparameter erreicht. Die Art des Polymers, sein Molekulargewicht und das Lösungsmittel beeinflussen die Viskositäts- und Ladungseigenschaften der resultierenden Lösung stark und haben daher einen starken Einfluss auf die Elektrospinneigenschaften31. Die bei diesem Verfahren angezeigten Spannungen können sich je nach den Bedingungen, unter denen das Elektrospinnen durchgeführt wird, ändern. Temperatur und Luftfeuchtigkeit beeinflussen das Verhalten des Elektrospinnprozesses32. Daher wird dem Leser empfohlen, darauf vorbereitet zu sein, die Spannung zu ändern, um eventuellen Hindernissen entgegenzuwirken und einen stabilen Taylor-Konus zu erreichen. Es wird empfohlen, den Elektrospinner in einem Gehäuse für die Umgebungskontrolle unterzubringen, um die Variabilität von Charge zu Charge im Elektrospinnprozess zu reduzieren.
Das Erreichen der verschiedenen Morphologien, die in diesem Verfahren vorgestellt werden, ist aufgrund der Fähigkeiten der IME-Elektrospinnvorrichtung möglich. Ein Dorn mit variabler Geschwindigkeit ist für die Steuerung der Faserausrichtung unerlässlich. Die Dornrotation bei niedrigen Drehzahlen (<250 U/min) ergibt aufgrund des Verhaltens des Polymerstrahls zufällig ausgerichtete Fasern. Wenn die geladene Polymerlösung von der Nadel emittiert wird, induzieren die internen Ladungen und aerodynamischen Kräfte einen chaotischen Peitscheneffekt, der ausgenutzt wird, um eine chaotische Anordnung von Fasern auf dem Dorn33, 34 abzulegen. Dieser Peitscheneffekt kann durch eine Erhöhung der Dorndrehzahl über 1.800 U/min überwunden werden. Fasern, die auf einem solchen Dorn mit hoher Drehzahl abgeschieden werden, weisen eine ausgerichtete Struktur auf, da die Oberflächengeschwindigkeit ausreicht, um einer Querbewegung der Peitschenfaser effektiv entgegenzuwirken. Es ist wichtig zu beachten, dass bei hohen Dorngeschwindigkeiten die Umgebungsluft gestört werden kann, was sich negativ auf die Produktion eines stabilen Taylor-Kegels auswirken kann.
Hochporöse Kryogerüste werden hergestellt, indem der Dorn mit Trockeneis bei -78,5 °C gefüllt wird. Dies senkt die Temperatur des Dorns und fördert die Kondensation und das Einfrieren von Wassertröpfchen auf der Oberfläche. Die gebildeten Kristalle weisen Peaks auf, die aus der Dornoberfläche austreten, und die Fasern lagern sich überall in den Peaks ab. Nach dem Aussublimieren der Eiskristalle verbleibt eine poröse Struktur von Fasern auf dem Dorn35,36. Das Gewicht und die Zerbrechlichkeit der Kristalle schränken die Fähigkeit ein, porös ausgerichtete Fasern zu erzeugen, da zu hohe Dorngeschwindigkeiten (>250 U/min) dazu führen, dass sich die Kristalle und Fasern aufgrund zu hoher Zentripetal- und aerodynamischer Kräfte vom Dorn lösen. Mit dieser Methode ist es möglich, aufgrund der Zerbrechlichkeit der gebildeten Strukturen Schwierigkeiten zu haben. Beim Umgang mit dem Dorn und auch beim anschließenden Umgang mit den Gerüsten ist Vorsicht geboten, da die Strukturen beim Zusammendrücken zum Abflachen und beim Entfernen aus Flüssigkeiten gefaltet werden. Es besteht auch die Möglichkeit, dass Lösungen, die ohne den kryogenen Dorn erfolgreich elektrospinnen, durch die Temperaturänderung und die Kristallstrukturen tödlich gestört werden können. Beim Kryospinnen hängt die Menge an Eis, die sich auf der Dornoberfläche bildet, stark von der Feuchtigkeit ab, was zu einer Variabilität des Endergebnisses führt. Es wird daher dringend empfohlen, den Elektrospinnprozess in einem Gehäuse für die Umgebungskontrolle zu unterbringen.
Um die zelluläre Leistung auf diesen Gerüsten zu beurteilen, ist es notwendig, das Material zuvor zu sterilisieren. Es gibt viele Optionen für die Sterilisation von Polymeren, einschließlich chemischer Methoden, Bestrahlungsmethoden und wärmebasierter Methoden37,38. Es ist wichtig, die Wirksamkeit jeder Methode und die Eignung sowohl für die Verwendung des Materials als auch für das Material selbst zu bewerten. Dieses Protokoll verwendet die Sterilisation in 70%igem Ethanol vor dem Lyophilisieren, Plasmabehandeln und Eintauchen in eine 1%ige Anti-Anti-Lösung. Die Verwendung von Ethanol ermöglicht es, Proteine und Mikroorganismen zu denaturieren und zu dehydrieren, ohne das PCL-Material zu stören37. Die Verwendung stärkerer Lösungsmittel kann zur Auflösung des PCL führen. Die Plasmabeschichtung wurde in diesem Verfahren in erster Linie integriert, um die Hydrophilie von PCL, das notorisch hydrophob ist, zu erhöhen und die Zelladhäsion zu verbessern39,40. Praktischerweise funktioniert dies auch als sekundärer Sterilisationsschritt, es muss jedoch darauf geachtet werden, dass die Gerüste vor und nach der Plasmabehandlung in einer sterilen Umgebung aufbewahrt werden. Diese Methode hat sich für in vitro-Studien mit antibiotikabehandelten Medien als geeignet erwiesen. Für In-vivo-Anwendungen müssen jedoch robustere Optionen wie Ethylenoxid (EtO) und Gamma-Exposition in Betracht gezogen werden. Sobald die Sterilisation durchgeführt wurde, können die Zellen auf das Gerüst ausgesät werden und Standard-Zellkulturtechniken können angewendet werden, um 3D-Zellkulturen in vitro zu bilden.
Es ist wichtig zu beachten, dass die Steifigkeitswerte auf die unterschiedlichen Mikrostrukturen zurückzuführen sind, die sich innerhalb der Gerüste bilden. Das Schüttgut (PCL) bleibt zwischen den Gerüsten konstant. Daher ändert sich die Steifigkeit des Schüttguts nicht zwischen den Gruppen. Die kryogenen Gerüste weisen aufgrund der reduzierten Konnektivität innerhalb der Fasermatrix, die in Tabelle 1 zu sehen ist, eine deutlich geringere Steifigkeit als die anderen Gruppen auf. Es wird angenommen, dass die verminderte Konnektivität eine stärker biegedominante Verformung induziert, im Gegensatz zu einer dehnungsdominanten Verformung innerhalb der faserigen Struktur41. Interessanterweise hängt die Gerüststeifigkeit nicht stark von der Fasergröße in der zufälligen und kryogenen Gruppe ab. Die Längssteifigkeit der ausgerichteten Fasern zeigt jedoch eine signifikant höhere Abhängigkeit von der Fasergröße, wobei der Elastizitätsmodul bei 0-2% Dehnung 27,94 ± 8,63 MPa für kleine Fasern und 46,94 ± 3,48 MPa für große Fasern beträgt. Aufgrund der Dehnung des Zugversuchs bedeutet dies eine höhere PCL-Dichte innerhalb des Längsquerschnitts. Es muss noch einmal darauf hingewiesen werden, dass es sich bei den hier vorgestellten mechanischen Daten um eine makroskalige mechanische Momentaufnahme der faserigen Architekturen handelt. Eine weitere mikromechanische Charakterisierung wäre von Vorteil, um die mechanischen Einflüsse auf der Zellskala vollständig zu verstehen.
Sowohl zufällige als auch ausgerichtete Architekturen wurden in diese Methode einbezogen, um einen Vergleich zwischen isotropen und anisotropen Morphologien zu ermöglichen. Das Ausmaß der Faserausrichtung ist in den REM-Bildern in Abbildung 2 und den Faseranalysen in Abbildung 2 und Abbildung 3 zu sehen. Anisotrope Eigenschaften werden in vielen Geweben des Körpers beobachtet. Dies wird insbesondere häufig in ausgerichteten zellulären Strukturen beobachtet, wie sie in Muskel- und Nervengewebe zu finden sind. Ausgerichtete polymere Faserstrukturen bieten die Möglichkeit, diese ausgerichteten Strukturen in vitro zu rekapitulieren42,43. Wie bereits beschrieben, reagiert die Zellfunktion empfindlich auf morphologische und mechanische Veränderungen, so dass weitere funktionelle Analysen an gerüstgebundenen Zellen durchgeführt werden sollten, um den biologischen Einfluss jedes Gerüsttyps zu bestimmen.
Im Vergleich zu anderen bestehenden Gerüstherstellungstechniken bietet diese Methode eine einfache Möglichkeit, mikroskalige Gerüststrukturen mit vergleichsweise hoher Kontrolle über die mechanischen Eigenschaften und die Morphologie herzustellen. Alternative PCL-Gerüstherstellung wie Phasentrennung, Salzlaugung und Gasschäumen ermöglichen eine morphologische Kontrolle in Bezug auf den Hohlraum und die Porengröße. Die Poren- und Strukturgeometrie bleibt jedoch weitgehend gleich 44,45,46,47. Daher lassen sich Eigenschaften wie der Grad der Isotropie im Vergleich zum Elektrospinnen nicht so leicht verändern. Hydrogelmaterialien, die für die Herstellung von Gerüsten beliebt sind, bieten die Möglichkeit, die Steifigkeit des Polymersubstrats durch Änderung des Niveaus der vernetzten Polymerkettenzu verändern 48. Es ist auch möglich, mit einer Vielzahl von Methoden in 3D zu drucken, was eine hervorragende Kontrolle über die Morphologiebietet 49. Das Erreichen einer Auflösung im Elektrospinnmaßstab in biokompatiblen Hydrogelmaterialien bleibt jedoch eine Herausforderung, die in der Praxis umgesetzt werdenmuss 50,51. Elektrogesponnene Gerüste waren in den letzten zehn Jahren in der Tissue-Engineering-Forschung weit verbreitet, und die Einführung neuer Materialien und Anwendungen mit unterschiedlichen Zelltypen wird ständig erforscht. Obwohl ständig neue Materialien für Elektrospinnengerüste entwickelt werden, bestehen weiterhin Möglichkeiten zur weiteren biologischen Charakterisierung bestehender Elektrospinnmaterialien und -methoden. Das beschriebene Verfahren wird als Verfahren zur Erleichterung biologischer In-vitro-Studien vorgeschlagen, da es direkt auf grundlegende Zellkulturtechniken anwendbar ist.
Danksagungen
Diese Arbeit wurde unterstützt durch den Engineering and Physical Sciences Research Council Grant Ref: EP/N509644/1, den UKRMPII Grant Ref: MR/L022974/1 und den MRC CCBN Grant Ref: MR/L012766/1. Die Autoren danken Dr. Alison McDonald und Dr. David Kelly (COIL) für die Unterstützung und Erleichterung der mikroskopischen Bildgebung und Prof. Alistair Elfick für den Zugang zu den Laboreinrichtungen (Institute for Bioengineering).
Materialien
| Name | Company | Catalog Number | Comments |
| 10 mm biopsy punch | Acuderm | P1025 | |
| 15 mL Falcon tube | Thermo-scientific | 339650 | |
| 20 mL glass vial | Fisherbrand | 11513542 | |
| 48 well cell culture plate | Greiner Bio-one | 677180 | |
| Anti-Anti 100X | Gibco | 15240062 | |
| Chloroform | Acros Organics | 13029236 | |
| DAPI | Sigma-aldrich | D9542 | |
| Eagles Minimum Essential Media | Gibco | 11090081 | |
| Electrospinner | IME Technologies | EC-DIG | |
| Fetal Bovine Serum | GE Healthcare | SH30071.03 | |
| Gold-Palladium Sputter coater | Emscope | SC500A | |
| HepG2 cell line | Sigma-aldrich | 85011430 | |
| Hexafluoroisopropanol (HFIP) | Manchester Organics | G26383 | |
| L-Glutamine 200 mM | Gibco | 25030081 | |
| MEM Non-essential Amino Acids | Gibco | 11140050 | |
| Methanol | Acros Organics | 11984591 | |
| Penicillin-Streptomycin 10,000 U/mL | Gibco | 15140122 | |
| Phalloidin | Abcam | ab176754 | |
| Phosphate Buffered Saline (PBS) | Sigma-aldrich | P4417-100TAB | |
| Plasma coater | Harrick Plasma | PDC-002 | |
| Polycaprolactone (Avg. MW 80,000) | Sigma-aldrich | 440744 | |
| PTFE Syringe | Fisherbrand | 12941031 | |
| Scanning Electron Microscope | Hitachi | S4700 | |
| T75 Culture Flask | Corning | CLS430641 | |
| Trypan blue (0.4%) | Gibco | 15250061 |
Referenzen
- Akter, F. Principles of Tissue Engineering. Tissue Engineering Made Easy. Akter, F. , Academic Press. London, UK. 3-16 (2016).
- Van Vlierberghe, S., Dubruel, P., Schacht, E. Biopolymer-Based Hydrogels as Scaffolds for Tissue Engineering Applications: A Review. Biomacromolecules. 12 (5), 1387-1408 (2011).
- Murugan, R., Ramakrishna, S. Nano-featured scaffolds for tissue engineering: A review of spinning methodologies. Tissue Engineering. 12 (3), 435-447 (2006).
- Hollister, S. J. Porous scaffold design for tissue engineering. Nature Materials. 4 (7), 518-524 (2005).
- Jun, I., Han, H. S., Edwards, J. R., Jeon, H. Electrospun fibrous scaffolds for tissue engineering: Viewpoints on architecture and fabrication. International Journal of Molecular Sciences. 19 (3), E745(2018).
- Rashidi, H., et al. 3D human liver tissue from pluripotent stem cells displays stable phenotype in vitro and supports compromised liver function in vivo. Archives of Toxicology. 92 (10), 3117-3129 (2018).
- Grant, R., Hay, D. C., Callanan, A. A Drug-Induced Hybrid Electrospun Poly-Capro-Lactone: Cell-Derived Extracellular Matrix Scaffold for Liver Tissue Engineering. Tissue Engineering Part A. 23 (13-14), 650-662 (2017).
- Munir, N., McDonald, A., Callanan, A. A combinatorial approach: Cryo-printing and electrospinning hybrid scaffolds for cartilage tissue engineering. Bioprinting. 16, e00056(2019).
- Burton, T. P., Corcoran, A., Callanan, A. The effect of electrospun polycaprolactone scaffold morphology on human kidney epithelial cells. Biomedical Materials. 13 (1), 015006(2018).
- Reid, J. A., Callanan, A. Influence of aorta extracellular matrix in electrospun polycaprolactone scaffolds. Journal of Applied Polymer Science. 136 (44), 48181(2019).
- Grant, R., Hallett, J., Forbes, S., Hay, D., Callanan, A. Blended electrospinning with human liver extracellular matrix for engineering new hepatic microenvironments. Scientific Reports. 9 (1), 6293(2019).
- Grant, R., Hay, D., Callanan, A. From scaffold to structure: The synthetic production of cell derived extracellular matrix for liver tissue engineering. Biomedical Physics and Engineering Express. 4 (6), 065015(2018).
- Reid, J. A., Callanan, A. Hybrid cardiovascular sourced extracellular matrix scaffolds as possible platforms for vascular tissue engineering. Journal of Biomedical Materials Research Part B: Applied Biomaterials. , 1-15 (2019).
- Chen, C. S. Mechanotransduction - A field pulling together? Journal of Cell Science. 121 (20), 3285-3292 (2008).
- Wang, N. Review of cellular mechanotransduction. Journal of Physics D: Applied Physics. 50 (23), 233002(2017).
- Fan, Y. L., Zhao, H. C., Li, B., Zhao, Z. L., Feng, X. Q. Mechanical Roles of F-Actin in the Differentiation of Stem Cells: A Review. ACS Biomaterials Science and Engineering. 5 (8), 3788-3801 (2019).
- Davidson, A. J., Wood, W. Unravelling the Actin Cytoskeleton: A New Competitive Edge. Trends in Cell Biology. 26 (8), 569-576 (2016).
- Blanchoin, L., Boujemaa-Paterski, R., Sykes, C., Plastino, J. Actin dynamics, architecture, and mechanics in cell motility. Physiological Reviews. 94 (1), 235-263 (2014).
- Guvendiren, M., Burdick, J. A. The control of stem cell morphology and differentiation by hydrogel surface wrinkles. Biomaterials. 31 (25), 6511-6518 (2010).
- Wan, L. Q., et al. Geometric control of human stem cell morphology and differentiation. Integrative Biology. 2 (7-8), 346(2010).
- Park, J. S., et al. The effect of matrix stiffness on the differentiation of mesenchymal stem cells in response to TGF-β. Biomaterials. 32 (16), 3921-3930 (2011).
- Evans, N., et al. Substrate stiffness affects early differentiation events in embryonic stem cells. European Cells and Materials. 18, 1-14 (2009).
- Stukel, J. M., Willits, R. K. Mechanotransduction of Neural Cells Through Cell-Substrate Interactions. Tissue Engineering Part B: Reviews. 22 (3), 173-182 (2016).
- Charbonier, F. W., Zamani, M., Huang, N. F. Endothelial Cell Mechanotransduction in the Dynamic Vascular Environment. Advanced Biosystems. 3 (2), 1800252(2019).
- Nyitray, C. E., Chavez, M. G., Desai, T. A. Compliant 3D Microenvironment Improves β-Cell Cluster Insulin Expression Through Mechanosensing and β-Catenin Signaling. Tissue Engineering Part A. 20 (13-14), 1888-1895 (2014).
- Baker, B. M., et al. Cell-mediated fiber recruitment drives extracellular matrix mechanosensing in engineered fibrillar microenvironments. Nature Materials. 14 (12), 1262-1268 (2015).
- Evans, N. D., Gentleman, E. The role of material structure and mechanical properties in cell-matrix interactions. Journal of Materials Chemistry B. 2 (17), 2345(2014).
- Tusan, C. G., et al. Collective Cell Behavior in Mechanosensing of Substrate Thickness. Biophysical Journal. 114 (11), 2743-2755 (2018).
- Hotaling, N. A., Bharti, K., Kriel, H., Simon, C. G. DiameterJ: A validated open source nanofiber diameter measurement tool. Biomaterials. 61, 327-338 (2015).
- Cox, T. R., Erler, J. T. Remodeling and homeostasis of the extracellular matrix: Implications for fibrotic diseases and cancer. DMM Disease Models and Mechanisms. 4 (2), 165-178 (2011).
- Haider, A., Haider, S., Kang, I. K. A comprehensive review summarizing the effect of electrospinning parameters and potential applications of nanofibers in biomedical and biotechnology. Arabian Journal of Chemistry. 11 (8), 1165-1188 (2018).
- De Vrieze, S., et al. The effect of temperature and humidity on electrospinning. Journal of Materials Science. 44 (5), 1357-1362 (2009).
- Hohman, M. M., Shin, M., Rutledge, G., Brenner, M. P. Electrospinning and electrically forced jets I. Stability theory. Physics of Fluids. 13 (8), 2201-2220 (2001).
- Yarin, A. L., Koombhongse, S., Reneker, D. H. Bending instability in electrospinning of nanofibers. Journal of Applied Physics. 89 (5), 3018-3026 (2001).
- Feltz, K. P., Kalaf, E. A. G., Chen, C., Martin, R. S., Sell, S. A. A review of electrospinning manipulation techniques to direct fiber deposition and maximize pore size. Electrospinning. 1, 46-61 (2017).
- Simonet, M., Schneider, O. D., Neuenschwander, P., Stark, W. J. Ultraporous 3D polymer meshes by low-temperature electrospinning: Use of ice crystals as a removable void template. Polymer Engineering & Science. 47 (12), 2020-2026 (2007).
- Dai, Z., Ronholm, J., Tian, Y., Sethi, B., Cao, X. Sterilization techniques for biodegradable scaffolds in tissue engineering applications. Journal of Tissue Engineering. 7, 204173141664881(2016).
- Rogers, W. J. Sterilisation techniques for polymers. Sterilisation of Biomaterials and Medical Devices. Lerouge, S., Simmons, A. , Elsevier Science. Amsterdam, Netherlands. 151-211 (2012).
- Jokinen, V., Suvanto, P., Franssila, S. Oxygen and nitrogen plasma hydrophilization and hydrophobic recovery of polymers. Biomicrofluidics. 6 (1), 16501(2012).
- Recek, N., et al. Cell Adhesion on Polycaprolactone Modified by Plasma Treatment. International Journal of Polymer Science. 2016, 1-9 (2016).
- Fleck, N. A., Deshpande, V. S., Ashby, M. F. Micro-architectured materials: Past, present and future. Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. 466 (2121), 2495-2516 (2010).
- Cooper, A., Bhattarai, N., Zhang, M. Fabrication and cellular compatibility of aligned chitosan-PCL fibers for nerve tissue regeneration. Carbohydrate Polymers. 85 (1), 149-156 (2011).
- Patel, K. H., et al. Aligned nanofibers of decellularized muscle ECM support myogenic activity in primary satellite cells in vitro. Biomedical Materials. 14 (3), 035010(2019).
- Wang, L., et al. Fabrication of open-porous PCL/PLA tissue engineering scaffolds and the relationship of foaming process, morphology, and mechanical behavior. Polymers for Advanced Technologies. 30 (10), 2539-2548 (2019).
- Sartore, L., Inverardi, N., Pandini, S., Bignotti, F., Chiellini, F. PLA/PCL-based foams as scaffolds for tissue engineering applications. Materials Today: Proceedings. 7, 410-417 (2019).
- Munir, N., Callanan, A. Novel phase separated polycaprolactone/collagen scaffolds for cartilage tissue engineering. Biomedical Materials (Bristol). 13 (5), 051001(2018).
- Wang, W., et al. Fabrication of heterogeneous porous bilayered nanofibrous vascular grafts by two-step phase separation technique. Acta Biomaterialia. 79, 168-181 (2018).
- Kim, C., et al. Stem Cell Mechanosensation on Gelatin Methacryloyl (GelMA) Stiffness Gradient Hydrogels. Annals of Biomedical Engineering. 48 (2), 893-902 (2019).
- Chen, Z., et al. 3D Printing of Multifunctional Hydrogels. Advanced Functional Materials. 29 (20), 1900971(2019).
- Lee, J. M., Ng, W. L., Yeong, W. Y. Resolution and shape in bioprinting: Strategizing towards complex tissue and organ printing. Applied Physics Reviews. 6, 011307(2019).
- Zimmermann, R., et al. High resolution bioprinting of multi-component hydrogels. Biofabrication. 11 (4), 045008(2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten