Method Article
HepG2 Hücre Hattı Kullanılarak Gösterilen Doku Mühendisliği için Elektrospun Polimer Morfolojisinin Kontrol Edilmesi
Bu Makalede
Özet
Bu yöntem, doku mühendisliği amacıyla farklı polikaprolakton lif morfolojilerini ve topografyalarını test etmek için araçlar sağlar. Küçük ve büyük lifler, rastgele yönelimler, hizalanmış yönelimler ve ayrıca gözenekli kriyojenik olarak elektroeğrilmiş yapılarla üretilir ve hücre kültürü için platformlar olarak kullanılır.
Özet
Elektrospinning, araştırmacılara tekrarlanabilir mikro ila nano ölçekli polimer lifleri üretme fırsatı verir. Elektroeğrilmiş polimerlerin 3D lifli mimarisi, hücre dışı matrisin (ECM) yapısal bir taklidi olarak kabul edilir. Bu nedenle, biyouyumlu polimerlerden üretilen elektroeğrilmiş lifler, doku mühendisliği araştırmacıları tarafından hem in vitro hem de in vivo doku büyümesine rehberlik etmek için yapay bir ECM olarak potansiyel rolleri açısından geniş çapta araştırılmıştır. Tüm hücreler mekanik ortamlarına karşı son derece hassastır. Bu, hücre iskeleti aktin filamentlerine içsel olarak bağlı çoklu mekanotransdüksiyon yollarının keşfi ile gösterilmiştir. Hücre iskeleti, substratının sertliğine ve morfolojisine bağlı olarak konakçı hücrenin işlevselliğini ve farklılaşmasını yönlendirebilen mekanik bir sensör görevi görür. Elektrospun elyaflar, lifli bir polimer iskele içindeki mekanik ortamı kolayca modüle etmek için hem elyaf boyutu hem de morfoloji açısından ayarlanabilir. Burada, iki farklı lif çapında üç farklı morfoloji için elektrospinning polikaprolakton (PCL) yöntemleri açıklanmaktadır. Morfolojik lif kategorileri, 1 μm ve 5 μm çaplara sahip rastgele yönlendirilmiş lifler, hizalanmış lifler ve gözenekli kriyojenik olarak eğrilmiş liflerden oluşur. Bu çalışmada detaylandırılan yöntemler, elektroeğrilmiş lif mimarisinin doku oluşumu üzerindeki etkisini araştırmak için bir platform olarak önerilmiştir. Bu etkilerin anlaşılması, araştırmacıların elektroeğrilmiş liflerin mekanik özelliklerini optimize etmelerine ve bu teknolojinin potansiyelini daha kapsamlı bir şekilde göstermelerine olanak sağlayacaktır.
Giriş
Doku mühendisliği yöntemleri, hem in vitro doku modelleri hem de in vivo rejeneratif teknikler için başarılı doku rejenerasyonunu teşvik etmek amacıyla hücrelere biyomimetik bir ortam sağlamak için son yıllarda geliştirilmiştir. Bu yöntemler tipik olarak hücreleri kendi başlarına veya bir kılavuz iskele1 kullanarak 3D agregalar oluşturmaya teşvik eder. İskeleler, gözenekli veya lifli polimer nano / mikro yapılar veya yüksek su emici hidrojeller 2,3,4 olarak üretilebilir. Polimer elektroeğirme, doğal hücre dışı matrisin (ECM) lifli mimarisini taklit edebilen dokunmamış nano-mikro ölçekli polimer elyaf matrisleri veren yaygın bir üretim tekniğidir5. Elektrospinning işlemine çoklu biyouyumlu polimerler uygulanabilir; Bu nedenle, elektroeğrilmiş lifler, doku yenilenmesini kolaylaştırmak için popüler bir ortamdır 6,7,8. Elektroeğrilmiş lifler, ucuz ve tekrarlanabilir iskele platformları için umut verici bir yol gösteren bir dizi doku kültüründe kullanılmıştır 9,10,11,12,13.
Hücrelerin mekanik çevrelerine karşı akut bir duyarlılığı vardır. Önceki araştırmalar, hücre fonksiyonunu, morfolojisini ve farklılaşmasını etkileyebilen mekanotransdüksiyon olarak adlandırılan bu önemli ilişkiyi vurgulamıştır14,15. Ökaryotik hücresel hücre iskeletinin temeli, filamentli aktinden yapılmıştır ve hücresel bölünme, yapışma, göç, kasılma ve morfolojide anahtar mekanik roller oynar. Hücre dışı yüzey proteinleri 16,17,18 ile bağlantı yoluyla dış mekanik uyaranlar tarafından manipüle edilir. Kök hücre farklılaşması üzerindeki morfolojik etki, daha sonra hücre şeklini kontrol edebilen ve farklılaşma sürecini yönlendirebilen bağlanabilir bir substratın şeklini değiştirerek çok sayıda çalışmada gösterilmiştir19,20. Ayrıca, hücrelerin üzerine bağlandığı substratın sertliği de kök hücre kaderini ve soyunuetkiler 21,22. Kök hücreler dışında, bu etkilerin farklı soylardan hücreleri de etkilediği gözlemlenmiştir23,24. Üç boyutlu doku mühendisliği yöntemleri, hem hidrojeller hem de fibriller iskeleler ile yapılan 2 boyutlu mekanotransdüksiyon çalışmalarında bulunanlara benzer sonuçlar göstermiştir 25,26,27. Ayrıca, substrat mekaniği, hücre-hücre sinyalizasyonu28 aracılığıyla 3D hücre agregaları aracılığıyla iletilir. Malzeme mekaniği, hücresel işlevselliğin yönlendirilmesinde çok önemli bir rol oynar ve bu nedenle mühendislik dokuları için iskele tasarımında önemli bir faktör olmalıdır.
Bu yöntemin amacı, elektroeğrilmiş polikaprolakton (PCL) lif boyutu ve morfolojisinin in vitro hücre kültürleri üzerindeki etkilerini anlamaktır. Yöntem, böbrek dokusu mühendisliğine odaklanan önceki araştırmalardan uyarlanmıştır9. İskele rekonstrüksiyonunu kolaylaştırmak ve tüm hücre tiplerine uygulanabilen standart bir yöntem geliştirmek için burada daha ayrıntılı bir adım adım protokol sunulmaktadır. Bu yöntemle altı grup iskele inşa edildi: üçü büyük 5 μm fiber (LG) ve diğer üçü küçük 1 μm fiber (SM), farklı PCL konsantrasyonları kullanılarak. Bu LG ve SM grupları içinde üç farklı morfolojik yapı vardır: rastgele lifler (RA), hizalanmış lifler (AL) ve gözenekli kriyojenik lifler (CR). Bu iskele gruplarının hepsi doğal olarak farklı yapılara sahiptir ve bu nedenle hücrelerin bağlandığı benzersiz yerel mekanik ortamlar sağlar. Bunun hücrelere sağladığı morfolojik etkiyi göstermek için, hepG2 hücre hattı, temsili bir çalışma olarak her bir iskele grubuna ekildi. Bu yöntem, kök hücrelerden hücre hatlarına ve birincil hücrelere kadar tüm hücre tipleri için elektroeğrili iskele tasarımı için bir temel analiz olarak sunulmaktadır.
Protokol
1. Çözelti hazırlama
- Büyük (rastgele, hizalanmış ve kriyojenik) lifler
- Bir cam serolojik pipet kullanarak cam solvente dayanıklı bir şişede 50 mL kloroform ve 10 mL metanolü karıştırarak 5:1 oranında kloroform ve metanol hazırlayın.
DİKKAT: Kloroform ve metanol toksik çözücülerdir ve karıştırma bir çeker ocakta yapılmalıdır. - 5: 1 kloroform: metanol içinde% 19 w / v'lik bir PCL çözeltisi oluşturmak için, 1.9 g PCL'yi tartın ve cam solvent geçirmez bir şişede 10 mL 5: 1 kloroform: metanole ekleyin. Parafin film kullanarak şişeyi iki kez kapatın ve PCL'nin tamamen çözülmesini sağlamak için şişeyi gece boyunca bir silindirde bırakın.
DİKKAT: Karıştırma bir çeker ocakta yapılmalıdır.
- Bir cam serolojik pipet kullanarak cam solvente dayanıklı bir şişede 50 mL kloroform ve 10 mL metanolü karıştırarak 5:1 oranında kloroform ve metanol hazırlayın.
- Küçük (rastgele ve hizalanmış) lifler
- Heksafloroizopropanol (HFIP) içinde ağırlıkça / v% 7'lik bir PCL çözeltisi hazırlamak için, 0.7 g PCL'yi tartın ve cam solvent geçirmez bir şişede 10 mL HFIP ile karıştırın. Parafin film kullanarak şişeyi iki kez kapatın ve PCL'nin tamamen çözülmesini sağlamak için gece boyunca bir silindirde bırakın.
DİKKAT: HFIP oldukça zehirlidir ve karıştırma bir çeker ocakta yapılmalıdır.
- Heksafloroizopropanol (HFIP) içinde ağırlıkça / v% 7'lik bir PCL çözeltisi hazırlamak için, 0.7 g PCL'yi tartın ve cam solvent geçirmez bir şişede 10 mL HFIP ile karıştırın. Parafin film kullanarak şişeyi iki kez kapatın ve PCL'nin tamamen çözülmesini sağlamak için gece boyunca bir silindirde bırakın.
- Küçük kriyojenik lifler
DİKKAT: Karıştırma bir çeker ocakta yapılmalıdır.- 30 mL kloroform ve 10 mL metanolü cam serolojik pipet kullanarak cam solvent geçirmez bir şişede karıştırarak 3:1 oranında kloroform ve metanol hazırlayın.
- 3: 1 kloroform: metanol içinde% 14 w/v'lik bir PCL çözeltisi oluşturmak için, 1.4 g PCL'yi tartın ve cam solvent geçirmez bir şişede 10 mL 3: 1 kloroform: metanole ekleyin. Parafin film kullanarak şişeyi iki kez kapatın ve PCL'nin tamamen çözülmesini sağlamak için gece boyunca bir silindirde bırakın.
2. Elektrospinning kurulumu
NOT: Elektrospinning işlemine başlamadan önce parametreler ayarlanmalıdır.
- İğne boyutu ve yerleşimi
- Büyük lifler için (rastgele, hizalanmış ve kriyojenik) 1 mm OD/0.8 mm ID pirinç iğne kullanın ve iğneyi mandrel yüzeyinden 230 mm uzağa yerleştirin.
- Küçük lifler için 1 mm OD / 0.4 mm ID pirinç iğne kullanın ve iğneyi mandrel yüzeyinden 15 mm uzağa yerleştirin.
- Yanal iğne hareketi
NOT: Şekil 1'de ayrıntıları verilen iskeleler, işlem boyunca sola ve sağa tekrarlanan hareketlerle 50 mm/s'de 100 mm'lik bir iğne traversi ile imal edilmiştir.- Yanal hareketi ayarlamak için Hareket | TNS 1 ve Başlangıç konumunu [mm] -50'ye, Mesafe [mm] 'yi 100'e, Hız [mm/s]' yi 50'ye ve Dönüş Gecikmesi'ni [ms] 750'ye ayarlayın.
- Şırınga pompası akış hızı
- Büyük lifler (rastgele, hizalı ve kriyojenik) için, kullanıcı arayüzündeki Malzeme sekmesine basın ve şırınga pompasını 4 mL/saate ayarlayın.
- Küçük (rastgele ve hizalanmış) lifler için şırınga pompasını 0,8 mL/saate ayarlayın.
- Küçük kriyojenik lifler için şırınga pompasını 2,5 mL/saate ayarlayın.
- Voltaj ayarları
- Büyük fiberler için, kullanıcı arayüzündeki Voltaj sekmesine basarak ve pozitif ve negatif voltaj değerlerini değiştirerek iğne voltajını +15 kV'a ve mandrel voltajını -4 kV'a ayarlayın.
- Küçük (rastgele ve hizalanmış) fiberler için iğne voltajını +17 kV'a ve mandrel voltajını -4 kV'a ayarlayın.
- Küçük kriyojenik lifler için iğne voltajını +18 kV'a ve mandrel voltajını -4 kV'a ayarlayın.
- Mandrel rotasyonu (büyük ve küçük lifler)
- Rastgele lifler için Hareket | Mandrel dönüş hızını hedefleyin ve 250 rpm'ye ayarlayın.
- Hizalanmış lifler için mandrel dönüş hızını 1.800 rpm'ye ayarlayın.
- Kriyojenik lifler için mandrel dönüş hızını 180 rpm'ye ayarlayın.
3. Rastgele ve hizalanmış liflerin (büyük ve küçük lifler) elektrospinning uygulaması
- İğneyi (iğne boyutu ve yerleşimi hakkında bilgi için bölüm 2.1'e bakın) 1 mm delikli PTFE boruya yerleştirin ve elektrospinner iğne tutucusuna sabitleyin.
- Bir çeker ocak altında, 10 mL polimer çözeltisini polipropilen veya cam (solvent geçirmez) bir şırıngaya aktarın. Astarlamadan önce şırınganın durmasına izin vererek kabarcıkları çıkardığınızdan emin olun.
- Şırıngayı PTFE boru aracılığıyla iğneye bağlayın ve şırıngayı şırınga pompasının içine sabitleyin. Bağlandıktan sonra, şırınga pistonunu sıkarak ve tüpü polimer çözeltisiyle doldurarak PTFE borusunu astarlayın.
- Mandreli alüminyum folyoya sarın ve mandrel döndürme cihazına sabitleyin.
- tuşuna basarak mandrel dönüşünü açın Hareket | Hedef | Döndürün ve şırınga pompasına basarak Malzeme | Pompayı çalıştırın 1.
- İğnenin ucunda küçük bir polimer boncuk oluştuğunda, AKTİVASYON YÜKSEK GERİLİYET'e basarak voltajı açın. Daha sonra Taylor konisi adı verilen konik bir polimer çözeltisi çıkıntısından bir polimer jeti salınmalıdır. Mandrel yüzeyindeki lif birikimini doğrulamak için mandreli kontrol edin.
- İstenilen miktarda PCL çözeltisi elektrospor olana kadar elektrospinning işlemini çalıştırın.
NOT: Şekil 1'de sunulan iskeleler için 4 mL çözelti elektrospile ile çevrilmiştir. - Elektrospinning sona erdiğinde, elyafla kaplı alüminyum folyoyu mandrelden çıkarın ve fazla çözücünün buharlaşmasını sağlamak için gece boyunca bir çeker ocakta bırakın.
- Buharlaştıktan sonra lifleri oda sıcaklığında (RT) saklayın.
4. Kriyojenik liflerin elektrospinning uygulaması
- Kriyojenik elektrospinning için kriyo-eğirme mandrelini kullanın. 3.1-3.3 adımlarını tekrarlayın ve ardından aşağıdaki adımlarla devam edin.
- Mandreli alüminyum folyoya sarın.
- Mandreli kuru buz topakları ile doldurun. Kuru buzun mandrelden kaçamamasını ancak basıncın kaçabilmesini sağlamak için kriyo eğirme mandrel kapağını mandrel üzerine sabitleyin. Mandrelin yüzeyinde hemen hemen buz kristalleri oluşmalıdır.
DİKKAT: Soğuk yanıklarını önlemek için kuru buzla çalışırken koruyucu eldiven kullanın. - Mandreli mandrel döndürme cihazına sabitleyin ve Motion | düğmesine basarak mandrel dönüşünü hemen açın. Hedef | Döndürün ve şırınga pompasına basarak Malzeme | Pompayı çalıştırın 1.
- İğnenin ucunda bir polimer boncuğu oluştuğunda, AKTİVASYON YÜKSEK VOLTAJ'a basarak voltajı açın. Daha sonra bir polimer jeti, polimer çözeltisinin konik bir çıkıntısından (yani, Taylor konisi) yayılmalıdır. Mandrel yüzeyindeki lif birikimini doğrulamak için mandreli kontrol edin.
- 1 saatlik elektro eğirme işleminden sonra, STOP ALL düğmesine basarak işlemi duraklatın ve mandreli kuru buzla doldurun. Mandreli yeniden doldururken solvent buharına karşı yeterli koruma sağlayın. Bunu, toplam 4 saatlik elektrospinning süresi için toplam 3x boyunca gerçekleştirin.
NOT: Elektro eğirme, 4.4 ve 4.5 adımları tekrarlanarak devam ettirilebilir. - Elektrospinning sona erdiğinde, mandreli dikkatlice çıkarın ve mandrel yüzeyindeki buz kristallerini süblimleştirmek için hemen 24 saat boyunca bir dondurarak kurutucuya koyun.
- Süblimasyondan sonra, elyaf kaplı folyoyu mandrelden çıkarın ve ezilmeyi önlemeye dikkat ederek RT'de saklayın.
5. İskele delme
- 10−12 mm'lik bir biyopsi zımbası kullanarak lif tabakasından iskeleleri delin. Lifler alüminyum folyoya bağlı kalırsa, ayrılmayı kolaylaştırmak için iskeleleri %70 etanol içine yerleştirin.
6. Sterilizasyon ve plazma kaplama
- İskeleleri (kuyu başına 1 iskele) 24 veya 48 kuyulu bir plakaya yerleştirin ve 3 kez% 70 etanol içinde yıkayın. Son yıkamada suya batırılmış halde bırakın, -80 °C dondurucuya koyun ve donmaya bırakın.
- Dondurulduktan sonra, plakayı bir dondurarak kurutucuya koyun ve 24 saat liyofilize edin. Kurutulmuş iskeleler artık plazma ile kaplanabilir.
NOT: Bir plazma kaplayıcıya erişim yoksa, iskeleleri fosfat tamponlu salin (PBS) içinde% 1 antibiyotik-antimikotik (Anti-Anti) içine daldırın ve gece boyunca 37 ° C'de inkübe etmeye bırakın. - Plakayı plazma haznesine yerleştirin ve kapağı çıkarın. Plazma kaplayıcıyı 500 mTorr ve orta radyo frekansı (RF) gücünde 30 saniye çalıştırın.
- Plazma kaplamadan sonra, iskeleleri 1 mL PBS ve% 1 Anti-Anti içine daldırın. İskeleler PBS çözeltisini kolayca emmelidir.
NOT: İskeleler artık hücrelerle tohumlanmaya hazırdır.
7. Hücrelerin hazırlanması ve tohumlanması
NOT: Aşağıda verilen temel hücre kültürü tekniği, temsili sonuçlarda gösterim amacıyla kullanılan hepg2 hücreleri içindir. Bu ilkeler herhangi bir yapışık hücre tipine uygulanabilir; Bununla birlikte, farklı hücreler farklı malzemeler ve farklı işlemler gerektirebilir. Hücre kullanımı, aseptik teknik izlenerek biyolojik bir güvenlik kabininde gerçekleştirilmelidir.
- 1 x 106 kriyoprezerve hepg2 hücresi alın ve %10 fetal sığır serumu, 100 U/mL penisilin-streptomisin, 5 mM L-glutamin ve %1 esansiyel olmayan amino asit ile desteklenmiş Eagle'ın minimum esansiyel besiyerinden (EMEM) oluşan 12 mL tam besiyeri olan bir T75 hücre kültürü şişesine tohum atın.
- Hücreler% 80 birleşmeye geldiğinde, PBS'de 3x yıkayarak ve 2 mL tripsin içinde 37 ° C'de 4 dakika inkübe ederek hücreleri kültür şişesinden ayırın. Şişeye dokunduktan sonra, hücreler ayrılmalıdır.
- 8 mL tam ortam ekleyerek tripsini devre dışı bırakın. Hücre süspansiyonunu 15 mL'lik bir tüpe aktarın ve hücreleri 5 dakika boyunca 120 x g'da bir santrifüjde döndürün.
- Hücre peletinin üzerindeki süpernatanı aspire eden bir pipetle çıkarın ve 5 mL tam ortam ile değiştirin. 5 mL'lik bir serolojik pipet ile yukarı ve aşağı pipetleyerek hücreleri yeniden süspanse edin.
- Elde edilen hücre süspansiyonunu tripan mavisi dışlama yöntemi ile sayın. 100 μL hücre süspansiyonu alın ve 1.5 mL'lik bir şişede 100 μL tripan mavisine ekleyin. Karışımı bir cam lamel altındaki bir hemositometreye verin ve hücreleri mikroskop altında sayın.
- Tam ortam ekleyerek veya çıkararak hücre konsantrasyonunu 2.6 x 106 hücre / mL'ye ayarlayın. Ortamı çıkarmak için, hücreleri 5 dakika boyunca 220 x g'da santrifüjleyin, gerekli ortamı çıkarın ve hücreleri yeniden süspanse edin.
- PBS'deki %1 Anti-Anti'yi kuyu plakasından aspire edin ve 200 μL'lik bir pipet kullanarak iskele yüzeyine 50 μL 2.6 x 106 hücre/mL hücre süspansiyonu tohumlayın.
- Hücrelerin 37 ° C'de ve% 5 CO2'de 1-3 saat inkübasyon altında tutunmasına izin verin ve kurumamasına dikkat edin. Takıldıktan sonra, 300 μL (48 oyuklu bir plaka için) veya 500 μL (24 oyuklu bir plaka için) kültür ortamı ekleyin ve 37 ° C ve% 5 CO2'de inkübe edin.
NOT: Standart hücre kültürü teknikleri buradan daha fazla fonksiyonel analize kadar kullanılabilir.
Sonuçlar
Şekil 1 , PCL çözeltilerinden üretilen hem küçük (~ 1 μm) hem de büyük liflerin (~ 5 μm) taramalı elektron mikroskobu (SEM) görüntülerini göstermektedir. Lifler, SEM görüntülemeden önce bir püskürtme kaplayıcı kullanılarak 30 saniye boyunca altın-paladyum (60:40) ile püskürtülerek kaplandı. Büyük lifler, yüksek viskoziteli bir PCL çözeltisi oluşturmak için 5:1 kloroform ve metanol çözeltisinde %19 w/v'lik yüksek bir PCL konsantrasyonu kullanılarak üretildi. Bu yüksek viskoziteli çözelti daha sonra elektrik alanı içinde büyük bir polimer çözeltisi ipliği yaymak için yüksek bir akış hızında elektrospun edildi. Bu nedenle, mandrel üzerinde biriktirmeden önce çözücünün etkili bir şekilde buharlaşmasını sağlamak için iğne ile mandrel arasında 230 mm'lik büyük bir mesafe gerekliydi. Tersine, düşük viskoziteli bir PCL çözeltisi oluşturmak için HFIP'de %7 w/v'lik düşük bir PCL konsantrasyonu kullanılarak daha küçük lifler üretildi. Düşük viskoziteli PCL çözeltisinin düşük akış hızında elektroeğirilmesi, elektrik alanı içindeki iğneden daha ince bir PCL çözeltisi ipliğinin yayılmasını sağlamıştır. Daha ince iplik, çözücünün daha hızlı buharlaşmasını kolaylaştırdı ve liflerin stabil bir şekilde birikmesini sağlamak için iğnenin mandrele 70 mm'de daha yakın olması gerekiyordu. Küçük kriyojenik liflerin elektrospinning yapılması için, güvenilir bir protokol elde etmek için PCL solüsyonunun değiştirilmesi gerekliydi. HFIP içindeki PCL, kriyojenik mandrel üzerine tekrar tekrar bükülür, parçalanmış bir lif yapısı ile sonuçlandı. 3: 1 kloroform metanolde %14 w/v'lik bir PCL konsantrasyonu olan elektrospinning bu sorunu çözdü; Bununla birlikte, bu, iskele boyunca elyaf boyutunda daha büyük bir varyasyon yarattı. Her bir iskele için fiber hizalamasının kapsamı (fiber yarıçapı ve oryantasyonu) ImageJ DiameterJ eklentisi29 aracılığıyla analiz edildi ve Şekil 2 ve Şekil 3'te gösterildi.

Şekil 1: Her bir iskele grubunun morfolojik özelliklerini gösteren SEM görüntüleri. Üst sıra küçük lifleri ve alt sıra büyük lifleri gösterir. Morfolojik gruplar soldan sağa sırasıyla rastgele lifler, hizalanmış lifler ve kriyojenik lifler olarak listelenir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
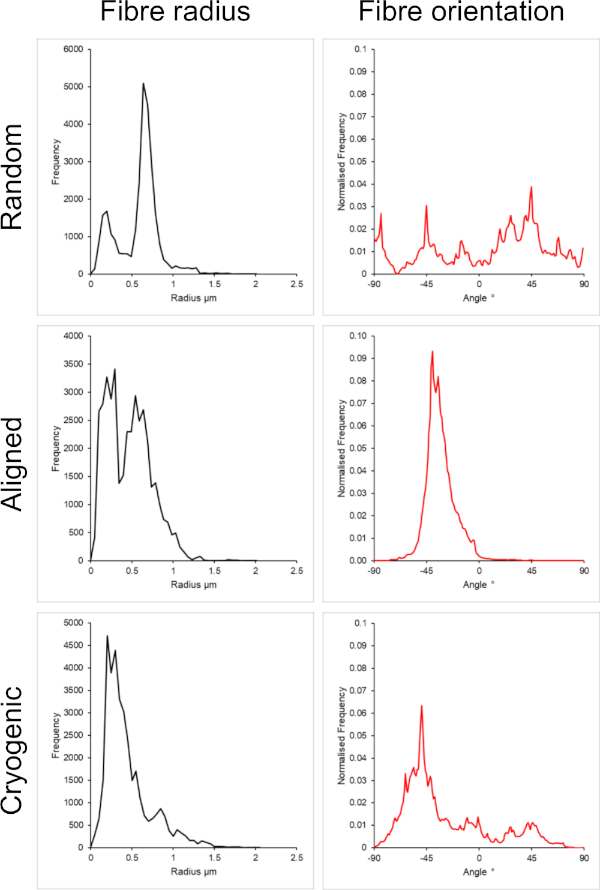
Şekil 2: Küçük fiber seti için DiameterJ eklentisinden alınan fiber yarıçapı (solda) ve fiber yönü (sağda) verileri. Morfoloji, sırasıyla rastgele lifler, hizalanmış lifler ve kriyojenik lifler olarak yukarıdan aşağıya listelenir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
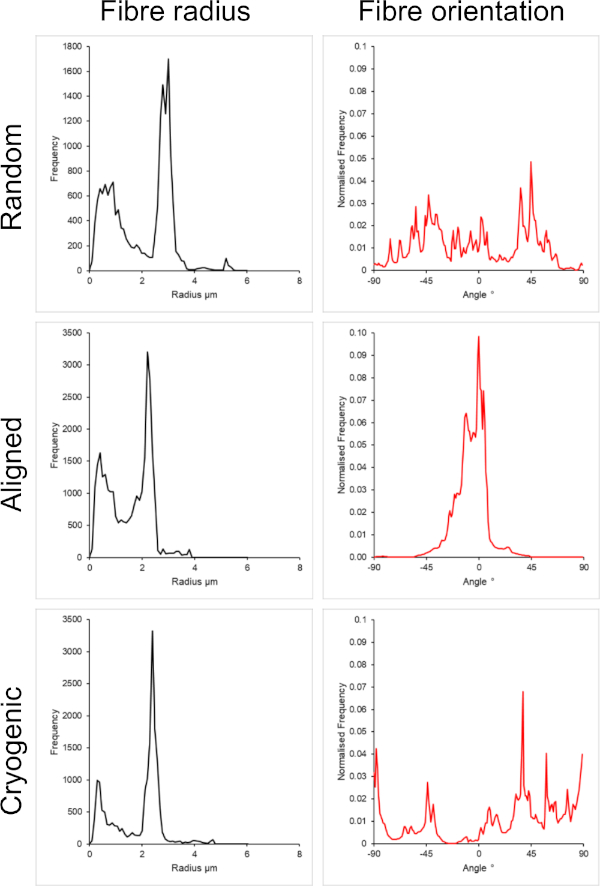
Şekil 3: Büyük fiber seti için DiameterJ eklentisinden alınan fiber yarıçapı (solda) ve fiber yönü (sağda) verileri. Morfoloji, sırasıyla rastgele lifler, hizalanmış lifler ve kriyojenik lifler olarak yukarıdan aşağıya listelenir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Bu yöntem bize, daha önce açıklanan yöntemlere göre bir çekme test makinesi kullanılarak belirlenen altı farklı çekme özelliğine sahip bir dizi iskele sundu9. Tablo 1'de gösterildiği gibi, makro ölçekli Youngs' Moduli, büyük hizalanmış liflerde 46.94 ± 3.48 MPa ile büyük kriyojenik liflerde 0.20 ± 0.01 MPa arasında değişir. Fizyolojik doku sertliği değerleri 100 Pa (nöral doku) ile 2−4 GPa (kemik dokusu) arasında değişir30; Burada bildirilen iskele rijitlik değerlerinin tümü bu aralıktaydı.
| Iskele | Gerinim için genç modülü (MPa)% | ||||
| 0–2% | 2–4% | 4–6% | 6–8% | 8–10% | |
| SM. RA | 11.14 ± 2.13 | 9,31 ± 0,43 | 6,75 ± 0,64 | 4,75 ± 0,59 | 3,32 ± 0,40 |
| SM. AL | 27,94 ± 8,63 | 28,27 ± 7,36 | 16.34 ± 4.87 | 9,10 ± 3,75 | 5.85 ± 3.11 |
| SM. CR | 0,27 ± 0,11 | 0,31 ± 0,44 | 0,31 ± 0,65 | 0,29 ± 0,59 | 0,26 ± 0,40 |
| LG. RA | 9,23 ± 0,78 | 8,22 ± 0,87 | 5,96 ± 0,68 | 3,96 ± 0,59 | 2,63 ± 0,45 |
| LG. AL | 46,94 ± 3,48 | 38,03 ± 2,46 | 27,69 ± 1,22 | 16.10 ± 1.61 | 7,87 ± 1,32 |
| LG. CR | 0,20 ± 0,01 | 0,16 ± 0,01 | 0,12 ± 0,01 | 0,10 ± 0,01 | 0,09 ± 0,01 |
Tablo 1: Her bir iskele grubu için %2 gerinim aralıklarla çekme testi verileri. SM. RA = Küçük rastgele, SM. AL = Küçük hizalı, SM. CR = Küçük kriyojenik, LG. RA = Büyük rastgele, LG. AL = Büyük hizalı ve LG. CR = Büyük kriyojenik. Ortalama ± SD olarak sunulan veriler, n = 5.
Şekil 4, hücresel morfolojiyi görselleştirmek için kullanılan DAPI ve phalloidin boyamasını göstermektedir. Kullanılan boyama yöntemi literatürde belirlenmiştir11,12. Görüntüler, 40x büyütme objektifine sahip bir mikroskop (Malzeme Tablosu) kullanılarak elde edildi. Görüntüler, bu yöntemle üretilen hizalanmış liflerin hepG2 hücre morfolojisini uzattığını ve çoğalan hücreleri liflerin uzunluğu boyunca yönlendirerek hücre kültürü içinde yönlülük yarattığını göstermektedir. Buna karşılık, rastgele lifler üzerindeki hepG2 hücreleri, hizalanmış yapılarda gözlenen yönlü proliferasyon ve uzamayı göstermedi. Rastgele yapılarda, hepG2 hücreleri, çevredeki PCL liflerine bağlanan genişletilmiş çıkıntılarla daha düzenli bir morfoloji sergiledi.
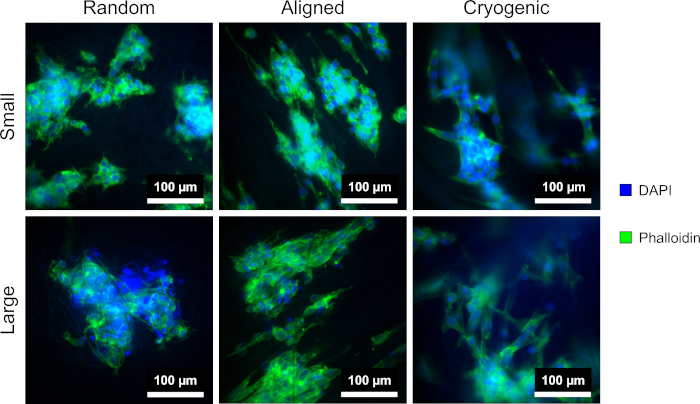
Şekil 4: DAPI (mavi) ve phalloidin (yeşil) farklı iskele morfolojilerinde boyanmış hepG2 hücreleri: rastgele (solda), hizalanmış (ortada) ve kriyojenik (sağda). Üst sıra küçük lifleri, alt sıra ise büyük lifleri gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Farklı lif boyutlarının oluşturulması, farklı çözücüler, PCL konsantrasyonları ve elektrospinning parametrelerinin bir kombinasyonu kullanılarak elde edildi. Polimerin türü, moleküler ağırlığı ve çözücü, elde edilen çözeltinin viskozitesini ve yük özelliklerini güçlü bir şekilde etkiler ve bu nedenle elektroeğirme özellikleri31 üzerinde güçlü bir etkiye sahiptir. Bu yöntemde görüntülenen voltajlar, elektroeğirmenin gerçekleştirildiği koşullara bağlı olarak değişebilir. Sıcaklık ve nem, elektro eğirme işleminin davranışını etkiler32. Bu nedenle, okuyucunun herhangi bir engele karşı koymak ve kararlı bir Taylor konisi elde etmek için voltajı değiştirmeye hazırlıklı olması önerilir. Elektro eğirme işleminde partiden partiye değişkenliği azaltmak için elektrospinner bir çevresel kontrol muhafazası içinde barındırılması önerilir.
Bu yöntemde sunulan farklı morfolojilerin elde edilmesi, IME elektrospinning cihazının yetenekleri sayesinde mümkündür. Fiber hizalamasını kontrol etmek için değişken hızlı bir mandrel gereklidir. Düşük bir rpm'de (<250 rpm) mandrel dönüşü, polimer jetinin davranışı nedeniyle rastgele yönlendirilmiş lifler verir. Yüklü polimer çözeltisi iğneden yayıldığında, iç yükler ve aerodinamik kuvvetler, mandrel33,34 üzerinde kaotik bir lif düzenlemesi oluşturmak için kullanılan kaotik bir kırbaçlama etkisine neden olur. Bu çırpma etkisi, mandrel dönüş hızını 1.800 rpm'nin üzerine çıkararak aşılabilir. Bu kadar yüksek devirli bir mandrel üzerinde biriken lifler, hizalanmış bir yapı sergiler, çünkü yüzey hızı, çırpma lifi tarafından sergilenen herhangi bir enine harekete etkili bir şekilde karşı koymak için yeterlidir. Yüksek mandrel hızları kullanıldığında, çevredeki havayı bozma olasılığının yüksek olduğunu ve bunun da stabil bir Taylor konisinin üretimi üzerinde olumsuz bir etkiye sahip olabileceğini unutmamak önemlidir.
Çok gözenekli kriyojenik iskeleler, mandrelin -78,5 °C'de kuru buz ile doldurulmasıyla üretilir. Bu, mandrelin sıcaklığını düşürür ve yüzeydeki su damlacıklarının yoğunlaşmasını ve donmasını teşvik eder. Oluşan kristaller, mandrel yüzeyinden çıkan tepeler sergiler ve lifler, tepeler boyunca biriktirilir. Buz kristalleri süblimleştikten sonra, mandrel35,36 üzerinde gözenekli bir lif yapısı kalır. Kristallerin ağırlığı ve kırılganlığı, çok yüksek mandrel hızları (>250 rpm), aşırı merkezcil ve aerodinamik kuvvetler nedeniyle kristallerin ve liflerin mandrelden ayrılmasına neden olduğundan, gözenekli hizalanmış lifler oluşturma yeteneğini sınırlar. Oluşan yapıların kırılgan olması nedeniyle bu yöntemle zorluklarla karşılaşmak mümkündür. Mandreli tutarken ve daha sonra iskeleleri tutarken dikkatli olunmalıdır, çünkü yapılar sıvılardan çıkarılırken sıkıldığında ve katlandığında düzleşmeye eğilimlidir. Kriyojenik mandrel olmadan başarılı bir şekilde elektrospin yapan çözeltilerin sıcaklık değişimi ve kristal yapılar tarafından ölümcül şekilde bozulma olasılığı da vardır. Kriyo-eğirme sırasında, mandrel yüzeyinde oluşan buz miktarı büyük ölçüde neme bağlıdır ve nihai sonuçta değişkenlik yaratır. Bu nedenle, elektrospinning işleminin bir çevresel kontrol muhafazası içinde tutulması şiddetle tavsiye edilir.
Bu iskelelerdeki hücresel performansı değerlendirmek için malzemeyi önceden sterilize etmek gerekir. Polimerleri sterilize etmek için kimyasal yöntemler, radyasyon yöntemleri ve ısıya dayalı yöntemler dahil olmak üzere birçok seçenek mevcuttur37,38. Her yöntemin etkinliğini ve hem malzemenin kullanımı hem de malzemenin kendisi için uygunluğunu değerlendirmek önemlidir. Bu protokol, liyofilizasyon, plazma işleme ve %1 Anti-Anti çözeltiye daldırmadan önce %70 etanol içinde sterilizasyon kullanır. Etanol kullanımı, PCL materyalini bozmazken proteinlerin ve mikroorganizmaların denatüre edilmesine ve kurutulmasına izin verir37. Daha güçlü çözücülerin kullanılması, PCL'nin çözünmesine neden olabilir. Plazma kaplama, esas olarak, herkesin bildiği gibi hidrofobik olan PCL'nin hidrofilikliğini arttırmak ve hücre bağlanmasını iyileştirmek için bu yönteme dahil edilmiştir 39,40. Uygun bir şekilde, bu aynı zamanda ikincil bir sterilizasyon adımı olarak da çalışır, ancak iskelelerin plazma tedavisi öncesi ve sonrası steril bir ortamda tutulmasına özen gösterilmelidir. Bu yöntemin antibiyotik uygulanmış ortamlarla yapılan in vitro çalışmalar için uygun olduğu kanıtlanmıştır. Bununla birlikte, in vivo uygulamalar için, etilen oksit (EtO) ve gama maruziyeti gibi daha sağlam seçenekler dikkate alınmalıdır. Sterilizasyon gerçekleştirildikten sonra, hücreler iskele üzerine ekilebilir ve in vitro olarak 3D hücre kültürleri oluşturmak için standart hücre kültürü teknikleri uygulanabilir.
Rijitlik değerlerinin, iskeleler içinde oluşan farklı mikro yapılara atfedilmesi gerektiğine dikkat etmek önemlidir. Dökme malzeme (PCL) iskeleler arasında sabit kalır. Bu nedenle, dökme malzeme sertliği gruplar arasında değişmez. Kriyojenik iskeleler, Tablo 1'de görülebileceği gibi, fiber matris içindeki bağlantının azalması nedeniyle diğer gruplardan çok daha düşük bir sertlik gösterir. Azaltılmış bağlanabilirliğin, lifli yapı içindeki gerilme baskın deformasyonunun aksine, daha fazla eğilme-baskın deformasyona neden olduğu düşünülmektedir41. İlginç bir şekilde, iskele sertliği, rastgele ve kriyojenik gruplardaki lif boyutuna büyük ölçüde bağlı değildir. Bununla birlikte, hizalanmış liflerin uzunlamasına sertliği, lif boyutuna önemli ölçüde daha yüksek bir bağımlılık gösterir ve %0-2 gerinimde Young Modülü, küçük lifler için 27.94 ± 8.63 MPa ve büyük lifler için 46.94 ± 3.48 MPa'dır. Çekme testinin gerilme doğası nedeniyle, bu, uzunlamasına enine kesit içinde daha yüksek bir yığın PCL yoğunluğu anlamına gelir. Burada sunulan mekanik verilerin, lifli mimarilerin makro ölçekli mekanik bir anlık görüntüsü olduğunu tekrarlamak gerekir. Hücre ölçeğindeki mekanik etkileri tam olarak anlamak için daha fazla mikromekanik karakterizasyon faydalı olacaktır.
İzotropik ve anizotropik morfolojiler arasında bir karşılaştırma sağlamak için hem rastgele hem de hizalanmış mimariler bu yönteme dahil edildi. Fiber hizalamanın kapsamı, Şekil 2'deki SEM görüntülerinde ve Şekil 2 ve Şekil 3'te sunulan fiber analizlerinde gözlemlenebilir. Anizotropik özellikler vücuttaki birçok dokuda gözlenir. Özellikle, bu genellikle kas ve sinir dokularında bulunanlar gibi hizalanmış hücresel yapılarda gözlenir. Hizalanmış polimerik fiber yapıları, bu hizalanmış yapıları in vitro42,43 olarak özetleme yeteneği sunar. Daha önce tarif edildiği gibi, hücre fonksiyonu morfolojik ve mekanik değişikliklere karşı hassastır, bu nedenle her bir iskele tipinin biyolojik etkisini belirlemek için iskeleye bağlı hücreler üzerinde daha fazla fonksiyonel analiz yapılmalıdır.
Mevcut diğer iskele imalat teknikleriyle karşılaştırıldığında, bu yöntem, mekanik özellikler ve morfoloji üzerinde nispeten yüksek kontrole sahip mikro ölçekli iskele yapıları üretmek için basit bir yol sağlar. Faz ayırma, tuz liçi ve gaz köpürtme gibi alternatif PCL iskele imalatı, boşluk alanı ve gözenek boyutu açısından morfolojik kontrole izin verir. Bununla birlikte, gözenek ve yapısal geometri büyük ölçüde aynı kalır 44,45,46,47. Bu nedenle, izotropi seviyesi gibi nitelikler, elektrospinning ile karşılaştırıldığında bu kadar kolay değiştirilemez. İskele üretimi için popüler olan hidrojel malzemeler, çapraz bağlı polimer zincirlerinin48 seviyesinin değiştirilmesi yoluyla polimer substratın sertliğini değiştirmek için araçlar sağlar. Morfoloji49 üzerinde mükemmel kontrol sağlayan çeşitli yöntemlerle 3D baskı yapmak da mümkündür. Bununla birlikte, biyouyumlu hidrojel malzemelerde elektrospinning ölçeği çözünürlüğü elde etmek, pratik olarak uygulanması gereken bir zorluk olmaya devam etmektedir50,51. Elektrospun iskeleler, son on yıl boyunca doku mühendisliği araştırmalarında yaygın olarak yer almıştır ve farklı hücre tiplerine sahip yeni malzemelerin ve uygulamaların tanıtımı her zaman araştırılmaktadır. Elektrospinning iskeleleri amacıyla sürekli olarak yeni malzemeler geliştirilmekte olsa da, mevcut elektrospinning malzemelerinin ve yöntemlerinin daha fazla biyolojik karakterizasyonu için fırsatlar devam etmektedir. Açıklanan yöntem, temel hücre kültürü tekniklerine doğrudan uygulanabilir olduğu için in vitro biyolojik çalışmayı kolaylaştırmak için bir yöntem olarak önerilmiştir.
Teşekkürler
Bu çalışma, Mühendislik ve Fizik Bilimleri Araştırma Konseyi Hibe Ref: EP/N509644/1, UKRMPII Hibe Ref: MR/L022974/1 ve MRC CCBN Hibe Ref: MR/L012766/1 tarafından desteklenmiştir. Yazarlar, mikroskopi görüntülemeye yardımcı oldukları ve kolaylaştırdıkları için Dr. Alison McDonald ve Dr. David Kelly'ye (COIL) ve laboratuvar tesislerine (Biyomühendislik Enstitüsü) erişim için Prof. Alistair Elfick'e teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10 mm biopsy punch | Acuderm | P1025 | |
| 15 mL Falcon tube | Thermo-scientific | 339650 | |
| 20 mL glass vial | Fisherbrand | 11513542 | |
| 48 well cell culture plate | Greiner Bio-one | 677180 | |
| Anti-Anti 100X | Gibco | 15240062 | |
| Chloroform | Acros Organics | 13029236 | |
| DAPI | Sigma-aldrich | D9542 | |
| Eagles Minimum Essential Media | Gibco | 11090081 | |
| Electrospinner | IME Technologies | EC-DIG | |
| Fetal Bovine Serum | GE Healthcare | SH30071.03 | |
| Gold-Palladium Sputter coater | Emscope | SC500A | |
| HepG2 cell line | Sigma-aldrich | 85011430 | |
| Hexafluoroisopropanol (HFIP) | Manchester Organics | G26383 | |
| L-Glutamine 200 mM | Gibco | 25030081 | |
| MEM Non-essential Amino Acids | Gibco | 11140050 | |
| Methanol | Acros Organics | 11984591 | |
| Penicillin-Streptomycin 10,000 U/mL | Gibco | 15140122 | |
| Phalloidin | Abcam | ab176754 | |
| Phosphate Buffered Saline (PBS) | Sigma-aldrich | P4417-100TAB | |
| Plasma coater | Harrick Plasma | PDC-002 | |
| Polycaprolactone (Avg. MW 80,000) | Sigma-aldrich | 440744 | |
| PTFE Syringe | Fisherbrand | 12941031 | |
| Scanning Electron Microscope | Hitachi | S4700 | |
| T75 Culture Flask | Corning | CLS430641 | |
| Trypan blue (0.4%) | Gibco | 15250061 |
Referanslar
- Akter, F. Principles of Tissue Engineering. Tissue Engineering Made Easy. Akter, F. , Academic Press. London, UK. 3-16 (2016).
- Van Vlierberghe, S., Dubruel, P., Schacht, E. Biopolymer-Based Hydrogels as Scaffolds for Tissue Engineering Applications: A Review. Biomacromolecules. 12 (5), 1387-1408 (2011).
- Murugan, R., Ramakrishna, S. Nano-featured scaffolds for tissue engineering: A review of spinning methodologies. Tissue Engineering. 12 (3), 435-447 (2006).
- Hollister, S. J. Porous scaffold design for tissue engineering. Nature Materials. 4 (7), 518-524 (2005).
- Jun, I., Han, H. S., Edwards, J. R., Jeon, H. Electrospun fibrous scaffolds for tissue engineering: Viewpoints on architecture and fabrication. International Journal of Molecular Sciences. 19 (3), E745(2018).
- Rashidi, H., et al. 3D human liver tissue from pluripotent stem cells displays stable phenotype in vitro and supports compromised liver function in vivo. Archives of Toxicology. 92 (10), 3117-3129 (2018).
- Grant, R., Hay, D. C., Callanan, A. A Drug-Induced Hybrid Electrospun Poly-Capro-Lactone: Cell-Derived Extracellular Matrix Scaffold for Liver Tissue Engineering. Tissue Engineering Part A. 23 (13-14), 650-662 (2017).
- Munir, N., McDonald, A., Callanan, A. A combinatorial approach: Cryo-printing and electrospinning hybrid scaffolds for cartilage tissue engineering. Bioprinting. 16, e00056(2019).
- Burton, T. P., Corcoran, A., Callanan, A. The effect of electrospun polycaprolactone scaffold morphology on human kidney epithelial cells. Biomedical Materials. 13 (1), 015006(2018).
- Reid, J. A., Callanan, A. Influence of aorta extracellular matrix in electrospun polycaprolactone scaffolds. Journal of Applied Polymer Science. 136 (44), 48181(2019).
- Grant, R., Hallett, J., Forbes, S., Hay, D., Callanan, A. Blended electrospinning with human liver extracellular matrix for engineering new hepatic microenvironments. Scientific Reports. 9 (1), 6293(2019).
- Grant, R., Hay, D., Callanan, A. From scaffold to structure: The synthetic production of cell derived extracellular matrix for liver tissue engineering. Biomedical Physics and Engineering Express. 4 (6), 065015(2018).
- Reid, J. A., Callanan, A. Hybrid cardiovascular sourced extracellular matrix scaffolds as possible platforms for vascular tissue engineering. Journal of Biomedical Materials Research Part B: Applied Biomaterials. , 1-15 (2019).
- Chen, C. S. Mechanotransduction - A field pulling together? Journal of Cell Science. 121 (20), 3285-3292 (2008).
- Wang, N. Review of cellular mechanotransduction. Journal of Physics D: Applied Physics. 50 (23), 233002(2017).
- Fan, Y. L., Zhao, H. C., Li, B., Zhao, Z. L., Feng, X. Q. Mechanical Roles of F-Actin in the Differentiation of Stem Cells: A Review. ACS Biomaterials Science and Engineering. 5 (8), 3788-3801 (2019).
- Davidson, A. J., Wood, W. Unravelling the Actin Cytoskeleton: A New Competitive Edge. Trends in Cell Biology. 26 (8), 569-576 (2016).
- Blanchoin, L., Boujemaa-Paterski, R., Sykes, C., Plastino, J. Actin dynamics, architecture, and mechanics in cell motility. Physiological Reviews. 94 (1), 235-263 (2014).
- Guvendiren, M., Burdick, J. A. The control of stem cell morphology and differentiation by hydrogel surface wrinkles. Biomaterials. 31 (25), 6511-6518 (2010).
- Wan, L. Q., et al. Geometric control of human stem cell morphology and differentiation. Integrative Biology. 2 (7-8), 346(2010).
- Park, J. S., et al. The effect of matrix stiffness on the differentiation of mesenchymal stem cells in response to TGF-β. Biomaterials. 32 (16), 3921-3930 (2011).
- Evans, N., et al. Substrate stiffness affects early differentiation events in embryonic stem cells. European Cells and Materials. 18, 1-14 (2009).
- Stukel, J. M., Willits, R. K. Mechanotransduction of Neural Cells Through Cell-Substrate Interactions. Tissue Engineering Part B: Reviews. 22 (3), 173-182 (2016).
- Charbonier, F. W., Zamani, M., Huang, N. F. Endothelial Cell Mechanotransduction in the Dynamic Vascular Environment. Advanced Biosystems. 3 (2), 1800252(2019).
- Nyitray, C. E., Chavez, M. G., Desai, T. A. Compliant 3D Microenvironment Improves β-Cell Cluster Insulin Expression Through Mechanosensing and β-Catenin Signaling. Tissue Engineering Part A. 20 (13-14), 1888-1895 (2014).
- Baker, B. M., et al. Cell-mediated fiber recruitment drives extracellular matrix mechanosensing in engineered fibrillar microenvironments. Nature Materials. 14 (12), 1262-1268 (2015).
- Evans, N. D., Gentleman, E. The role of material structure and mechanical properties in cell-matrix interactions. Journal of Materials Chemistry B. 2 (17), 2345(2014).
- Tusan, C. G., et al. Collective Cell Behavior in Mechanosensing of Substrate Thickness. Biophysical Journal. 114 (11), 2743-2755 (2018).
- Hotaling, N. A., Bharti, K., Kriel, H., Simon, C. G. DiameterJ: A validated open source nanofiber diameter measurement tool. Biomaterials. 61, 327-338 (2015).
- Cox, T. R., Erler, J. T. Remodeling and homeostasis of the extracellular matrix: Implications for fibrotic diseases and cancer. DMM Disease Models and Mechanisms. 4 (2), 165-178 (2011).
- Haider, A., Haider, S., Kang, I. K. A comprehensive review summarizing the effect of electrospinning parameters and potential applications of nanofibers in biomedical and biotechnology. Arabian Journal of Chemistry. 11 (8), 1165-1188 (2018).
- De Vrieze, S., et al. The effect of temperature and humidity on electrospinning. Journal of Materials Science. 44 (5), 1357-1362 (2009).
- Hohman, M. M., Shin, M., Rutledge, G., Brenner, M. P. Electrospinning and electrically forced jets I. Stability theory. Physics of Fluids. 13 (8), 2201-2220 (2001).
- Yarin, A. L., Koombhongse, S., Reneker, D. H. Bending instability in electrospinning of nanofibers. Journal of Applied Physics. 89 (5), 3018-3026 (2001).
- Feltz, K. P., Kalaf, E. A. G., Chen, C., Martin, R. S., Sell, S. A. A review of electrospinning manipulation techniques to direct fiber deposition and maximize pore size. Electrospinning. 1, 46-61 (2017).
- Simonet, M., Schneider, O. D., Neuenschwander, P., Stark, W. J. Ultraporous 3D polymer meshes by low-temperature electrospinning: Use of ice crystals as a removable void template. Polymer Engineering & Science. 47 (12), 2020-2026 (2007).
- Dai, Z., Ronholm, J., Tian, Y., Sethi, B., Cao, X. Sterilization techniques for biodegradable scaffolds in tissue engineering applications. Journal of Tissue Engineering. 7, 204173141664881(2016).
- Rogers, W. J. Sterilisation techniques for polymers. Sterilisation of Biomaterials and Medical Devices. Lerouge, S., Simmons, A. , Elsevier Science. Amsterdam, Netherlands. 151-211 (2012).
- Jokinen, V., Suvanto, P., Franssila, S. Oxygen and nitrogen plasma hydrophilization and hydrophobic recovery of polymers. Biomicrofluidics. 6 (1), 16501(2012).
- Recek, N., et al. Cell Adhesion on Polycaprolactone Modified by Plasma Treatment. International Journal of Polymer Science. 2016, 1-9 (2016).
- Fleck, N. A., Deshpande, V. S., Ashby, M. F. Micro-architectured materials: Past, present and future. Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. 466 (2121), 2495-2516 (2010).
- Cooper, A., Bhattarai, N., Zhang, M. Fabrication and cellular compatibility of aligned chitosan-PCL fibers for nerve tissue regeneration. Carbohydrate Polymers. 85 (1), 149-156 (2011).
- Patel, K. H., et al. Aligned nanofibers of decellularized muscle ECM support myogenic activity in primary satellite cells in vitro. Biomedical Materials. 14 (3), 035010(2019).
- Wang, L., et al. Fabrication of open-porous PCL/PLA tissue engineering scaffolds and the relationship of foaming process, morphology, and mechanical behavior. Polymers for Advanced Technologies. 30 (10), 2539-2548 (2019).
- Sartore, L., Inverardi, N., Pandini, S., Bignotti, F., Chiellini, F. PLA/PCL-based foams as scaffolds for tissue engineering applications. Materials Today: Proceedings. 7, 410-417 (2019).
- Munir, N., Callanan, A. Novel phase separated polycaprolactone/collagen scaffolds for cartilage tissue engineering. Biomedical Materials (Bristol). 13 (5), 051001(2018).
- Wang, W., et al. Fabrication of heterogeneous porous bilayered nanofibrous vascular grafts by two-step phase separation technique. Acta Biomaterialia. 79, 168-181 (2018).
- Kim, C., et al. Stem Cell Mechanosensation on Gelatin Methacryloyl (GelMA) Stiffness Gradient Hydrogels. Annals of Biomedical Engineering. 48 (2), 893-902 (2019).
- Chen, Z., et al. 3D Printing of Multifunctional Hydrogels. Advanced Functional Materials. 29 (20), 1900971(2019).
- Lee, J. M., Ng, W. L., Yeong, W. Y. Resolution and shape in bioprinting: Strategizing towards complex tissue and organ printing. Applied Physics Reviews. 6, 011307(2019).
- Zimmermann, R., et al. High resolution bioprinting of multi-component hydrogels. Biofabrication. 11 (4), 045008(2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır