Method Article
Control de la morfología de polímeros electrohilados para ingeniería de tejidos demostrado mediante la línea celular hepG2
En este artículo
Resumen
Este método proporciona los medios para probar diferentes morfologías y topografías de fibras de policaprolactona con fines de ingeniería de tejidos. Las fibras pequeñas y grandes se fabrican con orientaciones aleatorias, orientaciones alineadas y también estructuras porosas criogénicas electrohiladas y se utilizan como plataformas para el cultivo celular.
Resumen
El electrohilado ofrece a los investigadores la oportunidad de fabricar fibras poliméricas reproducibles a micro y nanoescala. La arquitectura fibrosa 3D de los polímeros electrohilados se considera una imitación estructural de la matriz extracelular (ECM). Por lo tanto, las fibras electrohiladas fabricadas a partir de polímeros biocompatibles han sido ampliamente investigadas por los investigadores de ingeniería de tejidos por su papel potencial como ECM artificial para guiar el crecimiento de tejidos tanto in vitro como in vivo. Todas las células son muy sensibles a su entorno mecánico. Esto se ha demostrado con el descubrimiento de múltiples vías de mecanotransducción intrínsecamente vinculadas a los filamentos de actina del citoesqueleto. El citoesqueleto actúa como un sensor mecánico que puede dirigir la funcionalidad y diferenciación de la célula huésped en función de la rigidez y morfología de su sustrato. Las fibras electrohiladas se pueden ajustar tanto en términos de tamaño como de morfología de la fibra para modular fácilmente el entorno mecánico dentro de un andamio de polímero fibroso. Aquí, se describen los métodos para electrohilar policaprolactona (PCL) para tres morfologías distintas en dos diámetros de fibra diferentes. Las categorías de fibras morfológicas consisten en fibras orientadas aleatoriamente, fibras alineadas y fibras porosas hiladas criogénicamente, con diámetros de 1 μm y 5 μm. Los métodos detallados en este estudio se proponen como una plataforma para investigar el efecto de la arquitectura de la fibra electrohilada en la generación de tejidos. La comprensión de estos efectos permitirá a los investigadores optimizar las propiedades mecánicas de las fibras electrohiladas y demostrar el potencial de esta tecnología más a fondo.
Introducción
Los métodos de ingeniería de tejidos se han desarrollado en las últimas décadas para proporcionar a las células un entorno biomimético con el fin de fomentar el éxito de la regeneración de tejidos, tanto para modelos de tejidos in vitro como para técnicas regenerativas in vivo. Estos métodos suelen animar a las células a formar agregados 3D, ya sea por sí mismas o con el uso de un andamio guía1. Los andamios pueden fabricarse como nano/microestructuras poliméricas porosas o fibrosas, o como hidrogeles altamente absorbentes de agua 2,3,4. El electrohilado de polímeros es una técnica de fabricación común que produce matrices de fibra polimérica a nanomicroescala no tejidas que pueden imitar la arquitectura fibrosa de la matriz extracelular nativa (ECM)5. Múltiples polímeros biocompatibles son aplicables al proceso de electrohilado; Por lo tanto, las fibras electrohiladas son un medio popular para facilitar la regeneración de tejidos 6,7,8. Las fibras electrohiladas se han utilizado en el cultivo de una variedad de tejidos, lo que demuestra una vía prometedora para plataformas de andamios baratas y reproducibles 9,10,11,12,13.
Las células tienen una sensibilidad aguda hacia su entorno mecánico. Investigaciones previas han destacado esta importante relación, denominada mecanotransducción, que puede influir en la función, morfología y diferenciación celular14,15. La base del citoesqueleto celular eucariota está construida a partir de actina filamentosa y desempeña funciones mecánicas clave en la división, adhesión, migración, contracción y morfología celular. Es manipulado por estímulos mecánicos externos a través de la conexión con proteínas de superficie extracelular 16,17,18. La influencia morfológica en la diferenciación de las células madre ha sido demostrada en numerosos estudios mediante la alteración de la forma de un sustrato adherible, que es capaz de controlar la forma de la célula y dirigir el proceso de diferenciación19,20. Además, la rigidez del sustrato al que se adhieren las células también influye en el destino y el linaje de las células madre21,22. Además de las células madre, también se ha observado que estos efectos afectan a células de diferentes linajes23,24. Los métodos de ingeniería de tejidos tridimensionales han mostrado resultados similares a los encontrados en estudios de mecanotransducción 2D tanto con hidrogeles como con andamios fibrilares 25,26,27. Además, la mecánica del sustrato se comunica a través de agregados de células 3D a través de la señalización célula-célula28. La mecánica de los materiales desempeña un papel crucial en la dirección de la funcionalidad celular y, por lo tanto, debería ser un factor importante en el diseño de andamios para tejidos artificiales.
El objetivo de este método es comprender los efectos del tamaño y la morfología de las fibras de policaprolactona electrohilada (PCL) en cultivos celulares in vitro. El método es una adaptación de investigaciones previas centradas en la ingeniería de tejidos renales9. Aquí se ofrece un protocolo paso a paso más detallado para facilitar la reconstrucción del andamio y desarrollar un método estandarizado que sea aplicable a todos los tipos de células. Con este método se construyeron seis grupos de andamios: tres son fibras grandes de 5 μm (LG) y los otros tres fibras pequeñas de 1 μm (SM), utilizando diferentes concentraciones de PCL. Dentro de estos grupos LG y SM hay tres construcciones morfológicas diferentes: fibras aleatorias (RA), fibras alineadas (AL) y fibras criogénicas porosas (CR). Todos estos grupos de andamios tienen estructuras inherentemente diferentes y, por lo tanto, proporcionan entornos mecánicos locales únicos a los que se adhieren las células. Para demostrar el efecto morfológico que esto produce en las células, la línea celular hepG2 se sembró en cada grupo de andamios como un estudio representativo. Este método se ofrece como un análisis de línea de base para el diseño de andamios electrohilados para todos los tipos de células, desde células madre hasta líneas celulares y células primarias.
Protocolo
1. Preparación de la solución
- Fibras grandes (aleatorias, alineadas y criogénicas)
- Prepare una proporción de 5:1 de cloroformo y metanol mezclando 50 ml de cloroformo y 10 ml de metanol en un frasco de vidrio a prueba de solventes con una pipeta serológica de vidrio.
PRECAUCIÓN: El cloroformo y el metanol son solventes tóxicos y la mezcla debe realizarse en una campana extractora. - Para crear una solución de 19 p/v % de PCL en cloroformo:metanol 5:1, pese 1,9 g de PCL y agregue 10 mL de cloroformo:metanol 5:1 en un vial de vidrio a prueba de solventes. Selle dos veces el vial con una película de parafina y deje el vial en un rodillo durante la noche para permitir que el PCL se disuelva por completo.
PRECAUCIÓN: La mezcla debe realizarse en una campana extractora.
- Prepare una proporción de 5:1 de cloroformo y metanol mezclando 50 ml de cloroformo y 10 ml de metanol en un frasco de vidrio a prueba de solventes con una pipeta serológica de vidrio.
- Fibras pequeñas (aleatorias y alineadas)
- Para preparar una solución de 7 p/v de PCL en hexafluoroisopropanol (HFIP), pese 0,7 g de PCL y mezcle con 10 mL de HFIP en un vial de vidrio resistente a solventes. Selle dos veces el vial con una película de parafina y déjelo en un rodillo durante la noche para permitir que el PCL se disuelva por completo.
PRECAUCIÓN: El HFIP es altamente tóxico y la mezcla debe realizarse en una campana extractora.
- Para preparar una solución de 7 p/v de PCL en hexafluoroisopropanol (HFIP), pese 0,7 g de PCL y mezcle con 10 mL de HFIP en un vial de vidrio resistente a solventes. Selle dos veces el vial con una película de parafina y déjelo en un rodillo durante la noche para permitir que el PCL se disuelva por completo.
- Pequeñas fibras criogénicas
PRECAUCIÓN: La mezcla debe realizarse en una campana extractora.- Prepare una proporción de 3:1 de cloroformo y metanol mezclando 30 ml de cloroformo y 10 ml de metanol en un frasco de vidrio a prueba de solventes con una pipeta serológica de vidrio.
- Para crear una solución de 14 p/v% de PCL en cloroformo:metanol 3:1, pese 1,4 g de PCL y añada 10 ml de cloroformo:metanol 3:1 en un vial de vidrio a prueba de disolventes. Selle dos veces el vial con una película de parafina y déjelo en un rodillo durante la noche para permitir que el PCL se disuelva por completo.
2. Configuración de electrospinning
NOTA: Los parámetros deben configurarse antes de comenzar el proceso de electrohilado.
- Tamaño y colocación de la aguja
- Para fibras grandes (aleatorias, alineadas y criogénicas) use una aguja de latón de 1 mm de diámetro exterior/0,8 mm de diámetro interno y coloque la aguja a 230 mm de distancia de la superficie del mandril.
- Para fibras pequeñas, utilice una aguja de latón de 1 mm de diámetro exterior/0,4 mm de diámetro interior y coloque la aguja a 15 mm de distancia de la superficie del mandril.
- Movimiento lateral de la aguja
NOTA: Los andamios detallados en la Figura 1 se fabricaron con un recorrido de aguja de 100 mm a 50 mm/s, con movimientos repetidos hacia la izquierda y hacia la derecha durante todo el proceso.- Para ajustar el movimiento lateral, pulse Movimiento | TNS 1 y ajuste la posición de inicio [mm] a -50, la distancia [mm] a 100, la velocidad [mm/s] a 50 y el retardo de giro [ms] a 750.
- Caudal de la bomba de jeringa
- Para fibras grandes (aleatorias, alineadas y criogénicas), presione la pestaña Material en la interfaz de usuario y configure la bomba de jeringa a 4 mL/h.
- Para fibras pequeñas (aleatorias y alineadas), ajuste la bomba de jeringa a 0,8 mL/h.
- Para fibras criogénicas pequeñas, ajuste la bomba de jeringa a 2,5 mL/h.
- Ajustes de voltaje
- Para las fibras grandes, ajuste el voltaje de la aguja a +15 kV y el voltaje del mandril a -4 kV presionando la pestaña Voltaje en la interfaz de usuario y cambiando los valores de voltaje positivo y negativo.
- Para las fibras pequeñas (aleatorias y alineadas), ajuste el voltaje de la aguja a +17 kV y el voltaje del mandril a -4 kV.
- Para las fibras criogénicas pequeñas, ajuste el voltaje de la aguja a +18 kV y el voltaje del mandril a -4 kV.
- Rotación del mandril (fibras grandes y pequeñas)
- Para fibras aleatorias, presione Movimiento | Apunte y ajuste la velocidad de rotación del mandril a 250 rpm.
- Para fibras alineadas, ajuste la velocidad de rotación del mandril a 1.800 rpm.
- Para fibras criogénicas, ajuste la velocidad de rotación del mandril a 180 rpm.
3. Electrohilado de fibras aleatorias y alineadas (fibras grandes y pequeñas)
- Inserte la aguja (consulte la sección 2.1 para obtener información sobre el tamaño y la ubicación de la aguja) en un tubo de PTFE de 1 mm de diámetro y asegúrela dentro del soporte de la aguja electrospinner.
- Bajo una campana extractora, transfiera los 10 ml de solución polimérica a una jeringa de polipropileno o vidrio (a prueba de solventes). Asegúrese de eliminar las burbujas dejando reposar la jeringa antes de cebar.
- Conecte la jeringa a la aguja a través del tubo de PTFE y asegure la jeringa dentro de la bomba de jeringa. Una vez conectado, cebe el tubo de PTFE apretando el émbolo de la jeringa y llenando el tubo con solución polimérica.
- Envuelva el mandril en papel de aluminio y asegúrelo en el dispositivo de rotación del mandril.
- Activa la rotación del mandril pulsando Motion | Objetivo | Gire y la bomba de jeringa presionando Material | Arranque de la bomba 1.
- Cuando se haya formado una pequeña gota de polímero en el extremo de la aguja, encienda el voltaje presionando ACTIVATE HIGH VOLTAGE. A continuación, se debe emitir un chorro de polímero desde una protuberancia cónica de solución polimérica, llamada cono de Taylor. Revise el mandril para confirmar la deposición de fibras en la superficie del mandril.
- Ejecute el proceso de electrohilado hasta que la cantidad deseada de solución de PCL se electrohile.
NOTA: Para los andamios presentados en la Figura 1, 4 mL de solución fueron electrohilados. - Una vez que haya terminado el electrohilado, retire el papel de aluminio cubierto con la fibra del mandril y déjelo en un armario de gases durante la noche para permitir la evaporación excesiva del solvente.
- Después de la evaporación, almacene las fibras a temperatura ambiente (RT).
4. Electrohilado de fibras criogénicas
- Para el electrohilado criogénico, utilice el mandril criogiratorio. Repita los pasos 3.1-3.3 y, a continuación, continúe con los pasos siguientes.
- Envuelva el mandril en papel de aluminio.
- Llene el mandril con gránulos de hielo seco. Asegure la cubierta del mandril criogiratorio en el mandril para asegurarse de que el hielo seco no pueda escapar del mandril, pero la presión puede escapar. Los cristales de hielo deben formarse en la superficie del mandril casi de inmediato.
PRECAUCIÓN: Utilice guantes protectores cuando manipule hielo seco para evitar quemaduras por frío. - Fije el mandril en el dispositivo de rotación del mandril y active inmediatamente la rotación del mandril pulsando Motion | Objetivo | Gire y la bomba de jeringa presionando Material | Arranque de la bomba 1.
- Una vez que se haya formado una gota de polímero en el extremo de la aguja, encienda el voltaje presionando ACTIVATE HIGH VOLTAGE. A continuación, se debe emitir un chorro de polímero desde una protuberancia cónica de la solución polimérica (es decir, el cono de Taylor). Revise el mandril para confirmar la deposición de fibras en la superficie del mandril.
- Después de 1 h de electrocentrifugado, detenga el proceso presionando STOP ALL y rellene el mandril con hielo seco. Asegure una protección adecuada contra el vapor de solvente mientras rellena el mandril. Realice esto durante un total de 3 veces durante 4 horas de tiempo total de electrogiro.
NOTA: El electrospinning se puede reanudar repitiendo los pasos 4.4 y 4.5. - Una vez que termine el electrospinado, retire con cuidado el mandril e indíquelo inmediatamente en un liofilizador durante 24 h para sublimar los cristales de hielo en la superficie del mandril.
- Después de la sublimación, retire la lámina cubierta de fibra del mandril y guárdela en RT, teniendo cuidado de evitar el aplastamiento.
5. Punzonado de andamios
- Perfore los andamios de la lámina de fibras con un punzón de biopsia de 10-12 mm. Si las fibras permanecen adheridas al papel de aluminio, coloque los andamios en etanol al 70% para facilitar el desprendimiento.
6. Esterilización y recubrimiento por plasma
- Coloque los andamios (1 andamio por pocillo) en una placa de 24 o 48 pocillos y lávelos 3 veces en etanol al 70%. Dejar sumergido en el lavado final, colocar en un congelador a -80 °C y dejar congelar.
- Una vez congelada, colocar la placa en un liofilizador y liofilizar durante 24 h. Los andamios secos ahora se pueden recubrir con plasma.
NOTA: Si no hay acceso a un recubridor de plasma, sumerja los andamios en antibiótico-antimicótico al 1% (Anti-Anti) en solución salina tamponada con fosfato (PBS) y déjelos incubar a 37 °C durante la noche. - Coloque la placa en la cámara de plasma y retire la tapa. Haga funcionar el recubridor de plasma a 500 mTorr y a una potencia de radiofrecuencia (RF) media durante 30 s.
- Después del recubrimiento con plasma, sumerja los andamios en 1 mL de PBS y 1% de Anti-Anti. Los andamios deben absorber fácilmente la solución de PBS.
NOTA: Los andamios ya están listos para ser sembrados con células.
7. Preparación y siembra de células
NOTA: La técnica básica de cultivo celular que se proporciona a continuación es para las células hepg2 utilizadas con fines de demostración en los resultados representativos. Estos principios se pueden aplicar a cualquier tipo de célula adherente; Sin embargo, diferentes celdas pueden requerir diferentes materiales y diferentes procesos. La manipulación de las células debe realizarse en una cabina de seguridad biológica, siguiendo una técnica aséptica.
- Tome 1 x 106 células hepg2 criopreservadas y siembre en un matraz de cultivo celular T75 con 12 mL de medio completo que consta de medios esenciales mínimos de Eagle (EMEM) suplementados con 10% de suero fetal bovino, 100 U/mL de penicilina-estreptomicina, 5 mM de L-glutamina y 1% de aminoácidos no esenciales.
- Una vez que las células estén al 80% de confluencia, separar las células del matraz de cultivo lavándolas 3 veces en PBS e incubando en 2 mL de tripsina a 37 °C durante 4 min. Después de golpear el matraz, las células deben desprenderse.
- Desactive la tripsina añadiendo 8 mL de medio completo. Transfiera la suspensión celular a un tubo de 15 mL y gire las celdas en una centrífuga a 120 x g durante 5 minutos.
- Retire el sobrenadante por encima del pellet de celda con una pipeta de aspiración y reemplácelo con 5 mL de medio completo. Vuelva a suspender las células pipeteando hacia arriba y hacia abajo con una pipeta serológica de 5 ml.
- Cuente la suspensión celular resultante mediante el método de exclusión de azul de tripano. Tome 100 μL de suspensión celular y agregue 100 μL de azul de tripán en un vial de 1,5 mL. Introduzca la mezcla en un hemocitómetro debajo de un cubreobjetos de vidrio y cuente las células bajo un microscopio.
- Ajuste la concentración de celdas a 2.6 x 106 celdas/mL agregando o quitando medios completos. Para eliminar el medio, centrifugue las células a 220 x g durante 5 minutos, retire el medio necesario y vuelva a suspender las células.
- Aspire el Anti-Anti al 1% en PBS de la placa de pocillos y siembre 50 μL de suspensión de celdas de 2,6 x 106 células/ml sobre la superficie del andamio utilizando una pipeta de 200 μL.
- Deje que las células se adhieran durante la incubación a 37 °C y 5% de CO2 durante 1-3 h, asegurándose de que no se sequen. Una vez colocado, añadir 300 μL (para una placa de 48 pocillos) o 500 μL (para una placa de 24 pocillos) de medio de cultivo e incubar a 37 °C y 5% deCO2.
NOTA: Las técnicas estándar de cultivo celular se pueden utilizar desde aquí hasta un análisis funcional adicional.
Resultados
La Figura 1 muestra imágenes de microscopio electrónico de barrido (SEM) de fibras pequeñas (~1 μm) y grandes (~5 μm) fabricadas a partir de soluciones de PCL. Las fibras se recubrieron con oro-paladio (60:40) durante 30 s utilizando un recubridor de pulverización catódica antes de la obtención de imágenes SEM. Las fibras grandes se produjeron utilizando una alta concentración de 19 w/v% de PCL en una solución 5:1 de cloroformo y metanol para crear una solución de PCL de alta viscosidad. Esta solución de alta viscosidad se electrohiló a un alto caudal para emitir un gran hilo de solución polimérica dentro del campo eléctrico. Por lo tanto, era necesaria una gran distancia de 230 mm entre la aguja y el mandril para garantizar una evaporación efectiva del disolvente antes de la deposición en el mandril. Por el contrario, se produjeron fibras más pequeñas utilizando una baja concentración de 7 w/v% de PCL en HFIP para crear una solución de PCL de baja viscosidad. El electrocentrifugado de la solución de PCL de baja viscosidad a un caudal bajo garantizó que se emitiera un hilo más delgado de solución de PCL desde la aguja dentro del campo eléctrico. La rosca más delgada facilitó una evaporación más rápida del solvente y la aguja debía estar más cerca del mandril a 70 mm para garantizar una deposición estable de las fibras. Para el electrohilado de pequeñas fibras criogénicas, fue necesario alterar la solución de PCL para lograr un protocolo confiable. El PCL en HFIP electrohilado sobre el mandril criogénico repetidamente resultó en una estructura de fibra desintegrada. El electrospinning a una concentración de PCL de 14 w/v% en metanol cloroformo 3:1 resolvió este problema; Sin embargo, esto creó una mayor variación en el tamaño de la fibra en todo el andamio. El grado de alineación de la fibra (radio y orientación de la fibra) para cada andamio se analizó a través del complemento ImageJ DiameterJ29 y se muestra en la Figura 2 y la Figura 3.

Figura 1: Imágenes SEM que muestran las cualidades morfológicas de cada grupo de andamios. La fila superior muestra las fibras pequeñas y la fila inferior las fibras grandes. Los grupos morfológicos se enumeran de izquierda a derecha como fibras aleatorias, fibras alineadas y fibras criogénicas, respectivamente. Haga clic aquí para ver una versión más grande de esta figura.
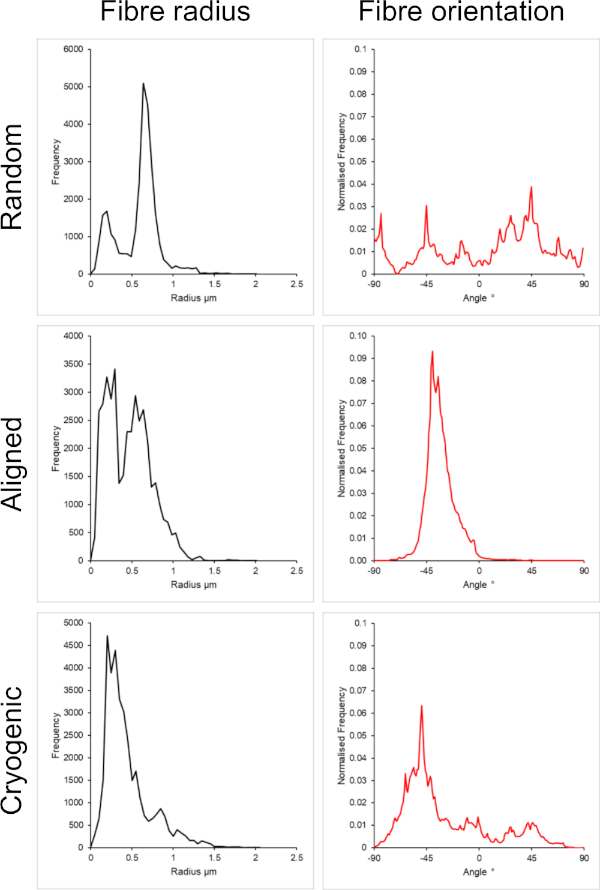
Figura 2: Datos de radio de fibra (izquierda) y orientación de fibra (derecha) del complemento DiameterJ para el pequeño conjunto de fibras. Morfología enumerada de arriba a abajo como fibras aleatorias, fibras alineadas y fibras criogénicas, respectivamente. Haga clic aquí para ver una versión más grande de esta figura.
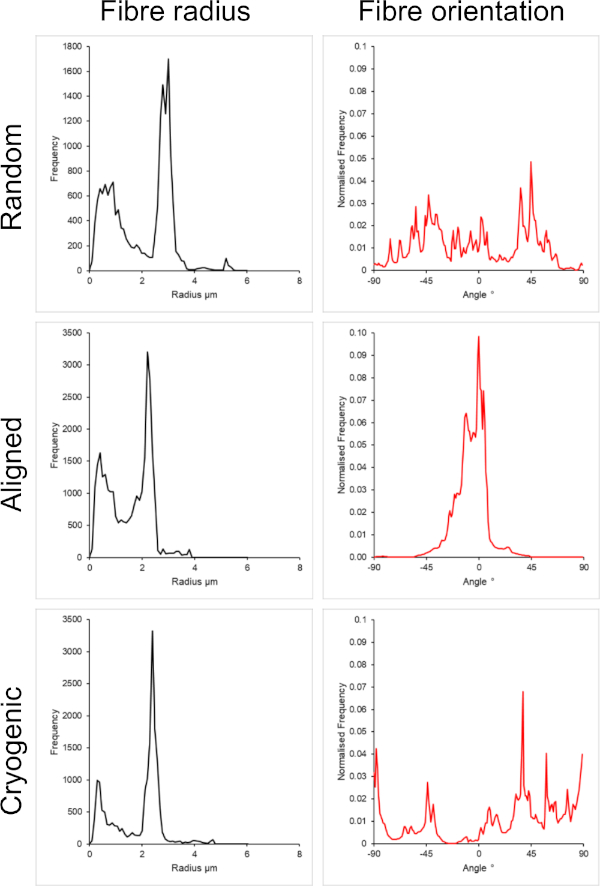
Figura 3: Datos de radio de fibra (izquierda) y orientación de fibra (derecha) del complemento DiameterJ para el gran conjunto de fibras. Morfología enumerada de arriba a abajo como fibras aleatorias, fibras alineadas y fibras criogénicas, respectivamente. Haga clic aquí para ver una versión más grande de esta figura.
Este método nos ofreció un conjunto de andamios con seis propiedades de tracción claramente diferentes, determinadas utilizando una máquina de ensayos de tracción de acuerdo con los métodos descritos anteriormente9. Como se muestra en la Tabla 1 , los módulos de Young a macroescala oscilan entre 46,94 ± 3,48 MPa en las fibras alineadas grandes y 0,20 ± 0,01 MPa en las fibras criogénicas grandes. Los valores de rigidez fisiológica del tejido oscilan entre 100 Pa (tejido neural) y 2-4 GPa (tejido óseo)30; Todos los valores de rigidez del andamio informados aquí estaban dentro de este rango.
| Andamio | Módulo de Young (MPa) para deformación% | ||||
| 0–2% | 2–4% | 4–6% | 6–8% | 8–10% | |
| SM. RA | 11.14 ± 2.13 | 9,31 ± 0,43 | 6,75 ± 0,64 | 4,75 ± 0,59 | 3,32 ± 0,40 |
| SM. AL | 27,94 ± 8,63 | 28,27 ± 7,36 | 16,34 ± 4,87 | 9,10 ± 3,75 | 5,85 ± 3,11 |
| SM. CR | 0,27 ± 0,11 | 0,31 ± 0,44 | 0,31 ± 0,65 | 0,29 ± 0,59 | 0,26 ± 0,40 |
| LG. RA | 9,23 ± 0,78 | 8,22 ± 0,87 | 5,96 ± 0,68 | 3,96 ± 0,59 | 2,63 ± 0,45 |
| LG. AL | 46,94 ± 3,48 | 38,03 ± 2,46 | 27,69 ± 1,22 | 16.10 ± 1.61 | 7,87 ± 1,32 |
| LG. CR | 0,20 ± 0,01 | 0,16 ± 0,01 | 0,12 ± 0,01 | 0,10 ± 0,01 | 0,09 ± 0,01 |
Tabla 1: Datos de ensayos de tracción para cada grupo de andamios a intervalos de 2% de deformación. SM. RA = Aleatorio pequeño, SM. AL = Alineado pequeño, SM. CR = Pequeño criogénico, LG. RA = Aleatorio grande, LG. AL = Alineado grande, y LG. CR = Criogénico de gran tamaño. Los datos se presentan como media ± DE, n = 5.
En la Figura 4 se muestra la tinción de DAPI y faloidina utilizada para visualizar la morfología celular. El método de tinción utilizado está establecido en la literatura11,12. Las imágenes se obtuvieron utilizando un microscopio (Tabla de Materiales) con un objetivo de aumento de 40x. Las imágenes muestran que las fibras alineadas producidas por este método alargaron la morfología de la célula hepG2 y dirigieron las células proliferantes a lo largo de las fibras, creando direccionalidad dentro del cultivo celular. Por el contrario, las células hepG2 en fibras aleatorias no mostraron la proliferación direccional y la elongación observadas en las estructuras alineadas. En las estructuras aleatorias, las células hepG2 mostraron una morfología más regular, con protuberancias extendidas que se unen a las fibras PCL circundantes.
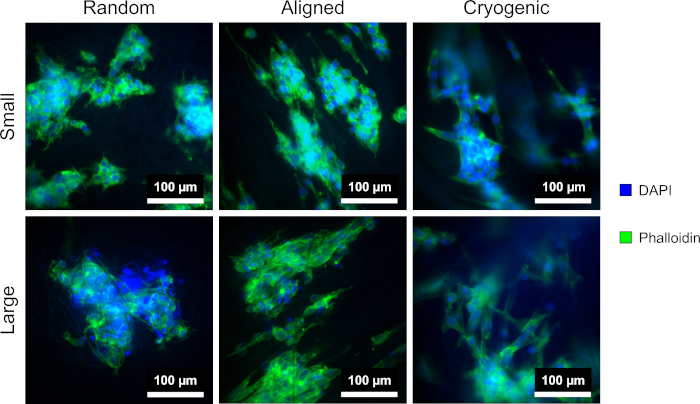
Figura 4: Células hepG2 teñidas con DAPI (azul) y faloidina (verde) en las diferentes morfologías de andamios: aleatorias (izquierda), alineadas (centro) y criogénicas (derecha). La fila superior muestra fibras pequeñas y la fila inferior muestra fibras grandes. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La creación de diferentes tamaños de fibra se logró utilizando una combinación de diferentes solventes, concentraciones de PCL y parámetros de electrohilado. El tipo de polímero, su peso molecular y el disolvente afectan fuertemente las propiedades de viscosidad y carga de la solución resultante y, por lo tanto, tienen una fuerte influencia en las propiedades de electrohilatura31. Los voltajes mostrados en este método están sujetos a cambios en función de las condiciones en las que se lleva a cabo el electrogiro. La temperatura y la humedad afectan el comportamiento del proceso de electrohilado32. Por lo tanto, se recomienda al lector que esté preparado para cambiar el voltaje para contrarrestar cualquier obstáculo y lograr un cono de Taylor estable. Se recomienda alojar el electrohilador dentro de un recinto de control ambiental para reducir la variabilidad de un lote a otro en el proceso de electrohilado.
Lograr las diferentes morfologías presentadas en este método es posible gracias a las capacidades del dispositivo de electrospinning IME. Un mandril de velocidad variable es esencial para controlar la alineación de la fibra. La rotación del mandril a bajas rpm (<250 rpm) produce fibras orientadas aleatoriamente debido al comportamiento del chorro de polímero. Cuando la solución de polímero cargada se emite desde la aguja, las cargas internas y las fuerzas aerodinámicas inducen un efecto de latigazo caótico que se utiliza para establecer una disposición caótica de fibras en el mandril33,34. Este efecto de latigazo se puede superar aumentando la velocidad de rotación del mandril por encima de 1.800 rpm. Las fibras depositadas en un mandril de rpm tan altas exhiben una estructura alineada porque la velocidad de la superficie es suficiente para contrarrestar eficazmente cualquier movimiento transversal exhibido por la fibra de batido. Es importante tener en cuenta que cuando se utilizan altas velocidades de mandril, es probable que se interrumpa el aire circundante, lo que puede tener un efecto adverso en la producción de un cono de Taylor estable.
Los andamios criogénicos altamente porosos se producen llenando el mandril con hielo seco a -78,5 °C. Esto reduce la temperatura del mandril y promueve la condensación y congelación de las gotas de agua en la superficie. Los cristales formados exhiben picos que emergen de la superficie del mandril y las fibras se depositan a lo largo de los picos. Una vez que los cristales de hielo se subliman, queda una estructura porosa de fibras en el mandril 35,36. El peso y la fragilidad de los cristales limitan la capacidad de crear fibras porosas alineadas, ya que velocidades de mandril demasiado altas (>250 rpm) hacen que los cristales y las fibras se desprendan del mandril debido a fuerzas centrípetas y aerodinámicas excesivas. Es posible enfrentar dificultades con este método debido a la fragilidad de las estructuras formadas. Se debe tener cuidado al manipular el mandril y también al manipular los andamios posteriormente, porque las estructuras son propensas a aplanarse cuando se aprietan y se doblan al retirarlas de los líquidos. También existe la posibilidad de que las soluciones que electrogiran con éxito sin el mandril criogénico puedan verse fatalmente interrumpidas por el cambio de temperatura y las estructuras cristalinas. Al criocentrifugar, la cantidad de hielo que se forma en la superficie del mandril depende en gran medida de la humedad, lo que produce variabilidad en el resultado final. Por lo tanto, se recomienda encarecidamente contener el proceso de electrohilado dentro de un recinto de control ambiental.
Para evaluar el rendimiento celular en estos andamios, es necesario esterilizar previamente el material. Hay muchas opciones disponibles para esterilizar polímeros, incluidos los métodos químicos, los métodos de radiación y los métodos basados en calor37,38. Es importante evaluar la eficacia de cada método y la idoneidad tanto para el uso del material como para el material en sí. Este protocolo utiliza la esterilización en etanol al 70% antes de liofilizar, tratar el plasma y sumergirlo en una solución Anti-Anti al 1%. El uso de etanol permite que las proteínas y los microorganismos se desnaturalicen y deshidraten sin alterar el material PCL37. El uso de disolventes más fuertes puede dar lugar a la disolución del PCL. El recubrimiento con plasma se incorporó en este método principalmente para aumentar la hidrofilicidad de PCL, que es notoriamente hidrofóbica, y mejorar la adhesión celular39,40. Convenientemente, esto también funciona como un paso de esterilización secundario, pero se debe tener cuidado de mantener los andamios en un ambiente estéril antes y después del tratamiento con plasma. Este método ha demostrado ser adecuado para estudios in vitro con medios tratados con antibióticos. Sin embargo, para aplicaciones in vivo, se deben considerar opciones más robustas como el óxido de etileno (EtO) y la exposición gamma. Una vez que se ha realizado la esterilización, las células se pueden sembrar en el andamio y se pueden aplicar técnicas estándar de cultivo celular para formar cultivos celulares 3D in vitro.
Es importante tener en cuenta que los valores de rigidez deben atribuirse a las diferentes microestructuras formadas dentro de los andamios. El material a granel (PCL) permanece constante entre andamios. Por lo tanto, la rigidez del material a granel no cambia entre grupos. Los andamios criogénicos muestran una rigidez mucho menor que los otros grupos debido a la conectividad reducida dentro de la matriz de fibra, que se puede ver en la Tabla 1. Se cree que la conectividad reducida induce una deformación dominante por flexión en comparación con la deformación dominante por estiramiento dentro de la estructura fibrosa41. Curiosamente, la rigidez del andamio no depende en gran medida del tamaño de la fibra en los grupos aleatorios y criogénicos. Sin embargo, la rigidez longitudinal de las fibras alineadas muestra una dependencia significativamente mayor del tamaño de la fibra, siendo el módulo de Young a una deformación del 0-2% de 27,94 ± 8,63 MPa para fibras pequeñas y de 46,94 ± 3,48 MPa para fibras grandes. Debido a la naturaleza de estiramiento de la prueba de tracción, esto implica una mayor densidad de PCL aparente dentro de la sección transversal longitudinal. Es necesario reiterar que los datos mecánicos presentados aquí son una instantánea mecánica a macroescala de las arquitecturas fibrosas. Una mayor caracterización micromecánica sería beneficiosa para comprender completamente las influencias mecánicas en la escala celular.
En este método se incluyeron arquitecturas aleatorias y alineadas para proporcionar una comparación entre morfologías isotrópicas y anisotrópicas. El grado de alineación de las fibras se puede observar en las imágenes SEM de la Figura 2 y en los análisis de fibras presentados en la Figura 2 y la Figura 3. Las propiedades anisotrópicas se observan en muchos de los tejidos del cuerpo. En particular, esto se observa comúnmente en estructuras celulares alineadas, como las que se encuentran en los tejidos musculares y nerviosos. Las estructuras de fibras poliméricas alineadas ofrecen la capacidad de recapitular estas estructuras alineadas in vitro42,43. Como se describió anteriormente, la función celular es sensible a los cambios morfológicos y mecánicos, por lo que se deben realizar análisis funcionales adicionales en las células unidas al andamio para determinar la influencia biológica de cada tipo de andamio.
En comparación con otras técnicas de fabricación de andamios existentes, este método proporciona una forma sencilla de producir estructuras de andamios a microescala con un control comparativamente alto sobre las propiedades mecánicas y la morfología. La fabricación alternativa de andamios PCL, como la separación de fases, la lixiviación de sal y la formación de espuma de gas, permite el control morfológico en términos de espacio vacío y tamaño de poro. Sin embargo, la geometría del poro y la estructura sigue siendo en gran medida la misma 44,45,46,47. Por lo tanto, cualidades como el nivel de isotropía no se pueden alterar tan fácilmente en comparación con el electrohilado. Los materiales de hidrogel, populares para la producción de andamios, proporcionan los medios para alterar la rigidez del sustrato polimérico a través de la alteración del nivel de las cadenas poliméricas reticuladas48. También es posible imprimir en 3D a través de una variedad de métodos, proporcionando un excelente control sobre la morfología49. Sin embargo, lograr la resolución de las incrustaciones de electrohilado en materiales de hidrogel biocompatibles sigue siendo un desafío a implementar en la práctica50,51. Los andamios electrohilados han aparecido comúnmente en la investigación de ingeniería de tejidos a lo largo de la última década, y siempre se está explorando la introducción de nuevos materiales y aplicaciones con diferentes tipos de celdas. Si bien se están desarrollando constantemente nuevos materiales con el propósito de andamios de electrohilado, siguen existiendo oportunidades para una mayor caracterización biológica de los materiales y métodos de electrohilatura existentes. El método descrito se propone como un método para facilitar el estudio biológico in vitro, ya que es directamente aplicable a las técnicas básicas de cultivo celular.
Agradecimientos
Este trabajo fue apoyado por la subvención del Consejo de Investigación de Ingeniería y Ciencias Físicas Ref: EP/N509644/1, la subvención UKRMPII Ref: MR/L022974/1 y la subvención MRC CCBN Ref: MR/L012766/1. Los autores desean agradecer a la Dra. Alison McDonald y al Dr. David Kelly (COIL) por ayudar y facilitar las imágenes de microscopía y al Prof. Alistair Elfick por el acceso a las instalaciones del laboratorio (Instituto de Bioingeniería).
Materiales
| Name | Company | Catalog Number | Comments |
| 10 mm biopsy punch | Acuderm | P1025 | |
| 15 mL Falcon tube | Thermo-scientific | 339650 | |
| 20 mL glass vial | Fisherbrand | 11513542 | |
| 48 well cell culture plate | Greiner Bio-one | 677180 | |
| Anti-Anti 100X | Gibco | 15240062 | |
| Chloroform | Acros Organics | 13029236 | |
| DAPI | Sigma-aldrich | D9542 | |
| Eagles Minimum Essential Media | Gibco | 11090081 | |
| Electrospinner | IME Technologies | EC-DIG | |
| Fetal Bovine Serum | GE Healthcare | SH30071.03 | |
| Gold-Palladium Sputter coater | Emscope | SC500A | |
| HepG2 cell line | Sigma-aldrich | 85011430 | |
| Hexafluoroisopropanol (HFIP) | Manchester Organics | G26383 | |
| L-Glutamine 200 mM | Gibco | 25030081 | |
| MEM Non-essential Amino Acids | Gibco | 11140050 | |
| Methanol | Acros Organics | 11984591 | |
| Penicillin-Streptomycin 10,000 U/mL | Gibco | 15140122 | |
| Phalloidin | Abcam | ab176754 | |
| Phosphate Buffered Saline (PBS) | Sigma-aldrich | P4417-100TAB | |
| Plasma coater | Harrick Plasma | PDC-002 | |
| Polycaprolactone (Avg. MW 80,000) | Sigma-aldrich | 440744 | |
| PTFE Syringe | Fisherbrand | 12941031 | |
| Scanning Electron Microscope | Hitachi | S4700 | |
| T75 Culture Flask | Corning | CLS430641 | |
| Trypan blue (0.4%) | Gibco | 15250061 |
Referencias
- Akter, F. Principles of Tissue Engineering. Tissue Engineering Made Easy. Akter, F. , Academic Press. London, UK. 3-16 (2016).
- Van Vlierberghe, S., Dubruel, P., Schacht, E. Biopolymer-Based Hydrogels as Scaffolds for Tissue Engineering Applications: A Review. Biomacromolecules. 12 (5), 1387-1408 (2011).
- Murugan, R., Ramakrishna, S. Nano-featured scaffolds for tissue engineering: A review of spinning methodologies. Tissue Engineering. 12 (3), 435-447 (2006).
- Hollister, S. J. Porous scaffold design for tissue engineering. Nature Materials. 4 (7), 518-524 (2005).
- Jun, I., Han, H. S., Edwards, J. R., Jeon, H. Electrospun fibrous scaffolds for tissue engineering: Viewpoints on architecture and fabrication. International Journal of Molecular Sciences. 19 (3), E745(2018).
- Rashidi, H., et al. 3D human liver tissue from pluripotent stem cells displays stable phenotype in vitro and supports compromised liver function in vivo. Archives of Toxicology. 92 (10), 3117-3129 (2018).
- Grant, R., Hay, D. C., Callanan, A. A Drug-Induced Hybrid Electrospun Poly-Capro-Lactone: Cell-Derived Extracellular Matrix Scaffold for Liver Tissue Engineering. Tissue Engineering Part A. 23 (13-14), 650-662 (2017).
- Munir, N., McDonald, A., Callanan, A. A combinatorial approach: Cryo-printing and electrospinning hybrid scaffolds for cartilage tissue engineering. Bioprinting. 16, e00056(2019).
- Burton, T. P., Corcoran, A., Callanan, A. The effect of electrospun polycaprolactone scaffold morphology on human kidney epithelial cells. Biomedical Materials. 13 (1), 015006(2018).
- Reid, J. A., Callanan, A. Influence of aorta extracellular matrix in electrospun polycaprolactone scaffolds. Journal of Applied Polymer Science. 136 (44), 48181(2019).
- Grant, R., Hallett, J., Forbes, S., Hay, D., Callanan, A. Blended electrospinning with human liver extracellular matrix for engineering new hepatic microenvironments. Scientific Reports. 9 (1), 6293(2019).
- Grant, R., Hay, D., Callanan, A. From scaffold to structure: The synthetic production of cell derived extracellular matrix for liver tissue engineering. Biomedical Physics and Engineering Express. 4 (6), 065015(2018).
- Reid, J. A., Callanan, A. Hybrid cardiovascular sourced extracellular matrix scaffolds as possible platforms for vascular tissue engineering. Journal of Biomedical Materials Research Part B: Applied Biomaterials. , 1-15 (2019).
- Chen, C. S. Mechanotransduction - A field pulling together? Journal of Cell Science. 121 (20), 3285-3292 (2008).
- Wang, N. Review of cellular mechanotransduction. Journal of Physics D: Applied Physics. 50 (23), 233002(2017).
- Fan, Y. L., Zhao, H. C., Li, B., Zhao, Z. L., Feng, X. Q. Mechanical Roles of F-Actin in the Differentiation of Stem Cells: A Review. ACS Biomaterials Science and Engineering. 5 (8), 3788-3801 (2019).
- Davidson, A. J., Wood, W. Unravelling the Actin Cytoskeleton: A New Competitive Edge. Trends in Cell Biology. 26 (8), 569-576 (2016).
- Blanchoin, L., Boujemaa-Paterski, R., Sykes, C., Plastino, J. Actin dynamics, architecture, and mechanics in cell motility. Physiological Reviews. 94 (1), 235-263 (2014).
- Guvendiren, M., Burdick, J. A. The control of stem cell morphology and differentiation by hydrogel surface wrinkles. Biomaterials. 31 (25), 6511-6518 (2010).
- Wan, L. Q., et al. Geometric control of human stem cell morphology and differentiation. Integrative Biology. 2 (7-8), 346(2010).
- Park, J. S., et al. The effect of matrix stiffness on the differentiation of mesenchymal stem cells in response to TGF-β. Biomaterials. 32 (16), 3921-3930 (2011).
- Evans, N., et al. Substrate stiffness affects early differentiation events in embryonic stem cells. European Cells and Materials. 18, 1-14 (2009).
- Stukel, J. M., Willits, R. K. Mechanotransduction of Neural Cells Through Cell-Substrate Interactions. Tissue Engineering Part B: Reviews. 22 (3), 173-182 (2016).
- Charbonier, F. W., Zamani, M., Huang, N. F. Endothelial Cell Mechanotransduction in the Dynamic Vascular Environment. Advanced Biosystems. 3 (2), 1800252(2019).
- Nyitray, C. E., Chavez, M. G., Desai, T. A. Compliant 3D Microenvironment Improves β-Cell Cluster Insulin Expression Through Mechanosensing and β-Catenin Signaling. Tissue Engineering Part A. 20 (13-14), 1888-1895 (2014).
- Baker, B. M., et al. Cell-mediated fiber recruitment drives extracellular matrix mechanosensing in engineered fibrillar microenvironments. Nature Materials. 14 (12), 1262-1268 (2015).
- Evans, N. D., Gentleman, E. The role of material structure and mechanical properties in cell-matrix interactions. Journal of Materials Chemistry B. 2 (17), 2345(2014).
- Tusan, C. G., et al. Collective Cell Behavior in Mechanosensing of Substrate Thickness. Biophysical Journal. 114 (11), 2743-2755 (2018).
- Hotaling, N. A., Bharti, K., Kriel, H., Simon, C. G. DiameterJ: A validated open source nanofiber diameter measurement tool. Biomaterials. 61, 327-338 (2015).
- Cox, T. R., Erler, J. T. Remodeling and homeostasis of the extracellular matrix: Implications for fibrotic diseases and cancer. DMM Disease Models and Mechanisms. 4 (2), 165-178 (2011).
- Haider, A., Haider, S., Kang, I. K. A comprehensive review summarizing the effect of electrospinning parameters and potential applications of nanofibers in biomedical and biotechnology. Arabian Journal of Chemistry. 11 (8), 1165-1188 (2018).
- De Vrieze, S., et al. The effect of temperature and humidity on electrospinning. Journal of Materials Science. 44 (5), 1357-1362 (2009).
- Hohman, M. M., Shin, M., Rutledge, G., Brenner, M. P. Electrospinning and electrically forced jets I. Stability theory. Physics of Fluids. 13 (8), 2201-2220 (2001).
- Yarin, A. L., Koombhongse, S., Reneker, D. H. Bending instability in electrospinning of nanofibers. Journal of Applied Physics. 89 (5), 3018-3026 (2001).
- Feltz, K. P., Kalaf, E. A. G., Chen, C., Martin, R. S., Sell, S. A. A review of electrospinning manipulation techniques to direct fiber deposition and maximize pore size. Electrospinning. 1, 46-61 (2017).
- Simonet, M., Schneider, O. D., Neuenschwander, P., Stark, W. J. Ultraporous 3D polymer meshes by low-temperature electrospinning: Use of ice crystals as a removable void template. Polymer Engineering & Science. 47 (12), 2020-2026 (2007).
- Dai, Z., Ronholm, J., Tian, Y., Sethi, B., Cao, X. Sterilization techniques for biodegradable scaffolds in tissue engineering applications. Journal of Tissue Engineering. 7, 204173141664881(2016).
- Rogers, W. J. Sterilisation techniques for polymers. Sterilisation of Biomaterials and Medical Devices. Lerouge, S., Simmons, A. , Elsevier Science. Amsterdam, Netherlands. 151-211 (2012).
- Jokinen, V., Suvanto, P., Franssila, S. Oxygen and nitrogen plasma hydrophilization and hydrophobic recovery of polymers. Biomicrofluidics. 6 (1), 16501(2012).
- Recek, N., et al. Cell Adhesion on Polycaprolactone Modified by Plasma Treatment. International Journal of Polymer Science. 2016, 1-9 (2016).
- Fleck, N. A., Deshpande, V. S., Ashby, M. F. Micro-architectured materials: Past, present and future. Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. 466 (2121), 2495-2516 (2010).
- Cooper, A., Bhattarai, N., Zhang, M. Fabrication and cellular compatibility of aligned chitosan-PCL fibers for nerve tissue regeneration. Carbohydrate Polymers. 85 (1), 149-156 (2011).
- Patel, K. H., et al. Aligned nanofibers of decellularized muscle ECM support myogenic activity in primary satellite cells in vitro. Biomedical Materials. 14 (3), 035010(2019).
- Wang, L., et al. Fabrication of open-porous PCL/PLA tissue engineering scaffolds and the relationship of foaming process, morphology, and mechanical behavior. Polymers for Advanced Technologies. 30 (10), 2539-2548 (2019).
- Sartore, L., Inverardi, N., Pandini, S., Bignotti, F., Chiellini, F. PLA/PCL-based foams as scaffolds for tissue engineering applications. Materials Today: Proceedings. 7, 410-417 (2019).
- Munir, N., Callanan, A. Novel phase separated polycaprolactone/collagen scaffolds for cartilage tissue engineering. Biomedical Materials (Bristol). 13 (5), 051001(2018).
- Wang, W., et al. Fabrication of heterogeneous porous bilayered nanofibrous vascular grafts by two-step phase separation technique. Acta Biomaterialia. 79, 168-181 (2018).
- Kim, C., et al. Stem Cell Mechanosensation on Gelatin Methacryloyl (GelMA) Stiffness Gradient Hydrogels. Annals of Biomedical Engineering. 48 (2), 893-902 (2019).
- Chen, Z., et al. 3D Printing of Multifunctional Hydrogels. Advanced Functional Materials. 29 (20), 1900971(2019).
- Lee, J. M., Ng, W. L., Yeong, W. Y. Resolution and shape in bioprinting: Strategizing towards complex tissue and organ printing. Applied Physics Reviews. 6, 011307(2019).
- Zimmermann, R., et al. High resolution bioprinting of multi-component hydrogels. Biofabrication. 11 (4), 045008(2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados