Method Article
hepG2細胞株を使用して実証された組織工学のためのエレクトロスピニングポリマー形態の制御
要約
この方法は、組織工学の目的で、さまざまなポリカプロラクトン繊維の形態とトポグラフィーをテストする手段を提供します。小さな繊維と大きな繊維は、ランダムな配向、整列した配向、さらには多孔質の極低温エレクトロスピニング構造で製造され、細胞培養のプラットフォームとして使用されます。
要約
エレクトロスピニングは、研究者に再現性のあるマイクロからナノスケールのポリマー繊維を製造する機会を提供します。エレクトロスピニングポリマーの3D繊維構造は、細胞外マトリックス(ECM)の構造模倣と見なされています。したがって、生体適合性ポリマーから作製されたエレクトロスピニングファイバーは、in vitroおよびin vivoの両方で組織成長を導く人工ECMとしての潜在的な役割について、組織工学研究者によって広く研究されてきました。すべての細胞は、その機械的環境に鋭敏に敏感です。これは、細胞骨格アクチンフィラメントに内在的に結合した複数のメカノトランスダクション経路の発見によって実証されています。細胞骨格は、宿主細胞の基質の硬さと形態に応じて、宿主細胞の機能性と分化を指示できる機械的なセンサーとして機能します。エレクトロスピニングファイバーは、繊維サイズと形態の両方の観点から調整でき、繊維状ポリマー足場内の機械的環境を簡単に調整できます。ここでは、2つの異なる繊維直径で3つの異なる形態のポリカプロラクトン(PCL)をエレクトロスピニングする方法について説明します。形態学的繊維のカテゴリーは、直径1μmおよび5μmのランダム配向繊維、整列繊維、および多孔質の極低温紡糸繊維で構成されています。この研究で詳述された方法は、エレクトロスピニングファイバーアーキテクチャが組織生成に及ぼす影響を調査するためのプラットフォームとして提案されています。これらの影響を理解することで、研究者はエレクトロスピニングファイバーの機械的特性を最適化し、この技術の可能性をより詳細に示すことができます。
概要
組織工学法は、ここ数十年にわたって発展し、in vitro組織モデルとin vivo再生技術の両方で組織再生の成功を促進するために、細胞に生体模倣環境を提供してきました。これらの方法は、典型的には、細胞がそれ自体で、または誘導足場1を使用して、3D凝集体を形成するように促す。足場は、多孔質または繊維状のポリマーナノ/微細構造として、または高吸水性ヒドロゲル2,3,4として製造することができる。ポリマーエレクトロスピニングは、天然の細胞外マトリックス(ECM)5の繊維構造を模倣できる、不織布ナノマイクロスケールのポリマーファイバーマトリックスを生成する一般的な製造技術です。複数の生体適合性ポリマーがエレクトロスピニングプロセスに適用できます。したがって、エレクトロスピニングファイバーは、組織の再生を促進するための一般的な媒体です6,7,8。エレクトロスピニングファイバーは、さまざまな組織の培養に利用されており、安価で再現性の高い足場プラットフォーム9,10,11,12,13の有望な道を示しています。
細胞は、機械的な周囲に対して鋭い感受性を持っています。以前の研究では、メカノトランスダクションと呼ばれるこの重要な関係が強調されており、細胞の機能、形態、および分化に影響を与える可能性があります14,15。真核生物の細胞骨格の基礎は、糸状アクチンから構築されており、細胞分裂、接着、移動、収縮、および形態において重要な機械的役割を果たしています。それは、細胞外表面タンパク質16,17,18との結合を介して外部の機械的刺激によって操作される。幹細胞の分化に対する形態学的影響は、接着可能な基質の形状を変えることにより、多くの研究で実証されており、これにより細胞の形状を制御し、分化プロセスを指示することができる19,20。さらに、細胞が付着する基質の硬さも幹細胞の運命と系統に影響を与える21,22。幹細胞とは別に、これらの影響は、異なる系統の細胞にも影響を与えることが観察されている23,24。三次元組織工学法は、ハイドロゲルと線維性足場の両方を用いた2次元メカノトランスダクション研究で見出されるものと同様の結果を示している25,26,27。さらに、基質力学は、細胞間シグナル伝達28を介して3D細胞凝集体を介して伝達される。材料力学は、細胞の機能を指示する上で重要な役割を果たすため、人工組織の足場の設計における主要な要素となるはずです。
この方法の目的は、エレクトロスピニングポリカプロラクトン(PCL)繊維のサイズと形態がin vitro細胞培養に及ぼす影響を理解することです。この方法は、腎臓組織工学に焦点を当てた以前の研究から適応されています9。ここでは、足場の再構築を容易にし、すべての細胞タイプに適用可能な標準化された方法を開発するために、より詳細なステップバイステップのプロトコルを提供します。この方法では、3つの大きな5μmファイバー(LG)と他の3つの小さな1μmファイバー(SM)の6つのグループの足場が構築され、異なるPCL濃度を使用しました。これらのLGグループとSMグループには、ランダムファイバー(RA)、整列ファイバー(AL)、多孔質極低温ファイバー(CR)の3つの異なる形態学的構造があります。これらの足場群はすべて本質的に異なる構造を持っているため、細胞が付着する独自の局所的な機械的環境を提供します。これが細胞にもたらす形態学的効果を実証するために、代表的な研究として、hepG2細胞株を各グループのスキャフォールドに播種しました。この方法は、幹細胞から細胞株、初代細胞まで、すべての細胞タイプのエレクトロスピニングスキャフォールド設計のベースライン分析として提供されています。
プロトコル
1. 溶液の調製
- 大型(ランダム、整列、極低温)繊維
- ガラス製血清ピペットを使用して、ガラス製耐溶剤ボトルに50 mLのクロロホルムと10 mLのメタノールを混合し、クロロホルムとメタノールの比率を5:1で調製します。
注意:クロロホルムとメタノールは有毒な溶媒であり、混合はドラフト内で行う必要があります。 - 5:1クロロホルム:メタノール中のPCLの19 w/v%溶液を作成するには、PCL1.9 gを秤量し、ガラス製耐溶剤バイアルで5:1クロロホルム:メタノール10 mLに加えます。パラフィンフィルムを使用してバイアルをダブルシールし、バイアルをローラーに一晩置いて、PCLが完全に溶解するまで待ちます。
注意: 混合はドラフト内で行う必要があります。
- ガラス製血清ピペットを使用して、ガラス製耐溶剤ボトルに50 mLのクロロホルムと10 mLのメタノールを混合し、クロロホルムとメタノールの比率を5:1で調製します。
- 小さな(ランダムで整列した)ファイバー
- ヘキサフルオロイソプロパノール(HFIP)中のPCLの7 w/v%溶液を調製するには、0.7 gのPCLを秤量し、ガラス製の耐溶剤性バイアルで10 mLのHFIPと混合します。パラフィンフィルムを使用してバイアルをダブルシールし、PCLが完全に溶解するまでローラーに一晩放置します。
注意:HFIPは非常に毒性が高いため、混合はドラフト内で行う必要があります。
- ヘキサフルオロイソプロパノール(HFIP)中のPCLの7 w/v%溶液を調製するには、0.7 gのPCLを秤量し、ガラス製の耐溶剤性バイアルで10 mLのHFIPと混合します。パラフィンフィルムを使用してバイアルをダブルシールし、PCLが完全に溶解するまでローラーに一晩放置します。
- 小さな極低温繊維
注意: 混合はドラフト内で行う必要があります。- ガラス製血清ピペットを使用して、ガラス製耐溶剤ボトルに30 mLのクロロホルムと10 mLのメタノールを混合し、クロロホルムとメタノールの比率を3:1に調製します。
- 3:1クロロホルム:メタノール中のPCLの14 w/v%溶液を作成するには、PCL1.4 gを秤量し、ガラス製耐溶剤バイアルで3:1クロロホルム:メタノール10 mLに加えます。パラフィンフィルムを使用してバイアルをダブルシールし、PCLが完全に溶解するまでローラーに一晩放置します。
2.エレクトロスピニングのセットアップ
注意: パラメータは、エレクトロスピニングプロセスを開始する前に設定する必要があります。
- 針のサイズと配置
- 大きな繊維(ランダム、整列、極低温)の場合は、外径1 mm/内径0.8 mmの真鍮針を使用し、針をマンドレル表面から230 mm離して配置します。
- 細い繊維の場合は、外径 1 mm / 内径 0.4 mm の真鍮針を使用し、針をマンドレル表面から 15 mm 離して配置します。
- 横方向の針の動き
注: 図1 で詳述されている足場は、50 mm / sで100 mmの針を横切るように、プロセス全体で左右に繰り返し動きながら製造されました。- 横方向の動きを設定するには、 Motion |TNS 1 に設定し、 開始位置 [mm] を -50 に、 距離 [mm] を 100 に、 速度 [mm/s] を 50 に、 ターン遅延 [ms] を 750 に設定します。
- シリンジポンプの流量
- 大きなファイバー(ランダム、整列、極低温)の場合は、ユーザーインターフェースの [材料 ]タブを押して、シリンジポンプを4 mL/hに設定します。
- 小さな(ランダムで整列した)ファイバーの場合は、シリンジポンプを0.8 mL/hに設定します。
- 極低温繊維が小さい場合は、シリンジポンプを2.5 mL/hに設定します。
- 電圧設定
- 太いファイバーの場合は、ユーザーインターフェースの 「電圧 」タブを押して正と負の電圧値を変更することにより、ニードル電圧を +15 kV に、マンドレル電圧を -4 kV に設定します。
- 細い(ランダムで整列した)ファイバーの場合、ニードル電圧を+17 kVに、マンドレル電圧を-4 kVに設定します。
- 小さな極低温ファイバーの場合、ニードル電圧を+18kVに、マンドレル電圧を-4kVに設定します。
- マンドレル回転(大小繊維)
- ランダムファイバーの場合は、 Motion | マンドレルの回転速度を250rpmに目標設定して設定します。
- 整列したファイバーの場合は、マンドレルの回転速度を 1,800 rpm に設定します。
- 極低温繊維の場合、マンドレルの回転速度を180rpmに設定します。
3. ランダムで整列したファイバー(大小ファイバー)のエレクトロスピニング
- 針(針のサイズと配置についてはセクション2.1を参照)を1mmボアPTFEチューブに挿入し、エレクトロスピナーニードルホルダー内に固定します。
- ドラフトの下で、10 mLのポリマー溶液をポリプロピレンまたはガラス(耐溶剤性)シリンジに移します。プライミングする前に、シリンジを放置して気泡を取り除いてください。
- PTFEチューブを介してシリンジを針に接続し、シリンジをシリンジポンプ内に固定します。接続したら、シリンジプランジャーを握り、チューブにポリマー溶液を充填してPTFEチューブをプライミングします。
- マンドレルをアルミホイルで包み、マンドレル回転装置に固定します。
- マンドレルの回転をオンにするには、 Motion |対象者 | シリンジポンプを押すことで回転させる Material |ポンプ1を起動します。
- 針の端にポリマーの小さなビーズが形成されたら、 ACTIVATE HIGHVOLTAGEを押して電圧をオンにします。次に、ポリマーのジェットは、テイラーコーンと呼ばれるポリマー溶液の円錐形の突起から放出されます。マンドレルをチェックして、マンドレル表面に繊維が堆積していることを確認します。
- 必要な量のPCL溶液がエレクトロスピニングされるまで、エレクトロスピニングプロセスを実行します。
注: 図1に示されている足場については、4mLの溶液をエレクトロスピニングしました。 - エレクトロスピニングが終了したら、繊維で覆われたアルミホイルをマンドレルから取り外し、ヒュームキャビネットに一晩置いて、過剰な溶剤の蒸発を可能にします。
- 蒸発後、繊維を室温(RT)で保存します。
4. 極低温繊維のエレクトロスピニング
- 極低温エレクトロスピニングには、クライオスピニングマンドレルを使用します。手順3.1〜3.3を繰り返してから、次の手順に進みます。
- マンドレルをアルミホイルで包みます。
- マンドレルにドライアイスペレットを入れます。クライオスピニングマンドレルカバーをマンドレルに固定して、ドライアイスがマンドレルから逃げないようにしますが、圧力が逃げることができるようにします。氷の結晶は、マンドレルの表面にほぼすぐに形成されるはずです。
注意: ドライアイスを取り扱うときは、冷たい火傷を避けるために保護手袋を使用してください。 - マンドレルをマンドレル回転装置に固定し、Motionを押してすぐにマンドレル回転をオンにします 。対象者 | シリンジポンプを押すことで回転させる Material |ポンプ1を起動します。
- 針の端にポリマーのビーズが形成されたら、 ACTIVATE HIGHVOLTAGEを押して電圧をオンにします。次に、ポリマーのジェットは、ポリマー溶液の円錐形の突起(すなわち、テイラーコーン)から放出されるべきです。マンドレルをチェックして、マンドレル表面に繊維が堆積していることを確認します。
- エレクトロスピニングを1時間行った後、 STOP ALL を押してプロセスを一時停止し、マンドレルにドライアイスを補充します。マンドレルを補充する際に、溶剤蒸気からの適切な保護を確保してください。これを合計3回、合計4時間のエレクトロスピニング時間で実行します。
注意: エレクトロスピニングは、手順4.4と4.5を繰り返すことで再開できます。 - エレクトロスピニングが終了したら、マンドレルを慎重に取り外し、すぐに凍結乾燥機に24時間入れて、マンドレル表面の氷の結晶を昇華させます。
- 昇華後、繊維で覆われたホイルをマンドレルから取り外し、つぶれないように注意しながらRTに保管します。
5.足場パンチング
- 10-12mmの生検パンチを使用して、繊維のシートから足場をパンチします。繊維がアルミホイルに付着したままの場合は、足場を70%エタノールに入れて剥離を容易にします。
6.滅菌とプラズマコーティング
- 足場(ウェルごとに1つの足場)を24ウェルプレートまたは48ウェルプレートに入れ、70%エタノールで3回洗浄します。最終洗浄液に浸し、-80°Cの冷凍庫に入れて凍結します。
- 凍結したら、プレートを凍結乾燥機に入れ、24時間凍結乾燥します。乾燥した足場をプラズマコーティングできるようになりました。
注:プラズマコーターにアクセスできない場合は、足場をリン酸緩衝生理食塩水(PBS)の1%抗生物質-抗真菌薬(Anti-Anti)に浸し、37°Cで一晩インキュベートします。 - プレートをプラズマチャンバーに入れ、蓋を取り外します。プラズマコーターを500mTorrおよび中高周波(RF)電力で30秒間運転します。
- プラズマコーティング後、足場を1 mLのPBSと1%アンチアンチに沈めます。足場はPBS溶液を容易に吸収する必要があります。
注:これで、スキャフォールドにセルを播種する準備が整いました。
7. 細胞の調製と播種
注:以下に示す基本的な細胞培養技術は、代表的な結果でデモンストレーション目的に使用されたhepg2細胞用です。これらの原理は、あらゆる接着細胞タイプに適用できます。ただし、セルが異なれば、必要な材料やプロセスも異なる場合があります。細胞の取り扱いは、無菌技術に従って生物学的安全キャビネットで行う必要があります。
- 凍結保存されたhepg2細胞1 x 106 を取り出し、10%ウシ胎児血清、100 U/mLペニシリン-ストレプトマイシン、5 mM L-グルタミン、および1%非必須アミノ酸を添加したEagle's minimum essential media(EMEM)からなる12 mLの完全培地を含むT75細胞培養フラスコに播種します。
- 細胞が80%のコンフルエンスに達したら、PBSで3回洗浄し、2mLのトリプシンに37°Cで4分間インキュベートして、細胞を培養フラスコから分離します。フラスコを軽くたたいた後、セルが分離するはずです。
- トリプシンを不活性化するために、8mLの完全培地を添加します。細胞懸濁液を15 mLチューブに移し、120 x g の遠心分離機で細胞を5分間スピンダウンします。
- 吸引ピペットで細胞ペレットの上の上清を取り除き、5 mLの完全培地と交換します。5 mLの血清ピペットでピペッティングして細胞を再懸濁します。
- 得られた細胞懸濁液をトリパンブルー排除法でカウントします。100 μLの細胞懸濁液を取り、1.5 mLバイアル中のトリパンブルー100 μLに加えます。混合物をガラスカバースリップの下の血球計算盤に導入し、顕微鏡で細胞をカウントします。
- 完全な培地を追加または削除して、細胞濃度を2.6 x 106 細胞/mLに調整します。培地を除去するには、細胞を220 x g で5分間遠心分離し、必要な培地を除去して、細胞を再懸濁します。
- ウェルプレートから1% Anti-Anti in PBSを吸引し、200 μLのピペットを使用して、2.6 x 106 細胞/mLの細胞懸濁液50 μLを足場表面に播種します。
- 細胞を37°Cおよび5%CO2 で1〜3時間インキュベート下で接着させ、細胞が乾燥しないようにします。付着したら、300 μL(48ウェルプレートの場合)または500 μL(24ウェルプレートの場合)の培地を加え、37°Cおよび5%CO2でインキュベートします。
注:ここからさらなる機能解析まで、標準的な細胞培養技術を使用できます。
結果
図1 は、PCL溶液から作製した小さな繊維(~1 μm)と大きい繊維(~5 μm)の両方の走査型電子顕微鏡(SEM)画像を示しています。繊維は、SEMイメージングの前に、スパッタコーターを使用して金パラジウム(60:40)で30秒間スパッタコーティングされました。クロロホルムとメタノールの5:1溶液中に高濃度の19 w/v%のPCLを使用して大きな繊維を製造し、高粘度のPCL溶液を作製しました。次に、この高粘度溶液を高流量でエレクトロスピニングして、電界内にポリマー溶液の大きな糸を放出しました。したがって、マンドレルに堆積する前に溶媒の効果的な蒸発を確保するために、針とマンドレルの間に230mmの大きな距離が必要でした。逆に、HFIP中の低濃度7 w/v%のPCLを使用して、より小さな繊維を製造し、低粘度のPCL溶液を作成しました。低粘度のPCL溶液を低流量でエレクトロスピニングすると、電界内の針からPCL溶液の細い糸が放出されることが保証されました。糸が細いほど溶剤の蒸発が速くなり、繊維の安定した堆積を確保するためには、針をマンドレルに70mm近づける必要がありました。小さな極低温ファイバーをエレクトロスピニングする場合、信頼性の高いプロトコールを達成するためには、PCL溶液を変更する必要がありました。HFIPのPCLを極低温マンドレル上にエレクトロスピニングすると、繊維構造が崩壊することが繰り返しありました。3:1クロロホルムメタノール中の14 w/v%PCL濃度をエレクトロスピニングすると、この問題が解決されました。ただし、これにより、足場全体の繊維サイズのばらつきが大きくなりました。各足場の繊維の整列(繊維の半径と配向)の程度をImageJ DiameterJプラグイン29 を通じて分析し、 図2 と 図3に示した。

図1:各足場グループの形態学的品質を示すSEM画像。 一番上の行は小さなファイバーを示し、下の行は大きなファイバーを示しています。形態学的グループは、それぞれランダムファイバー、整列ファイバー、および極低温ファイバーとして左から右にリストされています。 この図の拡大版を表示するには、ここをクリックしてください。
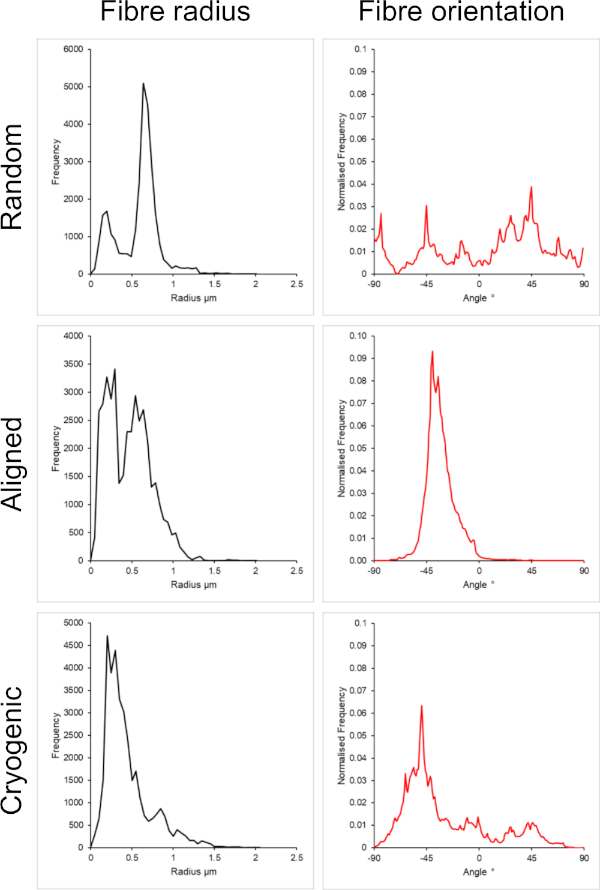
図2:小さなファイバーセットのDiameterJプラグインからのファイバー半径(左)とファイバー配向(右)のデータ。 形態は、上から下にランダムファイバー、整列ファイバー、および極低温ファイバーとしてそれぞれリストされています。 この図の拡大版を表示するには、ここをクリックしてください。
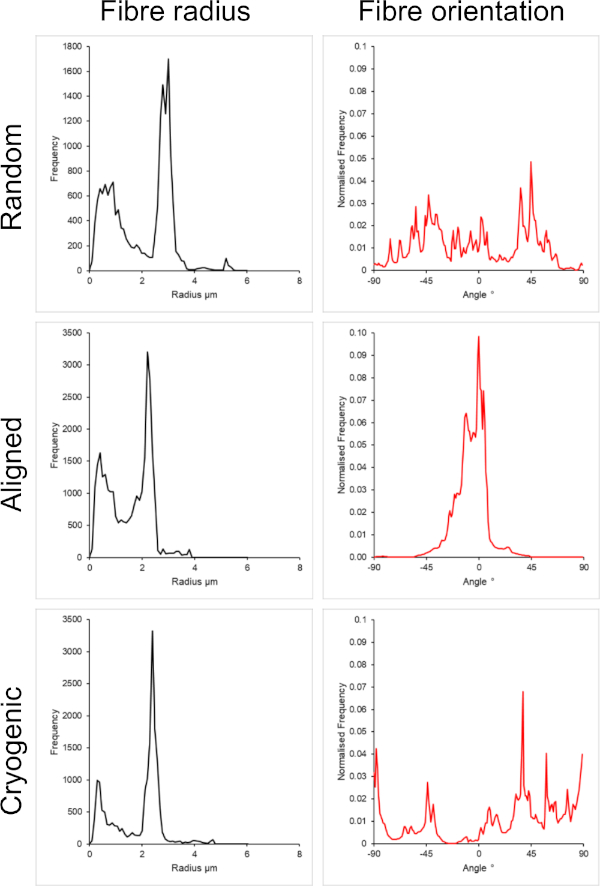
図3:大規模な繊維セットのDiameterJプラグインからの繊維半径(左)と繊維配向(右)のデータ。 形態は、上から下にランダムファイバー、整列ファイバー、および極低温ファイバーとしてそれぞれリストされています。 この図の拡大版を表示するには、ここをクリックしてください。
この方法は、前述の方法9に従って引張試験機を使用して決定された6つの明確に異なる引張特性を持つ足場のセットを提供しました。 表1 に示すように、マクロスケールのヤングス率は、大きな整列繊維の46.94±3.48MPaから、大きな極低温繊維の0.20±0.01MPaの範囲です。生理学的組織硬さの値は、100 Pa(神経組織)から2−4 GPa(骨組織)30の範囲です。ここで報告されたすべてのスキャフォールド剛性値は、この範囲内でした。
| 足場 | ひずみのヤングス率(MPa) | ||||
| 0–2% | 2–4% | 4–6% | 6–8% | 8–10% | |
| SMです。RAの | 11.14 ± 2.13 | 9.31±0.43 | 6.75±0.64 | 4.75 ± 0.59 | 3.32 ± 0.40 |
| SMです。アル | 27.94±8.63 | 28.27 ± 7.36 | 16.34±4.87 | 9.10 ± 3.75 | 5.85 ± 3.11 |
| SMです。CRの | 0.27 ± 0.11 | 0.31 ± 0.44 | 0.31 ± 0.65 | 0.29±0.59 | 0.26 ± 0.40 |
| LGの。RAの | 9.23 ± 0.78 | 8.22 ± 0.87 | 5.96 ± 0.68 | 3.96±0.59 | 2.63 ± 0.45 |
| LGの。アル | 46.94±3.48 | 38.03±2.46 | 27.69 ± 1.22 | 16.10 ± 1.61 | 7.87 ± 1.32 |
| LGの。CRの | 0.20±0.01 | 0.16 ± 0.01 | 0.12 ± 0.01 | 0.10 ± 0.01 | 0.09±0.01 |
表1:2%ひずみの間隔での各足場グループの引張試験データ。 SMです。RA = スモール ランダム、SM。AL = スモールアライメント、SM。CR = 小型極低温、LG。RA = ラージ ランダム、LG。AL = ラージ アライン、LG。CR = 大型極低温。データは平均± SD として表され、n = 5。
図4は、細胞の形態を可視化するために使用したDAPI染色とファロイジン染色を示しています。使用される染色方法は、文献11,12で確立されています。画像は、40倍の倍率の対物レンズを備えた顕微鏡(Table of Materials)を使用して取得されました。この画像は、この方法で生成された整列した繊維がhepG2細胞の形態を伸長させ、増殖する細胞を繊維の長さに沿って向け、細胞培養内に方向性を生み出したことを示しています。対照的に、ランダムファイバー上のhepG2細胞は、整列した構造で観察された指向性増殖と伸長を示さなかった。ランダムな構造では、hepG2細胞は、周囲のPCL線維に付着した拡張突起を持つ、より規則的な形態を示しました。
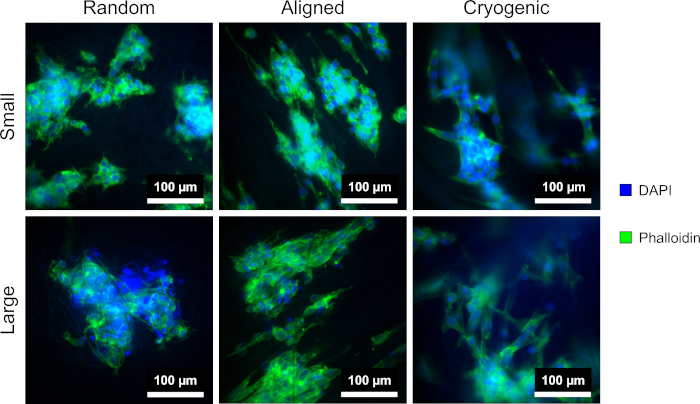
図4:DAPI(青)とファロイジン(緑)は、ランダム(左)、整列(中央)、極低温(右)の異なる足場形態でhepG2細胞を染色しました。 上の行は小さな繊維を示し、下の行は大きな繊維を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
さまざまなファイバーサイズの作成は、さまざまな溶媒、PCL濃度、およびエレクトロスピニングパラメーターの組み合わせを使用して達成されました。ポリマーの種類、その分子量、および溶媒は、得られる溶液の粘度および電荷特性に強く影響し、したがって、エレクトロスピニング特性31に強い影響を与える。この方法に表示される電圧は、エレクトロスピニングが伝導される条件に基づいて変化することがあります。温度と湿度は、エレクトロスピニングプロセス32の挙動に影響を与える。したがって、読者は、障害に対抗し、安定したテイラーコーンを達成するために電圧を変更する準備をすることをお勧めします。エレクトロスピナーを環境制御エンクロージャ内に収納して、エレクトロスピニングプロセスのバッチ間のばらつきを減らすことをお勧めします。
この方法で提示されるさまざまな形態を達成することは、IMEエレクトロスピニングデバイスの機能により可能です。可変速度マンドレルは、ファイバーアライメントを制御するために不可欠です。低rpm(<250rpm)でのマンドレル回転は、ポリマージェットの挙動によりランダムに配向された繊維を生成します。荷電したポリマー溶液が針から放出されると、内部の電荷と空力がカオス的なホイップ効果を誘発し、それがマンドレル33,34上に繊維のカオス的な配置を敷設するために利用される。このホイップ効果は、マンドレルの回転速度を1,800rpm以上に上げることで克服できます。このような高回転マンドレル上に堆積された繊維は、表面速度がホイップファイバーによって示される横方向の動きに効果的に対抗するのに十分であるため、整列した構造を示します。高いマンドレル速度を使用すると、周囲の空気を乱す可能性があり、安定したテイラーコーンの生成に悪影響を与える可能性があることに注意することが重要です。
多孔質の極低温足場は、-78.5°Cでマンドレルをドライアイスで満たすことによって作成されます。 これにより、マンドレルの温度が下がり、表面の水滴の結露と凍結が促進されます。形成された結晶は、マンドレル表面から現れるピークを示し、繊維はピーク全体に堆積します。氷の結晶が昇華されると、マンドレル35,36に繊維の多孔質構造が残ります。結晶の重量と脆弱性は、マンドレル速度が速すぎる(>250 rpm)ため、過度の求心力と空力により結晶と繊維がマンドレルから分離するため、多孔質に整列した繊維を作成する能力を制限します。この方法では、形成された構造の脆弱性のために困難に直面する可能性があります。マンドレルを取り扱うとき、またその後足場を取り扱うときは、液体から取り外すときに構造が圧迫され、折りたたまれる傾向があるため、注意が必要です。また、極低温マンドレルなしでエレクトロスピンに成功した溶液は、温度変化や結晶構造によって致命的に破壊される可能性があります。クライオスピニングでは、マンドレル表面に形成される氷の量は湿度に大きく依存するため、最終結果にばらつきが生じます。したがって、エレクトロスピニングプロセスを環境制御エンクロージャ内に封じ込めることを強くお勧めします。
これらの足場での細胞性能を評価するには、事前に材料を滅菌する必要があります。ポリマーの滅菌には、化学的方法、放射線法、熱ベースの方法など、多くの選択肢があります37,38。各方法の有効性と、材料の使用と材料自体の両方に対する適合性を評価することが重要です。このプロトコルでは、凍結乾燥、プラズマ処理、および1%抗抗溶液に浸す前に、70%エタノールで滅菌します。エタノールの使用は、PCL材料37を破壊することなく、タンパク質および微生物を変性および脱水することを可能にする。より強力な溶媒を使用すると、PCLが溶解する可能性があります。この方法には、主に疎水性で悪名高いPCLの親水性を高め、細胞接着を改善するためにプラズマコーティングが組み込まれました39,40。便利なことに、これは二次滅菌ステップとしても機能しますが、プラズマ処理の前後に足場を無菌環境に保つように注意する必要があります。この方法は、抗生物質処理培地を用いたin vitro研究に適していることが証明されています。ただし、in vivoアプリケーションでは、エチレンオキシド(EtO)やガンマ曝露などのより堅牢なオプションを検討する必要があります。滅菌が行われたら、細胞を足場に播種し、標準的な細胞培養技術を適用してin vitroで3D細胞培養を形成できます。
剛性の値は、足場内で形成されたさまざまな微細構造に起因する必要があることに注意することが重要です。バルク材料(PCL)は、スキャフォールド間で一定に保たれます。したがって、バルク材料の剛性はグループ間で変化しません。極低温スキャフォールドは、 表1に示すように、ファイバーマトリックス内の接続性が低下しているため、他のグループよりもはるかに低い剛性を示します。結合性の低下は、繊維構造41内の伸張優位変形とは対照的に、より曲げ優位な変形を誘発すると考えられる。興味深いことに、足場の剛性は、ランダムグループと極低温グループでは繊維サイズに大きく依存しません。しかし、整列した繊維の縦方向の剛性は、繊維サイズへの依存性が有意に高く、0-2%ひずみでのヤング率では、小繊維で27.94±8.63MPa、大繊維で46.94±3.48MPaとなっています。引張試験の伸張性により、これは縦断面内のかさ取りPCL密度が高いことを意味します。ここで提示された機械的データは、繊維状構造のマクロスケールの機械的スナップショットであることを繰り返す必要があります。さらなるマイクロメカニカル特性評価は、細胞スケールへの機械的影響を完全に理解するために有益です。
この方法には、等方性形態と異方性形態の比較を提供するために、ランダムアーキテクチャと整列アーキテクチャの両方が含まれていました。ファイバーアライメントの程度は、図2のSEM画像と、図2と図3に示すファイバー分析で観察できます。異方性は、体内の多くの組織で観察されます。特に、これは筋肉や神経組織に見られるような整列した細胞構造でよく観察されます。整列した高分子繊維構造は、これらの整列した構造をin vitroで再現する能力を提供します42,43。前述したように、細胞の機能は形態学的および機械的変化に敏感であるため、各足場タイプの生物学的影響を決定するために、足場結合細胞でさらに機能分析を実施する必要があります。
他の既存の足場製造技術と比較して、この方法は、機械的特性と形態を比較的高度に制御したマイクロスケールの足場構造を製造する簡単な方法を提供します。相分離、塩浸出、ガス発泡などの代替PCL足場製作により、ボイドスペースと細孔サイズの観点から形態学的制御が可能になります。しかし、細孔と構造形状はほぼ同じままです44,45,46,47。したがって、等方性のレベルなどの品質は、エレクトロスピニングと比較して簡単に変更することはできません。足場製造に一般的なヒドロゲル材料は、架橋ポリマー鎖48のレベルを変更することにより、ポリマー基質の剛性を変更する手段を提供する。また、様々な方法で3Dプリントを行うことも可能であり、形態49の優れた制御を提供する。しかし、生体適合性ヒドロゲル材料でエレクトロスピニングスケールの分解能を達成することは、実用化するための課題として残っています50,51。エレクトロスピニングスキャフォールドは、過去10年間を通じて組織工学研究で一般的に取り上げられてきましたが、さまざまな細胞タイプでの新しい材料やアプリケーションの導入が常に模索されています。エレクトロスピニング足場を目的とした新しい材料が絶えず開発されていますが、既存のエレクトロスピニング材料と方法のさらなる生物学的特性評価の機会は残されています。記載されている方法は、基本的な細胞培養技術に直接適用できるため、in vitro生物学的研究を容易にする方法として提案されています。
謝辞
この研究は、Engineering and Physical Sciences Research Council Grant Ref: EP/N509644/1、UKRMPII Grant Ref: MR/L022974/1、MRC CCBN Grant Ref: MR/L012766/1 の支援を受けました。著者らは、顕微鏡イメージングの支援と促進を行ったAlison McDonald博士とDavid Kelly博士(COIL)、および実験室施設へのアクセスを提供してくれたAlistair Elfick教授(Institute for Bioengineering)に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 10 mm biopsy punch | Acuderm | P1025 | |
| 15 mL Falcon tube | Thermo-scientific | 339650 | |
| 20 mL glass vial | Fisherbrand | 11513542 | |
| 48 well cell culture plate | Greiner Bio-one | 677180 | |
| Anti-Anti 100X | Gibco | 15240062 | |
| Chloroform | Acros Organics | 13029236 | |
| DAPI | Sigma-aldrich | D9542 | |
| Eagles Minimum Essential Media | Gibco | 11090081 | |
| Electrospinner | IME Technologies | EC-DIG | |
| Fetal Bovine Serum | GE Healthcare | SH30071.03 | |
| Gold-Palladium Sputter coater | Emscope | SC500A | |
| HepG2 cell line | Sigma-aldrich | 85011430 | |
| Hexafluoroisopropanol (HFIP) | Manchester Organics | G26383 | |
| L-Glutamine 200 mM | Gibco | 25030081 | |
| MEM Non-essential Amino Acids | Gibco | 11140050 | |
| Methanol | Acros Organics | 11984591 | |
| Penicillin-Streptomycin 10,000 U/mL | Gibco | 15140122 | |
| Phalloidin | Abcam | ab176754 | |
| Phosphate Buffered Saline (PBS) | Sigma-aldrich | P4417-100TAB | |
| Plasma coater | Harrick Plasma | PDC-002 | |
| Polycaprolactone (Avg. MW 80,000) | Sigma-aldrich | 440744 | |
| PTFE Syringe | Fisherbrand | 12941031 | |
| Scanning Electron Microscope | Hitachi | S4700 | |
| T75 Culture Flask | Corning | CLS430641 | |
| Trypan blue (0.4%) | Gibco | 15250061 |
参考文献
- Akter, F. Principles of Tissue Engineering. Tissue Engineering Made Easy. Akter, F. , Academic Press. London, UK. 3-16 (2016).
- Van Vlierberghe, S., Dubruel, P., Schacht, E. Biopolymer-Based Hydrogels as Scaffolds for Tissue Engineering Applications: A Review. Biomacromolecules. 12 (5), 1387-1408 (2011).
- Murugan, R., Ramakrishna, S. Nano-featured scaffolds for tissue engineering: A review of spinning methodologies. Tissue Engineering. 12 (3), 435-447 (2006).
- Hollister, S. J. Porous scaffold design for tissue engineering. Nature Materials. 4 (7), 518-524 (2005).
- Jun, I., Han, H. S., Edwards, J. R., Jeon, H. Electrospun fibrous scaffolds for tissue engineering: Viewpoints on architecture and fabrication. International Journal of Molecular Sciences. 19 (3), E745(2018).
- Rashidi, H., et al. 3D human liver tissue from pluripotent stem cells displays stable phenotype in vitro and supports compromised liver function in vivo. Archives of Toxicology. 92 (10), 3117-3129 (2018).
- Grant, R., Hay, D. C., Callanan, A. A Drug-Induced Hybrid Electrospun Poly-Capro-Lactone: Cell-Derived Extracellular Matrix Scaffold for Liver Tissue Engineering. Tissue Engineering Part A. 23 (13-14), 650-662 (2017).
- Munir, N., McDonald, A., Callanan, A. A combinatorial approach: Cryo-printing and electrospinning hybrid scaffolds for cartilage tissue engineering. Bioprinting. 16, e00056(2019).
- Burton, T. P., Corcoran, A., Callanan, A. The effect of electrospun polycaprolactone scaffold morphology on human kidney epithelial cells. Biomedical Materials. 13 (1), 015006(2018).
- Reid, J. A., Callanan, A. Influence of aorta extracellular matrix in electrospun polycaprolactone scaffolds. Journal of Applied Polymer Science. 136 (44), 48181(2019).
- Grant, R., Hallett, J., Forbes, S., Hay, D., Callanan, A. Blended electrospinning with human liver extracellular matrix for engineering new hepatic microenvironments. Scientific Reports. 9 (1), 6293(2019).
- Grant, R., Hay, D., Callanan, A. From scaffold to structure: The synthetic production of cell derived extracellular matrix for liver tissue engineering. Biomedical Physics and Engineering Express. 4 (6), 065015(2018).
- Reid, J. A., Callanan, A. Hybrid cardiovascular sourced extracellular matrix scaffolds as possible platforms for vascular tissue engineering. Journal of Biomedical Materials Research Part B: Applied Biomaterials. , 1-15 (2019).
- Chen, C. S. Mechanotransduction - A field pulling together? Journal of Cell Science. 121 (20), 3285-3292 (2008).
- Wang, N. Review of cellular mechanotransduction. Journal of Physics D: Applied Physics. 50 (23), 233002(2017).
- Fan, Y. L., Zhao, H. C., Li, B., Zhao, Z. L., Feng, X. Q. Mechanical Roles of F-Actin in the Differentiation of Stem Cells: A Review. ACS Biomaterials Science and Engineering. 5 (8), 3788-3801 (2019).
- Davidson, A. J., Wood, W. Unravelling the Actin Cytoskeleton: A New Competitive Edge. Trends in Cell Biology. 26 (8), 569-576 (2016).
- Blanchoin, L., Boujemaa-Paterski, R., Sykes, C., Plastino, J. Actin dynamics, architecture, and mechanics in cell motility. Physiological Reviews. 94 (1), 235-263 (2014).
- Guvendiren, M., Burdick, J. A. The control of stem cell morphology and differentiation by hydrogel surface wrinkles. Biomaterials. 31 (25), 6511-6518 (2010).
- Wan, L. Q., et al. Geometric control of human stem cell morphology and differentiation. Integrative Biology. 2 (7-8), 346(2010).
- Park, J. S., et al. The effect of matrix stiffness on the differentiation of mesenchymal stem cells in response to TGF-β. Biomaterials. 32 (16), 3921-3930 (2011).
- Evans, N., et al. Substrate stiffness affects early differentiation events in embryonic stem cells. European Cells and Materials. 18, 1-14 (2009).
- Stukel, J. M., Willits, R. K. Mechanotransduction of Neural Cells Through Cell-Substrate Interactions. Tissue Engineering Part B: Reviews. 22 (3), 173-182 (2016).
- Charbonier, F. W., Zamani, M., Huang, N. F. Endothelial Cell Mechanotransduction in the Dynamic Vascular Environment. Advanced Biosystems. 3 (2), 1800252(2019).
- Nyitray, C. E., Chavez, M. G., Desai, T. A. Compliant 3D Microenvironment Improves β-Cell Cluster Insulin Expression Through Mechanosensing and β-Catenin Signaling. Tissue Engineering Part A. 20 (13-14), 1888-1895 (2014).
- Baker, B. M., et al. Cell-mediated fiber recruitment drives extracellular matrix mechanosensing in engineered fibrillar microenvironments. Nature Materials. 14 (12), 1262-1268 (2015).
- Evans, N. D., Gentleman, E. The role of material structure and mechanical properties in cell-matrix interactions. Journal of Materials Chemistry B. 2 (17), 2345(2014).
- Tusan, C. G., et al. Collective Cell Behavior in Mechanosensing of Substrate Thickness. Biophysical Journal. 114 (11), 2743-2755 (2018).
- Hotaling, N. A., Bharti, K., Kriel, H., Simon, C. G. DiameterJ: A validated open source nanofiber diameter measurement tool. Biomaterials. 61, 327-338 (2015).
- Cox, T. R., Erler, J. T. Remodeling and homeostasis of the extracellular matrix: Implications for fibrotic diseases and cancer. DMM Disease Models and Mechanisms. 4 (2), 165-178 (2011).
- Haider, A., Haider, S., Kang, I. K. A comprehensive review summarizing the effect of electrospinning parameters and potential applications of nanofibers in biomedical and biotechnology. Arabian Journal of Chemistry. 11 (8), 1165-1188 (2018).
- De Vrieze, S., et al. The effect of temperature and humidity on electrospinning. Journal of Materials Science. 44 (5), 1357-1362 (2009).
- Hohman, M. M., Shin, M., Rutledge, G., Brenner, M. P. Electrospinning and electrically forced jets I. Stability theory. Physics of Fluids. 13 (8), 2201-2220 (2001).
- Yarin, A. L., Koombhongse, S., Reneker, D. H. Bending instability in electrospinning of nanofibers. Journal of Applied Physics. 89 (5), 3018-3026 (2001).
- Feltz, K. P., Kalaf, E. A. G., Chen, C., Martin, R. S., Sell, S. A. A review of electrospinning manipulation techniques to direct fiber deposition and maximize pore size. Electrospinning. 1, 46-61 (2017).
- Simonet, M., Schneider, O. D., Neuenschwander, P., Stark, W. J. Ultraporous 3D polymer meshes by low-temperature electrospinning: Use of ice crystals as a removable void template. Polymer Engineering & Science. 47 (12), 2020-2026 (2007).
- Dai, Z., Ronholm, J., Tian, Y., Sethi, B., Cao, X. Sterilization techniques for biodegradable scaffolds in tissue engineering applications. Journal of Tissue Engineering. 7, 204173141664881(2016).
- Rogers, W. J. Sterilisation techniques for polymers. Sterilisation of Biomaterials and Medical Devices. Lerouge, S., Simmons, A. , Elsevier Science. Amsterdam, Netherlands. 151-211 (2012).
- Jokinen, V., Suvanto, P., Franssila, S. Oxygen and nitrogen plasma hydrophilization and hydrophobic recovery of polymers. Biomicrofluidics. 6 (1), 16501(2012).
- Recek, N., et al. Cell Adhesion on Polycaprolactone Modified by Plasma Treatment. International Journal of Polymer Science. 2016, 1-9 (2016).
- Fleck, N. A., Deshpande, V. S., Ashby, M. F. Micro-architectured materials: Past, present and future. Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. 466 (2121), 2495-2516 (2010).
- Cooper, A., Bhattarai, N., Zhang, M. Fabrication and cellular compatibility of aligned chitosan-PCL fibers for nerve tissue regeneration. Carbohydrate Polymers. 85 (1), 149-156 (2011).
- Patel, K. H., et al. Aligned nanofibers of decellularized muscle ECM support myogenic activity in primary satellite cells in vitro. Biomedical Materials. 14 (3), 035010(2019).
- Wang, L., et al. Fabrication of open-porous PCL/PLA tissue engineering scaffolds and the relationship of foaming process, morphology, and mechanical behavior. Polymers for Advanced Technologies. 30 (10), 2539-2548 (2019).
- Sartore, L., Inverardi, N., Pandini, S., Bignotti, F., Chiellini, F. PLA/PCL-based foams as scaffolds for tissue engineering applications. Materials Today: Proceedings. 7, 410-417 (2019).
- Munir, N., Callanan, A. Novel phase separated polycaprolactone/collagen scaffolds for cartilage tissue engineering. Biomedical Materials (Bristol). 13 (5), 051001(2018).
- Wang, W., et al. Fabrication of heterogeneous porous bilayered nanofibrous vascular grafts by two-step phase separation technique. Acta Biomaterialia. 79, 168-181 (2018).
- Kim, C., et al. Stem Cell Mechanosensation on Gelatin Methacryloyl (GelMA) Stiffness Gradient Hydrogels. Annals of Biomedical Engineering. 48 (2), 893-902 (2019).
- Chen, Z., et al. 3D Printing of Multifunctional Hydrogels. Advanced Functional Materials. 29 (20), 1900971(2019).
- Lee, J. M., Ng, W. L., Yeong, W. Y. Resolution and shape in bioprinting: Strategizing towards complex tissue and organ printing. Applied Physics Reviews. 6, 011307(2019).
- Zimmermann, R., et al. High resolution bioprinting of multi-component hydrogels. Biofabrication. 11 (4), 045008(2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved