Method Article
Controlando a morfologia do polímero eletrofiado para engenharia de tecidos demonstrada usando a linha celular hepG2
Neste Artigo
Resumo
Este método fornece os meios para testar diferentes morfologias e topografias de fibras de policaprolactona para fins de engenharia de tecidos. Fibras pequenas e grandes são fabricadas com orientações aleatórias, orientações alinhadas e também estruturas porosas criogenicamente eletrofiadas e usadas como plataformas para cultura de células.
Resumo
A eletrofiação oferece aos pesquisadores a oportunidade de fabricar fibras poliméricas reprodutíveis em micro a nanoescala. A arquitetura fibrosa 3D dos polímeros eletrofiados é considerada uma imitação estrutural da matriz extracelular (MEC). Assim, as fibras eletrofiadas fabricadas a partir de polímeros biocompatíveis têm sido amplamente investigadas por pesquisadores de engenharia de tecidos por seu papel potencial como uma ECM artificial para orientar o crescimento de tecidos in vitro e in vivo. Todas as células são extremamente sensíveis ao seu ambiente mecânico. Isso foi demonstrado pela descoberta de múltiplas vias de mecanotransdução intrinsecamente ligadas aos filamentos de actina do citoesqueleto. O citoesqueleto atua como um sensor mecânico que pode direcionar a funcionalidade e diferenciação da célula hospedeira dependendo da rigidez e morfologia de seu substrato. As fibras eletrofiadas podem ser ajustadas tanto em termos de tamanho quanto de morfologia da fibra para modular facilmente o ambiente mecânico dentro de um andaime de polímero fibroso. Aqui, são descritos métodos para eletrofiação de policaprolactona (PCL) para três morfologias distintas em dois diâmetros de fibra diferentes. As categorias morfológicas de fibras consistem em fibras orientadas aleatoriamente, fibras alinhadas e fibras porosas fiadas criogenicamente, com diâmetros de 1 μm e 5 μm. Os métodos detalhados neste estudo são propostos como uma plataforma para investigar o efeito da arquitetura da fibra eletrofiada na geração de tecidos. A compreensão desses efeitos permitirá que os pesquisadores otimizem as propriedades mecânicas das fibras eletrofiadas e demonstrem o potencial dessa tecnologia de forma mais completa.
Introdução
Métodos de engenharia de tecidos se desenvolveram nas últimas décadas para fornecer às células um ambiente biomimético, a fim de incentivar a regeneração tecidual bem-sucedida, tanto para modelos de tecidos in vitro quanto para técnicas regenerativas in vivo. Esses métodos normalmente incentivam as células a formar agregados 3D, sozinhas ou com o uso de um andaime guia1. Os andaimes podem ser fabricados como nano/microestruturas de polímeros porosos ou fibrosos, ou como hidrogéis altamente absorventes de água 2,3,4. A eletrofiação de polímeros é uma técnica de fabricação comum que produz matrizes de fibras poliméricas em nanomicroescala não tecidas que podem imitar a arquitetura fibrosa da matriz extracelular nativa (ECM)5. Vários polímeros biocompatíveis são aplicáveis ao processo de eletrofiação; portanto, as fibras eletrofiadas são um meio popular para facilitar a regeneração tecidual 6,7,8. As fibras eletrofiadas têm sido utilizadas na cultura de uma variedade de tecidos, demonstrando um caminho promissor para plataformas de andaimes baratas e reprodutíveis 9,10,11,12,13.
As células têm uma sensibilidade aguda em relação ao seu ambiente mecânico. Pesquisas anteriores destacaram essa importante relação, denominada mecanotransdução, que pode influenciar a função, morfologia e diferenciação celular14,15. A base do citoesqueleto celular eucariótico é construída a partir de actina filamentosa e desempenha papéis mecânicos importantes na divisão, adesão, migração, contração e morfologia celular. É manipulado por estímulos mecânicos externos via conexão com proteínas de superfície extracelular 16,17,18. A influência morfológica na diferenciação de células-tronco foi demonstrada em vários estudos por meio da alteração da forma de um substrato acoplável, que é capaz de controlar a forma celular e direcionar o processo de diferenciação19,20. Além disso, a rigidez do substrato sobre o qual as células se ligam também influencia o destino e a linhagem das células-tronco21,22. Além das células-tronco, esses efeitos também foram observados afetando células de diferentes linhagens23,24. Os métodos tridimensionais de engenharia de tecidos mostraram resultados semelhantes aos encontrados em estudos de mecanotransdução 2D com hidrogéis e andaimes fibrilares 25,26,27. Além disso, a mecânica do substrato é comunicada por meio de agregados de células 3D por meio da sinalização célula-célula28. A mecânica dos materiais desempenha um papel crucial no direcionamento da funcionalidade celular e, portanto, deve ser um fator importante no projeto de andaimes para tecidos projetados.
O objetivo deste método é entender os efeitos do tamanho e morfologia da fibra de policaprolactona eletrofiada (PCL) em culturas de células in vitro. O método é adaptado de pesquisas anteriores focadas na engenharia de tecidos renais9. Um protocolo passo a passo mais detalhado é oferecido aqui para facilitar a reconstrução do andaime e desenvolver um método padronizado aplicável a todos os tipos de células. Seis grupos de scaffolds foram construídos com este método: três são fibras grandes de 5 μm (LG) e os outros três fibras pequenas de 1 μm (SM), usando diferentes concentrações de PCL. Dentro desses grupos LG e SM, existem três construções morfológicas diferentes: fibras aleatórias (RA), fibras alinhadas (AL) e fibras criogênicas porosas (CR). Todos esses grupos de andaimes têm estruturas inerentemente diferentes e, portanto, fornecem ambientes mecânicos locais únicos nos quais as células se ligam. Para demonstrar o efeito morfológico que isso proporciona às células, a linhagem celular hepG2 foi semeada em cada grupo de andaimes como um estudo representativo. Este método é oferecido como uma análise de linha de base para o projeto de andaimes eletrofiados para todos os tipos de células, desde células-tronco até linhagens celulares e células primárias.
Protocolo
1. Preparação da solução
- Fibras grandes (aleatórias, alinhadas e criogênicas)
- Preparar uma proporção de 5:1 de clorofórmio e metanol misturando 50 ml de clorofórmio e 10 ml de metanol num frasco de vidro à prova de solventes, utilizando uma pipeta serológica de vidro.
CUIDADO: O clorofórmio e o metanol são solventes tóxicos e a mistura deve ser realizada em uma capela de exaustão. - Para criar uma solução de 19 p/v% de PCL em clorofórmio 5:1:metanol, pesar 1,9 g de PCL e adicionar a 10 mL de clorofórmio 5:1 Feche duas vezes o frasco com filme de parafina e deixe o frasco em um rolo durante a noite para permitir que o PCL se dissolva completamente.
CUIDADO: A mistura deve ser realizada em um exaustor.
- Preparar uma proporção de 5:1 de clorofórmio e metanol misturando 50 ml de clorofórmio e 10 ml de metanol num frasco de vidro à prova de solventes, utilizando uma pipeta serológica de vidro.
- Fibras pequenas (aleatórias e alinhadas)
- Para preparar uma solução de 7 p/v% de PCL em hexafluoroisopropanol (HFIP), pesar 0,7 g de PCL e misturar com 10 mL de HFIP em um frasco de vidro à prova de solvente. Feche duas vezes o frasco com filme de parafina e deixe em um rolo durante a noite para permitir que o PCL se dissolva completamente.
CUIDADO: O HPIF é altamente tóxico e a mistura deve ser realizada em uma capela de exaustão.
- Para preparar uma solução de 7 p/v% de PCL em hexafluoroisopropanol (HFIP), pesar 0,7 g de PCL e misturar com 10 mL de HFIP em um frasco de vidro à prova de solvente. Feche duas vezes o frasco com filme de parafina e deixe em um rolo durante a noite para permitir que o PCL se dissolva completamente.
- Pequenas fibras criogênicas
CUIDADO: A mistura deve ser realizada em um exaustor.- Preparar uma proporção de 3:1 de clorofórmio e metanol misturando 30 ml de clorofórmio e 10 ml de metanol num frasco de vidro à prova de solventes, utilizando uma pipeta serológica de vidro.
- Para criar uma solução de 14 p/v% de PCL em clorofórmio 3:1:metanol, pesar 1,4 g de PCL e adicionar a 10 ml de clorofórmio 3:1 Feche duas vezes o frasco com filme de parafina e deixe em um rolo durante a noite para permitir que o PCL se dissolva completamente.
2. Configuração de eletrofiação
NOTA: Os parâmetros devem ser definidos antes de iniciar o processo de eletrofiação.
- Tamanho e colocação da agulha
- Para fibras grandes (aleatórias, alinhadas e criogênicas), use uma agulha de latão de 1 mm OD/0.8 mm de diâmetro interno e coloque a agulha a 230 mm de distância da superfície do mandril.
- Para fibras pequenas, use uma agulha de latão de 1 mm OD/0.4 mm de diâmetro interno e coloque a agulha a 15 mm de distância da superfície do mandril.
- Movimento lateral da agulha
NOTA: Os andaimes detalhados na Figura 1 foram fabricados com uma travessia de agulha de 100 mm a 50 mm/s, com movimento repetido para a esquerda e para a direita durante todo o processo.- Para definir o movimento lateral, pressione Movimento | TNS 1 e defina a posição inicial [mm] para -50, a distância [mm] para 100, a velocidade [mm/s] para 50 e o atraso de giro [ms] para 750.
- Taxa de fluxo da bomba de seringa
- Para fibras grandes (aleatórias, alinhadas e criogênicas), pressione a guia Material na interface do usuário e defina a bomba da seringa para 4 mL/h.
- Para fibras pequenas (aleatórias e alinhadas), ajuste a bomba da seringa para 0,8 mL/h.
- Para pequenas fibras criogênicas, ajuste a bomba da seringa para 2.5 mL / h.
- Configurações de tensão
- Para as fibras grandes, defina a tensão da agulha em +15 kV e a tensão do mandril em -4 kV pressionando a guia Tensão na interface do usuário e alterando os valores de tensão positiva e negativa.
- Para as fibras pequenas (aleatórias e alinhadas), ajuste a tensão da agulha em +17 kV e a tensão do mandril em -4 kV.
- Para as pequenas fibras criogênicas, defina a tensão da agulha em +18 kV e a tensão do mandril em -4 kV.
- Rotação do mandril (fibras grandes e pequenas)
- Para fibras aleatórias, pressione Movimento | Mire e defina a velocidade de rotação do mandril para 250 rpm.
- Para fibras alinhadas, defina a velocidade de rotação do mandril para 1.800 rpm.
- Para fibras criogênicas, defina a velocidade de rotação do mandril para 180 rpm.
3. Eletrofiação de fibras aleatórias e alinhadas (fibras grandes e pequenas)
- Insira a agulha (consulte a seção 2.1 para obter informações sobre o tamanho e a colocação da agulha) em um tubo de PTFE com diâmetro de 1 mm e prenda dentro do suporte da agulha do eletrogirador.
- Sob uma hotte, transfira os 10 mL de solução de polímero para uma seringa de polipropileno ou vidro (à prova de solventes). Certifique-se de remover quaisquer bolhas deixando a seringa repousar antes de preparar.
- Conecte a seringa à agulha através do tubo de PTFE e prenda a seringa dentro da bomba da seringa. Uma vez conectado, prepare o tubo de PTFE apertando o êmbolo da seringa e enchendo o tubo com solução de polímero.
- Enrole o mandril em papel alumínio e prenda no dispositivo de rotação do mandril.
- Ligue a rotação do mandril pressionando Movimento | Alvo | Gire e a bomba de seringa pressionando Material | Bomba de partida 1.
- Quando um pequeno cordão de polímero se formar na extremidade da agulha, ligue o voltage pressionando ATIVAR HIGH VOLTAGE. Um jato de polímero deve então ser emitido a partir de uma saliência cônica de solução polimérica, chamada cone de Taylor. Verifique o mandril para confirmar a deposição de fibras na superfície do mandril.
- Execute o processo de eletrofiação até que a quantidade desejada de solução de PCL seja eletrofiada.
NOTA: Para os scaffolds apresentados na Figura 1, foram eletrofiados 4 mL de solução. - Uma vez terminada a eletrofiação, remova a folha de alumínio coberta com a fibra do mandril e deixe em uma câmara de exaustão durante a noite para permitir a evaporação excessiva do solvente.
- Após a evaporação, armazene as fibras em temperatura ambiente (TR).
4. Eletrofiação de fibras criogênicas
- Para eletrofiação criogênica, use o mandril de fiação criogênica. Repita as etapas 3.1 a 3.3 e prossiga com as etapas a seguir.
- Enrole o mandril em papel alumínio.
- Encha o mandril com pellets de gelo seco. Prenda a tampa do mandril de fiação criogênica no mandril para garantir que o gelo seco não possa escapar do mandril, mas a pressão possa escapar. Os cristais de gelo devem se formar na superfície do mandril quase imediatamente.
CUIDADO: Use luvas de proteção ao manusear gelo seco para evitar queimaduras de frio. - Prenda o mandril no dispositivo de rotação do mandril e ligue imediatamente a rotação do mandril pressionando Movimento | Alvo | Gire e a bomba de seringa pressionando Material | Bomba de partida 1.
- Assim que um cordão de polímero se formar na extremidade da agulha, ligue a tensão pressionando ATIVAR ALTA TENSÃO. Um jato de polímero deve então ser emitido a partir de uma saliência cônica de solução de polímero (ou seja, o cone de Taylor). Verifique o mandril para confirmar a deposição de fibras na superfície do mandril.
- Após 1 h de eletrofiação, pause o processo pressionando STOP ALL e complete o mandril com gelo seco. Garanta proteção adequada contra vapor de solvente ao reabastecer o mandril. Faça isso por um total de 3x por 4 h no total de tempo de eletrofiação.
NOTA: A eletrofiação pode ser retomada repetindo as etapas 4.4 e 4.5. - Assim que a eletrofiação terminar, remova cuidadosamente o mandril e coloque-o imediatamente em um liofilizador por 24 h para sublimar os cristais de gelo na superfície do mandril.
- Após a sublimação, remova a folha coberta de fibra do mandril e guarde em RT, tomando cuidado para evitar esmagamento.
5. Perfuração de andaimes
- Perfure andaimes da folha de fibras usando um punção de biópsia de 10 a 12 mm. Se as fibras permanecerem aderidas à folha de alumínio, coloque os scaffolds em etanol 70% para facilitar o desprendimento.
6. Esterilização e revestimento de plasma
- Coloque os andaimes (1 andaime por poço) em uma placa de 24 ou 48 poços e lave-os 3x em etanol a 70%. Deixar submerso na lavagem final, colocar num congelador a -80 °C e deixar congelar.
- Depois de congelado, coloque a placa em um liofilizador e liofilize por 24 h. Os andaimes secos agora podem ser revestidos com plasma.
NOTA: Se não houver acesso a um revestidor de plasma, mergulhe os andaimes em antibiótico-antimicótico a 1% (Anti-Anti) em solução salina tamponada com fosfato (PBS) e deixe incubar a 37 ° C durante a noite. - Coloque a placa na câmara de plasma e remova a tampa. Execute o revestidor de plasma a 500 mTorr e potência média de radiofrequência (RF) por 30 s.
- Após o revestimento de plasma, mergulhe os scaffolds em 1 mL de PBS e 1% de Anti-Anti. Os andaimes devem absorver prontamente a solução de PBS.
NOTA: Os andaimes agora estão prontos para serem semeados com células.
7. Preparação e semeadura de células
NOTA: A técnica básica de cultura de células fornecida abaixo é para as células hepg2 usadas para fins de demonstração nos resultados representativos. Esses princípios podem ser aplicados a qualquer tipo de célula aderente; no entanto, células diferentes podem exigir materiais e processos diferentes. O manuseio das células deve ser realizado em uma cabine de segurança biológica, seguindo técnica asséptica.
- Pegue 1 x 106 células hepg2 criopreservadas e semeie em um frasco de cultura de células T75 com 12 mL de meio completo consistindo de meio essencial mínimo de Eagle (EMEM) suplementado com 10% de soro bovino fetal, 100 U/mL de penicilina-estreptomicina, 5 mM de L-glutamina e 1% de aminoácidos não essenciais.
- Quando as células estiverem a 80% de confluência, separe-as do frasco de cultura lavando 3x em PBS e incubando em 2 mL de tripsina a 37 ° C por 4 min. Depois de bater no frasco, as células devem se desprender.
- Desative a tripsina adicionando 8 mL de meio completo. Transfira a suspensão celular para um tubo de 15 mL e gire as células em uma centrífuga a 120 x g por 5 min.
- Remova o sobrenadante acima do pellet celular com uma pipeta de aspiração e substitua por 5 mL de meio completo. Ressuspenda as células pipetando para cima e para baixo com uma pipeta sorológica de 5 mL.
- Conte a suspensão celular resultante através do método de exclusão de azul de tripano. Pegue 100 μL de suspensão celular e adicione a 100 μL de azul de tripano em um frasco de 1,5 mL. Introduza a mistura em um hemocitômetro sob uma lamínula de vidro e conte as células sob um microscópio.
- Ajuste a concentração da célula para 2,6 x 106 células/mL adicionando ou removendo a mídia completa. Para remover o meio, centrifugue as células a 220 x g por 5 min, remova o meio necessário e ressuspenda as células.
- Aspire o Anti-Anti a 1% em PBS da placa do poço e semeie 50 μL de suspensão de células 2,6 x 106 células/mL na superfície do andaime usando uma pipeta de 200 μL.
- Deixe as células se fixarem sob incubação a 37 °C e 5% de CO2 por 1−3 h, certificando-se de que não sequem. Uma vez ligado, adicione 300 μL (para uma placa de 48 poços) ou 500 μL (para uma placa de 24 poços) de meio de cultura e incube a 37 °C e 5% de CO2.
NOTA: As técnicas padrão de cultura celular podem ser usadas daqui até uma análise funcional adicional.
Resultados
A Figura 1 mostra imagens de microscópio eletrônico de varredura (SEM) de fibras pequenas (~ 1 μm) e grandes (~ 5 μm) fabricadas a partir de soluções de PCL. As fibras foram revestidas com ouro-paládio (60:40) por 30 s usando um revestidor por pulverização catódica antes da imagem de MEV. Grandes fibras foram produzidas usando uma alta concentração de 19 p/v% de PCL em uma solução 5:1 de clorofórmio e metanol para criar uma solução de PCL de alta viscosidade. Esta solução de alta viscosidade foi então eletrofiada a uma alta taxa de fluxo para emitir um grande fio de solução de polímero dentro do campo elétrico. Portanto, uma grande distância de 230 mm entre a agulha e o mandril foi necessária para garantir a evaporação efetiva do solvente antes da deposição no mandril. Por outro lado, fibras menores foram produzidas usando uma baixa concentração de 7 p/v% de PCL em HFIP para criar uma solução de PCL de baixa viscosidade. A eletrofiação da solução de PCL de baixa viscosidade a uma baixa taxa de fluxo garantiu que um fio mais fino de solução de PCL fosse emitido da agulha dentro do campo elétrico. A linha mais fina facilitou uma evaporação mais rápida do solvente e a agulha precisava estar mais próxima do mandril a 70 mm para garantir uma deposição estável das fibras. Para eletrofiação de pequenas fibras criogênicas, foi necessário alterar a solução de PCL para obter um protocolo confiável. O PCL em HFIP eletrofiado no mandril criogênico repetidamente resultou em uma estrutura de fibra desintegrada. A eletrofiação de uma concentração de 14 w/v% de PCL em metanol de clorofórmio 3:1 resolveu esse problema; no entanto, isso criou uma variação maior no tamanho da fibra em todo o andaime. A extensão do alinhamento da fibra (raio e orientação da fibra) para cada andaime foi analisada através do plugin ImageJ DiameterJ29 e mostrada na Figura 2 e na Figura 3.

Figura 1: Imagens de MEV mostrando as qualidades morfológicas de cada grupo de andaimes. A linha superior mostra as fibras pequenas e a linha inferior as fibras grandes. Os grupos morfológicos são listados da esquerda para a direita como fibras aleatórias, fibras alinhadas e fibras criogênicas, respectivamente. Clique aqui para ver uma versão maior desta figura.
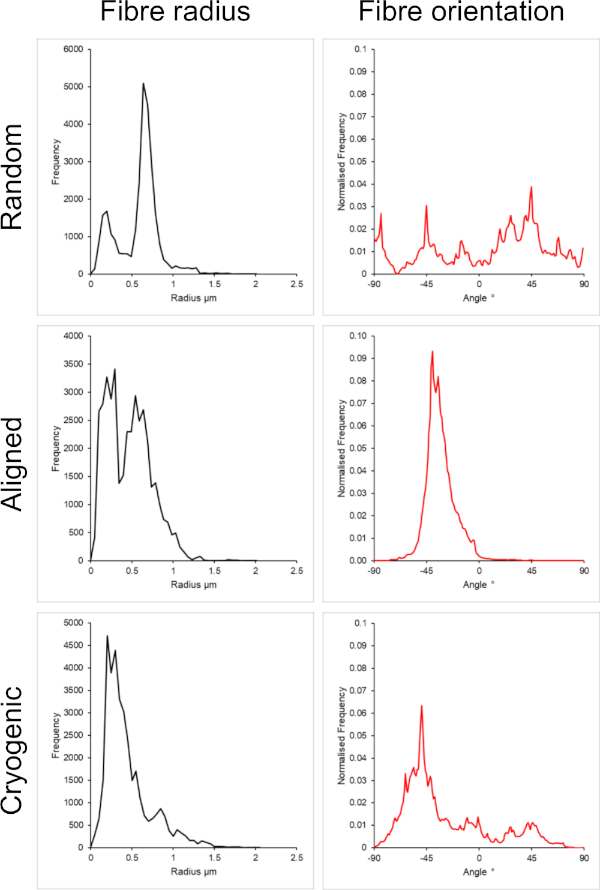
Figura 2: Dados de raio da fibra (esquerda) e orientação da fibra (direita) do plug-in DiameterJ para o pequeno conjunto de fibras. Morfologia listada de cima para baixo como fibras aleatórias, fibras alinhadas e fibras criogênicas, respectivamente. Clique aqui para ver uma versão maior desta figura.
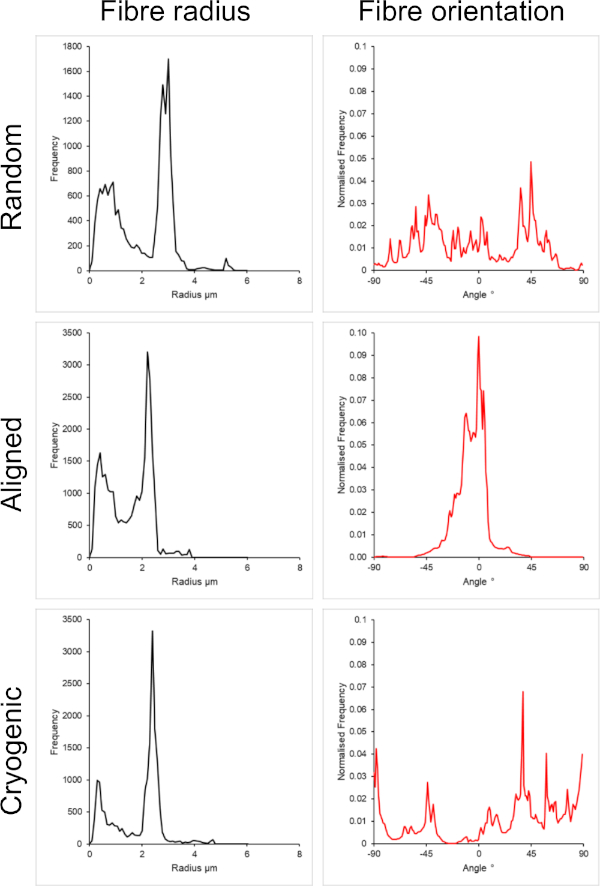
Figura 3: Dados de raio da fibra (esquerda) e orientação da fibra (direita) do plug-in DiameterJ para o grande conjunto de fibras. Morfologia listada de cima para baixo como fibras aleatórias, fibras alinhadas e fibras criogênicas, respectivamente. Clique aqui para ver uma versão maior desta figura.
Este método nos ofereceu um conjunto de andaimes com seis propriedades de tração distintamente diferentes, conforme determinado usando uma máquina de teste de tração de acordo com os métodos descritos anteriormente9. Conforme mostrado na Tabela 1 , os Módulos de Youngs em macroescala variam de 46,94 ± 3,48 MPa nas fibras grandes alinhadas a 0,20 ± 0,01 MPa nas grandes fibras criogênicas. Os valores de rigidez fisiológica do tecido variam de 100 Pa (tecido neural) a 2−4 GPa (tecido ósseo)30; Todos os valores de rigidez do andaime relatados aqui estavam dentro dessa faixa.
| Andaime | Módulo de Youngs (MPa) para deformação% | ||||
| 0–2% | 2–4% | 4–6% | 6–8% | 8–10% | |
| SM. RA | 11.14 ± 2.13 | 9,31 ± 0,43 | 6,75 ± 0,64 | 4,75 ± 0,59 | 3,32 ± 0,40 |
| SM. AL | 27,94 ± 8,63 | 28,27 ± 7,36 | 16.34 ± 4.87 | 9,10 ± 3,75 | 5,85 ± 3,11 |
| SM. CR | 0,27 ± 0,11 | 0,31 ± 0,44 | 0,31 ± 0,65 | 0,29 ± 0,59 | 0,26 ± 0,40 |
| LG. RA | 9,23 ± 0,78 | 8,22 ± 0,87 | 5,96 ± 0,68 | 3,96 ± 0,59 | 2,63 ± 0,45 |
| LG. AL | 46.94 ± 3.48 | 38,03 ± 2,46 | 27,69 ± 1,22 | 16,10 ± 1,61 | 7,87 ± 1,32 |
| LG. CR | 0,20 ± 0,01 | 0,16 ± 0,01 | 0,12 ± 0,01 | 0,10 ± 0,01 | 0,09 ± 0,01 |
Tabela 1: Dados de teste de tração para cada grupo de andaime em intervalos de 2% de deformação. SM. RA = Pequeno aleatório, SM. AL = Pequeno alinhado, SM. CR = Pequeno criogênico, LG. RA = Grande aleatório, LG. AL = Grande alinhado e LG. CR = Grande criogênico. Dados apresentados como média ± DP, n = 5.
A Figura 4 mostra a coloração DAPI e faloidina usada para visualizar a morfologia celular. O método de coloração utilizado está estabelecido na literatura11,12. As imagens foram obtidas usando um microscópio (Table of Materials) com uma objetiva de aumento de 40x. As imagens mostram que as fibras alinhadas produzidas por este método alongaram a morfologia das células hepG2 e direcionaram as células em proliferação ao longo do comprimento das fibras, criando direcionalidade dentro da cultura celular. Em contraste, as células hepG2 em fibras aleatórias não exibiram a proliferação direcional e o alongamento observados nas estruturas alinhadas. Nas estruturas aleatórias, as células hepG2 exibiram uma morfologia mais regular com protrusões estendidas ligando-se às fibras PCL circundantes.
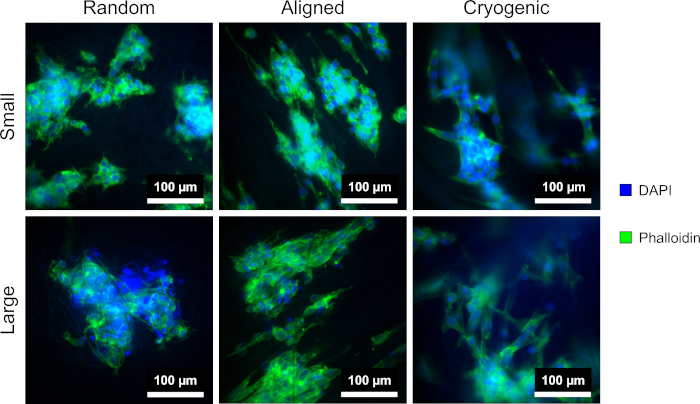
Figura 4: Células hepG2 coradas com DAPI (azul) e faloidina (verde) nas diferentes morfologias de andaime: aleatória (esquerda), alinhada (meio) e criogênica (direita). A linha superior mostra fibras pequenas e a linha inferior mostra fibras grandes. Clique aqui para ver uma versão maior desta figura.
Discussão
A criação de diferentes tamanhos de fibra foi obtida usando uma combinação de diferentes solventes, concentrações de PCL e parâmetros de eletrofiação. O tipo de polímero, seu peso molecular e o solvente afetam fortemente as propriedades de viscosidade e carga da solução resultante e, portanto, têm uma forte influência nas propriedades de eletrofiação31. As tensões exibidas neste método estão sujeitas a alterações com base nas condições em que a eletrofiação é conduzida. A temperatura e a umidade afetam o comportamento do processo de eletrofiação32. Portanto, o leitor é aconselhado a estar preparado para alterar a tensão para combater quaisquer obstáculos e obter um cone de Taylor estável. Recomenda-se alojar o eletrospinner dentro de um invólucro de controle ambiental para reduzir a variabilidade de lote para lote no processo de eletrofiação.
Alcançar as diferentes morfologias apresentadas neste método é possível devido às capacidades do dispositivo de eletrofiação IME. Um mandril de velocidade variável é essencial para controlar o alinhamento da fibra. A rotação do mandril em baixa rotação (<250 rpm) produz fibras orientadas aleatoriamente devido ao comportamento do jato de polímero. Quando a solução de polímero carregada é emitida da agulha, as cargas internas e as forças aerodinâmicas induzem um efeito caótico de chicote que é utilizado para estabelecer um arranjo caótico de fibras no mandril33,34. Este efeito de chicote pode ser superado aumentando a velocidade de rotação do mandril acima de 1.800 rpm. As fibras depositadas em um mandril de alta rotação exibem uma estrutura alinhada porque a velocidade da superfície é suficiente para combater efetivamente qualquer movimento transversal exibido pela fibra de chicoteamento. É importante observar que, quando altas velocidades do mandril são usadas, é provável que ele interrompa o ar circundante, o que pode ter um efeito adverso na produção de um cone de Taylor estável.
Andaimes criogênicos altamente porosos são produzidos enchendo o mandril com gelo seco a -78,5 °C. Isso reduz a temperatura do mandril e promove a condensação e o congelamento de gotículas de água na superfície. Os cristais formados exibem picos que emergem da superfície do mandril e as fibras são depositadas ao longo dos picos. Uma vez que os cristais de gelo são sublimados, uma estrutura porosa de fibras permanece no mandril 35,36. O peso e a fragilidade dos cristais limitam a capacidade de criar fibras porosas alinhadas, pois velocidades de mandril muito altas (>250 rpm) resultam no desprendimento dos cristais e fibras do mandril devido a forças centrípetas e aerodinâmicas excessivas. É possível enfrentar dificuldades com esse método devido à fragilidade das estruturas formadas. Deve-se ter cuidado ao manusear o mandril e também ao manusear os andaimes posteriormente, pois as estruturas tendem a ser achatadas quando espremidas e dobradas ao serem removidas de líquidos. Existe também a possibilidade de que as soluções que eletrogiram com sucesso sem o mandril criogênico possam ser fatalmente interrompidas pela mudança de temperatura e pelas estruturas cristalinas. Ao crio-fiação, a quantidade de gelo formada na superfície do mandril é altamente dependente da umidade, produzindo variabilidade no resultado final. Portanto, é altamente recomendável conter o processo de eletrofiação dentro de um gabinete de controle ambiental.
Para avaliar o desempenho celular nesses scaffolds, é necessário esterilizar o material previamente. Existem muitas opções disponíveis para esterilizar polímeros, incluindo métodos químicos, métodos de radiação e métodos baseados em calor37,38. É importante avaliar a eficácia de cada método e a adequação tanto para o uso do material quanto para o próprio material. Este protocolo usa esterilização em etanol a 70% antes da liofilização, tratamento com plasma e submersão em solução anti-anti a 1%. O uso de etanol permite que proteínas e microrganismos sejam desnaturados e desidratados, sem perturbar o material PCL37. O uso de solventes mais fortes pode resultar na dissolução do LCP. O revestimento de plasma foi incorporado neste método principalmente para aumentar a hidrofilicidade do PCL, que é notoriamente hidrofóbico, e melhorar a fixação celular39,40. Convenientemente, isso também funciona como uma etapa secundária de esterilização, mas deve-se tomar cuidado para manter os andaimes em um ambiente estéril antes e depois do tratamento com plasma. Este método provou ser adequado para estudos in vitro com meios tratados com antibióticos. No entanto, para aplicações in vivo, opções mais robustas, como óxido de etileno (EtO) e exposição gama, devem ser consideradas. Uma vez realizada a esterilização, as células podem ser semeadas no andaime e as técnicas padrão de cultura de células podem ser aplicadas para formar culturas de células 3D in vitro.
É importante notar que os valores de rigidez devem ser atribuídos às diferentes microestruturas formadas dentro dos andaimes. O material a granel (PCL) permanece constante entre os andaimes. Portanto, a rigidez do material a granel não muda entre os grupos. Os andaimes criogênicos apresentam uma rigidez muito menor do que os outros grupos devido à conectividade reduzida dentro da matriz de fibras, o que pode ser visto na Tabela 1. Acredita-se que a conectividade reduzida induza uma deformação mais dominante em oposição à deformação dominante de alongamento dentro da estrutura fibrosa41. Curiosamente, a rigidez do andaime não é altamente dependente do tamanho da fibra nos grupos aleatório e criogênico. No entanto, a rigidez longitudinal das fibras alinhadas mostra uma dependência significativamente maior do tamanho da fibra, com o Módulo de Youngs a 0-2% de deformação sendo 27,94 ± 8,63 MPa para fibras pequenas e 46,94 ± 3,48 MPa para fibras grandes. Devido à natureza de alongamento do teste de tração, isso implica uma maior densidade de PCL em massa dentro da seção transversal longitudinal. É necessário reiterar que os dados mecânicos apresentados aqui são um instantâneo mecânico em macroescala das arquiteturas fibrosas. Uma caracterização micromecânica adicional seria benéfica para entender completamente as influências mecânicas na escala celular.
Arquiteturas aleatórias e alinhadas foram incluídas neste método para fornecer uma comparação entre morfologias isotrópicas e anisotrópicas. A extensão do alinhamento das fibras pode ser observada nas imagens de MEV na Figura 2 e nas análises de fibras apresentadas na Figura 2 e na Figura 3. Propriedades anisotrópicas são observadas em muitos dos tecidos do corpo. Em particular, isso é comumente observado em estruturas celulares alinhadas, como as encontradas nos tecidos musculares e nervosos. Estruturas de fibras poliméricas alinhadas oferecem a capacidade de recapitular essas estruturas alinhadas in vitro42,43. Conforme descrito anteriormente, a função celular é sensível a mudanças morfológicas e mecânicas, portanto, análises funcionais adicionais devem ser conduzidas em células ligadas a andaimes para determinar a influência biológica de cada tipo de andaime.
Em comparação com outras técnicas de fabricação de andaimes existentes, este método fornece uma maneira simples de produzir estruturas de andaimes em microescala com controle comparativamente alto sobre as propriedades mecânicas e morfologia. A fabricação alternativa de andaimes PCL, como separação de fases, lixiviação de sal e formação de espuma de gás, permite o controle morfológico em termos de espaço vazio e tamanho dos poros. No entanto, o poro e a geometria estrutural permanecem praticamente os mesmos 44,45,46,47. Portanto, qualidades como o nível de isotropia não podem ser alteradas tão facilmente em comparação com a eletrofiação. Os materiais de hidrogel, populares para a produção de andaimes, fornecem os meios para alterar a rigidez do substrato polimérico por meio da alteração do nível de cadeias poliméricas reticuladas48. Também é possível imprimir em 3D por meio de uma variedade de métodos, proporcionando excelente controle sobre a morfologia49. No entanto, alcançar a resolução da escala de eletrofiação em materiais de hidrogel biocompatíveis continua sendo um desafio a ser implementado na prática50,51. Os andaimes eletrofiados têm se destacado comumente na pesquisa de engenharia de tecidos ao longo da última década, e a introdução de novos materiais e aplicações com diferentes tipos de células está sempre sendo explorada. Embora novos materiais estejam constantemente em desenvolvimento para fins de andaimes de eletrofiação, permanecem oportunidades para uma maior caracterização biológica dos materiais e métodos de eletrofiação existentes. O método descrito é proposto como um método para facilitar o estudo biológico in vitro, pois é diretamente aplicável às técnicas básicas de cultura de células.
Agradecimentos
Este trabalho foi apoiado pelo Conselho de Pesquisa em Engenharia e Ciências Físicas Grant Ref: EP / N509644 / 1, o UKRMPII Grant Ref: MR / L022974 / 1 e o MRC CCBN Grant Ref: MR / L012766 / 1. Os autores gostariam de agradecer à Dra. Alison McDonald e ao Dr. David Kelly (COIL) por auxiliar e facilitar a imagem da microscopia e ao Prof. Alistair Elfick pelo acesso às instalações do laboratório (Instituto de Bioengenharia).
Materiais
| Name | Company | Catalog Number | Comments |
| 10 mm biopsy punch | Acuderm | P1025 | |
| 15 mL Falcon tube | Thermo-scientific | 339650 | |
| 20 mL glass vial | Fisherbrand | 11513542 | |
| 48 well cell culture plate | Greiner Bio-one | 677180 | |
| Anti-Anti 100X | Gibco | 15240062 | |
| Chloroform | Acros Organics | 13029236 | |
| DAPI | Sigma-aldrich | D9542 | |
| Eagles Minimum Essential Media | Gibco | 11090081 | |
| Electrospinner | IME Technologies | EC-DIG | |
| Fetal Bovine Serum | GE Healthcare | SH30071.03 | |
| Gold-Palladium Sputter coater | Emscope | SC500A | |
| HepG2 cell line | Sigma-aldrich | 85011430 | |
| Hexafluoroisopropanol (HFIP) | Manchester Organics | G26383 | |
| L-Glutamine 200 mM | Gibco | 25030081 | |
| MEM Non-essential Amino Acids | Gibco | 11140050 | |
| Methanol | Acros Organics | 11984591 | |
| Penicillin-Streptomycin 10,000 U/mL | Gibco | 15140122 | |
| Phalloidin | Abcam | ab176754 | |
| Phosphate Buffered Saline (PBS) | Sigma-aldrich | P4417-100TAB | |
| Plasma coater | Harrick Plasma | PDC-002 | |
| Polycaprolactone (Avg. MW 80,000) | Sigma-aldrich | 440744 | |
| PTFE Syringe | Fisherbrand | 12941031 | |
| Scanning Electron Microscope | Hitachi | S4700 | |
| T75 Culture Flask | Corning | CLS430641 | |
| Trypan blue (0.4%) | Gibco | 15250061 |
Referências
- Akter, F. Principles of Tissue Engineering. Tissue Engineering Made Easy. Akter, F. , Academic Press. London, UK. 3-16 (2016).
- Van Vlierberghe, S., Dubruel, P., Schacht, E. Biopolymer-Based Hydrogels as Scaffolds for Tissue Engineering Applications: A Review. Biomacromolecules. 12 (5), 1387-1408 (2011).
- Murugan, R., Ramakrishna, S. Nano-featured scaffolds for tissue engineering: A review of spinning methodologies. Tissue Engineering. 12 (3), 435-447 (2006).
- Hollister, S. J. Porous scaffold design for tissue engineering. Nature Materials. 4 (7), 518-524 (2005).
- Jun, I., Han, H. S., Edwards, J. R., Jeon, H. Electrospun fibrous scaffolds for tissue engineering: Viewpoints on architecture and fabrication. International Journal of Molecular Sciences. 19 (3), E745(2018).
- Rashidi, H., et al. 3D human liver tissue from pluripotent stem cells displays stable phenotype in vitro and supports compromised liver function in vivo. Archives of Toxicology. 92 (10), 3117-3129 (2018).
- Grant, R., Hay, D. C., Callanan, A. A Drug-Induced Hybrid Electrospun Poly-Capro-Lactone: Cell-Derived Extracellular Matrix Scaffold for Liver Tissue Engineering. Tissue Engineering Part A. 23 (13-14), 650-662 (2017).
- Munir, N., McDonald, A., Callanan, A. A combinatorial approach: Cryo-printing and electrospinning hybrid scaffolds for cartilage tissue engineering. Bioprinting. 16, e00056(2019).
- Burton, T. P., Corcoran, A., Callanan, A. The effect of electrospun polycaprolactone scaffold morphology on human kidney epithelial cells. Biomedical Materials. 13 (1), 015006(2018).
- Reid, J. A., Callanan, A. Influence of aorta extracellular matrix in electrospun polycaprolactone scaffolds. Journal of Applied Polymer Science. 136 (44), 48181(2019).
- Grant, R., Hallett, J., Forbes, S., Hay, D., Callanan, A. Blended electrospinning with human liver extracellular matrix for engineering new hepatic microenvironments. Scientific Reports. 9 (1), 6293(2019).
- Grant, R., Hay, D., Callanan, A. From scaffold to structure: The synthetic production of cell derived extracellular matrix for liver tissue engineering. Biomedical Physics and Engineering Express. 4 (6), 065015(2018).
- Reid, J. A., Callanan, A. Hybrid cardiovascular sourced extracellular matrix scaffolds as possible platforms for vascular tissue engineering. Journal of Biomedical Materials Research Part B: Applied Biomaterials. , 1-15 (2019).
- Chen, C. S. Mechanotransduction - A field pulling together? Journal of Cell Science. 121 (20), 3285-3292 (2008).
- Wang, N. Review of cellular mechanotransduction. Journal of Physics D: Applied Physics. 50 (23), 233002(2017).
- Fan, Y. L., Zhao, H. C., Li, B., Zhao, Z. L., Feng, X. Q. Mechanical Roles of F-Actin in the Differentiation of Stem Cells: A Review. ACS Biomaterials Science and Engineering. 5 (8), 3788-3801 (2019).
- Davidson, A. J., Wood, W. Unravelling the Actin Cytoskeleton: A New Competitive Edge. Trends in Cell Biology. 26 (8), 569-576 (2016).
- Blanchoin, L., Boujemaa-Paterski, R., Sykes, C., Plastino, J. Actin dynamics, architecture, and mechanics in cell motility. Physiological Reviews. 94 (1), 235-263 (2014).
- Guvendiren, M., Burdick, J. A. The control of stem cell morphology and differentiation by hydrogel surface wrinkles. Biomaterials. 31 (25), 6511-6518 (2010).
- Wan, L. Q., et al. Geometric control of human stem cell morphology and differentiation. Integrative Biology. 2 (7-8), 346(2010).
- Park, J. S., et al. The effect of matrix stiffness on the differentiation of mesenchymal stem cells in response to TGF-β. Biomaterials. 32 (16), 3921-3930 (2011).
- Evans, N., et al. Substrate stiffness affects early differentiation events in embryonic stem cells. European Cells and Materials. 18, 1-14 (2009).
- Stukel, J. M., Willits, R. K. Mechanotransduction of Neural Cells Through Cell-Substrate Interactions. Tissue Engineering Part B: Reviews. 22 (3), 173-182 (2016).
- Charbonier, F. W., Zamani, M., Huang, N. F. Endothelial Cell Mechanotransduction in the Dynamic Vascular Environment. Advanced Biosystems. 3 (2), 1800252(2019).
- Nyitray, C. E., Chavez, M. G., Desai, T. A. Compliant 3D Microenvironment Improves β-Cell Cluster Insulin Expression Through Mechanosensing and β-Catenin Signaling. Tissue Engineering Part A. 20 (13-14), 1888-1895 (2014).
- Baker, B. M., et al. Cell-mediated fiber recruitment drives extracellular matrix mechanosensing in engineered fibrillar microenvironments. Nature Materials. 14 (12), 1262-1268 (2015).
- Evans, N. D., Gentleman, E. The role of material structure and mechanical properties in cell-matrix interactions. Journal of Materials Chemistry B. 2 (17), 2345(2014).
- Tusan, C. G., et al. Collective Cell Behavior in Mechanosensing of Substrate Thickness. Biophysical Journal. 114 (11), 2743-2755 (2018).
- Hotaling, N. A., Bharti, K., Kriel, H., Simon, C. G. DiameterJ: A validated open source nanofiber diameter measurement tool. Biomaterials. 61, 327-338 (2015).
- Cox, T. R., Erler, J. T. Remodeling and homeostasis of the extracellular matrix: Implications for fibrotic diseases and cancer. DMM Disease Models and Mechanisms. 4 (2), 165-178 (2011).
- Haider, A., Haider, S., Kang, I. K. A comprehensive review summarizing the effect of electrospinning parameters and potential applications of nanofibers in biomedical and biotechnology. Arabian Journal of Chemistry. 11 (8), 1165-1188 (2018).
- De Vrieze, S., et al. The effect of temperature and humidity on electrospinning. Journal of Materials Science. 44 (5), 1357-1362 (2009).
- Hohman, M. M., Shin, M., Rutledge, G., Brenner, M. P. Electrospinning and electrically forced jets I. Stability theory. Physics of Fluids. 13 (8), 2201-2220 (2001).
- Yarin, A. L., Koombhongse, S., Reneker, D. H. Bending instability in electrospinning of nanofibers. Journal of Applied Physics. 89 (5), 3018-3026 (2001).
- Feltz, K. P., Kalaf, E. A. G., Chen, C., Martin, R. S., Sell, S. A. A review of electrospinning manipulation techniques to direct fiber deposition and maximize pore size. Electrospinning. 1, 46-61 (2017).
- Simonet, M., Schneider, O. D., Neuenschwander, P., Stark, W. J. Ultraporous 3D polymer meshes by low-temperature electrospinning: Use of ice crystals as a removable void template. Polymer Engineering & Science. 47 (12), 2020-2026 (2007).
- Dai, Z., Ronholm, J., Tian, Y., Sethi, B., Cao, X. Sterilization techniques for biodegradable scaffolds in tissue engineering applications. Journal of Tissue Engineering. 7, 204173141664881(2016).
- Rogers, W. J. Sterilisation techniques for polymers. Sterilisation of Biomaterials and Medical Devices. Lerouge, S., Simmons, A. , Elsevier Science. Amsterdam, Netherlands. 151-211 (2012).
- Jokinen, V., Suvanto, P., Franssila, S. Oxygen and nitrogen plasma hydrophilization and hydrophobic recovery of polymers. Biomicrofluidics. 6 (1), 16501(2012).
- Recek, N., et al. Cell Adhesion on Polycaprolactone Modified by Plasma Treatment. International Journal of Polymer Science. 2016, 1-9 (2016).
- Fleck, N. A., Deshpande, V. S., Ashby, M. F. Micro-architectured materials: Past, present and future. Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. 466 (2121), 2495-2516 (2010).
- Cooper, A., Bhattarai, N., Zhang, M. Fabrication and cellular compatibility of aligned chitosan-PCL fibers for nerve tissue regeneration. Carbohydrate Polymers. 85 (1), 149-156 (2011).
- Patel, K. H., et al. Aligned nanofibers of decellularized muscle ECM support myogenic activity in primary satellite cells in vitro. Biomedical Materials. 14 (3), 035010(2019).
- Wang, L., et al. Fabrication of open-porous PCL/PLA tissue engineering scaffolds and the relationship of foaming process, morphology, and mechanical behavior. Polymers for Advanced Technologies. 30 (10), 2539-2548 (2019).
- Sartore, L., Inverardi, N., Pandini, S., Bignotti, F., Chiellini, F. PLA/PCL-based foams as scaffolds for tissue engineering applications. Materials Today: Proceedings. 7, 410-417 (2019).
- Munir, N., Callanan, A. Novel phase separated polycaprolactone/collagen scaffolds for cartilage tissue engineering. Biomedical Materials (Bristol). 13 (5), 051001(2018).
- Wang, W., et al. Fabrication of heterogeneous porous bilayered nanofibrous vascular grafts by two-step phase separation technique. Acta Biomaterialia. 79, 168-181 (2018).
- Kim, C., et al. Stem Cell Mechanosensation on Gelatin Methacryloyl (GelMA) Stiffness Gradient Hydrogels. Annals of Biomedical Engineering. 48 (2), 893-902 (2019).
- Chen, Z., et al. 3D Printing of Multifunctional Hydrogels. Advanced Functional Materials. 29 (20), 1900971(2019).
- Lee, J. M., Ng, W. L., Yeong, W. Y. Resolution and shape in bioprinting: Strategizing towards complex tissue and organ printing. Applied Physics Reviews. 6, 011307(2019).
- Zimmermann, R., et al. High resolution bioprinting of multi-component hydrogels. Biofabrication. 11 (4), 045008(2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados