Method Article
تكوين النخاع خارج الجسم الحي وإعادة تكوين الميالين في مزارع شرائح المخيخ كنموذج كمي للتلاعب التنموي والأمراض
In This Article
Summary
يتم تقديم بروتوكول لنموذج كمي خارج الجسم الحي لإزالة الميالين وإعادة تكوين الميالين باستخدام مزارع شرائح المخيخ في الفأر. تلخص هذه الطريقة عن كثب نموذجا في الجسم الحي مع مجموعته الكاملة من أنواع خلايا الجهاز العصبي المركزي في الأنسجة السليمة ، مع الحفاظ على الملاءمة الكيميائية والوراثية والبيئية لنظام المختبر.
Abstract
تشكل دراسة تكوين النخاع في المختبر وفي الجسم الحي العديد من التحديات. إن تمايز الخلايا السليفة قليلة التغصن (OPCs) في المختبر ، على الرغم من قابليته للتطوير ، لا يلخص تكوين النخاع المحوري. تسمح الزراعة المشتركة للخلايا العصبية OPC وثقافات ألياف OPC بفحص تكوين النخاع في المختبر ، لكنها تفتقر إلى أنواع الخلايا الإضافية الموجودة في الجسم الحي ، مثل الخلايا النجمية والخلايا الدبقية الصغيرة. ومع ذلك ، فإن نماذج الفئران في الجسم الحي أقل قابلية للتلاعب الكيميائي والبيئي والجيني وهي أكثر كثافة في العمالة. هنا ، نصف نظاما كميا لثقافة شرائح المخيخ للفأر خارج الجسم الحي (CSC) مفيد ل: 1) دراسة تكوين النخاع التنموي ، 2) نمذجة إزالة الميالين وإعادة تكوين الميالين ، و 3) إجراء البحوث الانتقالية. يتم عزل الأجزاء السهمية من المخيخ والدماغ الخلفي من فئران ما بعد الولادة (P) 0-2 ، وبعد ذلك يشعرون بالنخاع خارج الجسم الحي لمدة 12 يوما. خلال هذه الفترة ، يمكن التلاعب بالشرائح بطرق مختلفة ، بما في ذلك إضافة مركبات لاختبار التأثير على تكوين النخاع التنموي. بالإضافة إلى ذلك ، يمكن تثبيت الأنسجة للفحص المجهري الإلكتروني لتقييم بنية المايلين فوقية وضغطها. لنمذجة المرض ، يمكن أن يتعرض CSC لنقص الأكسجة الحاد للحث على نقص النخاعي. يمكن أيضا أن يتم تحفيز إزالة الميالين في هذه المصانع عن طريق الليسوليسيثين ، مما يسمح بتحديد العوامل التي تعزز إعادة الميالين. بصرف النظر عن التعديلات الكيميائية والبيئية ، يمكن عزل CSC عن الفئران المعدلة وراثيا وتستجيب للتلاعب الجيني الناجم عن الفيروسات الغدية Ad-Cre والتاموكسيفين. وبالتالي ، فإن مزارع شرائح المخيخ هي نموذج سريع وقابل للتكرار وقابل للقياس الكمي لتلخيص تكوين النخاع.
Introduction
يتيح تكوين النخاع للمحاور العصبية الانتشار السريع لإمكانات الفعل ، وهي آلية تعرف باسم التوصيل الملحي1. يتم التأكيد على أهمية المايلين من خلال الأمراض المزيلة للميالين ، مثل التصلب المتعدد (MS) ، والتي تشمل مجموعة واسعة من المظاهر المنهكة ، بما في ذلك فقدان البصر والمشكلات المعرفية والشلل. لا يوجد علاج لمرض التصلب العصبي المتعدد ، وتركز العلاجات الحالية على الحد من تطور المرض من خلال استهداف الخلايا المناعية المحيطية. يعتقد أن الإعاقة في مرض التصلب العصبي المتعدد والأمراض ذات الصلة مدفوعة بفشل إعادة تكوين الميالين والتنكس العصبي التدريجي. على وجه الخصوص ، لوحظ إزالة الميالين والضمور والفقدان المحوري في مرض التصلب العصبي المتعددالتدريجي 2،3. وبالتالي ، فإن تعزيز إعادة الميالين يمثل استراتيجية واعدة يمكن تنفيذها بالتوازي مع العلاجات الحالية وتحقيق فوائد علاجية إضافية.
في الجهاز العصبي المركزي (CNS) ، يتم إجراء تكوين النخاع بواسطة الخلايا الدبقية المتخصصة المعروفة باسم الخلايا الدبقية قليلة التغصن. تتمايز الخلايا السليفة قليلة التغصن (OPCs) إلى خلايا قليلة التغصن الناضجة من خلال سلسلة من الخطوات المنسقة للغاية ، بما في ذلك نمو العمليات التي تلامس المحاور ، وزيادة التعقيد المورفولوجي ، وتوسيع غشاء المايلين ، وأخيرا ، ضغط غمد المايلين4. وبالتالي ، فإن التفاعل بين الخلايا قليلة التغصن والخلايا العصبية حميم للغاية. التفاعلات المتبادلة بين الخلايا العصبية والخلايا قليلة التغصن مطلوبة أيضا لصحة وصيانة الجهاز العصبيالمركزي 2. يلعب النشاط المحوري دورا في تحفيز تكوين النخاع وتدعم العوامل العصبية الدبقية سلامة الخلايا العصبية. أصبحت أهمية الحديث المتبادل الدبقية الدبقية في الجهاز العصبي المركزي معترفا بها بشكل متزايد5،6،7،8. على سبيل المثال ، يمكن أن تؤثر العوامل النجمية على تمايز OPCs والحفاظ على مسارات المادة البيضاء. تلعب الخلايا الدبقية الصغيرة أيضا دورا في تعديل تمايز OPC بالإضافة إلى إزالة حطام المايلين ، وهي خطوة مهمة في عملية إعادة الميالين. سيكون تحديد العوامل المستقلة للخلايا وفهم تأثير أنواع خلايا الجهاز العصبي المركزي الأخرى في إزالة الميالين وإعادة تكوين الميالين أمرا لا يقدر بثمن لتطوير علاجات لأمراض مزيل الميالين وخلل الميالين.
هنا ، نصف نظام خارج الجسم الحي باستخدام مزارع شرائح المخيخ الفأر (CSC) التي تسمح بالتلاعب والقياس الكمي لأنسجة الجهاز العصبي المركزي السليمة. يسمح استخدام CSC بقياس الميالين ، أو إعادة تكوين الميالين بعد تحريض إزالة الميالين بواسطة الليزوليسيثين9،10 ، باستخدام الطرق المستخدمة تقليديا مع الدراسات في الجسم الحي ، مثل التلوين المناعي والفحص المجهري الإلكتروني11،12،13. ليسوليسيثين مادة كيميائية تعطيل الغشاء التي تؤدي إلى فقدان سريع للمايلين والخلايا قليلة التغصن. تحذير محتمل لملاحظة أن ليسوليسيثين قد يؤدي أيضا إلى الحد من أنواع الخلايا الأخرى بالقرب من منطقة الآفة. على عكس التجارب في الجسم الحي ، يمكن التلاعب بسهولة بالشرائح السهمية من المخيخ عن طريق إضافة المركبات ، أو تغييرها وراثيا باستخدام الفيروسات الغدية Ad-Cre. تسمح الطريقة أيضا بالتلاعب بالأنسجة المعزولة من الفئران أو الفئران المعدلة وراثيا التي تتعرض لإهانات بيئية مثل نقص الأكسجة11،12،13،14. وبالتالي ، يسمح نموذج CSC بدراسة تكوين النخاع التنموي ، ونمذجة المرض ، وتحديد العوامل التي تعزز أو تمنع تكوين النخاع ، مع دمج مساهمات أنواع مختلفة من خلايا الجهاز العصبي المركزي في وظيفة الخلايا قليلة التغصن.
Protocol
تم ترخيص جميع الدراسات التي أجريت على والموافقة عليها من قبل لجنة رعاية واستخدام المؤسسية في Genentech.
1. تحضير الوسائط والإمدادات للتشريح (~ 30-45 دقيقة)
- تحضير وتعقيم وسط زراعة شرائح الترشيح (SCM) ووسط التشريح (DM) كما هو مفصل في الجدول 1. يحفظ في درجة حرارة 4 درجات مئوية. إذا تم اختبار أي عوامل لمقايسة الميالين، فقم بإضافتها إلى SCM قبل الاستخدام مباشرة.
- ماصة 1 مل من SCM في كل بئر من 6 ألواح آبار.
- باستخدام ملقط معقم ، ضع إدخالا عضويا في كل بئر ، مع ضمان عدم احتجاز الفقاعات تحت الغشاء. قم بتسخين اللوحة بوسائط عند 37 درجة مئوية في حاضنة 7.5٪ CO2 .
2. تحضير منطقة التشريح (~ 5-10 دقائق)
- قم بإجراء الإجراءات في غطاء التدفق الصفحي المعقم أو على سطح الطاولة باستخدام تقنيات التعقيم المناسبة لجميع خطوات الإجراء. امسح جميع المناطق نظيفة بنسبة 70٪ من الإيثانول.
- ضع شفرة جديدة ومرحلة قطع سيليكون على مفرمة المناديل. الماصة ~ 300 ميكرولتر من الماء المعقم أو 70٪ من الإيثانول تحت مرحلة القطع لضمان بقائها في مكانها.
- استخدم قطعة قطن لمسح شفرة تقطيع المناديل ومرحلة القطع برفق بنسبة 70٪ من الإيثانول. جفف قبل استخدام مفرمة المناديل.
- رش جميع أدوات التشريح بنسبة 70٪ من الإيثانول وجففها قبل التشريح.
- قم بإعداد طبقين من بتري مقاس 10 سم: أحدهما يحتوي على 15-20 مل من DM ، والآخر يحتوي على 10 مل من SCM. تخزينها على الثلج. احتفظ بجميع الوسائط وأطباق بتري على الجليد عند عدم تشريحها.
3. تشريح ثقافة شريحة المخيخ (~ 15-20 دقيقة لكل جرو)
- ضع طبق بتري مع DM على مجهر تشريح.
- قتل جرو فأر ، يوم ما بعد الولادة P0-2 ، عن طريق قطع الرأس السريع بمقص حاد.
- ضع الرأس في طبق بتري مع DM تحت المجهر التشريح لتصفية الدم.
- باستخدام مقص ناعم ، قم بقص مرة واحدة على كل حافة جانبية في قاعدة الجمجمة.
- مع وضع الرأس رأسا على عقب في DM ، اضغط بقوة على الجانب السفلي من الجمجمة باستخدام ملقط # 5/45 ، مما يجبر الدماغ الخلفي غير التالف على المرور عبر الثقب في الجمجمة.
- تحت مجهر التشريح ، قم بقطع الأنسجة الزائدة باستخدام مشرطين # 11. تأكد من بقاء المخيخ متصلا بالقطعة الأساسية من الدماغ الخلفي. انظر الشكل 1 أ للحصول على رسم تخطيطي مفصل.
- باستخدام الملعقة ، انقل المخيخ إلى مرحلة قطع مفرمة الأنسجة مع وضع الأنسجة على الوجه المنقاري للدماغ الخلفي والوجه الذيلي للدماغ الخلفي المواجه للباحث. تأكد من أن المستوى الإنسي للدماغ مواز تماما لشفرة مفرمة الأنسجة.
- باستخدام ماصة P200، قم بإزالة الوسط الزائد حول الأنسجة، وتأكد من أنها لا تزال رطبة ولكنها ليست عائمة أو محاطة بالسائل.
- استبدل طبق بتري الذي يحتوي على DM بطبق بتري الذي يحتوي على SCM تحت مجهر التشريح.
- قطع الأنسجة إلى شرائح بسمك 350 ميكرومتر باستخدام مفرمة المناديل.
ملاحظة: يجب تحسين سرعة الشفرة (على سبيل المثال، قطع واحد تقريبا في الثانية) والقوة لضمان ظروف القطع المثلى. في حالات نادرة ، سوف يعلق النسيج على الشفرة. لتقليل فقدان أقسام الأنسجة ، احتفظ بالإبهام على زر الطاقة لإيقاف تشغيل مفرمة المناديل بسرعة إذا لزم الأمر. - قم بوضع 100 ميكرولتر من SCM برفق تحت الأنسجة، بحيث تطفو الشرائح. انقل الأنسجة المقطعة باستخدام الملعقة إلى طبق بتري باستخدام SCM تحت مجهر تشريح.
- استخدم قطعة قطن لمسح شفرة تقطيع المناديل ومرحلة القطع برفق بنسبة 70٪ من الإيثانول.
- باستخدام المشارط (الجانب الحاد) ، افصل الشرائح برفق تحت المجهر التشريح. باستخدام مشرط وملعقة ، انقل الشرائح إلى الغشاء في لوحة 6 آبار باستخدام SCM.
ملاحظة: غالبا ما يكون لمعظم الأقسام الإنسية أفضل نخايات وسلامة الأنسجة. في المتوسط ، يمكن تشريح 4-6 شرائح من دماغ فأر واحد. - احتضان الشرائح في SCM عند 37 درجة مئوية في 7.5٪ ثاني أكسيدالكربون 2.
4. تغييرات الثقافة ووسائل الإعلام (~ 15-30 دقيقة)
- استبدل SCM كل يومين.
- ماصة 1 مل من الوسط الطازج في كل بئر من صفيحة جديدة مكونة من 6 آبار ودافئة في حاضنة. باستخدام ملقط معقم ، انقل الأغشية إلى اللوحة الجديدة ، مع ضمان عدم وجود فقاعات تحتها. أعد الأطباق إلى الحاضنة.
5. الميلين القياسي وإعادة الميالين
- بروتوكول تكوين النخاع القياسي (الشكل 1 ب).
- تم تشريح شرائح الثقافة في القسم 3 من 0-12 يوما في المختبر (DIV). إذا تم اختبار تأثير أي عامل على تكوين النخاع ، فقم بإضافته إلى الوسط في وقت الاستزراع (0 DIV) وتجديده مع كل تغيير في الوسائط.
- الإصلاح عند 12 DIV (الخطوة 7.1) ، وهي نقطة زمنية محسنة لتكوين النخاع غير المكتمل11،12،13. هذا يسمح بالكشف عن أي تأثيرات معززة أو مانعة على تكوين النخاع بسبب العامل المضاف إلى الوسيط. تظهر نتيجة إيجابية تمثيلية مع إضافة 100 نانوغرام / مل أكتيفين أ في الشكل 2.
- بروتوكول إعادة الميالين (الشكل 1 ج)
- اتبع بروتوكول تكوين النخاع القياسي الموضح في القسم 5.1 دون أي عوامل إضافية حتى 14 DIV ، وهي النقطة الزمنية التي تكون فيها الشرائح ميالينية بالكامل11،12،13.
- تحضير مخزون ليسوليسيثين (125 ملغ/مل) كما هو مفصل في الجدول 1. ماصة 1 مل من 0.5٪ ليزولسيثين في SCM في كل بئر من جديد 6 بئر صفيحة ودافئة في حاضنة.
- نقل الأغشية إلى لوحة ليسوليسينين ووضعها في حاضنة بين عشية وضحاها لمدة 16-18 ساعة.
- في اليوم التالي ، قم بإعداد أطباق جديدة مع SCM طازج ، مع إضافة أي عامل (عوامل) يتم اختبارها بحثا عن تأثيرات إعادة تكوين الميالين إذا لزم الأمر. أطباق دافئة في حاضنة.
- لتغيير الوسائط ، اضغط برفق على الغشاء على جانب البئر لضمان إزالة كل وسط الليسولسيثين. تجديد العامل (العوامل) التي يتم اختبارها عند كل تغيير في الوسائط (القسم 4).
- قم بإصلاح الشرائح عند 28 DIV (الخطوة 7.1) ، وهي نقطة زمنية محسنة لإعادة الميالين غير المكتمل. هذا يسمح بالكشف عن تحسين أو منع إعادة الميالين بسبب العامل المضاف إلى الوسيط. يتم عرض نتيجة إيجابية تمثيلية مع إضافة 0.1 ميكرومتر XAV939 في الشكل 3.
6. الاختلافات في بروتوكول تكوين النخاع وإعادة الميالين
- بروتوكول نقص النخاع الناجم عن نقص الأكسجة (الشكل 1 د) 11،13.
ملاحظة: يتم تقديم هذا كشكل مختلف من بروتوكول تكوين النخاع القياسي المقدم في القسم 5.1.- شرائح اللوحة في SCM بدون عوامل.
- انقل ألواح الشرائح إلى حاضنة ناقص الأكسجين (2٪ FiO2) لمدة 24 ساعة بين 2-3 DIV.
- في اليوم التالي ، قم بإعداد أطباق جديدة مع SCM طازج ، مع إضافة أي عامل (عوامل) يتم اختبارها لإمكانية تكوين النخاع إذا لزم الأمر. أطباق دافئة في حاضنة.
- بعد الاستزراع في نقص الأكسجة ، قم بتغيير الوسط (القسم 4) وإعادة المزارع إلى حاضنة الاستزراع القياسية (37 درجة مئوية ، 7.5٪ ثاني أكسيدالكربون 2). قم بتجديد أي عوامل يتم اختبارها مع كل تغيير لاحق في الوسائط (القسم 4).
- الإصلاح عند 12 DIV (الخطوة 7.1).
- بروتوكول التلاعب الجيني (الشكل 1 هاء)13
- عزل الأنسجة من الفئران المعدلة وراثيا للتشريح كما في القسم 3.
- مع خطوط الفأر المعدلة وراثيا المحفزة ، يمكن إضافة تاموكسيفين (100 نانومتر ، جرعة لا تحفز تتكون النخاع أو تمايز OPC) أو الفيروس الغدي Ad-Cre إلى SCM أثناء تغييرات الوسائط التي تتم في 1 DIV و 3 DIV.
- بعد التلاعب الجيني بالتاموكسيفين أو الفيروس الغدي Ad-Cre ، استمر في تغيير الوسائط كل يومين كما في القسم 4 (مع إضافة عوامل إذا لزم الأمر).
ملاحظات: جميع الشرائح من فأر واحد تتناسب مع غشاء واحد ، مما يسمح بالتنميط الجيني بعد التشريح ، مما يجعل من السهل إجراء تجارب على الفئران المعدلة وراثيا.
7. معالجة الأنسجة وتحليلها
- قم بإصلاح الشرائح عن طريق غمر الغشاء برفق في 4٪ بارافورمالدهيد لمدة ساعة واحدة في درجة حرارة الغرفة (RT).
- اشطفها برفق عن طريق الغمر في محلول ملحي مخزن بالفوسفات (PBS). ثم اغمر في PBS في لوحة 6 آبار.
ملاحظة: يمكن إيقاف البروتوكول مؤقتا هنا. يمكن تخزين الشرائح الثابتة في PBS عند 4 درجات مئوية لمدة تصل إلى شهر. إذا لم يتم تخزين الشرائح ، اشطفها 2x في PBS لمدة 5 دقائق قبل المتابعة. - استخدم مشرطا لقطع الغشاء من الحلقة واستمر في التلوين في طبق 6 آبار. تأكد من إبقاء الشرائح متجهة لأعلى (جانب الغشاء لأسفل) للتلطيخ والتركيب اللاحق على الشرائح.
- كتلة لمدة 1 ساعة في RT في محلول الكتلة (3٪ مصل الحصان المعطل بالحرارة ، 2٪ ألبومين مصل البقر ، و 0.25٪ Triton-X 100 مخفف في PBS).
ملاحظة: إذا كانت هناك حاجة إلى استرجاع المستضد لتلوين الأجسام المضادة (على سبيل المثال ، CC1 / Olig2) ، فيمكن القيام بذلك في أطباق بتري الزجاجية. - لف الألواح في غشاء البارافين واحتضانها طوال الليل عند 4 درجات مئوية في الجسم المضاد الأولي المخفف في محلول الحظر.
- اغسل 3 مرات في محلول حجب : 1) شطف قصير ، 2) غسل لمدة 15 دقيقة ، و 3) غسيل لمدة ساعة واحدة. للشطف لفترة وجيزة ، املأ طبق بتري صغير بالمحلول واغمر الغشاء برفق باستخدام ملقط قبل نقله إلى محلول جديد. لغسل أطول (أي 15 دقيقة و 1 ساعة) ، اغمر الغشاء في محلول في صفيحة 6 آبار وضعها على هزاز لطيف.
- احتضان مغطى من الضوء لمدة ساعتين في RT في الأجسام المضادة الثانوية المخففة 1: 500 في PBS.
- اغسل 3 مرات في PBS: 1) شطف قصير ، 2) غسل لمدة 15 دقيقة ، و 3) غسيل لمدة ساعة واحدة.
- إذا كانت هناك حاجة إلى تلطيخ DAPI ، فقم بالغمر في محلول 1: 1,000 DAPI لمدة 7 دقائق في RT. اشطفها لفترة وجيزة ثم اغسلها لمدة 15 دقيقة في PBS.
- اشطفها بالماء المقطر المزدوج.
- قم بتركيب الأغشية على شريحة بحيث تكون الشرائح متجهة لأعلى (جانب الغشاء لأسفل).
ملاحظة: يمكن تخزين الشرائح المثبتة عند 4 درجات مئوية. من الأفضل إجراء التصوير على المجهر متحد البؤر في غضون أسبوع واحد ، قبل أن يصبح الغشاء معتما ويصعب تصويره. - شرائح الصورة باستخدام الفحص المجهري متحد البؤر وتحديد الكم كما هو موضح سابقا11،12،13.
النتائج
تم استخدام مزارع شرائح المخيخ المشتقة من الفئران P0-2 (الشكل 1 أ) لدراسة تكوين النخاع وتقييم آثار إضافة عوامل مختلفة من 0-12 DIV (الشكل 1 ب). لدراسة إعادة الميالين, تم أولا إزالة الميالين المزارع شرائح في 14 DIV مع ليسوليسين وسمح لها بإعادة الميالين لمدة 14 يوما إضافيا في الثقافة مع العوامل المختبرة (الشكل 1C), وبعد ذلك تم قياس إعادة الميالين. تمت دراسة تأثير نقص الأكسجة على تكوين النخاع أيضا عن طريق وضع مزارع الشرائح في حاضنة نقص الأكسجين بنسبة 2٪ FiO2 لمدة 24 ساعة ، من 2-3 DIV (الشكل 1 د). أخيرا ، تم استخدام مزارع الشرائح المشتقة من الفئران المعدلة وراثيا لدراسة تأثير الضربة القاضية الجينية على تكوين النخاع. في هذا النظام ، تم تحفيز إعادة تركيب Cre عن طريق إضافة تاموكسيفين أو الفيروس الغدي Ad-Cre في 1 DIV و 3 DIV ، ومزارع الشرائح الثابتة للتحليل في 12 DIV (الشكل 1E). بعد تثبيت الأنسجة ، تم إجراء القياس الكمي لإزالة الميالين وإعادة تكوين الميالين عن طريق التلوين المناعي (الشكل 2 ، الشكل 3) والفحص المجهري الإلكتروني11،12،13.
توضح البيانات التمثيلية الموضحة (الشكل 2 ، الشكل 3) النطاق الديناميكي لتكوين النخاع وإعادة تكوين الميالين في مزارع الشرائح. تم قياس مؤشر الميالين كميا من خلال نسبة Caspr ، وهي علامة جنون العظمة وهي قراءة غير مباشرة للمايلين المضغوط ، إلى بروتين الشعيرات العصبية H (NFH) ، الذي يلطخ المحاور. تم التحقق من صحة مؤشر تكوين النخاع هذا لتمثيل تكوين المايلين المضغوط عن طريق المجهر الإلكتروني وتلوين قناة الصوديوم12. أدى إزالة الميالين الناجم عن الليزولسيثين9،10 إلى الاختفاء الكامل لجنون العظمة الإيجابي للغة كاسبر (مؤشر الميالين = 0 ، الشكل 3 أ) وفقدان المايلين المضغوط ، والذي تم استعادته أثناء إعادة الميالين11،12.
لإثبات نتيجة إيجابية على تكوين النخاع ، تم استزراع الشرائح باستخدام Activin A باتباع الجدول الزمني في الشكل 1 ب. يشرك Activin A مستقبلات المنشطات على الخلايا قليلة التغصن ويدفع تمايز الخلايا الدبقية قليلة التغصن وضغط المايلين15. تظهر البيانات التمثيلية أن معالجة الشرائح ب 100 نانوغرام / مل من Activin A أثناء تكوين النخاع أدت إلى ارتفاع مؤشر تكوين النخاع (الأشكال 2 أ ، ب). تمشيا مع هذا ، قام علاج Activin A بتسريع تمايز OPC ، كما هو موضح من خلال نسبة الخلايا قليلة التغصن الناضجة الإيجابية CC1 إلى خلايا سلالة الخلايا قليلة التغصن Olig2 +11،13 (الأشكال 2C ، D).
ثبت أن مثبط جزيئي صغير من Tankyrase ، XAV939 ، يعزز تكوين النخاع وإعادة تكوين الميالين عن طريق تثبيت مستويات Axin2 في الخلايا قليلة التغصن11. بعد المعالجة ليسوليسيثين, تم تصور إزالة الميالين وقياسها في الثقافات شرائح عن طريق المجزأة البروتين الأساسي المايلين (MBP) تلطيخ ونقص جنون العظمة إيجابية في كاسبر (الأشكال 3 أ). أدى العلاج ب 0.1 ميكرومتر XAV939 أثناء إعادة الميالين (15-28 DIV) إلى زيادة مؤشر تكوين النخاع بشكل كبير مقارنة بضوابط المركبات ، كما هو موضح من خلال نسبة تلطيخ Caspr إلى NFH (الأشكال 3 ب ، ج). وبالتالي يمكن استخدام نموذج ثقافة الشرائح لفحص وتحديد التأثيرات على تمايز OPC ، وتكوين النخاع ، وإعادة تكوين الميالين في الأنسجة السليمة.
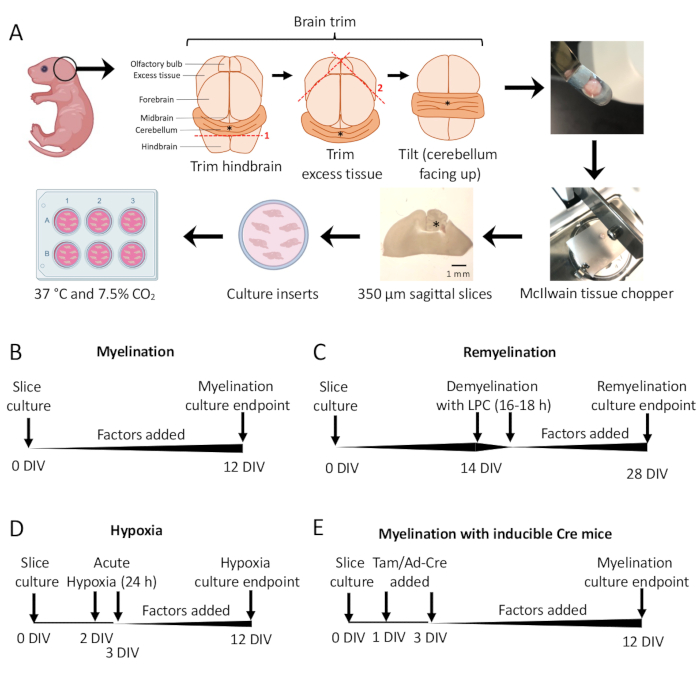
الشكل 1: تخطيطي لثقافات شرائح المخيخ يوضح الخطوات الرئيسية في عملية التشريح والجداول الزمنية لبروتوكولات زراعة الشرائح المختلفة. (أ) تصوير خطوات توليد ثقافات الشرائح: تشريح الأدمغة من صغار الفأر P0-2 ، وتقليم الدماغ (كما هو موضح) ، وقطع الدماغ بمفرمة الأنسجة لتوليد شرائح سهمية 350 ميكرومتر ، ووضع شرائح على إدخالات ثقافة النمط العضوي في طبق 6 آبار ، والحضانة عند 37 درجة مئوية و 7.5٪ ثاني أكسيدالكربون 2. * يدل على المخيخ. (ب) الجدول الزمني لثقافات شرائح النخاع. تم احتضان مزارع الشرائح لمدة 12 يوما قبل التثبيت للتحليل. (ج) الجدول الزمني لإعادة زراعة الشرائح الميالينية. تم التعامل مع شرائح مع الليسولسيثين في 14 DIV لمدة 16-18 ساعة للحث على إزالة الميالين بالكامل وسمح لها بإعادة الميالين حتى 28 DIV قبل التثبيت للتحليل. (د) الجدول الزمني لتكوين النخاع بعد إهانة نقص الأكسجة. تعرضت الشرائح لإهانة حادة ناجمة عن نقص الأكسجين لمدة 24 ساعة بين 2-3 DIV ، مما تسبب في نقص النخاعي. (ه) الجدول الزمني ل CSC من الفئران المعدلة وراثيا. تمت إضافة تاموكسيفين (تام ، 100 نانومتر) أو فيروس Ad-Cre في 1 DIV و 3 DIV للحث على التعديل الجيني ، وتم تحليل الشرائح في 12 DIV. مخططات الجدول الزمني مقتبسة من المنشورات السابقة11،13. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
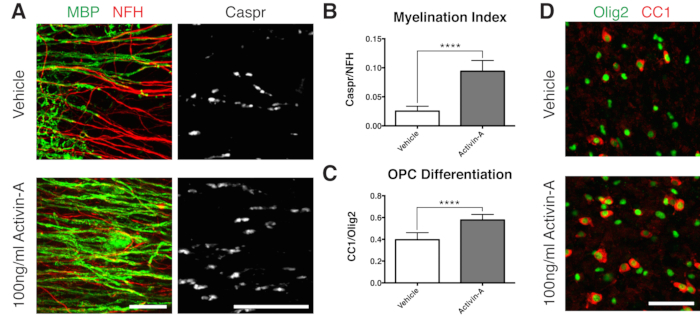
الشكل 2: البيانات التمثيلية التي تظهر أن Activin A يعزز تكوين النخاع وتمايز OPC. (أ) زيادة في تكوين النخاع (MBP) والجنون العظمي (Caspr) مع علاج 100 نانوغرام / مل من Activin A ، كما هو موضح من خلال التلوين المناعي لمزارع الشرائح. (ب) القياس الكمي لمؤشر تكوين النخاع (نسبة المساحة الملطخة ببراهن العظمة Caspr + إلى المنطقة الملطخة بمحاور NFH +). (ج) القياس الكمي لتمايز OPC (نسبة الخلايا قليلة التغصن CC1 + إلى خلايا سلالة الخلايا قليلة التغصن Olig2+). (د) صور تمثيلية لتلوين CC1 / Olig2. القيم المعروضة هي المتوسط + الانحراف المعياري. ص < 0.0001; اختبار T غير متزاوج. أشرطة المقياس: A = 25 ميكرومتر ، D = 50 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
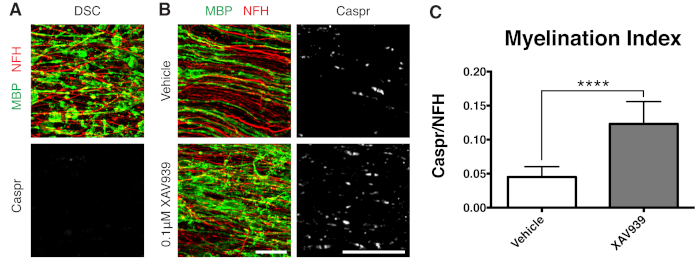
الشكل 3: البيانات التمثيلية التي تظهر أن XAV939 يعزز إعادة تكوين الميالين. (أ) صور تظهر إزالة الميالين عن طريق تلطيخ MBP المجزأ ونقص جنون العظمة في مزارع الشرائح المعالجة بالليزوليسيثين. (ب) زيادة في إعادة الميالين (MBP) والجنون العظمي (Caspr) مع علاج 0.1 ميكرومتر XAV939 بعد إزالة الميالين الناجم عن الليزولسيتين الذي يظهر عن طريق التلوين المناعي لمزارع الشرائح. (ج) القياس الكمي لمؤشر تكوين النخاع (نسبة المساحة الملطخة ب Caspr + paranodes إلى المنطقة الملطخة بمحاور NFH +). القيم المعروضة هي المتوسط + الانحراف المعياري. ص < 0.0001; اختبار T غير متزاوج. أشرطة المقياس = 25 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| وسائط ثقافة الشرائح (SCM) | |
| حجم | الكاشف |
| 100 مل | الحد الأدنى من الوسائط الأساسية (MEM) ، HEPES ، بدون جلوتامين |
| 50 مل | مصل الحصان المعطل بالحرارة |
| 50 مل | محلول الملح المتوازن من إيرل |
| 2 مل | البنسلين ستربتومايسين 10,000 وحدة / مل |
| 2 مل | مكمل GlutaMAX |
| 2888 ميكرولتر | محلول جلوكوز 45٪ |
| 1 مل | Fungizone |
| فلتر معقم من خلال فلتر 0.22 ميكرومتر وتخزينه في ثلاجة 4 درجات مئوية لمدة تصل إلى أسبوعين. | |
| وسائط التشريح (DM) | |
| حجم | الكاشف |
| 100 مل | MEM ، HEPES ، مع أملاح إيرل |
| 1 مل | البنسلين ستربتومايسين 10,000 وحدة / مل |
| فلتر معقم من خلال فلتر 0.22 ميكرومتر وتخزينه في ثلاجة 4 درجات مئوية لمدة تصل إلى شهرين. | |
| مخزون الليسوليسيثين (125 ملغ/مل) | |
| مبلغ | الكاشف |
| 100 مجم | الليسوليسيثين |
| 0.8 مل | معقم PBS |
| إذابة 100 ملغ من ليسوليسيثين في 0.8 مل من PBS معقمة. قم بتخزين 80 ميكرولتر من محلول المرق عند -20 درجة مئوية. | |
| قبل الاستخدام ، قم بإذابة 80 ميكرولتر من الكمية وتذوب في 20 مل من SCM (0.5٪ ليزولسيثين في SCM) ، يتم تسخينها في 37 درجة مئوية ، 7.5٪ حاضنة CO2. إذا لزم الأمر, دوامة لإذابة ليزولسيثين في SCM. | |
الجدول 1: قائمة المكونات والبروتوكول لعمل وسط زراعة الشرائح (SCM) ، ووسط التشريح (DM) ، ومحلول الليسولسيثين.
Discussion
يصف هذا البروتوكول نموذج ثقافة شرائح المخيخ العضوي الذي يلخص التكوين الخلوي في الجسم الحي مع بساطة نموذج المختبر. يمكن تطوير هذا البروتوكول بشكل أكبر ليصبح نموذجا أكثر تمثيلا للأمراض البشرية. يمكن تطوير CSC كنماذج للإصابات الخاصة بالأمراض ، مثل إصابة الأنسجة الناجمة بالقوة ، أو الإصابة التي تسببها الأجسام المضادة الخاصة بالمايلين ، أو إصابة الخلايا قليلة التغصن في مرض التصلب العصبي المتعدد مع إضافة الخلايا المناعية المحيطية. يمكن أيضا تحسين هذا البروتوكول للأنسجة التي تم تشريحها من أجزاء أخرى من الدماغ والحبل الشوكي16،17. بينما يركز هذا البروتوكول على القياس الكمي النسيجي لتكوين النخاع ، يمثل CSC نموذجا مناسبا لفحص نقاط النهاية التجريبية المختلفة. يمكن استخدام هذه الثقافات لتوصيف أنواع الخلايا المختلفة عبر تسلسل الحمض النووي الريبي أحادي الخلية ، وتقييم البنية التحتية للمحاور وأغلفة المايلين عبر المجهر الإلكتروني ، ودراسة ديناميكيات OPC عن طريق إجراء التصوير بفاصل زمني. يمكن أيضا تجاوز التلوين المناعي باستخدام خطوط مراسل الفئران المعدلة وراثيا18،19. أخيرا ، يمكن استخدام أعمار مختلفة من صغار الفئران ، أو الوقت في الثقافة ، أو سمك الأقسام لتكييف CSC لنمذجة آليات المرض المختلفة10،17،18،19،20،23.
تعتبر مزارع الشرائح مثالية لاختبار وقياس العوامل التي تؤثر على تكوين الميالين وإعادة تكوين الميالين ولكنها محدودة في تمثيلها للجهاز العصبي المركزي في سياقات معينة. مشتق من أدمغة P 0-2 ، يأتي CSC من أدمغة مبكرة في التطور ، ولها أوجه تشابه محدودة مع الدماغ الشيخوخة أو التنكسية العصبية. بالنظر إلى الوعي المتزايد بأهمية المايلين في اضطرابات الجهاز العصبي المركزي مثل مرض الزهايمر21 والفصام22 ، فإن نماذج البالغين أو الشيخوخة مطلوبة لقياس وتوصيف تكوين النخاع. تم نشر بروتوكولات أخرى لعزل الأنسجة عن القوارض الأكبر سنا ، على الرغم من أنها لا تزال خلال مراحل النمو10،18،19،23. بالإضافة إلى ذلك ، قد تكون هناك اختلافات جوهرية وخارجية في الخلايا قليلة التغصن و OPCs في المخيخ مقارنة بالحبل الشوكي ومناطق المادة البيضاء الأخرى في الدماغ. كما أن CSC أقل ملاءمة من الأنظمة المختبرية القائمة على الخلايا لشاشات CRISPR أو الجزيئات الصغيرة على نطاق واسع. نظرا لتقطيع الأنسجة الأولي ، هناك أيضا تنشيط للخلايا المناعية الفطرية المقيمة في الدماغ (أي الخلايا الدبقية الصغيرة والخلايا النجمية) ، وهو تحذير مهم للنظام24. أخيرا ، تلعب الخلايا المناعية الطرفية دورا كبيرا في أمراض مرض التصلب العصبيالمتعدد 25. يخلو CSC من الخلايا الطرفية ما لم تتم إضافة هذه الخلايا خارجيا ، وبالتالي فهي ليست نموذجا مثاليا لبيئة الجهاز العصبي المركزي الالتهابي.
ربما يكون جزء التشريح من هذا البروتوكول هو الأكثر أهمية. يجب اتخاذ خطوات التشريح بعناية فائقة ، حتى لا تتلف الأنسجة والبنية الأساسية. تضمن المحاذاة الصحيحة للدماغ على طول شفرة مفرمة الأنسجة الحد الأدنى من الضرر الذي يلحق بالأنسجة والخلايا. بالإضافة إلى ذلك ، من المهم التشريح الدقيق وفصل الشرائح ، وكذلك نقلها إلى الأغشية للثقافة. تم تحسين الأطر الزمنية الموضحة في هذا البروتوكول للبحث الموصوف ولكن قد تحتاج إلى تعديلها للحصول على أفضل النتائج في دراسات مختلفة. سيكون هذا البروتوكول مفيدا لأولئك الذين يرغبون في دراسة تكوين النخاع التنموي وإصلاح المايلين.
وتجدر الإشارة إلى أنه لا يوجد علاج لمرض التصلب المتعدد. في حين أن العلاجات الحالية فعالة جدا في تثبيط جهاز المناعة التكيفي ، فلا يوجد علاج حالي يمكن أن يوقف التقدم. يعتقد أن فشل إعادة تكوين الميالين والتنكس العصبي اللاحق يكمن وراء تطور مرض التصلب العصبيالمتعدد 2. يشير وجود OPCs في آفات التصلب العصبي المتعدد المزمنة إلى أن فشل إصلاح المايلين قد يكون بسبب توقف في تمايز OPC. يفتح استخدام CSC طريقا للاكتشاف لعلاجات إصلاح المايلين التي قد تساعد في عكس تطور مرض التصلب العصبي المتعدد واستعادة الوظيفة. يمكن أن يساعد علاج إصلاح المايلين أيضا في التعافي في المرضى الذين يعانون من إصابة في الحبل الشوكي ، حيث تمنع المسالك مزيلة الميالين الوظيفة الحركية26. لذلك ، تكمن أهمية CSC في ملاءمته لتحديد العوامل التي تؤثر على إزالة الميالين وإعادة تكوين الميالين في الثدييات بطريقة إنتاجية عالية نسبيا مقارنة بالنماذج الحيوانية في الجسم الحي. في حين أن العديد من الدراسات قد استخدمت OPCs الأولية لفحص المركبات التي تؤثر على التمايز ، فإن توليد وعزل OPCs الأولية يتطلب مناعة شاقة ومتسلسلة27. بالإضافة إلى ذلك ، لا تلخص المقايسات القائمة على الخلايا تنوع وتفاعل أنواع الخلايا الموجودة في الجسم الحي. يعد توليد CSC من صغار الفئران نموذجا سريعا وفعالا من حيث التكلفة لدراسة تكوين النخاع وإعادة تكوين الميالين الذي لا يتطلب معدات أو مواد استهلاكية باهظة الثمن. وبالتالي ، تمثل ثقافات شرائح المخيخ نموذجا كميا لا يقدر بثمن لتلخيص تكوين النخاع خارج الجسم الحي وتمكين اكتشاف الأدوية وأبحاث العلوم الأساسية.
Disclosures
المؤلفون موظفون في شركة Genentech، Inc. ، وهي عضو في مجموعة Roche.
Acknowledgements
يود المؤلفون أن يشكروا Yun-An Shen و Roxanne Kyauk و Chris Bohlen على التعليقات البناءة والمدخلات حول هذه المقالة. بالإضافة إلى ذلك ، يقر المؤلفون بمساهمات تشارلز فرنش كونستانت وأندرو جارجور وفيرونيك ميرون وديفيد رويتش في التطوير المبكر للمنهجية ذات الصلة المنشورة سابقا11،12،13.
Materials
| Name | Company | Catalog Number | Comments |
| #5/45 Forceps | Fine Science Tools | 11251-35 | Dissection tools |
| 32% Paraformaldehyde | Electron Microscopy Sciences | 50-980-495 | Fixative for staining |
| 45% glucose solution | Sigma | G8769 | Slice culture media component |
| 6-well tissue culture plates | Corning | 3516 | Plates for cultures |
| Alexa Fluor Goat anti-chicken 647 | Thermo Fisher Scientific | A21449 | Secondary staining antibody |
| Alexa Fluor Goat anti-mouse 647 | Thermo Fisher Scientific | A21236 | Secondary staining antibody |
| Alexa Fluor Goat anti-rabbit 555 | Thermo Fisher Scientific | A11006 | Secondary staining antibody |
| Alexa Fluor Goat anti-rat 488 | Thermo Fisher Scientific | A21428 | Secondary staining antibody |
| Blades, Double-edge, PTFE coated Stainless steel | Ted Pella | 121-6 | Chopping blades |
| Bovine Serum Albumin (BSA) | Sigma | A9418 | Blocking solution component |
| Chicken anti-NFH antibody | Encor Biotech | CPCA-NF-H | Staining antibody |
| Confocal Microscope | Zeiss | LSM780 | Confocal for imaging |
| Corning 250 mL vacuum filter/storage bottle system, 0.22 µm pore | Corning | 431096 | For media preparation |
| Earl's balanced salt solution | Sigma | E2888 | Slice culture media component |
| Feather surgical blade | Feather | 2976#11 | Dissection tools |
| Fungizone | Thermo Fisher Scientific | 15290-18 | Dissection media component |
| GlutaMAX supplement | Thermo Fisher Scientific | 35050-061 | Slice culture media component |
| Heat-inactivated horse serum | Thermo Fisher Scientific | 26050-88 | Slice culture media component |
| Lysolecithin | Sigma | L4129 | |
| Lysophosphatidylcholine from egg yolk | Sigma | L4129 | To induce demyelination |
| McIlwain Tissue Chopper | Ted Pella | 10180 | Tissue chopper |
| MEM, Hepes, no glutamine | Thermo Fisher Scientific | 12360-038 | Slice culture media component |
| MEM, Hepes, with Earle's salts | Sigma | M7278 | Dissection media component |
| Metal spatula | Fisher Scientific | 470149-442 | Dissection tools - bend flat end at angle for use |
| Millicell Culture Plate Insert 30mm Organotypic PTFE | Fisher | PICM0RG50 | Culture insert |
| Mouse anti-CC1 antibody | Millipore | OP80-100UG | Staining antibody |
| Noyes spring scissors | Fine Science Tools | 15012-12 | Dissection tools |
| PBS pH 7.4 | Gibco | 10010023 | For dilution of fixative |
| Penicillin-streptomycin 10,000U/mL | Thermo Fisher Scientific | 15140-122 | Slice culture media component |
| Rabbit anti-Caspr antibody | Abcam | ab34151 | Staining antibody |
| Rabbit anti-Olig2 antibody | Millipore | AB9610 | Staining antibody |
| Rat anti-MBP antibody | Serotec | MCA409S | Staining antibody |
| Scalpel handle #3 | Fine Science Tools | 10003-12 | Dissection tools |
| Silicone rubber foam sheet | MSC Industrial Direct Co | 31939176 | Cutting base |
| Stereo Microscope | Olympus Life Sciences | SZ61 | Microscope for dissection |
| Student surgical scissors | Fine Science Tools | 91401-12 | Dissection tools |
References
- Purves, D., Augustine, G. J., Fitzpatrick, D. Increased Conduction Velocity as a Result of Myelination. Neuroscience 2nd edition. , (2001).
- Dutta, R., Trapp, B. D. Mechanisms of neuronal dysfunction and degeneration in multiple sclerosis. Progress in Neurobiology. 93 (1), 1-12 (2011).
- Trapp, B. D., Nave, K. A. Multiple sclerosis: an immune or neurodegenerative disorder?. Annual Review of Neuroscience. 31, 247-269 (2008).
- Bradl, M., Lassmann, H. Oligodendrocytes: biology and pathology. Acta Neuropathologica. 119 (1), 37-53 (2010).
- Domingues, H. S., Portugal, C. C., Socodato, R., Relvas, J. B. Oligodendrocyte, Astrocyte, and Microglia Crosstalk in Myelin Development, Damage, and Repair. Frontiers in Cell and Developmental Biology. 4, 71 (2016).
- Nave, K. A., Werner, H. B. Myelination of the nervous system: mechanisms and functions. Annual Review of Cell and Developmental Biology. 30, 503-533 (2014).
- Franklin, R. J. M., Ffrench-Constant, C. Regenerating CNS myelin – from mechanisms to experimental medicines. Nature Reviews Neuroscience. 18 (12), 753-769 (2017).
- Molina-Gonzalez, I., Miron, V. E. Astrocytes in myelination and remyelination. Neuroscience Letters. 713, 134532 (2019).
- Keough, M. B., Jensen, S. K., Yong, V. W. Experimental demyelination and remyelination of murine spinal cord by focal injection of lysolecithin. Journal of Visualized Experiments. (97), e52679 (2015).
- Birgbauer, E., Rao, T. S., Webb, M. Lysolecithin induces demyelination in vitro in a cerebellar slice culture system. Journal of Neuroscience Research. 78, 157-166 (2004).
- Fancy, S. P., et al. Axin2 as regulatory and therapeutic target in newborn brain injury and remyelination. Nature Neuroscience. 14 (8), 1009-1016 (2011).
- Yuen, T. J., et al. Identification of endothelin-2 as an inflammatory factor that promotes CNS remyelination. Brain. 136, 1035-1047 (2013).
- Yuen, T. J., et al. Oligodendrocyte-encoded HIF function couples postnatal myelination and white matter angiogenesis. Cell. 158 (2), 383-396 (2014).
- Stokes, C. E., Murphy, D., Paton, J. F., Kasparov, S. Dynamics of a transgene expression in acute rat brain slices transfected with adenoviral vectors. Experimental Physiology. 88, 459-466 (2003).
- Dillenburg, A., et al. Activin receptors regulate the oligodendrocyte lineage in health and disease. Acta Neuropathologica. 135 (6), 887-906 (2018).
- Dean, J. M., et al. An organotypic slice culture model of chronic white matter injury with maturation arrest of oligodendrocyte progenitors. Molecular Neurodegeneration. 6, 46 (2011).
- Zhang, H., Jarjour, A. A., Boyd, A., Williams, A. Central nervous system remyelination in culture--a tool for multiple sclerosis research. Experimental Neurology. 230 (1), 138-148 (2011).
- Hill, R. A., Medved, J., Patel, K. D., Nishiyama, A. Organotypic slice cultures to study oligodendrocyte dynamics and myelination. Journal of Visualized Experiments. (90), e51835 (2014).
- Sherafat, A., Hill, R. A., Nishiyama, A. Organotypic Slice Cultures to Study Oligodendrocyte Proliferation, Fate, and Myelination. Molecular Biology (Clifton, N.J.). 1791, 145-156 (2018).
- Croft, C. L., Noble, W. Preparation of organotypic brain slice cultures for the study of Alzheimer's disease. F1000Research. 7, 592 (2018).
- Nasrabady, S. E., Rizvi, B., Goldman, J. E., Brickman, A. M. White matter changes in Alzheimer's disease: a focus on myelin and oligodendrocytes. Acta Neuropathologica Communications. 6 (1), 22 (2019).
- Flynn, S. W., et al. Abnormalities of myelination in schizophrenia detected in vivo with MRI, and post-mortem with analysis of oligodendrocyte proteins. Molecular Psychiatry. 38, 811-820 (2003).
- Thetiot, M., Ronzano, R., Aigrot, M. S., Lubetzki, C., Desmazières, A. Preparation and Immunostaining of Myelinating Organotypic Cerebellar Slice Cultures. Journal of Visualized Experiments. (145), e59163 (2019).
- Gerlach, J., Donkels, C., Münzner, G., Haas, C. A. Persistent Gliosis Interferes with Neurogenesis in Organotypic Hippocampal Slice Cultures. Frontiers in Cellular Neuroscience. 10, 131 (2016).
- Reich, D. S., Lucchinette, C. F., Calabresi, P. A. Multiple Sclerosis. New England Journal of Medicine. 378 (2), 169-180 (2018).
- Jeffery, N. D., Blakemore, W. F. Locomotor deficits induced by experimental spinal cord demyelination are abolished by spontaneous remyelination. Brain. 120, 27-37 (1997).
- Emery, B., Dugas, J. C. Purification of oligodendrocyte lineage cells from mouse cortices by immunopanning. Cold Spring Harbor Protocols. , 854-868 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved