Method Article
소뇌 절편 배양에서의 생체 외 수초화 및 재수초화(Ex vivo Myelination and Remyelination in Cerebellar Slice Cultures)는 발달 및 질병 관련 조작을 위한 정량적 모델로서의 것입니다.
요약
제시된 프로토콜은 마우스 소뇌 절편 배양을 사용한 탈수초화 및 재수초화의 생체 외 정량적 모델에 대한 프로토콜입니다. 이 방법은 in vitro 시스템의 화학적, 유전적, 환경적 특성을 유지하면서 온전한 조직에서 CNS 세포 유형을 완전히 보완하는 in vivo 모델을 면밀히 요약합니다.
초록
in vitro 및 in vivo 수초화를 연구하는 것은 수많은 도전 과제를 안고 있습니다. in vitro에서 희소돌기아교세포 전구세포(OPC)의 분화는 확장 가능하지만 축삭 수초화를 재현하지는 않습니다. OPC-뉴런 공동 배양 및 OPC-섬유 배양은 체외 수초화를 검사할 수 있지만 성상세포 및 미세아교세포와 같은 생체 내에 존재하는 추가 세포 유형이 없습니다. 그러나 생체 내 마우스 모델은 화학적, 환경적, 유전자 조작에 덜 순응하고 훨씬 더 노동 집약적입니다. 여기에서는 1) 발달 수초화 연구, 2) 탈수초 및 재수초화 모델링, 3) 중개 연구 수행에 유용한 생체 외 마우스 소뇌 절편 배양(CSC) 정량 시스템에 대해 설명합니다. 소뇌와 후뇌의 시상면절편은 출생 후 일(P) 0-2 마우스와 분리된 후 12일 동안 생체 외에서 수초화됩니다. 이 기간 동안 발달 수초화에 대한 효과를 테스트하기 위해 화합물을 추가하는 것을 포함하여 다양한 방법으로 슬라이스를 조작할 수 있습니다. 또한 전자 현미경을 사용하여 조직을 고정하여 수초의 미세 구조 및 압축을 평가할 수 있습니다. 질병을 모델링하기 위해 CSC는 급성 저산소증을 가하여 저수초화를 유도할 수 있습니다. 이러한 외식에서의 탈수초화는 또한 리솔레시틴에 의해 유도될 수 있으며, 이를 통해 재수초화를 촉진하는 요인을 식별할 수 있습니다. 화학적 및 환경적 변형 외에도 CSC는 형질전환 마우스에서 분리할 수 있으며 Ad-Cre 아데노바이러스 및 타목시펜으로 유도된 유전자 조작에 반응합니다. 따라서 소뇌 절편 배양은 수초화를 재현하기 위한 빠르고 재현 가능하며 정량화 가능한 모델입니다.
서문
축삭돌기의 수초화는 활동 전위의 빠른 전파를 가능하게 하며, 이는 염분 전도1로 알려진 메커니즘입니다. 미엘린의 중요성은 다발성 경화증(MS)과 같은 탈수초성 질환에 의해 강조되며, 여기에는 시력 상실, 인지 문제 및 마비를 포함한 광범위한 쇠약 증상이 포함됩니다. 다발성경화증에 대한 치료법은 없으며, 현재의 치료법은 말초 면역 세포를 표적으로 삼아 질병 진행을 제한하는 데 초점을 맞추고 있습니다. 다발성경화증 및 관련 질병의 장애는 재수초화(remyelination) 실패와 진행성 신경퇴행(progressive neurodegeneration)에 의해 유발되는 것으로 생각됩니다. 특히, 탈수초, 위축 및 축삭 소실은 진행성 MS 2,3에서 관찰됩니다. 따라서 재수초화를 촉진하는 것은 현재 치료법과 병행하여 수행할 수 있고 추가적인 치료 이점을 얻을 수 있는 유망한 전략을 나타냅니다.
중추신경계(CNS)에서 수초화는 희소돌기아교세포(oligodendrocyte)로 알려진 특수 신경교세포에 의해 수행됩니다. 희소돌기아교세포 전구세포(OPC)는 축삭돌기와 접촉하는 돌기의 성장, 형태학적 복잡성의 증가, 수초막의 확장, 마지막으로 수초초 압축4를 포함하여 일련의 고도로 조정된 단계를 통해 성숙한 수초돌기아교세포로 분화합니다. 따라서 희소돌기아교세포와 뉴런 사이의 상호 작용은 매우 밀접합니다. 뉴런과 희소돌기아교세포 사이의 상호 상호작용은 또한 CNS의 건강과 유지를 위해 필요합니다2. 축삭 활동은 수초화를 자극하는 역할을 하며 신경교신경 영양 인자는 뉴런의 무결성을 지원합니다. 중추신경계에서 신경교세포(glia-glia crosstalk)의 중요성도 점점 더 인식되고 있습니다 5,6,7,8. 예를 들어, 성상세포 인자는 OPC의 분화와 백질 관의 유지에 영향을 미칠 수 있습니다. 미세아교세포는 또한 OPC 분화를 조절하고 재수초화 과정의 중요한 단계인 미엘린 파편을 제거하는 역할을 합니다. 세포 자율 인자를 확인하고 탈수초 및 재수초화에 대한 다른 CNS 세포 유형의 영향을 이해하는 것은 탈수초성 및 수초성 질환에 대한 치료법을 개발하는 데 매우 중요할 것입니다.
여기에서는 온전한 CNS 조직의 조작 및 정량화를 가능하게 하는 마우스 소뇌 절편 배양(CSC)을 사용하는 생체 외 시스템에 대해 설명합니다. CSC를 사용하면 리솔레시틴 9,10에 의한 탈수초 유도 후 수초화 또는 재수초화를 면역염색 및 전자 현미경 11,12,13과 같은 생체 내 연구에서 전통적으로 사용되는 방법을 사용하여 측정할 수 있습니다. 리솔레시틴(Lysolecithin)은 수초(myelin)와 희소돌기아교세포(oligodendrocyte)의 급격한 소실을 초래하는 막을 파괴하는 화학 물질입니다. 주목해야 할 잠재적인 주의 사항은 리솔루시틴이 병변 부위에 가까운 다른 세포 유형을 감소시킬 수도 있다는 것입니다. 그러나 생체 내 실험과 달리 소뇌의 시상 절편은 화합물을 첨가하여 쉽게 조작하거나 Ad-Cre 아데노바이러스를 사용하여 유전적으로 변형할 수 있습니다. 이 방법은 또한 형질전환 마우스 또는 저산소 증11 , 12 , 13 , 14와 같은 환경 모욕을받은 마우스에서 분리 된 조직을 조작 할 수 있습니다. 따라서 CSC 모델은 발달 수초화, 질병 모델링 및 수초화를 촉진하거나 억제하는 요인의 식별에 대한 연구를 가능하게 하는 동시에 희소돌기아교세포 기능에 대한 다양한 CNS 세포 유형의 기여를 통합합니다.
프로토콜
모든 동물 연구는 Genentech 기관 동물 관리 및 사용 위원회의 승인 및 승인을 받았습니다.
1. 해부를 위한 매체 및 물품 준비 (~30–45분)
- 표 1에 설명된 대로 필터 슬라이스 배양 배지(SCM) 및 해부 배지(DM)를 준비하고 멸균합니다. 4 °C에서 보관하십시오. 수초화 분석에 대해 테스트 중인 요인이 있는 경우 사용 직전에 SCM에 추가하십시오.
- 1mL의 SCM을 6웰 플레이트의 각 웰에 피펫팅합니다.
- 멸균 겸자를 사용하여 각 웰에 유기형 삽입물을 배치하여 멤브레인 아래에 기포가 갇히지 않도록 합니다. 37% CO7.5 인큐베이터에서 2°C의 매체로 플레이트를 가열합니다.
2. 해부 구역 준비 (~5–10분)
- 멸균 층류 후드 또는 벤치탑에서 절차의 모든 단계에 대해 적절한 무균 기술을 사용하여 절차를 수행합니다. 70% 에탄올로 모든 부분을 깨끗이 닦습니다.
- 새 블레이드와 실리콘 절단 s를 놓습니다.tage 조직 초퍼에. 절단 단계 아래에 ~300 μL의 멸균수 또는 70% 에탄올을 피펫팅하여 제자리에 고정되도록 합니다.
- 면봉을 사용하여 티슈 다지기 날과 절단 단계를 70% 에탄올로 부드럽게 닦습니다. 티슈 초퍼를 사용하기 전에 건조시키십시오.
- 모든 해부 도구에 70% 에탄올을 뿌리고 해부 전에 건조시킵니다.
- 10cm 페트리 접시 2개를 준비합니다: 하나는 15-20mL의 DM이 있는 접시, 다른 하나는 10mL의 SCM이 있는 접시입니다. 얼음에 보관하세요. 해부하지 않을 때는 모든 미디어와 페트리 접시를 얼음 위에 보관하십시오.
3. 소뇌 절편 배양 박리 (강아지당 ~15-20분)
- DM이 있는 페트리 접시를 해부 현미경에 놓습니다.
- 생후 P0-2 날 새끼 쥐를 날카로운 가위로 재빨리 참수하여 안락사시킵니다.
- 해부 현미경 아래에 DM이 있는 페트리 접시에 머리를 넣어 피를 맑게 합니다.
- 가는 가위를 사용하여 두개골 기저부의 각 측면 가장자리를 한 번씩 자릅니다.
- DM에서 머리를 거꾸로 놓고 #5/45 집게를 사용하여 두개골 아래쪽을 단단히 눌러 손상되지 않은 뒷뇌를 두개골의 구멍으로 밀어 넣습니다.
- 해부 현미경 아래에서 두 개의 #11 메스를 사용하여 여분의 조직을 잘라냅니다. 소뇌가 후뇌의 기본 부분에 붙어 있는지 확인합니다. 자세한 다이어그램은 그림 1A 를 참조하십시오.
- 주걱을 사용하여 소뇌를 조직 다지기의 절단 단계로 옮기고 조직은 뒷뇌의 상부 면에 놓이고 뒷뇌의 꼬리 얼굴은 연구원을 향하게 합니다. 뇌의 내측면이 조직 다지기 블레이드와 정확히 평행한지 확인하십시오.
- P200 피펫을 사용하여 조직 주변의 과도한 매체를 제거하여 조직이 여전히 촉촉하지만 뜨거나 액체로 둘러싸여 있지 않은지 확인합니다.
- DM이 포함된 페트리 접시를 해부 현미경으로 SCM이 포함된 페트리 접시로 바꿉니다.
- 조직 다지기를 사용하여 조직을 350μm 두께의 조각으로 자릅니다.
참고: 최적의 절단 조건을 보장하기 위해 블레이드 속도(예: 대략 초당 1회 절단)와 힘을 최적화해야 합니다. 드문 경우지만 조직이 칼날에 걸릴 수 있습니다. 조직 부분의 손실을 최소화하려면 엄지 손가락을 전원 버튼에 대고 필요한 경우 조직 다지기 도구를 빠르게 끄십시오. - 조직 아래에 100μL의 SCM을 부드럽게 피펫팅하여 슬라이스가 떠오르도록 합니다. 주걱을 사용하여 얇게 썬 조직을 해부 현미경으로 SCM을 사용하여 페트리 접시로 옮깁니다.
- 면봉을 사용하여 티슈 다지기 날과 절단 단계를 70% 에탄올로 부드럽게 닦습니다.
- 메스(뭉툭한 면)를 사용하여 해부 현미경 아래에서 조각을 부드럽게 분리합니다. 메스와 주걱을 사용하여 SCM이 있는 6웰 플레이트의 멤브레인으로 슬라이스를 옮깁니다.
참고: 가장 내측 절편은 종종 가장 좋은 수초화와 조직 무결성을 갖습니다. 평균적으로 한 개의 마우스 뇌에서 4-6개의 슬라이스를 해부할 수 있습니다. - 37 ° C의 SCM에서 7.5 % CO2 로 슬라이스를 배양합니다.
4. 문화와 미디어의 변화 (~15–30분)
- SCM을 격일로 교체하십시오.
- 새로운 6웰 플레이트의 각 웰에 1mL의 신선한 배지를 피펫팅하고 인큐베이터에서 데웁니다. 멸균 겸자를 사용하여 멤브레인을 새 플레이트로 옮기고 아래에 기포가 없는지 확인합니다. 플레이트를 인큐베이터에 다시 넣습니다.
5. 표준 수초화 및 재수초화
- 표준 수초화 프로토콜(그림 1B).
- 섹션 3에서 0-12일 동안 체외(DIV)로 해부된 배양 조각. 수초화에 대한 요인의 영향을 테스트하고 있는 경우 배양 시 배지(0 DIV)에 추가하고 각 배지 변경으로 보충합니다.
- 불완전한 수초화 11,12,13에 최적화된 시점인 12 DIV(7.1단계)에서 수정합니다. 이를 통해 배지에 추가된 인자로 인한 수초화에 대한 모든 강화 또는 차단 효과를 감지할 수 있습니다. 100ng/mL Activin A를 첨가한 대표적인 양성 결과가 그림 2에 나와 있습니다.
- 재수초화 프로토콜(그림 1C)
- 슬라이스가 완전히 수초화되는 시점인 11,12,13인 14 DIV까지 추가 요인 없이 섹션 5.1에 설명된 표준 수초화 프로토콜을 따릅니다.
- 표 1에 설명된 대로 리솔레시틴 스톡(125mg/mL)을 준비합니다. SCM의 0.5% 리솔레시틴 1mL를 새 6웰 플레이트의 각 웰에 피펫팅하고 인큐베이터에서 따뜻하게 합니다.
- 멤브레인을 리솔레시틴 플레이트로 옮기고 인큐베이터에 하룻밤 동안 16-18시간 동안 놓습니다.
- 다음날, 새로운 SCM으로 새 플레이트를 준비하고 필요한 경우 재수초 효과에 대해 테스트 중인 인자를 추가합니다. 인큐베이터에서 접시를 따뜻하게 합니다.
- 배지를 교체하려면 웰 측면의 멤브레인을 부드럽게 두드려 모든 리솔레시틴 배지가 제거되었는지 확인합니다. 각 매체 교체 시 테스트 중인 계수를 보충합니다(섹션 4).
- 불완전한 재수초화에 최적화된 시점인 28 DIV에서 슬라이스를 수정합니다(7.1단계). 이를 통해 배지에 추가된 인자로 인한 재수초화의 향상 또는 차단을 감지할 수 있습니다. 0.1μM XAV939를 첨가한 대표적인 양성 결과가 그림 3에 나와 있습니다.
6. 수초화 및 재수초 프로토콜의 변형
- 저산소증 유도 저수초 형성 프로토콜(그림 1D)11,13.
참고: 이것은 섹션 5.1에 제시된 표준 수초화 프로토콜의 변형으로 제공됩니다.- 요인이 없는 SCM의 플레이트 슬라이스.
- 슬라이스 플레이트를 저산소 인큐베이터(2% FiO2)로 24-3 DIV 사이에 24시간 동안 옮깁니다.
- 다음 날, 새로운 SCM으로 새 플레이트를 준비하고 필요한 경우 수초화 가능성에 대해 테스트 중인 인자를 추가합니다. 인큐베이터에서 접시를 따뜻하게 합니다.
- 저산소증에서 배양 후 배지를 변경하고(섹션 4) 배양을 표준 배양 인큐베이터(37°C, 7.5% CO2)로 되돌립니다. 각 후속 미디어 변경으로 테스트 중인 모든 요소를 보충합니다(섹션 4).
- 12 DIV에서 수정합니다(7.1단계).
- 유전자 조작 프로토콜(그림 1E)13
- 섹션 3에서와 같이 해부를 위해 형질전환 마우스에서 조직을 분리합니다.
- 유도성 형질전환 마우스 라인의 경우, 타목시펜(100 nM, 수초화 또는 OPC 분화를 유도하지 않는 용량) 또는 Ad-Cre 아데노바이러스를 1 DIV 및 3 DIV에서 수행되는 배지 변경 중에 SCM에 추가할 수 있습니다.
- 타목시펜 또는 Ad-Cre 아데노바이러스를 사용한 유전자 조작 후 섹션 4와 같이 격일로 배지 변경을 계속합니다(필요한 경우 인자 추가).
참고: 한 마우스의 모든 절편이 하나의 멤브레인에 맞기 때문에 해부 후 유전형 분석이 가능하므로 형질전환 마우스로 실험을 간단하게 수행할 수 있습니다.
7. 조직 가공 및 분석
- 실온(RT)에서 4시간 동안 멤브레인을 1% 파라포름알데히드에 부드럽게 담가 슬라이스를 고정합니다.
- 인산염 완충 식염수(PBS)에 담가 부드럽게 헹굽니다. 그런 다음 6웰 플레이트에 PBS를 담그십시오.
참고: 여기에서 프로토콜을 일시 중지할 수 있습니다. 고정 슬라이스는 4°C의 PBS에 최대 한 달 동안 보관할 수 있습니다. 슬라이스를 보관하지 않는 경우 계속하기 전에 PBS에서 2회 헹굽니다. - 메스를 사용하여 링에서 멤브레인을 잘라내고 6웰 플레이트에서 염색을 진행합니다. 얼룩을 묻히고 슬라이드에 장착할 수 있도록 슬라이스를 위(멤브레인 쪽이 아래로)를 향하도록 하십시오.
- 블록 용액(3% 열 불활성화 말 혈청, 2% 소 혈청 알부민 및 PBS에 희석된 0.25% Triton-X 100)에서 RT에서 1시간 동안 블록합니다.
참고: 항체 염색을 위해 항원 회수가 필요한 경우(예: CC1/Olig2) 유리 페트리 접시에서 수행할 수 있습니다. - 플레이트를 파라핀 필름으로 감싸고 차단 용액에 희석된 1차 항체에서 4°C에서 밤새 배양합니다.
- 블로킹 용액으로 3회 세척: 1) 짧은 헹굼, 2) 15분 세척, 3) 1시간 세척. 간단한 헹굼을 위해 작은 페트리 접시에 용액을 채우고 새 용액으로 옮기기 전에 집게를 사용하여 멤브레인을 부드럽게 담그십시오. 더 긴 세척(즉, 15분 및 1시간)을 위해 멤브레인을 6웰 플레이트에 용액에 담그고 부드러운 로커에 놓습니다.
- PBS에서 1:500으로 희석된 2차 항체에서 RT에서 2시간 동안 빛으로부터 덮인 채로 배양합니다.
- PBS로 3회 세척: 1) 짧은 헹굼, 2) 15분 세척, 3) 1시간 세척.
- DAPI 염색이 필요한 경우 RT에서 1:1,000 DAPI 용액에 7분 동안 담그고 간단히 헹구고 PBS에서 15분 동안 세척합니다.
- 이중 증류수로 헹굽니다.
- 슬라이스가 위를 향하도록 슬라이드에 멤브레인을 장착합니다(멤브레인 면이 아래를 향하게).
참고: 장착된 슬라이스는 4°C에서 보관할 수 있습니다. 컨포칼 현미경을 통한 이미징은 멤브레인이 불투명해지고 이미징이 어려워지기 전인 1주일 이내에 완료하는 것이 가장 좋습니다. - 컨포칼 현미경을 사용하여 이미지를 슬라이스하고 앞에서 설명한 대로 정량화합니다 11,12,13.
결과
P0-2 마우스(그림 1A)에서 유래한 소뇌 절편 배양을 사용하여 수초화를 연구하고 0-12 DIV(그림 1B)의 다양한 요인 추가의 효과를 평가했습니다. 재수초화를 연구하기 위해 14 DIV의 슬라이스 배양물을 먼저 리솔레시틴으로 탈수초화하고 테스트된 인자(그림 1C)로 배양에서 14일 동안 추가로 재수초화한 후 재수초화를 정량화했습니다. 수초화에 대한 저산소증의 영향은 또한 2-3 DIV에서 24시간 동안 2% FiO2 저산소 인큐베이터에 슬라이스 배양액을 배치하여 연구되었습니다(그림 1D). 마지막으로, 형질전환 마우스에서 유래한 슬라이스 배양물을 사용하여 수초화에 대한 유전자 녹아웃의 효과를 연구했습니다. 이 시스템에서는 1 DIV 및 3 DIV에서 타목시펜 또는 Ad-Cre 아데노바이러스를 첨가하여 Cre 재조합을 유도하고, 12 DIV에서 분석을 위해 고정된 절편 배양물을 주입했습니다(그림 1E). 조직을 고정한 후, 면역염색(그림 2, 그림 3) 및 전자 현미경 11,12,13을 통해 탈수초화 및 재수초화의 정량화를 수행했습니다.
표시된 대표적인 데이터(그림 2, 그림 3)는 슬라이스 배양에서 수초화 및 재수초화의 동적 범위를 보여줍니다. 수초화 지수는 소형 미엘린의 간접 판독인 파라노드 마커인 Caspr과 축삭을 염색하는 신경필라멘트 단백질 H(NFH)의 비율로 정량화되었습니다. 이 수초화 지수는 전자 현미경 검사와 나트륨 채널 염색12에 의해 조밀한 미엘린의 형성을 나타내는 것으로 검증되었습니다. 리솔레시틴에 의한 탈수초화 9,10은 Caspr-양성 파라노드의 완전한 소실(수초화 지수 = 0, 그림 3A)과 재수초화 11,12 동안 회복된 소형 미엘린의 소실을 초래했습니다.
수초화에 대한 긍정적인 결과를 입증하기 위해, 그림 1B의 타임라인에 따라 Activin A로 슬라이스를 배양했습니다. Activin A는 희소돌기아교세포의 활성체 수용체와 결합하여 희소돌기아교세포 분화 및 미엘린 압축을 유도합니다15. 대표적인 데이터는 수초화 중 100ng/mL의 Activin A로 절편을 처리하면 수초화 지수가 더 높아진다는 것을 보여줍니다(그림 2A, B). 이와 일관되게 Activin A 처리는 Olig2+ 희소돌기아교세포 계통 세포에 대한 CC1 양성 성숙 희소돌기아교세포의 비율로 정량화된 바와 같이 OPC 분화를 가속화했습니다11,13(그림 2C, D).
탱키라제(Tankyrase)의 소분자 억제제인 XAV939는 희소돌기아교세포(oligodendrocyte)에서 액신2(Axin2) 수치를 안정화하여 수초화(myelination) 및 재수초화(remyelination)를 촉진하는 것으로 나타났습니다11. 리솔레시틴 처리 후, 단편화된 미엘린 염기성 단백질(MBP) 염색 및 Caspr 양성 파라노드의 결핍에 의해 슬라이스 배양에서 탈수초화가 시각화되고 정량화되었습니다(그림 3A). 재수초화(15-28 DIV) 중 0.1μM XAV939를 사용한 처리는 Caspr 대 NFH 염색의 비율로 정량화한 바와 같이 차량 대조군에 비해 수초화 지수를 유의하게 증가시켰습니다(그림 3B, C). 따라서 슬라이스 배양 모델은 온전한 조직에서 OPC 분화, 수초화 및 재수초화에 미치는 영향을 조사하고 정량화하는 데 사용할 수 있습니다.
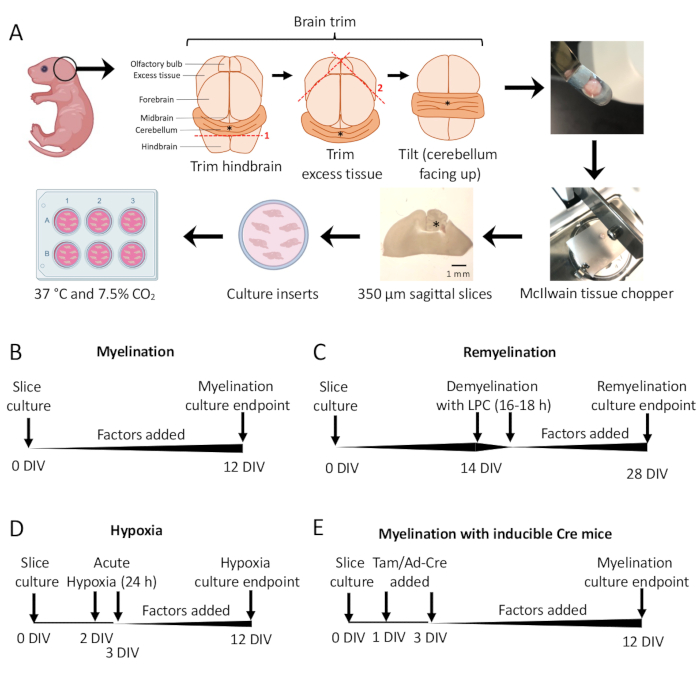
그림 1: 소뇌 절편 배양의 개략도는 해부 과정의 주요 단계와 다양한 절편 배양 프로토콜에 대한 타임라인을 보여줍니다. (A) 슬라이스 배양을 생성하는 단계 설명: P0-2 마우스 새끼의 뇌 해부, 뇌 트리밍(그림 참조), 조직 다지기로 뇌를 절단하여 350μm 시상 슬라이스 생성, 6웰 접시의 유기형 배양 삽입물에 슬라이스 배치, 37°C 및 7.5% CO2에서 배양. *는 소뇌를 나타냅니다. (B) 수초화 슬라이스 배양에 대한 타임라인. 슬라이스 배양액은 분석을 위해 고정하기 전에 12일 동안 배양했습니다. (C) 슬라이스 배양을 재수초화하기 위한 타임라인. 절편을 완전한 탈수초화를 유도하기 위해 16-18시간 동안 14DIV에서 리솔레시틴으로 처리하고, 분석을 위해 고정하기 전에 28DIV까지 재수초화하도록 하였다. (D) 저산소성 모욕에 따른 수초화 타임라인. 절편은 2-3 DIV 사이에 24시간 동안 급성 저산소성 모욕에 노출되었으며, 이는 저수초화를 일으켰습니다. (E) 유전자 변형 마우스의 CSC 타임라인. 유전자 변형을 유도하기 위해 1 DIV 및 3 DIV에 타목시펜(Tam, 100nM) 또는 Ad-Cre 바이러스를 첨가하고, 12 DIV에서 절편을 분석했다. 타임라인 다이어그램은 이전 간행물11,13에서 채택되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
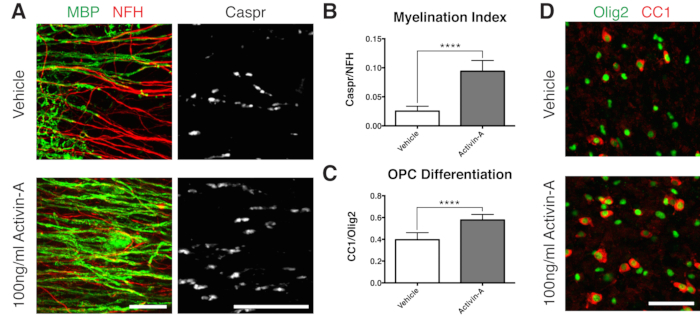
그림 2: Activin A가 수초화 및 OPC 분화를 촉진한다는 것을 보여주는 대표적인 데이터. (A) 100ng/mL Activin A 처리로 수초화(MBP) 및 파라노드(Caspr) 증가, 슬라이스 배양물의 면역 염색으로 나타남. (B) 수초화 지수의 정량화(Caspr+ 파라노드에 대해 염색된 면적과 NFH+ 축삭돌기에 대해 염색된 면적의 비율). (C) OPC 분화의 정량화(CC1+ 희소돌기아교세포와 Olig2+ 희소돌기아교세포 계통 세포의 비율). (D) CC1/Olig2 염색의 대표 이미지. 표시된 값은 평균 + 표준 편차입니다. P < 0.0001; 짝을 이루지 않은 T-검정. 스케일 바: A = 25 μm, D = 50 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
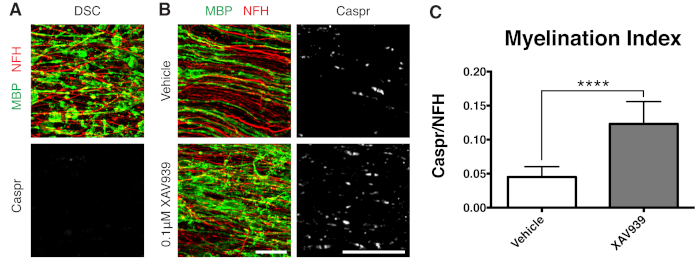
그림 3: XAV939가 재수초화를 촉진한다는 것을 보여주는 대표적인 데이터. (A) 리솔레시틴으로 처리된 슬라이스 배양에서 단편화된 MBP 염색에 의한 탈수초 및 Caspr 파라노드의 결핍을 보여주는 이미지. (B) 슬라이스 배양물의 면역 염색에 의해 나타난 리솔레시틴 유도 탈수초화 후 0.1μM XAV939 처리로 재수초화(MBP) 및 파라노드(Caspr)의 증가. (C) 수초화 지수의 정량화(Caspr+ 파라노드에 대해 염색된 면적과 NFH+ 축삭돌기에 대해 염색된 면적의 비율). 표시된 값은 평균 + 표준 편차입니다. P < 0.0001; 짝을 이루지 않은 T-검정. 눈금자 = 25μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 슬라이스 배양 배지(SCM) | |
| 음량 | 시약 |
| 100 밀리리터 | 최소 필수 매체 (MEM), HEPES, 글루타민 없음 |
| 50 밀리리터 | 열 비활성화 호스 세럼 |
| 50 밀리리터 | 얼의 균형 잡힌 소금 용액 |
| 2 mL | 페니실린-스트렙토마이신 10,000 U/mL |
| 2 mL | 글루타맥스 보충제 |
| 2888 마이크로L | 45% 포도당 용액 |
| 1 mL | 곰팡이 구역 |
| 0.22μm 필터를 통해 멸균 필터를 만들고 4°C 냉장고에 최대 2주 동안 보관합니다. | |
| 해부 매체(DM) | |
| 음량 | 시약 |
| 100 밀리리터 | MEM, HEPES, 얼의 소금 함유 |
| 1 mL | 페니실린-스트렙토마이신 10,000 U/mL |
| 0.22μm 필터를 통해 멸균 필터를 사용하고 4°C 냉장고에 최대 2개월 동안 보관합니다. | |
| 리솔레시틴 스톡(125mg/mL) | |
| 분량 | 시약 |
| 100의 mg의 | 리솔레시틴 |
| 0.8 밀리리터 | 멸균 PBS |
| 100mg의 리솔레시틴을 0.8mL의 멸균 PBS에 용해시킵니다. 80μL의 원액 분취액을 -20°C에서 보관합니다. | |
| 사용하기 전에 80μL 분취액을 해동하고 37°C, 7.5% CO2 인큐베이터에서 예열한 20mL의 SCM(SCM의 경우 0.5% 리솔레시틴)에 용해시킵니다. 필요한 경우 리솔레시틴을 SCM으로 용해시키는 와류. | |
표 1: 슬라이스 배양 배지(SCM), 해부 배지(DM) 및 리솔레시틴 용액을 만들기 위한 구성 요소 및 프로토콜 목록.
토론
이 프로토콜은 in vitro 모델의 단순성으로 in vivo 세포 구성을 재현하는 유기형 소뇌 절편 배양 모델을 설명합니다. 이 프로토콜은 인간 병리학의 보다 대표적인 모델이 되기 위해 더욱 개발될 수 있습니다. CSC는 힘에 의한 조직 손상, 미엘린 특이적 항체에 의해 유발된 손상 또는 말초 면역 세포의 추가에 의한 다발성 경화증의 희소돌기아교세포 손상과 같은 질병 특이적 손상에 대한 모델로 잠재적으로 개발될 수 있습니다. 이 프로토콜은 또한 뇌의 다른 부분과 척수의 다른 부분에서 절개된 조직에 최적화될 수 있습니다16,17. 이 프로토콜은 수초화의 조직학적 정량화에 중점을 두는 반면, CSC는 다양한 실험 종점을 검사하기 위한 편리한 모델을 나타냅니다. 이러한 배양은 단일 세포 RNA 염기서열 분석을 통해 다양한 세포 유형을 특성화하고, 전자 현미경을 통해 축삭 및 미엘린 수초의 미세 구조를 평가하고, 타임 랩스 이미징을 수행하여 OPC 역학을 연구하는 데 사용할 수 있습니다. 면역염색은 또한 형질전환 마우스 리포터 라인18,19를 사용하여 우회할 수 있습니다. 마지막으로, 새끼 생쥐의 나이, 배양 시간 또는 절편의 두께가 다르면 CSC를 조정하여 다양한 질병 메커니즘을 모델링할 수 있습니다 10,17,18,19,20,23.
Slice 배양은 수초화(myelination) 및 재수초화(remyelination)에 영향을 미치는 요인을 테스트하고 정량화하는 데 이상적이지만, 특정 상황에서 CNS를 표현하는 데는 한계가 있습니다. P 0-2 뇌에서 파생된 CSC는 발달 초기 뇌에서 유래하며 노화 또는 신경 퇴행성 뇌와 유사성이 제한적입니다. 알츠하이머병21 및 정신분열증22와 같은 중추신경계 질환에서 미엘린의 중요성에 대한 인식이 높아짐에 따라 수초화를 정량화하고 특성화하는 성인 또는 노화 모델이 필요합니다. 더 오래된 설치류에서 조직을 분리하는 다른 프로토콜이 발표되었지만 여전히 발달 단계에 있습니다 10,18,19,23. 또한, 소뇌의 희소돌기아교세포(oligodendrocyte) 및 OPC는 뇌의 척수 및 기타 백질관(spinal cable tract)과 비교하여 내재적 및 외인적 차이가 있을 수 있습니다. CSC는 또한 대규모 CRISPR 또는 저분자 스크리닝에 세포 기반 체외 시스템보다 적합하지 않습니다. 초기 조직 절단으로 인해, 뇌에 상주하는 선천성 면역 세포(즉, 미세아교세포와 성상세포)의 활성화도 있는데, 이는 시스템에 대한 중요한 경고이다24. 마지막으로, 말초 면역 세포는 다발성 경화증 병리학에서 큰 역할을 합니다25; CSC는 이러한 세포가 외인성으로 추가되지 않는 한 말초 세포가 없으므로 염증성 CNS 환경의 이상적인 모델이 아닙니다.
이 프로토콜의 해부 부분은 아마도 가장 중요할 것입니다. 박리 단계는 조직과 기본 구조를 손상시키지 않도록 최대한의 주의를 기울여 수행해야 합니다. 조직 초퍼 블레이드를 따라 뇌를 적절하게 정렬하면 조직과 세포의 손상을 최소화할 수 있습니다. 또한 절편을 주의 깊게 해부하고 분리하는 것뿐만 아니라 배양을 위해 막으로 옮기는 것도 중요합니다. 이 프로토콜에 설명된 기간은 설명된 연구에 맞게 최적화되었지만 다른 연구에서 최적의 결과를 얻으려면 조정해야 할 수도 있습니다. 이 프로토콜은 발달 수초화 및 수초 복구를 연구하고자 하는 사람들에게 유용할 것입니다.
참고로, 다발성경화증에 대한 치료법은 없습니다. 현재의 치료법은 적응면역계를 약화시키는 데 매우 효과적이지만, 현재의 어떤 치료법도 진행을 멈출 수는 없습니다. 재수초화(remyelination)의 실패와 그에 따른 신경퇴행은 다발성 경화증2의 진행의 기저에 있는 것으로 생각됩니다. 만성 다발성 경화증 병변에서 OPC가 존재한다는 것은 미엘린 복구의 실패가 OPC 분화의 정지에 기인할 수 있음을 시사합니다. CSC의 사용은 다발성 경화증의 진행을 역전시키고 기능을 회복하는 데 도움이 될 수 있는 미엘린 복구 요법에 대한 발견의 길을 열어줍니다. 미엘린 복구 요법은 또한 탈수초가 운동 기능을 억제하는 척수 손상 환자의 회복을 도울 수 있다26. 따라서 CSC의 중요성은 in vivo 동물 모델에 비해 상대적으로 높은 처리량 방식으로 포유류의 탈수초 및 재수초화에 영향을 미치는 요인을 식별하는 데 적합합니다. 많은 연구에서 분화에 영향을 미치는 화합물을 스크리닝하기 위해 1차 OPC를 사용했지만, 1차 OPC를 생성하고 분리하려면 힘들고 순차적인 면역판닝이 필요합니다27. 또한 세포 기반 분석은 생체 내에 존재하는 세포 유형의 다양성과 상호 작용을 요약하지 않습니다. 새끼 쥐에서 CSC를 생성하는 것은 값비싼 장비나 소모품이 필요하지 않은 수초화 및 재수초화를 연구하기 위한 빠르고 비용 효율적인 모델입니다. 따라서 소뇌 절편 배양은 체외 수초화를 재현하고 약물 발견 및 기초 과학 연구를 가능하게 하는 귀중한 정량적 모델을 나타냅니다.
공개
저자는 Roche Group의 계열사인 Genentech, Inc.의 직원입니다.
감사의 말
저자는 이 기사에 대한 건설적인 의견과 의견을 제시해 준 Yun-An Shen, Roxanne Kyauk, Chris Bohlen에게 감사의 뜻을 전합니다. 또한, 저자는 이전에 발표된 관련 방법론의 초기 개발에 대한 Charles ffrench-Constant, Andrew Jarjour, Veronique Miron 및 David Rowitch의 기여를 인정합니다 11,12,13.
자료
| Name | Company | Catalog Number | Comments |
| #5/45 Forceps | Fine Science Tools | 11251-35 | Dissection tools |
| 32% Paraformaldehyde | Electron Microscopy Sciences | 50-980-495 | Fixative for staining |
| 45% glucose solution | Sigma | G8769 | Slice culture media component |
| 6-well tissue culture plates | Corning | 3516 | Plates for cultures |
| Alexa Fluor Goat anti-chicken 647 | Thermo Fisher Scientific | A21449 | Secondary staining antibody |
| Alexa Fluor Goat anti-mouse 647 | Thermo Fisher Scientific | A21236 | Secondary staining antibody |
| Alexa Fluor Goat anti-rabbit 555 | Thermo Fisher Scientific | A11006 | Secondary staining antibody |
| Alexa Fluor Goat anti-rat 488 | Thermo Fisher Scientific | A21428 | Secondary staining antibody |
| Blades, Double-edge, PTFE coated Stainless steel | Ted Pella | 121-6 | Chopping blades |
| Bovine Serum Albumin (BSA) | Sigma | A9418 | Blocking solution component |
| Chicken anti-NFH antibody | Encor Biotech | CPCA-NF-H | Staining antibody |
| Confocal Microscope | Zeiss | LSM780 | Confocal for imaging |
| Corning 250 mL vacuum filter/storage bottle system, 0.22 µm pore | Corning | 431096 | For media preparation |
| Earl's balanced salt solution | Sigma | E2888 | Slice culture media component |
| Feather surgical blade | Feather | 2976#11 | Dissection tools |
| Fungizone | Thermo Fisher Scientific | 15290-18 | Dissection media component |
| GlutaMAX supplement | Thermo Fisher Scientific | 35050-061 | Slice culture media component |
| Heat-inactivated horse serum | Thermo Fisher Scientific | 26050-88 | Slice culture media component |
| Lysolecithin | Sigma | L4129 | |
| Lysophosphatidylcholine from egg yolk | Sigma | L4129 | To induce demyelination |
| McIlwain Tissue Chopper | Ted Pella | 10180 | Tissue chopper |
| MEM, Hepes, no glutamine | Thermo Fisher Scientific | 12360-038 | Slice culture media component |
| MEM, Hepes, with Earle's salts | Sigma | M7278 | Dissection media component |
| Metal spatula | Fisher Scientific | 470149-442 | Dissection tools - bend flat end at angle for use |
| Millicell Culture Plate Insert 30mm Organotypic PTFE | Fisher | PICM0RG50 | Culture insert |
| Mouse anti-CC1 antibody | Millipore | OP80-100UG | Staining antibody |
| Noyes spring scissors | Fine Science Tools | 15012-12 | Dissection tools |
| PBS pH 7.4 | Gibco | 10010023 | For dilution of fixative |
| Penicillin-streptomycin 10,000U/mL | Thermo Fisher Scientific | 15140-122 | Slice culture media component |
| Rabbit anti-Caspr antibody | Abcam | ab34151 | Staining antibody |
| Rabbit anti-Olig2 antibody | Millipore | AB9610 | Staining antibody |
| Rat anti-MBP antibody | Serotec | MCA409S | Staining antibody |
| Scalpel handle #3 | Fine Science Tools | 10003-12 | Dissection tools |
| Silicone rubber foam sheet | MSC Industrial Direct Co | 31939176 | Cutting base |
| Stereo Microscope | Olympus Life Sciences | SZ61 | Microscope for dissection |
| Student surgical scissors | Fine Science Tools | 91401-12 | Dissection tools |
참고문헌
- Purves, D., Augustine, G. J., Fitzpatrick, D. Increased Conduction Velocity as a Result of Myelination. Neuroscience 2nd edition. , (2001).
- Dutta, R., Trapp, B. D. Mechanisms of neuronal dysfunction and degeneration in multiple sclerosis. Progress in Neurobiology. 93 (1), 1-12 (2011).
- Trapp, B. D., Nave, K. A. Multiple sclerosis: an immune or neurodegenerative disorder?. Annual Review of Neuroscience. 31, 247-269 (2008).
- Bradl, M., Lassmann, H. Oligodendrocytes: biology and pathology. Acta Neuropathologica. 119 (1), 37-53 (2010).
- Domingues, H. S., Portugal, C. C., Socodato, R., Relvas, J. B. Oligodendrocyte, Astrocyte, and Microglia Crosstalk in Myelin Development, Damage, and Repair. Frontiers in Cell and Developmental Biology. 4, 71 (2016).
- Nave, K. A., Werner, H. B. Myelination of the nervous system: mechanisms and functions. Annual Review of Cell and Developmental Biology. 30, 503-533 (2014).
- Franklin, R. J. M., Ffrench-Constant, C. Regenerating CNS myelin – from mechanisms to experimental medicines. Nature Reviews Neuroscience. 18 (12), 753-769 (2017).
- Molina-Gonzalez, I., Miron, V. E. Astrocytes in myelination and remyelination. Neuroscience Letters. 713, 134532 (2019).
- Keough, M. B., Jensen, S. K., Yong, V. W. Experimental demyelination and remyelination of murine spinal cord by focal injection of lysolecithin. Journal of Visualized Experiments. (97), e52679 (2015).
- Birgbauer, E., Rao, T. S., Webb, M. Lysolecithin induces demyelination in vitro in a cerebellar slice culture system. Journal of Neuroscience Research. 78, 157-166 (2004).
- Fancy, S. P., et al. Axin2 as regulatory and therapeutic target in newborn brain injury and remyelination. Nature Neuroscience. 14 (8), 1009-1016 (2011).
- Yuen, T. J., et al. Identification of endothelin-2 as an inflammatory factor that promotes CNS remyelination. Brain. 136, 1035-1047 (2013).
- Yuen, T. J., et al. Oligodendrocyte-encoded HIF function couples postnatal myelination and white matter angiogenesis. Cell. 158 (2), 383-396 (2014).
- Stokes, C. E., Murphy, D., Paton, J. F., Kasparov, S. Dynamics of a transgene expression in acute rat brain slices transfected with adenoviral vectors. Experimental Physiology. 88, 459-466 (2003).
- Dillenburg, A., et al. Activin receptors regulate the oligodendrocyte lineage in health and disease. Acta Neuropathologica. 135 (6), 887-906 (2018).
- Dean, J. M., et al. An organotypic slice culture model of chronic white matter injury with maturation arrest of oligodendrocyte progenitors. Molecular Neurodegeneration. 6, 46 (2011).
- Zhang, H., Jarjour, A. A., Boyd, A., Williams, A. Central nervous system remyelination in culture--a tool for multiple sclerosis research. Experimental Neurology. 230 (1), 138-148 (2011).
- Hill, R. A., Medved, J., Patel, K. D., Nishiyama, A. Organotypic slice cultures to study oligodendrocyte dynamics and myelination. Journal of Visualized Experiments. (90), e51835 (2014).
- Sherafat, A., Hill, R. A., Nishiyama, A. Organotypic Slice Cultures to Study Oligodendrocyte Proliferation, Fate, and Myelination. Molecular Biology (Clifton, N.J.). 1791, 145-156 (2018).
- Croft, C. L., Noble, W. Preparation of organotypic brain slice cultures for the study of Alzheimer's disease. F1000Research. 7, 592 (2018).
- Nasrabady, S. E., Rizvi, B., Goldman, J. E., Brickman, A. M. White matter changes in Alzheimer's disease: a focus on myelin and oligodendrocytes. Acta Neuropathologica Communications. 6 (1), 22 (2019).
- Flynn, S. W., et al. Abnormalities of myelination in schizophrenia detected in vivo with MRI, and post-mortem with analysis of oligodendrocyte proteins. Molecular Psychiatry. 38, 811-820 (2003).
- Thetiot, M., Ronzano, R., Aigrot, M. S., Lubetzki, C., Desmazières, A. Preparation and Immunostaining of Myelinating Organotypic Cerebellar Slice Cultures. Journal of Visualized Experiments. (145), e59163 (2019).
- Gerlach, J., Donkels, C., Münzner, G., Haas, C. A. Persistent Gliosis Interferes with Neurogenesis in Organotypic Hippocampal Slice Cultures. Frontiers in Cellular Neuroscience. 10, 131 (2016).
- Reich, D. S., Lucchinette, C. F., Calabresi, P. A. Multiple Sclerosis. New England Journal of Medicine. 378 (2), 169-180 (2018).
- Jeffery, N. D., Blakemore, W. F. Locomotor deficits induced by experimental spinal cord demyelination are abolished by spontaneous remyelination. Brain. 120, 27-37 (1997).
- Emery, B., Dugas, J. C. Purification of oligodendrocyte lineage cells from mouse cortices by immunopanning. Cold Spring Harbor Protocols. , 854-868 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유