Method Article
Миелинизация и ремиелинизация ex vivo в культурах срезов мозжечка в качестве количественной модели для манипуляций, связанных с развитием и заболеванием
В этой статье
Резюме
Представлен протокол количественной модели демиелинизации и ремиелинизации ex vivo с использованием культур среза мозжечка мыши. Этот метод близко повторяет модель in vivo с полным набором типов клеток ЦНС в интактной ткани, сохраняя при этом химическую, генетическую и экологическую податливость системы in vitro.
Аннотация
Изучение миелинизации in vitro и in vivo сопряжено с многочисленными проблемами. Дифференцировка клеток-предшественников олигодендроцитов (OPCs) in vitro, хотя и масштабируема, не повторяет миелинизацию аксонов. Кокультуры OPC-нейронов и культуры OPC-волокон позволяют исследовать миелинизацию in vitro, но в них отсутствуют дополнительные типы клеток, присутствующие in vivo, такие как астроциты и микроглия. Однако мышиные модели in vivo менее поддаются химическим, экологическим и генетическим манипуляциям и являются гораздо более трудоемкими. Здесь мы описываем количественную систему культуры среза мозжечка мыши ex vivo, которая полезна для: 1) изучения миелинизации развития, 2) моделирования демиелинизации и ремиелинизации и 3) проведения трансляционных исследований. Сагиттальные отделы мозжечка и заднего мозга выделяют у мышей на 0–2 день после рождения, после чего они миелинируют ex vivo в течение 12 дней. В течение этого периода срезами можно манипулировать различными способами, включая добавление соединений для проверки влияния на миелинизацию развития. Кроме того, ткань может быть зафиксирована для электронной микроскопии для оценки ультраструктуры и уплотнения миелина. Для моделирования заболевания РСК можно подвергнуть острой гипоксии, чтобы вызвать гипомиелинизацию. Демиелинизация в этих эксплантах также может быть индуцирована лизолецитином, что позволяет идентифицировать факторы, способствующие ремиелинизации. Помимо химических модификаций и модификаций окружающей среды, CSC может быть выделен из трансгенных мышей и реагирует на генетические манипуляции, индуцированные аденовирусами Ad-Cre и тамоксифеном. Таким образом, культуры срезов мозжечка являются быстрой, воспроизводимой и количественно поддающейся оценке моделью для рекапитуляции миелинизации.
Введение
Миелинизация аксонов обеспечивает быстрое распространение потенциалов действия, механизм, известный как сальтационная проводимость1. Важность миелина подчеркивается демиелинизирующими заболеваниями, такими как рассеянный склероз (РС), которые включают в себя широкий спектр изнурительных проявлений, включая потерю зрения, когнитивные проблемы и паралич. Лекарства от рассеянного склероза не существует, и современные методы лечения сосредоточены на ограничении прогрессирования заболевания путем воздействия на клетки периферического иммунитета. Считается, что инвалидность при рассеянном склерозе и связанных с ним заболеваниях обусловлена нарушением ремиелинизации и прогрессирующей нейродегенерацией. В частности, демиелинизация, атрофия и потеря аксонов наблюдаются при прогрессирующем МС 2,3. Таким образом, стимулирование ремиелинизации представляет собой многообещающую стратегию, которая может осуществляться параллельно с существующими методами лечения и дает дополнительные терапевтические преимущества.
В центральной нервной системе (ЦНС) миелинизация осуществляется специализированными глиальными клетками, известными как олигодендроциты. Клетки-предшественники олигодендроцитов (OPCs) дифференцируются в зрелые, миелинизирующие олигодендроциты посредством ряда хорошо организованных этапов, включая рост процессов, контактирующих с аксонами, увеличение морфологической сложности, расширение миелиновой мембраны и, наконец, уплотнение миелиновой оболочки4. Таким образом, взаимодействие между олигодендроцитами и нейронами является очень тесным. Взаимные взаимодействия между нейронами и олигодендроцитами также необходимы для здоровья и поддержания ЦНС2. Активность аксонов играет роль в стимуляции миелинизации, а глиальные нейротрофические факторы поддерживают целостность нейронов. Важность перекрестных помех глиа-глия в ЦНС также становится все более признанной 5,6,7,8. Например, астроцитарные факторы могут влиять на дифференцировку OPC и поддержание трактов белого вещества. Микроглия также играет роль в модуляции дифференцировки OPC, а также в очистке от миелинового мусора, что является важным этапом процесса ремиелинизации. Идентификация клеточных автономных факторов и понимание влияния других типов клеток ЦНС на демиелинизацию и ремиелинизацию будут иметь неоценимое значение для разработки методов лечения демиелинизирующих и дисмиелинизирующих заболеваний.
В данной статье мы описываем систему ex vivo с использованием культур срезов мозжечка мыши (CSC), которая позволяет проводить манипуляции и количественную оценку интактной ткани ЦНС. Использование ЦСК позволяет измерять миелинизацию или ремиелинизацию после индукции демиелинизации лизолецитином 9,10 с использованием методов, традиционно используемых в исследованиях in vivo, таких как иммуноокрашивание и электронная микроскопия 11,12,13. Лизолецитин является химическим веществом, разрушающим мембрану, что приводит к быстрой потере миелина и олигодендроцитов. Следует отметить, что лизолецитин также может привести к уменьшению других типов клеток вблизи области поражения. Однако, в отличие от экспериментов in vivo, сагиттальные срезы мозжечка могут быть легко манипулированы путем добавления соединений или генетически изменены с помощью аденовирусов Ad-Cre. Метод также позволяет манипулировать изолированными тканями трансгенных мышей или мышей, подвергшихся воздействию окружающей среды, таким как гипоксия 11,12,13,14. Таким образом, модель CSC позволяет изучать миелинизацию при развитии, моделировать заболевание и идентифицировать факторы, которые способствуют или ингибируют миелинизацию, интегрируя вклад различных типов клеток ЦНС в функцию олигодендроцитов.
протокол
Все исследования на животных были одобрены и одобрены Институциональным комитетом по уходу за животными и их использованию Genentech.
1. Подготовка среды и расходных материалов к вскрытию (~30–45 мин)
- Подготовьте и стерилизуйте фильтрующую питательную среду для срезов (SCM) и среду для рассечения (DM), как описано в таблице 1. Хранить при температуре 4 °C. Если какие-либо факторы проверяются для анализа миелинизации, добавьте их в SCM непосредственно перед использованием.
- Пипеткой внесите 1 мл SCM в каждую лунку 6-луночного планшета.
- Используя стерильные щипцы, поместите органотипическую вставку в каждую лунку, следя за тем, чтобы под мембраной не застряли пузырьки. Прогрейте тарелку со средой при температуре 37 °C в инкубаторе с 7,5% CO2 .
2. Подготовка зоны вскрытия (~5–10 мин)
- Выполняйте процедуры в стерильном ламинарном вытяжном шкафу или на столе с использованием адекватных асептических техник для всех этапов процедуры. Протрите все участки 70% этанолом.
- Поместите новое лезвие и силиконовый режущий столик на измельчитель салфеток. Пипетка ~300 мкл стерильной воды или 70% этанола под ступенью резки, чтобы убедиться, что она остается на месте.
- С помощью ватного тампона аккуратно протрите лезвие измельчителя тканей и режущий столик 70% этанолом. Высушите перед использованием измельчитель тканей.
- Опрыскайте все инструменты для вскрытия 70% этанолом и высушите до вскрытия.
- Приготовьте две чашки Петри 10 см: одну с 15–20 мл сухого вещества, одну с 10 мл SCM. Хранить на льду. Держите все среды и чашки Петри на льду, когда не препарируете.
3. Вскрытие культуры мозжечка (~15–20 мин на детеныша)
- Поместите чашку Петри с ДМ на препарирующий микроскоп.
- Усыпьте детеныша мыши в послеродовой день P0–2 путем быстрого обезглавливания острыми ножницами.
- Поместите голову в чашку Петри с ДМ под препарирующий микроскоп для очистки крови.
- С помощью тонких ножниц разрежьте по одному разу на каждом боковом крае у основания черепа.
- Положив голову вверх ногами в DM, сильно надавите на нижнюю часть черепа с помощью щипцов #5/45, проталкивая неповрежденный задний мозг через отверстие в черепе.
- Под препарирующим микроскопом отрежьте лишнюю ткань с помощью двух скальпелей #11. Убедитесь, что мозжечок остается прикрепленным к нижележащему участку заднего мозга. Подробную схему см. на рисунке 1А .
- С помощью шпателя перенесите мозжечок на стадию разрезания тканевого измельчителя так, чтобы ткань лежала на ростральной поверхности заднего мозга и каудальной поверхности заднего мозга, обращенной к исследователю. Следите за тем, чтобы медиальная плоскость мозга была точно параллельна лезвию измельчителя тканей.
- С помощью пипетки P200 удалите излишки среды вокруг ткани, следя за тем, чтобы она оставалась влажной, но не плавала и не была окружена жидкостью.
- Поменяйте местами чашку Петри, содержащую ДМ, с чашкой Петри, содержащую СКМ, под препарирующим микроскопом.
- Разрежьте ткань на ломтики толщиной 350 мкм с помощью измельчителя тканей.
ПРИМЕЧАНИЕ: Скорость лезвия (например, примерно один рез в секунду) и усилие должны быть оптимизированы для обеспечения оптимальных условий резания. В редких случаях ткань застревает на лезвии. Чтобы свести к минимуму потерю участков ткани, держите большой палец на кнопке питания, чтобы при необходимости быстро выключить измельчитель тканей. - Аккуратно нанесите пипеткой 100 мкл SCM под ткань, чтобы срезы плавали. Переложите нарезанную ткань с помощью шпателя в чашку Петри с помощью SCM под препарирующим микроскопом.
- С помощью ватного тампона аккуратно протрите лезвие измельчителя тканей и режущий столик 70% этанолом.
- С помощью скальпелей (тупой стороной) аккуратно отделите срезы под рассекающим микроскопом. С помощью скальпеля и шпателя перенесите срезы на мембрану в 6-луночную пластину с SCM.
ПРИМЕЧАНИЕ: Наиболее медиальные отделы часто имеют наилучшую миелинизацию и целостность тканей. В среднем из одного мозга мыши можно препарировать 4–6 срезов. - Инкубируйте ломтики в SCM при 37 °C и 7,5%CO2.
4. Изменения в культуре и СМИ (~15–30 мин)
- Заменяйте SCM через день.
- Пипеткой внесите 1 мл свежей среды в каждую лунку нового 6-луночного планшета и прогрейте в инкубаторе. С помощью стерильных щипцов перенесите мембраны на новую пластину, следя за тем, чтобы под ней не было пузырьков. Верните тарелки в инкубатор.
5. Стандартная миелинизация и ремиелинизация
- Стандартный протокол миелинизации (Рисунок 1B).
- Срезы культуры рассекают на участке 3 от 0 до 12 дней in vitro (DIV). Если проверяется влияние какого-либо фактора на миелинизацию, добавьте его в среду во время культивирования (0 DIV) и пополняйте его при каждой смене среды.
- Исправление на 12 DIV (шаг 7.1), временная точка, оптимизированная для неполной миелинизации 11,12,13. Это позволяет обнаружить любые усиливающие или блокирующие эффекты на миелинизацию из-за фактора, добавляемого в среду. Репрезентативный положительный результат при добавлении 100 нг/мл активина А показан на рисунке 2.
- Протокол ремиелинизации (Рисунок 1C)
- Следуйте стандартному протоколу миелинизации, описанному в разделе 5.1, без каких-либо дополнительных факторов до 14 DIV, момента, когда срезы полностью миелинизируются 11,12,13.
- Приготовьте запас лизолецитина (125 мг/мл), как описано в таблице 1. Пипеткой по 1 мл 0,5% лизолецитина в СКМ в каждую лунку нового 6-луночного планшета и прогрейте в инкубаторе.
- Переложите мембраны в лизолецитиновую пластину и поместите в инкубатор на ночь на 16–18 ч.
- На следующий день приготовьте новые планшеты со свежими SCM, добавив при необходимости любые факторы, проверяемые на эффекты ремиелинизации. Теплые тарелки в инкубаторе.
- Для замены среды осторожно постучите по мембране на боковой стороне лунки, чтобы убедиться, что вся лизолецитиновая среда удалена. Пополняйте испытуемый фактор (факторы) при каждой смене среды (раздел 4).
- Исправьте срезы на 28 DIV (шаг 7.1), временной точке, оптимизированной для неполной ремиелинизации. Это позволяет обнаружить усиление или блокирование ремиелинизации из-за фактора, добавленного в среду. Репрезентативный положительный результат с добавлением 0,1 мкМ XAV939 представлен на рисунке 3.
6. Вариации протокола миелинизации и ремиелинизации
- Протокол гипомиелинизации, вызванной гипоксией (Рисунок 1D)11,13.
ПРИМЕЧАНИЕ: Это представлено как вариант стандартного протокола миелинизации, представленного в разделе 5.1.- Пластинчатые ломтики в SCM без факторов.
- Переложите тарелки для срезов в гипоксический инкубатор (2%FiO2) на 24 ч между 2–3 DIV.
- На следующий день приготовьте новые планшеты со свежими SCM, добавив при необходимости любые факторы, проверяемые на потенциал миелинизации. Теплые тарелки в инкубаторе.
- После культивирования в условиях гипоксии сменить среду (раздел 4) и вернуть культуры в стандартный инкубатор для культур (37 °C, 7,5%CO2). Пополняйте все тестируемые факторы при каждой последующей смене носителя (раздел 4).
- Исправление на 12 DIV (шаг 7.1).
- Протокол генетической манипуляции (Рисунок 1E)13
- Выделите ткань трансгенных мышей для вскрытия, как описано в разделе 3.
- При использовании индуцируемых трансгенных линий мышей тамоксифен (100 нМ, доза, которая не индуцирует миелинизацию или дифференцировку OPC) или аденовирус Ad-Cre могут быть добавлены к SCM во время смены среды, выполненной на 1 и 3 DIV.
- После генетической манипуляции с тамоксифеном или аденовирусом Ad-Cre продолжайте подмену среды через день, как описано в разделе 4 (с добавлением факторов при необходимости).
Все срезы одной мыши помещаются на одной мембране, что позволяет проводить генотипирование после вскрытия, что упрощает проведение экспериментов с трансгенными мышами.
7. Обработка и анализ тканей
- Зафиксируйте ломтики, аккуратно погрузив мембрану в 4% параформальдегид на 1 ч при комнатной температуре (RT).
- Аккуратно промойте, погрузив в фосфатно-солевой буфер (PBS). Затем погрузите в PBS в 6-луночную пластину.
ПРИМЕЧАНИЕ: Протокол может быть приостановлен здесь. Фиксированные ломтики могут храниться в PBS при температуре 4 °C до месяца. Если вы не храните ломтики, промойте 2 раза в PBS в течение 5 минут, прежде чем продолжить. - С помощью скальпеля вырезаем мембрану из кольца и приступаем к окрашиванию в 6-луночной пластине. Обязательно держите срезы лицевой стороной вверх (мембраной вниз) для окрашивания и последующего крепления на предметные стекла.
- Блокируют на 1 ч при ОТ в блочном растворе (3% инактивированная теплом лошадиная сыворотка, 2% бычий сывороточный альбумин и 0,25% Тритон-Х 100, разведенный в PBS).
ПРИМЕЧАНИЕ: Если для окрашивания антител необходимо извлечение антигена (например, CC1/Olig2), это можно сделать в стеклянных чашках Петри. - Оберните пластины парафиновой пленкой и инкубируйте в течение ночи при 4 °С в первичном антителе, разведенном в блокирующем растворе.
- Стирайте 3 раза в блокирующем растворе: 1) короткое полоскание, 2) 15 минут стирка и 3) 1 час стирки. Для кратковременного полоскания наполните раствором небольшую чашку Петри и аккуратно погрузите мембрану с помощью щипцов перед тем, как переложить в свежий раствор. Для более длительных стирок (т.е. 15 минут и 1 час) погрузите мембрану в раствор в 6-луночную пластину и поместите на мягкое качалку.
- Инкубировать под закрытым светом в течение 2 ч при ЛТ во вторичных антителах, разведенных в соотношении 1:500 в PBS.
- Стирайте 3 раза в PBS: 1) короткое полоскание, 2) 15 минут стирка и 3) 1 час стирки.
- Если необходимо окрашивание DAPI, погрузите в раствор DAPI 1:1,000 на 7 минут в RT. Кратковременно прополощите, а затем постирайте в течение 15 минут в PBS.
- Промойте в воде двойной дистилляции.
- Установите мембраны на предметное стекло срезами вверх (мембраной вниз).
ПРИМЕЧАНИЕ: Смонтированные ломтики можно хранить при температуре 4 °C. Визуализацию на конфокальном микроскопе лучше всего проводить в течение 1 недели, прежде чем мембрана станет непрозрачной и ее будет трудно визуализировать. - Срезы изображения с помощью конфокальной микроскопии и количественная оценка, как описано ранее 11,12,13.
Результаты
Культуры срезов мозжечка, полученные от мышей P0-2 (рис. 1A), были использованы для изучения миелинизации и оценки эффектов добавления различных факторов от 0–12 DIV (рис. 1B). Для изучения ремиелинизации срезы культур при 14 DIV сначала демиелинизировали лизолецитином и давали ремиелинизировать в течение 14 дополнительных дней в культуре с исследуемыми факторами (рис. 1C), после чего количественно оценивали ремиелинизацию. Влияние гипоксии на миелинизацию также изучали путем помещения культур срезов в гипоксический инкубатор с температурой 2%FiO2 на 24 ч от 2 до 3 DIV (рис. 1D). Наконец, срезные культуры, полученные от трансгенных мышей, были использованы для изучения влияния нокаутов генов на миелинизацию. В этой системе рекомбинацию Cre индуцировали добавлением тамоксифена или аденовируса Ad-Cre на 1 DIV и 3 DIV, а также срезами посевов фиксировали для анализа при 12 DIV (рис. 1E). После фиксации тканей количественную оценку демиелинизации и ремиелинизации проводили методом иммуноокрашивания (рис. 2, рис. 3) и электронной микроскопии 11,12,13.
Представленные репрезентативные данные (Рисунок 2, Рисунок 3) иллюстрируют динамический диапазон миелинизации и ремиелинизации в культурах срезов. Индекс миелинизации количественно определяли по отношению Caspr, паранодального маркера, который является косвенным считыванием компактного миелина, к нейрофиламентному белку H (NFH), который окрашивает аксоны. Этот индекс миелинизации был валидирован как представляющий образование компактного миелина с помощью электронной микроскопии и окрашивания натриевых каналов12. Индуцированная лизолецитином демиелинизация 9,10 привела к полному исчезновению Caspr-положительных параузлов (индекс миелинизации = 0, рис. 3А) и потере компактного миелина, который был восстановлен при ремиелинизации11,12.
Чтобы продемонстрировать положительный результат миелинизации, срезы культивировали активином А в соответствии с временной шкалой, показанной на рисунке 1B. Активин А взаимодействует с активиновыми рецепторами на олигодендроцитах и стимулирует дифференцировку олигодендроцитов и уплотнение миелина15. Репрезентативные данные показывают, что обработка срезов 100 нг/мл активина А во время миелинизации приводила к более высокому индексу миелинизации (рис. 2A, B). В соответствии с этим, лечение активином А ускорило дифференцировку OPC, что количественно определяется отношением CC1-положительных зрелых олигодендроцитов к клеткам линии олиг2+ олигодендроцитов11,13 (рисунки 2C,D).
Было показано, что низкомолекулярный ингибитор танкиразы, XAV939, способствует миелинизации и ремиелинизации за счет стабилизации уровня аксина2 в олигодендроцитах11. После лечения лизолецитином демиелинизацию визуализировали и количественно оценивали в культурах срезов путем окрашивания фрагментированным основным белком миелина (МБП) и отсутствием Caspr-положительных параузлов (рис. 3A). Обработка 0,1 мкМ XAV939 во время ремиелинизации (15-28 DIV) значительно увеличивала индекс миелинизации по сравнению с контрольной группой, что количественно оценивалось по отношению окрашивания Caspr к NFH (рис. 3B, C). Таким образом, модель культуры срезов может быть использована для изучения и количественной оценки влияния на дифференцировку, миелинизацию и ремиелинизацию OPC в интактной ткани.
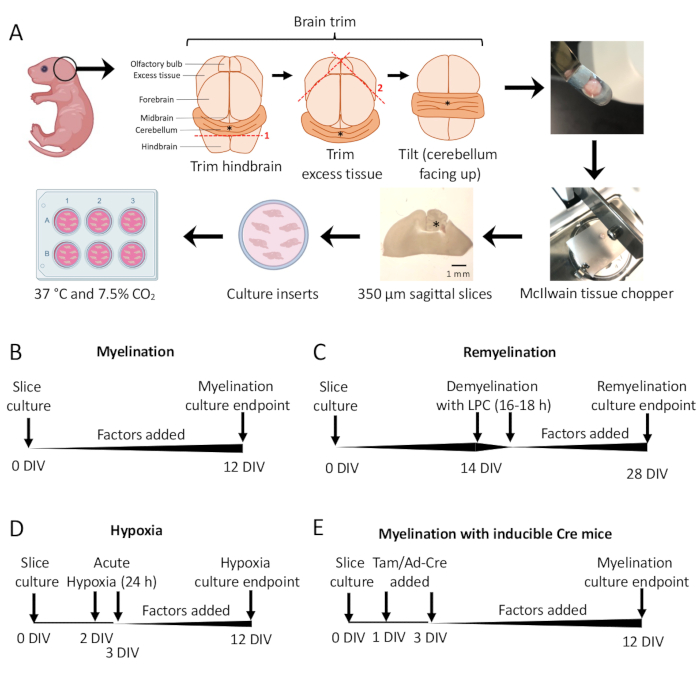
Рисунок 1: Схема культур срезов мозжечка, показывающая ключевые этапы процесса рассечения и временные рамки для различных протоколов культивирования срезов. (A) Описание этапов создания культур срезов: препарирование мозга детенышей мышей P0–2, обрезка мозга (как показано на рисунке), разрезание мозга тканевым измельчителем для получения сагиттальных срезов размером 350 мкм, помещение срезов на органотипические вставки для культур в чашке из 6 лунок и инкубация при 37 °C и 7,5%CO2. * обозначает мозжечок. (B) График для миелинизирующих культур срезов. Культуры срезов инкубировали в течение 12 дней перед фиксацией для анализа. (C) График ремиелинизации культур срезов. Срезы обрабатывали лизолецитином при 14 DIV в течение 16–18 ч для индуцирования полной демиелинизации и позволяли ремиелинизировать до 28 DIV перед фиксацией для анализа. (D) Хронология миелинизации после гипоксического инсульта. Срезы подвергались острому гипоксическому поражению в течение 24 ч между 2–3 ДЕЛ, что вызывало гипомиелинизацию. (E) Хронология КБК от генетически модифицированных мышей. Тамоксифен (Tam, 100 нМ) или вирус Ad-Cre добавляли через 1 DIV и 3 DIV для индуцирования генетической модификации, а срезы анализировали при 12 DIV. Диаграммы временной шкалы адаптированы из предыдущих публикаций11,13. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
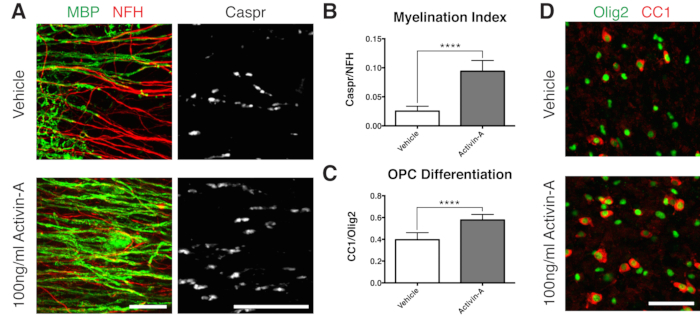
Рисунок 2: Репрезентативные данные, показывающие, что активин А способствует миелинизации и дифференцировке OPC. (А) Увеличение миелинизации (ОБМ) и параузлов (Caspr) при лечении активином А в концентрации 100 нг/мл, о чем свидетельствует иммуноокрашивание культур срезов. (B) Количественная оценка индекса миелинизации (отношение площади, окрашенной для параузлов Caspr+, к площади, окрашенной для аксонов NFH+). (C) Количественная оценка дифференцировки OPC (отношение CC1+ олигодендроцитов к клеткам линии олиг2+ олигодендроцитов). (D) Репрезентативные изображения окрашивания CC1/Olig2. Отображаются средние значения + стандартное отклонение. Р < 0,0001; непарный Т-критерий. Масштабные линейки: A = 25 μm, D = 50 μm. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
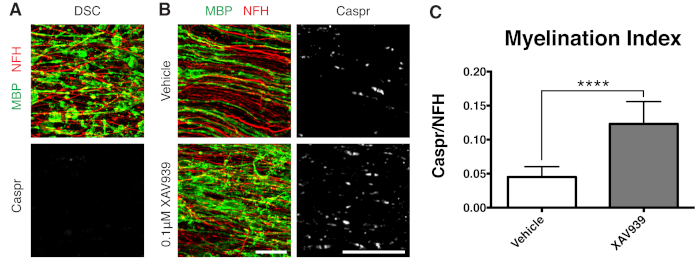
Рисунок 3: Репрезентативные данные, показывающие, что XAV939 способствует ремиелинизации. (A) Изображения, показывающие демиелинизацию при фрагментированном окрашивании MBP и отсутствие параузлов Caspr в культурах срезов, обработанных лизолецитином. (B) Увеличение ремиелинизации (MBP) и параузлов (Caspr) при лечении 0,1 мкМ XAV939 после демиелинизации, вызванной лизолецитином, проявляется в иммуноокрашивании культур срезов. (C) Количественная оценка индекса миелинизации (отношение площади, окрашенной для параноидов Caspr+, к площади, окрашенной для аксонов NFH+). Отображаются средние значения + стандартное отклонение. Р < 0,0001; непарный Т-критерий. Масштабные линейки = 25 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Среды для срезов культур (SCM) | |
| Том | Реагент |
| 100 мл | Минимальное содержание основных сред (MEM), HEPES, без глютамина |
| 50 мл | Термоинактивированная сыворотка для лошадей |
| 50 мл | Сбалансированный солевой раствор Эрла |
| 2 мл | Пенициллин-стрептомицин 10 000 ЕД/мл |
| 2 мл | Добавка GlutaMAX |
| 2888 μл | 45% раствор глюкозы |
| 1 мл | Фунгизон |
| Стерильно отфильтровать через фильтр 0,22 мкм и хранить в холодильнике при температуре 4 °C до 2 недель. | |
| Диссекционные среды (DM) | |
| Том | Реагент |
| 100 мл | MEM, HEPES, с солью Эрла |
| 1 мл | Пенициллин-стрептомицин 10 000 ЕД/мл |
| Стерильно отфильтровать через фильтр 0,22 мкм и хранить в холодильнике при температуре 4 °C до 2 месяцев. | |
| Лизолецитин в запасе (125 мг/мл) | |
| Количество | Реагент |
| 100 мг | Лизолецитин |
| 0,8 мл | Стерильный PBS |
| Растворите 100 мг лизолецитина в 0,8 мл стерильного PBS. Храните 80 μL аликвот стокового раствора при -20 °C. | |
| Перед применением разморозьте 80 мкл аликвоты и растворите в 20 мл СКМ (0,5% лизолецитина в СКМ), подогретом при 37 °С, 7,5% СО2 инкубаторе. При необходимости вихрем растворите лизолецитин в SCM. | |
Таблица 1: Список компонентов и протокол изготовления среды для срезов (SCM), среды для рассечения (DM) и раствора лизолецитина.
Обсуждение
Этот протокол описывает органотипическую модель культуры срезов мозжечка, которая повторяет клеточный состав in vivo с простотой модели in vitro. Этот протокол может быть доработан и стать более репрезентативной моделью патологий человека. ЦСК потенциально может быть разработан в качестве моделей для специфических для заболевания повреждений, таких как силовое повреждение тканей, повреждение, вызванное миелиноспецифическими антителами, или повреждение олигодендроцитов при РС с добавлением периферических иммунных клеток. Этот протокол также может быть оптимизирован для тканей, рассеченных из других частей головного и спинного мозга16,17. В то время как этот протокол сосредоточен на гистологической количественной оценке миелинизации, CSC представляет собой удобную модель для изучения различных экспериментальных конечных точек. Эти культуры могут быть использованы для характеристики различных типов клеток с помощью секвенирования РНК одиночных клеток, оценки ультраструктуры аксонов и миелиновых оболочек с помощью электронной микроскопии, а также для изучения динамики OPC путем проведения покадровой визуализации. Иммуноокрашивание также можно обойти с помощью трансгенных мышиных репортерных линий18,19. Наконец, различный возраст детенышей мышей, время в культуре или толщина срезов могут быть использованы для адаптации РСК к моделированию различных механизмов заболевания 10,17,18,19,20,23.
Срезовые культуры идеально подходят для тестирования и количественной оценки факторов, влияющих на миелинизацию и ремиелинизацию, но они ограничены в представлении ЦНС в определенных контекстах. Полученные из мозга P 0-2, CSC происходят из мозга, который находится на ранней стадии развития и имеет ограниченное сходство со стареющим или нейродегенеративным мозгом. Учитывая растущее осознание важности миелина при заболеваниях ЦНС, таких как болезнь Альцгеймера21 и шизофрения22, требуются модели количественной оценки и характеристики миелинизации для взрослых или пожилых людей. Были опубликованы и другие протоколы, выделяющие ткани от старых грызунов, хотя они все еще находятся на стадиях развития 10,18,19,23. Кроме того, могут существовать внутренние и внешние различия в олигодендроцитах и OPC в мозжечке по сравнению со спинным мозгом и другими трактами белого вещества в головном мозге. CSC также менее пригодны, чем клеточные системы in vitro, для крупномасштабного CRISPR или низкомолекулярного скрининга. Благодаря первоначальному срезу тканей также происходит активация резидентных в мозге клеток врожденного иммунитета (т.е. микроглии и астроцитов), что является важным предостережением для системы24. Наконец, клетки периферического иммунитета играют большую роль в патологии РС25; ЦСК лишены периферических клеток, если эти клетки не добавляются экзогенно, и, таким образом, не являются идеальной моделью воспалительной среды ЦНС.
Диссекционная часть этого протокола, пожалуй, самая важная. Этапы диссекции должны проводиться с максимальной осторожностью, чтобы не повредить ткани и подлежащую структуру. Правильное расположение мозга вдоль лопасти измельчителя тканей обеспечивает минимальное повреждение тканей и клеток. Кроме того, важны тщательное рассечение и разделение срезов, а также их перенос на мембраны для культуры. Временные рамки, указанные в этом протоколе, были оптимизированы для описываемого исследования, но, возможно, потребуется скорректировать их для получения оптимальных результатов в различных исследованиях. Этот протокол будет полезен тем, кто хотел бы изучить миелинизацию развития и репарацию миелина.
Следует отметить, что лекарства от рассеянного склероза не существует. В то время как современные методы лечения весьма эффективны для ослабления адаптивной иммунной системы, никакая современная терапия не может остановить прогрессирование. Считается, что сбой ремиелинизации и последующая нейродегенерация лежат в основе прогрессирования РС2. Наличие ОПК при хронических поражениях РС позволяет предположить, что неудачная репарация миелина может быть связана с остановкой дифференцировки ОПК. Использование CSC открывает путь к открытию методов лечения восстановления миелина, которые могут помочь обратить вспять прогрессирование рассеянного склероза и восстановить функции. Терапия восстановления миелина также может способствовать выздоровлению у пациентов с травмой спинного мозга, где демиелинизированные тракты подавляют локомоторную функцию26. Таким образом, значимость CSC заключается в его пригодности для идентификации факторов, влияющих на демиелинизацию и ремиелинизацию млекопитающих, с относительно высокой пропускной способностью по сравнению с животными моделями in vivo. В то время как во многих исследованиях первичные OPC использовались для скрининга соединений, влияющих на дифференцировку, генерация и выделение первичных OPC требует трудоемкой и последовательной иммунопанации27. Кроме того, клеточные анализы не повторяют разнообразие и взаимодействие типов клеток, присутствующих in vivo. Генерация CSC из детенышей мышей — это быстрая и экономичная модель изучения миелинизации и ремиелинизации, не требующая дорогостоящего оборудования или расходных материалов. Таким образом, культуры срезов мозжечка представляют собой бесценную количественную модель для повторения миелинизации ex vivo и позволяют открывать лекарства и проводить фундаментальные научные исследования.
Раскрытие информации
Авторы являются сотрудниками компании Genentech, Inc., входящей в группу компаний Roche.
Благодарности
Авторы хотели бы поблагодарить Юн-Ан Шена, Роксану Кьяук и Криса Болена за конструктивные комментарии и вклад в эту статью. Кроме того, авторы признают вклад Шарля френч-Констана, Эндрю Жаржура, Вероник Мирон и Дэвида Ровича в раннюю разработку соответствующей методологии, ранее опубликованной 11,12,13.
Материалы
| Name | Company | Catalog Number | Comments |
| #5/45 Forceps | Fine Science Tools | 11251-35 | Dissection tools |
| 32% Paraformaldehyde | Electron Microscopy Sciences | 50-980-495 | Fixative for staining |
| 45% glucose solution | Sigma | G8769 | Slice culture media component |
| 6-well tissue culture plates | Corning | 3516 | Plates for cultures |
| Alexa Fluor Goat anti-chicken 647 | Thermo Fisher Scientific | A21449 | Secondary staining antibody |
| Alexa Fluor Goat anti-mouse 647 | Thermo Fisher Scientific | A21236 | Secondary staining antibody |
| Alexa Fluor Goat anti-rabbit 555 | Thermo Fisher Scientific | A11006 | Secondary staining antibody |
| Alexa Fluor Goat anti-rat 488 | Thermo Fisher Scientific | A21428 | Secondary staining antibody |
| Blades, Double-edge, PTFE coated Stainless steel | Ted Pella | 121-6 | Chopping blades |
| Bovine Serum Albumin (BSA) | Sigma | A9418 | Blocking solution component |
| Chicken anti-NFH antibody | Encor Biotech | CPCA-NF-H | Staining antibody |
| Confocal Microscope | Zeiss | LSM780 | Confocal for imaging |
| Corning 250 mL vacuum filter/storage bottle system, 0.22 µm pore | Corning | 431096 | For media preparation |
| Earl's balanced salt solution | Sigma | E2888 | Slice culture media component |
| Feather surgical blade | Feather | 2976#11 | Dissection tools |
| Fungizone | Thermo Fisher Scientific | 15290-18 | Dissection media component |
| GlutaMAX supplement | Thermo Fisher Scientific | 35050-061 | Slice culture media component |
| Heat-inactivated horse serum | Thermo Fisher Scientific | 26050-88 | Slice culture media component |
| Lysolecithin | Sigma | L4129 | |
| Lysophosphatidylcholine from egg yolk | Sigma | L4129 | To induce demyelination |
| McIlwain Tissue Chopper | Ted Pella | 10180 | Tissue chopper |
| MEM, Hepes, no glutamine | Thermo Fisher Scientific | 12360-038 | Slice culture media component |
| MEM, Hepes, with Earle's salts | Sigma | M7278 | Dissection media component |
| Metal spatula | Fisher Scientific | 470149-442 | Dissection tools - bend flat end at angle for use |
| Millicell Culture Plate Insert 30mm Organotypic PTFE | Fisher | PICM0RG50 | Culture insert |
| Mouse anti-CC1 antibody | Millipore | OP80-100UG | Staining antibody |
| Noyes spring scissors | Fine Science Tools | 15012-12 | Dissection tools |
| PBS pH 7.4 | Gibco | 10010023 | For dilution of fixative |
| Penicillin-streptomycin 10,000U/mL | Thermo Fisher Scientific | 15140-122 | Slice culture media component |
| Rabbit anti-Caspr antibody | Abcam | ab34151 | Staining antibody |
| Rabbit anti-Olig2 antibody | Millipore | AB9610 | Staining antibody |
| Rat anti-MBP antibody | Serotec | MCA409S | Staining antibody |
| Scalpel handle #3 | Fine Science Tools | 10003-12 | Dissection tools |
| Silicone rubber foam sheet | MSC Industrial Direct Co | 31939176 | Cutting base |
| Stereo Microscope | Olympus Life Sciences | SZ61 | Microscope for dissection |
| Student surgical scissors | Fine Science Tools | 91401-12 | Dissection tools |
Ссылки
- Purves, D., Augustine, G. J., Fitzpatrick, D. Increased Conduction Velocity as a Result of Myelination. Neuroscience 2nd edition. , (2001).
- Dutta, R., Trapp, B. D. Mechanisms of neuronal dysfunction and degeneration in multiple sclerosis. Progress in Neurobiology. 93 (1), 1-12 (2011).
- Trapp, B. D., Nave, K. A. Multiple sclerosis: an immune or neurodegenerative disorder?. Annual Review of Neuroscience. 31, 247-269 (2008).
- Bradl, M., Lassmann, H. Oligodendrocytes: biology and pathology. Acta Neuropathologica. 119 (1), 37-53 (2010).
- Domingues, H. S., Portugal, C. C., Socodato, R., Relvas, J. B. Oligodendrocyte, Astrocyte, and Microglia Crosstalk in Myelin Development, Damage, and Repair. Frontiers in Cell and Developmental Biology. 4, 71 (2016).
- Nave, K. A., Werner, H. B. Myelination of the nervous system: mechanisms and functions. Annual Review of Cell and Developmental Biology. 30, 503-533 (2014).
- Franklin, R. J. M., Ffrench-Constant, C. Regenerating CNS myelin – from mechanisms to experimental medicines. Nature Reviews Neuroscience. 18 (12), 753-769 (2017).
- Molina-Gonzalez, I., Miron, V. E. Astrocytes in myelination and remyelination. Neuroscience Letters. 713, 134532 (2019).
- Keough, M. B., Jensen, S. K., Yong, V. W. Experimental demyelination and remyelination of murine spinal cord by focal injection of lysolecithin. Journal of Visualized Experiments. (97), e52679 (2015).
- Birgbauer, E., Rao, T. S., Webb, M. Lysolecithin induces demyelination in vitro in a cerebellar slice culture system. Journal of Neuroscience Research. 78, 157-166 (2004).
- Fancy, S. P., et al. Axin2 as regulatory and therapeutic target in newborn brain injury and remyelination. Nature Neuroscience. 14 (8), 1009-1016 (2011).
- Yuen, T. J., et al. Identification of endothelin-2 as an inflammatory factor that promotes CNS remyelination. Brain. 136, 1035-1047 (2013).
- Yuen, T. J., et al. Oligodendrocyte-encoded HIF function couples postnatal myelination and white matter angiogenesis. Cell. 158 (2), 383-396 (2014).
- Stokes, C. E., Murphy, D., Paton, J. F., Kasparov, S. Dynamics of a transgene expression in acute rat brain slices transfected with adenoviral vectors. Experimental Physiology. 88, 459-466 (2003).
- Dillenburg, A., et al. Activin receptors regulate the oligodendrocyte lineage in health and disease. Acta Neuropathologica. 135 (6), 887-906 (2018).
- Dean, J. M., et al. An organotypic slice culture model of chronic white matter injury with maturation arrest of oligodendrocyte progenitors. Molecular Neurodegeneration. 6, 46 (2011).
- Zhang, H., Jarjour, A. A., Boyd, A., Williams, A. Central nervous system remyelination in culture--a tool for multiple sclerosis research. Experimental Neurology. 230 (1), 138-148 (2011).
- Hill, R. A., Medved, J., Patel, K. D., Nishiyama, A. Organotypic slice cultures to study oligodendrocyte dynamics and myelination. Journal of Visualized Experiments. (90), e51835 (2014).
- Sherafat, A., Hill, R. A., Nishiyama, A. Organotypic Slice Cultures to Study Oligodendrocyte Proliferation, Fate, and Myelination. Molecular Biology (Clifton, N.J.). 1791, 145-156 (2018).
- Croft, C. L., Noble, W. Preparation of organotypic brain slice cultures for the study of Alzheimer's disease. F1000Research. 7, 592 (2018).
- Nasrabady, S. E., Rizvi, B., Goldman, J. E., Brickman, A. M. White matter changes in Alzheimer's disease: a focus on myelin and oligodendrocytes. Acta Neuropathologica Communications. 6 (1), 22 (2019).
- Flynn, S. W., et al. Abnormalities of myelination in schizophrenia detected in vivo with MRI, and post-mortem with analysis of oligodendrocyte proteins. Molecular Psychiatry. 38, 811-820 (2003).
- Thetiot, M., Ronzano, R., Aigrot, M. S., Lubetzki, C., Desmazières, A. Preparation and Immunostaining of Myelinating Organotypic Cerebellar Slice Cultures. Journal of Visualized Experiments. (145), e59163 (2019).
- Gerlach, J., Donkels, C., Münzner, G., Haas, C. A. Persistent Gliosis Interferes with Neurogenesis in Organotypic Hippocampal Slice Cultures. Frontiers in Cellular Neuroscience. 10, 131 (2016).
- Reich, D. S., Lucchinette, C. F., Calabresi, P. A. Multiple Sclerosis. New England Journal of Medicine. 378 (2), 169-180 (2018).
- Jeffery, N. D., Blakemore, W. F. Locomotor deficits induced by experimental spinal cord demyelination are abolished by spontaneous remyelination. Brain. 120, 27-37 (1997).
- Emery, B., Dugas, J. C. Purification of oligodendrocyte lineage cells from mouse cortices by immunopanning. Cold Spring Harbor Protocols. , 854-868 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены