Method Article
Gelişimsel ve Hastalıkla İlgili Manipülasyonlar için Kantitatif Bir Model Olarak Serebellar Dilim Kültürlerinde Ex Vivo Miyelinasyon ve Remiyelinasyon
Bu Makalede
Özet
Sunulan, fare serebellar dilim kültürleri kullanılarak ex vivo kantitatif bir demiyelinizasyon ve remiyelinizasyon modeli için bir protokoldür. Bu yöntem, bir in vitro sistemin kimyasal, genetik ve çevresel uygunluğunu korurken, sağlam dokudaki CNS hücre tiplerinin tam tamamlayıcısı ile bir in vivo modeli yakından özetler.
Özet
Miyelinasyonu in vitro ve in vivo olarak incelemek çok sayıda zorluk doğurur. Oligodendrosit öncü hücrelerinin (OPC'ler) farklılaşması in vitro, ölçeklenebilir olmasına rağmen, aksonal miyelinasyonu özetlemez. OPC-nöron kokültürleri ve OPC-lif kültürleri, in vitro miyelinasyonun incelenmesine izin verir, ancak astrositler ve mikroglia gibi in vivo olarak bulunan ek hücre tiplerinden yoksundurlar. Bununla birlikte, in vivo fare modelleri kimyasal, çevresel ve genetik manipülasyona daha az uygundur ve çok daha fazla emek yoğundur. Burada, aşağıdakiler için yararlı olan bir ex vivo fare serebellar dilim kültürü (CSC) kantitatif sistemini açıklıyoruz: 1) gelişimsel miyelinasyonu incelemek, 2) demiyelinizasyon ve remiyelinizasyonu modellemek ve 3) translasyonel araştırma yapmak. Beyincik ve arka beynin sagital bölümleri, doğum sonrası gün (P) 0-2 farelerinden izole edilir, daha sonra 12 gün boyunca ex vivo miyelinasyon yaparlar. Bu süre zarfında, dilimler, gelişimsel miyelinasyon üzerindeki etkiyi test etmek için bileşiklerin eklenmesi de dahil olmak üzere çeşitli şekillerde manipüle edilebilir. Ek olarak, miyelin ultrastrüktürünü ve sıkıştırmasını değerlendirmek için elektron mikroskobu için doku sabitlenebilir. Hastalığı modellemek için, CSC hipomiyelinasyonu indüklemek için akut hipoksiye maruz bırakılabilir. Bu eksplantlardaki demiyelinizasyon, remiyelinizasyonu teşvik eden faktörlerin tanımlanmasına izin veren lizolesitin tarafından da indüklenebilir. Kimyasal ve çevresel modifikasyonların yanı sıra, CSC transgenik farelerden izole edilebilir ve Ad-Cre adenovirüsleri ve tamoksifen ile indüklenen genetik manipülasyona yanıt verir. Bu nedenle, serebellar dilim kültürleri, miyelinasyonu özetlemek için hızlı, tekrarlanabilir ve ölçülebilir bir modeldir.
Giriş
Aksonların miyelinasyonu, tuzlu iletim1 olarak bilinen bir mekanizma olan aksiyon potansiyellerinin hızlı bir şekilde yayılmasını sağlar. Miyelinin önemi, görme kaybı, bilişsel sorunlar ve felç dahil olmak üzere çok çeşitli zayıflatıcı belirtileri içeren multipl skleroz (MS) gibi demiyelinizan hastalıklarla vurgulanmaktadır. MS için bir tedavi yoktur ve mevcut tedaviler periferik bağışıklık hücrelerini hedef alarak hastalığın ilerlemesini sınırlamaya odaklanmaktadır. MS ve ilgili hastalıklarda özürlülüğün, remiyelinizasyon ve ilerleyici nörodejenerasyon başarısızlığından kaynaklandığı düşünülmektedir. Özellikle, ilerleyici MS'de demiyelinizasyon, atrofi ve aksonal kayıp gözlenir 2,3. Bu nedenle, remiyelinizasyonun teşvik edilmesi, mevcut tedavilere paralel olarak yürütülebilecek ve ek terapötik faydalar sağlayabilecek umut verici bir stratejiyi temsil etmektedir.
Merkezi sinir sisteminde (CNS) miyelinleşme, oligodendrositler olarak bilinen özel glial hücreler tarafından gerçekleştirilir. Oligodendrosit öncü hücreleri (OPC'ler), aksonlarla temas eden süreçlerin büyümesi, morfolojik karmaşıklıkta artışlar, miyelin zarının genişlemesi ve son olarak miyelin kılıf sıkışması4 dahil olmak üzere bir dizi yüksek düzeyde düzenlenmiş adımla olgun, miyelinli oligodendrositlere farklılaşır. Bu nedenle, oligodendrositler ve nöronlar arasındaki etkileşim oldukça samimidir. CNS2'nin sağlığı ve bakımı için nöronlar ve oligodendrositler arasındaki karşılıklı etkileşimler de gereklidir. Aksonal aktivite, miyelinasyonun uyarılmasında rol oynar ve glial nörotrofik faktörler nöronların bütünlüğünü destekler. CNS'de glia-glia karışmasının önemi de giderek daha fazla tanınmaktadır 5,6,7,8. Örneğin, astrositik faktörler OPC'lerin farklılaşmasını ve beyaz madde yollarının bakımını etkileyebilir. Mikroglia ayrıca OPC farklılaşmasının modüle edilmesinde ve remiyelinizasyon işleminin önemli bir adımı olan miyelin kalıntılarının temizlenmesinde de rol oynar. Hücre otonom faktörlerin tanımlanması ve diğer CNS hücre tiplerinin demiyelinizasyon ve remiyelinizasyondaki etkisinin anlaşılması, demiyelinizan ve dismiyelinizan hastalıklar için tedaviler geliştirmek için paha biçilmez olacaktır.
Burada, sağlam CNS dokusunun manipülasyonuna ve miktarının belirlenmesine izin veren fare serebellar dilim kültürlerini (CSC) kullanan bir ex vivo sistemi açıklıyoruz. CSC kullanımı, lizolesitin9,10 ile demiyelinizasyonun indüksiyonundan sonra miyelinasyon veya remiyelinizasyonun, immün boyama ve elektron mikroskobu 11,12,13 gibi in vivo çalışmalarda geleneksel olarak kullanılan yöntemler kullanılarak ölçülmesine izin verir. Lizolesitin, hızlı bir miyelin ve oligodendrosit kaybına neden olan zarı bozan bir kimyasaldır. Unutulmaması gereken potansiyel bir uyarı, lizolesitinin lezyon alanına yakın diğer hücre tiplerinin de azalmasına neden olabileceğidir. Bununla birlikte, in vivo deneylerden farklı olarak, serebellumun sagital dilimleri, bileşiklerin eklenmesiyle kolayca manipüle edilebilir veya Ad-Cre adenovirüsleri kullanılarak genetik olarak değiştirilebilir. Yöntem ayrıca, transgenik farelerden veya hipoksi 11,12,13,14 gibi çevresel hakaretlere maruz kalan farelerden izole edilen dokunun manipülasyonuna da izin verir. Bu nedenle CSC modeli, farklı CNS hücre tiplerinin oligodendrosit fonksiyonuna katkılarını entegre ederken, gelişimsel miyelinasyonun incelenmesine, hastalığın modellenmesine ve miyelinleşmeyi teşvik eden veya inhibe eden faktörlerin tanımlanmasına izin verir.
Protokol
Tüm hayvan çalışmaları, Genentech Kurumsal Hayvan Bakım ve Kullanım Komitesi tarafından yetkilendirilmiş ve onaylanmıştır.
1. Diseksiyon için ortam ve malzemelerin hazırlanması (~30–45 dk)
- Tablo 1'de detaylandırıldığı gibi filtre dilimi kültür ortamını (SCM) ve diseksiyon ortamını (DM) hazırlayın ve steril hale getirin. 4 °C'de saklayın. Miyelinasyon testi için herhangi bir faktör test ediliyorsa, bunları kullanmadan hemen önce SCM'ye ekleyin.
- 6 oyuklu plakanın her bir oyuğuna 1 mL SCM pipetleyin.
- Steril forseps kullanarak, zarın altında kabarcık sıkışmadığından emin olarak her bir oyuğa organotipik bir ek yerleştirin. Plakayı ortamla 37 °C'de% 7.5 CO2 inkübatörde ısıtın.
2. Diseksiyon alanının hazırlanması (~5–10 dk)
- Prosedürleri steril bir laminer akış başlığında veya prosedürün tüm adımları için yeterli aseptik tekniklerle tezgah üzerinde gerçekleştirin. Tüm alanları% 70 etanol ile silerek temizleyin.
- Doku doğrayıcıya yeni bir bıçak ve silikon kesme aşaması yerleştirin. Yerinde kalmasını sağlamak için kesme aşamasının altına ~300 μL steril su veya %70 etanol pipetleyin.
- Mendil doğrayıcı bıçağı ve kesme aşamasını %70 etanol ile nazikçe silmek için pamuklu çubuk kullanın. Kağıt mendil doğrayıcıyı kullanmadan önce kurulayın.
- Tüm diseksiyon aletlerine %70 etanol püskürtün ve diseksiyondan önce kurulayın.
- İki adet 10 cm'lik Petri kabı hazırlayın: biri 15-20 mL DM, diğeri 10 mL SCM. Buz üzerinde saklayın. Diseksiyon yapmadığınız zamanlarda tüm medya ve Petri kaplarını buz üzerinde tutun.
3. Serebellar dilim kültürü diseksiyonu (yavru başına ~ 15-20 dakika)
- DM'li Petri kabını diseksiyon mikroskobuna yerleştirin.
- Bir fare yavrusunu, doğum sonrası gün P0-2'yi keskin bir makasla hızlı bir şekilde keserek ötenazi yapın.
- Kanı temizlemek için kafayı diseksiyon mikroskobu altında DM ile Petri kabına yerleştirin.
- İnce makas kullanarak, kafatasının tabanındaki her bir yan kenardan bir kez kesin.
- Baş DM'de baş aşağı yerleştirildiğinde, # 5/45 forseps kullanarak kafatasının alt tarafına sıkıca bastırın ve hasar görmemiş arka beyni kafatasındaki delikten zorlayın.
- Diseksiyon mikroskobu altında, iki # 11 neşter kullanarak fazla dokuyu kesin. Beyinciğin alttaki arka beyin parçasına bağlı kaldığından emin olun. Ayrıntılı bir diyagram için Şekil 1A'ya bakın.
- Spatulayı kullanarak, beyinciği, doku arka beynin rostral yüzü üzerinde duracak ve arka beynin kaudal yüzü araştırmacıya bakacak şekilde doku kıyıcının kesme aşamasına aktarın. Beynin medial düzleminin doku doğrayıcı bıçağına tam olarak paralel olduğundan emin olun.
- P200 pipetini kullanarak, dokunun etrafındaki fazla ortamı çıkarın, hala nemli olduğundan ancak yüzmediğinden veya sıvıyla çevrili olmadığından emin olun.
- DM içeren Petri kabını diseksiyon mikroskobu altında SCM içeren Petri kabı ile değiştirin.
- Doku kıyıcı kullanarak dokuyu 350 μm kalınlığında dilimler halinde kesin.
NOT: Optimum kesme koşullarını sağlamak için bıçak hızının (örneğin, saniyede yaklaşık bir kesim) ve kuvvetin optimize edilmesi gerekir. Nadir durumlarda, doku bıçağa takılacaktır. Doku bölümlerinin kaybını en aza indirmek için, gerekirse doku kıyıcıyı hızlı bir şekilde kapatmak için başparmağınızı güç düğmesinin üzerinde tutun. - Dokunun altına 100 μL SCM'yi nazikçe pipetleyin, böylece dilimler yüzer. Spatula kullanarak dilimlenmiş dokuyu diseksiyon mikroskobu altında SCM ile Petri kabına aktarın.
- Mendil doğrayıcı bıçağı ve kesme aşamasını %70 etanol ile nazikçe silmek için pamuklu çubuk kullanın.
- Neşterleri (künt taraf) kullanarak, dilimleri diseksiyon mikroskobu altında nazikçe ayırın. Bir neşter ve spatula kullanarak, dilimleri SCM ile 6 oyuklu plakadaki zara aktarın.
NOT: En medial bölümler genellikle en iyi miyelinasyon ve doku bütünlüğüne sahip olacaktır. Ortalama olarak, bir fare beyninden 4-6 dilim çıkarılabilir. - Dilimleri SCM'de 37 °C'de% 7.5 CO2 içinde inkübe edin.
4. Kültür ve medya değişiklikleri (~15–30 dk)
- SCM'yi iki günde bir değiştirin.
- Yeni bir 6 oyuklu plakanın her bir oyuğuna 1 mL taze ortam pipetleyin ve bir inkübatörde ısıtın. Steril forseps kullanarak, zarları yeni plakaya aktarın ve altında kabarcık olmadığından emin olun. Plakaları inkübatöre geri koyun.
5. Standart miyelinasyon ve remiyelinizasyon
- Standart miyelinasyon protokolü (Şekil 1B).
- Bölüm 3'te 0-12 gün arasında in vitro (DIV) diseke edilen kültür dilimleri. Herhangi bir faktörün miyelinleşme üzerindeki etkisi test ediliyorsa, bunu kültürleme sırasında ortama ekleyin (0 DIV) ve her ortam değişikliğinde yenileyin.
- Eksik miyelinasyon 11,12,13 için optimize edilmiş bir zaman noktası olan 12 DIV'de (adım7.1) düzeltin. Bu, ortama eklenen faktöre bağlı olarak miyelinleşme üzerindeki herhangi bir arttırıcı veya bloke edici etkinin tespit edilmesini sağlar. 100 ng / mL Aktivin A ilavesiyle temsili bir pozitif sonuç Şekil 2'de gösterilmiştir.
- Remiyelinasyon protokolü (Şekil 1C)
- Dilimlerin tamamen miyelinlendiği zaman noktası olan 14 DIV'e kadar ek faktör olmadanbölüm 11,12,13'de açıklanan standart miyelinasyon protokolünü izleyin.
- Lizolesitin stoğunu (125 mg / mL) Tablo 1'de detaylandırıldığı gibi hazırlayın. SCM'de 1 mL %0.5 lizolesitini yeni bir 6 oyuklu plakanın her bir oyuğuna pipetleyin ve bir inkübatörde ısıtın.
- Membranları bir lizolesitin plakaya aktarın ve gece boyunca 16-18 saat boyunca bir inkübatöre koyun.
- Ertesi gün, gerekirse remiyelinizasyon etkileri için test edilen herhangi bir faktörü ekleyerek taze SCM ile yeni plakalar hazırlayın. Bir inkübatörde sıcak plakalar.
- Ortam değişimi için, tüm lizositin ortamının çıkarıldığından emin olmak için kuyu tarafındaki zara hafifçe vurun. Her ortam değişikliğinde test edilen faktör(ler)i yenileyin (bölüm 4).
- Dilimleri, eksik remiyelinasyon için optimize edilmiş bir zaman noktası olan 28 DIV'de (adım 7.1) sabitleyin. Bu, ortama eklenen faktöre bağlı olarak remiyelinizasyonun arttırılmasının veya bloke edilmesinin tespit edilmesini sağlar. 0.1 μM XAV939 ilavesiyle temsili bir pozitif sonuç Şekil 3'te sunulmuştur.
6. Miyelinasyon ve remiyelinizasyon protokolündeki değişiklikler
- Hipoksiye bağlı hipomiyelinasyon protokolü (Şekil 1D)11,13.
NOT: Bu, bölüm 5.1'de sunulan standart miyelinasyon protokolünün bir varyasyonu olarak sunulmuştur.- SCM'de faktör içermeyen plaka dilimleri.
- Dilim plakalarını 2-3 DIV arasında 24 saat boyunca hipoksik bir inkübatöre (% 2 FiO2) aktarın.
- Ertesi gün, gerekirse miyelinasyon potansiyeli için test edilen herhangi bir faktörü (faktörleri) ekleyerek taze SCM ile yeni plakalar hazırlayın. Bir inkübatörde sıcak plakalar.
- Hipokside kültürü takiben, ortamı değiştirin (bölüm 4) ve kültürleri standart bir kültür inkübatörüne (37 ° C,% 7.5 CO2) geri döndürün. Test edilmekte olan tüm faktörleri sonraki her ortam değişikliğiyle yenileyin (bölüm 4).
- 12 DIV'de düzeltin (adım 7.1).
- Genetik manipülasyon protokolü (Şekil 1E)13
- Bölüm 3'teki gibi diseksiyon için transgenik farelerden doku izole edin.
- İndüklenebilir transgenik fare çizgileri ile, tamoksifen (100 nM, miyelinasyon veya OPC farklılaşmasını indüklemeyen bir doz) veya bir Ad-Cre adenovirüsü, 1 DIV ve 3 DIV'de yapılan medya değişiklikleri sırasında SCM'ye eklenebilir.
- Tamoksifen veya Ad-Cre adenovirüs ile genetik manipülasyonu takiben, bölüm 4'teki gibi her gün ortam değişikliklerine devam edin (gerekirse faktörler eklenerek).
NOTLAR: Bir fareden alınan tüm dilimler tek bir zara sığacak ve diseksiyondan sonra genotiplemeye izin verecek, böylece transgenik farelerle deney yapmayı kolaylaştıracaktır.
7. Doku işleme ve analizi
- Membranı oda sıcaklığında (RT) 1 saat boyunca nazikçe %4 paraformaldehit içine batırarak dilimleri sabitleyin.
- Fosfat tamponlu tuzlu suya (PBS) batırarak nazikçe durulayın. Ardından, PBS'ye 6 oyuklu bir plakaya daldırın.
NOT: Protokol buradan duraklatılabilir. Sabit dilimler PBS'de 4 °C'de bir aya kadar saklanabilir. Dilimleri saklamıyorsanız, devam etmeden önce 2x'i PBS'de 5 dakika durulayın. - Zarı halkadan kesmek için bir neşter kullanın ve 6 oyuklu bir plakada boyamaya devam edin. Boyama ve ardından slaytlara montaj için dilimleri yukarı bakacak şekilde (zar tarafı aşağı) tuttuğunuzdan emin olun.
- Blok çözeltisinde RT'de 1 saat bloke edin (% 3 ısıyla inaktive edilmiş at serumu,% 2 sığır serum albümini ve% 0.25 Triton-X 100 PBS'de seyreltilmiş).
NOT: Antikor boyaması için antijen alımı gerekiyorsa (örneğin, CC1 / Olig2), bu cam Petri kaplarında yapılabilir. - Plakaları parafin filme sarın ve bloke edici çözelti içinde seyreltilmiş birincil antikor içinde gece boyunca 4 ° C'de inkübe edin.
- Bloke edici solüsyonda 3 kez yıkayın: 1) kısa durulayın, 2) 15 dakika yıkayın ve 3) 1 saat yıkayın. Kısa bir durulama için, küçük bir Petri kabını solüsyonla doldurun ve taze solüsyona aktarmadan önce forseps kullanarak zarı hafifçe batırın. Daha uzun yıkamalar için (yani 15 dakika ve 1 saat), membranı 6 oyuklu bir plakaya çözeltiye batırın ve yumuşak bir külbütör üzerine yerleştirin.
- PBS'de 1:500 oranında seyreltilmiş ikincil antikorlarda RT'de 2 saat boyunca ışıktan kapalı inkübe edin.
- PBS'de 3 kez yıkayın: 1) kısa durulayın, 2) 15 dakika yıkayın ve 3) 1 saat yıkayın.
- DAPI boyama gerekiyorsa, RT'de 7 dakika boyunca 1: 1.000 DAPI çözeltisine batırın. Kısa bir süre durulayın ve ardından PBS'de 15 dakika yıkayın.
- Çift damıtılmış suda durulayın.
- Membranları, dilimleri yukarı bakacak şekilde (membran tarafı aşağı) bir slayt üzerine monte edin.
NOT: Monte edilmiş dilimler 4 °C'de saklanabilir. Konfokal mikroskopta görüntüleme en iyi 1 hafta içinde, zar opak hale gelmeden ve görüntülenmesi zor hale gelmeden önce yapılır. - Konfokal mikroskopi kullanarak görüntü dilimleri ve daha önce tarif edildiği gibi nicelleştirme 11,12,13.
Sonuçlar
P0-2 farelerinden türetilen serebellar dilim kültürleri (Şekil 1A), miyelinasyonu incelemek ve 0-12 DIV (Şekil 1B) arasındaki çeşitli faktörlerin eklenmesinin etkilerini değerlendirmek için kullanıldı. Remiyelinasyonu incelemek için, 14 DIV'deki dilim kültürleri önce lizolesitin ile demiyelinize edildi ve test edilen faktörlerle kültürde 14 gün daha remiyelinat yapmasına izin verildi (Şekil 1C), daha sonra remiyelinizasyon ölçüldü. Hipoksinin miyelinleşme üzerindeki etkisi, dilim kültürlerinin 2-3 DIV'den 24 saat boyunca% 2 FiO2 hipoksik inkübatöre yerleştirilmesiyle de incelenmiştir (Şekil 1D). Son olarak, gen nakavtlarının miyelinleşme üzerindeki etkisini incelemek için transgenik farelerden türetilen dilim kültürleri kullanıldı. Bu sistemde, Cre rekombinasyonu, 1 DIV ve 3 DIV'de tamoksifen veya Ad-Cre adenovirüsünün eklenmesi ve 12 DIV'de analiz için sabitlenen dilim kültürleri ile indüklenmiştir (Şekil 1E). Dokuların fiksasyonundan sonra, demiyelinizasyon ve remiyelinizasyonun miktar tayini immün boyama (Şekil 2, Şekil 3) ve elektron mikroskobu 11,12,13 ile gerçekleştirildi.
Gösterilen temsili veriler (Şekil 2, Şekil 3), dilim kültürlerinde miyelinasyon ve remiyelinizasyonun dinamik aralığını göstermektedir. Miyelinasyon indeksi, kompakt miyelinin dolaylı bir okuması olan paranodal bir belirteç olan Caspr'ın, aksonları boyayan nörofilament protein H'ye (NFH) oranı ile ölçüldü. Bu miyelinasyon indeksi, elektron mikroskobu ve sodyum kanal boyaması12 ile kompakt miyelin oluşumunu temsil edecek şekilde doğrulanmıştır. Lizolesitin ile indüklenen demiyelinizasyon9,10, Caspr-pozitif paranotların tamamen kaybolmasına (miyelinasyon indeksi = 0, Şekil 3A) ve remiyelinizasyon 11,12 sırasında restore edilen kompakt miyelin kaybına yol açtı.
Miyelinleşme üzerinde olumlu bir sonuç göstermek için, dilimler Şekil 1B'deki zaman çizelgesini takip ederek Activin A ile kültürlendi. Aktivin A, oligodendrositler üzerindeki aktivin reseptörlerini devreye sokar ve oligodendrosit farklılaşmasını ve miyelin sıkıştırmasını15 tetikler. Temsili veriler, miyelinasyon sırasında dilimlerin 100 ng / mL Aktivin A ile muamele edilmesinin daha yüksek bir miyelinasyon indeksi ile sonuçlandığını göstermektedir (Şekil 2A, B). Bununla tutarlı olarak, Activin A tedavisi, CC1 pozitif olgun oligodendrositlerin Olig2 + oligodendrosit soy hücrelerine11,13 oranı ile ölçüldüğü gibi OPC farklılaşmasını hızlandırdı (Şekil 2C, D).
Küçük moleküllü bir Tankyrase inhibitörü olan XAV939'un, oligodendrositler11'de Axin2 seviyelerinin stabilizasyonu ile miyelinasyon ve remiyelinizasyonu teşvik ettiği gösterilmiştir. Lizolesitin tedavisini takiben, parçalanmış miyelin bazik protein (MBP) boyaması ve Caspr pozitif paranot eksikliği ile dilim kültürlerinde demiyelinizasyon görüntülendi ve ölçüldü (Şekil 3A). Remiyelinizasyon (15-28 DIV) sırasında 0.1 μM XAV939 ile tedavi, Caspr'nin NFH boyamasına oranı ile ölçüldüğü gibi, araç kontrollerine kıyasla miyelinasyon indeksini önemli ölçüde arttırmıştır (Şekil 3B, C). Bu nedenle dilim kültürü modeli, sağlam dokuda OPC farklılaşması, miyelinleşme ve remiyelinizasyon üzerindeki etkileri incelemek ve ölçmek için kullanılabilir.
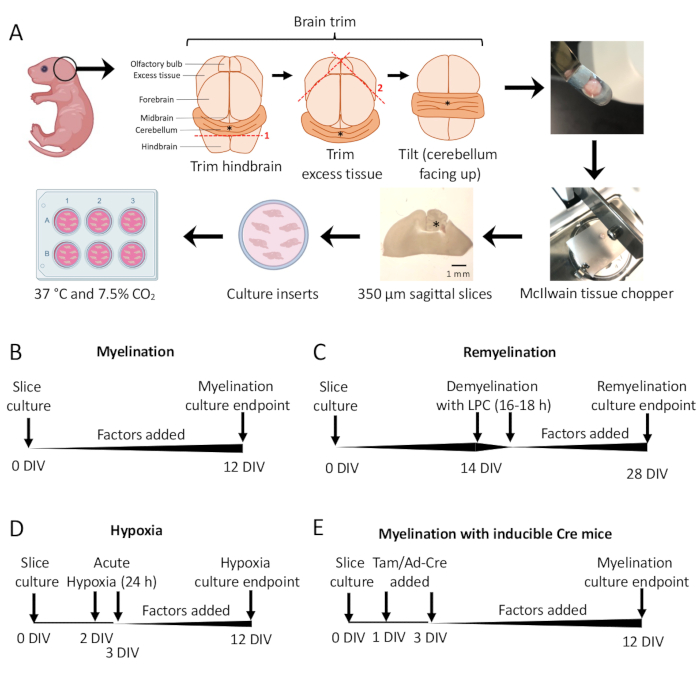
Şekil 1: Diseksiyon sürecindeki temel adımları ve farklı dilim kültürü protokolleri için zaman çizelgelerini gösteren serebellar dilim kültürlerinin şeması. (A) Dilim kültürleri oluşturmak için adımların tasviri: P0-2 fare yavrularından beyinlerin diseksiyonu, beynin kesilmesi (gösterildiği gibi), 350 μm sagital dilimler oluşturmak için beynin bir doku kıyıcı ile kesilmesi, dilimlerin 6 oyuklu bir tabakta organotipik kültür eklerine yerleştirilmesi ve 37 ° C ve% 7.5 CO2'de inkübe edilmesi. * beyinciği ifade eder. (B) Miyelinli dilim kültürleri için zaman çizelgesi. Dilim kültürleri, analiz için fiksasyondan önce 12 gün inkübe edildi. (C) Dilim kültürlerinin yeniden miyelinize edilmesi için zaman çizelgesi. Dilimler, tam demiyelinizasyonu indüklemek için 16-18 saat boyunca 14 DIV'de lizolesitin ile muamele edildi ve analiz için fiksasyondan önce 28 DIV'ye kadar remiyelinasyona izin verildi. (D) Hipoksik hakaretten sonra miyelinasyon için zaman çizelgesi. Dilimler, 2-3 DIV arasında 24 saat boyunca akut hipoksik bir hakarete maruz bırakıldı ve bu da hipomiyelinleşmeye neden oldu. (E) Genetiği değiştirilmiş farelerden CSC için zaman çizelgesi. Genetik modifikasyonu indüklemek için 1 DIV ve 3 DIV'de tamoksifen (Tam, 100nM) veya Ad-Cre virüsü eklendi ve dilimler 12 DIV'de analiz edildi. Önceki yayınlardan uyarlanan zaman çizelgesi diyagramları11,13. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
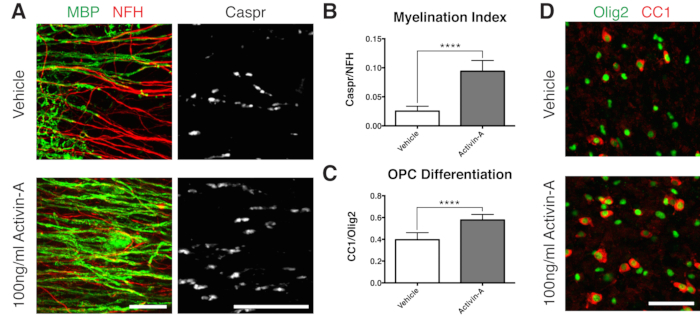
Şekil 2: Aktivin A'nın miyelinasyon ve OPC farklılaşmasını desteklediğini gösteren temsili veriler. (A) 100 ng / mL Aktivin A tedavisi ile miyelinasyon (MBP) ve paranotlarda (Caspr) artış, dilim kültürlerinin immün boyanması ile gösterilmiştir. (B) Miyelinasyon indeksinin ölçülmesi (Caspr + paranodları için boyanan alanın NFH + aksonları için boyanan alana oranı). (C) OPC farklılaşmasının nicelleştirilmesi (CC1 + oligodendrositlerin Olig2 + oligodendrosit soy hücrelerine oranı). (D) CC1/Olig2 boyamanın temsili görüntüleri. Gösterilen değerler ortalama + standart sapmadır. P < 0.0001; eşlenmemiş T-testi. Ölçek çubukları: A = 25 μm, D = 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
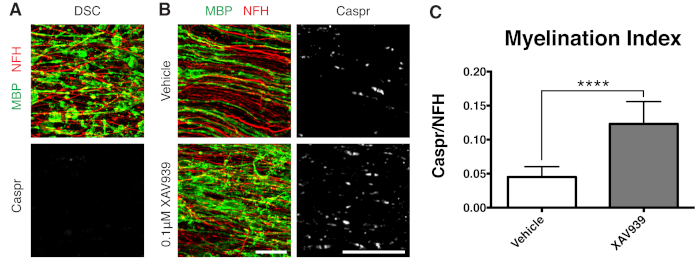
Şekil 3: XAV939'un remiyelinasyonu desteklediğini gösteren temsili veriler. (A) Lizolesitin ile muamele edilen dilim kültürlerinde parçalanmış MBP boyaması ile demiyelinizasyon ve Caspr paranot eksikliğini gösteren görüntüler. (B) Dilim kültürlerinin immün boyanması ile gösterilen lizolesitin kaynaklı demiyelinizasyonu takiben 0.1 μM XAV939 tedavisi ile remiyelinizasyon (MBP) ve paranotlarda (Caspr) artış. (C) Miyelinasyon indeksinin nicelleştirilmesi (Caspr + paranotları için boyanan alanın NFH + aksonları için boyanan alana oranı). Gösterilen değerler ortalama + standart sapmadır. P < 0.0001; eşlenmemiş T-testi. Ölçek çubukları = 25 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Dilim kültürü ortamı (SCM) | |
| Hacim | Reaktif |
| 100 mL | Minimum Esansiyel Medya (MEM), HEPES, glutamin içermez |
| 50 mL | Isı ile etkisiz hale getirilmiş at serumu |
| 50 mL | Earle'ün dengeli tuz çözeltisi |
| 2 mL | Penisilin-streptomisin 10.000 U/mL |
| 2 mL | GlutaMAX takviyesi |
| 2888 μL | % 45 glikoz çözeltisi |
| 1 mL | mantar bölgesi |
| Steril filtreyi 0,22 μm'lik bir filtreden geçirin ve 4 °C buzdolabında 2 haftaya kadar saklayın. | |
| Diseksiyon ortamı (DM) | |
| Hacim | Reaktif |
| 100 mL | MEM, HEPES, Earle'ün tuzları ile |
| 1 mL | Penisilin-streptomisin 10.000 U/mL |
| Steril filtreyi 0,22 μm'lik bir filtreden geçirin ve 4 °C buzdolabında 2 aya kadar saklayın. | |
| Lizolesitin stoğu (125 mg / mL) | |
| Miktar | Reaktif |
| 100 mg | Lisolesitin |
| 0.8 mL | Steril PBS |
| 100 mg lizolesitini 0.8 mL steril PBS'de çözün. 80 μL'lik stok çözeltisini -20 °C'de saklayın. | |
| Kullanmadan önce, 80 μL'lik alikotu çözün ve 37 °C, %7,5 CO2 inkübatörde ısıtılan 20 mL SCM'de (SCM'de %0,5 lizolesitin) çözün. Gerekirse, lizolesitini SCM'ye çözmek için girdap. | |
Tablo 1: Dilim kültür ortamı (SCM), diseksiyon ortamı (DM) ve lizolesitin çözeltisi yapmak için bileşenlerin ve protokolün listesi.
Tartışmalar
Bu protokol, bir in vitro modelin basitliği ile in vivo hücresel bileşimi özetleyen bir organotipik serebellar dilim kültür modelini tanımlar. Bu protokol, insan patolojilerinin daha temsili bir modeli haline gelmek için daha da geliştirilebilir. CSC, kuvvete bağlı doku yaralanması, miyelin spesifik antikorların neden olduğu yaralanma veya periferik bağışıklık hücrelerinin eklenmesiyle MS'de oligodendrosit hasarı gibi hastalığa özgü yaralanmalar için potansiyel olarak model olarak geliştirilebilir. Bu protokol aynı zamanda beynin ve omuriliğin diğer bölümlerinden diseke edilen dokular için de optimize edilebilir16,17. Bu protokol miyelinasyonun histolojik miktar tayinine odaklanırken, CSC çeşitli deneysel uç noktaları incelemek için uygun bir model temsil eder. Bu kültürler, tek hücreli RNA dizilimi yoluyla farklı hücre tiplerini karakterize etmek, elektron mikroskobu ile aksonların ve miyelin kılıflarının üst yapısını değerlendirmek ve zaman atlamalı görüntüleme yaparak OPC dinamiklerini incelemek için kullanılabilir. İmmün boyama, transgenik fare raportör hatları18,19 kullanılarak da atlanabilir. Son olarak, CSC'yi farklı hastalık mekanizmalarını modellemek için farklı yaşlardaki fare yavruları, kültürde geçen süre veya kesit kalınlığı kullanılabilir 10,17,18,19,20,23.
Dilim kültürleri, miyelinasyon ve remiyelinasyonu etkileyen faktörleri test etmek ve ölçmek için idealdir, ancak belirli bağlamlarda CNS'yi temsillerinde sınırlıdır. P 0-2 beyinlerinden türetilen CSC, gelişimin erken dönemlerinde olan ve yaşlanan veya nörodejeneratif bir beyinle sınırlı benzerlikleri olan beyinlerden gelir. Alzheimer Hastalığı21 ve şizofreni22 gibi CNS bozukluklarında miyelinin önemi konusunda artan bir farkındalık göz önüne alındığında, miyelinleşmeyi ölçmek ve karakterize etmek için yetişkin veya yaşlanan modeller gereklidir. Hala gelişim aşamalarında olmasına rağmen, yaşlı kemirgenlerden doku izole eden başka protokoller yayınlanmıştır 10,18,19,23. Ek olarak, beyincikteki oligodendrositlerde ve OPC'lerde, omurilik ve beyindeki diğer beyaz cevher yollarına kıyasla içsel ve dışsal farklılıklar olabilir. CSC ayrıca büyük ölçekli CRISPR veya küçük moleküllü ekranlar için hücre bazlı in vitro sistemlerden daha az uygundur. İlk doku dilimlemesi nedeniyle, beyinde yerleşik doğuştan gelen bağışıklık hücrelerinin (yani mikroglia ve astrositler) aktivasyonu da vardır, bu da sistem24 için önemli bir uyarıdır. Son olarak, periferik immün hücreler MS patolojisinde büyük bir rol oynar25; CSC, bu hücreler ekzojen olarak eklenmedikçe periferik hücrelerden yoksundur ve bu nedenle inflamatuar CNS ortamının ideal bir modeli değildir.
Bu protokolün diseksiyon kısmı belki de en kritik olanıdır. Dokuya ve alttaki yapıya zarar vermemek için diseksiyon adımları azami özen gösterilerek yapılmalıdır. Beynin doku doğrayıcı bıçağı boyunca uygun şekilde hizalanması, doku ve hücrelere minimum hasar verilmesini sağlar. Ek olarak, dilimlerin dikkatli bir şekilde diseksiyonu ve ayrılması ve bunların kültür için zarlara aktarılması önemlidir. Bu protokolde belirtilen zaman dilimleri, açıklanan araştırma için optimize edilmiştir, ancak farklı çalışmalarda en iyi sonuçlar için ayarlanması gerekebilir. Bu protokol, gelişimsel miyelinleşme ve miyelin onarımı üzerine çalışmak isteyenler için faydalı olacaktır.
Notsuz, MS için bir tedavi yoktur. Mevcut tedaviler adaptif bağışıklık sistemini nemlendirmede oldukça etkili olsa da, mevcut hiçbir tedavi ilerlemeyi durduramaz. Remiyelinizasyon başarısızlığının ve müteakip nörodejenerasyonun MS2'nin ilerlemesinin altında yattığı düşünülmektedir. Kronik MS lezyonlarında OPC'lerin varlığı, miyelin onarımının başarısızlığının OPC farklılaşmasındaki bir durmaya bağlı olabileceğini düşündürmektedir. CSC kullanımı, MS ilerlemesini tersine çevirmeye ve işlevi geri kazanmaya yardımcı olabilecek miyelin onarım tedavileri için bir keşif yolu açar. Miyelin onarım tedavisi, demiyelinize yolların lokomotor fonksiyonu inhibe ettiği omurilik yaralanması olan hastalarda iyileşmeye de yardımcı olabilir26. Bu nedenle, CSC'nin önemi, in vivo hayvan modellerine kıyasla memeli demiyelinizasyonunu ve remiyelinizasyonunu nispeten yüksek verimli bir şekilde etkileyen faktörleri belirlemeye uygunluğunda yatmaktadır. Birçok çalışmada farklılaşmayı etkileyen bileşiklerin taranması için primer OPC'ler kullanılmış olsa da, primer OPC'lerin üretilmesi ve izole edilmesi zahmetli ve ardışık immünopanning gerektirir27. Ek olarak, hücre bazlı tahliller, in vivo olarak mevcut hücre tiplerinin çeşitliliğini ve etkileşimini özetlemez. Fare yavrularından CSC oluşturmak, pahalı ekipman veya sarf malzemeleri gerektirmeyen miyelinasyon ve remiyelinasyonu incelemek için hızlı ve uygun maliyetli bir modeldir. Bu nedenle serebellar dilim kültürleri, miyelinasyonu ex vivo olarak özetlemek için paha biçilmez bir kantitatif modeli temsil eder ve ilaç keşfi ve temel bilim araştırmalarını mümkün kılar.
Açıklamalar
Yazarlar, Roche Grubu'nun bir üyesi olan Genentech, Inc.'in çalışanlarıdır.
Teşekkürler
Yazarlar, bu makaleyle ilgili yapıcı yorumları ve katkıları için Yun-An Shen, Roxanne Kyauk ve Chris Bohlen'e teşekkür eder. Buna ek olarak, yazarlar Charles ffrench-Constant, Andrew Jarjour, Veronique Miron ve David Rowitch'in daha önce yayınlanan ilgili metodolojinin erken gelişiminde katkılarını kabul ederler 11,12,13.
Malzemeler
| Name | Company | Catalog Number | Comments |
| #5/45 Forceps | Fine Science Tools | 11251-35 | Dissection tools |
| 32% Paraformaldehyde | Electron Microscopy Sciences | 50-980-495 | Fixative for staining |
| 45% glucose solution | Sigma | G8769 | Slice culture media component |
| 6-well tissue culture plates | Corning | 3516 | Plates for cultures |
| Alexa Fluor Goat anti-chicken 647 | Thermo Fisher Scientific | A21449 | Secondary staining antibody |
| Alexa Fluor Goat anti-mouse 647 | Thermo Fisher Scientific | A21236 | Secondary staining antibody |
| Alexa Fluor Goat anti-rabbit 555 | Thermo Fisher Scientific | A11006 | Secondary staining antibody |
| Alexa Fluor Goat anti-rat 488 | Thermo Fisher Scientific | A21428 | Secondary staining antibody |
| Blades, Double-edge, PTFE coated Stainless steel | Ted Pella | 121-6 | Chopping blades |
| Bovine Serum Albumin (BSA) | Sigma | A9418 | Blocking solution component |
| Chicken anti-NFH antibody | Encor Biotech | CPCA-NF-H | Staining antibody |
| Confocal Microscope | Zeiss | LSM780 | Confocal for imaging |
| Corning 250 mL vacuum filter/storage bottle system, 0.22 µm pore | Corning | 431096 | For media preparation |
| Earl's balanced salt solution | Sigma | E2888 | Slice culture media component |
| Feather surgical blade | Feather | 2976#11 | Dissection tools |
| Fungizone | Thermo Fisher Scientific | 15290-18 | Dissection media component |
| GlutaMAX supplement | Thermo Fisher Scientific | 35050-061 | Slice culture media component |
| Heat-inactivated horse serum | Thermo Fisher Scientific | 26050-88 | Slice culture media component |
| Lysolecithin | Sigma | L4129 | |
| Lysophosphatidylcholine from egg yolk | Sigma | L4129 | To induce demyelination |
| McIlwain Tissue Chopper | Ted Pella | 10180 | Tissue chopper |
| MEM, Hepes, no glutamine | Thermo Fisher Scientific | 12360-038 | Slice culture media component |
| MEM, Hepes, with Earle's salts | Sigma | M7278 | Dissection media component |
| Metal spatula | Fisher Scientific | 470149-442 | Dissection tools - bend flat end at angle for use |
| Millicell Culture Plate Insert 30mm Organotypic PTFE | Fisher | PICM0RG50 | Culture insert |
| Mouse anti-CC1 antibody | Millipore | OP80-100UG | Staining antibody |
| Noyes spring scissors | Fine Science Tools | 15012-12 | Dissection tools |
| PBS pH 7.4 | Gibco | 10010023 | For dilution of fixative |
| Penicillin-streptomycin 10,000U/mL | Thermo Fisher Scientific | 15140-122 | Slice culture media component |
| Rabbit anti-Caspr antibody | Abcam | ab34151 | Staining antibody |
| Rabbit anti-Olig2 antibody | Millipore | AB9610 | Staining antibody |
| Rat anti-MBP antibody | Serotec | MCA409S | Staining antibody |
| Scalpel handle #3 | Fine Science Tools | 10003-12 | Dissection tools |
| Silicone rubber foam sheet | MSC Industrial Direct Co | 31939176 | Cutting base |
| Stereo Microscope | Olympus Life Sciences | SZ61 | Microscope for dissection |
| Student surgical scissors | Fine Science Tools | 91401-12 | Dissection tools |
Referanslar
- Purves, D., Augustine, G. J., Fitzpatrick, D. Increased Conduction Velocity as a Result of Myelination. Neuroscience 2nd edition. , (2001).
- Dutta, R., Trapp, B. D. Mechanisms of neuronal dysfunction and degeneration in multiple sclerosis. Progress in Neurobiology. 93 (1), 1-12 (2011).
- Trapp, B. D., Nave, K. A. Multiple sclerosis: an immune or neurodegenerative disorder?. Annual Review of Neuroscience. 31, 247-269 (2008).
- Bradl, M., Lassmann, H. Oligodendrocytes: biology and pathology. Acta Neuropathologica. 119 (1), 37-53 (2010).
- Domingues, H. S., Portugal, C. C., Socodato, R., Relvas, J. B. Oligodendrocyte, Astrocyte, and Microglia Crosstalk in Myelin Development, Damage, and Repair. Frontiers in Cell and Developmental Biology. 4, 71 (2016).
- Nave, K. A., Werner, H. B. Myelination of the nervous system: mechanisms and functions. Annual Review of Cell and Developmental Biology. 30, 503-533 (2014).
- Franklin, R. J. M., Ffrench-Constant, C. Regenerating CNS myelin – from mechanisms to experimental medicines. Nature Reviews Neuroscience. 18 (12), 753-769 (2017).
- Molina-Gonzalez, I., Miron, V. E. Astrocytes in myelination and remyelination. Neuroscience Letters. 713, 134532 (2019).
- Keough, M. B., Jensen, S. K., Yong, V. W. Experimental demyelination and remyelination of murine spinal cord by focal injection of lysolecithin. Journal of Visualized Experiments. (97), e52679 (2015).
- Birgbauer, E., Rao, T. S., Webb, M. Lysolecithin induces demyelination in vitro in a cerebellar slice culture system. Journal of Neuroscience Research. 78, 157-166 (2004).
- Fancy, S. P., et al. Axin2 as regulatory and therapeutic target in newborn brain injury and remyelination. Nature Neuroscience. 14 (8), 1009-1016 (2011).
- Yuen, T. J., et al. Identification of endothelin-2 as an inflammatory factor that promotes CNS remyelination. Brain. 136, 1035-1047 (2013).
- Yuen, T. J., et al. Oligodendrocyte-encoded HIF function couples postnatal myelination and white matter angiogenesis. Cell. 158 (2), 383-396 (2014).
- Stokes, C. E., Murphy, D., Paton, J. F., Kasparov, S. Dynamics of a transgene expression in acute rat brain slices transfected with adenoviral vectors. Experimental Physiology. 88, 459-466 (2003).
- Dillenburg, A., et al. Activin receptors regulate the oligodendrocyte lineage in health and disease. Acta Neuropathologica. 135 (6), 887-906 (2018).
- Dean, J. M., et al. An organotypic slice culture model of chronic white matter injury with maturation arrest of oligodendrocyte progenitors. Molecular Neurodegeneration. 6, 46 (2011).
- Zhang, H., Jarjour, A. A., Boyd, A., Williams, A. Central nervous system remyelination in culture--a tool for multiple sclerosis research. Experimental Neurology. 230 (1), 138-148 (2011).
- Hill, R. A., Medved, J., Patel, K. D., Nishiyama, A. Organotypic slice cultures to study oligodendrocyte dynamics and myelination. Journal of Visualized Experiments. (90), e51835 (2014).
- Sherafat, A., Hill, R. A., Nishiyama, A. Organotypic Slice Cultures to Study Oligodendrocyte Proliferation, Fate, and Myelination. Molecular Biology (Clifton, N.J.). 1791, 145-156 (2018).
- Croft, C. L., Noble, W. Preparation of organotypic brain slice cultures for the study of Alzheimer's disease. F1000Research. 7, 592 (2018).
- Nasrabady, S. E., Rizvi, B., Goldman, J. E., Brickman, A. M. White matter changes in Alzheimer's disease: a focus on myelin and oligodendrocytes. Acta Neuropathologica Communications. 6 (1), 22 (2019).
- Flynn, S. W., et al. Abnormalities of myelination in schizophrenia detected in vivo with MRI, and post-mortem with analysis of oligodendrocyte proteins. Molecular Psychiatry. 38, 811-820 (2003).
- Thetiot, M., Ronzano, R., Aigrot, M. S., Lubetzki, C., Desmazières, A. Preparation and Immunostaining of Myelinating Organotypic Cerebellar Slice Cultures. Journal of Visualized Experiments. (145), e59163 (2019).
- Gerlach, J., Donkels, C., Münzner, G., Haas, C. A. Persistent Gliosis Interferes with Neurogenesis in Organotypic Hippocampal Slice Cultures. Frontiers in Cellular Neuroscience. 10, 131 (2016).
- Reich, D. S., Lucchinette, C. F., Calabresi, P. A. Multiple Sclerosis. New England Journal of Medicine. 378 (2), 169-180 (2018).
- Jeffery, N. D., Blakemore, W. F. Locomotor deficits induced by experimental spinal cord demyelination are abolished by spontaneous remyelination. Brain. 120, 27-37 (1997).
- Emery, B., Dugas, J. C. Purification of oligodendrocyte lineage cells from mouse cortices by immunopanning. Cold Spring Harbor Protocols. , 854-868 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır