Method Article
mielinización y remielinización ex vivo en cultivos de cortes cerebelosos como modelo cuantitativo para manipulaciones relevantes para el desarrollo y la enfermedad
En este artículo
Resumen
Se presenta un protocolo para un modelo cuantitativo ex vivo de desmielinización y remielinización utilizando cultivos de cortes cerebelosos de ratón. Este método recapitula de cerca un modelo in vivo con su complemento completo de tipos de células del SNC en tejido intacto, al tiempo que mantiene la capacidad química, genética y ambiental de un sistema in vitro.
Resumen
El estudio de la mielinización in vitro e in vivo plantea numerosos desafíos. La diferenciación de las células precursoras de oligodendrocitos (OPCs) in vitro, aunque escalable, no recapitula la mielinización axonal. Los cocultivos de neuronas OPC y los cultivos de fibras OPC permiten el examen de la mielinización in vitro, pero carecen de tipos de células adicionales que estén presentes in vivo, como los astrocitos y la microglía. Sin embargo, los modelos de ratón in vivo son menos susceptibles a la manipulación química, ambiental y genética y son mucho más laboriosos. Aquí, describimos un sistema cuantitativo de cultivo de corte cerebeloso (CSC) de ratón ex vivo que es útil para: 1) estudiar la mielinización del desarrollo, 2) modelar la desmielinización y la remielinización, y 3) realizar investigación traslacional. Las secciones sagitales del cerebelo y el cerebro posterior se aíslan de ratones del día postnatal (P) 0-2, después de lo cual mielinizan ex vivo durante 12 días. Durante este período, los cortes se pueden manipular de varias maneras, incluida la adición de compuestos para probar un efecto sobre la mielinización del desarrollo. Además, se puede fijar tejido para microscopía electrónica para evaluar la ultraestructura y la compactación de la mielina. Para modelar la enfermedad, la CSC puede someterse a hipoxia aguda para inducir hipomielinización. La desmielinización en estos explantes también puede ser inducida por la lisolecitina, lo que permite la identificación de factores que promueven la remielinización. Aparte de las modificaciones químicas y ambientales, las CSC se pueden aislar de ratones transgénicos y responden a la manipulación genética inducida con adenovirus Ad-Cre y tamoxifeno. Por lo tanto, los cultivos de cortes cerebelosos son un modelo rápido, reproducible y cuantificable para recapitular la mielinización.
Introducción
La mielinización de los axones permite la rápida propagación de los potenciales de acción, un mecanismo conocido como conducción saltatoria1. La importancia de la mielina se ve subrayada por las enfermedades desmielinizantes, como la esclerosis múltiple (EM), que incluyen una amplia gama de manifestaciones debilitantes, como la pérdida de la visión, los problemas cognitivos y la parálisis. No existe cura para la EM, y las terapias actuales se centran en limitar la progresión de la enfermedad dirigiéndose a las células inmunitarias periféricas. Se cree que la discapacidad en la EM y las enfermedades relacionadas está impulsada por una falla en la remielinización y una neurodegeneración progresiva. En particular, se observa desmielinización, atrofia y pérdida axonal en la EM progresiva 2,3. Por lo tanto, promover la remielinización representa una estrategia prometedora que podría llevarse a cabo en paralelo a los tratamientos actuales y producir beneficios terapéuticos adicionales.
En el sistema nervioso central (SNC), la mielinización es llevada a cabo por células gliales especializadas conocidas como oligodendrocitos. Las células precursoras de oligodendrocitos (OPC) se diferencian en oligodendrocitos maduros y mielinizantes a través de una serie de pasos altamente orquestados, que incluyen el crecimiento de procesos que entran en contacto con los axones, aumentos en la complejidad morfológica, expansión de la membrana de mielina y, finalmente, la compactación de la vaina de mielina4. Por lo tanto, la interacción entre los oligodendrocitos y las neuronas es muy íntima. Las interacciones recíprocas entre las neuronas y los oligodendrocitos también son necesarias para la salud y el mantenimiento del SNC2. La actividad axonal desempeña un papel en la estimulación de la mielinización y los factores neurotróficos gliales apoyan la integridad de las neuronas. La importancia de la diafonía glía-glía en el SNC también es cada vez más reconocida 5,6,7,8. Por ejemplo, los factores astrocíticos pueden influir en la diferenciación de las OPC y en el mantenimiento de los tractos de sustancia blanca. La microglía también desempeña un papel en la modulación de la diferenciación de OPC, así como en la eliminación de los restos de mielina, un paso importante del proceso de remielinización. La identificación de los factores autónomos de las células y la comprensión de la influencia de otros tipos de células del SNC en la desmielinización y la remielinización serán invaluables para el desarrollo de terapias para las enfermedades desmielinizantes y desmielinizantes.
En este trabajo describimos un sistema ex vivo que utiliza cultivos de cortes cerebelosos (CSC) de ratón que permite la manipulación y cuantificación de tejido intacto del SNC. El uso de CSC permite medir la mielinización, o remielinización después de la inducción de la desmielinización por lisolecitina 9,10, utilizando métodos tradicionalmente utilizados con estudios in vivo, como la inmunotinción y la microscopía electrónica 11,12,13. La lisolecitina es un producto químico que altera la membrana y provoca una rápida pérdida de mielina y oligodendrocitos. Una posible advertencia a tener en cuenta es que la lisolecitina también puede resultar en la reducción de otros tipos de células cerca del área de la lesión. Sin embargo, a diferencia de los experimentos in vivo, los cortes sagitales del cerebelo pueden manipularse fácilmente mediante la adición de compuestos o alterarse genéticamente utilizando adenovirus Ad-Cre. El método también permite la manipulación de tejido aislado de ratones transgénicos o ratones sometidos a agresiones ambientales como la hipoxia 11,12,13,14. Por lo tanto, el modelo CSC permite el estudio de la mielinización del desarrollo, el modelado de la enfermedad y la identificación de factores que promueven o inhiben la mielinización, al tiempo que integra las contribuciones de diferentes tipos de células del SNC a la función de los oligodendrocitos.
Protocolo
Todos los estudios en animales fueron autorizados y aprobados por el Comité Institucional de Cuidado y Uso de Animales de Genentech.
1. Preparación de medios y suministros para la disección (~30–45 min)
- Prepare y filtre estérilmente el medio de cultivo (SCM) y el medio de disección (DM) como se detalla en la Tabla 1. Conservar a 4 °C. Si se está probando algún factor para el ensayo de mielinización, agréguelo al SCM justo antes de usarlo.
- Pipetee 1 mL de SCM en cada pocillo de la placa de 6 pocillos.
- Con pinzas estériles, coloque un inserto organotípico en cada pocillo, asegurándose de que no queden burbujas atrapadas debajo de la membrana. Calentar la placa con medios a 37 °C en una incubadora de 7,5% de CO2 .
2. Preparación del área de disección (~5–10 min)
- Realice procedimientos en una campana de flujo laminar estéril o en la mesa de trabajo con técnicas asépticas adecuadas para todos los pasos del procedimiento. Limpie todas las áreas con etanol al 70%.
- Coloque una nueva cuchilla y una nueva etapa de corte de silicona en la picadora de pañuelos. Pipetea ~300 μL de agua estéril o etanol al 70% bajo la etapa de corte para garantizar que permanezca en su lugar.
- Utilice un bastoncillo de algodón para limpiar suavemente la cuchilla del picador de pañuelos y la etapa de corte con etanol al 70%. Seque antes de usar el picador de pañuelos.
- Rocíe todas las herramientas de disección con etanol al 70% y séquelas antes de la disección.
- Prepare dos placas de Petri de 10 cm: una con 15-20 mL de MS y otra con 10 mL de SCM. Almacenar en hielo. Mantenga todos los medios y placas de Petri en hielo cuando no esté diseccionando.
3. Disección del cultivo en corte cerebeloso (~15-20 min por cachorro)
- Coloque la placa de Petri con DM en un microscopio de disección.
- Sacrificar a un cachorro de ratón, día postnatal P0-2, mediante una decapitación rápida con tijeras afiladas.
- Coloque la cabeza en la placa de Petri con DM bajo el microscopio de disección para eliminar la sangre.
- Con unas tijeras finas, corte una vez en cada borde lateral en la base del cráneo.
- Con la cabeza colocada boca abajo en DM, presione firmemente la parte inferior del cráneo con pinzas # 5/45, forzando el cerebro posterior no dañado a través del orificio en el cráneo.
- Bajo el microscopio de disección, corte el exceso de tejido con dos bisturíes #11. Asegúrese de que el cerebelo permanezca unido a la parte subyacente del cerebro posterior. Consulte la Figura 1A para obtener un diagrama detallado.
- Con la espátula, transfiera el cerebelo a la etapa de corte del cortador de tejidos con el tejido descansando sobre la cara rostral del cerebro posterior y la cara caudal del cerebro posterior mirando hacia el investigador. Asegúrese de que el plano medial del cerebro esté exactamente paralelo a la cuchilla del corte de tejido.
- Con la pipeta P200, elimine el exceso de medio alrededor del tejido, asegurándose de que aún esté húmedo pero no flotando ni rodeado de líquido.
- Cambie la placa de Petri que contiene DM por la placa de Petri que contiene SCM bajo el microscopio de disección.
- Corta el pañuelo en rodajas de 350 μm de grosor con la picadora de pañuelos.
NOTA: La velocidad de la cuchilla (por ejemplo, aproximadamente un corte por segundo) y la fuerza deben optimizarse para garantizar condiciones de corte óptimas. En raras ocasiones, el tejido quedará atrapado en la hoja. Para minimizar la pérdida de secciones de tejido, mantenga el pulgar en el botón de encendido para apagar rápidamente el picador de pañuelos si es necesario. - Pipetee suavemente 100 μL de SCM debajo del pañuelo, para que las rodajas floten. Transfiera el tejido cortado con la espátula a la placa de Petri con SCM bajo un microscopio de disección.
- Utilice un bastoncillo de algodón para limpiar suavemente la cuchilla del picador de pañuelos y la etapa de corte con etanol al 70%.
- Con los bisturíes (lado romo), separe suavemente las rodajas bajo el microscopio de disección. Con un bisturí y una espátula, transfiera las rodajas a la membrana en la placa de 6 pocillos con SCM.
NOTA: Las secciones más mediales suelen tener la mejor mielinización e integridad de los tejidos. En promedio, se pueden diseccionar de 4 a 6 rebanadas de un cerebro de ratón. - Incubar las rodajas en SCM a 37 °C con 7,5% de CO2.
4. Cambios en la cultura y los medios de comunicación (~15–30 min)
- Reemplace el SCM cada dos días.
- Pipetear 1 mL de medio fresco en cada pocillo de una nueva placa de 6 pocillos y calentar en una incubadora. Con pinzas estériles, transfiera las membranas a la nueva placa, asegurándose de que no haya burbujas debajo. Regrese las placas a la incubadora.
5. Mielinización y remielinización estándar
- Protocolo estándar de mielinización (Figura 1B).
- Cortes de cultivo disecados en la sección 3 de 0 a 12 días in vitro (DIV). Si se está probando el efecto de cualquier factor sobre la mielinización, agréguelo al medio en el momento del cultivo (0 DIV) y reponga con cada cambio de medio.
- Se ha corregido en 12 DIV (paso 7.1), un punto de tiempo optimizado para la mielinización incompleta 11,12,13. Esto permite la detección de cualquier efecto potenciador o bloqueador de la mielinización debido al factor añadido al medio. En la Figura 2 se muestra un resultado positivo representativo con la adición de 100 ng/mL de Activina A.
- Protocolo de remielinización (Figura 1C)
- Seguir el protocolo estándar de mielinización descrito en la sección 5.1 sin factores adicionales hasta 14 DIV, momento en el que los cortes están completamente mielinizados 11,12,13.
- Prepare el caldo de lisolecitina (125 mg/mL) como se detalla en la Tabla 1. Pipetear 1 mL de lisolecitina al 0,5% en SCM en cada pocillo de una nueva placa de 6 pocillos y calentar en una incubadora.
- Transfiera las membranas a una placa de lisolecitina y colóquelas en una incubadora durante la noche durante 16 a 18 h.
- Al día siguiente, prepare platos nuevos con SCM fresco, agregando cualquier factor que se esté probando para determinar los efectos de la remielinización si es necesario. Placas calientes en una incubadora.
- Para el cambio de medio, golpee suavemente la membrana en el costado del pocillo para asegurarse de que se elimine todo el medio de lisolecitina. Reponga los factores que se están probando en cada cambio de medio (sección 4).
- Se corrigieron los segmentos en 28 DIV (paso 7.1), un punto de tiempo optimizado para la remielinización incompleta. Esto permite la detección de aumento o bloqueo de la remielinización debido al factor agregado al medio. En la Figura 3 se presenta un resultado positivo representativo con la adición de 0,1 μM de XAV939.
6. Variaciones en el protocolo de mielinización y remielinización
- Protocolo de hipomielinización inducida por hipoxia (Figura 1D)11,13.
NOTA: Esto se presenta como una variación del protocolo estándar de mielinización presentado en la sección 5.1.- Laminar lonchas en SCM sin factores.
- Transfiera las placas de corte a una incubadora hipóxica (2% FiO2) durante 24 h entre 2-3 DIV.
- Al día siguiente, prepare platos nuevos con SCM fresco, agregando cualquier factor que se esté probando para determinar el potencial de mielinización si es necesario. Placas calientes en una incubadora.
- Después del cultivo en hipoxia, cambie el medio (sección 4) y devuelva los cultivos a una incubadora de cultivo estándar (37 °C, 7,5% CO2). Reponga los factores que se estén probando con cada cambio de medio subsiguiente (sección 4).
- Corrección en 12 DIV (paso 7.1).
- Protocolo de manipulación genética (Figura 1E)13
- Aísle tejido de ratones transgénicos para su disección como en la sección 3.
- En el caso de las líneas de ratón transgénicos inducibles, se puede añadir tamoxifeno (100 nM, una dosis que no induce mielinización ni diferenciación de OPC) o un adenovirus Ad-Cre a la SCM durante los cambios de medio realizados en 1 DIV y 3 DIV.
- Después de la manipulación genética con tamoxifeno o adenovirus Ad-Cre, continúe con los cambios de medios cada dos días como en la sección 4 (con factores añadidos si es necesario).
NOTAS: Todos los cortes de un ratón caben en una membrana, lo que permite el genotipado después de la disección, lo que simplifica la realización de experimentos con ratones transgénicos.
7. Procesamiento y análisis de tejidos
- Fije las rodajas sumergiendo suavemente la membrana en paraformaldehído al 4% durante 1 h a temperatura ambiente (RT).
- Enjuague suavemente sumergiéndolo en solución salina tamponada con fosfato (PBS). Luego, sumérjalo en PBS en una placa de 6 pocillos.
NOTA: El protocolo se puede pausar aquí. Las porciones fijas se pueden almacenar en PBS a 4 °C durante un máximo de un mes. Si no almacena rebanadas, enjuague 2 veces en PBS durante 5 minutos antes de continuar. - Use un bisturí para cortar la membrana del anillo y proceda a teñir en una placa de 6 pocillos. Asegúrese de mantener las rodajas hacia arriba (con la membrana hacia abajo) para teñirlas y montarlas posteriormente en portaobjetos.
- Bloquear durante 1 h a RT en solución de bloques (3% de suero de caballo inactivado por calor, 2% de albúmina sérica bovina y 0,25% de Triton-X 100 diluido en PBS).
NOTA: Si se necesita la recuperación de antígenos para la tinción de anticuerpos (por ejemplo, CC1/Olig2), esto se puede hacer en placas de Petri de vidrio. - Envuelva las placas en una película de parafina e incube durante la noche a 4 °C en anticuerpo primario diluido en solución bloqueante.
- Lavar 3 veces en solución de bloqueo: 1) enjuague breve, 2) lavado de 15 minutos y 3) lavado de 1 hora. Para un enjuague breve, llene una pequeña placa de Petri con solución y sumerja suavemente la membrana con pinzas antes de transferir a una solución fresca. Para lavados más largos (es decir, 15 minutos y 1 hora), sumerja la membrana en solución en una placa de 6 pocillos y colóquela sobre un balancín suave.
- Incubar cubierto de luz durante 2 h a RT en anticuerpos secundarios diluidos 1:500 en PBS.
- Lavar 3 veces en PBS: 1) enjuague breve, 2) lavado de 15 minutos y 3) lavado de 1 h.
- Si es necesario tintar con DAPI, sumergir en una solución de DAPI 1:1.000 durante 7 min en RT. Enjuagar brevemente y luego lavar durante 15 min en PBS.
- Enjuague con agua bidestilada.
- Monte las membranas en un portaobjetos con las rodajas hacia arriba (con la membrana hacia abajo).
NOTA: Las lonchas montadas se pueden almacenar a 4 °C. Las imágenes en un microscopio confocal se realizan mejor dentro de 1 semana, antes de que la membrana se vuelva opaca y difícil de obtener imágenes. - Cortes de imagen mediante microscopía confocal y cuantificar como se describió anteriormente 11,12,13.
Resultados
Se utilizaron cultivos de cortes cerebelosos derivados de ratones P0-2 (Figura 1A) para estudiar la mielinización y evaluar los efectos de la adición de varios factores de 0 a 12 DIV (Figura 1B). Para estudiar la remielinización, primero se desmielinizaron con lisolecitina y se dejaron remielinizar durante 14 días adicionales en cultivo con los factores probados (Figura 1C), después de lo cual se cuantificó la remielinización. También se estudió el efecto de la hipoxia sobre la mielinización mediante la colocación de cultivos en rodajas en una incubadora hipóxica FiO2 al 2% durante 24 h, de 2 a 3 DIV (Figura 1D). Por último, se utilizaron cultivos de cortes derivados de ratones transgénicos para estudiar el efecto de los knockouts genéticos en la mielinización. En este sistema, la recombinación de Cre fue inducida por la adición de tamoxifeno o adenovirus Ad-Cre a 1 DIV y 3 DIV, y se fijaron cultivos en cortes para análisis a 12 DIV (Figura 1E). Después de la fijación de los tejidos, la cuantificación de la desmielinización y remielinización se realizó mediante inmunotinción (Figura 2, Figura 3) y microscopía electrónica 11,12,13.
Los datos representativos mostrados (Figura 2, Figura 3) ilustran el rango dinámico de la mielinización y la remielinización en cultivos en rodajas. El índice de mielinización se cuantificó mediante la relación entre Caspr, un marcador paranodal que es una lectura indirecta de la mielina compacta, y la proteína H (NFH) del neurofilamento, que tiñe los axones. Este índice de mielinización ha sido validado para representar la formación de mielina compacta por microscopía electrónica y tinción de canales de sodio12. La desmielinización inducida por la lisolecitina 9,10 condujo a la desaparición completa de los paraganglios Caspr positivos (índice de mielinización = 0, Figura 3A) y a la pérdida de mielina compacta, que se restableció durante la remielinización11,12.
Para demostrar un resultado positivo en la mielinización, los cortes se cultivaron con Activina A siguiendo la línea de tiempo de la Figura 1B. La activina A se une a los receptores de activina en los oligodendrocitos e impulsa la diferenciación de los oligodendrocitos y la compactación de la mielina15. Los datos representativos muestran que el tratamiento de los cortes con 100 ng/mL de activina A durante la mielinización dio lugar a un mayor índice de mielinización (Figuras 2A,B). De acuerdo con esto, el tratamiento con Activina A aceleró la diferenciación de OPC, como se cuantifica por la proporción de oligodendrocitos maduros CC1 positivos a las células del linaje de oligodendrocitos Olig2+11,13 (Figuras 2C, D).
Se ha demostrado que una pequeña molécula inhibidora de la tankirasa, XAV939, promueve la mielinización y la remielinización mediante la estabilización de los niveles de Axin2 en los oligodendrocitos11. Tras el tratamiento con lisolecitina, la desmielinización se visualizó y cuantificó en cultivos en rodajas mediante tinción de proteínas básicas de mielina fragmentada (MBP) y ausencia de paranodos Caspr positivos (Figuras 3A). El tratamiento con 0,1 μM de XAV939 durante la remielinización (15-28 DIV) aumentó significativamente el índice de mielinización en comparación con los controles del vehículo, cuantificado por la relación entre la tinción de Caspr y NFH (Figuras 3B, C). Por lo tanto, el modelo de cultivo en cortes se puede utilizar para examinar y cuantificar los efectos sobre la diferenciación, mielinización y remielinización de OPC en tejido intacto.
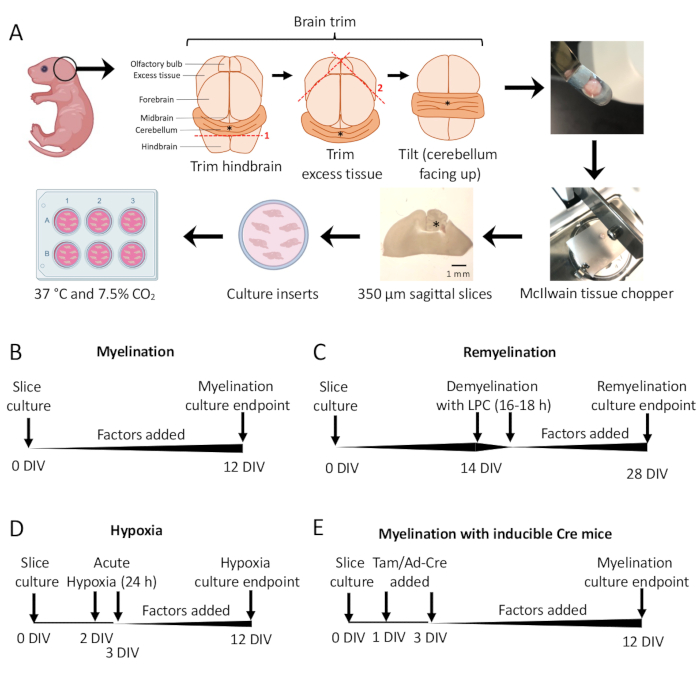
Figura 1: Esquema de los cultivos de cortes cerebelosos que muestra los pasos clave en el proceso de disección y los plazos para diferentes protocolos de cultivo de cortes. (A) Representación de los pasos para generar cultivos de cortes: disección de cerebros de cachorros de ratón P0-2, recorte del cerebro (como se muestra), corte del cerebro con un picador de tejido para generar cortes sagitales de 350 μm, colocación de cortes en insertos de cultivo organotípico en un plato de 6 pocillos e incubación a 37 °C y 7,5% de CO2. * denota cerebelo. (B) Cronograma de los cultivos de cortes mielinizantes. Los cultivos en rodajas se incubaron durante 12 días antes de la fijación para su análisis. (C) Cronograma para la remielinización de cultivos en rodajas. Los cortes se trataron con lisolecitina a 14 DIV durante 16-18 h para inducir la desmielinización completa y se dejaron remielinizar hasta 28 DIV antes de la fijación para el análisis. (D) Cronología de la mielinización después de la agresión hipóxica. Los cortes se expusieron a una agresión hipóxica aguda durante 24 h entre 2 y 3 DIV, lo que provocó hipomielinización. (E) Cronología de CSC a partir de ratones modificados genéticamente. Se añadió tamoxifeno (Tam, 100 nM) o virus Ad-Cre en 1 DIV y 3 DIV para inducir la modificación genética, y se analizaron cortes en 12 DIV. Diagramas de línea de tiempo adaptados de publicaciones anteriores11,13. Haga clic aquí para ver una versión más grande de esta figura.
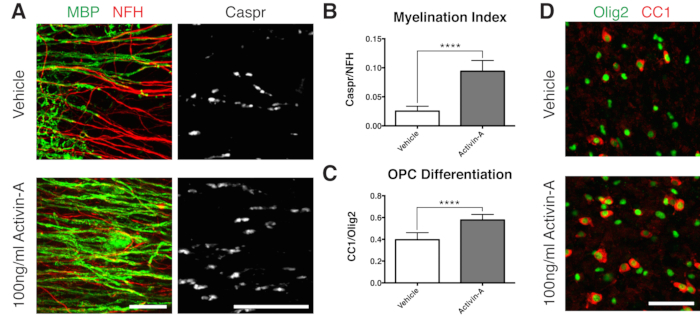
Figura 2: Datos representativos que muestran que la activina A promueve la mielinización y la diferenciación de OPC. (A) Aumento de la mielinización (MBP) y de los paranodos (Caspr) con el tratamiento con 100 ng/mL de activina A, demostrado por inmunotinción de cultivos en cortes. (B) Cuantificación del índice de mielinización (relación entre el área teñida para los paranodos de Caspr+ y el área teñida para los axones de NFH+). (C) Cuantificación de la diferenciación de OPC (proporción de oligodendrocitos CC1+ a células del linaje de oligodendrocitos Olig2+). (D) Imágenes representativas de la tinción CC1/Olig2. Los valores mostrados son media + desviación estándar. P < 0,0001; prueba T no apareada. Barras de escala: A = 25 μm, D = 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
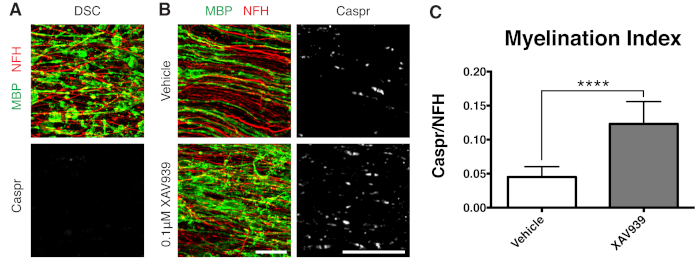
Figura 3: Datos representativos que muestran que XAV939 promueve la remielinización. (A) Imágenes que muestran desmielinización por tinción fragmentada de MBP y ausencia de paranodos de Caspr en cultivos en rodajas tratados con lisolecitina. (B) Aumento de la remielinización (MBP) y de los paranodos (Caspr) con el tratamiento con XAV939 de 0,1 μM tras la desmielinización inducida por lisolecitina demostrado por inmunotinción de cultivos en rodajas. (C) Cuantificación del índice de mielinización (relación entre el área teñida para los paranodos de Caspr+ y el área teñida para los axones de NFH+). Los valores mostrados son media + desviación estándar. P < 0,0001; prueba T no apareada. Barras de escala = 25 μm. Haga clic aquí para ver una versión más grande de esta figura.
| Medios de cultivo de corte (SCM) | |
| Volumen | Reactivo |
| 100 mL | Medios Esenciales Mínimos (MEM), HEPES, sin glutamina |
| 50 mL | Suero de caballo inactivado por calor |
| 50 mL | Solución salina equilibrada de Earle |
| 2 mL | Penicilina-estreptomicina 10.000 U/mL |
| 2 mL | Suplemento GlutaMAX |
| 2888 μL | Solución de glucosa al 45% |
| 1 mL | Zona de hongos |
| Filtre estérilmente a través de un filtro de 0,22 μm y almacene en una nevera a 4 °C durante un máximo de 2 semanas. | |
| Medios de disección (DM) | |
| Volumen | Reactivo |
| 100 mL | MEM, HEPES, con sales de Earle |
| 1 mL | Penicilina-estreptomicina 10.000 U/mL |
| Filtre estérilmente a través de un filtro de 0,22 μm y almacene en una nevera a 4 °C durante un máximo de 2 meses. | |
| Caldo de lisolecitina (125 mg/mL) | |
| Importe | Reactivo |
| 100 mg | Lisolecitina |
| 0,8 mL | PBS estéril |
| Disolver 100 mg de lisolecitina en 0,8 mL de PBS estéril. Almacene 80 μl de alícuotas de solución madre a -20 °C. | |
| Antes de usar, descongele 80 μL de alícuota y disuelva en 20 mL de SCM (0,5% de lisolecitina en SCM), calentado en una incubadora de CO2 al 7,5% a 37 °C. Si es necesario, vórtice para disolver la lisolecitina en SCM. | |
Tabla 1: Lista de componentes y protocolo para hacer medio de cultivo en corte (SCM), medio de disección (DM) y solución de lisolecitina.
Discusión
Este protocolo describe un modelo organotípico de cultivo de cortes cerebelosos que recapitula la composición celular in vivo con la simplicidad de un modelo in vitro. Este protocolo podría desarrollarse aún más para convertirse en un modelo más representativo de las patologías humanas. Las CSC pueden desarrollarse potencialmente como modelos para lesiones específicas de enfermedades, como la lesión tisular inducida por fuerza, la lesión inducida por anticuerpos específicos de mielina o la lesión de oligodendrocitos en la EM con la adición de células inmunitarias periféricas. Este protocolo también puede optimizarse para tejido diseccionado de otras partes del cerebro y la médula espinal16,17. Si bien este protocolo se centra en la cuantificación histológica de la mielinización, las CSC representan un modelo conveniente para examinar varios criterios de valoración experimentales. Estos cultivos se pueden utilizar para caracterizar diferentes tipos de células a través de la secuenciación de ARN de una sola célula, evaluar la ultraestructura de los axones y las vainas de mielina mediante microscopía electrónica y estudiar la dinámica de OPC mediante la realización de imágenes de lapso de tiempo. La inmunotinción también puede evitarse con el uso de líneas reporteras de ratones transgénicos 18,19. Por último, las diferentes edades de las crías de ratón, el tiempo de cultivo o el grosor de las secciones pueden utilizarse para adaptar la CSC a los diferentes mecanismos de la enfermedad 10,17,18,19,20,23.
Los cultivos en rodajas son ideales para analizar y cuantificar los factores que afectan a la mielinización y la remielinización, pero son limitados en su representación del SNC en determinados contextos. Derivado de cerebros P 0-2, los CSC provienen de cerebros que están en una etapa temprana de desarrollo y tienen similitudes limitadas con un cerebro envejecido o neurodegenerativo. Dada la creciente concienciación sobre la importancia de la mielina en los trastornos del SNC, como la enfermedad de Alzheimer21 y la esquizofrenia22, se requieren modelos adultos o envejecidos para cuantificar y caracterizar la mielinización. Se han publicado otros protocolos que aíslan tejido de roedores mayores, aunque todavía en las etapas de desarrollo 10,18,19,23. Además, puede haber diferencias intrínsecas y extrínsecas en los oligodendrocitos y las OPC en el cerebelo en comparación con la médula espinal y otros tractos de materia blanca en el cerebro. Los CSC también son menos adecuados que los sistemas in vitro basados en células para CRISPR a gran escala o pantallas de moléculas pequeñas. Debido al corte inicial del tejido, también hay una activación de las células inmunitarias innatas residentes en el cerebro (es decir, la microglía y los astrocitos), una advertencia importante para el sistema24. Por último, las células inmunitarias periféricas desempeñan un papel importante en la patología de la EM25; Las CSC están desprovistas de células periféricas a menos que estas células se añadan exógenamente y, por lo tanto, no son un modelo ideal del entorno inflamatorio del SNC.
La parte de disección de este protocolo es quizás la más crítica. Los pasos de disección deben realizarse con el máximo cuidado, para no dañar el tejido y la estructura subyacente. La alineación adecuada del cerebro a lo largo de la cuchilla del corte de tejido garantiza un daño mínimo al tejido y las células. Además, es importante la disección y separación cuidadosas de las rodajas, así como su transferencia a las membranas para el cultivo. Los plazos descritos en este protocolo se han optimizado para la investigación descrita, pero es posible que sea necesario ajustarlos para obtener resultados óptimos en diferentes estudios. Este protocolo será útil para aquellos que deseen estudiar la mielinización del desarrollo y la reparación de la mielina.
Cabe destacar que no existe cura para la EM. Si bien las terapias actuales son bastante efectivas para amortiguar el sistema inmunológico adaptativo, ninguna terapia actual puede detener la progresión. Se cree que un fallo en la remielinización y la posterior neurodegeneración son la base de la progresión de la EM2. La presencia de OPC en las lesiones crónicas de la EM sugiere que el fracaso de la reparación de la mielina podría deberse a una detención en la diferenciación de las OPC. El uso de CSC abre una vía de descubrimiento para las terapias de reparación de mielina que pueden ayudar a revertir la progresión de la EM y restaurar la función. La terapia de reparación de mielina también puede ayudar a la recuperación en pacientes con lesión de la médula espinal, donde los tractos desmielinizados inhiben la función locomotora26. Por lo tanto, la importancia de la CSC radica en su idoneidad para identificar los factores que afectan a la desmielinización y remielinización de los mamíferos de una manera relativamente alta en comparación con los modelos animales in vivo. Si bien muchos estudios han utilizado OPC primarias para el cribado de compuestos que afectan a la diferenciación, la generación y el aislamiento de OPC primarias requiere un inmunopanning laborioso y secuencial27. Además, los ensayos basados en células no recapitulan la diversidad e interacción de los tipos de células presentes in vivo. La generación de CSC a partir de crías de ratón es un modelo rápido y rentable para estudiar la mielinización y la remielinización que no requiere equipos ni consumibles costosos. Por lo tanto, los cultivos de cortes cerebelosos representan un modelo cuantitativo invaluable para recapitular la mielinización ex vivo y permiten el descubrimiento de fármacos y la investigación científica básica.
Divulgaciones
Los autores son empleados de Genentech, Inc., miembro del Grupo Roche.
Agradecimientos
Los autores desean agradecer a Yun-An Shen, Roxanne Kyauk y Chris Bohlen por sus comentarios constructivos y aportes a este artículo. Además, los autores reconocen las contribuciones de Charles ffrench-Constant, Andrew Jarjour, Veronique Miron y David Rowitch en el desarrollo temprano de la metodología relacionada publicada previamente 11,12,13.
Materiales
| Name | Company | Catalog Number | Comments |
| #5/45 Forceps | Fine Science Tools | 11251-35 | Dissection tools |
| 32% Paraformaldehyde | Electron Microscopy Sciences | 50-980-495 | Fixative for staining |
| 45% glucose solution | Sigma | G8769 | Slice culture media component |
| 6-well tissue culture plates | Corning | 3516 | Plates for cultures |
| Alexa Fluor Goat anti-chicken 647 | Thermo Fisher Scientific | A21449 | Secondary staining antibody |
| Alexa Fluor Goat anti-mouse 647 | Thermo Fisher Scientific | A21236 | Secondary staining antibody |
| Alexa Fluor Goat anti-rabbit 555 | Thermo Fisher Scientific | A11006 | Secondary staining antibody |
| Alexa Fluor Goat anti-rat 488 | Thermo Fisher Scientific | A21428 | Secondary staining antibody |
| Blades, Double-edge, PTFE coated Stainless steel | Ted Pella | 121-6 | Chopping blades |
| Bovine Serum Albumin (BSA) | Sigma | A9418 | Blocking solution component |
| Chicken anti-NFH antibody | Encor Biotech | CPCA-NF-H | Staining antibody |
| Confocal Microscope | Zeiss | LSM780 | Confocal for imaging |
| Corning 250 mL vacuum filter/storage bottle system, 0.22 µm pore | Corning | 431096 | For media preparation |
| Earl's balanced salt solution | Sigma | E2888 | Slice culture media component |
| Feather surgical blade | Feather | 2976#11 | Dissection tools |
| Fungizone | Thermo Fisher Scientific | 15290-18 | Dissection media component |
| GlutaMAX supplement | Thermo Fisher Scientific | 35050-061 | Slice culture media component |
| Heat-inactivated horse serum | Thermo Fisher Scientific | 26050-88 | Slice culture media component |
| Lysolecithin | Sigma | L4129 | |
| Lysophosphatidylcholine from egg yolk | Sigma | L4129 | To induce demyelination |
| McIlwain Tissue Chopper | Ted Pella | 10180 | Tissue chopper |
| MEM, Hepes, no glutamine | Thermo Fisher Scientific | 12360-038 | Slice culture media component |
| MEM, Hepes, with Earle's salts | Sigma | M7278 | Dissection media component |
| Metal spatula | Fisher Scientific | 470149-442 | Dissection tools - bend flat end at angle for use |
| Millicell Culture Plate Insert 30mm Organotypic PTFE | Fisher | PICM0RG50 | Culture insert |
| Mouse anti-CC1 antibody | Millipore | OP80-100UG | Staining antibody |
| Noyes spring scissors | Fine Science Tools | 15012-12 | Dissection tools |
| PBS pH 7.4 | Gibco | 10010023 | For dilution of fixative |
| Penicillin-streptomycin 10,000U/mL | Thermo Fisher Scientific | 15140-122 | Slice culture media component |
| Rabbit anti-Caspr antibody | Abcam | ab34151 | Staining antibody |
| Rabbit anti-Olig2 antibody | Millipore | AB9610 | Staining antibody |
| Rat anti-MBP antibody | Serotec | MCA409S | Staining antibody |
| Scalpel handle #3 | Fine Science Tools | 10003-12 | Dissection tools |
| Silicone rubber foam sheet | MSC Industrial Direct Co | 31939176 | Cutting base |
| Stereo Microscope | Olympus Life Sciences | SZ61 | Microscope for dissection |
| Student surgical scissors | Fine Science Tools | 91401-12 | Dissection tools |
Referencias
- Purves, D., Augustine, G. J., Fitzpatrick, D. Increased Conduction Velocity as a Result of Myelination. Neuroscience 2nd edition. , (2001).
- Dutta, R., Trapp, B. D. Mechanisms of neuronal dysfunction and degeneration in multiple sclerosis. Progress in Neurobiology. 93 (1), 1-12 (2011).
- Trapp, B. D., Nave, K. A. Multiple sclerosis: an immune or neurodegenerative disorder?. Annual Review of Neuroscience. 31, 247-269 (2008).
- Bradl, M., Lassmann, H. Oligodendrocytes: biology and pathology. Acta Neuropathologica. 119 (1), 37-53 (2010).
- Domingues, H. S., Portugal, C. C., Socodato, R., Relvas, J. B. Oligodendrocyte, Astrocyte, and Microglia Crosstalk in Myelin Development, Damage, and Repair. Frontiers in Cell and Developmental Biology. 4, 71 (2016).
- Nave, K. A., Werner, H. B. Myelination of the nervous system: mechanisms and functions. Annual Review of Cell and Developmental Biology. 30, 503-533 (2014).
- Franklin, R. J. M., Ffrench-Constant, C. Regenerating CNS myelin – from mechanisms to experimental medicines. Nature Reviews Neuroscience. 18 (12), 753-769 (2017).
- Molina-Gonzalez, I., Miron, V. E. Astrocytes in myelination and remyelination. Neuroscience Letters. 713, 134532 (2019).
- Keough, M. B., Jensen, S. K., Yong, V. W. Experimental demyelination and remyelination of murine spinal cord by focal injection of lysolecithin. Journal of Visualized Experiments. (97), e52679 (2015).
- Birgbauer, E., Rao, T. S., Webb, M. Lysolecithin induces demyelination in vitro in a cerebellar slice culture system. Journal of Neuroscience Research. 78, 157-166 (2004).
- Fancy, S. P., et al. Axin2 as regulatory and therapeutic target in newborn brain injury and remyelination. Nature Neuroscience. 14 (8), 1009-1016 (2011).
- Yuen, T. J., et al. Identification of endothelin-2 as an inflammatory factor that promotes CNS remyelination. Brain. 136, 1035-1047 (2013).
- Yuen, T. J., et al. Oligodendrocyte-encoded HIF function couples postnatal myelination and white matter angiogenesis. Cell. 158 (2), 383-396 (2014).
- Stokes, C. E., Murphy, D., Paton, J. F., Kasparov, S. Dynamics of a transgene expression in acute rat brain slices transfected with adenoviral vectors. Experimental Physiology. 88, 459-466 (2003).
- Dillenburg, A., et al. Activin receptors regulate the oligodendrocyte lineage in health and disease. Acta Neuropathologica. 135 (6), 887-906 (2018).
- Dean, J. M., et al. An organotypic slice culture model of chronic white matter injury with maturation arrest of oligodendrocyte progenitors. Molecular Neurodegeneration. 6, 46 (2011).
- Zhang, H., Jarjour, A. A., Boyd, A., Williams, A. Central nervous system remyelination in culture--a tool for multiple sclerosis research. Experimental Neurology. 230 (1), 138-148 (2011).
- Hill, R. A., Medved, J., Patel, K. D., Nishiyama, A. Organotypic slice cultures to study oligodendrocyte dynamics and myelination. Journal of Visualized Experiments. (90), e51835 (2014).
- Sherafat, A., Hill, R. A., Nishiyama, A. Organotypic Slice Cultures to Study Oligodendrocyte Proliferation, Fate, and Myelination. Molecular Biology (Clifton, N.J.). 1791, 145-156 (2018).
- Croft, C. L., Noble, W. Preparation of organotypic brain slice cultures for the study of Alzheimer's disease. F1000Research. 7, 592 (2018).
- Nasrabady, S. E., Rizvi, B., Goldman, J. E., Brickman, A. M. White matter changes in Alzheimer's disease: a focus on myelin and oligodendrocytes. Acta Neuropathologica Communications. 6 (1), 22 (2019).
- Flynn, S. W., et al. Abnormalities of myelination in schizophrenia detected in vivo with MRI, and post-mortem with analysis of oligodendrocyte proteins. Molecular Psychiatry. 38, 811-820 (2003).
- Thetiot, M., Ronzano, R., Aigrot, M. S., Lubetzki, C., Desmazières, A. Preparation and Immunostaining of Myelinating Organotypic Cerebellar Slice Cultures. Journal of Visualized Experiments. (145), e59163 (2019).
- Gerlach, J., Donkels, C., Münzner, G., Haas, C. A. Persistent Gliosis Interferes with Neurogenesis in Organotypic Hippocampal Slice Cultures. Frontiers in Cellular Neuroscience. 10, 131 (2016).
- Reich, D. S., Lucchinette, C. F., Calabresi, P. A. Multiple Sclerosis. New England Journal of Medicine. 378 (2), 169-180 (2018).
- Jeffery, N. D., Blakemore, W. F. Locomotor deficits induced by experimental spinal cord demyelination are abolished by spontaneous remyelination. Brain. 120, 27-37 (1997).
- Emery, B., Dugas, J. C. Purification of oligodendrocyte lineage cells from mouse cortices by immunopanning. Cold Spring Harbor Protocols. , 854-868 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados