Method Article
מיאלינציה ורמיאלינציה Ex Vivo בתרביות פרוסות מוח כמודל כמותי למניפולציות התפתחותיות ורלוונטיות למחלות
In This Article
Summary
מוצג פרוטוקול למודל כמותי ex vivo של דה-מיאלינציה ורמיאלינציה באמצעות תרביות פרוסות מוח של עכבר. שיטה זו מסכמת מקרוב מודל in vivo עם השלמה מלאה של סוגי תאי מערכת העצבים המרכזית ברקמה שלמה, תוך שמירה על הנוחות הכימית, הגנטית והסביבתית של מערכת חוץ גופית.
Abstract
חקר מיאלינציה במבחנה ובגוף החי מציב אתגרים רבים. ההתמיינות של תאי מבשר אוליגודנדרוציטים (OPCs) במבחנה, למרות שהיא ניתנת להרחבה, אינה מסכמת מיאלינציה אקסונלית. תרביות OPC-נוירונים ותרביות סיבי OPC מאפשרות בחינה של מיאלינציה במבחנה, אך חסרים להם סוגי תאים נוספים הקיימים in vivo, כגון אסטרוציטים ומיקרוגליה. מודלים של עכברים in vivo, לעומת זאת, פחות מועדים למניפולציות כימיות, סביבתיות וגנטיות והם הרבה יותר עתירי עבודה. כאן, אנו מתארים מערכת כמותית של תרבית פרוסות מוח קטן (CSC) של עכבר ex vivo שימושית עבור: 1) חקר מיאלינציה התפתחותית, 2) מידול דה-מיאלינציה ורמיאלינציה, ו-3) ביצוע מחקר תרגומי. חלקי קשת של המוח הקטן והמוח האחורי מבודדים מעכברים ביום שלאחר הלידה (P) 0-2, ולאחר מכן הם מבצעים מיאלינטציה ex vivo למשך 12 ימים. במהלך תקופה זו, ניתן לתפעל פרוסות בדרכים שונות, כולל הוספת תרכובות לבדיקת השפעה על מיאלינציה התפתחותית. בנוסף, ניתן לקבע רקמה למיקרוסקופ אלקטרונים כדי להעריך את המבנה האולטרה-מבנה והדחיסה של המיאלין. כדי לדגמן מחלה, CSC יכול להיות נתון להיפוקסיה חריפה כדי לגרום להיפומיאלינציה. דה-מיאלינציה באקספלנטים אלה יכולה להיגרם גם על ידי ליזולציטין, המאפשר זיהוי של גורמים המקדמים רמיאלינציה. מלבד שינויים כימיים וסביבתיים, ניתן לבודד CSC מעכברים טרנסגניים והם מגיבים למניפולציה גנטית הנגרמת על ידי אדנו-וירוסים Ad-Cre וטמוקסיפן. לפיכך, תרביות פרוסות המוח הקטן הן מודל מהיר, ניתן לשחזור וניתן לכימות לסיכום מיאלינציה.
Introduction
מיאלינציה של אקסונים מאפשרת התפשטות מהירה של פוטנציאל פעולה, מנגנון המכונה הולכה מלחית1. חשיבות המיאלין מודגשת על ידי מחלות דמיאליניות, כגון טרשת נפוצה (MS), הכוללות מגוון רחב של ביטויים מתישים, כולל אובדן ראייה, בעיות קוגניטיביות ושיתוק. אין תרופה לטרשת נפוצה, והטיפולים הנוכחיים מתמקדים בהגבלת התקדמות המחלה על ידי התמקדות בתאי חיסון היקפיים. נכות בטרשת נפוצה ומחלות קשורות נחשבת מונעת על ידי כישלון של רמיאלינציה וניוון עצבי מתקדם. בפרט, דה-מיאלינציה, ניוון ואובדן אקסונלי נצפים בטרשת נפוצה מתקדמת 2,3. לפיכך, קידום רמיאלינציה מייצג אסטרטגיה מבטיחה שיכולה להתבצע במקביל לטיפולים הנוכחיים ולהניב יתרונות טיפוליים נוספים.
במערכת העצבים המרכזית (CNS), מיאלינציה מתבצעת על ידי תאי גליה מיוחדים הידועים בשם אוליגודנדרוציטים. תאי מבשר אוליגודנדרוציטים (OPCs) מתמיינים לאוליגודנדרוציטים בוגרים ומיאלינים באמצעות סדרה של שלבים מתוזמרים מאוד, כולל צמיחה של תהליכים המגעים עם אקסונים, עלייה במורכבות המורפולוגית, הרחבת קרום המיאלין, ולבסוף, דחיסת נדן מיאלין4. לפיכך, האינטראקציה בין אוליגודנדרוציטים לנוירונים היא אינטימית ביותר. אינטראקציות הדדיות בין נוירונים לאוליגודנדרוציטים נדרשות גם לבריאות ותחזוקה של מערכת העצבים המרכזית2. פעילות אקסונלית ממלאת תפקיד בגירוי מיאלינציה וגורמים נוירוטרופיים גליאליים תומכים בשלמות הנוירונים. החשיבות של ערב-דיבור גליה-גליה במערכת העצבים המרכזית הופכת גם היא למוכרת יותר ויותר 5,6,7,8. לדוגמה, גורמים אסטרוציטים יכולים להשפיע על התמיינות של OPCs ועל תחזוקת מסלולים של חומר לבן. מיקרוגליה ממלאת גם תפקיד בוויסות התמיינות OPC כמו גם בפינוי פסולת מיאלין, שלב חשוב בתהליך הרמיאלינציה. זיהוי גורמים אוטונומיים תאיים והבנת ההשפעה של סוגי תאי מערכת העצבים המרכזית האחרים בדמיאלינציה ורמיאלינציה יהיו בעלי ערך רב לפיתוח טיפולים למחלות דמיאלינטיות ודיסמיאלינציה.
כאן, אנו מתארים מערכת ex vivo המשתמשת בתרביות פרוסות מוח קטן של עכבר (CSC) המאפשרת מניפולציה וכימות של רקמת מערכת העצבים המרכזית השלמה. השימוש ב-CSC מאפשר למדוד מיאלינציה, או רמיאלינציה לאחר השראת הדמיאלינציה על ידי ליזולציטין 9,10, בשיטות המשמשות באופן מסורתי במחקרי in vivo, כגון צביעה חיסונית ומיקרוסקופ אלקטרונים 11,12,13. ליזולציטין הוא כימיקל המשבש את הממברנה וגורם לאובדן מהיר של מיאלין ואוליגודנדרוציטים. אזהרה פוטנציאלית שיש לציין היא שליזולציטין עשוי לגרום גם להפחתה של סוגי תאים אחרים הקרובים לאזור הנגע. עם זאת, בניגוד לניסויים in vivo, ניתן לתפעל בקלות פרוסות סגיטליות של המוח הקטן באמצעות הוספת תרכובות, או לשנות גנטית באמצעות אדנו-וירוסים Ad-Cre. השיטה מאפשרת גם מניפולציה של רקמה מבודדת מעכברים טרנסגניים או עכברים שנחשפו לעלבונות סביבתיים כגון היפוקסיה 11,12,13,14. מודל ה-CSC מאפשר אפוא לחקור מיאלינציה התפתחותית, מידול מחלות וזיהוי גורמים המקדמים או מעכבים מיאלינציה, תוך שילוב התרומות של סוגי תאי מערכת העצבים המרכזית השונים לתפקוד האוליגודנדרוציטים.
Protocol
כל המחקרים בבעלי חיים אושרו ואושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים של ג'ננטק.
1. הכנת מדיה ואספקה לדיסקציה (~30-45 דקות)
- הכן וסינן סטרילי מדיום תרבית פרוסות (SCM) ומדיום חיתוך (DM) כמפורט בטבלה 1. יש לאחסן בטמפרטורה של 4 מעלות צלזיוס. אם גורמים כלשהם נבדקים לבדיקת המיאלינציה, הוסף אותם ל-SCM ממש לפני השימוש.
- פיפטה 1 מ"ל SCM לכל באר של צלחת 6 בארות.
- בעזרת מלקחיים סטריליים, הנח תוספת אורגנוטיפית לכל באר, וודא שלא נלכדו בועות מתחת לממברנה. מחממים את הצלחת עם מדיה בטמפרטורה של 37 מעלות צלזיוס באינקובטור 7.5% CO2 .
2. הכנת אזור הדיסקציה (~5-10 דקות)
- בצע הליכים במכסה מנוע זרימה למינרי סטרילי או על הספסל עם טכניקות אספטיות מתאימות לכל שלבי ההליך. נגב את כל האזורים עם 70% אתנול.
- הנח שלב חיתוך להב וסיליקון חדש על קוצץ הרקמות. פיפטה ~ 300 מיקרוליטר מים סטריליים או 70% אתנול מתחת לשלב החיתוך כדי להבטיח שהוא יישאר במקומו.
- השתמש בצמר גפן כדי לנגב בעדינות את להב קוצץ הרקמות ואת שלב החיתוך עם 70% אתנול. יבש לפני השימוש בקוצץ הטישו.
- יש לרסס את כל כלי החיתוך באתנול 70% ולייבש לפני הדיסקציה.
- הכינו שתי צלחות פטרי בגודל 10 ס"מ: אחת עם 15-20 מ"ל DM, אחת עם 10 מ"ל SCM. יש לאחסן על קרח. שמור את כל כלי המדיה והפטרי על קרח כאשר לא מנתחים.
3. דיסקציה של תרבית פרוסות מוח קטן (~15-20 דקות לגור)
- מניחים את צלחת הפטרי עם DM על מיקרוסקופ מנתח.
- המתת חסד של גור עכברים, יום לאחר הלידה P0-2, על ידי עריפת ראש מהירה במספריים חדים.
- הניחו את הראש בצלחת הפטרי עם DM מתחת למיקרוסקופ הניתוח כדי לנקות את הדם.
- בעזרת מספריים עדינים חותכים פעם אחת בכל קצה צדדי בבסיס הגולגולת.
- כשהראש מונח הפוך ב-DM, לחץ בחוזקה כלפי מטה על הצד התחתון של הגולגולת באמצעות מלקחיים #5/45, והכריח את המוח האחורי הלא פגוע דרך החור בגולגולת.
- תחת מיקרוסקופ הניתוח, חותכים רקמות עודפות באמצעות שני אזמל #11. ודא שהמוח הקטן נשאר מחובר לחלק הבסיסי של המוח האחורי. ראה איור 1א לתרשים מפורט.
- בעזרת המרית, העבירו את המוח הקטן לשלב החיתוך של קוצץ הרקמות כאשר הרקמה מונחת על הפנים הרוסטרליות של המוח האחורי והפנים הזנביות של המוח האחורי הפונות לחוקר. ודא שהמישור המדיאלי של המוח מקביל בדיוק ללהב קוצץ הרקמות.
- בעזרת פיפטת P200, הסר עודף מדיום סביב הרקמה, וודא שהיא עדיין לחה אך לא צפה או מוקפת בנוזל.
- החלף את צלחת הפטרי המכילה DM בצלחת פטרי המכילה SCM תחת מיקרוסקופ הניתוח.
- חותכים את הרקמה לפרוסות בעובי 350 מיקרומטר בעזרת קוצץ הרקמות.
הערה: יש לייעל את מהירות הלהב (למשל, בערך חתך אחד בשנייה) ואת הכוח כדי להבטיח תנאי חיתוך אופטימליים. במקרים נדירים, הרקמה תיתפס על הלהב. כדי למזער אובדן של קטעי רקמות, השאר את האגודל על לחצן ההפעלה כדי לכבות במהירות את קוצץ הטישו במידת הצורך. - פיפטה בעדינות 100 מיקרוליטר SCM מתחת לרקמה, כך שהפרוסות צפות. העבירו את הרקמה הפרוסה בעזרת המרית לצלחת הפטרי עם SCM תחת מיקרוסקופ מנתח.
- השתמש בצמר גפן כדי לנגב בעדינות את להב קוצץ הרקמות ואת שלב החיתוך עם 70% אתנול.
- בעזרת האזמל (הצד הבוטה) הפרד בעדינות את הפרוסות מתחת למיקרוסקופ הניתוח. בעזרת אזמל ומרית, מעבירים פרוסות לקרום בצלחת 6 בארות עם SCM.
הערה: החלקים המדיאליים ביותר יהיו לרוב בעלי המיאלינציה ושלמות הרקמות הטובות ביותר. בממוצע, אפשר לנתח 4-6 פרוסות ממוח עכבר אחד. - דגרו פרוסות ב-SCM ב-37 מעלות צלזיוס ב-7.5% CO2.
4. שינויי תרבות ומדיה (~15-30 דקות)
- החלף את ה-SCM כל יומיים.
- פיפטה 1 מ"ל של מדיום טרי לכל באר של צלחת חדשה של 6 בארות ומחממת בחממה. בעזרת מלקחיים סטריליים, העבירו ממברנות לצלחת החדשה, וודאו שאין בועות מתחת. החזר את הצלחות לחממה.
5. מיאלינציה ורמיאלינציה סטנדרטית
- פרוטוקול מיאלינציה סטנדרטי (איור 1B).
- פרוסות תרבית שנותחו בסעיף 3 מ-0-12 ימים במבחנה (DIV). אם נבדקת ההשפעה של גורם כלשהו על המיאלינציה, הוסף אותו למדיום בזמן התרבות (0 DIV) וחדש אותו עם כל שינוי מדיה.
- תקן ב-12 DIV (שלב 7.1), נקודת זמן ממוטבת למיאלינציה לא שלמה 11,12,13. זה מאפשר לזהות כל השפעות משפרות או חוסמות על המיאלינציה עקב הגורם שנוסף למדיום. תוצאה חיובית מייצגת עם תוספת של 100 ננוגרם/מ"ל Activin A מוצגת באיור 2.
- פרוטוקול רמיאלינציה (איור 1C)
- עקוב אחר פרוטוקול המיאלינציה הסטנדרטי המתואר בסעיף 5.1 ללא גורמים נוספים עד 14 DIV, נקודת הזמן שבה הפרוסות עוברות מיאלין מלא 11,12,13.
- הכן ציר ליזולציטין (125 מ"ג/מ"ל) כמפורט בטבלה 1. פיפטה 1 מ"ל של 0.5% ליזולציטין ב-SCM לכל באר של צלחת חדשה של 6 בארות ומחממת בחממה.
- מעבירים את הממברנות לצלחת ליזולציטין ומניחים בחממה למשך 16-18 שעות.
- למחרת, הכינו צלחות חדשות עם SCM טרי, והוסיפו את כל הגורמים שנבדקים להשפעות רמיאלינציה במידת הצורך. צלחות חמות בחממה.
- להחלפת המדיה, הקש בעדינות על הממברנה בצד הבאר כדי לוודא שכל מדיום הליזולציטין מוסר. לחדש את הגורם/ים הנבדקים בכל החלפת מדיה (סעיף 4).
- תקן פרוסות ב-28 DIV (שלב 7.1), נקודת זמן ממוטבת עבור רמיאלינציה לא שלמה. זה מאפשר זיהוי של שיפור או חסימה של רמיאלינציה עקב הגורם שנוסף למדיום. תוצאה חיובית מייצגת עם תוספת של 0.1 μM XAV939 מוצגת באיור 3.
6. וריאציות לפרוטוקול המיאלינציה והרמיאלינציה
- פרוטוקול היפומיאלינציה הנגרמת על ידי היפוקסיה (איור 1D)11,13.
הערה: זה מוצג כוריאציה של פרוטוקול המיאלינציה הסטנדרטי המוצג בסעיף 5.1.- פרוסות צלחת ב- SCM ללא גורמים.
- העבירו את צלחות הפרוסות לאינקובטור היפוקסי (2% FiO2) למשך 24 שעות בין 2-3 DIV.
- למחרת, הכינו צלחות חדשות עם SCM טרי, והוסיפו את כל הגורמים שנבדקים לפוטנציאל מיאלינציה במידת הצורך. צלחות חמות בחממה.
- לאחר תרבית בהיפוקסיה יש לשנות את המדיום (סעיף 4) ולהחזיר את התרביות לחממת תרבית סטנדרטית (37 מעלות צלזיוס, 7.5% CO2). לחדש את כל הגורמים הנבדקים עם כל שינוי מדיה עוקב (סעיף 4).
- תקן ב-12 DIV (שלב 7.1).
- פרוטוקול מניפולציה גנטית (איור 1E)13
- בודד רקמה מעכברים טרנסגניים לדיסקציה כמו בסעיף 3.
- עם קווי עכבר טרנסגניים הניתנים להשראה, ניתן להוסיף טמוקסיפן (100 ננומטר, מינון שאינו גורם למיאלינציה או התמיינות OPC) או אדנו-וירוס Ad-Cre ל-SCM במהלך שינויי מדיה הנעשים ב-1 DIV ו-3 DIV.
- לאחר המניפולציה הגנטית עם טמוקסיפן או אדנו-וירוס Ad-Cre, המשך בהחלפת מדיה כל יומיים כמו בסעיף 4 (עם הוספת גורמים במידת הצורך).
הערות: כל הפרוסות מעכבר אחד יתאימו לממברנה אחת, מה שיאפשר גנוטיפ לאחר דיסקציה, ובכך יקל על ביצוע ניסויים בעכברים טרנסגניים.
7. עיבוד וניתוח רקמות
- תקן פרוסות על ידי טבילת הממברנה בעדינות ב-4% פרפורמלדהיד למשך שעה בטמפרטורת החדר (RT).
- יש לשטוף בעדינות על ידי טבילה בתמיסת מלח חוצצת פוספט (PBS). לאחר מכן, טבלו ב-PBS בצלחת של 6 בארות.
הערה: ניתן להשהות את הפרוטוקול כאן. ניתן לאחסן פרוסות קבועות ב-PBS בטמפרטורה של 4 מעלות צלזיוס עד חודש. אם לא מאחסנים פרוסות, יש לשטוף פעמיים ב-PBS למשך 5 דקות לפני שתמשיך. - השתמש באזמל כדי לחתוך את הממברנה מהטבעת ולהמשיך לצבוע בצלחת 6 בארות. הקפד לשמור על פרוסות כלפי מעלה (צד הממברנה כלפי מטה) לצורך צביעה והרכבה לאחר מכן על שקופיות.
- יש לחסום למשך שעה אחת בתמיסת RT בבלוק (3% סרום סוס מומת בחום, 2% אלבומין בסרום בקר ו-0.25% טריטון-X 100 מדולל ב-PBS).
הערה: אם יש צורך בשליפת אנטיגן להכתמת נוגדנים (למשל, CC1/Olig2), ניתן לעשות זאת בצלחות פטרי מזכוכית. - עטפו את הצלחות בסרט פרפין ודגרו למשך הלילה בטמפרטורה של 4 מעלות צלזיוס בנוגדנים ראשוניים מדוללים בתמיסת חסימה.
- שטיפה 3 פעמים בתמיסת חסימה: 1) שטיפה קצרה, 2) כביסה של 15 דקות, ו-3) כביסה של שעה. לשטיפה קצרה, מלאו צלחת פטרי קטנה בתמיסה וטבלו בעדינות את הממברנה באמצעות מלקחיים לפני העברתם לתמיסה טרייה. לשטיפות ארוכות יותר (כלומר 15 דקות ושעה), טבלו את הממברנה בתמיסה בצלחת 6 בארות והניחו על נדנדה עדינה.
- הדגירה מכוסה מאור למשך שעתיים ב-RT בנוגדנים משניים מדוללים 1:500 ב-PBS.
- יש לכבס 3 פעמים ב-PBS: 1) שטיפה קצרה, 2) כביסה של 15 דקות ו-3) כביסה של שעה אחת.
- אם יש צורך בצביעת DAPI, טבלו בתמיסת DAPI של 1:1,000 למשך 7 דקות ב-RT. שטפו קצרות ולאחר מכן שטפו במשך 15 דקות ב-PBS.
- שוטפים במים מזוקקים פעמיים.
- הרכיבו ממברנות על שקופית עם פרוסות כלפי מעלה (צד הממברנה כלפי מטה).
הערה: ניתן לאחסן פרוסות רכובות בטמפרטורה של 4 מעלות צלזיוס. הדמיה במיקרוסקופ קונפוקלי נעשית בצורה הטובה ביותר תוך שבוע, לפני שהממברנה הופכת אטומה וקשה לצילום. - פרוסות תמונה באמצעות מיקרוסקופיה קונפוקלית וכימות כמתואר קודם לכן 11,12,13.
תוצאות
תרביות פרוסות מוח קטן שמקורן בעכברי P0-2 (איור 1A) שימשו לחקר מיאלינציה ולהערכת ההשפעות של הוספת גורמים שונים מ-0-12 DIV (איור 1B). כדי לחקור רמיאלינציה, תרביות פרוסות ב-14 DIV עברו תחילה דה-מיאלין עם ליזולציטין ואפשרו לרמיאלינט במשך 14 ימים נוספים בתרבית עם הגורמים שנבדקו (איור 1C), ולאחר מכן כומתו רמיאלינציה. השפעת ההיפוקסיה על מיאלינציה נחקרה גם על ידי הצבת תרביות פרוסות באינקובטור היפוקסי של 2% FiO2 למשך 24 שעות, מ-2-3 DIV (איור 1D). לבסוף, תרביות פרוסות שמקורן בעכברים טרנסגניים שימשו לחקר ההשפעה של נוקאאוט גנים על מיאלינציה. במערכת זו, רקומבינציה של Cre הושרה על ידי תוספת של טמוקסיפן או אדנו-וירוס Ad-Cre ב-1 DIV ו-3 DIV, ותרביות פרוסות קבועות לניתוח ב-12 DIV (איור 1E). לאחר קיבוע הרקמות, כימות הדמיאלינציה והרמיאלינציה בוצע על ידי צביעה חיסונית (איור 2, איור 3) ומיקרוסקופ אלקטרונים 11,12,13.
נתונים מייצגים המוצגים (איור 2, איור 3) ממחישים את הטווח הדינמי של מיאלינציה ורמיאלינציה בתרביות פרוסות. מדד המיאלינציה כומת על ידי היחס בין Caspr, סמן פרנודלי שהוא קריאה עקיפה של מיאלין קומפקטי, לחלבון נוירופילמנט H (NFH), שמכתים אקסונים. אינדקס מיאלינציה זה אומת כמייצג היווצרות מיאלין קומפקטי על ידי מיקרוסקופ אלקטרונים וצביעה של תעלות נתרן12. דה-מיאלינציה 9,10 המושרה על ידי ליזולציטין הובילה להיעלמות מוחלטת של פרנודות חיוביות ל-Caspr (אינדקס מיאלינציה = 0, איור 3A) ולאובדן מיאלין קומפקטי, ששוחזר במהלך רמיאלינציה11,12.
כדי להדגים תוצאה חיובית על מיאלינציה, פרוסות תורבבו עם Activin A בעקבות ציר הזמן באיור 1B. אקטיבין A מפעיל קולטני אקטיבין על אוליגודנדרוציטים ומניע התמיינות אוליגודנדרוציטים ודחיסת מיאלין15. הנתונים המייצגים מראים שטיפול בפרוסות עם 100 ננוגרם/מ"ל של אקטיבין A במהלך המיאלינציה הביא לאינדקס מיאלינציה גבוה יותר (איורים 2A,B). בהתאם לכך, הטיפול ב-Activin A האיץ את התמיינות ה-OPC, כפי שכומת על ידי היחס בין אוליגודנדרוציטים בוגרים חיוביים ל-CC1 לתאי שושלת אוליגודנדרוציטים Olig2+11,13 (איורים 2C,D).
מעכב מולקולה קטנה של Tankyrase, XAV939, הוכח כמקדם מיאלינציה ורמיאלינציה על ידי ייצוב רמות Axin2 באוליגודנדרוציטים11. לאחר טיפול בליזולציטין, הדמיאלינציה הודגמה וכומתה בתרביות פרוסות על ידי צביעת חלבון בסיסי מיאלין מקוטע (MBP) והיעדר פרנודות חיוביות ל-Caspr (איורים 3A). טיפול ב-0.1 מיקרומטר XAV939 במהלך רמיאלינציה (15-28 DIV) העלה משמעותית את מדד המיאלינציה בהשוואה לבקרות רכב, כפי שכומת על ידי היחס בין צביעת Caspr ל-NFH (איורים 3B, C). לפיכך ניתן להשתמש במודל תרבית הפרוסות כדי לבחון ולכמת את ההשפעות על התמיינות OPC, מיאלינציה ורמיאלינציה ברקמה שלמה.
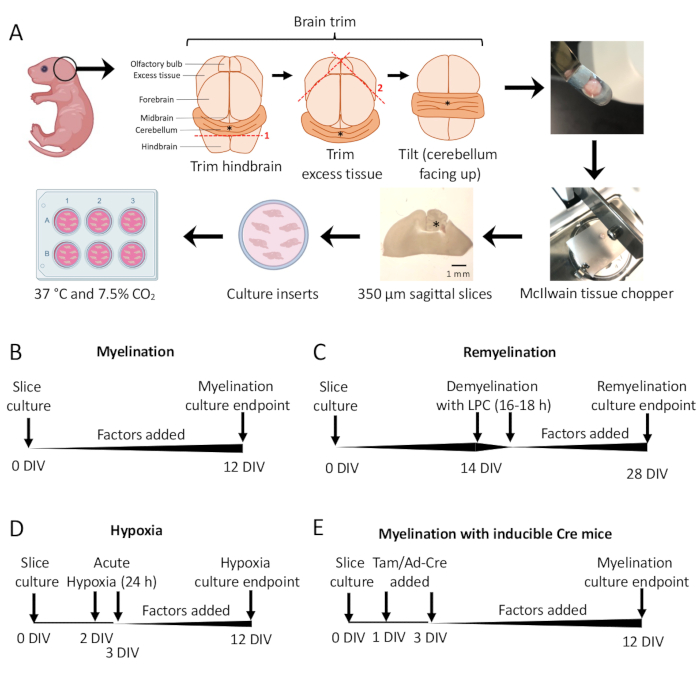
איור 1: סכמטי של תרביות פרוסות מוח קטן המראה שלבים מרכזיים בתהליך הדיסקציה ולוחות זמנים עבור פרוטוקולים שונים של תרבית פרוסות. (A) תיאור של שלבים ליצירת תרביות פרוסות: דיסקציה של מוחות מגורי עכברים P0-2, חיתוך המוח (כפי שמוצג), חיתוך המוח באמצעות קוצץ רקמות כדי ליצור פרוסות סגיטליות של 350 מיקרומטר, הנחת פרוסות על תוספות תרבית אורגנוטיפיות בצלחת של 6 בארות, ודגירה ב-37 מעלות צלזיוס ו-7.5% CO2. * מציין מוח קטן. (B) ציר זמן למיאלינציה של תרביות פרוסות. תרביות פרוסות הודגרו במשך 12 יום לפני הקיבוע לניתוח. (C) ציר זמן לרמיאלינציה של תרביות פרוסות. פרוסות טופלו בליזולציטין ב-14 DIV למשך 16-18 שעות כדי לגרום לדמיאלינציה מלאה ואפשרו לרמיאלינט עד 28 DIV לפני הקיבוע לניתוח. (D) ציר זמן למיאלינציה בעקבות עלבון היפוקסי. הפרוסות נחשפו לעלבון היפוקסי חריף במשך 24 שעות בין 2-3 DIV, מה שגרם להיפומיאלינציה. (E) ציר זמן ל-CSC מעכברים מהונדסים גנטית. טמוקסיפן (Tam, 100nM) או וירוס Ad-Cre נוסף ב-1 DIV ו-3 DIV כדי לגרום לשינוי גנטי, והפרוסות נותחו ב-12 DIV. דיאגרמות ציר זמן מותאמות מפרסומים קודמים11,13. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
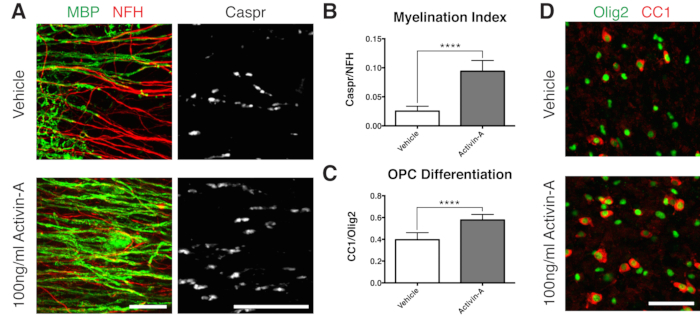
איור 2: נתונים מייצגים המראים ש-Activin A מקדם מיאלינציה והתמיינות OPC. (A) עלייה במיאלינציה (MBP) ופרנודות (Caspr) עם טיפול ב-100 ננוגרם/מ"ל Activin A, שהוצג על ידי צביעה חיסונית של תרביות פרוסות. (B) כימות של אינדקס המיאלינציה (היחס בין השטח הצבוע עבור פרנודות Caspr+ לאזור הצבוע עבור אקסונים NFH+). (C) כימות התמיינות OPC (היחס בין אוליגודנדרוציטים CC1+ לתאי שושלת אוליגודנדרוציטים Olig2+). (D) תמונות מייצגות של צביעת CC1/Olig2. הערכים המוצגים הם ממוצע + סטיית תקן. P < 0.0001; מבחן T לא מזווג. פסי קנה מידה: A = 25 מיקרומטר, D = 50 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
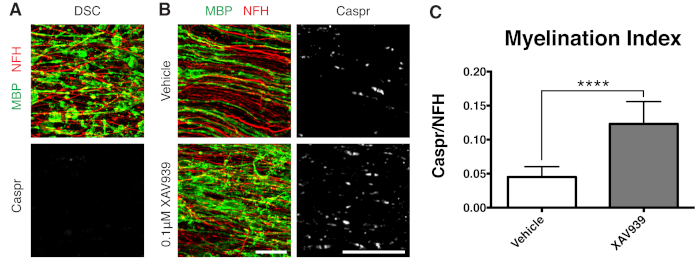
איור 3: נתונים מייצגים המראים ש-XAV939 מקדם רמיאלינציה. (A) תמונות שמציגות דה-מיאלינציה על ידי צביעת MBP מקוטעת והיעדר פרנודות Caspr בתרביות פרוסות שטופלו בליזולציטין. (B) עלייה ברמיאלינציה (MBP) ופרנודות (Caspr) עם טיפול ב-0.1 מיקרומטר XAV939 בעקבות דה-מיאלינציה המושרה על ידי ליזולציטין שהוכחה על ידי צביעה חיסונית של תרביות פרוסות. (C) כימות אינדקס המיאלינציה (היחס בין השטח הצבוע עבור פרנודות Caspr+ לשטח הצבוע עבור אקסונים NFH+). הערכים המוצגים הם ממוצע + סטיית תקן. P < 0.0001; מבחן T לא מזווג. פסי קנה מידה = 25 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| מדיית תרבות פרוסות (SCM) | |
| נפח | מגיב |
| 100 מ"ל | חומר חיוני מינימלי (MEM), HEPES, ללא גלוטמין |
| 50 מ"ל | סרום סוסים מנוטרל חום |
| 50 מ"ל | תמיסת המלח המאוזנת של ארל |
| 2 מ"ל | פניצילין-סטרפטומיצין 10,000 יח'/מ"ל |
| 2 מ"ל | תוסף GlutaMAX |
| 2888 מיקרוליטר | תמיסת גלוקוז 45% |
| 1 מ"ל | אזור הפטריות |
| מסנן סטרילי דרך מסנן 0.22 מיקרומטר ושומר במקרר 4 מעלות צלזיוס עד שבועיים. | |
| מדיית חיתוך (DM) | |
| נפח | מגיב |
| 100 מ"ל | MEM, HEPES, עם מלחי ארל |
| 1 מ"ל | פניצילין-סטרפטומיצין 10,000 יח'/מ"ל |
| מסנן סטרילי דרך מסנן 0.22 מיקרומטר ושומר במקרר 4 מעלות צלזיוס עד חודשיים. | |
| ציר ליזולציטין (125 מ"ג/מ"ל) | |
| כמות | מגיב |
| 100 מ"ג | ליזולציטין |
| 0.8 מ"ל | PBS סטרילי |
| ממיסים 100 מ"ג ליזולציטין ב-0.8 מ"ל של PBS סטרילי. אחסן 80 מיקרוליטר של תמיסת מלאי ב-20 מעלות צלזיוס. | |
| לפני השימוש יש להפשיר 80 מיקרוליטר ולהמיס ב -20 מ"ל של SCM (0.5% ליזולציטין ב- SCM), מחומם ב 37 מעלות צלזיוס, 7.5% CO2 אינקובטור. במידת הצורך, מערבולת כדי להמיס את הליזולציטין לתוך SCM. | |
טבלה 1: רשימת רכיבים ופרוטוקול לייצור מדיום תרבית פרוסות (SCM), מדיום דיסקציה (DM) ותמיסת ליזולציטין.
Discussion
פרוטוקול זה מתאר מודל תרבית פרוסות מוח מוחי אורגנוטיפי המסכם את ההרכב התאי in vivo בפשטות של מודל במבחנה. ניתן לפתח פרוטוקול זה עוד יותר כדי להפוך למודל מייצג יותר של פתולוגיות אנושיות. ניתן לפתח CSC כמודלים לפגיעות ספציפיות למחלה, כגון פגיעה ברקמות הנגרמת בכוח, פגיעה הנגרמת על ידי נוגדנים ספציפיים למיאלין, או פגיעה באוליגודנדרוציטים בטרשת נפוצה בתוספת תאי חיסון היקפיים. פרוטוקול זה יכול להיות אופטימלי גם עבור רקמות המנותחות מחלקים אחרים של המוח וחוט השדרה16,17. בעוד שפרוטוקול זה מתמקד בכימות ההיסטולוגי של מיאלינציה, CSC מייצג מודל נוח לבחינת נקודות קצה ניסיוניות שונות. ניתן להשתמש בתרביות אלה כדי לאפיין סוגי תאים שונים באמצעות ריצוף RNA של תא בודד, להעריך את המבנה האולטרה-מבני של אקסונים ומעטפות מיאלין באמצעות מיקרוסקופ אלקטרונים, ולחקור את דינמיקת ה-OPC על ידי ביצוע הדמיית זמן-lapse. ניתן לעקוף צביעה חיסונית גם באמצעות קווי דיווח עכברים טרנסגניים18,19. לבסוף, ניתן להשתמש בגילאים שונים של גורי עכברים, זמן בתרבית או עובי חתכים כדי להתאים את CSC למודל מנגנוני מחלה שונים 10,17,18,19,20,23.
תרביות פרוסות הן אידיאליות לבדיקה וכימות גורמים המשפיעים על מיאלינציה ורמיאלינציה, אך מוגבלות בייצוג שלהן של מערכת העצבים המרכזית בהקשרים מסוימים. נגזר ממוחות P 0-2, CSC מגיע ממוחות שנמצאים בשלבים מוקדמים של התפתחות, ויש להם דמיון מוגבל למוח מזדקן או נוירודגנרטיבי. לאור המודעות הגוברת לחשיבות המיאלין בהפרעות במערכת העצבים המרכזית כגון מחלת אלצהיימר21 וסכיזופרניה22, נדרשים מודלים של מבוגרים או הזדקנות של כימות ואפיון מיאלינציה. פורסמו פרוטוקולים אחרים המבודדים רקמות ממכרסמים מבוגרים, אם כי עדיין בשלבי ההתפתחות 10,18,19,23. בנוסף, ייתכנו הבדלים פנימיים וחיצוניים באוליגודנדרוציטים ו-OPCs במוח הקטן בהשוואה לחוט השדרה ולדרכי חומר לבן אחרות במוח. CSC גם פחות מתאימים ממערכות מבחנה מבוססות תאים עבור מסכי CRISPR בקנה מידה גדול או מולקולות קטנות. בשל חיתוך הרקמה הראשוני, יש גם הפעלה של תאי חיסון מולדים השוכנים במוח (כלומר, מיקרוגליה ואסטרוציטים), אזהרה חשובה למערכת24. לבסוף, תאי חיסון היקפיים ממלאים תפקיד גדול בפתולוגיה של טרשת נפוצה25; CSC נטול תאים היקפיים אלא אם כן תאים אלה מתווספים באופן אקסוגני, ולכן אינם מודל אידיאלי לסביבה הדלקתית של מערכת העצבים המרכזית.
חלק הדיסקציה של פרוטוקול זה הוא אולי הקריטי ביותר. יש לבצע שלבי דיסקציה בזהירות מירבית, כדי לא לפגוע ברקמה ובמבנה הבסיסי. יישור נכון של המוח לאורך להב קוצץ הרקמות מבטיח נזק מינימלי לרקמה ולתאים. בנוסף, חיתוך והפרדה קפדניים של פרוסות, כמו גם העברתם לממברנות לתרבות, חשובים. מסגרות הזמן המתוארות בפרוטוקול זה עברו אופטימיזציה למחקר המתואר, אך ייתכן שיהיה צורך להתאים אותן לתוצאות מיטביות במחקרים שונים. פרוטוקול זה יהיה שימושי למי שרוצה לחקור מיאלינציה התפתחותית ותיקון מיאלין.
יש לציין כי אין תרופה לטרשת נפוצה. בעוד שהטיפולים הנוכחיים יעילים למדי בדיכוי מערכת החיסון הנרכשת, אף טיפול נוכחי לא יכול לעצור את התקדמותה. כשל של רמיאלינציה וניוון עצבי לאחר מכן נחשב כבסיס להתקדמות של MS2. נוכחותם של OPCs בנגעים כרוניים של טרשת נפוצה מצביעה על כך שכשל בתיקון המיאלין עשוי לנבוע מעצירת התמיינות OPC. השימוש ב-CSC פותח נתיב גילוי לטיפולים לתיקון מיאלין שעשויים לעזור להפוך את התקדמות הטרשת הנפוצה ולשקם את התפקוד. טיפול בתיקון מיאלין יכול גם לסייע בהחלמה בחולים עם פגיעה בחוט השדרה, כאשר מסלולים דמיאליניים מעכבים את התפקוד התנועתי26. לכן, חשיבותו של CSC נעוצה בהתאמתו לזיהוי גורמים המשפיעים על דמיאלינציה ורמיאלינציה של יונקים באופן תפוקה גבוה יחסית בהשוואה למודלים של בעלי חיים in vivo. בעוד שמחקרים רבים השתמשו ב-OPCs ראשוניים לסינון תרכובות המשפיעות על התמיינות, יצירה ובידוד של OPCs ראשוניים דורשים אימונופאנינג מייגע ורציף. בנוסף, בדיקות מבוססות תאים אינן מסכמות את המגוון והאינטראקציה של סוגי התאים הקיימים in vivo. יצירת CSC מגורי עכברים היא מודל מהיר וחסכוני לחקר מיאלינציה ורמיאלינציה שאינה דורשת ציוד יקר או חומרים מתכלים. תרביות פרוסות המוח הקטן מייצגות אפוא מודל כמותי שלא יסולא בפז לסיכום מיאלינציה ex vivo ומאפשרות גילוי תרופות ומחקר מדעי בסיסי.
Disclosures
הכותבים הם עובדי Genentech, Inc., חברה בקבוצת Roche.
Acknowledgements
המחברים רוצים להודות ליון-אן שן, רוקסן קיאוק וכריס בולן על ההערות הבונות והמשוב על המאמר הזה. בנוסף, המחברים מכירים בתרומות של צ'ארלס פרנץ'-קונסטנט, אנדרו ג'רג'ור, ורוניק מירון ודיוויד רוביץ' בפיתוח מוקדם של מתודולוגיה קשורה שפורסמה בעבר 11,12,13.
Materials
| Name | Company | Catalog Number | Comments |
| #5/45 Forceps | Fine Science Tools | 11251-35 | Dissection tools |
| 32% Paraformaldehyde | Electron Microscopy Sciences | 50-980-495 | Fixative for staining |
| 45% glucose solution | Sigma | G8769 | Slice culture media component |
| 6-well tissue culture plates | Corning | 3516 | Plates for cultures |
| Alexa Fluor Goat anti-chicken 647 | Thermo Fisher Scientific | A21449 | Secondary staining antibody |
| Alexa Fluor Goat anti-mouse 647 | Thermo Fisher Scientific | A21236 | Secondary staining antibody |
| Alexa Fluor Goat anti-rabbit 555 | Thermo Fisher Scientific | A11006 | Secondary staining antibody |
| Alexa Fluor Goat anti-rat 488 | Thermo Fisher Scientific | A21428 | Secondary staining antibody |
| Blades, Double-edge, PTFE coated Stainless steel | Ted Pella | 121-6 | Chopping blades |
| Bovine Serum Albumin (BSA) | Sigma | A9418 | Blocking solution component |
| Chicken anti-NFH antibody | Encor Biotech | CPCA-NF-H | Staining antibody |
| Confocal Microscope | Zeiss | LSM780 | Confocal for imaging |
| Corning 250 mL vacuum filter/storage bottle system, 0.22 µm pore | Corning | 431096 | For media preparation |
| Earl's balanced salt solution | Sigma | E2888 | Slice culture media component |
| Feather surgical blade | Feather | 2976#11 | Dissection tools |
| Fungizone | Thermo Fisher Scientific | 15290-18 | Dissection media component |
| GlutaMAX supplement | Thermo Fisher Scientific | 35050-061 | Slice culture media component |
| Heat-inactivated horse serum | Thermo Fisher Scientific | 26050-88 | Slice culture media component |
| Lysolecithin | Sigma | L4129 | |
| Lysophosphatidylcholine from egg yolk | Sigma | L4129 | To induce demyelination |
| McIlwain Tissue Chopper | Ted Pella | 10180 | Tissue chopper |
| MEM, Hepes, no glutamine | Thermo Fisher Scientific | 12360-038 | Slice culture media component |
| MEM, Hepes, with Earle's salts | Sigma | M7278 | Dissection media component |
| Metal spatula | Fisher Scientific | 470149-442 | Dissection tools - bend flat end at angle for use |
| Millicell Culture Plate Insert 30mm Organotypic PTFE | Fisher | PICM0RG50 | Culture insert |
| Mouse anti-CC1 antibody | Millipore | OP80-100UG | Staining antibody |
| Noyes spring scissors | Fine Science Tools | 15012-12 | Dissection tools |
| PBS pH 7.4 | Gibco | 10010023 | For dilution of fixative |
| Penicillin-streptomycin 10,000U/mL | Thermo Fisher Scientific | 15140-122 | Slice culture media component |
| Rabbit anti-Caspr antibody | Abcam | ab34151 | Staining antibody |
| Rabbit anti-Olig2 antibody | Millipore | AB9610 | Staining antibody |
| Rat anti-MBP antibody | Serotec | MCA409S | Staining antibody |
| Scalpel handle #3 | Fine Science Tools | 10003-12 | Dissection tools |
| Silicone rubber foam sheet | MSC Industrial Direct Co | 31939176 | Cutting base |
| Stereo Microscope | Olympus Life Sciences | SZ61 | Microscope for dissection |
| Student surgical scissors | Fine Science Tools | 91401-12 | Dissection tools |
References
- Purves, D., Augustine, G. J., Fitzpatrick, D. Increased Conduction Velocity as a Result of Myelination. Neuroscience 2nd edition. , (2001).
- Dutta, R., Trapp, B. D. Mechanisms of neuronal dysfunction and degeneration in multiple sclerosis. Progress in Neurobiology. 93 (1), 1-12 (2011).
- Trapp, B. D., Nave, K. A. Multiple sclerosis: an immune or neurodegenerative disorder?. Annual Review of Neuroscience. 31, 247-269 (2008).
- Bradl, M., Lassmann, H. Oligodendrocytes: biology and pathology. Acta Neuropathologica. 119 (1), 37-53 (2010).
- Domingues, H. S., Portugal, C. C., Socodato, R., Relvas, J. B. Oligodendrocyte, Astrocyte, and Microglia Crosstalk in Myelin Development, Damage, and Repair. Frontiers in Cell and Developmental Biology. 4, 71 (2016).
- Nave, K. A., Werner, H. B. Myelination of the nervous system: mechanisms and functions. Annual Review of Cell and Developmental Biology. 30, 503-533 (2014).
- Franklin, R. J. M., Ffrench-Constant, C. Regenerating CNS myelin – from mechanisms to experimental medicines. Nature Reviews Neuroscience. 18 (12), 753-769 (2017).
- Molina-Gonzalez, I., Miron, V. E. Astrocytes in myelination and remyelination. Neuroscience Letters. 713, 134532 (2019).
- Keough, M. B., Jensen, S. K., Yong, V. W. Experimental demyelination and remyelination of murine spinal cord by focal injection of lysolecithin. Journal of Visualized Experiments. (97), e52679 (2015).
- Birgbauer, E., Rao, T. S., Webb, M. Lysolecithin induces demyelination in vitro in a cerebellar slice culture system. Journal of Neuroscience Research. 78, 157-166 (2004).
- Fancy, S. P., et al. Axin2 as regulatory and therapeutic target in newborn brain injury and remyelination. Nature Neuroscience. 14 (8), 1009-1016 (2011).
- Yuen, T. J., et al. Identification of endothelin-2 as an inflammatory factor that promotes CNS remyelination. Brain. 136, 1035-1047 (2013).
- Yuen, T. J., et al. Oligodendrocyte-encoded HIF function couples postnatal myelination and white matter angiogenesis. Cell. 158 (2), 383-396 (2014).
- Stokes, C. E., Murphy, D., Paton, J. F., Kasparov, S. Dynamics of a transgene expression in acute rat brain slices transfected with adenoviral vectors. Experimental Physiology. 88, 459-466 (2003).
- Dillenburg, A., et al. Activin receptors regulate the oligodendrocyte lineage in health and disease. Acta Neuropathologica. 135 (6), 887-906 (2018).
- Dean, J. M., et al. An organotypic slice culture model of chronic white matter injury with maturation arrest of oligodendrocyte progenitors. Molecular Neurodegeneration. 6, 46 (2011).
- Zhang, H., Jarjour, A. A., Boyd, A., Williams, A. Central nervous system remyelination in culture--a tool for multiple sclerosis research. Experimental Neurology. 230 (1), 138-148 (2011).
- Hill, R. A., Medved, J., Patel, K. D., Nishiyama, A. Organotypic slice cultures to study oligodendrocyte dynamics and myelination. Journal of Visualized Experiments. (90), e51835 (2014).
- Sherafat, A., Hill, R. A., Nishiyama, A. Organotypic Slice Cultures to Study Oligodendrocyte Proliferation, Fate, and Myelination. Molecular Biology (Clifton, N.J.). 1791, 145-156 (2018).
- Croft, C. L., Noble, W. Preparation of organotypic brain slice cultures for the study of Alzheimer's disease. F1000Research. 7, 592 (2018).
- Nasrabady, S. E., Rizvi, B., Goldman, J. E., Brickman, A. M. White matter changes in Alzheimer's disease: a focus on myelin and oligodendrocytes. Acta Neuropathologica Communications. 6 (1), 22 (2019).
- Flynn, S. W., et al. Abnormalities of myelination in schizophrenia detected in vivo with MRI, and post-mortem with analysis of oligodendrocyte proteins. Molecular Psychiatry. 38, 811-820 (2003).
- Thetiot, M., Ronzano, R., Aigrot, M. S., Lubetzki, C., Desmazières, A. Preparation and Immunostaining of Myelinating Organotypic Cerebellar Slice Cultures. Journal of Visualized Experiments. (145), e59163 (2019).
- Gerlach, J., Donkels, C., Münzner, G., Haas, C. A. Persistent Gliosis Interferes with Neurogenesis in Organotypic Hippocampal Slice Cultures. Frontiers in Cellular Neuroscience. 10, 131 (2016).
- Reich, D. S., Lucchinette, C. F., Calabresi, P. A. Multiple Sclerosis. New England Journal of Medicine. 378 (2), 169-180 (2018).
- Jeffery, N. D., Blakemore, W. F. Locomotor deficits induced by experimental spinal cord demyelination are abolished by spontaneous remyelination. Brain. 120, 27-37 (1997).
- Emery, B., Dugas, J. C. Purification of oligodendrocyte lineage cells from mouse cortices by immunopanning. Cold Spring Harbor Protocols. , 854-868 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved