Method Article
نموذج القُزلة السنخية البشرية متعددة الخلايا يتكون من الخلايا الظهارية والخلايا المناعية الأولية لتقييم المخاطر
* These authors contributed equally
In This Article
Summary
قدم هنا هو بروتوكول لعزلة أحادية الدم الإنسان الأولية وكذلك تمايزها في الضامة والخلايا التشعبية والتجميع مع الخلايا الظهارية في نموذج الرئة البشرية متعددة الخلايا. وتقارن الاستجابات البيولوجية لثقافات النقوش المكونة من خلايا مناعية متمايزة عن الخلايا الأحادية المعزولة حديثا أو المذابة، عند التعرض للمحفزات البهوية.
Abstract
ويرد هنا نموذج لزراعة الخلايا القُصَلية البشرية لمحاكاة حاجز الأنسجة الظهارية السنخية المكون من خلايا ظهارية من النوع الثاني واثنين من أنواع الخلايا المناعية (أي الضامة المشتقة من أحادية الخلايا البشرية [MDMs] والخلايا التكينة [MDDCs]). يتم توفير بروتوكول لتجميع النموذج متعدد الخلايا. تنمو الخلايا الظهارية السنخية (خط الخلية A549) وتتمايز في ظل ظروف مغمورة على إدراج نفاذي في آبار من غرفتين، ثم جنبا إلى جنب مع MDMs متفاوتة وDDCS. وأخيراً، تتعرض الخلايا لواجهة هوائية سائلة لعدة أيام. كما الخلايا المناعية الأولية البشرية تحتاج إلى عزل من المعاطف بافي الإنسان، يتم مقارنة الخلايا المناعية التي تم تمييزها من إما أحاديات الطازجة أو المذابة من أجل تكييف الأسلوب على أساس الاحتياجات التجريبية. تظهر النماذج ثلاثية الأبعاد ، المكونة من خلايا قُزَّرة إما معزولة حديثًا أو مذابة خلايا مناعية مشتقة من أحادية السُنَة ، زيادة كبيرة إحصائيًا في السيتوكين (إنترلوكين 6 و 8) عند التعرض للمحفزات البروتينية (liplysaccharide وعامل نخر الورم α) مقارنة بالخلايا غير المعالجة. من ناحية أخرى، لا يوجد فرق مهم إحصائيا بين الإفراج السيتوكين لوحظ في الثقافات. وهذا يدل على أن النموذج المقدم يستجيب للمحفزات البروينفلية في وجود MDMs و MDDCs التي تميّز من ذوبان أو ذوبان ونُسج الدم المحيطي الطازجة (PBMs). وبالتالي، فهو أداة قوية للتحقيق في الاستجابة البيولوجية الحادة لمختلف المواد، بما في ذلك العقاقير الهباءية أو المواد النانوية.
Introduction
في الثقافات في خلايا الرئة في المختبر تقدم فعالة من حيث التكلفة، قوية، ومنصات تسيطر عليها بشكل جيد لتقييم مخاطر الهباء الجوي1. كنظام الخلايا النموذجية لثنوموسيات الأمهرة السنخية البشرية، وغالبا ما يستخدم خط الخلية A549 الظهارية المعزولة من غدية رئوية2. هذه الخلايا تمثل الخلايا الظهارية من النوع الثاني الحرشفية من المنطقة القُصيبية3 وهي عبارة عن خط خلايا الرئة المستخدم على نطاق واسع لتقييم الخطر والسمية1،4،5,،6،7،8،9،10. يمتلك خط الخلية A549 ميزات ذات صلة من خلايا النوع الظهاري الثاني السنخية ، مثل وجود أجسام لميلاس مميزة تحتوي على فوسفوليبيدات معبأة بكثافة3.
وقد تبين أنه عندما يتم استزراع الخلايا في واجهة الهواء السائل (ALI)، يتم تحرير السطحي على الجانب apical من الخلايا الظهارية الهواء المكشوفة، والحد من التوترالسطحي 11،12،13. هذه الميزة هي ذات أهمية خاصة في المواد النانوية في التنفس وفحوصات السمية. مرة واحدة يتم ترسيس المواد النانوية المستنشقة / المواد السامة في منطقة السنخية، فإنها تتفاعل أولا مع السطح الرئوي ويتم تشريدها من قبل قوات التبول في hypophase مائي، حيث التفاعل مع الخلايا الرئوية يحدث14،15. على الرغم من أن الخلايا A549 تشكل أحادية الطبقة (التي يمكن أن overgrow في multilayers في وقت لاحق من النقاط الزمنية عندما تزرع في ALI) وإنتاج السطحي، والعيب هو عدم كفاية تشكيل تقاطع ضيق، مما أدى إلى انخفاض قيم المقاومة الكهربائية transepithelial، ولكن لا يزال تقديم حاجز وظيفي ضد بين الخلايا (نانو) الجسيمات نقل المواقع16،17،18.
في الرئتين، هناك مجموعة متنوعة من مجموعات الخلايا المناعية، بما في ذلك الخلايا التي تقدم المستضدات بالبلعية والمهنية (أي الضامة والخلايا التشعبية) التي تتواصل مباشرة من خلال الاتصال الخلوي أو الإشارات بين الخلايا للتحكم في التوازن والحفاظ عليه. الضامة والخلايا التشعبية هي الآثار المناعية الفطرية الحرجة والمبادرين من الاستجابة المناعية التكيفية19. يمكن للخلايا التشعبية المقيمة داخل أو تحت الظهارة أن تشكل نتوءات عبر الظهارة إلى التجويف لالتقاط المستضدات. تقع الضامة السنوية على السطح الكبي للظهارة وتعمل كخلايا خرابة ، تمثل أول دفاع خلوي ضد المواد الأجنبية وكذلك العدوى البكتيرية والفيروسية والفطرية. اللدونة phenotypic يسمح التعريفي بسرعة من ردود الفعل proinflammatory ردا على هذه المحفزات وكذلك التحول إلى اثارة مضادة للالتهابات (أي، مثبطة) ردود الفعل20.
لمحاكاة حاجز الأنسجة الظهارية السنخية البشرية، أنشأنا نموذج تربية الأحياء الثلاثية مع الخلايا A549 تكملها الضامة المشتقة من الدم البشري (MDMs) والخلايا التشعبية (MDDCs) على الجانبين apical والقاعدة، على التوالي17. وقد تم الإبلاغ سابقا عن زراعة هذا النموذج في ALI16، حتى تصل إلى 72 ساعة بعد التعرض21. وقد تعززت الاستجابات المناعية الحادة للتعرض للأنابيب النانوية الكربونية بشكل كبير في زراعة الخلايا المعرضة لـ ALI مقارنة بالظروف المغمورة22. نموذج تربية الأحياء، المستزرعة والمعرضة لمواد مختلفة في ALI، وقد استخدمت سابقا للتحقيق في السمية الخلوية، والإجهاد التأسدي والاستجابات الالتهابية على التعرض لأكسيد الزنك،23 المواد ذات الصلة الجرافين24، الذهب الجسيمات النانوية25،26، الكربون نانوتيوب21، والرماد البركاني وجزيئات العادمالديزل 27.
وعلاوة على ذلك، تم تأكيد الدور الهام لل الضامة والخلايا التشعبية كخلايا مناعية في نموذج الرئة البشري في المختبر. على وجه الخصوص، لوحظ استجابة proinflammatory زيادة في النموذج فقط في وجود الخلايا المناعية بالمقارنة مع نظم أحادية الاستزراع7. تتمثل العيوب المحتملة لاستخدام الخلايا المناعية الأولية المشتقة من أحادية الخلايا في محدودية إمكانية الوصول إلى PBMs وكذلك الاختلاف بين المانحين والمتبرعين. كحل لهذه العيوب المحتملة ، المقدمة هنا هو بروتوكول إدخال حفظ التبريد من PBMs المعزولة حديثا28 لثقافة الخلية نموذج التجميع. الهدف من هذه الدراسة هو إثبات 3D الإنسان 3D الأنسجة الظهارية الجمعية الظهارية، بما في ذلك عزل PBMs من المعاطف بافي الإنسان. وتقارن الاستجابة للمحفزات الحفزية بالنموذج المؤلف من الـ MDMs وMDDCs المتمايزة عن برامج العمل الناشئة أو المتمايزة عن PBMs المجمدة/المذابة.
ويتطلب العمل مع عينات دم بشرية لم تختبر بعد رعاية محددة لمنع انتقال الأمراض المعدية المحتملة، مثل فيروس نقص المناعة البشرية والتهاب الكبد B والتهاب الكبد C. ولذلك، فإن استخدام تدابير الحماية الشخصية مثل القفازات والعباءات والأقنعة وحماية العين أمر بالغ الأهمية ويجب أن يكون وفقا لمبادئ الممارسة المختبرية الجيدة. هذه الحماية تقلل من خطر تعريض الجلد أو الأغشية المخاطية للسوائل المعدية المحتملة. بالإضافة إلى ذلك، بالنسبة لأولئك الذين يشاركون في التعامل مع المعاطف البافي وPMS، فإن التطعيم ضد فيروس التهاب الكبد B إلزامي، ومستويات تتر الدم من الأجسام المضادة لالتهاب الكبد B يجب أن تكون فوق 100 وحدة دولية /لتر (يجب معالجة المتطلبات التشريعية الخاصة بالبلد). وبالإضافة إلى ذلك، يجب أن يتم تنفيذ جميع الأعمال في مختبرات السلامة الأحيائية 2 (يلزم معالجة المتطلبات التشريعية الخاصة بكل بلد). وينبغي عند إجراء البروتوكول بأكمله اعتماد احتياطات معيارية للصحة والسلامة ترتبط بالعمل في بيئة مختبرية ومناولة ثقافة خلايا الثدييات، بما في ذلك مناولة النفايات.
Protocol
وقد وافقت لجنة المكتب الاتحادي للصحة العامة في سويسرا على العمل الذي يشمل الخلايا الأحادية الأولية المعزولة عن الدم البشري (رقم مرجعي: 611-1، ميلدونغ A110635/2) لمعهد أدولف ميركل.
1. عزل monocytes الدم المحيطي (PBMs) من المعاطف بافي الإنسان
ملاحظة: يصف القسم التالي عزل الخلايا المناعية من كيس واحد من معطف بافي 50 مل، تم شراؤه من مركز نقل الدم السويسري في برن، سويسرا.
- إعداد الكواشف
- إعداد 100 مل من العازلة الفاصلة المغناطيسية لكل معطف برتقالي: 0.5٪ [ث / الخامس] البوم مصل الأبقار (BSA؛ في الفوسفات المخزنة المالحة [PBS]) مع 2 mM Ethylenediaminetetraacetic حامض (EDTA)، والتكيف مع pH = 7.2، مرشح معقمة مع 0.22 ميكرومتر المسام حجم). تبقي عند 4 درجة مئوية طوال العملية.
- إعداد المتوسطة ثقافة الخلية (CCM): RPMI 1640 مع 10٪ [v/v] مصل الأبقار الجنين (FBS)، 1٪ [v/v] L-الجلوتامين (هنا، 2 M L-الجلوتامين)، و 1٪ [الخامس / الخامس] البنسلين-الستربتوميسين (هنا، 100 وحدة/ مل البنسلين و 100 ميكروغرام/مل ستريبتوميسين).
ملاحظة: يعتمد المبلغ المطلوب من كل كاشف على عدد الخلايا التي سيتم بذرها في الخطوات التالية.
- عزل PBMs
ملاحظة: جميع الزجاج والبرمجيات البلاستيكية يحتاج إلى تعقيم قبل الاستخدام. لأسباب تتعلق بالسلامة، ينصح باستخدام أدوات البلاستيك عند التعامل مع عينات الدم البشري للحد من خطر الإصابة مع الأواني الزجاجية.- استخدام مقص لقطع فتح نهاية خرطوم من الحقيبة التي تحتوي على معطف بافي.
- توزيع معطف بافي عن طريق صب محتويات الحقيبة من خلال مجرى الحقيبة مباشرة في اثنين من أنابيب جهاز الطرد المركزي مخروطية 50 مل (~ 25 مل لكل منهما).
- صب بلطف أو ماصة برنامج تلفزيوني في الأنابيب لتصل إلى 50 مل وحدات التخزين. اخلط المحتويات عن طريق تحويل الأنبوب برفق رأساً على عقب 3x.
- تقسيم معطف بافي-PBS الخليط إلى أربعة أنابيب جديدة 50 مل مخروطية الطرد المركزي عن طريق الأنابيب 25 مل من الخليط في كل أنبوب جديد.
- وضع ببطء 13 مل من متوسطة التدرج الكثافة تحت خليط معطف-PBS بافي باستخدام ماصة مصلية 10 مل. فصل الماصات المملوءة من حامل الماصات وقم على الفور بتوصيل الفتحة العليا للماصات بإبهام لمنع أي تسرب إضافي لتدرج الكثافة المتوسط في خليط معطف PBS.
ملاحظة: عقد الفتحة العليا مع الإبهام، ضع ماصة مملوءة في الجزء السفلي من أنبوب الطرد المركزي المخروطي بحيث متوسط الكثافة متدرج يتدفق ببطء تحت معطف- مخلط بافي خليط، وترك ما يقرب من 1 مل من متوسطة التدرج الكثافة داخل الماصات. - كرر الخطوة 1.2.5 مع أنابيب الثلاثة الأخرى التي تحتوي على خليط معطف-PBS.
- أجهزة الطرد المركزي جميع الأنابيب الأربعة التي تحتوي على خليط لمدة 20 دقيقة في 1000 × ز و 25 درجة مئوية في وضع الكبح بطيئة. استخدام أصحاب مع أغطية واقية للطرد المركزي.
- افتح غطاء كل أنبوب، وأزل الطبقة العليا التي تحتوي على البلازما والصفائح الدموية باستخدام ماصة مصلية، والتخلص منها في حاوية نفايات سائلة محتلة بغاز حيوي.
- استخدم ماصة مصلية لجمع طبقة خلايا الدم أحادية النوى الطرفية، والتي تظهر ككسر صغير عكر (~ 2-3 مم في سمك) بين البلازما والطبقات المتوسطة للكثافة. بيليه يحتوي على خلايا الدم الحمراء في الجزء السفلي. تجنب نقل كريات الدم الحمراء التي تشكل الطبقة السفلية الأكثر. كرر هذا لجميع الأنابيب الأربعة.
ملاحظة: تتكون خلايا الدم أحادية النواة الطرفية من PBMs والخلايا اللمفاوية. سيتم فصل PBMs من الخلايا الليمفاوية في وقت لاحق خلال فصل CD14+ المغناطيسي. - بركة خلايا أحادية النوى الدم الطرفية من أربعة أنابيب إلى اثنين من أنابيب 50 مل.
- ملء أنبوبين مع برنامج تلفزيوني إلى 50 مل وتغطية مع غطاء.
- تخلص من بقايا الكريات الحمراء والبلازما من الأنابيب الأربعة الأصلية في حاوية نفايات سائلة مُهترِبة بيولوجياً.
- جهاز طرد مركزي الأنابيب اثنين لمدة 8 دقيقة في 500 س ز و 18-20 درجة مئوية في سرعة جهاز طرد مركزي العادية.
- بعد الطرد المركزي، إزالة المطاول مع ماصة المصلية والتخلص منه في حاوية النفايات السائلة مخاطرة حيوية.
- Resuspend الخلايا مع 5 مل من برنامج تلفزيوني باستخدام ماصة المصلية.
- تجمع تعليق الخلية في واحد 50 مل أنبوب أجهزة الطرد المركزي المخروطية وملء إلى 50 مل مع برنامج تلفزيوني.
- استخدم 5 ميكرولتر من تعليق الخلية لحساب الخلايا التي تحتوي على عداد خلية باستخدام طريقة الاستبعاد الزرقاء (45 ميكرولتر).
- Pipette 10 μL من حل trypan الأزرق PBMs في غرفة عداد الخلية وحساب عدد الخلايا في بروتوكول العد القياسية. استخدم المعادلة 1 لحساب إجمالي عدد الخلايا، CT.
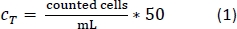
- بعد عد الخلايا، الطرد المركزي أنبوب 50 مل كما فعلت في الخطوة 1.2.13.
- CD14 اختيار إيجابي
- فتح بلطف غطاء كل أنبوب، ثم إزالة والتخلص من مافر باستخدام ماصة المصلية دون إزعاج بيليه.
- إضافة المبلغ المحسوب (المعادلة 2) من العازلة الفاصل المغناطيسي (هنا، 80 ميكرولتر من المخزن المؤقت لكل 1 × 107 مجموع الخلايا) وإعادة تركيب خلية بيليه عن طريق الأنابيب الحل صعودا وهبوطا.
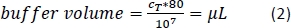
- حساب باستخدام المعادلة 3 (هنا، 10 ميكرولتر لكل 1 × 107 مجموع الخلايا) حجم المقابلة من CD14 + الخرز المغناطيسي والماصات الحجم المناسب.
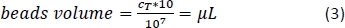
- مزيج جيدا عن طريق الأنابيب صعودا وهبوطا، وإغلاق الغطاء، واحتضان الحل في 4 درجة مئوية لمدة 15 دقيقة.
- عند الحضانة، ملء أنبوب تصل إلى 50 مل مع العازلة الفاصل المغناطيسي.
- جهاز طرد مركزي كما تم في الخطوة 1-2-13.
- التعرق والتخلص من المابس باستخدام ماصة المصلية دون إزعاج بيليه الخلية.
- Pipette المبلغ المقابل من العازلة الفاصل المغناطيسي (المعادلة 4؛ هنا، 500 ميكرولتر من العازلة لكل 1 × 108 خلايا) ومزيج بلطف عن طريق الأنابيب صعودا وهبوطا 3x.
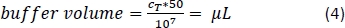
- تطهير محطة الفصل المغناطيسي عن طريق الرش ومسحه مع عامل تعقيم. مكان في غطاء محرك تدفق الفاتن جنبا إلى جنب مع العمود للفصل المغناطيسي.
- ضع عمود الفصل المغناطيسي في المجال المغناطيسي ووضع أنبوب طرد مركزي مخروطي فارغ 50 مل مباشرة تحت العمود لجمع الخلايا الغسلية والخلايا غير المُوَمَّمة (أي النفايات).
- شطف العمود الفاصل المغناطيسي عن طريق الأنابيب 3 مل من العازلة الفاصل المغناطيسي في العمود. لا تدع العمود يجف طوال العملية.
- إعداد أنبوب جهاز طرد مركزي مخروطي 15 مل وماصة 1 مل من العازلة الفاصلة المغناطيسية.
- تطبيق تعليق الخلية (المعدة في الخطوة 1.3.8) إلى عمود فصل المغناطيسي. في أنبوب أجهزة الطرد المركزي المخروطية 50 مل تحت المرشح، وجمع الخلايا غير التي تم تصنيفها التي مرت من خلال.
ملاحظة: لا تتجاوز 2 × 109 خلايا لكل عمود لتجنب حظر العمود. - بمجرد أن يكون خزان العمود فارغًا (أي عندما تمر الخلايا عبر العمود) ، قم بتطبيق 3 مل من عازلة الفصل المغناطيسي باستخدام ماصة مصلية واتركها تمر عبر العمود. كرر هذا 3x.
- قم بإزالة عمود الفصل المغناطيسي من الفاصل المغناطيسي عن طريق السحب بلطف باليدين، ثم وضعه في أنبوب 15 مل يحتوي على 1 مل من عازلة الفصل المغناطيسية (المعدة في الخطوة 1.3.12).
- إضافة 5 مل من العازلة الفاصل المغناطيسي إلى العمود وطرد الخلايا المسمى مغناطيسيا عن طريق دفع بقوة المكبس في العمود.
- إعداد الكاشف لتمايز MDM و MDDC
- عد الخلايا التي لها عداد خلية باستخدام أسلوب الاستبعاد الأزرق trypan كما تم في الخطوة 1.2.17.
- حساب الأحجام المطلوبة من CCM أو FBS للخطوات التالية: إما حجم CCM المقابلة لكثافة خلية 1 × 106 خلايا /مل (الخطوة 1.5.1)، أو حجم FBS المقابلة كثافات خلية 6 × 106 خلايا لكل 0.9 مل من FBS (الخطوة 1.6.3).
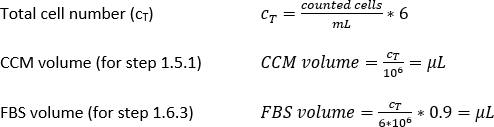
- أغلق الغطاء، وضع الأنبوب في جهاز الطرد المركزي، والطرد المركزي كما تم في الخطوة 1.2.13. إزالة والتخلص من افرط دون إزعاج بيليه الخلية. تابع إلى الخطوة 1.5 لبذور الخلايا أو الخطوة 1.6 لتجميد الخلية.
- البذر PBM والتمايز في MDMs و MDDCs
- Resuspend بيليه الخلية في حجم محسوب من CCM كما تحسب في الخطوة 1.4.2 (هنا، تركيز نهائي من 1 × 106 خلايا / مل) عن طريق الأنابيب صعودا وهبوطا 3x.
- مايات عدد الخلايا التي تهدف إلى التفريق إلى MDM وDDCs في أنابيب منفصلة للطرد المركزي المخروطي باستخدام ماصة المصلية.
- عوامل الماصة التمييز إلى CCM مع PBMs ومزيج جيد عن طريق الأنابيب صعودا وهبوطا. وتُطبَّق عوامل التمييز على النحو التالي:
- بالنسبة للبلدان متعددة الأعراق: التركيز النهائي البالغ 10 نانوغرام/مل إنترلوكين-4 (IL-4) و10 نانوغرام/مل من الحبيبات-الضامة-عامل تحفيز مستعمرة (GM-CSF).
- لMDMs: التركيز النهائي من 10 نانوغرام / مل الضامة عامل تحفيز مستعمرة (M-CSF).
- Pipette تعليق الخلية في CCM مع عوامل التمييز المضافة إلى 6 ألواح الآبار عن طريق توزيع 3 مل من التعليق في البئر (يتوافق مع 3 × 106 خلايا / جيدا، أي 1 × 106 خلايا / مل).
- ضع 6 لوحات بئر في حاضنة ثقافة الخلية (37 درجة مئوية، 5٪ CO2) واتركها تفرق لمدة 6 أيام دون تحديث CCM.
ملاحظة: يتراوح التمييز بين 5 و8 أيام حسب التوافر المحلي للمعاطف المُتَبَرّة والإعداد التجريبي، شريطة أن يتم تحديد كفاءة التمايز باستخدام التقنيات المناسبة (راجع قسم المناقشة).
- PBM تجميد
- Resuspend بيليه الخلية في وسط التبريد (هنا، FBS وكبريتيد ثنائي الفينيل [DMSO؛ السامة للخلايا]) بنسبة 9:1 (v/v) عن طريق الأنابيب حجم FBS مسبقة الالدفء. وهذا يقابل تركيز الخلية النهائي من 6 × 106 خلايا / مل، مع الأخذ في الاعتبار إضافة أخرى من 10٪ DMSO (v/v).
- وضع علامة على العدد المطلوب من cryات في غطاء تدفق الفارين (أي، تسجيل التاريخ، رمز العزل، وعدد الخلايا).
- Pipette 0.9 مل من تعليق الخلية في FBS نقية (هنا، 6 × 106 الخلايا في 0.9 مل من FBS) إلى كل cryovial. في وقت لاحق، ببطء ماصة 0.1 مل من DMSO وخلط التعليق جيدا عن طريق تحويل التبريد صعودا وهبوطا 3x.
- نقل cryovials إلى حاوية تجميد الخلية وتعيينها على الفور إلى -80 درجة مئوية لمدة 24 ساعة.
- بعد 24 ساعة، وإزالة cryovials من -80 درجة مئوية الفريزر والحاويات ووضعها في خزان النيتروجين السائل مناسبة لتخزين الخلايا.
- ذوبان PBM والتمايز في MDMs و MDDCs
- دافئة جميع الكواشف المطلوبة إلى 37 درجة مئوية في حمام مائي (~ 20-30 دقيقة).
- إعداد العدد المناسب من 6 ألواح بئر مطابقة لعدد الخلايا المذابة (هنا، صفيحة واحدة لكل 1.8 × 107 خلايا، أي 3 كريوفيات). ماصة 2 مل من CCM إلى كل بئر في ظل الظروف المتعفنة. ضع لوحات في الحاضنة (5 ٪ CO2، 37 درجة مئوية) لمدة 15 دقيقة للسماح للدرجة المئوية لتكبيل.
- خذ الكمية المطلوبة من التبريد مع الخلايا المجمدة من خزان النيتروجين السائل ودوامة بلطف لهم في حمام الماء 37 درجة مئوية (1-2 دقيقة) لضمان ذوبان موحدة من تعليق الخلية.
- إزالة cryovial من حمام الماء وإزالة التلوث مع عامل تعقيم، وضمان أن وكيل لا تتفاعل مع غطاء و O-حلقة.
ملاحظة: هيرون، يجب أن تكتمل جميع الخطوات في ظل ظروف اكمت. - إعداد العدد المناسب من 15 مل أنابيب أجهزة الطرد المركزي المخروطية المقابلة لعدد من التبريدات التي سيتم إذابتها (هنا، 6 × 106 خلايا / أنبوب). ماصة 9 مل من CCM ما قبل الدفء في كل أنبوب.
- الماصات ببطء (قطرة قطرة) محتويات التبريد في أنبوب يحتوي على CCM. أغلق الغطاء، وكرر كل أنبوب، وطاردة مركزية عند 200 x غم لمدة 5 دقائق بسرعة منتظمة للطرد المركزي.
- تجاهل المابير بدون إزعاج بيليه
- Resuspend بيليه من كل أنبوب (الذي يحتوي على خلايا من واحد cryovial) في 2 مل من CCM قبل الدفء عن طريق الأنابيب صعودا وهبوطا باستخدام ماصة المصلية (كثافة الخلية المقابلة ل3 × 106 الخلايا / مل).
- من كل أنبوب، الماصات الخلايا resuspended في بئرين (1 مل في البئر) من لوحة 6 آبار تحتوي على 2 مل من CCM أعدت سابقا للوصول إلى كثافة الخلية من 3 × 106 خلايا / بئر (المقابلة لتركيز نهائي من 1 × 106 خلايا / مل). كرر هذا لجميع الأنابيب الأخرى.
- المضي قدما في التمييز على النحو المبين في الفرع 1-5-3.
- ضع 6 لوحات بئر في حاضنة ثقافة الخلية (37 درجة مئوية، 5٪ CO2) واتركها تفرق لمدة 6 أيام دون تحديث CCM.
2. الثلاثي خلية coculture نموذج من الأنسجة الظهارية السنخية البشرية
ملاحظة: يوفر هذا القسم إرشادات حول وحدات التخزين وأرقام الخلايا المطابقة لإدراج 12 لوحةجيدة. ويلخص الشكل 1 جدولاً زمنياً مقترحاً للتجميع النموذجي.
- الخلايا الظهارية (خط الخلية A549) البذر
- زراعة الخلايا الظهارية وفقا لتوصيات المقدمة من المورد (ATTC). باختصار، والخلايا في ccm في 80٪ التقاء الخلية (تقريبا، 2x-3x في الأسبوع).
ملاحظة: ثقافة فرعية A549 لأربعة مقاطع على الأقل قبل تكوين نموذج الثقافة المشتركة، باستخدام خلايا A549 في نطاق مرور 5-25. - Pipette 1.5 مل من CCM قبل الدفء إلى 12 لوحة بئر (عدد الآبار يتوافق مع العدد المطلوب من النماذج).
- مكان فردي 12 ثقافة خلية جيدا إدراج في آبار من لوحة 12 جيدا باستخدام ملاقط معقمة.
- فصل الخلايا من قارورة وفقا لبروتوكول subcultivation (أي، باستخدام عامل فصل، إزالة العامل عن طريق الطرد المركزي كما فعلت في الخطوة 1.2.13). Resuspend في حجم مناسب من CCM المقابلة لتركيز الخلية النهائي من A549 (هنا، 50 × 104 الخلايا / مل؛ 0.5 مل من تعليق الخلية لكل إدراج، أي 25 × 104 خلايا / إدراج، والذي يتوافق مع كثافة البذر من 27.8 × 104 خلايا / سم2).
- Pipette 0.5 مل من تعليق الخلية (أي 25 × 104 خلايا / إدراج) في الجانب apical من إدراج باستخدام ماصة 1 مل.
- تغطية لوحات مع الأغطية ووضعها في حاضنة ثقافة الخلية (37 درجة مئوية، 5 ٪ CO2) لمدة 4 أيام.
ملاحظة: تحقق بانتظام من التقاء الخلايا A549 تحت المجهر على النقيض من المرحلة.
- زراعة الخلايا الظهارية وفقا لتوصيات المقدمة من المورد (ATTC). باختصار، والخلايا في ccm في 80٪ التقاء الخلية (تقريبا، 2x-3x في الأسبوع).
- MDDC البذر
- 4- التعرق في CCM مع خلايا غير مُرَزَّة في 6 صحون بئر تحتوي على MDDCs.
- إضافة 1 مل من CCM مسبق ة الطازجة إلى كل بئر.
- استخدام مكشطة الخلية، وفصل (كشط) MDDCs المتمسك من كل بئر، وغسل بلطف الآبار مع 1 مل القائمة من CCM 3x، والجمع بينها في أنبوب واحد مخروطي الطرد المركزي.
- عد الخلايا مع عداد الخلية باستخدام طريقة استبعاد trypan الأزرق باستخدام 10 ميكرولتر من تعليق الخلية و 10 ميكرولتر من حل تريبان الأزرق.
- الطرد المركزي تعليق الخلية كما فعلت في الخطوة 1.2.13.
- حساب حجم CCM المطلوبة لإعادة التوسين (المعادلة 5):
كثافة MDDC المطلوبة = 42 × 104 خلايا /مل؛ كل إدراج يتطلب 6.3 × 104 الخلايا، والذي يتوافق مع كثافة الخلايا المصنفة من 7 × 104 خلية / سم2 (هنا، 150 μL إضافة إلى 0.9 سم2 في الخطوة 2.2.10.).
وحدة تخزين CCM لإعادة تشغيل الخلية (Vm; المعادلة 5):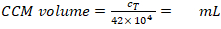
- التعرق بلطف وتجاهل CCM من الغرفة العليا من 12 لوحات جيدا مع تزايد A549 على إدراج.
- ضع ال inserts مع خلايا A549 في وضع رأسا على عقب في طبق بيتري معقمة باستخدام ملاقط معقمة. إعداد أنبوب الطرد المركزي المخروطي (50 مل) مع برنامج تلفزيوني وبرطيبة قبل مكشطة الخلية.
- كشط من الخلايا A549 من السطح القاعدي من إدراج (أي، الجزء العلوي في موقف رأسا على عقب)، والتي ينبغي أن تنمو من خلال مسام إدراج.
ملاحظة: شطف مكشطة مع برنامج تلفزيوني (أعدت في أنبوب) بين كشط العينات الفردية والاحتفاظ بها الرطب طوال العملية. - عند الطرد المركزي (الخطوة 2.2.5) ، pirate وتجاهل السوبر ، ثم إعادة حساب بيليه MDDC في المبلغ المحسوب من CCM (الخطوة 2.2.6) والماصات صعودا وهبوطا 3x.
- الماصات 150 μL من تعليق الخلية على رأس كل إدراج بحيث يتم تغطية كامل سطح القاعدية من إدراج على قدم المساواة مع السائل وليس تحتوي على فقاعات.
- غطي الطبق بغطاء وضع في حاضنة لثقافة الخلية لمدة 70 دقيقة. استلهمي CCM من لوحات زراعة الخلية (حيث تم وضع الإدراجات في البداية) ، والتخلص منه في نفايات سائلة محتلة بيولوجيًا ، والماصات 1.5 مل من CCM الطازجة في كل بئر. تغطية لوحة مع غطاء ومكان في حاضنة الخلية (37 درجة مئوية، 5٪ CO2).
ملاحظة: لا تتجاوز الفترة الزمنية المذكورة أعلاه لتجنب تجفيف الخلايا. - بعد الحضانة، عقد بعناية كل إدراج مع ملاقط معقمة ووضعها على لوحات تحتوي على CCM في وضع عادي. غطي اللوحة بغطاء وارجعها إلى حاضنة الخلية (37 درجة مئوية، 5% CO2).
- بذرات الضامة (MDM)
- خذ 6 لوحات جيدا تحتوي على MDMs متمايزة مسبقا. ضعها من حاضنة الخلية إلى غطاء تدفق المفارق.
- التعرق والتخلص من CCM مع MDMs غير مرتبط نمت في 6 لوحات جيدا، والماصات 1 مل من CCM الطازجة مسبقا في كل بئر.
- باستخدام مكشطة الخلية، قم بإزالة MDM المُنتَقِدة بلطف من الآبار الفردية (كما هو الحال في الخطوة 2.2.3 لـ MDDCs).
- Pipette 10 ميكرولتر من الأزرق trypan في بئر أو أنبوب وإضافة 10 ميكرولتر من تعليق MDM لتحقيق التخفيف النهائي من 1:1 (الخامس / الخامس). حساب عدد MDMs باستخدام بروتوكول الجرد المناسب.
- الطرد المركزي تعليق الخلية كما فعلت في الخطوة 1.2.13.
- حساب حجم المطلوبة (المعادلة 6):
كثافة MDM المطلوبة = 2.5 × 104 خلايا / مل في CCM (هنا، كل إدراج يتطلب 1.25 × 104 خلايا في 0.5 مل CCM، الذي يتوافق مع كثافة الخلايا المصنفة من 1.4 × 104 خلية / سم2).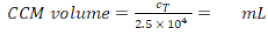 (6)
(6) - عند الطرد المركزي، التعرق وتجاهل السوبر، redisperse بيليه MDM في المبلغ المحسوب من CCM (الخطوة 2.3.6)، والماصة صعودا وهبوطا 3x.
- بعناية ماصة 0.5 مل من تعليق MDM (أعدت في الخطوة 2.3.7) على الجدار من الخلية ثقافة إدراج مع A549 و MDDCs (وليس مباشرة على الخلايا الظهارية) باستخدام ماص 1 مل. لوحات تغطية مع الأغطية ومكان في حاضنة ثقافة الخلية (37 درجة مئوية، 5 ٪ CO2)لمدة 24 ساعة.
- نقل نموذج الزراعة المشتركة إلى واجهة الهواء السائل (ALI)
- عند نهاية 24 ساعة (± 2 ساعة) فترة حضانة النموذج المجمعة في حاضنة ثقافة الخلية، الطامح والتخلص من CCM من كل من الأجزاء apical والقاعدية من إدراج ثقافة الخلية ومن الآبار.
- باستخدام ملاقط معقمة، رفع إدراج الفردية من الآبار والماصات 0.6 مل من CCM الطازجة قبل الدفء إلى كل بئر باستخدام ماصة 1 مل. لا تقم بإضافة CCM إلى الجانب apical من إدراج.
- لوحات تغطية مع الأغطية ومكان في حاضنة ثقافة الخلية (37 درجة مئوية، 5 ٪ CO2) لمدة 24 ساعة الاستخدام الإضافي.
3- التعرض لضوابط إيجابية مختارة (محفزات معروفة لحفز الاستجابة البرونفلية)
ملاحظة: يتم استخدام التعرض لنماذج الاستزراع المشترك إلى حافز مضاد للاندوسومين الدهني (LPS) 7 و7 و 7 proinflammatory cytokine ورم نخر عامل α (TNF-α)7 لتوضيح استجابة النموذج. وعلاوة على ذلك، يتم استخدام التعرض للمنظفات (تريتون X-100) لتأكيد حساسية المقايسة لاكتات ديهيدروجيناز (LDH).
- إعداد حلول التحكم الإيجابية: مخزون LPS (1 ملغم/مل في الماء المقطر)، مخزون TNF-α (100 ميكروغرام/مل في الماء المقطر) وتريتون-X 100 (2% [v/v] في PBS).
- بناء على حضانة 24 ح من نموذج الزراعة في ظروف ALI، الطامح وتجاهل السوبر من المقصورة القاعدية. باستخدام ملاقط معقمة، ورفع إدراج الفردية من الآبار والماصات 0.6 مل من CCM الطازجة مسبقا في كل بئر.
- إعداد حلول عمل للضوابط الإيجابية الفردية عن طريق تخفيف المخزونات في CCM في أنابيب الطرد المركزي المخروطية على النحو التالي: 1 ميكروغرام/مل LPS، و1 ميكروغرام/مل TNF-α، و0.2٪ Triton-X 100. وحدات التخزين تتوافق مع عدد من إدراج اختبار (هنا، 100 μL / إدراج). مزيج الحلول جيدا عن طريق الأنابيب صعودا وهبوطا 3x.
- تطبيق 100 μL من كل حل تحكم إيجابي عن طريق الأنابيب ببطء على جدار من إدراج ثقافة الخلية. تغطية لوحة البئر مع غطاء ومكان في حاضنة ثقافة الخلية (37 درجة مئوية، 5٪ CO2)لمدة 24 ساعة. عند الحضانة، التعرق والتخلص من السائل في الجانب apical من إدراج عن طريق عقد إدراج الفردية باستخدام ملاقط.
- جمع CCM في مقصورات القاعدية وتخزينها في 1) 4 درجة مئوية لمزيد من التحليل LDH، مما يدل على تمزق غشاء الخلية السامة للخلايا بوساطة، و / أو 2) تخزين في -80 درجة مئوية لمزيد من التحليل لإطلاق البروتين عن طريق تحليل المناعة المرتبطة الانزيم (ELISA). تشغيل المقايسات وفقا لتوصيات المورد مجموعة.
- عند إزالة CCM، وغسل إدراج مع برنامج تلفزيوني 3x وإصلاح الخلايا على إدراج ثقافة الخلية في 4٪ [ث / الخامس] paraformaldehyde (في برنامج تلفزيوني، 15 دقيقة في درجة حرارة الغرفة) عن طريق ضمان كلا الجانبين إدراج مغطاة جيدا مع محلول PFA. غسل 3X في وقت لاحق مع برنامج تلفزيوني لإزالة PFA. تخزين العينات المغمورة في برنامج تلفزيوني في 4 درجة مئوية لمزيد من المناعة (مثال على هذه الطريقة وقد وصفت سابقا17).
النتائج
تم تجميع نماذج تربية الرئة البشرية، التي تتكون من الخلايا الظهارية السنخية والخلايا المناعية، إما من MDDCs الطازجة أو المجمدة وMDMs السلف (هنا، أحاديات مشتقة من الدم المحيطي البشري). كما هو معروض في الشكل 1، تم زرع الخلايا A549 بعد 3 أيام من القسم الأول الذي ينطوي على عزل أحادية / ذوبان. وبعد ستة أيام من التمايز، ظهرت هذه الآليات المتمايزة على شكل دائري، في حين شكلت البلدان متعددة الأطراف شكلاً أكثر إمتدها مع نتوءات يمكن ملاحظتها. كما ظهرت كـ أجُلمرتات، خاصة عندما تُميز عن الوحديات الطازجة(الشكل 2، الشكل 3). شكلت الخلايا الظهارية طبقة الخلايا الكثيفة من الخلايا بعد 3 أيام من النمو على إدراج الغشاء (الشكل 4)، عندما تم تجميع الثقافات. بعد 24 ساعة من تجميع و 24 ساعة إضافية من التعرض لشروط ALI، تم إعداد الثقافات المشتركة للتعرض.
تم التحقيق في الاستجابة لنماذج ثقافة الخلايا ثلاثية الأبعاد عند التعرض للمحفزات البروفلورية المعروفة باستخدام نهج pseudo-ALI ، كما هو موضح سابقًا29. تمت إضافة المحفزات البروينفلاmmatory، LPS و TNF-α، بكميات منخفضة (100 ميكرولتر) على السطح السطحي لنموذج الخلية المكشوفة للهواء. في موازاة ذلك، تم تقييم عدم وجود تمزق الغشاء كمقياس للسمية الخلوية عن طريق فحص LDH. وقد لوحظت زيادة كبيرة في إطلاق LDH في CCM من المقصورة القاعدية عند التعرض للرقابة الإيجابية لتمزق الغشاء، وهو منظف Triton-X 100(الشكل 5). أثبتت هذه النتائج استجابة النموذج لمادة سمية للخلايا، في حين لم تلاحظ أي زيادة في إطلاق LDH على التحفيز apical مع TNF-α أو LPS.
ويمكن أن يعزى سبب محتمل للقيم المختلفة المقاسة للـ LDH في العينات المجمعة إما بـ PBMs الطازجة أو المجمدة سابقًا إلى تخزين العينات. تم تخزين عينات من PBMs الطازجة لفترة أطول في -80 درجة مئوية؛ لذلك، قد ينخفض نشاط إنزيم LDH. وتجدر الإشارة إلى أن رابطة LDH مستقرة لمدة تصل إلى 4 أيام فقط في CCM؛ وهكذا، فمن المستحسن لأداء المقايسة آخر 2 أيام بعد جمع سراويل. بدلا من ذلك، فمن الممكن لتجميد أسفل supernatants مباشرة بعد جمع. ومع ذلك، من المهم أن تنظر إلى أن تجميد يمكن أن تقلل من النشاط الأنزيمي للLDH.
تم تحديد كمية إفراز وسطاء proinflammatory (هنا، TNF-α وinterleukins 6 [IL-6] و 8 [IL-8]) في CCM القاعدية عن طريق ELISA. ولوحظت الزيادات ذات الأهمية الإحصائية (p < 0.05, ANOVA) في اتجاه واحد) في الانبعاثات من IL-6 و IL-8 في كل من العينات المعالجة LPS-و TNF-α مقارنة بالخلايا غير المعالجة، وكذلك في نماذج ثقافة الخلية التي تم تجميعها من مصدر PBMs(الشكل 6). على الرغم من تركيزات (pg/mL) من جميع السيتوكينات المختبرة في CCM القاعدية كانت أعلى في الثقافات المشتركة المكونة من PBMs الطازجة ، فإن الاختلافات بين الثقافات المشتركة وزراعة أحادية لم تكن ذات أهمية إحصائية (p > 0.05) (الشكل 6). لتأكيد القيمة المضافة لنماذج الزراعة التكانية فيما يتعلق بثقافة الخلايا الظهارية 2D، تم أيضاً تعرض الثقافات أحادية A549 إلى LPS أو TNF-α. وكما هو متوقع، كان الإفراج عن جميع الوسطاء الذين تم التحقيق معهم من الثقافات الأحادية A549 أقل مقارنة بكلا النموذجين اللذين اُجرىهما في مجال الزراعة المشتركة؛ على الرغم من أن الفرق بينهما لم يكن مهمًا إحصائيًا (p > 0.05، ANOVA في اتجاه واحد).
تم تقييم التشكل الخلوي لحواجز الأنسجة الظهارية السنخية البشرية ثلاثية الأبعاد عبر المجهر المسح الضوئي بالليزر (LSM) . لتصور تكوين كل نموذج، كانت الضامة داخل نماذج الثقافة المشتركة (MDMs) ملطخة بعلامة الضامة الناضجة 25F9. كانت ملوّناة MDDCs مع CD83، وهو علامة هامة لالخلايا التشعبية المنشط30. وفيما يتعلق بالمرفرف الخلوي، لم يلاحظ أي اختلاف بين نماذج الزراعة التكتهية التي تستخدم هذه المقاييس والبلدان ذات ال MDDCs من مركبات PBMs الطازجة مقارنة بالنماذج التي تستخدم PBMs المذابة. في LPS- و TNF-α-exposed الثقافات، وكلاهما يتكون من الخلايا المناعية الطازجة والمجمدة، لوحظ وجود طبقة ظهارية معطلة في صور LSM، وهو ما لم يكن الحال في الخلايا غير المعالجة(الشكل 7، الشكل 8).
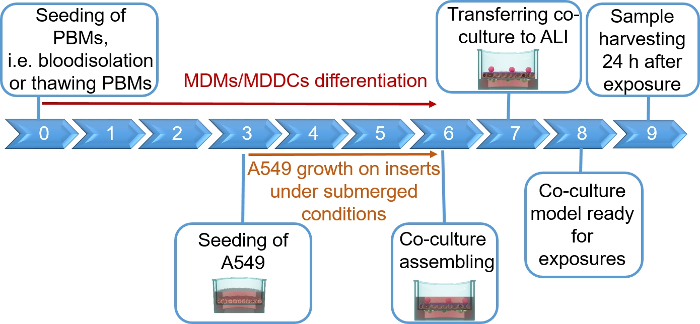
الشكل 1: المخطط الزمني المخطط للبروتوكول. عرض نموذج تربية 3D، والتجمع، والتطبيق (التعرض لمادة اختبار). ALI = واجهة الهواء السائل، MDDCs = الخلايا المتجانسة المشتقة من أحادية الخلايا، MDMs = الضامة المشتقة من أحادية الولي، PBMs = أحاديات الدم المحيطية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
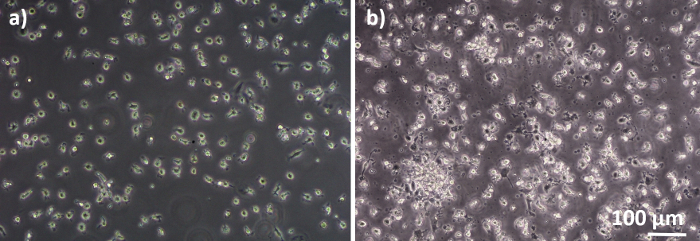
الشكل 2: برامج MDM وMDDCs التي تم تمييزها عن برامج إدارة الميزات الناشئة. صورة المجهر على النقيض من الطور من متباينة (A) MDMs و (B) MDDCs من PBMs جديدة (6 أيام بعد عزل الخلية). تكون هذه الأجهزة مستديرة الشكل، بينما كثيراً ما تُلاحظ البلدان MDDCs كتكتلات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
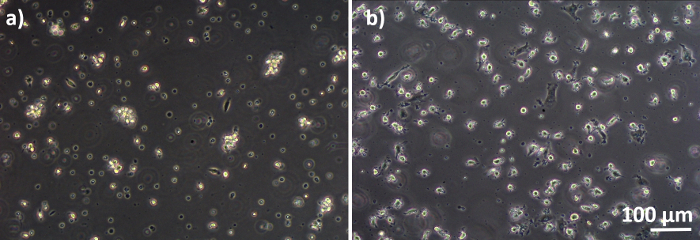
الشكل 3: نظم إدارة الانبعاثات وال MDDCs التي تم تمييزها عن برامج إدارة الانبعاثات المجمدة. صورة المجهر على النقيض من الطور من متباينة (A) MDMs و (B) MDDCs من PBMs المذاب (6 أيام بعد ذوبان). تكون هذه الخلايا مستديرة الشكل، ولكن يمكن ملاحظة بعض الخلايا الممدودة. كما تظهر MDDCs مستديرة الشكل مع نتوءات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: نمو الخلايا الظهارية على إدراج الأغشية. صورة المجهر على النقيض من المرحلة من التقاء A549 المتزايد على إدراج غشاء 4 أيام بعد البذر، وتشكيل طبقة كثيفة من الخلايا. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
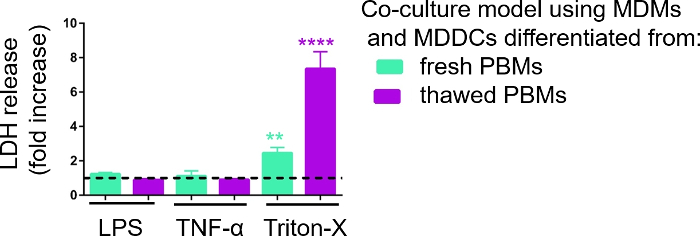
الشكل 5: نتائج السمية الخلوية التي تم التحقيق فيها عن طريق الغشاء القائم على تمزق (LDH) مقايسة. يتم تقديم البيانات على أنها زيادة أضعاف على الخلايا غير المعالجة (متوسط ± SD، ن = 3، تشير النجمة إلى زيادة ذات دلالة إحصائية مقارنة بالخلايا غير المعالجة، **p < 0.01، ****p < 0.0001). في النماذج الخضراء يتم تمثيل MDMs و MDDCs من PBMs جديدة، وفي نماذج الأرجواني تجميعها من PBMs المذابة يتم تمثيل. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
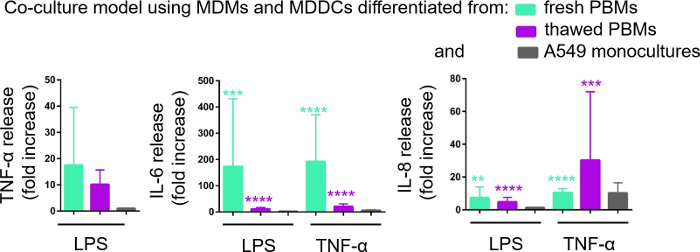
الشكل 6: ردود الفعل الProinflammatory في الثقافات وزراعة أحادية. الوسطاء proinflammatory (TNF-α, IL-6, و IL-8) الإفراج في الثقافات المشتركة على 24 ح التحدي مع LPS أو TNF-α. يتم عرض البيانات على أنها نسبة إلى الخلايا غير المعالجة (متوسط ± SD، ن = 3، ** p < 0.01، ***p < 0.001، ****p < 0.0001). في النماذج الخضراء يتم تمثيل MDMs و MDDCs من PBMs جديدة، وفي نماذج الأرجواني تجميعها من PBMs المذابة يتم تمثيل. الرمادي يمثل A549 الثقافات الأحادية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
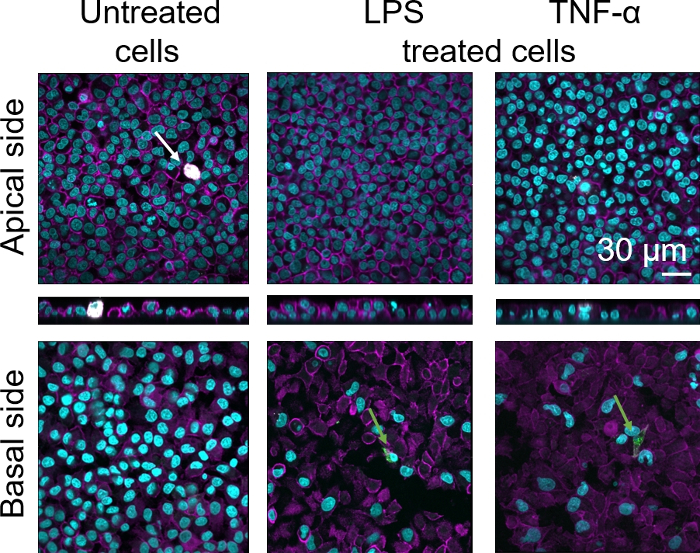
الشكل 7: مورفولوجيا الثقافات المكونة من خلايا مناعية جديدة. LSM صور من الجوانب apical والضموية من نموذج تربية الأحياء مع إسقاطات XZ من الجوانب apical من النموذج باستخدام MDMs و MDDCs من PBMs الطازجة. السماوي يمثل النوى (DAPI), يمثل الأرجواني cytoskeleton (رودامين-phalloidin), الأبيض يمثل MDM (25F9), والأخضر يمثل MDDCs (CD 83). يشير السهم الأبيض إلى MDM، بينما يشير السهم الأخضر إلى MDDC. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
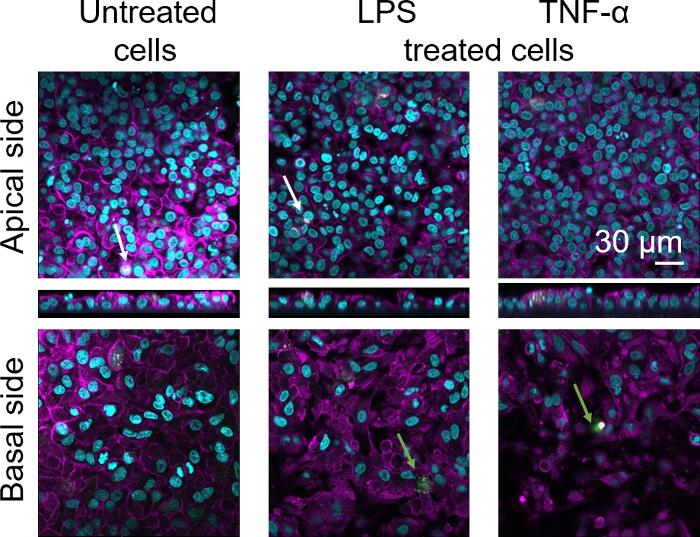
الشكل 8: مورفولوجيا الثقافات المكونة من الخلايا المناعية المجمدة. LSM الصور من الجانب apical من نموذج الزراعة المشتركة مع الإسقاطات XZ المقابلة، والجانب القاعدي للنموذج باستخدام MDMs و MDDCs من PBMs المذابة. السماوي يمثل نوات (DAPI)، يمثل اللون الأرجواني cytoskeleton (رودامين-phalloidin)، يمثل الأبيض MDMs (25F9)، والأخضر يمثل MDDCs (CD 83). يشير السهم الأبيض إلى MDM، بينما يشير السهم الأخضر إلى MDDC. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
10- إن إنتاج المواد الجديدة، بما في ذلك المواد الكيميائية والعقاقير، يزيد تدريجياً من الحاجة إلى نماذج تنبؤية في المختبر. الامتثال للمبادئ الثلاثة للاحلال، والحد، وصقل اختبار الحيوانات32، في المختبر نماذج الخلايا أصبحت أدوات قوية فيما يتعلق بجانب الاستبدال والحد من آليات توضيح المخدرات أو المادة العمل8،9،10،11. هنا هو بروتوكول مفصل لتجميع نموذج متعدد الخلايا باستخدام الخلايا المناعية التي هي إما معزولة حديثا أو إذابة من monocytes المجمدة سابقا. كما وصف زراعة النموذج في ALI. وأخيراً، يوضح البروتوكول مثالاً على التعرض للمحفزات البهوية ويقارن استجابة النموذجين اللذين يحتويان إما على وحدات أحادية جديدة أو مجمدة.
وقد أجريت دراسات مختلفة لتأكيد وتبرير القيمة المضافة للتعقيدات المعززة للنماذج التي نمت وتتعرض في ظل ظروف ALI مقارنة بالتعرض المغمور التقليدي7,22,31. مراقبة استجابة بروتينفلاmmatory أعلى في الثقافات المشتركة بالمقارنة مع الثقافات الأحادية للخلايا الظهارية تؤكد دراسة سابقة. واستخدمت الدراسة نموذج استزراع التكتهين (حفز مع LPS) وأظهرت استجابة أعلى عند مستويات التعبير الجيني لـ TNF و IL1B مقارنة بنموذج مكافئ A549 أحادي الثقافة7. من ناحية أخرى، أظهر كلا النموذجين اختلافات أعلى داخل قيم إطلاق الوسيط البروفلورية المقاسة مقارنة بزراعة A549 الأحادية. ويمكن تفسير ذلك باستخدام الخلايا المناعية من المتبرعين المختلفين (المعاطف البافية) ضمن التكرار البيولوجي (أي التكرار، متبرع واحد)، كما هو مبينسابقاً 7. إذا رغبت في ذلك، يمكن التغلب على الاختلافات بين التكرارات من قبل 1) باستخدام PBMs المذاب من نفس المانح أو 2) تجميع PBMs من مختلف المانحين قبل تجميد الخلايا، ثم استخدام لاحق لنفس التجمع في كل تكرار. كما يوصى أيضاً بإدراج المزيد من التكرارات البيولوجية.
يمكن اعتبار تقنية تجميد الخلايا كخطوة حاسمة; ومع ذلك، فمن إجراء مختبري مشترك للحفاظ على الخلايا لتحليل ظاهري وظيفية. وقد أظهرت الدراسات المختلفة أن نوعية PBMs المجمدة أمر حيوي لبقائهم، وتقنية التجميد المناسبة هي المفتاح لنجاح عمليات الفحص اللاحقة مع نفس الخلايا28,32. ويمكن إجراء تعديل للبروتوكول عن طريق تجميد PBMs، مما يوفر المرونة في الإعداد التجريبي، حيث أن توافر المعاطف البافي عادة ما يكون محدودا. ميزة أخرى لاستخدام PBMs المجمدة (في عدة قوارير) على تلك المعزولة حديثا هو أنها يمكن استخدامها في التجارب اللاحقة حتى بعد 1 سنة. ويقلل هذا الأمر من المسألة المحتملة للتباين بين المانحين والمانحين إذا كان هذا المعلمة مرغوباً أو مطلوباً في تجربة.
تظهر نتائج مقارنة بين الاحتياد التي أجريت بعد ما يصل إلى 13 شهراً أن PBMs، عندما تخزن بشكل صحيح في خزان النيتروجين السائل، يمكن استخدامها على مدى فترة طويلة دون أي تأثير على جدوى الخلية أو استعادة الخلايا33. قد تكون أوقات التخزين الأطول (أكثر من سنة) ممكنة عند التحقق من صحة الخلية وسرعة الاستجابة لها قبل إجراء تجربة. أيضا، يجب أن تظل درجة الحرارة في خزان النيتروجين السائل مستقرة في جميع الأوقات. ووجد أن العامل الرئيسي الذي يؤثر على صلاحية نظام PBMs المبردة هو تركيز نظام إدارة الاستدامة المالي، مع التركيز الأمثل من 10% إلى 20% (v/v)28. للتقليل من الآثار الضارة المحتملة للتجميد، مصادر مختلفة من البروتينات، FBS أو BSA (مع مجموعة واسعة من التركيز من 40٪ تصل إلى 100٪34)غالبا ما تضاف إلى وسيطة تجميد كمكونات وقائية طبيعية يمكن أن تزيد من بقاء الخلايا.
نظراً لإمكانية السمية الخلوية العالية لـ DMSO، فمن المستحسن أولاً تشتيت PBMs في FBS، ثم إضافة DMSO إلى PBMs المنتشرة بالفعل في FBS. وتجدر الإشارة إلى أنه على الرغم من وجود تركيزات عالية من FBS (> 40%) لم تظهر أي تحسن في جدوى الخلية، في الوقت نفسه، فإنها لم تسبب ضررا للخلايا28. ومع ذلك، تجميد monocytes هو نهج ممكن للتغلب على قضايا توافر معطف بافي محدودة. ومع ذلك، إذا كان استخدام MDDCs وMM من PBMs الطازجة هو المطلوب، يمكن أن تكون متباينة الخلايا المناعية واستخدامها 5-8 أيام بعد العزل7،16،17،35،36،37. وإذا سمح التخطيط التجريبي، يوصى بتمايز 6 أيام على الأقل في كل من البلدان المتعددة الأطراف للبلدان النامية الجزرية المتعددة الأطراف وMDMs. ومع ذلك، فإن الاتساق بين التكرارات المختلفة في نفس التجربة، إلى جانب عمليات التفتيش الروتينية لتعابير علامات سطحها المحددة، أمر بالغ الأهمية. وينبغي أيضا أن يتم التحقق بانتظام من الاستجابة للحافز البروينفلوري، مثل LPS، بعد وقت التمايز.
وقد أجريت العديد من التحقيقات باستخدام خط الخلية A549 في ALI، إما باعتبارها أحادية أو جنبا إلى جنب مع أنواع الخلايا الأخرى (الضامة، الخلايا التشعبية، أو الخلايا الليفية) في نموذج 3D تربية الأحياء22،24،29،38. باستخدام هذا النموذج 3D coculture، السمية الخلوية، والأكسدة، أو آثار proinflammatory من (نانو-) وقد تم التحقيق في المواد لمدة تصل إلى 72 ح1،,17،,21،,24،,29. وقد سبق التحقيق في التشابه في نموذج في الأنسجة الجسمية استنادا إلى التصوير الضوئي بالليزر confocal من نموذج16. عند تجميع النموذج، من المهم النظر في كل من انتشار الخلايا (التي يمكن أن تؤثر على A549 في النموذج المعروض هنا) وكذلك أداء الخلايا المناعية الأولية (لا تتكاثر) (هنا، MDDCs وMDMs). ومن المهم أيضاً أن تؤخذ في الاعتبار أن الخلايا غير جميع الوحديات الموجبة CD14 تفرق إلى مراكز متعددة الأطراف للأدوية وMDMs، وأن الخلايا يمكن أن تكون موجودة في كل من النماذج المرفقة والموقفة. استناداً إلى طبيعة الجمعية لزراعة نقّال (هنا، كلا النوعين من الخلايا بحاجة إلى إرفاق الطبقة الظهارية الموجودة)، فمن المستحسن استخدام فقط أتباع السكان الفرعية من كلا النوعين من الخلايا المناعية. بالإضافة إلى ذلك، فإن التحليلات الروتينية للوحدات الأحادية و MDDC و MDM استجابة أحادية الثقافة LPS، والتعبير عن علامات سطحية محددة (CD14، CD163، CD86، CD93، أو CD206، البيانات غير مبينة) قد اقترحت أن 6 و 7 أيام من التمييز هي النقاط الزمنية المثلى.
على الرغم من أن عددا واقعيا من الخلايا الظهارية القُزُلية في الرئتين البشرية يتوافق مع ~ 160،000 الخلايا / سم2، وعدد الخلايا A549 عد في النموذج هو ~ 1،000،000 الخلايا / سم2 بعد 9 أيام مثقف على إدراج16،18. وبالتالي، يجب النظر في هذا القيد في النموذج في المختبر. أولاً، تم تأسيس كثافة الخلايا الظهارية بناء على قدرتها على تشكيل طبقة التقاء على الغشاء المتنامي. ومن المهم أيضا أن نذكر أن A549 يمثل خلية من النوع الظهاري الثاني مع شكل الظهارية، على عكس الخلايا الظهارية الأولى، والتي هي مسطحة و outspread. من ناحية أخرى ، تم تأسيس العدد المطلوب من الخلايا المناعية على أساس الأدب وعرضها في هذا البروتوكول كرقم الخلية / مساحة السطح39،40،41. كثافة الخلية من MDDCs في نطاق 400 الخلايا / ملم2 (4 خلايا / سم2)16 هو مماثل للثابتة حالة كثافة الخلايا من 500-750 خلايا / مم2 (5- 7 الخلايا / سم2)ذكرت من في دراسات vivo39. كثافة MDMs في هذا النموذج ضمن نفس النطاق من في حالة في الجسم الحي في المنطقة السنخية البشرية40.
لوحظ تلطيخ علامة الضامة الناضجة (25F9) في الجانب الزفيري (حيث توجد MDMs) وكذلك الجانب القاعدي (أي، في موقع الخلايا المتججرة). نقل الخلايا المناعية من خلال الغشاء إدراج المسام من الممكن ، وقد لوحظ أيضا باستخدام هذا النموذج16، والتي قد تفسر الاختلافات الملاحظة في كثافة تلطيخ. ومع ذلك، تفسير آخر ممكن هو أن علامة الضامة الناضجة يمكن أيضا أن أعرب عن خلايا التشعب، ولكن التعبير هو المانحة للغاية42محددة . أيضا، فإن كثافة التعبير 25F9 أعلى بكثير في MDMs (الشكل 7، الشكل 8). كل من المحفزات proinflammatory (LPS و TNF-α) أثرت على سلامة حاجز الظهارية الرئوية في كل من الثقافات(الشكل 7، الشكل 8). وكان هذا متوقعا على أساس المنشورات السابقة43،44 تبين أن السيتوكينات proinflammatory والمنتجات البكتيرية تعطيل سلامة الحواجز الظهارية.
نموذج متعدد الخلايا 3D من ظهارة السنخية البشرية، التي أنشئت وتتميز سابقا17،وقد خدم كأداة قوية ومفيدة لتقييم الاستجابات البيولوجية (أي، ردود الفعل proinflammatory الحاد، استجابة الإجهاد التأسدي، وتوزيع الجسيمات، والاتصالات الخلوية) في المختبر21،24،25،45. وتؤكد النتائج على إعادة النقية من نماذج تربية الأحياء إلى المحفزات proinflammatory (هنا، LPS و TNF-α). وزادت الاستجابة قليلا عند استخدام الخلايا المناعية من PBMs جديدة; ومع ذلك، لم يكن هناك فرق إحصائياً هاماً بين الثقافات المشتركة باستخدام PBMs العذبة مقابل المذابة. وعلاوة على ذلك، كانت ردود الفعل البروينفلورية لكلا النموذجين لزراعة تربية الظهارة أعلى من تلك التي كانت من الظهارية أحادية الخلية المزروعة في ظل نفس الظروف (ALI). وباختصار، يصف البروتوكول تجميع نموذج تربية ظهارية بشرية ثلاثية الأبعاد ثلاثية الأبعاد باستخدام برامج عمل ثنائية عذبة أو مذابة للتمايز في MDMs و MDDCs. وتبين أن كلا النموذجين يستجيبان بدرجة عالية للمحفزات البهائية. ولذلك، يمكن أن تكون بمثابة أدوات قوية لتقييمات المخاطر المحتملة والسمية.
Disclosures
ليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
ويود المؤلفون أن يشكروا الدكتور ميغيل سبوش - كالفار على مخطط تربية الأحياء في الشكل 3 وللدكتورة بيديا بيغوم كاراكوكاك على القراءة النقدية. وقد دعم هذه الدراسة مشروع الدوريات، وبرنامج الاتحاد الأوروبي للبحوث والابتكار في أفق 2020 بموجب اتفاقية المنحة رقم 760813، ومؤسسة أدولف ميركل. B.D. يشكر بيتر أوند ترادل إنغلهورن مؤسسة للدعم المالي.
Materials
| Name | Company | Catalog Number | Comments |
| Benchmark microplate reader | does not have to be specific, for example BioRad, Cressier, Switzerland | ||
| Cell culture Incubator | does not have to be specific | ||
| Cell freezing container (for example Mr. Frosty) | does not have to be specific | ||
| Centrifuge | does not have to be specific | ||
| Confocal laser scanning microscope | does not have to be specific, for example | Zeiss LSM 710 meta | |
| Heamatocytometer, or automatic cell counter | does not have to be specific | ||
| Laminar bio-safety hood class II | does not have to be specific | ||
| MultiStand Macs (Macs Cell Separator) | Miltenyi, Germany | 130-042-303 | |
| pH meter | does not have to be specific | ||
| Phase contrast inverted light microscope | does not have to be specific | ||
| Pipette boy, pipettors (different volumes) | do not have to be specific | ||
| Scissors | do not have to be specific | ||
| Vacuum pump | does not have to be specific | ||
| Water bath | does not have to be specific | ||
| Disposable small equipment/glassware | Catalogue Number | ||
| 15 mL and 50 mL conical centrifuge tubes | does not have to be specific | ||
| 6- and 12-well cell culture plates, flat bottom, low evaporation lid, sterile | Falcon, Switzerland | 353046 and 353043 | |
| Cell culture inserts, transparent PET membrane, 12-well, 3 μm pore size | Falcon, Switzerland | 353181 | |
| Cell scrapper | does not have to be specific, for example VWR, Switzerland | 353085 | |
| Cryovials | do not have to be specific | ||
| Glass autoclaved Petri Dishes | do not have to be specific | ||
| LS Columns | Miltenyi, Germany | 130-042-401 | |
| Sterile filtration cup for vacuum filtration, 0.2 μm pore size | does not have to be specific, for example VWR, Switzerland | 10040-446 | |
| Sterile Lab Bottle compatible with Filtration cup (min. 100 mL) | does not have to be specific | ||
| Sterile pipettes | do not have to be specific | ||
| Chemicals | |||
| Bovine serum albumine (BSA) | Sigma-Aldrich, Switzerland | A7030-100g | |
| CD14+ MicroBeads human - magnetic beads | Miltenyi, Germany | 130-097-052 | |
| Deattachnig agent Trypsin-EDTA, 0.05%, phenol red | Gibco, Switzerland | 25300054 | |
| Density gradient medium Lymphoprep | Alere Technologies AS, Norway | 1114547 | |
| Dimethyl Sulfoxide (DMSO) | Sigma Aldrich, Switzerland | D2438 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich, Switzerland | E6758-100g | |
| Fetal bovine serum (heat inactivated) | Gibco, Switzerland | 10270-106 | |
| Human granulocyte-macrophage colony-stimulating factor (GM-CSF), premium grade | Miltenyi, Germany | 130-093-864 | |
| Human Interleukin 4 (IL-4), premium grade | Miltenyi, Germany | 130-095-373 | |
| Human macrophage colony-stimulating factor (M-CSF), premium grade | Miltenyi, Germany | 130-096-485 | |
| L-glutamine | Gibco, Switzerland | 25030-024 | |
| Lipopolysaccharid (LPS) from Escherichia coli | Sigma-Aldrich, Switzerland | 4524-5mg | |
| Paraformaldehyde (PFA) | Sigma-Aldrich, Switzerland | 158127 | |
| Penicilin-Streptomycin | Gibco, Switzerland | 15140-122 | |
| Phosphate Buffer Saline (PBS) | Gibco, Switzerland | 10010-015 | |
| Roswell Park Memorial Institute-1640 Medium (RPMI) | Gibco, Switzerland | 42401-018 | |
| Triton X-100 | Sigma-Aldrich, Switzerland | T8787 | |
| Trypan blue solution (0.4%) | Sigma Aldrich, Switzerland | ||
| Tumor necrosis factor alpha (TNF-α) | Immunotools | 11343015 | |
| Assays used for cytotoxicity, (pro-)inflammatory response | |||
| Cytotoxicity Detection Kit (LDH) | Roche, Switzerland | 11644793001 | |
| Human IL-6 DuoSet ELISA | R&D, Biotechne, Switzerland | DY206 | |
| Human IL-8/CXCL8 DuoSet ELISA | R&D, Biotechne, Switzerland | DY208 | |
| Immunostaining | |||
| 4′,6-diamidino-2-phenylindole (DAPI), concentration 2 μg/mL | Sigma-Aldrich, Switzerland | 10236276001 | |
| Goat anti-mouse IgG (H+L) Alexa Fluor 647 conjugated, concentration 20 μg/mL | Abcam, UK | ab150115 | |
| Goat anti-rabbit IgG antibody (H+L) Dylight 488 conjugated, concentration 10 μg/mL | Agrisera, Sweden | AS09 633 | |
| Mature Macrophage Marker Monoclonal Antibody, concentration 50 μg/mL | eBioScience, Thermo Fischer, Switzerland | 14-0115-82 | |
| Phalloidin rhodamine, concentration 0.264 µM | Molecular Probes, Life Technologies, Switzerland | R415 | |
| Recombinant Anti-CD83 antibody, 1:50 dillution | Abcam, UK | ab244204 |
References
- Rothen-Rutishauser, B., Blank, F., Mühlfeld, C., Gehr, P. In vitro models of the human epithelial airway barrier to study the toxic potential of particulate matter. Expert Opinion on Drug Metabolism and Toxicology. 4 (8), 1075-1089 (2008).
- Giard, D., et al. In vitro cultivation of human tumors: establishment of cell lines derived from a series of solid tumors. Journal of National Cancer Institute. 51 (5), 1417-1423 (1973).
- Ochs, M., Weibel, E. R., Grippi, M. A. Ch. 2: Functional Design of the Human Lung for Gas Exchange . Fishman's Pulmonary Diseases and Disorders, 5e. , (2008).
- Foster, K. A., Oster, C. G., Mayer, M. M., Avery, M. L., Audus, K. L. Characterization of the A549 Cell Line as a Type II Pulmonary Epithelial Cell Model for Drug Metabolism. Experimental Cell Research. 243 (2), 359-366 (1998).
- Guo, X. Y., Lu, M., Chen, X. Q., He, F. D., Li, A. Correlation study of biological characteristics of non-small cell lung cancer A549 cells after transfecting plasmid by microbubble ultrasound contrast agent. Asian Pacific Journal of Tropical Medicine. 9 (6), 582-586 (2016).
- Cooper, J. R., et al. Long Term Culture of the A549 Cancer Cell Line Promotes Multilamellar Body Formation and Differentiation towards an Alveolar Type II Pneumocyte Phenotype. PLoS ONE. 11 (10), 0164438 (2016).
- Bisig, C., Voss, C., Petri-Fink, A., Rothen-Rutishauser, B. The crux of positive controls - Proinflammatory responses in lung cell models. Toxicology In Vitro. 54, 189-193 (2019).
- Rothen-Rutishauser, B., et al. A newly developed in vitro model of the human epithelial airway barrier to study the toxic potential of nanoparticles. ALTEX. 25, (2008).
- Braakhuis, H. M., et al. Progress and future of in vitro models to study translocation of nanoparticles. Archives of Toxicology. 89 (9), 1469-1495 (2015).
- Thai, P., Chen, Y., Dolganov, G., Wu, R. Differential regulation of MUC5AC/Muc5ac and hCLCA-1/mGob-5 expression in airway epithelium. American Journal of Respiratory Cell and Molecular Biology. 33 (6), 523-530 (2005).
- Wu, J., et al. Characterization of air-liquid interface culture of A549 alveolar epithelial cells. Brazilian Journal of Medical and Biological Research. 51 (2), 6950 (2017).
- Shapiro, D. I., Nardone, L. L., Rooney, S. A., Motoyama, E. K., Munoz, J. L. Phospholipid biosynthesis and secretion by a cell line (A549) which resembles type II aleveolar epithelial cells. Biochimica and Biophysica Acta. 530 (2), 197-207 (1978).
- Balis, J., Bumgarner, S. D., Paciga, J. E., Paterson, J. F., Shelley, S. A. Synthesis of lung surfactant-associated glycoproteins by A549 cells: description of an in vitro model for human type II cell dysfunction. Experimental Lung Research. 6 (3-4), 197-213 (1984).
- Schurch, S., Gehr, P., Im Hof, V., Geiser, M., Green, F. Surfactant displaces particles toward the epithelium in airways and alveoli. Respiration Physiology. 80 (1), 17-32 (1990).
- Gehr, P., Schurch, S., Berthiaume, Y., Hof, V. I., Geiser, M. Particle Retention in Airways by Surfactant. Journal of Aerosol Medicine. 3 (1), 27-43 (2009).
- Blank, F., Rothen-Rutishauser, B., Gehr, P. Dendritic Cells and Macrophages Form a Transepithelial Network against Foreign Particulate Antigens. American Journal of Respiratory Cell and Molecular Biology. 36 (6), (2007).
- Rothen-Rutishauser, B. M., Kiama, S. G., Gehr, P. A three-dimensional cellular model of the human respiratory tract to study the interaction with particles. American Journal of Respiratory Cell and Molecular Biology. 32, (2005).
- Blank, F., Rothen-Rutishauser, B. M., Schurch, S., Gehr, P. An optimized in vitro model of the respiratory tract wall to study particle cell interactions. Journal of Aerosol Medicine. 19, (2006).
- Jardine, L., et al. Lipopolysaccharide inhalation recruits monocytes and dendritic cell subsets to the alveolar airspace. Nature Communications. 10 (1), 1999 (2019).
- Kopf, M., Schneider, C., Nobs, S. P. The development and function of lung-resident macrophages and dendritic cells. Nature Immunology. 16 (1), 36-44 (2015).
- Chortarea, S., et al. Repeated exposure to carbon nanotube-based aerosols does not affect the functional properties of a 3D human epithelial airway model. Nanotoxicology. 9 (8), 983-993 (2015).
- Hilton, G., Barosova, H., Petri-Fink, A., Rothen-Rutishauser, B., Bereman, M. Leveraging proteomics to compare submerged versus air-liquid interface carbon nanotube exposure to a 3D lung cell model. Toxicology In Vitro. 54, 58-66 (2019).
- Brandenberger, C., et al. Effects and uptake of gold nanoparticles deposited at the air-liquid interface of a human epithelial airway model. Toxicology and Applied Pharmacology. 242, (2010).
- Drasler, B., et al. Single exposure to aerosolized graphene oxide and graphene nanoplatelets did not initiate an acute biological response in a 3D human lung model. Carbon. 137, 125-135 (2018).
- Durantie, E., et al. Carbon nanodots: Opportunities and limitations to study their biodistribution at the human lung epithelial tissue barrier. Biointerphases. 13, (2018).
- Brandenberger, C., et al. Quantitative evaluation of cellular uptake and trafficking of plain and polyethylene glycol-coated gold nanoparticles. Small. 6 (15), 1669-1678 (2010).
- Tomašek, I., et al. Combined exposure of diesel exhaust particles and respirable Soufrière Hills volcanic ash causes a (pro-)inflammatory response in an in vitro multicellular epithelial tissue barrier model. Particle and Fibre Toxicology. 13 (1), 67 (2016).
- Nazarpour, R., et al. Optimization of Human Peripheral Blood Mononuclear Cells (PBMCs) Cryopreservation. International Journal of Molecular and Cellular Medicine. 1 (2), 88-93 (2012).
- Endes, C., et al. An in vitro testing strategy towards mimicking the inhalation of high aspect ratio nanoparticles. Particle and Fibre Toxicology. 11 (1), (2014).
- Ju, X., et al. The Analysis of CD83 Expression on Human Immune Cells Identifies a Unique CD83+-Activated T Cell Population. Journal of Immunology. 197 (12), 4613-4625 (2016).
- Lenz, A. G., et al. Inflammatory and Oxidative Stress Responses of an Alveolar Epithelial Cell Line to Airborne Zinc Oxide Nanoparticles at the Air-Liquid Interface: A Comparison with Conventional, Submerged Cell-Culture Conditions. BioMed Research International. , 12 (2013).
- Germann, A., Schulz, J. C., Kemp-Kamke, B., Zimmermann, H., von Briesen, H. Standardized serum-free cryomedia maintain peripheral blood mononuclear cell viability, recovery, and antigen-specific T-cell response compared to fetal calf serum-based medium. Biopreservation and Biobanking. 9 (3), 229-236 (2011).
- Weinberg, A., et al. Optimization and Limitations of Use of Cryopreserved Peripheral Blood Mononuclear Cells for Functional and Phenotypic T-Cell Characterization. Clinical and Vaccine Immunology. 16 (8), 1176 (2009).
- Freshney, R. I., Freshney, R. I. . Culture of animal cells: a manual of basic technique. , 321-334 (2005).
- Lehmann, A. B. C., Blank, F., Gehr, P., Rothen-Rutishauser, B., Yarmush, M. L., Langer, R. S. . Alternatives to animal testing. , 239-260 (2010).
- Steiner, S., et al. Reduction in (pro-)inflammatory responses of lung cells exposed in to diesel exhaust treated with a non-catalyzed diesel particle filter. Atmospheric Environment. 81, 117-124 (2013).
- Martinez, F. O., Gordon, S., Locati, M., Mantovani, A. Transcriptional Profiling of the Human Monocyte-to-Macrophage Differentiation and Polarization: New Molecules and Patterns of Gene Expression. The Journal of Immunology. 177 (10), 7303 (2006).
- Chortarea, S., et al. Profibrotic activity of multi-walled carbon nanotubes upon prolonged exposures in different human lung cell types. Applied In Vitro Toxicology. 5 (1), (2019).
- Holt, P. G. Pulmonary Dendritic Cells in Local Immunity to Inert and Pathogenic Antigens in the Respiratory Tract. Proceedings of the American Thoracic Society. 2 (2), 116-120 (2005).
- Pinkerton, K. E., Gehr, P., Castañeda, A., Crapo, J. D., Parent, R. A. . Comparative Biology of the Normal Lung (Second Edition). , 105-117 (2015).
- Crapo, J., Barry, B., Gehr, P., Bachofen, M., Weibel, E. R. Cell number and cell characteristics of the normal human lung. American Review of Respiratory Disease. 126 (2), 332-337 (1982).
- Maniecki, M. B., Møller, H. J., Moestrup, S. K., Møller, B. K. CD163 positive subsets of blood dendritic cells: The scavenging macrophage receptors CD163 and CD91 are coexpressed on human dendritic cells and monocytes. Immunobiology. 211 (6), 407-417 (2006).
- Chignard, M., Balloy, V. Neutrophil recruitment and increased permeability during acute lung injury induced by lipopolysaccharide. American Journal of Physiology-Lung Cellular and Molecular Physiology. 279 (6), 1083-1090 (2000).
- Coyne, C. B., et al. Regulation of Airway Tight Junctions by Proinflammatory Cytokines. Molecular Biology of the Cell. 13 (9), 3218-3234 (2002).
- Durantie, E., et al. Biodistribution of single and aggregated gold nanoparticles exposed to the human lung epithelial tissue barrier at the air-liquid interface. Particle and Fibre Toxicology. 14 (49), (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved