Method Article
Modelo Alveolar Humano Multicelular Composto por Células Epiteliais e Células Imunes Primárias para Avaliação de Riscos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Apresentado aqui é um protocolo para isolamento do monócito sanguíneo humano primário, bem como sua diferenciação em macrófagos e células dendríticas e montagem com células epiteliais em um modelo pulmonar humano multicelular. Respostas biológicas de coculturas compostas de células imunes diferenciadas de monócitos recém-isolados ou descongelados, após exposição a estímulos proinflamatórios, são comparadas.
Resumo
Um modelo de cocultura celular alveolar humana é descrito aqui para simulação da barreira do tecido epitelial alveolar composta por células epiteliais alveolares tipo II e dois tipos de células imunes (ou seja, macrófagos derivados de monócitos humanos [MDMs] e células dendríticas [MDDCs]). Um protocolo para a montagem do modelo multicelular é fornecido. As células epiteliais alveolares (linha celular A549) são cultivadas e diferenciadas sob condições submersas em pastilhas permeáveis em poços de duas câmaras, em seguida, combinadas com MDMs e MDDCs diferenciados. Finalmente, as células são expostas a uma interface ar-líquido por vários dias. Como as células imunes primárias humanas precisam ser isoladas das camadas de buffy humanas, as células imunes diferenciadas dos monócitos frescos ou descongelados são comparadas para adaptar o método com base em necessidades experimentais. Os modelos tridimensionais, compostos por células alveolares com células imunes recém-isoladas ou descongeladas derivadas de monócitos, mostram um aumento estatisticamente significativo na citocina (interleucinas 6 e 8) liberadas após a exposição a estímulos proinflamatórios (lipopolysaccarídeo e fator de necrose tumoral α) em comparação com células não tratadas. Por outro lado, não há diferença estatisticamente significante entre a liberação de citocinas observada nas coculturas. Isso mostra que o modelo apresentado responde a estímulos proinflamatórios na presença de MDMs e MDDCs diferenciados de monócitos sanguíneos periféricos frescos ou descongelados (PBMs). Assim, é uma poderosa ferramenta para investigações de resposta biológica aguda a diferentes substâncias, incluindo drogas aerossolizadas ou nanomateriais.
Introdução
Culturas in vitro de células pulmonares oferecem plataformas econômicas, robustas e bem controladas para avaliar os perigos dos aerossóis1. Como um sistema celular modelo para pneumócitos alveolares humanos, a linha celular epitelial A549 isolada de um adenocarcinoma pulmonar é frequentemente usada2. Essas células representam células epiteliais escamosas tipo II da região alveolar3 e são uma linha de células pulmonares amplamente utilizada para avaliação de risco e toxicidade1,4,,5,,6,,7,,8,,9,,10. A linha celular A549 possui características relevantes das células epiteliais alveolares tipo II, como a presença de corpos lamelares característicos contendo fosfolipídios densamente embalados3.
Foi demonstrado que quando as células são cultivadas em uma interface ar-líquido (ALI), o surfactante é liberado no lado apical das células epiteliais expostas ao ar, reduzindo a tensão superficial11,,12,13. Essa característica é particularmente importante em investigações de risco respiratório e toxicidade de nanomateriais. Uma vez inalados nanomateriais/tóxicos são depositados na região alveolar, eles primeiro interagem com o surfactante pulmonar e são deslocados por forças de molhar na hipofase aquosa, onde a interação com células pulmonares ocorre14,,15. Embora as células A549 formem uma monocamada (que pode crescer demais em multicamadas em pontos de tempo posteriores quando cultivadas em ALI) e produzem surfactantes, uma desvantagem é sua formação de junção apertada insuficiente, resultando em baixos valores de resistência elétrica transepitelial, mas ainda apresentando uma barreira funcional contra a translocação intercelular (nano)partículas16,,17,,18.
Nos pulmões, há uma variedade de populações de células imunes, incluindo células fagocíticas e profissionais que apresentam antígenos (ou seja, macrófagos e células dendríticas) que se comunicam diretamente através do contato celular ou sinalização intercelular para controlar e manter a homeostase. Macrófagos e células dendríticas são efeitos imunológicos inatas críticos e iniciadores da resposta imune adaptativa19. Células dendríticas que residem dentro ou abaixo do epitélio podem formar saliências através do epitélio para o lúmen para capturar antígenos. Os macrófagos alveolares estão localizados na superfície apical do epitélio e atuam como células sentinelas, representando a primeira defesa celular contra material estranho, bem como infecções bacterianas, virais e fúngicas. Sua plasticidade fenotípica permite a rápida indução de reações proinflamatórias em resposta a tais estímulos, bem como mudar para desencadear reações anti-inflamatórias (ou seja, inibitórias)20.
Para simular a barreira do tecido epitelial alveolar humano, estabelecemos um modelo triplo de cocultura com células A549 suplementadas com macrófagos derivados do sangue humano (MDMs) e células dendríticas (MDDCs) nos lados apical e basal,respectivamente 17. O cultivo deste modelo na ALI foi previamente relatado16, mesmo até 72 h pós-exposição21. As respostas imunes agudas às exposições de nanotubos de carbono foram significativamente aumentadas na cultura celular exposta ao ALI em comparação com as condições submersas22. O modelo de cocultura, cultivado e exposto a diferentes materiais da ALI, tem sido previamente utilizado para investigar citotoxicidade, estresse oxidativo e respostas inflamatórias após exposições a óxido de zinco,23 materiais relacionados ao grafeno24, nanopartículas de ouro25,,26, nanotubos de carbono21, e cinzas vulcânicas e partículas de escape diesel27.
Além disso, o importante papel dos macrófagos e células dendríticas como células de efeito imunológico em um modelo pulmonar humano in vitro foi confirmado. Em particular, observou-se uma resposta proinflamatória aumentada no modelo apenas na presença de células imunes em comparação com os sistemas de monocultura7. As desvantagens potenciais do uso de células imunes derivadas do monocito primário são a acessibilidade limitada dos PBMs, bem como a variação de doadores para doadores. Como solução para essas potenciais desvantagens, apresentado aqui é um protocolo que introduz a criopreservação de PBMs recém-isolados28 para a montagem do modelo de cultura celular. O objetivo deste estudo é demonstrar a montagem do modelo de tecido epitelial 3D humano, incluindo o isolamento de PBMs de casacos de buffy humanos. A capacidade de resposta aos estímulos proinflamatórios é comparada ao modelo composto por MDMs e MDDCs diferenciados de PBMs frescos ou diferenciados de PBMs congelados/descongelados.
Trabalhar com amostras de sangue humano não testadas envolve cuidados específicos para prevenir a transmissão potencial de doenças infecciosas, como o HIV (vírus da imunodeficiência humana), hepatite B e hepatite C. Portanto, o uso de medidas de proteção pessoal, como luvas, vestidos, máscaras e proteção ocular são cruciais e devem estar de acordo com os princípios da boa prática laboratorial. Essas proteções reduzem o risco de expor a pele ou membranas mucosas a fluidos potencialmente infecciosos. Além disso, para os envolvidos no manuseio de casacos e PBMs, a vacinação contra o vírus da hepatite B é obrigatória, e os níveis de titulação sanguínea de anticorpos anti-hepatite B devem estar acima de 100 UI/L (requisitos legislativos específicos do país precisam ser abordados). Além disso, todo o trabalho deve ser realizado em laboratórios de biossegurança nível 2 (requisitos legislativos específicos do país precisam ser abordados). As precauções padrão de saúde e segurança associadas ao trabalho em um ambiente laboratorial e ao manuseio da cultura celular de mamíferos, incluindo o manuseio de resíduos, devem ser adotadas na condução de todo o protocolo.
Protocolo
O trabalho envolvendo monócitos primários isolados do sangue humano foi aprovado pelo comitê do Escritório Federal de Saúde Pública da Suíça (número de referência: 611-1, Meldung A110635/2) para o Instituto Adolphe Merkle.
1. Isolamento de monócitos sanguíneos periféricos (PBMs) de casacos de buffy humanos
NOTA: A seção a seguir descreve o isolamento de células imunes de um saco de 50 mL de um casaco de polimento, comprado do Centro suíço de Transfusão em Berna, Suíça.
- Preparação de reagentes
- Prepare 100 mL de tampão de separação magnética por casaco buffy: 0,5% [w/v] albumina de soro bovino (BSA; em soro tampão de fosfato [PBS]) com ácido 2 mM etilenodiaminatotraacético (EDTA), e ajuste ao pH = 7,2, filtro estéril com 0,22 μm de pore tamanho). Mantenha a 4 °C durante todo o procedimento.
- Preparar o meio de cultura celular (CCM): RPMI 1640 com 10% [v/v] soro bovino fetal (FBS), 1% [v/v] L-glutamina (aqui, 2 mM L-glutamina), e 1% [v/v] penicilina-estreptomicina (aqui, 100 unidades/mL penicilina e 100 μg/mL streptomicina).
NOTA: A quantidade necessária de cada reagente depende do número de células a serem semeadas nas etapas seguintes.
- Isolamento de PBMs
NOTA: Todo vidro e plástico precisam ser esterilizados antes de serem usados. Por razões de segurança, recomenda-se o uso de plásticos para o manuseio de amostras de sangue humano para reduzir o risco de ferimentos com vidros.- Use uma tesoura para cortar a extremidade da mangueira do saco contendo o casaco de polimento.
- Distribua o casaco de buffy despejando o conteúdo do saco através do duto do saco diretamente em dois tubos de centrífuga cônica de 50 mL (~25 mL cada).
- Despeje suavemente ou pipeta PBS nos tubos para atingir volumes de 50 mL. Misture o conteúdo girando o tubo suavemente de cabeça para baixo 3x.
- Divida a mistura buffy coat-PBS em quatro novos tubos de centrífuga cônica de 50 mL, tubos de 25 mL da mistura em cada tubo fresco.
- Coloque lentamente 13 mL de gradiente de densidade médio sob a mistura buffy coat-PBS usando uma pipeta sorológica de 10 mL. Retire a pipeta preenchida do suporte da pipeta e conecte imediatamente a abertura superior da pipeta com um polegar para evitar qualquer vazamento adicional do meio gradiente de densidade na mistura buffy coat-PBS.
NOTA: Segurando a abertura superior com o polegar, coloque a pipeta preenchida na parte inferior do tubo de centrífuga cônica para que o meio de gradiente de densidade flua lentamente sob a mistura buffy coat-PBS, deixando aproximadamente 1 mL do meio gradiente de densidade dentro da pipeta. - Repita o passo 1.2.5 com os outros três tubos contendo a mistura buffy coat-PBS.
- Centrifugar todos os quatro tubos contendo as misturas por 20 min a 1.000 x g e 25 °C em um modo de frenagem lenta. Use suportes com tampas protetoras para centrifugação.
- Abra a tampa de cada tubo, remova a camada superior contendo plasma e plaquetas usando uma pipeta sorológica e descarte em um recipiente de resíduos líquidos de risco biológico.
- Use uma pipeta sorológica para coletar a camada celular mononuclear de sangue periférica, que aparece como uma pequena fração turva esbranquiçada (~2-3 mm de espessura) entre o plasma e as camadas médias gradientes de densidade. A pelota contém glóbulos vermelhos na parte inferior. Evite transferir eritrócitos que formam a camada mais baixa. Repita isso para todos os quatro tubos.
NOTA: As células mononucleares sanguíneas periféricas consistem em PBMs e linfócitos. Os PBMs serão separados dos linfócitos mais tarde durante a separação magnética do CD14+. - Possuo de células mononucleares de sangue periféricos de quatro tubos em dois tubos de 50 mL.
- Encha os dois tubos com PBS a 50 mL e cubra com uma tampa.
- Descarte os eritrócitos e o plasma dos quatro tubos originais em um recipiente de resíduos líquidos de risco biológico.
- Centrifugar os dois tubos por 8 min a 500 x g e 18-20 °C a uma velocidade regular de centrífuga.
- Após a centrifugação, remova o supernasce com uma pipeta sorológica e descarte-a em um recipiente de resíduos líquidos de risco biológico.
- Resuspend as células com 5 mL de PBS usando uma pipeta sorológica.
- Acumule as suspensões celulares em um tubo de centrífuga cônica de 50 mL e encha até 50 mL com PBS.
- Use 5 μL da suspensão celular para contar as células com um contador de células usando o método de exclusão azul trypan (45 μL).
- Pipeta 10 μL da solução trypan blue-PBMs em uma câmara de contador celular e contar o número de células pelo protocolo de contagem padrão. Use a Equação 1 para calcular o número total da célula, CT.
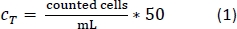
- Após a contagem das células, centrifugar o tubo de 50 mL como feito na etapa 1.2.13.
- Seleção positiva do CD14
- Abra suavemente a tampa de cada tubo, depois remova e descarte o supernatante usando uma pipeta sorológica sem perturbar a pelota.
- Adicione a quantidade calculada (Equação 2) do tampão de separação magnética (aqui, 80 μL de tampão por 1 x 107 células totais) e resuspenco a pelota celular tubondo a solução para cima e para baixo.
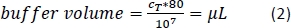
- Calcule usando a Equação 3 (aqui, 10 μL por 1 x 107 células totais) o volume correspondente de contas magnéticas CD14+ e pipeta o volume apropriado.
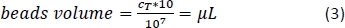
- Misture bem por pipetar para cima e para baixo, feche a tampa e incubar a solução a 4 °C por 15 min.
- Após a incubação, encha o tubo até 50 mL com tampão de separação magnética.
- Centrifugar como feito na etapa 1.2.13.
- Aspire e descarte o supernasce usando uma pipeta sorológica sem perturbar a pelota celular.
- Pipeta a quantidade correspondente de tampão de separação magnética (Equação 4; aqui, 500 μL de tampão por 1 x 108 células) e misturar suavemente por pipetação para cima e para baixo 3x.
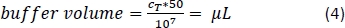
- Desinfete a estação de separação magnética pulverizando-a e limpando-a com um agente esterilizador. Coloque na capa de fluxo laminar junto com a coluna para separação magnética.
- Coloque a coluna de separação magnética no campo magnético e coloque um tubo de centrífuga cônica vazio de 50 mL diretamente sob a coluna para coletar a lavagem e células sem rótulo (ou seja, resíduos).
- Enxágüe a coluna de separação magnética ao tubo de 3 mL de tampão de separação magnética na coluna. Não deixe a coluna secar durante todo o procedimento.
- Prepare um tubo de centrífuga cônica de 15 mL e pipeta 1 mL de tampão de separação magnética.
- Aplique a suspensão celular (preparada na etapa 1.3.8) na coluna de separação magnética. No tubo de centrífuga cônica de 50 mL sob o filtro, colete células sem rótulo que passaram.
NOTA: Não exceda 2 x 109 células por coluna para evitar o bloqueio da coluna. - Assim que o reservatório da coluna estiver vazio (ou seja, quando as células passarem pela coluna), aplique 3 mL de tampão de separação magnética usando uma pipeta sorológica e deixe passar pela coluna. Repita este 3x.
- Remova a coluna de separação magnética do separador magnético puxando suavemente com as mãos e, em seguida, coloque-a em um tubo de 15 mL contendo 1 mL pré-tubo de tampão de separação magnética (preparado na etapa 1.3.12).
- Adicione 5 mL de tampão de separação magnética à coluna e limpe as células magneticamente rotuladas empurrando firmemente o êmbolo para dentro da coluna.
- Preparação de reagentes para diferenciação de MDM e MDDC
- Conte as células com um contador celular usando o método de exclusão azul trypan como feito na etapa 1.2.17.
- Calcule os volumes necessários de CCM ou FBS para outras etapas da seguinte forma: ou o volume de CCM correspondente a uma densidade celular de 1 x 106 células/mL (etapa 1,5.1), ou o volume de FBS correspondente a uma densidade celular de 6 x 106 células por 0,9 mL de FBS (etapa 1.6.3).
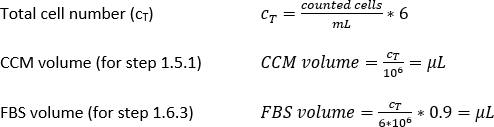
- Feche a tampa, coloque o tubo na centrífuga e centrífuga como feito na etapa 1.2.13. Remova e descarte o supernasce sem perturbar a pelota celular. Prossiga para a etapa 1.5 para semeadura celular ou passo 1.6 para congelamento celular.
- Sementes e diferenciação de PBM em MDMs e MDDCs
- Resuspende a pelota celular no volume calculado de CCM como calculado na etapa 1.4.2 (aqui, uma concentração final de 1 x 106 células/mL) por tubulação para cima e para baixo 3x.
- Pipeta o número de células destinadas a diferenciar-se em MDMs e MDDCs em tubos de centrífuga cônica separados usando uma pipeta sorológica.
- Fatores diferenciadores de pipeta para o CCM com PBMs e misturar bem por pipetar para cima e para baixo. Fatores diferenciais são aplicados da seguinte forma:
- Para MDDCs: concentração final de 10 ng/mL interleucina-4 (IL-4) e fator estimulante de colônia granulocito-macrócico de 10 ng/mL (GM-CSF).
- Para MDMs: concentração final de 10 ng/mL fator estimulante da colônia de macrófagos (M-CSF).
- Pipeta as suspensões celulares em CCM com os fatores diferenciais adicionados em 6 placas de poço, distribuindo 3 mL da suspensão por poço (corresponde a 3 x 106 células/bem, ou seja, 1 x 106 células/mL).
- Coloque as 6 placas de poço em uma incubadora de cultura celular (37 °C, 5% CO2) e deixe-as diferenciar por 6 dias sem refrescar o CCM.
NOTA: A diferenciação varia de 5 a 8 dias, dependendo da disponibilidade local de casacos buffy e configuração experimental, desde que a eficiência de diferenciação seja determinada utilizando as técnicas apropriadas (consulte a seção de discussão).
- Congelamento de PBM
- Resuspenque a pelota celular em um meio crioprotetor (aqui, FBS e sulfóxido de dimetil [DMSO; citotóxico]) a uma razão de 9:1 (v/v) por tubos de um volume de FBS pré-armado. Isso corresponde a uma concentração celular final de 6 x 106 células/mL, considerando uma adição adicional de 10% DMSO (v/v).
- Marque o número desejado de criovias na capa de fluxo laminar (ou seja, regisce a data, o código de isolamento e o número de células).
- Pipeta 0,9 mL de suspensão celular em FBS puro (aqui, 6 x 106 células em 0,9 mL de FBS) para cada criovial. Posteriormente, pipeta lentamente 0,1 mL de DMSO e misture bem a suspensão girando os criovials para cima e para baixo 3x.
- Transfira os criovials para um recipiente de congelamento de células e coloque-o imediatamente em -80 °C por 24 h.
- Após 24 horas, retire os criovials do congelador e do recipiente de -80 °C e coloque-os no tanque de nitrogênio líquido adequado para armazenamento celular.
- Degelo e diferenciação do PBM em MDMs e MDDCs
- Aqueça todos os reagentes necessários a 37 °C em um banho de água (~20-30 min).
- Prepare o número adequado de 6 placas de poço correspondentes ao número de células descongeladas (aqui, uma placa por 1,8 x 107 células, ou seja, 3 criovials). Pipeta 2 mL de CCM para cada poço em condições assépticas. Coloque as placas na incubadora (5 % CO2, 37 °C) por 15 minutos para permitir que o pH se equilibre.
- Pegue a quantidade necessária de criovials com células congeladas de um tanque de nitrogênio líquido e gire-as suavemente em um banho de água de 37 °C (1-2 min) para garantir o degelo uniforme da suspensão celular.
- Retire o criovial do banho de água e descontamine com um agente esterilizador, garantindo que o agente não interaja com a tampa e o anel O.
NOTA: Aqui, todas as etapas devem ser concluídas em condições assépticas. - Prepare o número apropriado de tubos de centrífuga cônica de 15 mL correspondentes ao número de criovias a serem descongelados (aqui, 6 x 106 células/tubo). Pipeta 9 mL de CCM pré-armado em cada tubo.
- Pipeta lentamente (drop-by-drop) o conteúdo do criovial em um tubo contendo CCM. Feche a tampa, repita para cada tubo e centrífuga a 200 x g por 5 min a uma velocidade de centrífuga regular.
- Descarte o supernatante sem perturbar a pelota.
- Resuspenha a pelota de cada tubo (que contém células de um criovial) em 2 mL de CCM pré-enchido por pipetar6 para cima e para baixo usando uma pipeta sorológica (densidade celular correspondente a 3 x 106 células/mL).
- De cada tubo, pipeta as células resuspended em dois poços (1 mL por poço) de uma placa de 6 poços contendo 2 mL de CCM previamente preparado para atingir uma densidade celular de 3 x 106 células/bem (correspondendo a uma concentração final de 1 x 106 células/mL). Repita isso para todos os outros tubos.
- Proceda com diferenciação conforme descrito na seção 1.5.3.
- Coloque as 6 placas de poço em uma incubadora de cultura celular (37 °C, 5% CO2) e deixe-as diferenciar por 6 dias sem refrescar o CCM.
2. Modelo de cocultura celular tripla do tecido epitelial alveolar humano
NOTA: Esta seção fornece instruções sobre volumes e números de células correspondentes a 12 inserções de placas de poço. A Figura 1 resume um cronograma proposto para a montagem do modelo.
- Semeadura de célula epitelial (linha celular A549)
- Cultura as células epiteliais de acordo com as recomendações fornecidas pelo fornecedor (ATTC). Resumidamente, subcultura as células em CCM a 80% de confluência celular (aproximadamente, 2x-3x por semana).
NOTA: Subcultura A549 por pelo menos quatro passagens antes da composição do modelo de cocultura, utilizando células A549 em uma faixa de passagem de 5 a 25. - Pipeta 1,5 mL de CCM pré-armado em 12 placas de poço (o número de poços corresponde ao número desejado de modelos).
- Coloque inserções individuais de cultura celular de 12 poços em poços de uma placa de 12 poços usando pinças esterilizadas.
- Retire as células de um frasco de acordo com o protocolo de subcultivação (ou seja, usando um agente desapego, remova o agente por centrifugação como feito na etapa 1.2.13). Resuspend no volume apropriado de CCM correspondente à concentração celular final de A549 (aqui, 50 x 104 células/mL; 0,5 mL de suspensão celular por inserção, ou seja, 25 x 104 células/inserção, o que corresponde à densidade de semeadura de 27,8 x 104 células/cm2).
- Pipeta 0,5 mL da suspensão celular (ou seja, 25 x 104 células/inserção) no lado apical da inserção usando uma pipeta de 1 mL.
- Cubra as placas com tampas e coloque-as em uma incubadora de cultura celular (37 °C, 5 % CO2) durante 4 dias.
NOTA: Verifique regularmente a confluência das células A549 sob um microscópio de contraste de fase.
- Cultura as células epiteliais de acordo com as recomendações fornecidas pelo fornecedor (ATTC). Resumidamente, subcultura as células em CCM a 80% de confluência celular (aproximadamente, 2x-3x por semana).
- Semeadura MDDC
- CcM aspirado com células nãoectadas nas 6 placas do poço contendo MDDCs.
- Adicione 1 mL de CCM pré-armado fresco a cada poço.
- Use um raspador de célula, desprender (raspar) MDDCs adeptos de cada poço, lave suavemente os poços com os 1 mL existentes de CCM 3x e combine-os em um tubo cônico de centrífuga.
- Conte as células com um contador celular usando o método de exclusão azul trypan usando 10 μL de suspensão celular e 10 μL de solução azul trypan.
- Centrifugar a suspensão celular como feito na etapa 1.2.13.
- Calcule o volume CCM necessário para a ressuspensão (Equação 5):
Densidade MDDC necessária = 42 x 104 células/mL; cada inserção requer 6,3 x 104 células, o que corresponde a uma densidade celular semeada de 7 x 104 células/cm2 (aqui, 150 μL adicionado em 0,9 cm2 na etapa 2.2.10.).
Volume CCM para ressuspensão celular (Vm; Equação 5):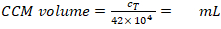
- Aspire suavemente e descarte o CCM da câmara superior de 12 placas de poço com A549 crescente nas pastilhas.
- Coloque as pastilhas com células A549 em uma posição de cabeça para baixo em uma placa de Petri estéril usando pinças esterilizadas. Prepare um tubo de centrífuga cônica (50 mL) com PBS e pré-umedeça um raspador de células.
- Raspe as células A549 da superfície basal da pastilha (ou seja, a parte superior na posição de cabeça para baixo), que deve crescer através dos poros das pastilhas.
NOTA: Enxágüe o raspador com PBS (preparado em um tubo) entre raspar amostras individuais e mantenha-o molhado durante todo o procedimento. - Após a centrifugação (etapa 2.2.5), aspirar e descartar o supernascimento, em seguida, remediar a pelota MDDC na quantidade calculada de CCM (etapa 2.2.6) e pipeta para cima e para baixo 3x.
- Pipeta 150 μL da suspensão celular em cima de cada inserção de modo que toda a superfície basal da inserção esteja igualmente coberta com o líquido e não contenha bolhas.
- Cubra o prato com uma tampa e coloque em uma incubadora de cultura celular por 70 minutos. Aspire o CCM das placas de cultura celular (onde as pastilhas foram inicialmente colocadas), descarte-o em resíduos líquidos de risco biológico e pipeta de 1,5 mL de CCM fresco em cada poço. Cubra a placa com uma tampa e coloque na incubadora celular (37 °C, 5% CO2).
NOTA: Não exceda o período de tempo mencionado acima para evitar a secagem das células. - Após a incubação, segure cuidadosamente cada inserção com pinças esterilizadas e coloque-as nas placas contendo CCM em uma posição comum. Cubra a placa com uma tampa e devolva-a à incubadora celular (37°C, 5% CO2).
- Semeadura do Macrófago (MDM)
- Pegue 6 placas de poço contendo MDMs prediferenciados. Coloque-os da incubadora celular para um capô de fluxo laminar.
- Aspirar e descartar CCM com MDMs não ligados cultivados em 6 placas de poço, e pipeta 1 mL de CCM pré-armado fresco em cada poço.
- Usando um raspador de célula, remova suavemente MDMs aderentes de poços individuais (como feito na etapa 2.2.3 para os MDDCs).
- Pipeta 10 μL de tripano azul em um poço ou tubo e adicionar 10 μL da suspensão MDM para alcançar a diluição final de 1:1 (v/v). Conte o número de MDMs usando o protocolo de contagem apropriado.
- Centrifugar a suspensão celular como feito na etapa 1.2.13.
- Calcular o volume necessário (Equação 6):
Densidade MDM necessária = 2,5 x 104 células/mL em CCM (aqui, cada inserção requer 1,25 x 104 células em 0,5 mL CCM, o que corresponde a uma densidade celular semeada de 1,4 x 104 células/cm2).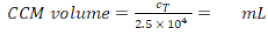 (6)
(6) - Após a centrifugação, aspire e descarte o supernasciente, redisperse a pelota MDM na quantidade calculada de CCM (etapa 2.3.6), e pipeta para cima e para baixo 3x.
- Cuidadosamente pipeta 0,5 mL da suspensão MDM (preparada na etapa 2.3.7) na parede da cultura celular insere com A549 e MDDCs (não diretamente em células epiteliais) usando uma pipeta de 1 mL. Cubra as placas com tampas e coloque em uma incubadora de cultura celular (37 °C, 5 % CO2) por 24 h.
- Transferência do modelo de cocultura para interface ar-líquido (ALI)
- Após o término do período de incubação de 24 h (±2 h) do modelo montado em uma incubadora de cultura celular, aspirar e descartar CCM de partes apical e basal das pastilhas de cultura celular e dos poços.
- Utilizando pinças esterilizadas, levante as pastilhas individuais dos poços e pipeta 0,6 mL de CCM pré-armado fresco para cada poço usando uma pipeta de 1 mL. Não adicione CCM ao lado apical da inserção.
- Cubra as placas com tampas e coloque em uma incubadora de cultura celular (37 °C, 5 % CO2) para 24 horas antes do uso posterior.
3. Exposição a controles positivos selecionados (estímulos conhecidos para induzir resposta proinflamatória)
NOTA: A exposição dos modelos de cocultura a um conhecido fator de lipopolissacarídeo de estímulo proinflamatório (LPS)7 e o fator de necrose tumora-citocina proinflammatória α (TNF-α)7 é usado para ilustrar a responsividade do modelo. Além disso, a exposição a um detergente (Triton X-100) é usada para confirmar a sensibilidade de um ensaio de desidrogenase lactato (LDH).
- Prepare as soluções de controle positivo: estoque de LPS (1 mg/mL em água destilada), estoque TNF-α (100 μg/mL em água destilada) e Triton-X 100 (2% [v/v] na PBS).
- Após a incubação 24 h do modelo de cocultura em condições ALI, aspire e descarte o sobrenante do compartimento basal. Utilizando pinças esterilizadas, levante as pastilhas individuais dos poços e a pipeta de 0,6 mL de CCM pré-armado fresco em cada poço.
- Prepare soluções individuais de trabalho de controles positivos diluindo os estoques em CCM em tubos cônicos de centrífuga da seguinte forma: 1 μg/mL LPS, 1 μg/mL TNF-α e 0,2% Triton-X 100. Os volumes correspondem ao número de pastilhas testadas (aqui, 100 μL/insert). Misture bem as soluções, subindo e descendo 3x.
- Aplique 100 μL de cada solução de controle positivo, pipetando lentamente na parede da inserção de cultura celular. Cubra a placa do poço com uma tampa e coloque na incubadora de cultura celular (37 °C, 5% CO2) por 24 h. Após a incubação, aspire e descarte o líquido no lado apical da inserção segurando pastilhas individuais usando pinças.
- Colete CCM nos compartimentos basais e armazene a 1) 4 °C para análise posterior de LDH, denotando citotoxicidade mediada pela ruptura da membrana celular e/ou 2) armazenar a -80 °C para análise posterior da liberação de proteínas via ensaio imunossorbente ligado à enzima (ELISA). Execute os ensaios de acordo com as recomendações do fornecedor do kit.
- Após a remoção do CCM, lave as pastilhas com PBS 3x e fixe as células nas pastilhas de cultura celular em 4% [c/v] paraformaldeído (em PBS, 15 min em temperatura ambiente) garantindo que ambos os lados de inserção estejam bem cobertos com solução PFA. Posteriormente, lave 3x com PBS para remover PFA. Armazene as amostras submersas em PBS a 4 °C para maior imunossuagem (um exemplo deste método foi descrito anteriormente17).
Resultados
Modelos de cocultura pulmonar humana, compostos por células epiteliais alveolares e células imunes, foram montados a partir de MDDCs frescos ou congelados e progenitores de MDMs (aqui, monócitos periféricos derivados do sangue humano). Conforme apresentado na Figura 1,as células A549 foram semeadas 3 dias após a primeira seção envolvendo isolamento/descongelamento de monócitos. Após 6 dias de diferenciação, os MDMs diferenciados apareceram em forma redonda, enquanto os MDDCs formaram uma forma mais alongada com saliências observáveis. Eles também apareceram como aglomerados, especialmente quando diferenciados dos monócitos frescos(Figura 2, Figura 3). As células epiteliais formaram uma densa camada celular de células após 3 dias de crescimento nas pastilhas de membrana(Figura 4),quando as coculturas foram montadas. Após 24h de montagem e 24h adicionais de serem submetidas às condições de ALI, as coculturas foram preparadas para exposições.
A responsividade dos modelos de cultura celular 3D foi investigada após a exposição a estímulos proinflamatórios conhecidos usando uma abordagem pseudo-ALI, como descrito anteriormente29. Os estímulos proinflamatórios, LPS e TNF-α, foram adicionados em volumes baixos (100 μL) à superfície apical do modelo celular exposto ao ar. Paralelamente, a ausência de ruptura da membrana como medida de citotoxicidade foi avaliada via ensaio LDH. Observou-se aumento significativo da liberação de LDH em CCM do compartimento basal após exposição ao controle positivo para ruptura da membrana, um detergente Triton-X 100 (Figura 5). Esses resultados mostraram responsividade do modelo a uma substância citotóxica, enquanto nenhum aumento na liberação de LDH foi observado após estimulação apical com TNF-α ou LPS.
Uma possível razão para os diferentes valores medidos de LDH nas amostras montadas com PBMs frescos ou previamente congelados pode ser atribuída ao armazenamento da amostra. Amostras de PBMs frescos foram armazenadas por mais tempo a -80 °C; portanto, a atividade da enzima LDH pode cair. Notavelmente, o LDH é estável por apenas até 4 dias no CCM; assim, recomenda-se realizar o ensaio nos últimos 2 dias após a coleta dos supernantes. Alternativamente, é possível congelar os supernaentes logo após a coleta. No entanto, é importante considerar que o congelamento pode diminuir a atividade enzimática do LDH.
A secreção de mediadores proinflamatórios (aqui, TNF-α e interleucinas 6 [IL-6] e 8 [IL-8]) no CCM basal foi quantificada via ELISA. Estatisticamente significativos (p < 0,05, ANOVA unidirecional) foram observados aumentos na liberação de IL-6 e IL-8 em amostras tratadas LPS e TNF-α em comparação com as respectivas células não tratadas, bem como nos modelos de cultura celular montados a partir de qualquer fonte de PBMs(Figura 6). Embora as concentrações (pg/mL) de todas as citocinas testadas no CCM basal tenham sido maiores nas coculturas compostas por PBMs frescos, as diferenças entre as duas coculturas e monoculturas não foram estatisticamente significativas (p > 0,05) (Figura 6). Para confirmar o valor agregado dos modelos de cocultura em relação a uma cultura celular epitelial 2D, as monoculturas A549 também foram expostas a LPS ou TNF-α. Como esperado, a liberação de todos os mediadores investigados das monoculturas A549 foi menor em relação aos dois modelos de cocultura; embora, a diferença entre eles não tenha sido estatisticamente significante (p > 0,05, ANOVA unidirecional).
A morfologia celular da barreira do tecido epitelial alveolar humano 3D foi avaliada por meio de microscopia de varredura a laser confocal (LSM). Para visualizar a composição de cada modelo, os macrófagos dentro dos modelos de cocultura (MDMs) foram manchados com marcador macrófago maduro 25F9. Os MDDCs foram manchados com CD83, que é um importante marcador para células dendríticas ativadas30. Quanto à morfologia celular, não foi observada diferença entre os modelos de cocultura utilizando MDMs e MDDCs de PBMs frescos em comparação com aqueles que utilizam PBMs descongelados. Em coculturas expostas ao LPS e TNF-α, ambas compostas por células imunes frescas e congeladas, observou-se uma camada epitelial interrompida em imagens LSM, o que não ocorreu em células não tratadas(Figura 7, Figura 8).
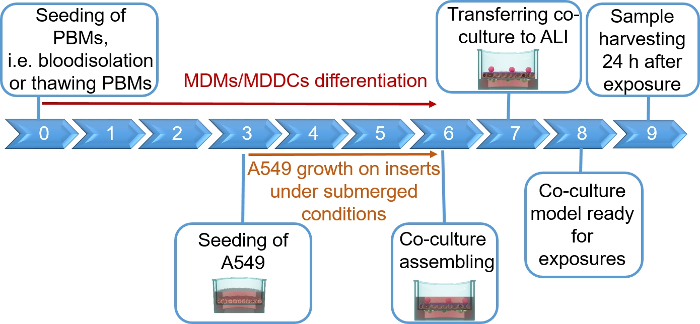
Figura 1: Cronograma esquemático do protocolo. Apresentação do modelo de cocultura 3D preparação, montagem e aplicação (exposição a uma substância testada). ALI = interface ar-líquido, MDDCs = células dendríticas derivadas de monocitos, MDMs = macrófagos derivados de monócitos, PBMs = monócitos sanguíneos periféricos. Clique aqui para ver uma versão maior desta figura.
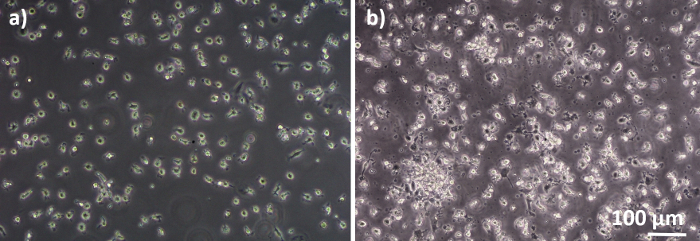
Figura 2: MDMs e MDDCs diferenciados de PBMs frescos. Imagem de microscopia de contraste de fase de MDMs diferenciados(A)e(B) MDDCs de PBMs frescos (6 dias após isolamento celular). Os MDMs são em forma redonda, enquanto os MDDCs são frequentemente observados como aglomeradores. Clique aqui para ver uma versão maior desta figura.
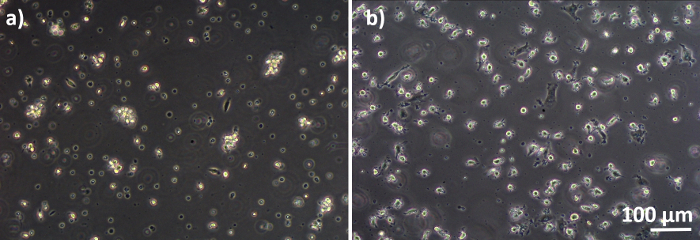
Figura 3: MDMs e MDDCs diferenciados de PBMs congelados. Imagem de microscopia de contraste de fase de MDMs diferenciados(A)e(B) MDDCs de PBMs descongelados (6 dias após o descongelamento). Os MDMs têm formato redondo, mas algumas células alongadas podem ser observadas. Os MDDCs também aparecem em forma redonda com saliências. Clique aqui para ver uma versão maior desta figura.

Figura 4: Crescimento das células epiteliais nas pastilhas de membrana. Imagem de microscopia de contraste de fase do confluente A549 crescendo em uma membrana inserida 4 dias após a semeadura, formando uma camada densa de células. Clique aqui para ver uma versão maior desta figura.
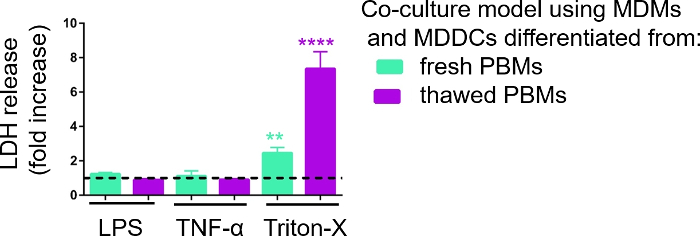
Figura 5: Resultados de citotoxicidade investigados através do ensaio baseado em ruptura de membrana (LDH). Os dados são apresentados como um aumento de dobra sobre células não tratadas (média ± SD, n = 3, asterisco denota aumento estatisticamente significativo em comparação com células não tratadas, **p < 0,01, ****p < 0,0001). Nos modelos verdes, MDMs e MDDCs de PBMs frescos são representados, e em modelos roxos montados a partir de PBMs descongelados são representados. Clique aqui para ver uma versão maior desta figura.
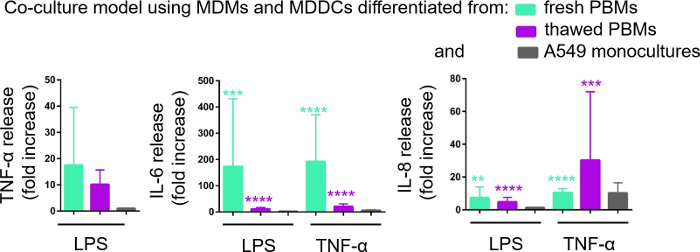
Figura 6: Reações proinflamatórias nas coculturas e monoculturas. Os mediadores proinflamatórios (TNF-α, IL-6 e IL-8) liberam nas coculturas após o desafio de 24 h com LPS ou TNF-α. Os dados são apresentados em relação às células não tratadas (média ± SD, n = 3, **p < 0,01, ***p < 0,001, ****p < 0,0001). Nos modelos verdes, MDMs e MDDCs de PBMs frescos são representados, e em modelos roxos montados a partir de PBMs descongelados são representados. Grey representa monoculturas A549. Clique aqui para ver uma versão maior desta figura.
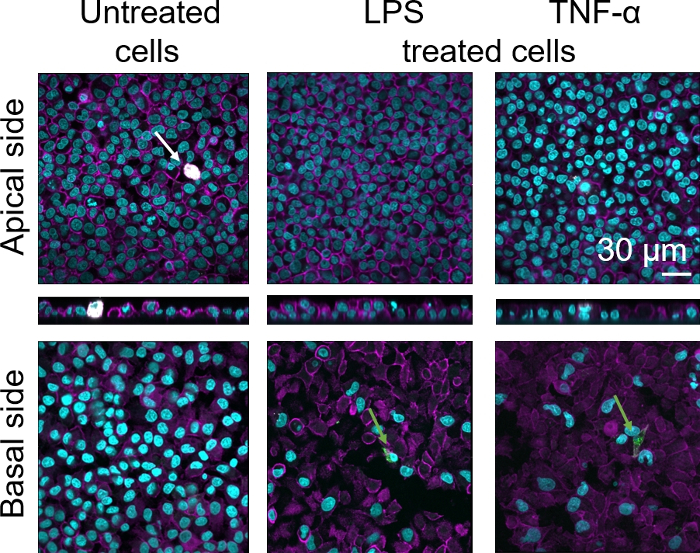
Figura 7: Morfologia de coculturas compostas de células imunes frescas. Imagens LSM de lados apical e basais do modelo de cocultura com projeções xz de lados apical do modelo usando MDMs e MDDCs de PBMs frescos. Cyan representa núcleos (DAPI), magenta representa citoesqueleto (rhodamine-phalloidin), branco representa MDMs (25F9), e verde representa MDDCs (CD 83). A seta branca denota MDM, enquanto o arqueiro verde denota MDDC. Clique aqui para ver uma versão maior desta figura.
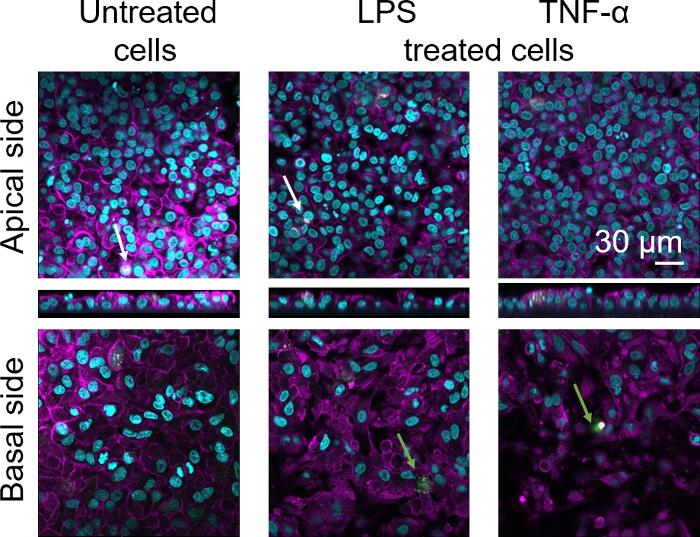
Figura 8: Morfologia de coculturas compostas de células imunes congeladas. Imagens LSM do lado apical do modelo de cocultura com projeções xz correspondentes, e lado basal do modelo usando MDMs e MDDCs de PBMs descongelados. Cyan representa núcleos (DAPI), magenta representa citoesqueleto (rhodamine-phalloidin), branco representa MDMs (25F9), e verde representa MDDCs (CDDCs). A seta branca denota MDM, enquanto o arqueiro verde denota MDDC. Clique aqui para ver uma versão maior desta figura.
Discussão
A produção emergente de novos materiais, incluindo produtos químicos e medicamentos, aumenta gradualmente a necessidade de modelos in vitro preditivos. Para cumprir os três princípios de substituição, redução e refinamento dos testes em animais32, os modelos de células in vitro tornaram-se ferramentas poderosas quanto ao aspecto de substituição e redução para mecanismos de elucidação da ação de uma droga ou material8,,9,,10,,11. Apresentado aqui é um protocolo detalhado de montagem do modelo multicelular usando células imunes que são recém-isoladas ou descongeladas de monócitos previamente congelados. Também é descrito o cultivo do modelo na ALI. Por fim, o protocolo ilustra um exemplo de exposição a estímulos proinflamatórios e compara a resposta dos dois modelos contendo monócitos frescos ou congelados.
Vários estudos têm sido realizados para confirmar e justificar o valor agregado da maior complexidade dos modelos cultivados e expostos em condições de ALI em comparação com a exposição submersa convencional7,22,31. A observação da maior resposta proinflamatória em coculturas em comparação com monoculturas de células epiteliais confirmam um estudo anterior. O estudo utilizou o modelo de cocultura apresentado (estimulado com LPS) e mostrou maior resposta aos níveis de expressão genética de TNF e IL1B em comparação com o modelo equivalente de monocultura A5497. Por outro lado, ambos os modelos apresentaram maiores variações dentro dos valores de liberação de mediadores proinflamatórios medidos em comparação com as monoculturas A549. Isso pode ser explicado pelo uso de células imunes de diferentes doadores (casacos buffy) dentro de repetições biológicas (ou seja, uma repetição, um doador), como mostrado anteriormente7. Se desejar, as variações entre as réplicas podem ser superadas por 1) utilizando PBMs descongelados do mesmo doador ou 2) agrupando PBMs de diferentes doadores antes do congelamento das células e, em seguida, posterior utilização do mesmo pool em cada repetição. Incluindo mais repetições biológicas também é recomendado.
A técnica de congelamento celular pode ser considerada como um passo crítico; no entanto, é um procedimento laboratorial comum para a preservação de células para análise fenotípica e funcional. Vários estudos demonstraram que a qualidade dos PBMs congelados é vital para sua sobrevivência, e uma técnica de congelamento adequada é fundamental para o sucesso de ensaios subsequentes com as mesmas células28,32. A modificação do protocolo pode ser realizada por meio do congelamento de PBMs, o que proporciona flexibilidade na configuração experimental, já que a disponibilidade de casacos buffy é geralmente limitada. Outra vantagem do uso de PBMs congelados (em vários frascos) sobre os recém-isolados é que eles podem ser usados em experimentos subsequentes mesmo após 1 ano. Isso diminui a potencial questão da variabilidade doador-a-doador se este for um parâmetro desejado ou necessário em um experimental.
Os resultados de uma comparação interlaboratória realizada após até 13 meses mostram que os PBMs, quando armazenados adequadamente em um tanque de nitrogênio líquido, podem ser usados por um longo período sem qualquer efeito sobre a viabilidade celular ou recuperação celular33. Tempos de armazenamento mais longos (mais de 1 ano) podem ser possíveis após a validação cuidadosa da viabilidade celular e da capacidade de resposta celular antes de realizar um experimento. Além disso, a temperatura no tanque de nitrogênio líquido deve permanecer estável o tempo todo. O principal fator que afetou a viabilidade dos PBMs criopreservados foi a concentração de DMSO, com concentração ideal de 10%-20 % (v/v)28. Para minimizar os efeitos potencialmente nocivos do congelamento, diferentes fontes de proteínas, FBS ou BSA (com uma ampla gama de concentração de 40% até 100 %34) são frequentemente adicionadas ao meio de congelamento como componentes protetores naturais que podem aumentar a sobrevivência celular.
Devido ao alto potencial citotóxico do DMSO, recomenda-se primeiro dispersar PBMs em FBS, depois adicionar DMSO a PBMs já dispersos em FBS. Notavelmente, embora maiores concentrações de FBS (>40%) não apresentaram melhora na viabilidade celular, ao mesmo tempo, não causaram danos às células28. No entanto, o congelamento de monócitos é uma possível abordagem para superar questões de disponibilidade limitada de casacos buffy. No entanto, se desejar o uso de MDDCs e MDMs de PBMs frescos, as células imunes podem ser diferenciadas e utilizadas 5-8 dias após o isolamento7,16,17,,35,,36,,37. Se o planejamento experimental permitir, pelo menos 6 dias de diferenciação em MDDCs e MDMs são recomendados. No entanto, a consistência entre diferentes repetições no mesmo experimento, juntamente com inspeções rotineiras de suas expressões específicas de marcadores de superfície, são cruciais. A capacidade de resposta a um estímulo proinflamatório, como o LPS, após o tempo de diferenciação também deve ser verificada regularmente.
Muitas investigações utilizando a linha celular A549 têm sido realizadas na ALI, seja como monocultura ou combinadas com outros tipos de células (macrófagos, células dendríticas ou fibroblastos) em cocultura 3D modelo22,,24,,29,38. Utilizando este modelo de cocultura 3D, a citotoxicidade, o estresse oxidativo ou efeitos proinflamatórios de (nano-)materiais têm sido investigados por até 72 h1,17,21,,24,29. A semelhança do modelo com o tecido in vivo já foi investigada com base em imagens de escaneamento a laser confocal do modelo16. Ao montar o modelo, é importante considerar tanto a proliferação celular (que pode afetar A549 no modelo aqui apresentado) quanto o desempenho das células imunes primárias (não proliferando) (aqui, MDDCs e MDMs). Também é importante considerar que nem todos os monócitos positivos cd14 se diferenciam em MDDCs e MDMs, e que as células podem estar presentes tanto em formas anexadas quanto suspensas. Com base na natureza do conjunto de cocultura (aqui, ambos os tipos de células precisam se conectar à camada epitelial existente), recomenda-se usar apenas as subsusu populações aderentes de ambos os tipos de células imunes. Além disso, análises rotineiras de monócitos, monografia MDDC e MDM de resposta à moncultura para LPS, e expressão de marcadores de superfície específicos (CD14, CD163, CD86, CD93 ou CD206, dados não mostrados) sugeriram que 6 e 7 dias de diferenciação são os pontos de tempo ideais.
Embora um número realista de células epiteliais alveolares nos pulmões humanos corresponda a ~160.000 células/cm2, o número de células A549 contadas no modelo é de ~1.000.000 células/cm2 após 9 dias cultivados na inserção16,18. Assim, as limitações deste modelo in vitro precisam ser consideradas. Primeiro, a densidade das células epiteliais foi estabelecida com base em sua capacidade de formar uma camada confluente na membrana em crescimento. Também é importante mencionar que o A549 representa uma célula epitelial tipo II com uma forma cuboidal, ao contrário das células epiteliais tipo I, que são planas e outspread. Por outro lado, o número necessário de células imunes foi estabelecido com base na literatura e apresentado neste protocolo como número celular/área de superfície39,,40,,41. A densidade celular de MDDCs na faixa de 400 células/mm2 (4 células/cm2)16 é comparável à densidade celular de estado estável de 500-750 células/mm2 (5- 7 células/cm2) relatada a partir de estudos in vivo39. A densidade de MDMs neste modelo está dentro da mesma faixa de situação in vivo na região alveolar humana40.
A coloração madura do marcador macrófago (25F9) foi observada tanto no lado apical (onde os MDMs estão presentes) quanto no lado basal (ou seja, no local das células dendríticas). A translocação de células imunes através da membrana insere os poros é possível e também tem sido observada utilizando este modelo16, o que pode explicar as diferenças observadas nas intensidades de coloração. No entanto, outra explicação possível é que o marcador de macrófago maduro também pode ser expresso em células dendríticas, mas a expressão é altamente específica do doador42. Além disso, a intensidade da expressão 25F9 é muito maior em MDMs(Figura 7, Figura 8). Ambos os estímulos proinflamatórios (LPS e TNF-α) afetaram a integridade da barreira epitelial pulmonar em ambas as coculturas(Figura 7, Figura 8). Isso era esperado com base em publicações anteriores43,44 mostrando que citocinas proinflamatórias e produtos bacterianos perturbam a integridade das barreiras epiteliais.
O modelo multicelular 3D do epitélio alveolar humano, estabelecido e caracterizado anteriormente17, serviu como uma ferramenta poderosa e útil para avaliar respostas biológicas (ou seja, reações proinflamatórias agudas, resposta ao estresse oxidativo, distribuição de partículas e comunicação celular) in vitro21,24,,25,45. Os resultados confirmam a responsabilidade dos modelos de cocultura com estímulos proinflamatórios (aqui, LPS e TNF-α). A resposta foi ligeiramente aumentada ao usar células imunes de PBMs frescos; no entanto, não houve diferença estatisticamente significativa entre as coculturas utilizando PBMs frescos versus descongelados. Além disso, as reações proinflamatórias de ambos os modelos de cocultura foram maiores do que as das monoculturas de células epiteliais cultivadas sob as mesmas condições (ALI). Em resumo, o protocolo descreve a montagem de um modelo de cocultura de tecido epitelial 3D humano alveolar usando PBMs frescos ou descongelados para diferenciação em MDMs e MDDCs. Mostra-se que ambos os modelos são altamente responsivos a estímulos proinflamatórios; portanto, eles podem servir como ferramentas poderosas para avaliações potenciais de risco e toxicidade.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores gostariam de agradecer ao Dr. Miguel Spuch-Calvar pelo esquema de cocultura na Figura 3 e à Dra. Este estudo foi apoiado pelo projeto PATROLS, Programa de Pesquisa e Inovação Horizon 2020 da União Europeia sob o acordo de subvenção nº 760813, e pela Fundação Adolphe Merkle. B.D. agradece à Fundação Peter und Traudl Engelhorn pelo apoio financeiro.
Materiais
| Name | Company | Catalog Number | Comments |
| Benchmark microplate reader | does not have to be specific, for example BioRad, Cressier, Switzerland | ||
| Cell culture Incubator | does not have to be specific | ||
| Cell freezing container (for example Mr. Frosty) | does not have to be specific | ||
| Centrifuge | does not have to be specific | ||
| Confocal laser scanning microscope | does not have to be specific, for example | Zeiss LSM 710 meta | |
| Heamatocytometer, or automatic cell counter | does not have to be specific | ||
| Laminar bio-safety hood class II | does not have to be specific | ||
| MultiStand Macs (Macs Cell Separator) | Miltenyi, Germany | 130-042-303 | |
| pH meter | does not have to be specific | ||
| Phase contrast inverted light microscope | does not have to be specific | ||
| Pipette boy, pipettors (different volumes) | do not have to be specific | ||
| Scissors | do not have to be specific | ||
| Vacuum pump | does not have to be specific | ||
| Water bath | does not have to be specific | ||
| Disposable small equipment/glassware | Catalogue Number | ||
| 15 mL and 50 mL conical centrifuge tubes | does not have to be specific | ||
| 6- and 12-well cell culture plates, flat bottom, low evaporation lid, sterile | Falcon, Switzerland | 353046 and 353043 | |
| Cell culture inserts, transparent PET membrane, 12-well, 3 μm pore size | Falcon, Switzerland | 353181 | |
| Cell scrapper | does not have to be specific, for example VWR, Switzerland | 353085 | |
| Cryovials | do not have to be specific | ||
| Glass autoclaved Petri Dishes | do not have to be specific | ||
| LS Columns | Miltenyi, Germany | 130-042-401 | |
| Sterile filtration cup for vacuum filtration, 0.2 μm pore size | does not have to be specific, for example VWR, Switzerland | 10040-446 | |
| Sterile Lab Bottle compatible with Filtration cup (min. 100 mL) | does not have to be specific | ||
| Sterile pipettes | do not have to be specific | ||
| Chemicals | |||
| Bovine serum albumine (BSA) | Sigma-Aldrich, Switzerland | A7030-100g | |
| CD14+ MicroBeads human - magnetic beads | Miltenyi, Germany | 130-097-052 | |
| Deattachnig agent Trypsin-EDTA, 0.05%, phenol red | Gibco, Switzerland | 25300054 | |
| Density gradient medium Lymphoprep | Alere Technologies AS, Norway | 1114547 | |
| Dimethyl Sulfoxide (DMSO) | Sigma Aldrich, Switzerland | D2438 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich, Switzerland | E6758-100g | |
| Fetal bovine serum (heat inactivated) | Gibco, Switzerland | 10270-106 | |
| Human granulocyte-macrophage colony-stimulating factor (GM-CSF), premium grade | Miltenyi, Germany | 130-093-864 | |
| Human Interleukin 4 (IL-4), premium grade | Miltenyi, Germany | 130-095-373 | |
| Human macrophage colony-stimulating factor (M-CSF), premium grade | Miltenyi, Germany | 130-096-485 | |
| L-glutamine | Gibco, Switzerland | 25030-024 | |
| Lipopolysaccharid (LPS) from Escherichia coli | Sigma-Aldrich, Switzerland | 4524-5mg | |
| Paraformaldehyde (PFA) | Sigma-Aldrich, Switzerland | 158127 | |
| Penicilin-Streptomycin | Gibco, Switzerland | 15140-122 | |
| Phosphate Buffer Saline (PBS) | Gibco, Switzerland | 10010-015 | |
| Roswell Park Memorial Institute-1640 Medium (RPMI) | Gibco, Switzerland | 42401-018 | |
| Triton X-100 | Sigma-Aldrich, Switzerland | T8787 | |
| Trypan blue solution (0.4%) | Sigma Aldrich, Switzerland | ||
| Tumor necrosis factor alpha (TNF-α) | Immunotools | 11343015 | |
| Assays used for cytotoxicity, (pro-)inflammatory response | |||
| Cytotoxicity Detection Kit (LDH) | Roche, Switzerland | 11644793001 | |
| Human IL-6 DuoSet ELISA | R&D, Biotechne, Switzerland | DY206 | |
| Human IL-8/CXCL8 DuoSet ELISA | R&D, Biotechne, Switzerland | DY208 | |
| Immunostaining | |||
| 4′,6-diamidino-2-phenylindole (DAPI), concentration 2 μg/mL | Sigma-Aldrich, Switzerland | 10236276001 | |
| Goat anti-mouse IgG (H+L) Alexa Fluor 647 conjugated, concentration 20 μg/mL | Abcam, UK | ab150115 | |
| Goat anti-rabbit IgG antibody (H+L) Dylight 488 conjugated, concentration 10 μg/mL | Agrisera, Sweden | AS09 633 | |
| Mature Macrophage Marker Monoclonal Antibody, concentration 50 μg/mL | eBioScience, Thermo Fischer, Switzerland | 14-0115-82 | |
| Phalloidin rhodamine, concentration 0.264 µM | Molecular Probes, Life Technologies, Switzerland | R415 | |
| Recombinant Anti-CD83 antibody, 1:50 dillution | Abcam, UK | ab244204 |
Referências
- Rothen-Rutishauser, B., Blank, F., Mühlfeld, C., Gehr, P. In vitro models of the human epithelial airway barrier to study the toxic potential of particulate matter. Expert Opinion on Drug Metabolism and Toxicology. 4 (8), 1075-1089 (2008).
- Giard, D., et al. In vitro cultivation of human tumors: establishment of cell lines derived from a series of solid tumors. Journal of National Cancer Institute. 51 (5), 1417-1423 (1973).
- Ochs, M., Weibel, E. R., Grippi, M. A. Ch. 2: Functional Design of the Human Lung for Gas Exchange . Fishman's Pulmonary Diseases and Disorders, 5e. , (2008).
- Foster, K. A., Oster, C. G., Mayer, M. M., Avery, M. L., Audus, K. L. Characterization of the A549 Cell Line as a Type II Pulmonary Epithelial Cell Model for Drug Metabolism. Experimental Cell Research. 243 (2), 359-366 (1998).
- Guo, X. Y., Lu, M., Chen, X. Q., He, F. D., Li, A. Correlation study of biological characteristics of non-small cell lung cancer A549 cells after transfecting plasmid by microbubble ultrasound contrast agent. Asian Pacific Journal of Tropical Medicine. 9 (6), 582-586 (2016).
- Cooper, J. R., et al. Long Term Culture of the A549 Cancer Cell Line Promotes Multilamellar Body Formation and Differentiation towards an Alveolar Type II Pneumocyte Phenotype. PLoS ONE. 11 (10), 0164438 (2016).
- Bisig, C., Voss, C., Petri-Fink, A., Rothen-Rutishauser, B. The crux of positive controls - Proinflammatory responses in lung cell models. Toxicology In Vitro. 54, 189-193 (2019).
- Rothen-Rutishauser, B., et al. A newly developed in vitro model of the human epithelial airway barrier to study the toxic potential of nanoparticles. ALTEX. 25, (2008).
- Braakhuis, H. M., et al. Progress and future of in vitro models to study translocation of nanoparticles. Archives of Toxicology. 89 (9), 1469-1495 (2015).
- Thai, P., Chen, Y., Dolganov, G., Wu, R. Differential regulation of MUC5AC/Muc5ac and hCLCA-1/mGob-5 expression in airway epithelium. American Journal of Respiratory Cell and Molecular Biology. 33 (6), 523-530 (2005).
- Wu, J., et al. Characterization of air-liquid interface culture of A549 alveolar epithelial cells. Brazilian Journal of Medical and Biological Research. 51 (2), 6950 (2017).
- Shapiro, D. I., Nardone, L. L., Rooney, S. A., Motoyama, E. K., Munoz, J. L. Phospholipid biosynthesis and secretion by a cell line (A549) which resembles type II aleveolar epithelial cells. Biochimica and Biophysica Acta. 530 (2), 197-207 (1978).
- Balis, J., Bumgarner, S. D., Paciga, J. E., Paterson, J. F., Shelley, S. A. Synthesis of lung surfactant-associated glycoproteins by A549 cells: description of an in vitro model for human type II cell dysfunction. Experimental Lung Research. 6 (3-4), 197-213 (1984).
- Schurch, S., Gehr, P., Im Hof, V., Geiser, M., Green, F. Surfactant displaces particles toward the epithelium in airways and alveoli. Respiration Physiology. 80 (1), 17-32 (1990).
- Gehr, P., Schurch, S., Berthiaume, Y., Hof, V. I., Geiser, M. Particle Retention in Airways by Surfactant. Journal of Aerosol Medicine. 3 (1), 27-43 (2009).
- Blank, F., Rothen-Rutishauser, B., Gehr, P. Dendritic Cells and Macrophages Form a Transepithelial Network against Foreign Particulate Antigens. American Journal of Respiratory Cell and Molecular Biology. 36 (6), (2007).
- Rothen-Rutishauser, B. M., Kiama, S. G., Gehr, P. A three-dimensional cellular model of the human respiratory tract to study the interaction with particles. American Journal of Respiratory Cell and Molecular Biology. 32, (2005).
- Blank, F., Rothen-Rutishauser, B. M., Schurch, S., Gehr, P. An optimized in vitro model of the respiratory tract wall to study particle cell interactions. Journal of Aerosol Medicine. 19, (2006).
- Jardine, L., et al. Lipopolysaccharide inhalation recruits monocytes and dendritic cell subsets to the alveolar airspace. Nature Communications. 10 (1), 1999 (2019).
- Kopf, M., Schneider, C., Nobs, S. P. The development and function of lung-resident macrophages and dendritic cells. Nature Immunology. 16 (1), 36-44 (2015).
- Chortarea, S., et al. Repeated exposure to carbon nanotube-based aerosols does not affect the functional properties of a 3D human epithelial airway model. Nanotoxicology. 9 (8), 983-993 (2015).
- Hilton, G., Barosova, H., Petri-Fink, A., Rothen-Rutishauser, B., Bereman, M. Leveraging proteomics to compare submerged versus air-liquid interface carbon nanotube exposure to a 3D lung cell model. Toxicology In Vitro. 54, 58-66 (2019).
- Brandenberger, C., et al. Effects and uptake of gold nanoparticles deposited at the air-liquid interface of a human epithelial airway model. Toxicology and Applied Pharmacology. 242, (2010).
- Drasler, B., et al. Single exposure to aerosolized graphene oxide and graphene nanoplatelets did not initiate an acute biological response in a 3D human lung model. Carbon. 137, 125-135 (2018).
- Durantie, E., et al. Carbon nanodots: Opportunities and limitations to study their biodistribution at the human lung epithelial tissue barrier. Biointerphases. 13, (2018).
- Brandenberger, C., et al. Quantitative evaluation of cellular uptake and trafficking of plain and polyethylene glycol-coated gold nanoparticles. Small. 6 (15), 1669-1678 (2010).
- Tomašek, I., et al. Combined exposure of diesel exhaust particles and respirable Soufrière Hills volcanic ash causes a (pro-)inflammatory response in an in vitro multicellular epithelial tissue barrier model. Particle and Fibre Toxicology. 13 (1), 67 (2016).
- Nazarpour, R., et al. Optimization of Human Peripheral Blood Mononuclear Cells (PBMCs) Cryopreservation. International Journal of Molecular and Cellular Medicine. 1 (2), 88-93 (2012).
- Endes, C., et al. An in vitro testing strategy towards mimicking the inhalation of high aspect ratio nanoparticles. Particle and Fibre Toxicology. 11 (1), (2014).
- Ju, X., et al. The Analysis of CD83 Expression on Human Immune Cells Identifies a Unique CD83+-Activated T Cell Population. Journal of Immunology. 197 (12), 4613-4625 (2016).
- Lenz, A. G., et al. Inflammatory and Oxidative Stress Responses of an Alveolar Epithelial Cell Line to Airborne Zinc Oxide Nanoparticles at the Air-Liquid Interface: A Comparison with Conventional, Submerged Cell-Culture Conditions. BioMed Research International. , 12 (2013).
- Germann, A., Schulz, J. C., Kemp-Kamke, B., Zimmermann, H., von Briesen, H. Standardized serum-free cryomedia maintain peripheral blood mononuclear cell viability, recovery, and antigen-specific T-cell response compared to fetal calf serum-based medium. Biopreservation and Biobanking. 9 (3), 229-236 (2011).
- Weinberg, A., et al. Optimization and Limitations of Use of Cryopreserved Peripheral Blood Mononuclear Cells for Functional and Phenotypic T-Cell Characterization. Clinical and Vaccine Immunology. 16 (8), 1176 (2009).
- Freshney, R. I., Freshney, R. I. . Culture of animal cells: a manual of basic technique. , 321-334 (2005).
- Lehmann, A. B. C., Blank, F., Gehr, P., Rothen-Rutishauser, B., Yarmush, M. L., Langer, R. S. . Alternatives to animal testing. , 239-260 (2010).
- Steiner, S., et al. Reduction in (pro-)inflammatory responses of lung cells exposed in to diesel exhaust treated with a non-catalyzed diesel particle filter. Atmospheric Environment. 81, 117-124 (2013).
- Martinez, F. O., Gordon, S., Locati, M., Mantovani, A. Transcriptional Profiling of the Human Monocyte-to-Macrophage Differentiation and Polarization: New Molecules and Patterns of Gene Expression. The Journal of Immunology. 177 (10), 7303 (2006).
- Chortarea, S., et al. Profibrotic activity of multi-walled carbon nanotubes upon prolonged exposures in different human lung cell types. Applied In Vitro Toxicology. 5 (1), (2019).
- Holt, P. G. Pulmonary Dendritic Cells in Local Immunity to Inert and Pathogenic Antigens in the Respiratory Tract. Proceedings of the American Thoracic Society. 2 (2), 116-120 (2005).
- Pinkerton, K. E., Gehr, P., Castañeda, A., Crapo, J. D., Parent, R. A. . Comparative Biology of the Normal Lung (Second Edition). , 105-117 (2015).
- Crapo, J., Barry, B., Gehr, P., Bachofen, M., Weibel, E. R. Cell number and cell characteristics of the normal human lung. American Review of Respiratory Disease. 126 (2), 332-337 (1982).
- Maniecki, M. B., Møller, H. J., Moestrup, S. K., Møller, B. K. CD163 positive subsets of blood dendritic cells: The scavenging macrophage receptors CD163 and CD91 are coexpressed on human dendritic cells and monocytes. Immunobiology. 211 (6), 407-417 (2006).
- Chignard, M., Balloy, V. Neutrophil recruitment and increased permeability during acute lung injury induced by lipopolysaccharide. American Journal of Physiology-Lung Cellular and Molecular Physiology. 279 (6), 1083-1090 (2000).
- Coyne, C. B., et al. Regulation of Airway Tight Junctions by Proinflammatory Cytokines. Molecular Biology of the Cell. 13 (9), 3218-3234 (2002).
- Durantie, E., et al. Biodistribution of single and aggregated gold nanoparticles exposed to the human lung epithelial tissue barrier at the air-liquid interface. Particle and Fibre Toxicology. 14 (49), (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados