Method Article
Modèle alvéolaire humain multicellulaire composé de cellules épithéliales et de cellules immunitaires primaires pour l’évaluation des risques
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Présenté ici est un protocole pour l’isolement primaire de monocyte de sang humain aussi bien que leur différenciation dans les macrophages et les cellules dendritiques et l’assemblage avec des cellules épithéliales dans un modèle humain multicellulaire de poumon. Les réponses biologiques des cocultures composées de cellules immunitaires différenciées des monocytes fraîchement isolés ou décongelés, lors de l’exposition à des stimuli proinflammatoires, sont comparées.
Résumé
Un modèle de coculture de cellules alvéolaires humaines est décrit ici pour la simulation de la barrière épithéliale alvéolaire composée de cellules épithéliales alvéolaires de type II et de deux types de cellules immunitaires (c.-à-d. les macrophages humains dérivés des monocytes [MDM] et les cellules dendritiques [MDDC]). Un protocole d’assemblage du modèle multicellulaire est fourni. Les cellules épithéliales alvéolaires (lignée cellulaire A549) sont cultivées et différenciées dans des conditions submergées sur des inserts perméables dans des puits à deux chambres, puis combinées avec des MDM et des MDDC différenciés. Enfin, les cellules sont exposées à une interface air-liquide pendant plusieurs jours. Comme les cellules immunitaires primaires humaines doivent être isolées des couches de buffy humaines, les cellules immunitaires différenciées des monocytes frais ou décongelés sont comparées afin d’adapter la méthode en fonction des besoins expérimentaux. Les modèles tridimensionnels, composés de cellules alvéolaires avec des cellules immunitaires nouvellement isolées ou décongelées dérivées des monocytes, montrent une augmentation statistiquement significative de la libération de cytokine (interleukines 6 et 8) lors de l’exposition à des stimuli proinflammatoires (lipopolysaccharide et facteur de nécrose tumorale α) par rapport aux cellules non traitées. D’autre part, il n’y a pas de différence statistiquement significative entre la libération de cytokine observée dans les cocultures. Cela montre que le modèle présenté est sensible aux stimuli proinflammatoires en présence de MDM et de MDDC différenciés des monocytes sanguins périphériques frais ou décongelés (PBM). Il s’agit donc d’un outil puissant pour l’étude de la réponse biologique aiguë à différentes substances, y compris les médicaments aérosols ou les nanomatériaux.
Introduction
Les cultures de cellules pulmonaires in vitro offrent des plates-formes rentables, robustes et bien contrôlées pour évaluer les dangers des aérosols1. En tant que système cellulaire modèle pour les pneumocytes alvéolaires humains, la lignée épithéliale a549 isolée d’un adénocarcinome pulmonaire est souvent utilisée2. Ces cellules représentent des cellules épithéliales de type II squamous de la région alvéolaire3 et sont une lignée de cellules pulmonaires largement utilisée pour l’évaluation des risques et de la toxicité1,4,5,6,7,8,9,10. La lignée cellulaire A549 possède des caractéristiques pertinentes des cellules épithéliales alvéolaires de type II, telles que la présence de corps lamellaires caractéristiques contenant des phospholipides densément emballés3.
Il a été démontré que lorsque les cellules sont cultivées à une interface air-liquide (ALI), le surfactant est libéré sur le côté apical des cellules épithéliales exposées à l’air, réduisant la tension superficielle11,12,13. Cette caractéristique est particulièrement importante dans les enquêtes sur les risques respiratoires et la toxicité des nanomatériaux. Une fois que les nanomatériaux/substances toxiques inhalés sont déposés dans la région alvéolaire, ils interagissent d’abord avec le surfactant pulmonaire et sont déplacés par des forces mouillantes dans l’hypophase aqueuse, où l’interaction avec les cellules pulmonaires a lieu14,15. Même si les cellules A549 forment une monocouche (qui peut se superposer en multicouches à des délais ultérieurs lorsqu’elles sont cultivées à ALI) et produire du surfactant, un inconvénient est leur formation de jonction serrée insuffisante, résultant en de faibles valeurs de résistance électrique transepitheliale, mais présentant toujours une barrière fonctionnelle contre la translocation intercellulaire (nano)particules16,17,18.
Dans les poumons, il existe une variété de populations de cellules immunitaires, y compris les cellules phagocytiques et professionnelles présentant des antigènes (c.-à-d. les macrophages et les cellules dendritiques) qui communiquent directement par contact cellule-cellule ou signalisation intercellulaire pour contrôler et maintenir l’homéostasie. Les macrophages et les cellules dendritiques sont des effecteurs immunitaires innés critiques et des initiateurs de la réponse immunitaire adaptative19. Les cellules dendritiques résidant à l’intérieur ou sous l’épithélium peuvent former des protrusions à travers l’épithélium jusqu’au lumen pour attraper des antigènes. Les macrophages alvéolaires sont situés sur la surface apicale de l’épithélium et agissent comme cellules sentinelles, représentant la première défense cellulaire contre les matières étrangères ainsi que les infections bactériennes, virales et fongiques. Leur plasticité phénotypique permet l’induction rapide de réactions proinflammatoires en réponse à de tels stimuli ainsi que le déplacement dans le déclenchement des réactions anti-inflammatoires (c.-à-d. inhibiteurs)20.
Pour simuler la barrière du tissu épithélial alvéolaire humain, nous avons établi un modèle de coculture triple avec des cellules A549 complétées par des macrophages sanguins humains dérivés (MDM) et des cellules dendritiques (MDDCs) sur les côtés apical et basal, respectivement17. La culture de ce modèle à ALI a été précédemment signalé16, même jusqu’à 72 h post-exposition21. Les réponses immunitaires aiguës aux nanotubes de carbone ont été significativement améliorées dans la culture cellulaire exposée à l’ALI par rapport aux conditions submergées22. Le modèle de coculture, cultivé et exposé à différents matériaux chez ALI, a déjà été utilisé pour étudier la cytotoxicité, le stress oxydatif et les réponses inflammatoires lors des expositions à l’oxyde de zinc,23 matériaux liés au graphène24, nanoparticules d’or25,26, nanotubes de carbone21, et les cendres volcaniques et les particules d’échappement diesel27.
En outre, le rôle important des macrophages et des cellules dendritiques en tant que cellules effecteuses immunitaires dans un modèle de poumon humain in vitro a été confirmé. En particulier, une réponse proinflammatoire accrue dans le modèle n’a été observée qu’en présence de cellules immunitaires par rapport aux systèmes de monoculture7. Les inconvénients potentiels de l’utilisation des cellules immunitaires primaires dérivées des monocytes sont l’accessibilité limitée des PBM ainsi que la variation de donneur à donneur. Comme solution à ces inconvénients potentiels, présenté ici est un protocole introduisant la cryoconservation des PBMs28 fraîchement isolés pour l’assemblage du modèle de culture cellulaire. Le but de cette étude est de démontrer l’assemblage du modèle de tissu épithélial alvéolaire humain 3D, y compris l’isolement des PBM des manteaux buffy humains. La réactivité aux stimuli proinflammatoires est comparée au modèle composé de MMD et de MDDC différenciés des PBM frais ou différenciés des PBM congelés/décongelés.
Travailler avec des échantillons de sang humain non testés implique des soins spécifiques pour prévenir la transmission potentielle de maladies infectieuses, telles que le VIH (virus de l’immunodéficience humaine), l’hépatite B et l’hépatite C. Par conséquent, l’utilisation de mesures de protection individuelle telles que des gants, des robes, des masques et une protection oculaire sont cruciales et doivent être conformes aux principes de bonnes pratiques de laboratoire. Ces protections réduisent le risque d’exposer la peau ou les muqueuses à des liquides potentiellement infectieux. En outre, pour ceux qui s’occupent des manteaux et des PBM, la vaccination contre le virus de l’hépatite B est obligatoire, et les taux d’anticorps anti-hépatite B doivent être supérieurs à 100 UI/L (les exigences législatives spécifiques à chaque pays doivent être prises en compte). En outre, tous les travaux doivent être effectués dans les laboratoires de niveau 2 de biosécurité (les exigences législatives propres à chaque pays doivent être prises en compte). Des précautions standard s’visant à travailler en laboratoire et à manipuler la culture des cellules de mammifères, y compris la manipulation des déchets, devraient être adoptées lors de la conduite de l’ensemble du protocole.
Protocole
Les travaux portant sur des monocytes primaires isolés du sang humain ont été approuvés par le comité de l’Office fédéral de santé publique suisse (numéro de référence: 611-1, Meldung A110635/2) pour l’Institut Adolphe Merkle.
1. Isolement des monocytes sanguins périphériques (PBM) des manteaux buffy humains
NOTE: La section suivante décrit l’isolement des cellules immunitaires à partir d’un sac de 50 mL d’un manteau buffy, acheté au Centre suisse de transfusion à Berne, en Suisse.
- Préparation des réactifs
- Préparer 100 mL de tampon de séparation magnétique par pelage : 0,5 % [w/v] albumine de sérum bovin (BSA; saline tamponnée par phosphate [PBS]) avec 2 mM d’acide éthylènediaminetétraacétique (EDTA) et ajuster au pH = 7,2, filtre stérile avec 0,22 μm de la taille des pores). Conserver à 4 °C tout au long de la procédure.
- Préparer le milieu de culture cellulaire (CCM): RPMI 1640 avec 10% [v/v] sérum bovin fœtal (FBS), 1% [v/v] L-glutamine (ici, 2 mM L-glutamine), et 1% [v/v] pénicilline-streptomycine (ici, 100 unités/mL pénicillin et 100 μg/M streptomycine).
REMARQUE : La quantité requise de chaque réactif dépend du nombre de cellules à semer dans les étapes suivantes.
- Isolement des PBM
REMARQUE : Tout le verre et la plastique doivent être stérilisés avant utilisation. Pour des raisons de sécurité, l’utilisation de plastique est recommandée lors de la manipulation d’échantillons de sang humain afin de réduire le risque de blessures avec la verrerie.- Utilisez des ciseaux pour ouvrir l’extrémité du tuyau du sac contenant le manteau buffy.
- Distribuez le manteau buffy en versant le contenu du sac à travers le conduit du sac directement dans deux tubes coniques de 50 mL (~25 mL chacun).
- Verser doucement ou pipette PBS dans les tubes pour atteindre 50 mL volumes. Mélanger le contenu en tournant le tube doucement à l’envers 3x.
- Diviser le mélange buffy coat-PBS en quatre nouveaux tubes de centrifugeuse conique de 50 mL en faisant 25 ml de mélange dans chaque tube frais.
- Pose lentement 13 mL de milieu de gradient de densité sous le mélange buffy manteau-PBS à l’aide d’une pipette sérologique de 10 mL. Détachez la pipette remplie du support de pipette et branchez immédiatement l’ouverture supérieure de la pipette avec un pouce pour éviter toute fuite supplémentaire du milieu de gradient de densité dans le mélange buffy coat-PBS.
REMARQUE : En maintenant l’ouverture supérieure avec le pouce, placez la pipette remplie au fond du tube conique de centrifugeuse de sorte que le milieu de gradient de densité s’écoule lentement sous le mélange buffy manteau-PBS, laissant environ 1 ml du milieu de gradient de densité à l’intérieur de la pipette. - Répétez l’étape 1.2.5 avec les trois autres tubes contenant le mélange buffy coat-PBS.
- Centrifugez les quatre tubes contenant les mélanges pendant 20 min à 1 000 x g et 25 °C en mode de freinage lent. Utiliser des supports avec couvercles protecteurs pour la centrifugation.
- Ouvrez le couvercle de chaque tube, retirez la couche supérieure contenant du plasma et des plaquettes à l’aide d’une pipette sérologique et jetez-les dans un contenant de déchets liquides à risque biologique.
- Utilisez une pipette sérologique pour la collecte de la couche de cellules monococleaires du sang périphérique, qui apparaît sous la forme d’une petite fraction turbide blanchâtre (~2–3 mm d’épaisseur) entre le plasma et les couches moyennes de gradient de densité. La pastille contient des globules rouges au fond. Évitez de transférer des érythrocytes qui forment la couche la plus basse. Répétez cela pour les quatre tubes.
REMARQUE : Les cellules mononucléaires périphériques de sang se composent des PBM et des lymphocytes. Les PBM seront séparés des lymphocytes plus tard lors de la séparation magnétique du CD14+. - Piscine des cellules mononucléaires périphériques du sang à partir de quatre tubes en deux tubes de 50 mL.
- Remplissez les deux tubes de PBS à 50 mL et couvrez-les d’un couvercle.
- Jetez les restes d’érythrocytes et de plasma des quatre tubes d’origine dans un contenant de déchets liquides biorisards.
- Centrifugez les deux tubes pendant 8 min à 500 x g et 18–20 °C à une vitesse régulière de centrifugeuse.
- Après la centrifugation, retirer le supernatant à l’aide d’une pipette sérologique et le jeter dans un contenant de déchets liquides à risque biologique.
- Resuspendez les cellules avec 5 mL de PBS à l’aide d’une pipette sérologique.
- Piscinez les suspensions cellulaires en un tube de centrifugeuse conique de 50 mL et remplissez-les à 50 ml avec PBS.
- Utilisez 5 μL de la suspension cellulaire pour compter les cellules avec un compteur cellulaire à l’aide de la méthode d’exclusion du bleu trypan (45 μL).
- Pipette 10 μL de la solution trypan blue-PBMs dans une chambre de compteur cellulaire et compter le nombre de cellules par le protocole de comptage standard. Utilisez l’équation 1 pour calculer le nombre total de cellules, CT.
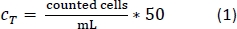
- Après avoir compté les cellules, centrifuge le tube de 50 ml comme fait à l’étape 1.2.13.
- Sélection positive CD14
- Ouvrez doucement le couvercle de chaque tube, puis retirez et jetez le supernatant à l’aide d’une pipette sérologique sans perturber la pastille.
- Ajoutez la quantité calculée (équation 2) de la mémoire tampon de séparation magnétique (ici, 80 μL de tampon par 1 x 107 cellules totales) et resuspendez la pastille de cellule en canalisant la solution de haut en bas.
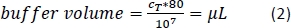
- Calculer à l’aide de l’équation 3 (ici, 10 μL par 1 x 107 cellules totales) le volume correspondant de perles magnétiques CD14+ et de pipette le volume approprié.
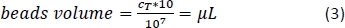
- Bien mélanger en faisant monter et descendre, fermer le couvercle et incuber la solution à 4 °C pendant 15 min.
- Lors de l’incubation, remplissez le tube jusqu’à 50 ml de tampon de séparation magnétique.
- Centrifugeuse comme fait à l’étape 1.2.13.
- Remplacer et jeter le supernatant à l’aide d’une pipette sérologique sans perturber la pastille cellulaire.
- Pipette la quantité correspondante de tampon de séparation magnétique (Équation 4; ici, 500 μL de tampon par 1 x 108 cellules) et mélanger doucement en faisant monter et descendre 3x.
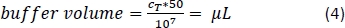
- Désinfectez la station de séparation magnétique en la pulvérisant et en l’essuyant à l’aide d’un agent stérilisant. Placez dans le capot de flux laminaire avec la colonne pour la séparation magnétique.
- Placez la colonne de séparation magnétique dans le champ magnétique et placez un tube de centrifugeuse conique vide de 50 m L directement sous la colonne pour la collecte des cellules de lavage et non étiquetées (c.-à-d. les déchets).
- Rincez la colonne de séparation magnétique en canalisant 3 mL de tampon de séparation magnétique dans la colonne. Ne laissez pas la colonne sécher tout au long de la procédure.
- Préparer un tube de centrifugeuse conique de 15 mL et une pipette de 1 mL de tampon de séparation magnétique.
- Appliquer la suspension cellulaire (préparée à l’étape 1.3.8) à la colonne de séparation magnétique. Dans le tube de centrifugeuse conique de 50 ml sous le filtre, recueillir les cellules non étiquetées qui sont passées à travers.
REMARQUE : Ne dépassez pas 2 x 109 cellules par colonne pour éviter le blocage de la colonne. - Dès que le réservoir de colonne est vide (c.-à-d. lorsque les cellules ont traversé la colonne), appliquez 3 mL de tampon de séparation magnétique à l’aide d’une pipette sérologique et laissez-la passer à travers la colonne. Répétez ce 3x.
- Retirez la colonne de séparation magnétique du séparateur magnétique en tirant doucement avec les mains, puis placez-la dans un tube de 15 mL contenant 1 mL de tampon de séparation magnétique pré-pipetted (préparé à l’étape 1.3.12).
- Ajoutez 5 mL de tampon de séparation magnétique à la colonne et chassez les cellules étiquetées magnétiquement en poussant fermement le piston dans la colonne.
- Préparation des réactifs pour la différenciation MDM et MDDC
- Compter les cellules avec un compteur de cellules à l’aide de la méthode d’exclusion bleue trypan telle qu’elle est effectuée à l’étape 1.2.17.
- Calculer les volumes requis de CCM ou de FBS pour d’autres étapes comme suit : soit le volume de CCM correspondant à une densité cellulaire de 1 x10 6 cellules/mL (étape 1.5.1), soit le volume de FBS correspondant à une densité cellulaire de 6 x 106 cellules par 0,9 mL de FBS (étape 1.6.3).
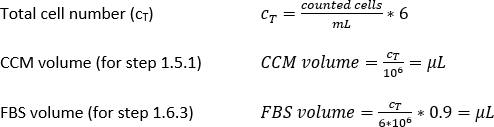
- Fermez le couvercle, placez le tube dans la centrifugeuse et centrifugez comme fait à l’étape 1.2.13. Retirer et jeter le supernatant sans perturber la pastille cellulaire. Passez à l’étape 1.5 pour l’ensemencement cellulaire ou à l’étape 1.6 pour la congélation cellulaire.
- Ensemencement et différenciation pbm en MDM et MDDC
- Resuspendez le granulé cellulaire dans le volume calculé de CCM tel que calculé à l’étape 1.4.2 (ici, une concentration finale de 1 x 106 cellules/mL) par pipeting de haut en bas 3x.
- Pipette le nombre de cellules destinées à se différencier en MDM et MDDCs dans des tubes de centrifugeuse conique séparés à l’aide d’une pipette sérologique.
- Pipette différenciant les facteurs de la CCM avec les PBM et bien mélanger en faisant des pipes de haut en bas. Les facteurs de différenciation sont appliqués comme suit :
- Pour les MDDC : concentration finale de 10 ng/mL interleukine-4 (IL-4) et 10 ng/mL facteur stimulant colonie de granulocyte-macrophage (GM-CSF).
- Pour les MDM : concentration finale de 10 ng/mL macrophage facteur stimulant la colonie (M-CSF).
- Pipette les suspensions cellulaires en CCM avec les facteurs de différenciation ajoutés en 6 plaques de puits en distribuant 3 mL de la suspension par puits (correspond à 3 x10 6 cellules/puits, c’est-à-dire 1 x 106 cellules/mL).
- Placez les 6 plaques de puits dans un incubateur de culture cellulaire (37 °C, 5 % CO2)et laissez-les différencier pendant 6 jours sans rafraîchir le CCM.
REMARQUE : La différenciation varie de 5 à 8 jours en fonction de la disponibilité locale des manteaux buffy et de la configuration expérimentale, à condition que l’efficacité de différenciation soit déterminée à l’aide des techniques appropriées (voir la section de discussion).
- Gel du PBM
- Resuspendez la pastille cellulaire dans un milieu cryoprotecteur (ici, FBS et sulfoxyde de diméthyle [DMSO; cytotoxique]) à un rapport de 9:1 (v/v) en pipeting un volume de FBS préguerre. Cela correspond à une concentration cellulaire finale de 6 x 106 cellules/mL, compte tenu d’un ajout supplémentaire de 10% DMSO (v/v).
- Marquez le nombre désiré de cryocials dans le capot d’écoulement laminaire (c.-à-d. enregistrez la date, le code d’isolement et le nombre de cellules).
- Pipette 0,9 mL de suspension cellulaire en FBS pur (ici, 6 x 106 cellules dans 0,9 mL de FBS) à chaque cryocial. Par la suite, lentement pipette 0,1 mL de DMSO et bien mélanger la suspension en tournant les cryocials de haut en bas 3x.
- Transférer les cryocials dans un contenant de congélation cellulaire et le placer immédiatement à -80 °C pendant 24 h.
- Après 24 h, retirer les cryocials du congélateur et du récipient à -80 °C et les placer dans le réservoir d’azote liquide approprié pour le stockage cellulaire.
- Dégel et différenciation des PBM en MDM et MDDC
- Chauffer tous les réactifs requis à 37 °C dans un bain d’eau (~20–30 min).
- Préparer le nombre approprié de 6 plaques de puits correspondant au nombre de cellules décongelées (ici, une plaque pour 1,8 x 107 cellules, c’est-à-dire 3 cryoviens). Pipette 2 mL de CCM à chaque puits dans des conditions aseptiques. Placer les plaques dans l’incubateur (5 % CO2, 37 °C) pendant 15 min pour permettre au pH d’équilibrer.
- Prenez la quantité requise de cryocials avec des cellules congelées d’un réservoir d’azote liquide et faites-les tourbillonner doucement dans un bain d’eau de 37 °C (1–2 min) pour assurer un dégel uniforme de la suspension cellulaire.
- Retirez le cryocial du bain d’eau et décontaminez-le avec un agent stérilisant, en veillant à ce que l’agent n’interagisse pas avec le couvercle et l’anneau O.
REMARQUE : Ici, toutes les étapes doivent être effectuées dans des conditions aseptiques. - Préparer le nombre approprié de tubes de centrifugeuse conique de 15 mL correspondant au nombre de cryoviens à décongeler (ici, 6 x 106 cellules/tube). Pipette 9 mL de CCM préguerre dans chaque tube.
- Pipette lentement (goutte à goutte) le contenu du cryocial dans un tube contenant CCM. Fermez le couvercle, répétez pour chaque tube et centrifugez à 200 x g pendant 5 min à une vitesse régulière de centrifugeuse.
- Jetez le supernatant sans déranger le granulé.
- Resuspendez le granulé de chaque tube (qui contient des cellules d’un cryocial) en 2 ml de CCM préguerre en faisant monter et descendre à l’aide d’une pipette sérologique (densité cellulaire correspondant à 3 x 106 cellules/mL).
- De chaque tube, pipette les cellules réessublés dans deux puits (1 ml par puits) d’une plaque de 6 puits contenant 2 ml de CCM précédemment préparé pour atteindre une densité cellulaire de 3 x 106 cellules/puits (correspondant à une concentration finale de 1 x 106 cellules/mL). Répétez cela pour tous les autres tubes.
- Procéder à la différenciation décrite à la section 1.5.3.
- Placez les 6 plaques de puits dans un incubateur de culture cellulaire (37 °C, 5 % CO2)et laissez-les différencier pendant 6 jours sans rafraîchir le CCM.
2. Modèle de coculture à trois cellules du tissu épithélial alvéolaire humain
REMARQUE : Cette section fournit des instructions sur les volumes et les numéros de cellules correspondant à 12 inserts de plaque de puits. La figure 1 résume un échéancier proposé pour l’assemblage des modèles.
- Ensemencement des cellules épithéliales (ligne cellulaire A549)
- Culture des cellules épithéliales selon les recommandations fournies par le fournisseur (ATTC). En bref, sous-culture des cellules dans CCM à 80% confluence cellulaire (environ, 2x–3x par semaine).
REMARQUE : Sous-culture A549 pour au moins quatre passages avant la composition du modèle de coculture, en utilisant des cellules A549 dans une gamme de passage de 5 à 25. - Pipette 1,5 mL de CCM préguerre en 12 plaques de puits (le nombre de puits correspond au nombre souhaité de modèles).
- Placez les inserts individuels de culture cellulaire de 12 puits dans les puits d’une plaque de 12 puits à l’aide de pinces stérilisées.
- Détacher les cellules d’un flacon selon le protocole de sous-culture (c.-à-d. à l’aide d’un agent de détachement, retirer l’agent par centrifugation comme fait à l’étape 1.2.13). Réessiper dans le volume approprié de CCM correspondant à la concentration cellulaire finale d’A549 (ici, 50 x 104 cellules/mL; 0,5 mL de suspension cellulaire par insert, c’est-à-dire 25 x 104 cellules/insertion, ce qui correspond à une densité d’ensemencement de 27,8 x 104 cellules/cm2).
- Pipette 0,5 mL de la suspension cellulaire (c.-à-d. 25 x 104 cellules/insertion) dans le côté apical de l’insert à l’aide d’une pipette de 1 mL.
- Couvrir les plaques de couvercles et les placer dans un incubateur de culture cellulaire (37 °C, 5 % CO2) pendant 4 jours.
REMARQUE : Vérifiez régulièrement la confluence des cellules A549 sous un microscope à contraste de phase.
- Culture des cellules épithéliales selon les recommandations fournies par le fournisseur (ATTC). En bref, sous-culture des cellules dans CCM à 80% confluence cellulaire (environ, 2x–3x par semaine).
- Ensemencement MDDC
- Aspirate CCM avec cellules non attachées dans les 6 plaques de puits contenant des MDDC.
- Ajouter 1 mL de CCM préguerre frais à chaque puits.
- Utilisez un grattoir cellulaire, détachez (gratter) les MDDC adhérents de chaque puits, lavez doucement les puits avec les 1 ml existants de CCM 3x, et combinez-les en un seul tube conique de centrifugeuse.
- Compter les cellules avec un compteur cellulaire à l’aide de la méthode d’exclusion du bleu trypan à l’aide de 10 μL de suspension cellulaire et de 10 μL de solution bleue trypan.
- Centrifuge la suspension cellulaire comme fait à l’étape 1.2.13.
- Calculer le volume CCM requis pour la resuspension (Équation 5) :
Densité MDDC requise = 42 x 104 cellules/mL; chaque insertion nécessite 6,3 x 104 cellules, ce qui correspond à une densité cellulaire ensemencée de 7 x 104 cellules/cm2 (ici, 150 μL ajoutés sur 0,9 cm2 à l’étape 2.2.10.).
Volume de CCM pour la resuspension de cellules (Vm; Équation 5) :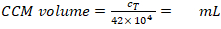
- Augmenter doucement et jeter le CCM de la chambre supérieure de 12 plaques de puits avec la croissance de l’A549 sur les inserts.
- Placez les inserts avec des cellules A549 en position à l’envers dans une boîte de Pétri stérile à l’aide de pinces stérilisées. Préparer un tube de centrifugeuse conique (50 ml) avec PBS et pré-humidifier un grattoir cellulaire.
- Gratter les cellules A549 de la surface basale de l’insert (c’est-à-dire la partie supérieure à la position à l’envers), qui devrait se développer à travers les pores des inserts.
REMARQUE : Rincez le grattoir avec du PBS (préparé dans un tube) entre le grattage des échantillons individuels et gardez-le humide tout au long de la procédure. - Lors de la centrifugation (étape 2.2.5), l’aspirate et le rejet du supernatant, puis redisper le granulé MDDC dans la quantité calculée de CCM (étape 2.2.6) et de pipette de haut en bas 3x.
- Pipette 150 μL de la suspension cellulaire sur le dessus de chaque insert de sorte que toute la surface basale de l’insert est également recouverte du liquide et ne contient pas de bulles.
- Couvrir le plat d’un couvercle et placer dans un incubateur de culture cellulaire pendant 70 min. Apirate le CCM des plaques de culture cellulaire (où les inserts ont été initialement placés), jeter dans un déchet liquide biohazard, et pipette 1,5 mL de CCM frais dans chaque puits. Couvrir la plaque d’un couvercle et placer dans l’incubateur cellulaire (37 °C, 5% CO2).
REMARQUE : Ne dépassez pas la période mentionnée ci-dessus pour éviter de sécher les cellules. - Après l’incubation, maintenez soigneusement chaque insert avec des pinces stérilisées et placez-les dans les plaques contenant du CCM dans une position ordinaire. Couvrir la plaque d’un couvercle et la retourner à l’incubateur cellulaire (37°C, 5% CO2).
- Semis de macrophage (MDM)
- Prenez 6 plaques de puits contenant des MDM prédifférentiated. Placez-les de l’incubateur cellulaire à un capot de flux laminaire.
- Aspirate et jeter CCM avec MDM non attaché cultivés dans 6 plaques de puits, et pipette 1 mL de CCM préassée fraîche dans chaque puits.
- À l’aide d’un grattoir cellulaire, retirez doucement les MDM adhérents des puits individuels (comme c’est le cas à l’étape 2.2.3 pour les MDDC).
- Pipette 10 μL de bleu trypan dans un puits ou un tube et ajouter 10 μL de la suspension MDM pour obtenir la dilution finale de 1:1 (v/v). Comptez le nombre de MDM à l’aide du protocole de comptage approprié.
- Centrifuge la suspension cellulaire comme fait à l’étape 1.2.13.
- Calculer le volume requis (équation 6) :
Densité MDM requise = 2,5 x 104 cellules/mL en CCM (ici, chaque insert nécessite 1,25 x 104 cellules en CCM de 0,5 mL, ce qui correspond à une densité cellulaire ensemencée de 1,4 x 104 cellules/cm2). (6)
(6) - Lors de la centrifugation, remplacer et jeter le supernatant, redisper le granulé MDM dans la quantité calculée de CCM (étape 2.3.6), et pipette de haut en bas 3x.
- Soigneusement pipette 0,5 mL de la suspension MDM (préparé à l’étape 2.3.7) sur la paroi des inserts de culture cellulaire avec A549 et MDDCs (pas directement sur les cellules épithéliales) à l’aide d’une pipette de 1 mL. Couvrir les plaques de couvercles et les placer dans un incubateur de culture cellulaire (37 °C, 5 % CO2) pendant 24 h.
- Transfert du modèle de coculture à l’interface air-liquide (ALI)
- À la fin de la période d’incubation de 24 h (±2 h) du modèle assemblé dans un incubateur de culture cellulaire, aspirate et jetez le CCM des parties apicales et basales des inserts de culture cellulaire et des puits.
- À l’aide de pinces stérilisées, soulevez les inserts individuels des puits et la pipette 0,6 mL de CCM frais préguerre à chaque puits à l’aide d’une pipette de 1 mL. N’ajoutez pas de CCM sur le côté apical de l’insert.
- Couvrir les plaques de couvercles et les placer dans un incubateur de culture cellulaire (37 °C, 5 % CO2) pendant 24 h avant utilisation.
3. Exposition à certains contrôles positifs (stimuli connus pour induire une réponse proinflammatoire)
NOTE : L’exposition des modèles de coculture à un lipopolysaccharide proinflammatoire connu de stimulus de stimulus (LPS)7 et le facteur de nécrose de tumeur de cytokine proinflammatoire α (TNF-α)7 est employé pour illustrer la réactivité du modèle. En outre, l’exposition à un détergent (Triton X-100) est utilisée pour confirmer la sensibilité d’un test de déshydrogénase de lactate (LDH).
- Préparer les solutions de contrôle positives : stock de LPS (1 mg/mL dans l’eau distillée), stock de TNF-α (100 μg/mL dans l’eau distillée) et Triton-X 100 (2 % [v/v] dans pbs).
- Sur 24 h d’incubation du modèle de coculture aux conditions ALI, remplacer et jeter le supernatant du compartiment basal. À l’aide de pinces stérilisées, soulevez les inserts individuels des puits et la pipette 0,6 mL de CCM frais préguerre dans chaque puits.
- Préparer des solutions de travail individuelles de contrôle positif en diluant les stocks de CCM dans des tubes coniques de centrifugeuse comme suit : 1 μg/mL LPS, 1 μg/mL TNF-α et 0,2 % Triton-X 100. Les volumes correspondent au nombre d’inserts testés (ici, 100 μL/insert). Bien mélanger les solutions en faisant des pipes de haut en bas 3x.
- Appliquer 100 μL de chaque solution de contrôle positif en le canalisant lentement sur la paroi de l’insert de culture cellulaire. Couvrir la plaque de puits d’un couvercle et placer dans l’incubateur de culture cellulaire (37 °C, 5 % CO2) pendant 24 h. Lors de l’incubation, aspiratez et jetez le liquide sur le côté apical de l’insert en tenant des inserts individuels à l’aide de pinces à épiler.
- Recueillir le CCM dans les compartiments basaux et conserver à 1) 4 °C pour une analyse plus poussée de la LDH, en dénotant la cytotoxicité médiée par la rupture de la membrane cellulaire, et/ou 2) stocker à -80 °C pour une analyse plus approfondie de la libération de protéines par l’intermédiaire d’un test immunosorbent lié aux enzymes (ELISA). Exécutez les tests conformément aux recommandations du fournisseur de kit.
- Lors de l’enlèvement de CCM, laver les inserts avec PBS 3x et fixer les cellules sur les inserts de culture cellulaire dans 4% [w/v] paraformaldéhyde (en PBS, 15 min à température ambiante) en veillant à ce que les deux côtés d’insertion sont bien couverts avec la solution PFA. Lavez ensuite 3x avec PBS pour enlever la PFA. Stockez les échantillons immergés dans pbs à 4 °C pour une immunostaining supplémentaire (un exemple de cette méthode a été décrit précédemment17).
Résultats
Les modèles de coculture pulmonaire humaine, composés de cellules épithéliales alvéolaires et de cellules immunitaires, ont été assemblés soit à partir de MDDCs frais ou congelés et de progéniteurs de MDM (ici, monocytes dérivés du sang périphérique humain). Comme il est présenté à la figure 1, les cellules A549 ont été ensemencées 3 jours après la première section impliquant l’isolement/dégel des monocytes. Après 6 jours de différenciation, les MDM différenciés sont apparus en forme de rond, tandis que les MDDC formaient une forme plus allongée avec des saillies observables. Ils sont également apparus comme des agglomères, surtout lorsqu’ils sont différenciés des monocytes frais (figure 2, figure 3). Les cellules épithéliales ont formé une couche cellulaire dense de cellules après 3 jours de croissance sur les inserts membranaires (figure 4), lorsque les cocultures ont été assemblées. Après 24 h d’assemblage et 24 h supplémentaires d’être soumis à des conditions d’ALI, les cocultures ont été préparées pour les expositions.
La réactivité des modèles de culture cellulaire 3D a été étudiée lors de l’exposition à des stimuli proinflammatoires connus à l’aide d’une approche pseudo-ALI, comme décrit précédemment29. Les stimuli proinflammatoires, LPS et TNF-α, ont été ajoutés en faibles volumes (100 μL) sur la surface apicale du modèle cellulaire exposé à l’air. En parallèle, l’absence de rupture de membrane comme mesure de cytotoxicité a été évaluée par l’essai de LDH. Une augmentation significative de la libération de LDH dans le CCM du compartiment basal a été observée lors de l’exposition au contrôle positif pour la rupture de membrane, un détergent Triton-X 100 (Figure 5). Ces résultats ont prouvé la réactivité du modèle à une substance cytotoxique, alors qu’aucune augmentation de la libération de LDH n’a été observée sur la stimulation aticale avec TNF-α ou LPS.
Une raison possible des différentes valeurs mesurées de la LDH dans les échantillons assemblés avec des PBM frais ou préalablement congelés peut être attribuée au stockage de l’échantillon. Les échantillons provenant de PBM frais ont été stockés plus longtemps à -80 °C; par conséquent, l’activité de l’enzyme LDH peut diminuer. Notamment, la LDH n’est stable que jusqu’à 4 jours en CCM; ainsi, il est recommandé d’effectuer l’essai les 2 derniers jours après la collecte des supernatants. Alternativement, il est possible de geler les supernatants directement après la collecte. Toutefois, il est important de considérer que le gel peut diminuer l’activité enzymatique de la LDH.
La sécrétion de médiateurs proinflammatoires (ici, TNF-α et interleukins 6 [IL-6] et 8 [IL-8]) dans le CCM basal a été quantifiée par l’intermédiaire d’ELISA. Des augmentations statistiquement significatives (p < 0,05, à sens unique ANOVA) dans la libération d’IL-6 et d’IL-8 ont été observées dans les échantillons traités par LPS et TNF-α par rapport aux cellules non traitées respectives, ainsi que dans les modèles de culture cellulaire assemblés à partir de l’une ou l’autre source de PBMs (figure 6). Bien que les concentrations (pg/mL) de toutes les cytokines testées dans le CCM basal aient été plus élevées dans les cocultures composées de PBM frais, les différences entre les deux cocultures et les monocultures n’étaient pas statistiquement significatives (p > 0,05) (figure 6). Pour confirmer la valeur ajoutée des modèles de coculture par rapport à une culture cellulaire épithéliale 2D, les monocultures A549 ont également été exposées au LPS ou au TNF-α. Comme prévu, la libération de tous les médiateurs étudiés des monocultures A549 était plus faible par rapport aux deux modèles de coculture; bien que la différence entre eux n’était pas statistiquement significative (p > 0,05, à sens unique ANOVA).
La morphologie cellulaire de la barrière épithéliale alvéolaire humaine 3D a été évaluée par microscopie de balayage de laser confocal (LSM). Pour visualiser la composition de chaque modèle, les macrophages dans les modèles de coculture (MDM) ont été tachés de marqueur de macrophage mature 25F9. Les MDDC ont été tachés de CD83, qui est un marqueur important pour les cellules dendritiques activées30. En ce qui concerne la morphologie cellulaire, aucune différence n’a été observée entre les modèles de coculture utilisant les MDM et les MDDC des PBM frais par rapport à ceux utilisant des PBM décongelés. Dans les cocultures exposées au LPS et au TNF-α, toutes deux composées de cellules immunitaires fraîches et congelées, on a observé une couche épithéliale perturbée dans les images de LSM, ce qui n’était pas le cas dans les cellules non traitées (Figure 7, Figure 8).
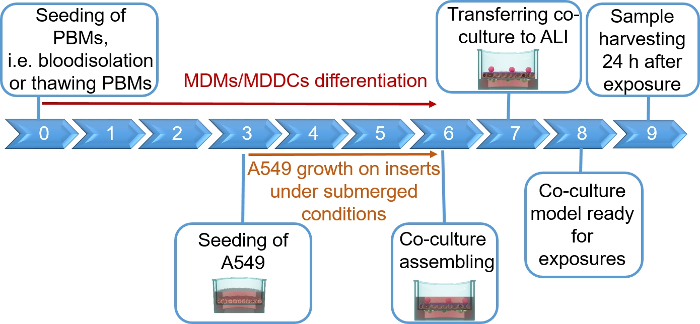
Figure 1 : Chronologie schématique du protocole. Présentation de la préparation, de l’assemblage et de l’application du modèle de coculture 3D (exposition à une substance testée). ALI = interface air-liquide, MDDCs = cellules dendritiques dérivées des monocytes, MDM = macrophages dérivés de monocytes, PBMs = monocytes sanguins périphériques. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
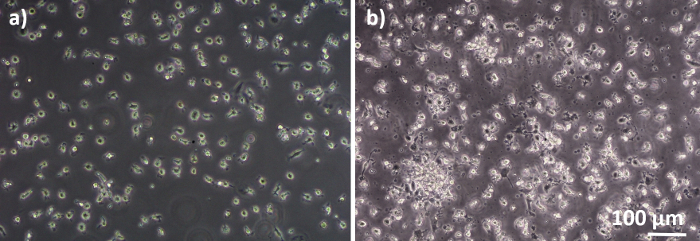
Figure 2 : MDM et MDDC se différencient des PBM frais. Image de microscopie de phase-contraste des MDM différenciés (A) et (B) MDDCs des PBM frais (6 jours après l’isolement cellulaire). Les MDM sont en forme de rond, tandis que les MDDC sont souvent observés comme des agglomères. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
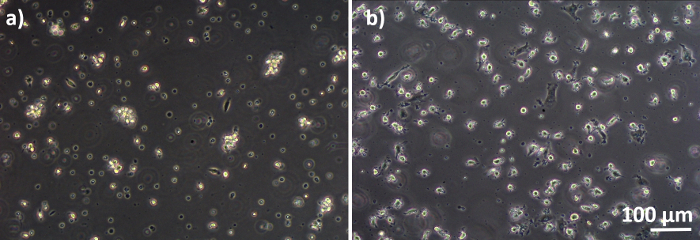
Figure 3 : MDM et MDDC se différencient des PBM congelés. Image de microscopie de phase-contraste des MDM différenciés (A) et (B) MDDCs des PBM décongelés (6 jours après la décongélation). Les MDM sont en forme de rond, mais certaines cellules allongées peuvent être observées. Les MDDC apparaissent également en forme de rond avec des protubérances. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 4 : Croissance des cellules épithéliales sur inserts membranaires. Image de microscopie de phase-contraste de confluent A549 se développant sur un insert de membrane 4 jours après l’ensemencement, formant une couche dense de cellules. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
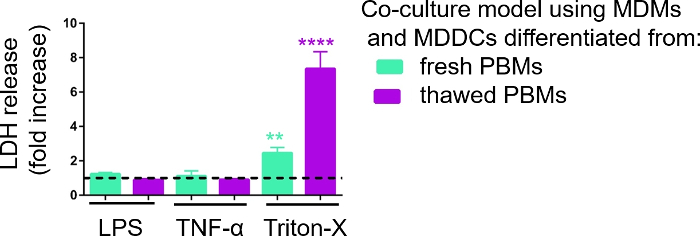
Figure 5 : Résultats de cytotoxicité étudiés par l’essai basé sur la rupture de membrane (LDH). Les données sont présentées sous forme d’augmentation du pli par rapport aux cellules non traitées (moyenne ± SD, n = 3, astérisque indique une augmentation statistiquement significative par rapport aux cellules non traitées, **p < 0,01, ****p < 0,0001). Dans les modèles verts, les MDM et les MDDC provenant de PBM frais sont représentés, et dans les modèles violets assemblés à partir de PBM décongelés sont représentés. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
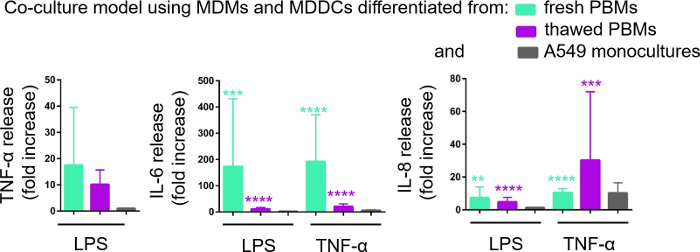
Figure 6 : Réactions proinflammatoires dans les cocultures et les monocultures. Les médiateurs proinflammatoires (TNF-α, IL-6 et IL-8) libèrent dans les cocultures sur 24 h défi avec LPS ou TNF-α. Les données sont présentées comme relatives aux cellules non traitées (moyenne ± SD, n = 3, **p < 0,01, ***p < 0,001, ****p < 0,0001). Dans les modèles verts, les MDM et les MDDC provenant de PBM frais sont représentés, et dans les modèles violets assemblés à partir de PBM décongelés sont représentés. Le gris représente les monocultures de l’A549. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
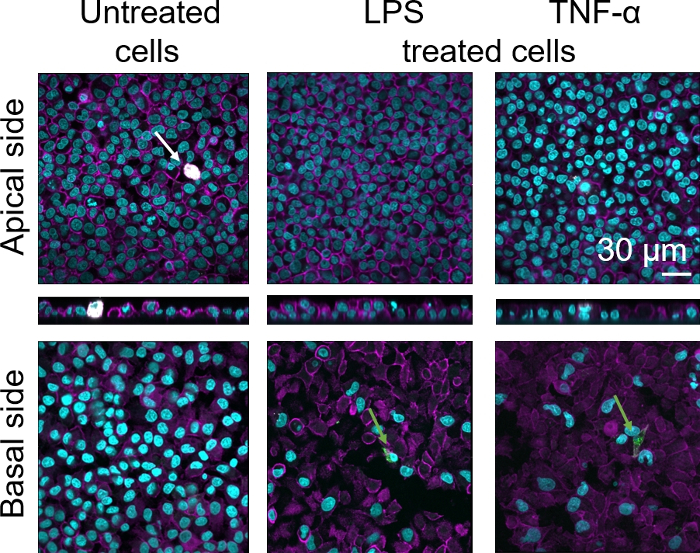
Figure 7 : Morphologie des cocultures composées de cellules immunitaires fraîches. Images LSM des côtés apical et basaux du modèle de coculture avec xz projections des côtés apiques du modèle à l’aide de MDM et de MDM frais. Cyan représente des noyaux (DAPI), magenta représente le cytosquelette (rhodamine-phalloïdine), le blanc représente les MDM (25F9), et le vert représente les MDDC (CD 83). La flèche blanche désigne MDM, tandis que la flèche verte dénote MDDC. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
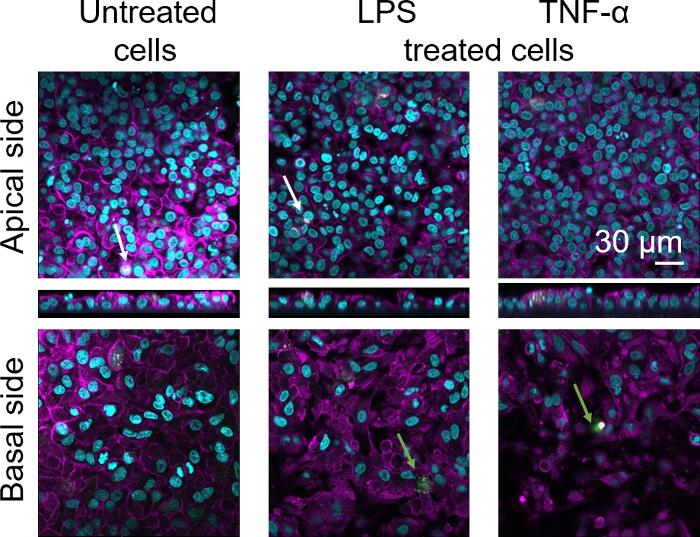
Figure 8 : Morphologie des cocultures composées de cellules immunitaires congelées. Images LSM du côté apical du modèle de coculture avec les projections xz correspondantes, et côté basal du modèle utilisant MDMs et MDDC des PBMs décongelés. Cyan représente les noyaux (DAPI), le magenta représente le cytosquelette (rhodamine-phalloïdin), le blanc représente les MDM (25F9), et le vert représente les MDDC (CD 83). La flèche blanche désigne MDM, tandis que la flèche verte dénote MDDC. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
La production émergente de nouveaux matériaux, y compris les produits chimiques et les médicaments, augmente progressivement le besoin de modèles in vitro prédictifs. Pour se conformer aux trois principes de remplacement, de réduction et de raffinement de l’expérimentation animale32, les modèles cellulaires in vitro sont devenus des outils puissants en ce qui concerne l’aspect remplacement et réduction pour élucider les mécanismes de l’action d’un médicament ou d’un matériau8,9,10,11. Présenté ici est un protocole détaillé d’assemblage du modèle multicellulaire à l’aide de cellules immunitaires qui sont soit fraîchement isolées ou décongelées à partir de monocytes préalablement congelés. La culture du modèle chez ALI est également décrite. Enfin, le protocole illustre un exemple d’exposition aux stimuli proinflammatoires et compare la réponse des deux modèles contenant des monocytes frais ou congelés.
Diverses études ont été réalisées pour confirmer et justifier la valeur ajoutée de la complexité accrue des modèles cultivés et exposés dans des conditions ALI par rapport à l’exposition immergée conventionnelle7,22,31. L’observation de la réponse proinflammatoire plus élevée dans les cocultures comparée aux monocultures des cellules épithéliales confirme une étude précédente. L’étude a utilisé le modèle de coculture présenté (stimulé par le LPS) et a montré une réponse plus élevée aux niveaux d’expression génique de TNF et d’IL1B par rapport au modèle équivalent de monoculture A5497. D’autre part, les deux modèles ont montré des variations plus élevées dans les valeurs mesurées de libération de médiateur proinflammatoire par rapport aux monocultures A549. Cela peut s’expliquer par l’utilisation de cellules immunitaires de différents donneurs (manteaux buffy) dans les répétitions biologiques (c.-à-d. une répétition, un donneur), comme indiqué précédemment7. Si vous le souhaitez, les variations entre les répliques peuvent être surmontées par 1) à l’aide de PBM décongelés du même donneur ou 2) la mise en commun des PBM de différents donneurs avant de geler les cellules, puis l’utilisation ultérieure du même pool dans chaque répétition. Il est également recommandé d’inclure plus de répétitions biologiques.
La technique de congélation cellulaire peut être considérée comme une étape critique; cependant, il s’agit d’une procédure de laboratoire courante pour la préservation des cellules pour l’analyse phénotypique et fonctionnelle. Diverses études ont démontré que la qualité des PBM congelés est essentielle à leur survie, et une technique de congélation appropriée est la clé du succès des essais ultérieurs avec les mêmes cellules28,32. La modification du protocole peut être effectuée par le gel des PBM, ce qui offre une flexibilité dans la configuration expérimentale, car la disponibilité des manteaux buffy est généralement limitée. Un autre avantage de l’utilisation de PBM congelés (dans plusieurs flacons) par rapport à ceux fraîchement isolés est qu’ils peuvent être utilisés dans des expériences ultérieures, même après 1 an. Cela diminue la question potentielle de la variabilité entre donneurs et donneurs s’il s’agit d’un paramètre souhaité ou requis dans un domaine expérimental.
Les résultats d’une comparaison interlaboratoire effectuée après un délai allant jusqu’à 13 mois montrent que les PBM, lorsqu’ils sont correctement stockés dans un réservoir d’azote liquide, peuvent être utilisés sur une longue période sans aucun effet sur la viabilité cellulaire ou la récupération cellulaire33. Des temps de stockage plus longs (plus d’un an) peuvent être possibles après une validation minutieuse de la viabilité cellulaire et de la réactivité des cellules avant d’effectuer une expérience. En outre, la température dans le réservoir d’azote liquide doit rester stable en tout temps. Le principal facteur affectant la viabilité des PBM cryopréservés s’est avéré être la concentration de DMSO, avec une concentration optimale de 10%–20 % (v/v)28. Pour minimiser les effets potentiellement nocifs de la congélation, différentes sources de protéines, FBS ou BSA (avec une large gamme de concentration de 40% à 100 %34)sont souvent ajoutées au milieu de congélation comme composants protecteurs naturels qui peuvent augmenter la survie cellulaire.
En raison du potentiel cytotoxique élevé de DMSO, il est recommandé d’abord de disperser les PBM dans FBS, puis d’ajouter DMSO aux PBM déjà dispersés dans FBS. Notamment, bien que des concentrations plus élevées de FBS (>40%) n’a montré aucune amélioration de la viabilité cellulaire, en même temps, ils n’ont pas causé de dommages aux cellules28. Néanmoins, la congélation des monocytes est une approche possible pour surmonter les problèmes de disponibilité limitée des couches de buffy. Toutefois, si l’utilisation de MDDCs et MDM à partir de PBM frais est souhaitée, les cellules immunitaires peuvent être différenciées et utilisées 5 à 8 jours après l’isolement7,16,17,35,36,37. Si la planification expérimentale le permet, il est recommandé d’avoir au moins 6 jours de différenciation dans les MDDC et les MDM. Cependant, la cohérence entre les différentes répétitions dans la même expérience, ainsi que les inspections de routine de leurs expressions spécifiques marqueur de surface, sont cruciales. La réactivité à un stimulus proinflammatoire, tel que le LPS, après le temps de différenciation doit également être vérifiée régulièrement.
De nombreuses études utilisant la lignée cellulaire A549 ont été réalisées à ALI, soit en monoculture, soit en combinaison avec d’autres types de cellules (macrophages, cellules dendritiques ou fibroblastes) dans le modèle de coculture 3D22,24,29,38. En utilisant ce modèle de coculture 3D, la cytotoxicité, le stress oxydatif ou les effets proinflammatoires des (nano-)matériaux ont été étudiés jusqu’à 72 h1,17,21,24,29. La ressemblance du modèle avec le tissu in vivo a déjà été étudiée sur la base de l’imagerie de balayage laser confocal du modèle16. Lors de l’assemblage du modèle, il est important de tenir compte à la fois de la prolifération cellulaire (qui peut affecter A549 dans le modèle présenté ici) ainsi que des performances des cellules immunitaires primaires (non proliférantes) (ici, les MDDCs et les MDM). Il est également important de considérer que tous les monocytes positifs CD14 ne se différencient pas en MDDCs et MDM, et que les cellules peuvent être présentes sous les formes attachées et suspendues. En fonction de la nature de l’assemblage de coculture (ici, les deux types de cellules doivent s’attacher à la couche épithéliale existante), il est recommandé d’utiliser uniquement les sous-populations adhérentes des deux types de cellules immunitaires. En outre, les analyses de routine des monocytes, de la réactivité à la monoculture du MDDC et de la MDM au SPL, et l’expression de marqueurs de surface spécifiques (CD14, CD163, CD86, CD93 ou CD206, données non montrées) ont suggéré que 6 et 7 jours de différenciation sont les délais optimaux.
Bien qu’un nombre réaliste de cellules épithéliales alvéolaires dans les poumons humains corresponde à ~160.000 cellules/cm2, le nombre de cellules A549 comptées dans le modèle est de ~1.000.000 cellules/cm2 après 9 jours cultivés sur l’insert16,18. Ainsi, les limites de ce modèle in vitro doivent être prises en considération. Tout d’abord, la densité des cellules épithéliales a été établie en fonction de leur capacité à former une couche confluente sur la membrane en croissance. Il est également important de mentionner que l’A549 représente une cellule épithéliale de type II avec une forme cuboïdale, contrairement aux cellules épithéliales de type I, qui sont plates et outspread. D’autre part, le nombre requis de cellules immunitaires a été établi sur la base de la littérature et présenté dans ce protocole comme numéro de cellule / surface39,40,41. La densité cellulaire des MDDC de l’ordre de 400 cellules/mm2 (4 cellules/cm2)16 est comparable à la densité cellulaire à état stable de 500–750 cellules/mm2 (5- 7 cellules/cm2) rapportées à partir d’études in vivo39. La densité des MDM dans ce modèle se situe dans la même gamme de situations in vivo dans la région alvéolaire humaine40.
Des taches de marqueurs macrophages matures (25F9) ont été observées à la fois dans le côté apical (où les MDM sont présents) ainsi que sur le côté basal (c.-à-d. à l’emplacement des cellules dendritiques). La translocation des cellules immunitaires par les pores d’insertions membranaires est possible et a également été observée à l’aide de ce modèle16, ce qui peut expliquer les différences observées dans les intensités de coloration. Cependant, une autre explication possible est que le marqueur de macrophage mature peut également être exprimé sur les cellules dendritiques, mais l’expression est fortement spécifique au donneur42. En outre, l’intensité de l’expression 25F9 est beaucoup plus élevée dans les MDM (Figure 7, Figure 8). Les deux stimuli proinflammatoires (LPS et TNF-α) ont affecté l’intégrité de la barrière épithéliale pulmonaire dans les deux cocultures (figure 7, figure 8). Cela était prévu sur la base des publications précédentes43,44 montrant que les cytokines proinflammatoires et les produits bactériens perturbent l’intégrité des barrières épithéliales.
Le modèle multicellulaire 3D de l’épithélium alvéolaire humain, établi et caractérisé précédemment17, a servi d’outil puissant et utile pour évaluer les réponses biologiques (c.-à-d. les réactions proinflammatoires aiguës, la réponse au stress oxydatif, la distribution des particules et la communication cellulaire) in vitro21,24,25,45. Les résultats confirment la responsabilité des modèles de coculture aux stimuli proinflammatoires (ici, LPS et TNF-α). La réponse a été légèrement augmentée lors de l’utilisation des cellules immunitaires des PBM frais ; cependant, il n’y avait pas de différence statistiquement significative entre les cocultures utilisant des PBM frais ou des PBM décongelés. En outre, les réactions proinflammatoires des deux modèles de coculture étaient plus élevées que celles des monocultures épithéliales cultivées dans les mêmes conditions (ALI). En résumé, le protocole décrit l’assemblage d’un modèle de coculture épithéliale alvéolaire humaine 3D utilisant des PBM frais ou décongelés pour la différenciation en MDM et MDDCs. Il est démontré que les deux modèles sont très sensibles aux stimuli proinflammatoires; par conséquent, ils peuvent servir d’outils puissants pour les évaluations potentielles des dangers et de la toxicité.
Déclarations de divulgation
Les auteurs n’ont rien à révéler.
Remerciements
Les auteurs tiennent à remercier le Dr Miguel Spuch-Calvar pour le programme de coculture de la figure 3 et le Dr Bedia Begum Karakocak pour la lecture critique. Cette étude a été soutenue par le projet PATROLS, le programme de recherche et d’innovation Horizon 2020 de l’Union européenne dans le cadre de l’accord de subvention no 760813 et par la Fondation Adolphe Merkle. B.D. remercie la fondation Peter und Traudl Engelhorn pour son soutien financier.
matériels
| Name | Company | Catalog Number | Comments |
| Benchmark microplate reader | does not have to be specific, for example BioRad, Cressier, Switzerland | ||
| Cell culture Incubator | does not have to be specific | ||
| Cell freezing container (for example Mr. Frosty) | does not have to be specific | ||
| Centrifuge | does not have to be specific | ||
| Confocal laser scanning microscope | does not have to be specific, for example | Zeiss LSM 710 meta | |
| Heamatocytometer, or automatic cell counter | does not have to be specific | ||
| Laminar bio-safety hood class II | does not have to be specific | ||
| MultiStand Macs (Macs Cell Separator) | Miltenyi, Germany | 130-042-303 | |
| pH meter | does not have to be specific | ||
| Phase contrast inverted light microscope | does not have to be specific | ||
| Pipette boy, pipettors (different volumes) | do not have to be specific | ||
| Scissors | do not have to be specific | ||
| Vacuum pump | does not have to be specific | ||
| Water bath | does not have to be specific | ||
| Disposable small equipment/glassware | Catalogue Number | ||
| 15 mL and 50 mL conical centrifuge tubes | does not have to be specific | ||
| 6- and 12-well cell culture plates, flat bottom, low evaporation lid, sterile | Falcon, Switzerland | 353046 and 353043 | |
| Cell culture inserts, transparent PET membrane, 12-well, 3 μm pore size | Falcon, Switzerland | 353181 | |
| Cell scrapper | does not have to be specific, for example VWR, Switzerland | 353085 | |
| Cryovials | do not have to be specific | ||
| Glass autoclaved Petri Dishes | do not have to be specific | ||
| LS Columns | Miltenyi, Germany | 130-042-401 | |
| Sterile filtration cup for vacuum filtration, 0.2 μm pore size | does not have to be specific, for example VWR, Switzerland | 10040-446 | |
| Sterile Lab Bottle compatible with Filtration cup (min. 100 mL) | does not have to be specific | ||
| Sterile pipettes | do not have to be specific | ||
| Chemicals | |||
| Bovine serum albumine (BSA) | Sigma-Aldrich, Switzerland | A7030-100g | |
| CD14+ MicroBeads human - magnetic beads | Miltenyi, Germany | 130-097-052 | |
| Deattachnig agent Trypsin-EDTA, 0.05%, phenol red | Gibco, Switzerland | 25300054 | |
| Density gradient medium Lymphoprep | Alere Technologies AS, Norway | 1114547 | |
| Dimethyl Sulfoxide (DMSO) | Sigma Aldrich, Switzerland | D2438 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich, Switzerland | E6758-100g | |
| Fetal bovine serum (heat inactivated) | Gibco, Switzerland | 10270-106 | |
| Human granulocyte-macrophage colony-stimulating factor (GM-CSF), premium grade | Miltenyi, Germany | 130-093-864 | |
| Human Interleukin 4 (IL-4), premium grade | Miltenyi, Germany | 130-095-373 | |
| Human macrophage colony-stimulating factor (M-CSF), premium grade | Miltenyi, Germany | 130-096-485 | |
| L-glutamine | Gibco, Switzerland | 25030-024 | |
| Lipopolysaccharid (LPS) from Escherichia coli | Sigma-Aldrich, Switzerland | 4524-5mg | |
| Paraformaldehyde (PFA) | Sigma-Aldrich, Switzerland | 158127 | |
| Penicilin-Streptomycin | Gibco, Switzerland | 15140-122 | |
| Phosphate Buffer Saline (PBS) | Gibco, Switzerland | 10010-015 | |
| Roswell Park Memorial Institute-1640 Medium (RPMI) | Gibco, Switzerland | 42401-018 | |
| Triton X-100 | Sigma-Aldrich, Switzerland | T8787 | |
| Trypan blue solution (0.4%) | Sigma Aldrich, Switzerland | ||
| Tumor necrosis factor alpha (TNF-α) | Immunotools | 11343015 | |
| Assays used for cytotoxicity, (pro-)inflammatory response | |||
| Cytotoxicity Detection Kit (LDH) | Roche, Switzerland | 11644793001 | |
| Human IL-6 DuoSet ELISA | R&D, Biotechne, Switzerland | DY206 | |
| Human IL-8/CXCL8 DuoSet ELISA | R&D, Biotechne, Switzerland | DY208 | |
| Immunostaining | |||
| 4′,6-diamidino-2-phenylindole (DAPI), concentration 2 μg/mL | Sigma-Aldrich, Switzerland | 10236276001 | |
| Goat anti-mouse IgG (H+L) Alexa Fluor 647 conjugated, concentration 20 μg/mL | Abcam, UK | ab150115 | |
| Goat anti-rabbit IgG antibody (H+L) Dylight 488 conjugated, concentration 10 μg/mL | Agrisera, Sweden | AS09 633 | |
| Mature Macrophage Marker Monoclonal Antibody, concentration 50 μg/mL | eBioScience, Thermo Fischer, Switzerland | 14-0115-82 | |
| Phalloidin rhodamine, concentration 0.264 µM | Molecular Probes, Life Technologies, Switzerland | R415 | |
| Recombinant Anti-CD83 antibody, 1:50 dillution | Abcam, UK | ab244204 |
Références
- Rothen-Rutishauser, B., Blank, F., Mühlfeld, C., Gehr, P. In vitro models of the human epithelial airway barrier to study the toxic potential of particulate matter. Expert Opinion on Drug Metabolism and Toxicology. 4 (8), 1075-1089 (2008).
- Giard, D., et al. In vitro cultivation of human tumors: establishment of cell lines derived from a series of solid tumors. Journal of National Cancer Institute. 51 (5), 1417-1423 (1973).
- Ochs, M., Weibel, E. R., Grippi, M. A. Ch. 2: Functional Design of the Human Lung for Gas Exchange . Fishman's Pulmonary Diseases and Disorders, 5e. , (2008).
- Foster, K. A., Oster, C. G., Mayer, M. M., Avery, M. L., Audus, K. L. Characterization of the A549 Cell Line as a Type II Pulmonary Epithelial Cell Model for Drug Metabolism. Experimental Cell Research. 243 (2), 359-366 (1998).
- Guo, X. Y., Lu, M., Chen, X. Q., He, F. D., Li, A. Correlation study of biological characteristics of non-small cell lung cancer A549 cells after transfecting plasmid by microbubble ultrasound contrast agent. Asian Pacific Journal of Tropical Medicine. 9 (6), 582-586 (2016).
- Cooper, J. R., et al. Long Term Culture of the A549 Cancer Cell Line Promotes Multilamellar Body Formation and Differentiation towards an Alveolar Type II Pneumocyte Phenotype. PLoS ONE. 11 (10), 0164438 (2016).
- Bisig, C., Voss, C., Petri-Fink, A., Rothen-Rutishauser, B. The crux of positive controls - Proinflammatory responses in lung cell models. Toxicology In Vitro. 54, 189-193 (2019).
- Rothen-Rutishauser, B., et al. A newly developed in vitro model of the human epithelial airway barrier to study the toxic potential of nanoparticles. ALTEX. 25, (2008).
- Braakhuis, H. M., et al. Progress and future of in vitro models to study translocation of nanoparticles. Archives of Toxicology. 89 (9), 1469-1495 (2015).
- Thai, P., Chen, Y., Dolganov, G., Wu, R. Differential regulation of MUC5AC/Muc5ac and hCLCA-1/mGob-5 expression in airway epithelium. American Journal of Respiratory Cell and Molecular Biology. 33 (6), 523-530 (2005).
- Wu, J., et al. Characterization of air-liquid interface culture of A549 alveolar epithelial cells. Brazilian Journal of Medical and Biological Research. 51 (2), 6950 (2017).
- Shapiro, D. I., Nardone, L. L., Rooney, S. A., Motoyama, E. K., Munoz, J. L. Phospholipid biosynthesis and secretion by a cell line (A549) which resembles type II aleveolar epithelial cells. Biochimica and Biophysica Acta. 530 (2), 197-207 (1978).
- Balis, J., Bumgarner, S. D., Paciga, J. E., Paterson, J. F., Shelley, S. A. Synthesis of lung surfactant-associated glycoproteins by A549 cells: description of an in vitro model for human type II cell dysfunction. Experimental Lung Research. 6 (3-4), 197-213 (1984).
- Schurch, S., Gehr, P., Im Hof, V., Geiser, M., Green, F. Surfactant displaces particles toward the epithelium in airways and alveoli. Respiration Physiology. 80 (1), 17-32 (1990).
- Gehr, P., Schurch, S., Berthiaume, Y., Hof, V. I., Geiser, M. Particle Retention in Airways by Surfactant. Journal of Aerosol Medicine. 3 (1), 27-43 (2009).
- Blank, F., Rothen-Rutishauser, B., Gehr, P. Dendritic Cells and Macrophages Form a Transepithelial Network against Foreign Particulate Antigens. American Journal of Respiratory Cell and Molecular Biology. 36 (6), (2007).
- Rothen-Rutishauser, B. M., Kiama, S. G., Gehr, P. A three-dimensional cellular model of the human respiratory tract to study the interaction with particles. American Journal of Respiratory Cell and Molecular Biology. 32, (2005).
- Blank, F., Rothen-Rutishauser, B. M., Schurch, S., Gehr, P. An optimized in vitro model of the respiratory tract wall to study particle cell interactions. Journal of Aerosol Medicine. 19, (2006).
- Jardine, L., et al. Lipopolysaccharide inhalation recruits monocytes and dendritic cell subsets to the alveolar airspace. Nature Communications. 10 (1), 1999 (2019).
- Kopf, M., Schneider, C., Nobs, S. P. The development and function of lung-resident macrophages and dendritic cells. Nature Immunology. 16 (1), 36-44 (2015).
- Chortarea, S., et al. Repeated exposure to carbon nanotube-based aerosols does not affect the functional properties of a 3D human epithelial airway model. Nanotoxicology. 9 (8), 983-993 (2015).
- Hilton, G., Barosova, H., Petri-Fink, A., Rothen-Rutishauser, B., Bereman, M. Leveraging proteomics to compare submerged versus air-liquid interface carbon nanotube exposure to a 3D lung cell model. Toxicology In Vitro. 54, 58-66 (2019).
- Brandenberger, C., et al. Effects and uptake of gold nanoparticles deposited at the air-liquid interface of a human epithelial airway model. Toxicology and Applied Pharmacology. 242, (2010).
- Drasler, B., et al. Single exposure to aerosolized graphene oxide and graphene nanoplatelets did not initiate an acute biological response in a 3D human lung model. Carbon. 137, 125-135 (2018).
- Durantie, E., et al. Carbon nanodots: Opportunities and limitations to study their biodistribution at the human lung epithelial tissue barrier. Biointerphases. 13, (2018).
- Brandenberger, C., et al. Quantitative evaluation of cellular uptake and trafficking of plain and polyethylene glycol-coated gold nanoparticles. Small. 6 (15), 1669-1678 (2010).
- Tomašek, I., et al. Combined exposure of diesel exhaust particles and respirable Soufrière Hills volcanic ash causes a (pro-)inflammatory response in an in vitro multicellular epithelial tissue barrier model. Particle and Fibre Toxicology. 13 (1), 67 (2016).
- Nazarpour, R., et al. Optimization of Human Peripheral Blood Mononuclear Cells (PBMCs) Cryopreservation. International Journal of Molecular and Cellular Medicine. 1 (2), 88-93 (2012).
- Endes, C., et al. An in vitro testing strategy towards mimicking the inhalation of high aspect ratio nanoparticles. Particle and Fibre Toxicology. 11 (1), (2014).
- Ju, X., et al. The Analysis of CD83 Expression on Human Immune Cells Identifies a Unique CD83+-Activated T Cell Population. Journal of Immunology. 197 (12), 4613-4625 (2016).
- Lenz, A. G., et al. Inflammatory and Oxidative Stress Responses of an Alveolar Epithelial Cell Line to Airborne Zinc Oxide Nanoparticles at the Air-Liquid Interface: A Comparison with Conventional, Submerged Cell-Culture Conditions. BioMed Research International. , 12 (2013).
- Germann, A., Schulz, J. C., Kemp-Kamke, B., Zimmermann, H., von Briesen, H. Standardized serum-free cryomedia maintain peripheral blood mononuclear cell viability, recovery, and antigen-specific T-cell response compared to fetal calf serum-based medium. Biopreservation and Biobanking. 9 (3), 229-236 (2011).
- Weinberg, A., et al. Optimization and Limitations of Use of Cryopreserved Peripheral Blood Mononuclear Cells for Functional and Phenotypic T-Cell Characterization. Clinical and Vaccine Immunology. 16 (8), 1176 (2009).
- Freshney, R. I., Freshney, R. I. . Culture of animal cells: a manual of basic technique. , 321-334 (2005).
- Lehmann, A. B. C., Blank, F., Gehr, P., Rothen-Rutishauser, B., Yarmush, M. L., Langer, R. S. . Alternatives to animal testing. , 239-260 (2010).
- Steiner, S., et al. Reduction in (pro-)inflammatory responses of lung cells exposed in to diesel exhaust treated with a non-catalyzed diesel particle filter. Atmospheric Environment. 81, 117-124 (2013).
- Martinez, F. O., Gordon, S., Locati, M., Mantovani, A. Transcriptional Profiling of the Human Monocyte-to-Macrophage Differentiation and Polarization: New Molecules and Patterns of Gene Expression. The Journal of Immunology. 177 (10), 7303 (2006).
- Chortarea, S., et al. Profibrotic activity of multi-walled carbon nanotubes upon prolonged exposures in different human lung cell types. Applied In Vitro Toxicology. 5 (1), (2019).
- Holt, P. G. Pulmonary Dendritic Cells in Local Immunity to Inert and Pathogenic Antigens in the Respiratory Tract. Proceedings of the American Thoracic Society. 2 (2), 116-120 (2005).
- Pinkerton, K. E., Gehr, P., Castañeda, A., Crapo, J. D., Parent, R. A. . Comparative Biology of the Normal Lung (Second Edition). , 105-117 (2015).
- Crapo, J., Barry, B., Gehr, P., Bachofen, M., Weibel, E. R. Cell number and cell characteristics of the normal human lung. American Review of Respiratory Disease. 126 (2), 332-337 (1982).
- Maniecki, M. B., Møller, H. J., Moestrup, S. K., Møller, B. K. CD163 positive subsets of blood dendritic cells: The scavenging macrophage receptors CD163 and CD91 are coexpressed on human dendritic cells and monocytes. Immunobiology. 211 (6), 407-417 (2006).
- Chignard, M., Balloy, V. Neutrophil recruitment and increased permeability during acute lung injury induced by lipopolysaccharide. American Journal of Physiology-Lung Cellular and Molecular Physiology. 279 (6), 1083-1090 (2000).
- Coyne, C. B., et al. Regulation of Airway Tight Junctions by Proinflammatory Cytokines. Molecular Biology of the Cell. 13 (9), 3218-3234 (2002).
- Durantie, E., et al. Biodistribution of single and aggregated gold nanoparticles exposed to the human lung epithelial tissue barrier at the air-liquid interface. Particle and Fibre Toxicology. 14 (49), (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon