Method Article
Modello alveolare umano multicellulare composto da cellule epiteliali e cellule immunitarie primarie per la valutazione del pericolo
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui è presentato un protocollo per l'isolamento primario del sangue monocito umano, nonché la loro differenziazione in macrofagi e cellule dendritiche e assemblaggio con cellule epiteliali in un modello polmonare umano multicellulare. Vengono confrontate le risposte biologiche delle coculture composte da cellule immunitarie differenziate dai monociti appena isolati o scongelati, dopo l'esposizione a stimoli proinfiammatori.
Abstract
Un modello di coculazione cellulare alveolar umana è descritto qui per la simulazione della barriera del tessuto epiteliale alveolar composto da cellule epiteliali alveolari di tipo II e due tipi di cellule immunitarie (cioè macrofagi derivati da monociti umani [MDM] e cellule dendritiche [MDDC]). Viene fornito un protocollo per l'assemblaggio del modello multicellulare. Le cellule epiteliali alveolare (linea cellulare A549) vengono coltivate e differenziate in condizioni sommerse su inserti permeabili in pozzi a due camere, quindi combinate con MDM e MDDC differenziati. Infine, le cellule sono esposte a un'interfaccia aria-liquido per diversi giorni. Poiché le cellule immunitarie primarie umane devono essere isolate dai cappotti umani, le cellule immunitarie differenziate dai monociti freschi o scongelati vengono confrontate al fine di adattare il metodo in base alle esigenze sperimentali. I modelli tridimensionali, composti da cellule alveolari con cellule immunitarie appena isolate o scongelate derivate da monociti, mostrano un aumento statisticamente significativo del rilascio di citochine (interleukins 6 e 8) dopo l'esposizione a stimoli proinfiammatori (lipopolysaccharide e fattore di necrosi tumorale) rispetto alle cellule non trattate. D'altra parte, non vi è alcuna differenza statisticamente significativa tra il rilascio di citochine osservato nelle coculture. Ciò dimostra che il modello presentato è sensibile agli stimoli proinfiammatori in presenza di MDM e MDDC differenziati dai monociti del sangue periferico freschi o scongelati (PBM). Pertanto, è un potente strumento per le indagini della risposta biologica acuta a diverse sostanze, tra cui farmaci aerosolizzati o nanomateriali.
Introduzione
Le colture di cellule polmonari in vitro offrono piattaforme convenienti, robuste e ben controllate per valutare i rischi degli aerosol1. Come sistema cellulare modello per gli pneumociti alveolari umani, la linea cellulare epiteliale A549 isolata da un adenocarcinoma polmonare vienespesso utilizzata 2. Queste cellule rappresentano cellule epiteliali squamose di tipo II della regione alveolar3 e sono una linea di cellule polmonari ampiamente utilizzata per la valutazione del pericoloedellatossicità 1,4,5,6,7,8,9,10. La linea cellulare A549 possiede caratteristiche rilevanti delle cellule epiteliali alveolari di tipo II, come la presenza di caratteristici corpi lamellari contenenti fosfoloidi densamente imballati3.
È stato dimostrato che quando le cellule vengono colturate in un'interfaccia aria-liquido (ALI), il surfactant viene rilasciato sul lato apico delle cellule epiteliali esposte all'aria, riducendo la tensionesuperficiale 11,12,13. Questa caratteristica è particolarmente importante nelle indagini sul rischio respiratorio nanomateriale e sulle indagini sulla tossicità. Una volta che i nanomateriali/tossici inalati vengono depositati nella regione alveolar, interagiscono prima con il surfactant polmonare e vengono spostati dalle forze bagnanti nell'ipofrode aqueo, dove l'interazione con le cellule polmonariavviene 14,15. Anche se le cellule A549 formano un monostrato (che può sovracrescere in multistrati in punti di tempo successivi quando coltivate all'ALI) e producono surfactant, uno svantaggio è la loro formazione di giunzione stretta insufficiente, con conseguente basso transepithelial valori di resistenza elettrica, ma ancora presentando una barriera funzionale contro intercellulare (nano)particelle traslocazione16,17,18.
Nei polmoni, c'è una varietà di popolazioni di cellule immunitarie, tra cui cellule fagone e professionali che presentano antigeni (cioè macrofagi e cellule dendritiche) che comunicano direttamente attraverso il contatto cellulare o la segnalazione intercellulare per controllare e mantenere l'omeostasi. I macrofagi e le cellule dendritiche sono effetti immunitari innati critici e iniziatori della risposta immunitaria adattiva19. Le cellule dendritiche che risiedono all'interno o sotto l'epitelio possono formare sporgenze attraverso l'epitelio al lume per catturare gli antigeni. I macrofagi alveoli si trovano sulla superficie apica dell'epitelio e fungono da cellule sentinella, che rappresentano la prima difesa cellulare contro il materiale estraneo e le infezioni batteriche, virali e fungine. La loro plasticità fenotipica consente una rapida induzione di reazioni proinfiammatorie in risposta a tali stimoli e il passaggio a innescare reazioni antinfiammatorie (cioè inibitorie)20.
Per simulare la barriera del tessuto epiteliale alveolar umano, abbiamo stabilito un modello di tripla cocoltura con cellule A549 integrate con macrofagi derivati da monociti del sangue umano (MDM) e cellule dendritiche (MDDC) rispettivamente sui lati atici e basali,rispettivamente 17. Coltivazione di questo modello ad ALI è stato precedentemente segnalato16, anche fino a 72 h post-esposizione21. Le risposte immunitarie acute alle esposizioni ai nanotubi di carbonio sono state significativamente migliorate nella coltura cellulare esposta all'ALI rispetto alle condizioni sommerse22. Il modello di cocoltura, colto ed esposto a diversi materiali di ALI, è stato precedentemente utilizzato per studiare la citotossicità, lo stress ossidativo e le risposte infiammatorie all'esposizione all'ossido di zinco,23 materiali correlati algrafene 24, nanoparticelled'oro 25,26, nanotubidi carbonio 21e particelle di sangue vulcanico e gasolio di scarico27.
Inoltre, è stato confermato l'importante ruolo dei macrofagi e delle cellule dendritiche come cellule effreenti immunitarie in un modello polmonare umano in vitro. In particolare, una maggiore risposta proinfiammatoria nel modello è stata osservata solo in presenza di cellule immunitarie rispetto ai sistemi di monocoltura7. I potenziali inconvenienti derivanti dall'uso di cellule immunitarie derivate da monociti primari sono la limitata accessibilità dei PBM e la variazione da donatore a donatore. Come soluzione a questi potenziali inconvenienti, presentato qui è un protocollo che introduce la crioconservazione di PBM28 appena isolati per l'assemblaggio del modello di coltura cellulare. Lo scopo di questo studio è dimostrare l'assemblaggio del modello di tessuto epiteliale alveolar umano 3D, compreso l'isolamento dei PBM dai cappotti di buffy umani. La reattività agli stimoli proinfiammatori viene confrontata con il modello composto da MMM e MDDC differenziati da PBM freschi o differenziati dai PBM congelati/scongelati.
Lavorare con campioni di sangue umano non testati comporta cure specifiche per prevenire la potenziale trasmissione di malattie infettive, come l'HIV (virus dell'immunodeficienza umana), l'epatite B e l'epatite C. Pertanto, l'uso di misure di protezione personale come guanti, abiti, maschere e protezione degli occhi sono cruciali e devono essere conformi ai principi di buona pratica di laboratorio. Queste protezioni riducono il rischio di esporre la pelle o le membrane mucose a fluidi potenzialmente infettivi. Inoltre, per coloro che sono coinvolti nella manipolazione di cappotti di buffy e PBM, la vaccinazione contro il virus dell'epatite B è obbligatoria e i livelli di emabrazione degli anticorpi anti-epatite B devono essere superiori a 100 IU/L (devono essere affrontati i requisiti legislativi specifici del paese). Inoltre, tutto il lavoro deve essere svolto nei laboratori di biosafety di livello 2 (devono essere affrontati i requisiti legislativi specifici per paese). Quando si esegue l'intero protocollo, devono essere adottate le precauzioni standard in materia di salute e sicurezza associate al lavoro in un ambiente di laboratorio e alla manipolazione della coltura cellulare dei mammiferi, compresa la manipolazione dei rifiuti.
Protocollo
Il lavoro che ha coinvolto monociti primari isolati dal sangue umano è stato approvato dal comitato dell'Ufficio federale per la salute pubblica Svizzera (numero di riferimento: 611-1, Meldung A110635/2) per l'Istituto Adolphe Merkle.
1. Isolamento dei monociti di sangue periferici (PBM) dai cappotti di buffy umani
NOTA: La sezione seguente descrive l'isolamento delle cellule immunitarie da un sacchetto da 50 mL di un cappotto buffy, acquistato presso il Centro di trasfusione svizzero di Berna, in Svizzera.
- Preparazione dei reagenti
- Preparare 100 mL di buffer di separazione magnetica per cappotto di buffy: 0,5% [w/v] albumina di siero bovino (BSA; in salina tamponata di fosfati [PBS]) con acido etilenediatetetraacetico di 2 mM (EDTA) e regolare in pH - 7,2, filtro sterile con 0,22 mm di dimensione del pore). Mantenere a 4 gradi centigradi per tutta la procedura.
- Preparare il mezzo di coltura cellulare (CCM): RPMI 1640 con 10% [v/v] siero bovino fetale (FBS), 1% [v/v] L-glutamina (qui, 2 mM L-glutamina), e 1% [v/v] penicillina-streptomicina (qui, 100 unità/penicillina mL e 100 g/mL streptomycin).
NOTA: la quantità richiesta di ogni reagente dipende dal numero di celle da eseguire il seeding nei passaggi seguenti.
- Isolamento dei PBM
NOTA: Tutti i bicchieri e le stoviglie devono essere sterilizzati prima dell'uso. Per motivi di sicurezza, si raccomanda l'uso di plastica durante la manipolazione di campioni di sangue umano per ridurre il rischio di lesioni con vetro.- Utilizzare le forbici per aprire l'estremità del tubo della borsa contenente il cappotto buffy.
- Distribuire il cappotto buffy versando il contenuto della borsa attraverso il condotto della borsa direttamente in due centrifugazioni coniche da 50 mL (25 mL ciascuno).
- Versare delicatamente o pipetta PBS nei tubi per raggiungere volumi di 50 mL. Mescolare il contenuto girando il tubo delicatamente a testa in giù 3x.
- Dividere la miscela buffy coat-PBS in quattro nuovi tubi centrifuga conica da 50 mL mediante pipettazione 25 mL della miscela in ogni tubo fresco.
- Lentamente giaceva 13 mL di densità gradiente medio sotto la miscela buffy coat-PBS utilizzando una pipetta sierologica di 10 mL. Staccare la pipetta riempita dal supporto della pipetta e collegare immediatamente l'apertura superiore della pipetta con un pollice per evitare ulteriori perdite del mezzo di pendenza di densità nella miscela buffy coat-PBS.
NOTA: Tenendo l'apertura superiore con il pollice, posizionare la pipetta riempita nella parte inferiore del tubo di centrifuga conica in modo che il mezzo di pendenza di densità fluisca lentamente sotto la miscela buffy coat-PBS, lasciando circa 1 mL del mezzo di pendenza di densità all'interno della pipetta. - Ripetere il passaggio 1.2.5 con gli altri tre tubi contenenti la miscela buffy coat-PBS.
- Centrifuga tutti e quattro i tubi contenenti le miscele per 20 min a 1.000 x g e 25 gradi centigradi in modalità frenante lenta. Utilizzare i supporti con coperchi protettivi per la centrifugazione.
- Aprire il coperchio di ogni tubo, rimuovere lo strato superiore contenente plasma e piastrine utilizzando una pipetta sierologica e smaltire in un contenitore di rifiuti liquidi a rischio biohazard.
- Utilizzare una pipetta sierologica per raccogliere lo strato di cellule mononucleari del sangue periferico, che appare come una piccola frazione torbida biancastra (2-3 mm di spessore) tra il plasma e gli strati medi del gradiente di densità. Il pellet contiene globuli rossi nella parte inferiore. Evitare di trasferire erythrociti che formano lo strato più basso. Ripetere questa operazione per tutti e quattro i tubi.
NOTA: Le cellule mononucleari del sangue periferiche sono costituite da PBM e linfociti. I PBM saranno separati dai linfociti in seguito durante la separazione magnetica del CD14. - Piscina cellule mononucleari del sangue periferico da quattro tubi in due tubi da 50 mL.
- Riempire i due tubi con PBS a 50 mL e coprire con un coperchio.
- Scartare gli etritrociti e il plasma rimasti dai quattro tubi originali in un contenitore di rifiuti liquidi a rischio bio-siero.
- Centrifugare i due tubi per 8 min a 500 x g e 18-20 gradi centigradi ad una velocità di centrifuga regolare.
- Dopo la centrifugazione, rimuovere il supernatant con una pipetta sierologica e scartarlo in un contenitore di rifiuti liquidi a rischio bio-sinaro.
- Riespere le cellule con 5 mL di PBS utilizzando una pipetta sierologica.
- Mettere in comune le sospensioni cellulari in un tubo centrifugo conico da 50 mL e riempire a 50 mL con PBS.
- Utilizzare 5 L della sospensione delle celle per contare le celle con un contatore di celle utilizzando il metodo di esclusione trypan blue (45 L).
- Pipette 10 L della soluzione trypan blue-PBMs in una camera contatore di celle e contare il numero di celle in base al protocollo di conteggio standard. Utilizzare l'equazione 1 per calcolare il numero totale di celle, CT.
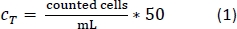
- Dopo aver contato le celle, centrifugare il tubo da 50 mL come fatto al punto 1.2.13.
- Selezione positiva CD14
- Aprire delicatamente il coperchio di ogni tubo, quindi rimuovere e scartare il supernatant utilizzando una pipetta sierologica senza disturbare il pellet.
- Aggiungere la quantità calcolata (Equazione 2) del buffer di separazione magnetica (qui, 80 L di buffer per 1 x 107 celle totali) e risundere il pellet della cella eseguendo il pipettamento della soluzione su e giù.
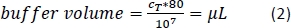
- Calcolare utilizzando l'equazione 3 (qui, 10 L per 1 x 107 celle totali) il volume corrispondente di perline magnetiche CD14 e pipette il volume appropriato.
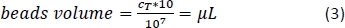
- Mescolare bene facendo pipa su e giù, chiudere il coperchio e incubare la soluzione a 4 gradi centigradi per 15 minuti.
- Al momento dell'incubazione, riempire il tubo fino a 50 mL con buffer di separazione magnetica.
- Centrifugazione come fatto al punto 1.2.13.
- Aspirare e scartare il supernatant usando una pipetta sierologica senza disturbare il pellet cellulare.
- Pipetta la quantità corrispondente di buffer di separazione magnetica (Equazione 4; qui, 500 L di buffer per 1 x 108 celle) e mescolare delicatamente pipettando su e giù 3x.
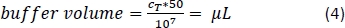
- Disinfettare la stazione di separazione magnetica spruzzandola e asciugandosi con un agente sterilizzante. Posizionare nel cofano di flusso laminare insieme alla colonna per la separazione magnetica.
- Posizionare la colonna di separazione magnetica nel campo magnetico e posizionare un tubo di centrifugazione conica vuoto di 50 mL direttamente sotto la colonna per raccogliere le celle di lavaggio e senza etichetta (cioè i rifiuti).
- Sciacquare la colonna di separazione magnetica mediante pipettamento di 3 mL di buffer di separazione magnetica nella colonna. Non lasciare asciugare la colonna per tutta la procedura.
- Preparare un tubo di centrifuga conica di 15 mL e una pipetta da 1 mL di buffer di separazione magnetica.
- Applicare la sospensione cellulare (preparata al punto 1.3.8) alla colonna di separazione magnetica. Nel tubo di centrifuga conica da 50 mL sotto il filtro, raccogliere le cellule senza etichetta che sono passate.
NOTA: non superare 2 x 109 celle per colonna per evitare il blocco della colonna. - Non appena il serbatoio della colonna è vuoto (cioè, quando le cellule sono passate attraverso la colonna), applicare 3 mL di buffer di separazione magnetica utilizzando una pipetta sierologica e lasciarlo passare attraverso la colonna. Ripetere questo 3x.
- Rimuovere la colonna di separazione magnetica dal separatore magnetico tirando delicatamente con le mani, quindi posizionarla in un tubo di 15 mL contenente 1 mL di buffer di separazione magnetica pre-pipettato (preparato al punto 1.3.12).
- Aggiungere 5 mL di buffer di separazione magnetica alla colonna e svuotare le cellule etichettate magneticamente spingendo saldamente lo stantuffo nella colonna.
- Preparazione del reagente per la differenziazione MDM e MDDC
- Contare le celle con un contatore di celle utilizzando il metodo di esclusione blu trypan come fatto nel passaggio 1.2.17.
- Calcolare i volumi richiesti di CCM o FBS per ulteriori passaggi come segue: il volume di CCM corrispondente a una densità cellulare di 1 x 106 celle/mL (punto 1.5.1) o il volume di FBS corrispondente a una densità cellulare di 6 x 106 celle per 0,9 mL di FBS (punto 1.6.3).
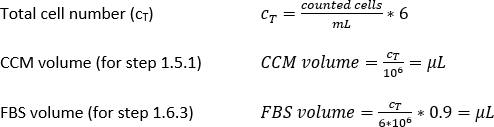
- Chiudere il coperchio, posizionare il tubo nella centrifuga e la centrifuga come fatto al punto 1.2.13. Rimuovere e scartare il supernatant senza disturbare il pellet cellulare. Procedere al passaggio 1.5 per la semina delle cellule o al punto 1.6 per il congelamento delle cellule.
- Seeding e differenziazione PBM in MDM e MDDC
- Riesping del pellet cellulare nel volume calcolato di CCM calcolato al punto 1.4.2 (qui, una concentrazione finale di 1 x 106 celle/mL) mediante pipettamento su e giù 3x.
- Pipette il numero di cellule destinate a differenziarsi in MDM e MDDC in tubi di centrifugazione conici separati utilizzando una pipetta sierologica.
- Pipette differenziare i fattori per il CCM con PBM e mescolare bene pipettando su e giù. I fattori di differenziazione vengono applicati come segue:
- Per gli MDC: concentrazione finale di 10 ng/mL interleukin-4 (IL-4) e 10 ng/mL granulocyte-macrophage fattore di stimolazione della colonia (GM-CSF).
- Per gli MMM: concentrazione finale di 10 ng/mL fattore di stimolazione della colonia di macrofagi (M-CSF).
- Pipette le sospensioni cellulari in CCM con i fattori di differenziazione aggiunti in 6 piastre di pozzo distribuendo 3 mL della sospensione per pozzo (corrisponde a 3 x10 6 celle/beh, cioè 1 x 106 celle/mL).
- Mettere le 6 piastre del pozzo in un incubatore di coltura cellulare (37 gradi centigradi, 5% CO2)e lasciarle differenziare per 6 giorni senza rinfrescare il CCM.
NOTA: la differenziazione varia da 5 a 8 giorni a seconda della disponibilità locale di cappotti buffy e configurazione sperimentale, a condizione che l'efficienza di differenziazione sia determinata utilizzando le tecniche appropriate (fare riferimento alla sezione discussione).
- Congelamento PBM
- Risundere il pellet cellulare in un mezzo crioprotettivo (qui, FBS e solfosside dimetrilo [DMSO; citotossico]) ad un rapporto di 9:1 (v/v) pipettando un volume di FBS preriwarmed. Ciò corrisponde ad una concentrazione finale di 6 x 106 celle/mL, considerando un'ulteriore aggiunta del 10% di DMSO (v/v).
- Contrassegnare il numero desiderato di criovials nel cofano flusso laminare (ad esempio, registrare la data, il codice di isolamento e il numero di celle).
- Pipette 0,9 mL di sospensione cellulare in FBS puro (qui, 6 x 106 celle in 0,9 mL di FBS) ad ogni criovial. Successivamente, pipetta lentamente 0,1 mL di DMSO e mescolare bene le sospensioni girando i criovials su e giù 3x.
- Trasferire i criovials in un contenitore di congelamento delle cellule e impostarlo immediatamente a -80 gradi centigradi per 24 h.
- Dopo 24 h, rimuovere i criovials dal congelatore e dal contenitore -80 gradi centigradi e collocarli nel serbatoio di azoto liquido adatto per lo stoccaggio delle cellule.
- Scongelamento e differenziazione PBM in MDM e MDDC
- Riscaldare tutti i reagenti necessari a 37 gradi centigradi in un bagno d'acqua (20-30 min).
- Preparare il numero appropriato di 6 piastre di pozzo corrispondenti al numero di cellule scongelate (qui, una piastra per 1,8 x 107 cellule, cioè 3 criovials). Pipette 2 mL di CCM per ogni pozzo in condizioni asetiche. Mettere le piastre nell'incubatrice (5 % CO2, 37 gradi centigradi) per 15 minuti per consentire l'equilibrio del pH.
- Prendere la quantità necessaria di criovials con cellule congelate da un serbatoio di azoto liquido e vorticoso in un bagno d'acqua di 37 gradi centigradi (1-2 min) per garantire lo scongelamento uniforme della sospensione cellulare.
- Togliere il criovial dal bagno d'acqua e decontaminare con un agente sterilizzante, assicurandosi che l'agente non interagisca con il coperchio e l'anello O.
NOTA: Qui, tutti i passaggi devono essere completati in condizioni asetiche. - Preparare il numero appropriato di tubi centrifugazione conica da 15 mL corrispondenti al numero di criovials da scongelare (qui, 6 x 106 celle/tubo). Pipette 9 mL di CCM preriguermed in ogni tubo.
- Pipette lentamente (drop-by-drop) il contenuto del criovial in un tubo contenente CCM. Chiudere il coperchio, ripetere per ogni tubo e centrifugare a 200 x g per 5 min ad una velocità di centrifuga regolare.
- Scartare il supernatant senza disturbare il pellet.
- Rispendere il pellet da ogni tubo (che contiene cellule da un criovial) in 2 mL di CCM preguerrito mediante pipetta su e giù utilizzando una pipetta sierologica (densità cellulare corrispondente a 3 x 106 cellule/mL).
- Da ogni tubo, pipetta le cellule risuospette in due pozzi (1 mL per pozzo) di una piastra di 6 pozzi contenente 2 mL di CCM precedentemente preparato per raggiungere una densità cellulare di 3 x 106 celle/pozzo (corrispondente ad una concentrazione finale di 1 x 106 celle/mL). Ripetere questa operazione per tutti gli altri tubi.
- Procedere con la differenziazione come descritto nella sezione 1.5.3.
- Mettere le 6 piastre del pozzo in un incubatore di coltura cellulare (37 gradi centigradi, 5% CO2)e lasciarle differenziare per 6 giorni senza rinfrescare il CCM.
2. Modello di cocoltura a tripla cellula del tessuto epiteliale alveorare umano
NOTA: questa sezione fornisce istruzioni sui volumi e sui numeri di cella corrispondenti agli inserti a 12 piastre dipozzo. Figura 1 riepiloga una sequenza temporale proposta per l'assemblaggio del modello.
- Semina di cellule epiteliali (linea cellulare A549)
- Coltura delle cellule epiteliali secondo le raccomandazioni fornite dal fornitore (ATTC). In breve, sottocultura le cellule in CCM a 80% confluenza cellulare (circa, 2x–3x a settimana).
NOTA: Sottocultura A549 per almeno quattro passaggi prima della composizione del modello di cocoltura, utilizzando cellule A549 in un intervallo di passaggio di 5-25. - Pipetta 1,5 mL di CCM preriguersato in 12 piastre di pozzo (il numero di pozzetti corrisponde al numero desiderato di modelli).
- Posizionare singoli inserti di coltura delle cellule del pozzo in pozzetti di una piastra di 12 pozzetti utilizzando pinzette sterilizzate.
- Scollegare le cellule da una fiaschetta secondo il protocollo di subcoltivazione (cioè, utilizzando un agente di distacco, rimuovere l'agente mediante centrifugazione come fatto al punto 1.2.13). Rispendere nel volume appropriato di CCM corrispondente alla concentrazione finale di cellule di A549 (qui, 50 x 104 celle/mL; 0,5 mL di sospensione cellulare per inserto, cioè 25 x 104 celle/inserto, che corrisponde alla densità di semina di 27,8 x 104 celle/cm 2).
- Pipette 0,5 mL della sospensione della cella (cioè 25 x 104 celle/inserire) nel lato apico dell'inserto utilizzando una pipetta da 1 mL.
- Coprire le piastre con i coperchi e metterli in un incubatore di coltura cellulare (37 gradi centigradi, 5 % CO2) per 4 giorni.
NOTA: Controllare regolarmente la confluenza delle cellule A549 sotto un microscopio a contrasto di fase.
- Coltura delle cellule epiteliali secondo le raccomandazioni fornite dal fornitore (ATTC). In breve, sottocultura le cellule in CCM a 80% confluenza cellulare (circa, 2x–3x a settimana).
- Seeding MDDC
- CCM aspirato con cellule non attaccate nelle 6 piastre di pozzo contenenti MDDC.
- Aggiungere 1 mL di CCM fresco preriguero ad ogni pozzo.
- Utilizzare un raschietto cellulare, staccare (scrape) MDDC aderenti da ogni pozzo, lavare delicatamente i pozzi con l'attuale 1 mL di CCM 3x, e combinarli in un tubo di centrifuga conica.
- Contare le celle con un contatore di celle utilizzando il metodo di esclusione blu trypan utilizzando 10 L di sospensione delle cellule e 10 L di soluzione blu trypan.
- Centrifugare la sospensione delle celle come fatto al punto 1.2.13.
- Calcolare il volume CCM necessario per la resuspensione (equazione 5):
Densità MDDC richiesta: 42 x 104 celle/mL; ogni inserto richiede 6,3 x 104 celle, che corrisponde a una densità di cellule seme di 7 x10 4 celle/cm2 (qui, 150 l aggiunte su 0,9 cm2 nel passaggio 2.2.10.).
Volume CCM per la risussione cellulare (Vm; Equazione 5):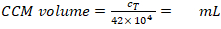
- Aspirare delicatamente e scartare il CCM dalla camera superiore di 12 piastre di pozzo con A549 in crescita sugli inserti.
- Posizionare gli inserti con celle A549 in una posizione capovolta in una piastra Petri sterile utilizzando pinzette sterilizzate. Preparare un tubo di centrifugazione conica (50 mL) con PBS e pre-inumidire un raschietto cellulare.
- Raschiare le cellule A549 dalla superficie basale dell'inserto (cioè la parte superiore in posizione capovolta), che dovrebbe crescere attraverso i pori degli inserti.
NOTA: Sciacquare il raschiatore con PBS (preparato in un tubo) tra la raschiazione di singoli campioni e tenerlo bagnato per tutta la procedura. - Al momento della centrifugazione (punto 2.2.5), aspirare e scartare il supernante, quindi dissperare il pellet MDDC nella quantità calcolata di CCM (passo 2.2.6) e pipetta su e giù 3x.
- Pipetta 150 L della sospensione cellulare sopra ogni inserto in modo che l'intera superficie basale dell'inserto sia ugualmente coperta con il liquido e non contenente bolle.
- Coprire il piatto con un coperchio e mettere in un incubatore di coltura cellulare per 70 min. Aspirare il CCM dalle piastre di coltura cellulare (dove gli inserti sono stati inizialmente collocati), scartarlo in un rifiuti liquidi a rischio bio-siza, e pipette 1,5 mL di CCM fresco in ogni pozzo. Coprire la piastra con un coperchio e posizionarsi nell'incubatrice cellulare (37 gradi centigradi, 5% CO2).
NOTA: Non superare il periodo di tempo di cui sopra per evitare di asciugare le cellule. - Dopo l'incubazione, tenere con cura ogni inserto con pinzette sterilizzate e posizionarli sulle piastre contenenti CCM in una posizione ordinaria. Coprire la piastra con un coperchio e restituirla all'incubatrice cellulare (37oC, 5% CO2).
- Seeding macrofagio (MDM)
- Prendi 6 piastre di pozzo contenenti MDM predifferenziati.
- Aspirate e scartare CCM con MDM non collegati coltivati in 6 piastre di pozzo, e pipette 1 mL di CCM fresco preriguero in ogni pozzo.
- Utilizzando un raschietto cellulare, rimuovere delicatamente gli MPM aderenti dai singoli pozzi (come fatto al punto 2.2.3 per gli MDDC).
- Pipetta 10 L di blu trypan in un pozzo o in un tubo e aggiungere 10 L della sospensione MDM per ottenere la diluizione finale di 1:1 (v/v). Contare il numero di MMM utilizzando il protocollo di conteggio appropriato.
- Centrifugare la sospensione delle celle come fatto al punto 1.2.13.
- Calcolare il volume richiesto (Equazione 6):
Densità MDM richiesta : 2,5 x 104 celle/mL in CCM (qui, ogni inserto richiede 1,25 x 104 celle in CCM 0,5 mL, che corrisponde a una densità di cellule seme di 1,4 x 104 celle/cm2).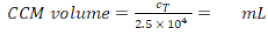 (6)
(6) - Al momento della centrifugazione, aspirare e scartare il supernante, disperare il pellet MDM nella quantità calcolata di CCM (passo 2.3.6) e pipetta su e giù 3x.
- Pipetta con attenzione 0,5 mL della sospensione MDM (preparata al punto 2.3.7) sulla parete degli inserti di coltura cellulare con A549 e MDDC (non direttamente sulle cellule epiteliali) utilizzando una pipetta da 1 mL. Piastre di copertura con coperchi e collocate in un incubatore di coltura cellulare (37 gradi centigradi, 5 % CO2) per 24 h.
- Trasferimento del modello di cocoltura all'interfaccia aria-liquido (ALI)
- Alla fine del periodo di incubazione di 24 h (2 h) del modello assemblato in un incubatore di coltura cellulare, aspirare e scartare CCM da parti ambiche e basali degli inserti di coltura cellulare e dai pozzi.
- Utilizzando una pinzetta sterilizzata, sollevare singoli inserti dai pozzetti e pipette 0,6 mL di CCM fresco preriguero ad ogni pozzo utilizzando una pipetta da 1 mL. Non aggiungere CCM al lato apical dell'inserto.
- Coprire le piastre con i coperchi e collocare in un incubatore di coltura cellulare (37 gradi centigradi, 5 % DI CO2) per 24 h prima di un ulteriore utilizzo.
3. Esposizione a controlli positivi selezionati (stimoli noti per indurre una risposta proinfiammatoria)
NOTA: L'esposizione dei modelli di cocoltura a un noto fattore di necrosi tumorale proinfiammatoria (LPS)7 e il fattore di necrosi tumorale proinfiammatoria ( TNF-7)7 viene utilizzato per illustrare la reattività del modello. Inoltre, l'esposizione a un detergente (Triton X-100) viene utilizzata per confermare la sensibilità di un saggio di disidrogenasi del lattato (LDH).
- Preparare le soluzioni di controllo positive: stock LPS (1 mg/mL in acqua distillata), stock TNF-z (100 g/mL in acqua distillata) e Triton-X 100 (2% [v/v] in PBS).
- Al 24 h di incubazione del modello di cocoltura in condizioni ALI, aspirare e scartare il supernante dal compartimento basale. Utilizzando pinzette sterilizzate, sollevare singoli inserti dai pozzetti e pipette 0,6 mL di CCM fresco preriguero in ogni pozzo.
- Preparare le singole soluzioni di lavoro per i controlli positivi diluizione delle scorte di CCM in tubi di centrifugazione conica come segue: 1 G/mL LPS, 1 g/mL TNF-z e 0,2% Triton-X 100. I volumi corrispondono al numero di inserti testati (qui, 100 L/insert). Mescolare bene le soluzioni pipettando su e giù 3x.
- Applicare 100 L di ogni soluzione di controllo positivo mediante un pipettamento lento sulla parete dell'inserto della coltura cellulare. Coprire il piatto del pozzo con un coperchio e mettere nell'incubatore di coltura cellulare (37 gradi centigradi, 5% CO2) per 24 h. Al momento dell'incubazione, aspirare e scartare il liquido sul lato apico dell'inserto tenendo singoli inserti utilizzando una pinzetta.
- Raccogliere il CCM nei compartimenti basali e conservarlo a 1) 4 gradi centigradi per un'ulteriore analisi di LDH, denotando la citotossicità mediata dalla rottura della membrana cellulare e/o 2) conservare a -80 gradi centigradi per un'ulteriore analisi del rilascio di proteine tramite analisi immunosore collegate agli enzimi (ELISA). Eseguire i test in base alle raccomandazioni del fornitore del kit.
- Dopo la rimozione di CCM, lavare gli inserti con PBS 3x e fissare le cellule sugli inserti di coltura cellulare in paraformaldeide 4% [w/v] (in PBS, 15 min a temperatura ambiente) assicurando che entrambi i lati dell'inserto siano ben coperti con soluzione PFA. Successivamente lavare 3x con PBS per rimuovere PFA. Conservare i campioni sommersi in PBS a 4 gradi centigradi per un'ulteriore immunosostenimento (un esempio di questo metodo è stato descritto in precedenza17).
Risultati
I modelli di coculazione polmonare umana, composti da cellule epiteliali alveolari e cellule immunitarie, sono stati assemblati da MDDC freschi o congelati e progenitori MDM (qui, monociti periferici periferici umani derivati dal sangue). Come illustrato nella Figura 1, le cellule A549 sono state seme 3 giorni dopo la prima sezione che riguarda l'isolamento/scongelamento dei monociti. Dopo 6 giorni di differenziazione, gli MSM differenziati apparivano a forma rotonda, mentre gli MDDC formavano una forma più allungata con sporgenze osservabili. Essi sono anche apparsi come agglomerati, soprattutto se differenziati da monociti freschi (Figura 2, Figura 3). Le cellule epiteliali formavano uno strato di cellule dense dopo 3 giorni di crescita sugli inserti a membrana (Figura 4), quando le coculture erano assemblate. Dopo 24 h di assemblaggio e altri 24 h di essere sottoposti a condizioni di ALI, le coculture sono state preparate per le esposizioni.
La reattività dei modelli di coltura cellulare 3D è stata studiata dopo l'esposizione a stimoli proinfiammatori noti utilizzando un approccio pseudo-ALI, come descritto inprecedenza 29. Gli stimoli proinfiammatori, LPS e TNF-z, sono stati aggiunti in bassi volumi (100 L) sulla superficie apica del modello cellulare esposto all'aria. Parallelamente, l'assenza di rottura della membrana come misura della citotossicità è stata valutata tramite analisi LDH. Un aumento significativo del rilascio di LDH nel CCM del compartimento basale è stato osservato dopo l'esposizione al controllo positivo per la rottura della membrana, un detergente Triton-X 100 (Figura 5). Questi risultati hanno dimostrato la reattività del modello a una sostanza citotossica, mentre nessun aumento del rilascio di LDH è stato osservato sulla stimolazione apica con TNF-z o LPS.
Una possibile ragione per i diversi valori misurati di LDH nei campioni assemblati con PBM freschi o precedentemente congelati può essere attribuita allo stoccaggio del campione. I campioni provenienti da PBM freschi sono stati conservati per un periodo più lungo a -80 gradi centigradi; pertanto, l'attività dell'enzima LDH può diminuire. In particolare, LDH è stabile solo fino a 4 giorni in CCM; quindi, si consiglia di eseguire il saggio gli ultimi 2 giorni dopo la raccolta dei supernatanti. In alternativa, è possibile congelare i supernatanti subito dopo la raccolta. Tuttavia, è importante considerare che il congelamento può diminuire l'attività ezimatica di LDH.
La secrezione di mediatori proinfiammatori (qui, TNF-z e interleukins 6 [IL-6] e 8 [IL-8]) nel CCM basale è stata quantificata tramite ELISA. Gli aumenti statisticamente significativi (p < 0,05, ANOVA uni controllo) sono stati osservati nel rilascio di IL-6 e IL-8 sia nei campioni trattati da LPS che in TNF-z rispetto alle rispettive cellule non trattate, nonché nei modelli di coltura cellulare assemblati da una delle due origini PBM (Figura 6). Sebbene le concentrazioni (pg/mL) di tutte le citochine testate nella CCM basale fossero più elevate nelle coculture composte da PBM freschi, le differenze tra le due coculture e monocolture non erano statisticamente significative (p > 0,05)(Figura 6). Per confermare il valore aggiunto dei modelli di cocoltura rispetto a una coltura cellulare epiteliale 2D, le monocolture A549 sono state esposte anche a LPS o TNF- . Come previsto, il rilascio di tutti i mediatori studiati dalle monocolture A549 è stato inferiore rispetto a entrambi i modelli di cocoltura; anche se, la differenza tra di loro non era statisticamente significativa (p > 0,05, ANOVA univo).
La morfologia cellulare della barriera del tessuto epiteliale alveolar umano 3D è stata valutata tramite microscopia a scansione laser confocale (LSM). Per visualizzare la composizione di ogni modello, i macrofagi all'interno dei modelli di cocoltura (MMM) sono stati macchiati con il marcatore di macrofago maturo 25F9. Gli MDDC sono stati macchiati di CD83, che è un marcatore importante per le cellule dendriticheattivate 30. Per quanto riguarda la morfologia cellulare, non è stata osservata alcuna differenza tra i modelli di cocoltura che utilizzano MMM e MDDC da PBM freschi rispetto a quelli che utilizzano PBM scongelati. Nelle coculture esposte da LPS e TNF- , entrambe composte da cellule immunitarie fresche e congelate, è stato osservato uno strato epiteliale interrotto nelle immagini LSM, che non era il caso nelle cellule non trattate (Figura 7, Figura 8).
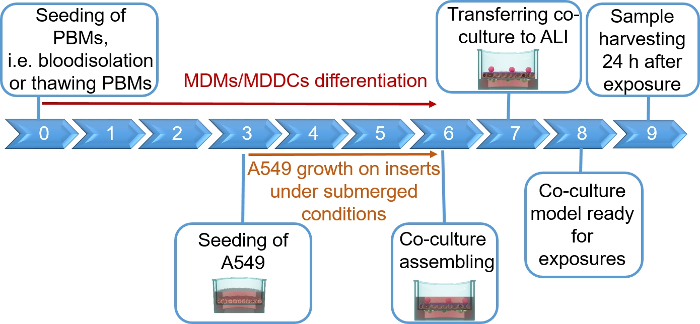
Figura 1: sequenza temporale schematica del protocollo. Presentazione della preparazione, dell'assemblaggio e dell'applicazione del modello di cocoltura 3D (esposizione a una sostanza testata). ALI - interfaccia aria-liquido, MDDC - cellule dendritiche derivate da monociti, MMM - macrofagi derivati da monociti, PBM , monociti del sangue periferici. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
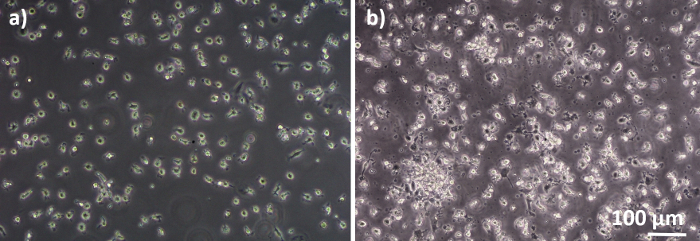
Figura 2: MPM e MDDC differenziati dai nuovi PBM. Immagine di microscopia a contrasto di fase di MDMdifferenziati( A ) e (B) da MPM freschi (6 giorni dopo l'isolamento delle cellule). Gli MMM sono a forma rotonda, mentre gli MDDC sono spesso osservati come agglomerati. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
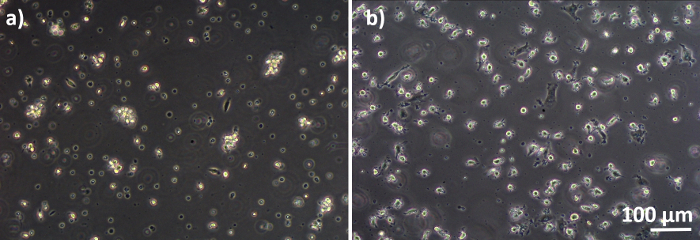
Figura 3: MPM e MDDC differenziati dai PBM congelati. Immagine di microscopia a contrasto di fase di MDMdifferenziati( A ) e (B) MDDC da PBM scongelati (6 giorni dopo lo scongelamento). Gli MMM sono a forma rotonda, ma alcune cellule allungate possono essere osservate. Gli MDDC appaiono anche a forma rotonda con protrusioni. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Crescita delle cellule epiteliali sugli inserti a membrana. Immagine di microscopia a contrasto di fase di A549 confluente che cresce su un inserto a membrana 4 giorni dopo la semina, formando un denso strato di cellule. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
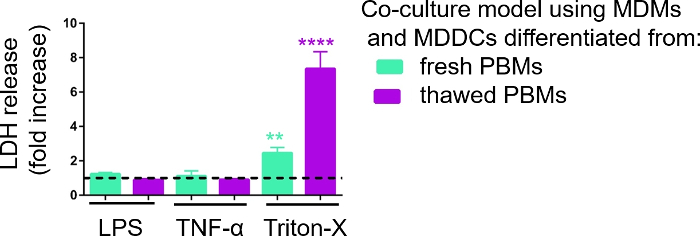
Figura 5: Risultati della citotossicità studiati tramite analisi A base di rottura della membrana (LDH). I dati sono presentati come un aumento di piegatura rispetto alle celle non trattate (media : SD, n e 3, l'asterisco indica un aumento statisticamente significativo rispetto alle celle non trattate, "p < 0,01, "p < 0.0001). Nei modelli verdi sono rappresentati MMM e MDDC da MPM freschi e in modelli viola assemblati da PBM scongelati sono rappresentati. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
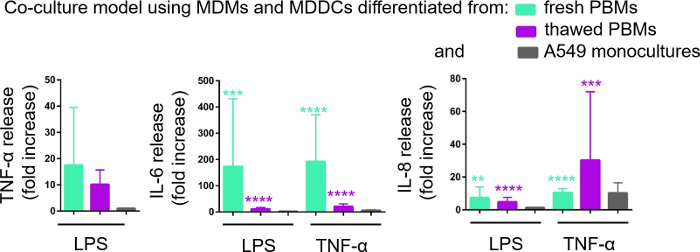
Figura 6: Reazioni proinfiammatorie nelle coculture e nelle monocolture. I mediatori proinfiammatori (TNF-z, IL-6 e IL-8) rilasciano nelle coculture dopo 24 h sfida con LPS o TNF-. I dati vengono presentati in relazione alle celle non trattate (media : SD, n e 3, p < 0,01, p < 0,001, p < 0,001). Nei modelli verdi sono rappresentati MMM e MDDC da MPM freschi e in modelli viola assemblati da PBM scongelati sono rappresentati. Il grigio rappresenta le monocolture A549. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
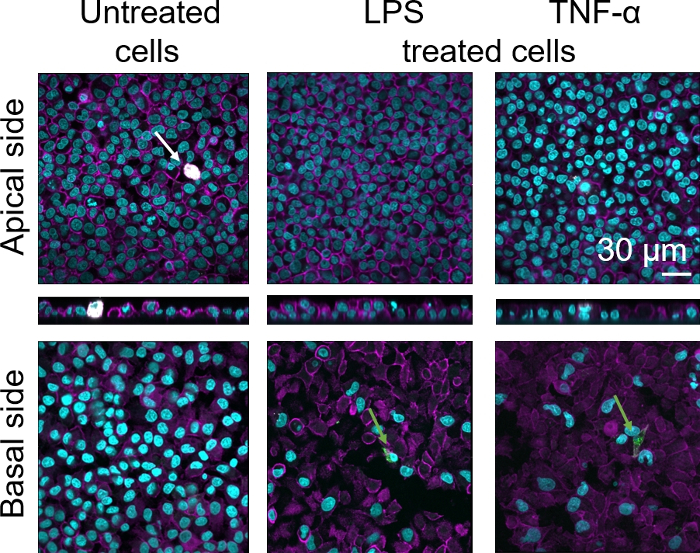
Figura 7: Morfologia delle coculture composta da cellule immunitarie fresche. Immagini LSM di lati apicali e basali del modello di cocoltura con proiezioni xz di lati apicali del modello utilizzando MMM e MDDC da MPM freschi. Cyan rappresenta i nuclei (DAPI), magenta rappresenta il citoscheletro (rhodamine-phalloidin), il bianco rappresenta gli MMM (25F9) e il verde rappresenta gli MDD (CD 83). La freccia bianca indica MDM, mentre la freccia verde indica MDDC. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
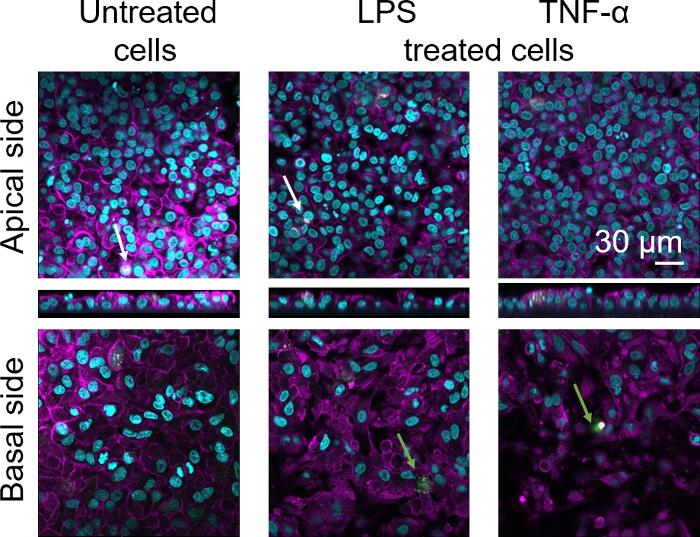
Figura 8: Morfologia delle coculture composte da cellule immunitarie congelate. Immagini LSM del lato apical del modello di cocoltura con proiezioni xz corrispondenti e lato basale del modello che utilizza MDM e MDDC da MPM scongelati. Cyan rappresenta nuclei (DAPI), magenta rappresenta citoscheletro (rhodamine-phalloidin), bianco rappresenta MDM (25F9) e verde rappresenta MDDCs (CD 83). La freccia bianca indica MDM, mentre la freccia verde indica MDDC. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
La produzione emergente di nuovi materiali, tra cui sostanze chimiche e farmaci, aumenta gradualmente la necessità di modelli in vitro predittivi. Per conformarsi ai tre principi di sostituzione, riduzione e perfezionamento della sperimentazioneanimale 32, i modelli cellulari in vitro sono diventati potenti strumenti per quanto riguarda l'aspetto di sostituzione e riduzione per chiarire i meccanismi di azione di un farmaco o del materiale8,9,10,11. Presentato qui è un protocollo dettagliato di assemblaggio del modello multicellulare utilizzando cellule immunitarie che sono o appena isolate o scongelate da monociti precedentemente congelati. Viene descritta anche la coltivazione del modello in ALI. Infine, il protocollo illustra un esempio di esposizione agli stimoli proinfiammatori e confronta la risposta dei due modelli contenenti monociti freschi o congelati.
Sono stati eseguiti vari studi per confermare e giustificare il valore aggiunto della maggiore complessità dei modelli coltivati ed esposti in condizioni ALI rispetto all'esposizione convenzionale sommersa7,22,31. L'osservazione della maggiore risposta proinfiammatoria nelle coculture rispetto alle monocolture delle cellule epiteliali conferma uno studio precedente. Lo studio ha utilizzato il modello di cocoltura presentato (stimolato con LPS) e ha mostrato una risposta più elevata ai livelli di espressione genica di TNF e IL1B rispetto al modello equivalente di monocoltura A5497. D'altra parte, entrambi i modelli hanno mostrato variazioni più elevate all'interno dei valori di rilascio del mediatore proinfiammatori misurati rispetto alle monocolture A549. Ciò può essere spiegato dall'uso di cellule immunitarie di diversi donatori (cappotti di bufala) all'interno di ripetizioni biologiche (cioè, una ripetizione, un donatore), come mostrato inprecedenza 7. Se lo si desidera, le variazioni tra le repliche possono essere superate di 1) utilizzando PBM scongelati dello stesso donatore o 2) un pooling di PBM da diversi donatori prima di congelare le cellule, quindi il successivo utilizzo dello stesso pool in ogni ripetizione. Si raccomanda anche l'inclusione di più ripetizioni biologiche.
La tecnica di congelamento delle cellule può essere considerata come un passo critico; tuttavia, è una procedura di laboratorio comune per preservare le cellule per l'analisi fenotipico e funzionale. Vari studi hanno dimostrato che la qualità dei PBM congelati è vitale per la loro sopravvivenza, e un'adeguata tecnica di congelamento è la chiave per il successo dei successivi saggi con le stessecellule 28,32. La modifica del protocollo può essere eseguita congelando i PBM, che fornisce flessibilità nella configurazione sperimentale, in quanto la disponibilità di cappotti buffy è solitamente limitata. Un altro vantaggio dell'utilizzo di PBM congelati (in diverse fiale) rispetto a quelli appena isolati è che possono essere utilizzati in esperimenti successivi anche dopo 1 anno. Questo riduce il potenziale problema della variabilità da donato a donatore se si tratta di un parametro desiderato o obbligatorio in uno sperimentale.
I risultati di un confronto interlaboratorio effettuato dopo un massimo di 13 mesi mostrano che i PBM, se correttamente conservati in un serbatoio di azoto liquido, possono essere utilizzati per un lungo periodo senza alcun effetto sulla vitalità cellulare o sul recupero cellulare33. Tempi di conservazione più lunghi (oltre 1 anno) possono essere possibili dopo un'attenta convalida della vitalità cellulare e della reattività delle cellule prima di eseguire un esperimento. Inoltre, la temperatura nel serbatoio di azoto liquido deve rimanere stabile in ogni momento. Il fattore principale che influisce sulla fattibilità dei PBM crioconservati è risultato essere la concentrazione DMSO, con una concentrazione ottimale del 10%-20 % (v/v)28. Per ridurre al minimo gli effetti potenzialmente dannosi del congelamento, diverse fonti di proteine, FBS o BSA (con un'ampia gamma di concentrazione dal 40% fino al 100 %34) sono spesso aggiunte al mezzo di congelamento come componenti protettivi naturali che possono aumentare la sopravvivenza delle cellule.
A causa dell'elevato potenziale citotossico del DMSO, si consiglia prima di disperdere i PBM in FBS, quindi aggiungere DMSO ai PBM già dispersi in FBS. In particolare, sebbene concentrazioni più elevate di FBS (>40%) non ha mostrato alcun miglioramento della vitalità cellulare, allo stesso tempo, non hanno causato danni alle cellule28. Tuttavia, congelare i monociti è un possibile approccio per superare i problemi di disponibilità limitata del cappotto buffy. Tuttavia, se si desidera l'uso di MDDC e MMI da MPM freschi, le cellule immunitarie possono essere differenziate e utilizzate 5-8 giorni dopol'isolamento 7,16,17,35,36,37. Se la pianificazione sperimentale lo consente, si raccomanda almeno 6 giorni di differenziazione sia negli MDDC che negli MMM. Tuttavia, la coerenza tra le diverse ripetizioni nello stesso esperimento, insieme alle ispezioni di routine delle loro espressioni specifiche dei marcatori di superficie, sono cruciali. Anche la reattività a uno stimolo proinfiammatorio, come LPS, dopo il tempo di differenziazione deve essere regolarmente controllata.
Molte indagini che utilizzano la linea cellulare A549 sono state eseguite all'ALI, sia come monocultura che in combinazione con altri tipi di cellule (macrofagi, cellule dendritiche o fibroblasti) nel modello di cocoltura 3D22,24,29,38. Utilizzando questo modello di cocoltura 3D, la citotossicità, lo stress ossidativo o gli effetti proinfiammatori di (nano-)materiali sono stati studiati per un massimo di 72 h1,17,21,24,29. La somiglianza del modello con il tessuto in vivo è stata precedentemente studiata sulla base dell'imaging a scansione laser confocale del modello16. Quando si assembla il modello, è importante considerare sia la proliferazione cellulare (che può influenzare A549 nel modello qui presentato) sia le prestazioni delle cellule immunitarie primarie (non proliferare) (qui, MDDC e MDM). È inoltre importante considerare che non tutti i monociti positivi del CD14 si differenziano in MDDC e MSM e che le cellule possono essere presenti sia in forma collegata che sospesa. In base alla natura dell'assieme della cocoltura (qui, entrambi i tipi di cellule devono essere attacchi allo strato epiteliale esistente), si consiglia di utilizzare solo le sotto-popolazioni aderenti di entrambi i tipi di cellule immunitarie. Inoltre, le analisi di routine di monociti, mdDC e risposta della monocultura MDM a LPS ed espressione di marcatori di superficie specifici (CD14, CD163, CD86, CD93 o CD206, dati non mostrati) hanno suggerito che 6 e 7 giorni di differenziazione sono i punti di tempo ottimali.
Anche se un numero realistico di cellule epiteliali alveolar nei polmoni umani corrisponde a 160.000 dollari/cm2, il numero di cellule A549 conteggiate nel modello è di 1.000.000 di cellule/cm2 dopo 9 giornicolturati sull'inserto 16,18. Pertanto, è necessario considerare i limiti di questo modello in vitro. In primo luogo, la densità delle cellule epiteliali è stata stabilita in base alla loro capacità di formare uno strato confluente sulla membrana in crescita. È anche importante ricordare che l'A549 rappresenta una cellula epiteliale di tipo II con una forma cuboiale, contrariamente alle cellule epiteliali di tipo I, che sono piatte e dispanate. D'altra parte, il numero richiesto di cellule immunitarie è stato stabilito sulla base della letteratura e presentato in questo protocollo come numero di cellulare / superficie area39,40,41. La densità cellulare degli MDDC nell'intervallo di 400 celle/mm2 (4 celle/cm2)16 è paragonabile alla densità delle cellule a stato costante di 500-750 cellule/mm2 (5- 7 cellule/cm2) riportata dagli studi in vivo39. La densità degli MMM in questo modello rientra nella stessa gamma di situazione in vivo nella regione alveolar umana40.
La colorazione matura del marcatore macrofago (25F9) è stata osservata sia nel lato apoco (dove sono presenti gli MSM) sia sul lato basale (cioè nel sito delle cellule dendritiche). La traslocazione delle cellule immunitarie attraverso i pori di inserti della membrana è possibile ed è stata osservata ancheutilizzando questo modello 16, che può spiegare le differenze osservate nelle intensità di colorazione. Tuttavia, un'altra possibile spiegazione è che il marcatore di macrofago maturo può essere espresso anche sulle cellule dendritiche, ma l'espressione è altamente specifica deldonatore 42. Inoltre, l'intensità dell'espressione 25F9 è molto più elevata negli MMM (Figura 7, Figura 8). Entrambi gli stimoli proinfiammatori (LPS e TNF-z) hanno influito sull'integrità della barriera epiteliale polmonare in entrambe le coculture (Figura 7, Figura 8). Questo era previsto sulla base di precedentipubblicazioni 43,44 che mostrano che le citochine proinfiammatiche e i prodotti batterici interrompono l'integrità delle barriere epiteliali.
Il modello multicellulare 3D dell'epitelio alveolare umano, stabilito e caratterizzato inprecedenza 17,è servito come strumento potente e utile per valutare le risposte biologiche (cioè, reazioni proinfiammatori acute, risposta allo stress ossidativo, distribuzione di particelle e comunicazione cellulare) in vitro21,24,25,45. I risultati confermano la responsabilità dei modelli di cocoltura a stimoli proinfiammatori (qui, LPS e TNF-z). La risposta è stata leggermente aumentata quando si utilizzano cellule immunitarie da PBM freschi; tuttavia, non vi era alcuna differenza statisticamente significativa tra le cocolture che utilizzano PBM freschi e scongelati. Inoltre, le reazioni proinfiammatorie di entrambi i modelli di cocoltura erano superiori a quelle delle monocolture cellulari epiteliali coltivate nelle stesse condizioni (ALI). In sintesi, il protocollo descrive l'assemblaggio di un modello di cocoltura del tessuto epiteliale alveolar umano 3D utilizzando PBM freschi o scongelati per la differenziazione in MDM e MDDC. È dimostrato che entrambi i modelli sono altamente reattivi agli stimoli proinfiammatori; pertanto, possono servire come potenti strumenti per potenziali valutazioni dei pericoli e della tossicità.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori ringraziano il Dr. Miguel Spuch-Calvar per lo schema di cocultura nella Figura 3 e alla Dott.ssa Bedia Begum Karakocak per la lettura critica. Questo studio è stato sostenuto dal progetto PATROLS, dal programma orizzonte 2020 dell'Unione europea per la ricerca e l'innovazione in base all'accordo n. 760813, e dalla Fondazione Adolphe Merkle. B.D. ringrazia la fondazione Peter und Traudl Engelhorn per il sostegno finanziario.
Materiali
| Name | Company | Catalog Number | Comments |
| Benchmark microplate reader | does not have to be specific, for example BioRad, Cressier, Switzerland | ||
| Cell culture Incubator | does not have to be specific | ||
| Cell freezing container (for example Mr. Frosty) | does not have to be specific | ||
| Centrifuge | does not have to be specific | ||
| Confocal laser scanning microscope | does not have to be specific, for example | Zeiss LSM 710 meta | |
| Heamatocytometer, or automatic cell counter | does not have to be specific | ||
| Laminar bio-safety hood class II | does not have to be specific | ||
| MultiStand Macs (Macs Cell Separator) | Miltenyi, Germany | 130-042-303 | |
| pH meter | does not have to be specific | ||
| Phase contrast inverted light microscope | does not have to be specific | ||
| Pipette boy, pipettors (different volumes) | do not have to be specific | ||
| Scissors | do not have to be specific | ||
| Vacuum pump | does not have to be specific | ||
| Water bath | does not have to be specific | ||
| Disposable small equipment/glassware | Catalogue Number | ||
| 15 mL and 50 mL conical centrifuge tubes | does not have to be specific | ||
| 6- and 12-well cell culture plates, flat bottom, low evaporation lid, sterile | Falcon, Switzerland | 353046 and 353043 | |
| Cell culture inserts, transparent PET membrane, 12-well, 3 μm pore size | Falcon, Switzerland | 353181 | |
| Cell scrapper | does not have to be specific, for example VWR, Switzerland | 353085 | |
| Cryovials | do not have to be specific | ||
| Glass autoclaved Petri Dishes | do not have to be specific | ||
| LS Columns | Miltenyi, Germany | 130-042-401 | |
| Sterile filtration cup for vacuum filtration, 0.2 μm pore size | does not have to be specific, for example VWR, Switzerland | 10040-446 | |
| Sterile Lab Bottle compatible with Filtration cup (min. 100 mL) | does not have to be specific | ||
| Sterile pipettes | do not have to be specific | ||
| Chemicals | |||
| Bovine serum albumine (BSA) | Sigma-Aldrich, Switzerland | A7030-100g | |
| CD14+ MicroBeads human - magnetic beads | Miltenyi, Germany | 130-097-052 | |
| Deattachnig agent Trypsin-EDTA, 0.05%, phenol red | Gibco, Switzerland | 25300054 | |
| Density gradient medium Lymphoprep | Alere Technologies AS, Norway | 1114547 | |
| Dimethyl Sulfoxide (DMSO) | Sigma Aldrich, Switzerland | D5879_1L | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich, Switzerland | E6758-100g | |
| Fetal bovine serum (heat inactivated) | Gibco, Switzerland | 10270-106 | |
| Human granulocyte-macrophage colony-stimulating factor (GM-CSF), premium grade | Miltenyi, Germany | 130-093-864 | |
| Human Interleukin 4 (IL-4), premium grade | Miltenyi, Germany | 130-095-373 | |
| Human macrophage colony-stimulating factor (M-CSF), premium grade | Miltenyi, Germany | 130-096-485 | |
| L-glutamine | Gibco, Switzerland | 25030-024 | |
| Lipopolysaccharid (LPS) from Escherichia coli | Sigma-Aldrich, Switzerland | 4524-5mg | |
| Paraformaldehyde (PFA) | Sigma-Aldrich, Switzerland | 158127 | |
| Penicilin-Streptomycin | Gibco, Switzerland | 31870-025 | |
| Phosphate Buffer Saline (PBS) | Gibco, Switzerland | 14190-094 | |
| Roswell Park Memorial Institute-1640 Medium (RPMI) | Gibco, Switzerland | 11875093 | |
| Triton X-100 | Sigma-Aldrich, Switzerland | T8787 | |
| Trypan blue solution (0.4%) | Sigma Aldrich, Switzerland | ||
| Tumor necrosis factor alpha (TNF-α) | Immunotools | 11343015 | |
| Assays used for cytotoxicity, (pro-)inflammatory response | |||
| Cytotoxicity Detection Kit (LDH) | Roche, Switzerland | 11644793001 | |
| Human IL-6 DuoSet ELISA | R&D, Biotechne, Switzerland | DY206 | |
| Human IL-8/CXCL8 DuoSet ELISA | R&D, Biotechne, Switzerland | DY208 | |
| Immunostaining | |||
| 4′,6-diamidino-2-phenylindole (DAPI), concentration 2 μg/mL | Sigma-Aldrich, Switzerland | 28718-90-3 | |
| Goat anti-mouse IgG (H+L) Alexa Fluor 647 conjugated, concentration 20 μg/mL | Abcam, UK | ab150115 | |
| Goat anti-rabbit IgG antibody (H+L) Dylight 488 conjugated, concentration 10 μg/mL | Agrisera, Sweden | AS09 633 | |
| Mature Macrophage Marker Monoclonal Antibody, concentration 50 μg/mL | eBioScience, Thermo Fischer, Switzerland | 14-0115-82 | |
| Phalloidin rhodamine, concentration 0.264 µM | Molecular Probes, Life Technologies, Switzerland | R415 | |
| Recombinant Anti-CD83 antibody, 1:50 dillution | Abcam, UK | ab244204 |
Riferimenti
- Rothen-Rutishauser, B., Blank, F., Mühlfeld, C., Gehr, P. In vitro models of the human epithelial airway barrier to study the toxic potential of particulate matter. Expert Opinion on Drug Metabolism and Toxicology. 4 (8), 1075-1089 (2008).
- Giard, D., et al. In vitro cultivation of human tumors: establishment of cell lines derived from a series of solid tumors. Journal of National Cancer Institute. 51 (5), 1417-1423 (1973).
- Ochs, M., Weibel, E. R., Grippi, M. A. Ch. 2: Functional Design of the Human Lung for Gas Exchange . Fishman's Pulmonary Diseases and Disorders, 5e. , (2008).
- Foster, K. A., Oster, C. G., Mayer, M. M., Avery, M. L., Audus, K. L. Characterization of the A549 Cell Line as a Type II Pulmonary Epithelial Cell Model for Drug Metabolism. Experimental Cell Research. 243 (2), 359-366 (1998).
- Guo, X. Y., Lu, M., Chen, X. Q., He, F. D., Li, A. Correlation study of biological characteristics of non-small cell lung cancer A549 cells after transfecting plasmid by microbubble ultrasound contrast agent. Asian Pacific Journal of Tropical Medicine. 9 (6), 582-586 (2016).
- Cooper, J. R., et al. Long Term Culture of the A549 Cancer Cell Line Promotes Multilamellar Body Formation and Differentiation towards an Alveolar Type II Pneumocyte Phenotype. PLoS ONE. 11 (10), 0164438 (2016).
- Bisig, C., Voss, C., Petri-Fink, A., Rothen-Rutishauser, B. The crux of positive controls - Proinflammatory responses in lung cell models. Toxicology In Vitro. 54, 189-193 (2019).
- Rothen-Rutishauser, B., et al. A newly developed in vitro model of the human epithelial airway barrier to study the toxic potential of nanoparticles. ALTEX. 25, (2008).
- Braakhuis, H. M., et al. Progress and future of in vitro models to study translocation of nanoparticles. Archives of Toxicology. 89 (9), 1469-1495 (2015).
- Thai, P., Chen, Y., Dolganov, G., Wu, R. Differential regulation of MUC5AC/Muc5ac and hCLCA-1/mGob-5 expression in airway epithelium. American Journal of Respiratory Cell and Molecular Biology. 33 (6), 523-530 (2005).
- Wu, J., et al. Characterization of air-liquid interface culture of A549 alveolar epithelial cells. Brazilian Journal of Medical and Biological Research. 51 (2), 6950 (2017).
- Shapiro, D. I., Nardone, L. L., Rooney, S. A., Motoyama, E. K., Munoz, J. L. Phospholipid biosynthesis and secretion by a cell line (A549) which resembles type II aleveolar epithelial cells. Biochimica and Biophysica Acta. 530 (2), 197-207 (1978).
- Balis, J., Bumgarner, S. D., Paciga, J. E., Paterson, J. F., Shelley, S. A. Synthesis of lung surfactant-associated glycoproteins by A549 cells: description of an in vitro model for human type II cell dysfunction. Experimental Lung Research. 6 (3-4), 197-213 (1984).
- Schurch, S., Gehr, P., Im Hof, V., Geiser, M., Green, F. Surfactant displaces particles toward the epithelium in airways and alveoli. Respiration Physiology. 80 (1), 17-32 (1990).
- Gehr, P., Schurch, S., Berthiaume, Y., Hof, V. I., Geiser, M. Particle Retention in Airways by Surfactant. Journal of Aerosol Medicine. 3 (1), 27-43 (2009).
- Blank, F., Rothen-Rutishauser, B., Gehr, P. Dendritic Cells and Macrophages Form a Transepithelial Network against Foreign Particulate Antigens. American Journal of Respiratory Cell and Molecular Biology. 36 (6), (2007).
- Rothen-Rutishauser, B. M., Kiama, S. G., Gehr, P. A three-dimensional cellular model of the human respiratory tract to study the interaction with particles. American Journal of Respiratory Cell and Molecular Biology. 32, (2005).
- Blank, F., Rothen-Rutishauser, B. M., Schurch, S., Gehr, P. An optimized in vitro model of the respiratory tract wall to study particle cell interactions. Journal of Aerosol Medicine. 19, (2006).
- Jardine, L., et al. Lipopolysaccharide inhalation recruits monocytes and dendritic cell subsets to the alveolar airspace. Nature Communications. 10 (1), 1999 (2019).
- Kopf, M., Schneider, C., Nobs, S. P. The development and function of lung-resident macrophages and dendritic cells. Nature Immunology. 16 (1), 36-44 (2015).
- Chortarea, S., et al. Repeated exposure to carbon nanotube-based aerosols does not affect the functional properties of a 3D human epithelial airway model. Nanotoxicology. 9 (8), 983-993 (2015).
- Hilton, G., Barosova, H., Petri-Fink, A., Rothen-Rutishauser, B., Bereman, M. Leveraging proteomics to compare submerged versus air-liquid interface carbon nanotube exposure to a 3D lung cell model. Toxicology In Vitro. 54, 58-66 (2019).
- Brandenberger, C., et al. Effects and uptake of gold nanoparticles deposited at the air-liquid interface of a human epithelial airway model. Toxicology and Applied Pharmacology. 242, (2010).
- Drasler, B., et al. Single exposure to aerosolized graphene oxide and graphene nanoplatelets did not initiate an acute biological response in a 3D human lung model. Carbon. 137, 125-135 (2018).
- Durantie, E., et al. Carbon nanodots: Opportunities and limitations to study their biodistribution at the human lung epithelial tissue barrier. Biointerphases. 13, (2018).
- Brandenberger, C., et al. Quantitative evaluation of cellular uptake and trafficking of plain and polyethylene glycol-coated gold nanoparticles. Small. 6 (15), 1669-1678 (2010).
- Tomašek, I., et al. Combined exposure of diesel exhaust particles and respirable Soufrière Hills volcanic ash causes a (pro-)inflammatory response in an in vitro multicellular epithelial tissue barrier model. Particle and Fibre Toxicology. 13 (1), 67 (2016).
- Nazarpour, R., et al. Optimization of Human Peripheral Blood Mononuclear Cells (PBMCs) Cryopreservation. International Journal of Molecular and Cellular Medicine. 1 (2), 88-93 (2012).
- Endes, C., et al. An in vitro testing strategy towards mimicking the inhalation of high aspect ratio nanoparticles. Particle and Fibre Toxicology. 11 (1), (2014).
- Ju, X., et al. The Analysis of CD83 Expression on Human Immune Cells Identifies a Unique CD83+-Activated T Cell Population. Journal of Immunology. 197 (12), 4613-4625 (2016).
- Lenz, A. G., et al. Inflammatory and Oxidative Stress Responses of an Alveolar Epithelial Cell Line to Airborne Zinc Oxide Nanoparticles at the Air-Liquid Interface: A Comparison with Conventional, Submerged Cell-Culture Conditions. BioMed Research International. , 12 (2013).
- Germann, A., Schulz, J. C., Kemp-Kamke, B., Zimmermann, H., von Briesen, H. Standardized serum-free cryomedia maintain peripheral blood mononuclear cell viability, recovery, and antigen-specific T-cell response compared to fetal calf serum-based medium. Biopreservation and Biobanking. 9 (3), 229-236 (2011).
- Weinberg, A., et al. Optimization and Limitations of Use of Cryopreserved Peripheral Blood Mononuclear Cells for Functional and Phenotypic T-Cell Characterization. Clinical and Vaccine Immunology. 16 (8), 1176 (2009).
- Freshney, R. I., Freshney, R. I. . Culture of animal cells: a manual of basic technique. , 321-334 (2005).
- Lehmann, A. B. C., Blank, F., Gehr, P., Rothen-Rutishauser, B., Yarmush, M. L., Langer, R. S. . Alternatives to animal testing. , 239-260 (2010).
- Steiner, S., et al. Reduction in (pro-)inflammatory responses of lung cells exposed in to diesel exhaust treated with a non-catalyzed diesel particle filter. Atmospheric Environment. 81, 117-124 (2013).
- Martinez, F. O., Gordon, S., Locati, M., Mantovani, A. Transcriptional Profiling of the Human Monocyte-to-Macrophage Differentiation and Polarization: New Molecules and Patterns of Gene Expression. The Journal of Immunology. 177 (10), 7303 (2006).
- Chortarea, S., et al. Profibrotic activity of multi-walled carbon nanotubes upon prolonged exposures in different human lung cell types. Applied In Vitro Toxicology. 5 (1), (2019).
- Holt, P. G. Pulmonary Dendritic Cells in Local Immunity to Inert and Pathogenic Antigens in the Respiratory Tract. Proceedings of the American Thoracic Society. 2 (2), 116-120 (2005).
- Pinkerton, K. E., Gehr, P., Castañeda, A., Crapo, J. D., Parent, R. A. . Comparative Biology of the Normal Lung (Second Edition). , 105-117 (2015).
- Crapo, J., Barry, B., Gehr, P., Bachofen, M., Weibel, E. R. Cell number and cell characteristics of the normal human lung. American Review of Respiratory Disease. 126 (2), 332-337 (1982).
- Maniecki, M. B., Møller, H. J., Moestrup, S. K., Møller, B. K. CD163 positive subsets of blood dendritic cells: The scavenging macrophage receptors CD163 and CD91 are coexpressed on human dendritic cells and monocytes. Immunobiology. 211 (6), 407-417 (2006).
- Chignard, M., Balloy, V. Neutrophil recruitment and increased permeability during acute lung injury induced by lipopolysaccharide. American Journal of Physiology-Lung Cellular and Molecular Physiology. 279 (6), 1083-1090 (2000).
- Coyne, C. B., et al. Regulation of Airway Tight Junctions by Proinflammatory Cytokines. Molecular Biology of the Cell. 13 (9), 3218-3234 (2002).
- Durantie, E., et al. Biodistribution of single and aggregated gold nanoparticles exposed to the human lung epithelial tissue barrier at the air-liquid interface. Particle and Fibre Toxicology. 14 (49), (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon