Method Article
Modelo alveolar humano multicelular compuesto por células epiteliales y células inmunes primarias para la evaluación de riesgos
* Estos autores han contribuido por igual
En este artículo
Resumen
Aquí se presenta un protocolo para el aislamiento primario de monocitos de sangre humana, así como su diferenciación en macrófagos y células dendríticas y el montaje con células epiteliales en un modelo pulmonar humano multicelular. Se comparan las respuestas biológicas de las cocultivos compuestas de células inmunitarias diferenciadas de los monocitos recién aislados o descongelados, tras la exposición a estímulos proinflamatorios.
Resumen
Un modelo de cocultivo de células alveolares humanas se describe aquí para la simulación de la barrera del tejido epitelial alveolar compuesta de células epiteliales alveolares tipo II y dos tipos de células inmunitarias (es decir, macrófagos derivados de monocitos humanos [MDM] y células dendríticas [MDDC]). Se proporciona un protocolo para ensamblar el modelo multicelular. Las células epiteliales alveolares (línea celular A549) se cultivan y diferencian en condiciones sumergidas en plaquitas permeables en pozos de dos cámaras, luego se combinan con MDM y MDDC diferenciados. Finalmente, las células se exponen a una interfaz aire-líquido durante varios días. Como las células inmunitarias primarias humanas necesitan ser aisladas de las capas de puly humanas, las células inmunitarias diferenciadas de los monocitos frescos o descongelados se comparan con el fin de adaptar el método en función de las necesidades experimentales. Los modelos tridimensionales, compuestos por células alveolares con células inmunitarias recién aisladas o descongeladas derivadas de monocitos, muestran un aumento estadísticamente significativo de la liberación de citoquinas (interleukins 6 y 8) tras la exposición a estímulos proinflamatorios (lipopolisacárido y factor de necrosis tumoral) en comparación con las células no tratadas. Por otro lado, no hay diferencia estadísticamente significativa entre la liberación de citoquinas observada en las coculturas. Esto demuestra que el modelo presentado responde a estímulos proinflamatorios en presencia de MDM y MDDC diferenciados de monocitos de sangre periférica fresca o descongelados (PBM). Por lo tanto, es una herramienta poderosa para las investigaciones de la respuesta biológica aguda a diferentes sustancias, incluyendo fármacos aerosolizados o nanomateriales.
Introducción
Los cultivos in vitro de células pulmonares ofrecen plataformas rentables, robustas y bien controladas para evaluar los peligros de los aerosoles1. Como sistema celular modelo para neumocitos alveolares humanos, la línea celular epitelial A549 aislada de un adenocarcinoma pulmonar se utiliza a menudo2. Estas células representan células epiteliales de tipo II escamosas de la región alveolar3 y son una línea celular pulmonar ampliamente utilizada para la evaluación de peligros y toxicidad1,4,5,6,7,8,9,10. La línea celular A549 posee características relevantes de las células epiteliales alveolares tipo II, como la presencia de cuerpos lamelares característicos que contienen fosfolípidos densamente embalados3.
Se ha demostrado que cuando las células se cultivan en una interfaz aire-líquido (ALI), el surfactante se libera en el lado apical de las células epiteliales expuestas al aire, reduciendo la tensión superficial11,12,13. Esta característica es particularmente importante en las investigaciones de peligro respiratorio y toxicidad de nanomateriales. Una vez que los nanomateriales/tóxicos inhalados se depositan en la región alveolar, primero interactúan con el tensioactivo pulmonar y son desplazados por las fuerzas humectantes en la hipofase acuosa, donde la interacción con las células pulmonares tiene lugar14,15. A pesar de que las células A549 forman una monocapa (que puede crecer en exceso en multicapas en momentos posteriores cuando se cultiva en ALI) y producir surfactante, un inconveniente es su formación de unión estrecha insuficiente, lo que resulta en valores bajos de resistencia eléctrica transepitelial, pero todavía presentando una barrera funcional contra la translocación intercelular (nano)partículas16,,17,,18.
En los pulmones, hay una variedad de poblaciones de células inmunitarias, incluyendo células fagocíticas y profesionales que presentan antígenos (es decir, macrófagos y células dendríticas) que se comunican directamente a través del contacto celular-célula o la señalización intercelular para controlar y mantener la homeostasis. Los macrófagos y las células dendríticas son efectores inmunes innatos críticos e iniciadores de la respuesta inmune adaptativa19. Las células dendríticas que residen dentro o debajo del epitelio pueden formar protuberancias a través del epitelio hasta el lumen para atrapar antígenos. Los macrófagos alveolares se encuentran en la superficie apical del epitelio y actúan como células centinela, representando la primera defensa celular contra el material extraño, así como las infecciones bacterianas, virales y fúngicas. Su plasticidad fenotípica permite la rápida inducción de reacciones proinflamatorias en respuesta a tales estímulos, así como el cambio a reacciones antiinflamatorias desencadenantes (es decir, inhibitorias)20.
Para simular la barrera del tejido epitelial alveolar humano, establecimos un modelo de triple cocultura con células A549 complementadas con macrófagos humanos derivados de monocitos sanguíneos (MDM) y células dendríticas (MDDC) en los lados apical y basal, respectivamente17. El cultivo de este modelo en ALI se ha notificado previamente16, incluso hasta 72 h después de la exposición21. Las respuestas inmunitarias agudas a las exposiciones a nanotubos de carbono se mejoraron significativamente en el cultivo celular expuesto al ALI en comparación con las condiciones sumergidas22. El modelo de cocultura, cultivado y expuesto a diferentes materiales en ALI, se ha utilizado previamente para investigar la citotoxicidad, el estrés oxidativo y las respuestas inflamatorias sobre exposiciones al óxido de zinc,23 materiales relacionados con elgrafeno 24,nanopartículas de oro25,,26,nanotubos de carbono21,y las partículas de escape de ceniza volcánica y diésel27.
Además, se ha confirmado el importante papel de los macrófagos y las células dendríticas como células efectores inmunes en un modelo pulmonar humano in vitro. En particular, sólo se observó una mayor respuesta proinflamatoria en el modelo en presencia de células inmunitarias en comparación con los sistemas monocultivos7. Los posibles inconvenientes del uso de células inmunitarias derivadas de monocitos primarios son la accesibilidad limitada de los PMM, así como la variación de donante a donante. Como solución a estos posibles inconvenientes, se presenta aquí un protocolo que introduce la criopreservación de PRM28 recién aislados para el ensamblaje del modelo de cultivo celular. El objetivo de este estudio es demostrar el ensamblaje del modelo de tejido epitelial alveolar humano 3D, incluyendo el aislamiento de PPM de batas de color humano. La capacidad de respuesta a los estímulos proinflamatorios se compara con el modelo compuesto de MDM y MDDC diferenciados de los PBM frescos o diferenciados de los PBM congelados o descongelados.
Trabajar con muestras de sangre humana no probadas implica atención específica para prevenir la transmisión potencial de enfermedades infecciosas, como el VIH (virus de inmunodeficiencia humana), la hepatitis B y la hepatitis C. Por lo tanto, el uso de medidas de protección personal como guantes, batas, máscaras y protección ocular son cruciales y deben estar de acuerdo con los principios de buenas prácticas de laboratorio. Estas protecciones reducen el riesgo de exponer la piel o las membranas mucosas a fluidos potencialmente infecciosos. Además, para los que se dedican a la manipulación de batas y PPM, la vacunación contra el virus de la hepatitis B es obligatoria, y los niveles de títulos sanguíneos de anticuerpos contra la hepatitis B deben ser superiores a 100 UI/L (es necesario abordar los requisitos legislativos específicos de cada país). Además, todo el trabajo debe realizarse en laboratorios de nivel 2 de bioseguridad (es necesario abordar los requisitos legislativos específicos de cada país). Al llevar a cabo todo el protocolo, deben adoptarse precauciones estándar de salud y seguridad asociadas con el trabajo en un entorno de laboratorio y la manipulación del cultivo celular de mamíferos, incluida la manipulación de residuos.
Protocolo
El trabajo en el que participaron monocitos primarios aislados de sangre humana fue aprobado por el comité de la Oficina Federal de Salud Pública de Suiza (número de referencia: 611-1, Meldung A110635/2) para el Instituto Adolphe Merkle.
1. Aislamiento de monocitos de sangre periférica (PRM) de las capas de puly humana
NOTA: La siguiente sección describe el aislamiento de las células inmunitarias de una bolsa de 50 ml de una capa de buffy, comprada en el Centro Suizo de Transfusión en Berna, Suiza.
- Preparación de reactivos
- Preparar 100 ml de tampón de separación magnética por capa buffy: 0,5% [p/v] albúmina sérica bovina (BSA; en solución salina tamponada de fosfato [PBS]) con ácido etilendiaminetetraacético de 2 mM (EDTA), y ajustar a pH a 7,2, filtro estéril con 0,22 mm de tamaño de poro). Mantener a 4 oC durante todo el procedimiento.
- Preparar el medio de cultivo celular (CCM): RPMI 1640 con suero bovino fetal (FBS) 10% [v/v], 1% [v/v] L-glutamina (aquí, 2 mM de L-glutamina), y 1% [v/v] penicilina-estreptomicina (aquí, 100 unidades/penicilina mL y 100 g/mLlcecina).
NOTA: La cantidad necesaria de cada reactivo depende del número de celdas que se van a sembrar en los pasos siguientes.
- Aislamiento de PMM
NOTA: Todo el vidrio y la plastificación deben esterilizarse antes de su uso. Por razones de seguridad, se recomienda el uso de material plástico al manipular muestras de sangre humana para reducir el riesgo de lesiones con cristalería.- Utilice tijeras para abrir el extremo de la manguera de la bolsa que contiene la capa buffy.
- Distribuya la capa buffy vertiendo el contenido de la bolsa a través del conducto de la bolsa directamente en dos tubos cónicos de centrífuga de 50 ml (25 ml cada uno).
- Vierta o pipetee suavemente PBS en los tubos para alcanzar volúmenes de 50 ml. Mezcle el contenido girando el tubo suavemente al revés 3x.
- Divida la mezcla buffy coat-PBS en cuatro nuevos tubos de centrífuga cónica de 50 ml pipeteando 25 ml de la mezcla en cada tubo fresco.
- Coloca lentamente 13 ml de medio de gradiente de densidad debajo de la mezcla buffy coat-PBS usando una pipeta serológica de 10 ml. Separe la pipeta rellena del soporte de la pipeta y enchufe inmediatamente la abertura superior de la pipeta con un pulgar para evitar cualquier fuga adicional del medio de gradiente de densidad en la mezcla de capa de color beige-PBS.
NOTA: Sosteniendo la abertura superior con el pulgar, coloque la pipeta rellena en la parte inferior del tubo de centrífuga cónica de modo que el medio de gradiente de densidad fluya lentamente por debajo de la mezcla buffy coat-PBS, dejando aproximadamente 1 ml del medio de gradiente de densidad dentro de la pipeta. - Repita el paso 1.2.5 con los otros tres tubos que contienen la mezcla buffy coat-PBS.
- Centrifugar los cuatro tubos que contienen las mezclas durante 20 min a 1.000 x g y 25 oC en un modo de frenado lento. Utilice soportes con tapas protectoras para la centrifugación.
- Abra la tapa de cada tubo, retire la capa superior que contiene plasma y plaquetas utilizando una pipeta serológica y deseche en un recipiente de residuos líquidos biopeligroso.
- Utilice una pipeta serológica para recoger la capa de célula mononuclear de sangre periférica, que aparece como una pequeña fracción turbia blanquecina (2-3 mm de espesor) entre el plasma y las capas medias de gradiente de densidad. El pellet contiene glóbulos rojos en la parte inferior. Evite transferir eritrocitos que forman la capa inferior. Repite esto para los cuatro tubos.
NOTA: Las células mononucleares de sangre periférica consisten en PBM y linfocitos. Los PPM se separarán de los linfocitos más tarde durante la separación magnética de CD14+. - Acose células mononucleares de sangre periférica de cuatro tubos en dos tubos de 50 ml.
- Llene los dos tubos con PBS a 50 mL y cubra con una tapa.
- Deseche los eritrocitos y el plasma sobrantes de los cuatro tubos originales en un contenedor de residuos líquidos biopeligroso.
- Centrifugar los dos tubos durante 8 min a 500 x g y 18–20 oC a una velocidad de centrífuga regular.
- Después de la centrifugación, retire el sobrenadante con una pipeta serológica y deséchelo en un recipiente de residuos líquidos biopeligrados.
- Resuspender las células con 5 ml de PBS utilizando una pipeta serológica.
- A la vez, ensacama las suspensiones celulares en un tubo de centrífuga cónica de 50 ml y llene a 50 ml con PBS.
- Utilice 5 l de la suspensión celular para contar las celdas con un contador de celdas utilizando el método de exclusión trypan blue (45 l).
- Pipetear 10 l de la solución trypan blue-PBMs en una cámara de contador de células y contar el número de celdas según el protocolo de conteo estándar. Utilice la ecuación 1 para calcular el número de celda total, CT.
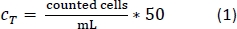
- Después de contar las células, centrifugar el tubo de 50 ml como se hace en el paso 1.2.13.
- Selección positiva cd14
- Abra suavemente la tapa de cada tubo, luego retire y deseche el sobrenadante con una pipeta serológica sin alterar el pellet.
- Agregue la cantidad calculada (Ecuación 2) del búfer de separación magnética (aquí, 80 ml de tampón por 1 x 107 celdas totales) y resuspendir el pellet celular pipeteando la solución hacia arriba y hacia abajo.
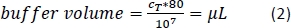
- Calcular utilizando la Ecuación 3 (aquí, 10 l por 1 x 107 celdas totales) el volumen correspondiente de perlas magnéticas CD14+ y pipetear el volumen adecuado.
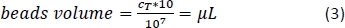
- Mezclar bien pipeteando hacia arriba y hacia abajo, cerrar la tapa e incubar la solución a 4 oC durante 15 min.
- Tras la incubación, llene el tubo hasta 50 ml con tampón de separación magnética.
- Centrifugar como se hace en el paso 1.2.13.
- Aspirar y desechar el sobrenadante con una pipeta serológica sin alterar el pellet celular.
- Pipetear la cantidad correspondiente de búfer de separación magnética (Ecuación 4; aquí, 500 ml de tampón por 1 x 108 celdas) y mezclar suavemente pipeteando hacia arriba y hacia abajo 3x.
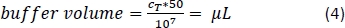
- Desinfecte la estación de separación magnética rociándola y limpiándola con un agente esterilizante. Coloque en la campana de flujo laminar junto con la columna para la separación magnética.
- Coloque la columna de separación magnética en el campo magnético y coloque un tubo de centrífuga cónica vacío de 50 ml directamente debajo de la columna para recoger las celdas de lavado y sin etiquetar (es decir, residuos).
- Enjuague la columna de separación magnética pipeteando 3 ml de búfer de separación magnética en la columna. No deje que la columna se seque durante todo el procedimiento.
- Preparar un tubo de centrífuga cónica de 15 ml y pipeta de 1 ml de tampón de separación magnética.
- Aplique la suspensión celular (preparada en el paso 1.3.8) a la columna de separación magnética. En el tubo de centrífuga cónica de 50 ml debajo del filtro, recoja las células sin etiquetar que pasaron.
NOTA: No exceda 2 x 109 celdas por columna para evitar el bloqueo de la columna. - Tan pronto como el depósito de la columna esté vacío (es decir, cuando las celdas hayan pasado a través de la columna), aplique 3 ml de búfer de separación magnética utilizando una pipeta serológica y déjela pasar a través de la columna. Repita este 3x.
- Retire la columna de separación magnética del separador magnético tirando suavemente con las manos y colóquela en un tubo de 15 ml que contenga 1 ml pre-pipetado de búfer de separación magnética (preparado en el paso 1.3.12).
- Agregue 5 ml de búfer de separación magnética a la columna y expulse las celdas etiquetadas magnéticamente empujando firmemente el émbolo en la columna.
- Preparación de reactivos para diferenciación de MDM y MDDC
- Cuente las celdas con un contador de celdas utilizando el método de exclusión azul de trypan como se hace en el paso 1.2.17.
- Calcule los volúmenes requeridos de CCM o FBS para pasos adicionales de la siguiente manera: ya sea el volumen de CCM correspondiente a una densidad de celdas de 1 x10 6 células/ml (paso 1.5.1), o el volumen de FBS correspondiente a una densidad de celda de 6 x 106 celdas por 0,9 ml de FBS (paso 1.6.3).
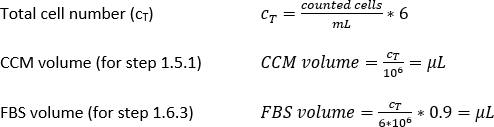
- Cierre la tapa, coloque el tubo en la centrífuga y centrifugar como se hace en el paso 1.2.13. Retire y deseche el sobrenadante sin alterar el pellet celular. Continúe con el paso 1.5 para la siembra de celdas o el paso 1.6 para la congelación de celdas.
- Siembra y diferenciación de PBM en MDM y MDDC
- Resuspender el pellet celular en el volumen calculado de CCM calculado en el paso 1.4.2 (aquí, una concentración final de 1 x 106 células/ml) pipeteando hacia arriba y hacia abajo 3x.
- Pipetear el número de células destinadas a diferenciarse en MDM y MDDC en tubos de centrífuga cónica separados utilizando una pipeta serológica.
- Pipetear factores diferenciadores al MCP con PBM y mezclar bien pipeteando arriba y abajo. Los factores diferenciadores se aplican de la siguiente manera:
- Para MDDC: concentración final de 10 ng/mL interleucina-4 (IL-4) y 10 ng/mL granulocitos-macrofagos factor estimulante de colonias (GM-CSF).
- Para los MDM: concentración final de 10 ng/mL de factor estimulante de colonias de macrófagos (M-CSF).
- Pipetear las suspensiones celulares en CCM con los factores diferenciadores añadidos en 6 placas de pozo mediante la distribución de 3 ml de la suspensión por pozo (corresponde a 3 x 106 células/pozo, es decir, 1 x 106 células/ml).
- Colocar las 6 placas de pozo en una incubadora de cultivo celular (37 oC, 5% CO2)y dejar que se diferencien durante 6 días sin actualizar el MCP.
NOTA: La diferenciación oscila entre 5 y 8 días dependiendo de la disponibilidad local de las capas de buffy y la configuración experimental, siempre que la eficiencia de diferenciación se determine utilizando las técnicas adecuadas (consulte la sección de discusión).
- Congelación de PBM
- Resuspender el pellet celular en un medio crioprotector (aquí, FBS y dimetil sulfóxido [DMSO; citotóxico]) en una proporción de 9:1 (v/v) pipeteando un volumen de FBS precalentado. Esto corresponde a una concentración de célula final de 6 x 106 células/ml, teniendo en cuenta una adición adicional de 10% DMSO (v/v).
- Marque el número deseado de crioviales en la campana de flujo laminar (es decir, registre la fecha, el código de aislamiento y el número de celdas).
- Pipeta 0,9 ml de suspensión celular en FBS puro (aquí, 6 x 106 células en 0,9 ml de FBS) a cada criovial. Posteriormente, pipetear lentamente 0,1 mL de DMSO y mezclar bien la suspensión girando los crioviales hacia arriba y hacia abajo 3x.
- Transfiera los crioviales a un recipiente de congelación celular y establézcalo inmediatamente en -80 oC durante 24 h.
- Después de 24 h, retire los crioviales del congelador y recipiente de -80 oC y colóquelos en el tanque de nitrógeno líquido adecuado para el almacenamiento celular.
- Descongelación y diferenciación de PBM en MDM y MDDC
- Caliente todos los reactivos requeridos a 37oC en un baño de agua (20–30 min).
- Preparar el número adecuado de 6 placas de pozo correspondientes al número de celdas descongeladas (aquí, una placa por 1,8 x 107 células, es decir, 3 crioviales). Pipeta de 2 ml de MCP a cada pozo en condiciones asépticas. Colocar las placas en la incubadora (5 % CO2, 37 oC) durante 15 min para permitir que el pH se equilibre.
- Tome la cantidad necesaria de crioviales con células congeladas de un tanque de nitrógeno líquido y arremolinalos suavemente en un baño de agua de 37 oC (1-2 min) para asegurar el descongelación uniforme de la suspensión celular.
- Retire el criovial del baño de agua y descontamine con un agente esterilizante, asegurándose de que el agente no interactúe con la tapa y la junta tórica.
NOTA: A continuación, todos los pasos deben completarse en condiciones asépticas. - Preparar el número adecuado de tubos de centrífuga cónica de 15 ml correspondiente al número de crioviales a descongelar (aquí, 6 x 106 células/tubo). Pipeta 9 mL de CCM precalentado en cada tubo.
- Pipetear lentamente (gota por gota) el contenido del criovial en un tubo que contiene CCM. Cierre la tapa, repita para cada tubo y centrifugar a 200 x g durante 5 minutos a una velocidad de centrífuga regular.
- Deseche el sobrenadante sin alterar el pellet.
- Resuspender el pellet de cada tubo (que contiene células de un criovial) en 2 ml de CCM preadmanido pipeteando hacia arriba y hacia abajo usando una pipeta serológica (densidad celular correspondiente a 3 x 106 células/ml).
- De cada tubo, pipetear las células resuspendidas en dos pozos (1 ml por pozo) de una placa de 6 pozos que contenga 2 ml de CCM previamente preparado para alcanzar una densidad celular de 3 x 106 células/pozo (correspondiente a una concentración final de 1 x 106 células/ml). Repita esto para todos los demás tubos.
- Proceda con la diferenciación como se describe en la sección 1.5.3.
- Colocar las 6 placas de pozo en una incubadora de cultivo celular (37 oC, 5% CO2)y dejar que se diferencien durante 6 días sin actualizar el MCP.
2. Modelo de cocultura de células triples del tejido epitelial alveolar humano
NOTA: Esta sección proporciona instrucciones sobre volúmenes y números de celda correspondientes a 12 plaquitas de placa depozo. En la figura 1 se resume una escala de tiempo propuesta para el ensamblaje del modelo.
- Siembra de células epiteliales (línea celular A549)
- Cultivar las células epiteliales de acuerdo con las recomendaciones proporcionadas por el proveedor (ATTC). Brevemente, subcultura las células en el MCP en 80% de confluencia celular (aproximadamente, 2x–3x por semana).
NOTA: Subcultura A549 para al menos cuatro pasajes antes de la composición del modelo de cocultura, utilizando células A549 en un rango de paso de 5–25. - Pipeta de 1,5 ml de MCP precalentado en 12 placas de pozo (el número de pozos corresponde al número deseado de modelos).
- Coloque inserciones individuales de cultivo celular de 12 pozos en pozos de una placa de 12 pozos usando pinzas esterilizadas.
- Separe las células de un matraz de acuerdo con el protocolo de subcultivación (es decir, utilizando un agente desprendimiento, retire el agente por centrifugación como se hace en el paso 1.2.13). Resuspender en el volumen apropiado de MCP correspondiente a la concentración celular final de A549 (aquí, 50 x 104 células/ml; 0,5 ml de suspensión celular por plaquita, es decir, 25 x 104 células/inserción, que corresponde a una densidad de siembra de 27,8 x 104 células/cm2).
- Pipetear 0,5 ml de la suspensión celular (es decir, 25 x 104 células/inserción) en el lado apical de la plaquita utilizando una pipeta de 1 ml.
- Cubra las placas con tapas y colóquelas en una incubadora de cultivo celular (37oC, 5 % CO2)durante 4 días.
NOTA: Compruebe regularmente la confluencia de las células A549 bajo un microscopio de contraste de fase.
- Cultivar las células epiteliales de acuerdo con las recomendaciones proporcionadas por el proveedor (ATTC). Brevemente, subcultura las células en el MCP en 80% de confluencia celular (aproximadamente, 2x–3x por semana).
- Siembra de MDDC
- Aspirar CCM con celdas no asociadas en las 6 placas de pozo que contienen MDDC.
- Agregue 1 ml de MCP precalentado fresco a cada pozo.
- Utilice un rascador de células, desprenda (raspe) los MDDC adherentes de cada pozo, lave suavemente los pozos con el 1 ml existente de CCM 3x y combínelos en un tubo cónico centrífugo.
- Cuente las células con un contador de celdas utilizando el método de exclusión azul trypan utilizando 10 ml de suspensión celular y 10 l de solución azul de tripano.
- Centrifugar la suspensión celular como se hace en el paso 1.2.13.
- Calcule el volumen CCM requerido para la resuspensión (Ecuación 5):
Densidad MDDC requerida: 42 x 104 células/ml; cada plaquita requiere 6,3 x 104 celdas, lo que corresponde a una densidad de celdas sembradas de 7 x 104 celdas/cm2 (aquí, 150 l añadidos a 0,9 cm2 en el paso 2.2.10.).
Volumen de CCM para resuspensión celular (Vm; Ecuación 5):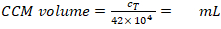
- Aspirar suavemente y desechar el CCM de la cámara superior de 12 placas de pozo con A549 en crecimiento en las plaquitas.
- Coloque las plaquitas con células A549 en una posición al revés en un plato estéril de Petri utilizando pinzas esterilizadas. Preparar un tubo de centrífuga cónica (50 ml) con PBS y prehumedece un rascador de células.
- Raspar las células A549 de la superficie basal de la plaquita (es decir, la parte superior en la posición al revés), que debe crecer a través de los poros de las plaquitas.
NOTA: Enjuague el rascador con PBS (preparado en un tubo) entre raspar muestras individuales y manténgalo húmedo durante todo el procedimiento. - Tras la centrifugación (paso 2.2.5), aspirar y desechar el sobrenadante, luego redisperar el pellet MDDC en la cantidad calculada de MCP (paso 2.2.6) y pipetear hacia arriba y hacia abajo 3x.
- Pipetear 150 l de la suspensión celular en la parte superior de cada plaquita para que toda la superficie basal de la plaquita esté igualmente cubierta con el líquido y no contenga burbujas.
- Cubra el plato con una tapa y colóquelo en una incubadora de cultivo celular durante 70 minutos. Aspirar el MCP de las placas de cultivo celular (donde se han colocado inicialmente las plaquitas), desecharlo en un residuo líquido biopeligroso y pipetear 1,5 ml de MCP fresco en cada pozo. Cubra la placa con una tapa y colóquela en la incubadora celular (37oC, 5% CO2).
NOTA: No exceda el período de tiempo mencionado anteriormente para evitar secar las células. - Después de la incubación, sostenga cuidadosamente cada plaquita con pinzas esterilizadas y colóquela en las placas que contienen CCM en una posición ordinaria. Cubra la placa con una tapa y devuélvala a la incubadora celular (37oC, 5% CO2).
- Siembra de macrófagos (MDM)
- Tomar 6 placas de pozo que contengan MDM prediferenciados.
- Aspirar y desechar CCM con MDM no conectados cultivados en 6 placas de pozo, y pipeta 1 ml de CCM precalentado fresco en cada pozo.
- Usando un rascador de celdas, retire suavemente los MDM adherentes de los pozos individuales (como se hace en el paso 2.2.3 para los MDDC).
- Pipetear 10 l de azul tripano en un pozo o tubo y añadir 10 l de la suspensión MDM para lograr la dilución final de 1:1 (v/v). Cuente el número de MDM utilizando el protocolo de recuento adecuado.
- Centrifugar la suspensión celular como se hace en el paso 1.2.13.
- Calcular el volumen requerido (Ecuación 6):
Densidad de MDM requerida: 2,5 x 104 células/ml en CCM (aquí, cada plaquita requiere 1,25 x 104 celdas en 0,5 ml de CCM, lo que corresponde a una densidad de celdas sembradas de 1,4 x 104 celdas/cm2).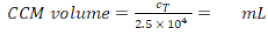 (6)
(6) - Tras la centrifugación, aspirar y desechar el sobrenadante, volver a abrir el pellet MDM en la cantidad calculada de MCP (paso 2.3.6), y pipetear hacia arriba y hacia abajo 3x.
- Pipetear cuidadosamente 0,5 ml de la suspensión MDM (preparada en el paso 2.3.7) en la pared de las inserciones de cultivo celular con A549 y MDDC (no directamente en células epiteliales) utilizando una pipeta de 1 ml. Cubrir las placas con tapas y colocarlas en una incubadora de cultivo celular (37oC, 5 % CO2) durante 24 h.
- Transferencia del modelo de cocultura a la interfaz aire-líquido (ALI)
- Al final del período de incubación de 24 h (2 h) del modelo ensamblado en una incubadora de cultivo celular, aspirar y desechar CCM de las partes apicales y basales de los insertos de cultivo celular y de los pozos.
- Usando pinzas esterilizadas, levante las plaquitas individuales de los pozos y la pipeta 0.6 mL de CCM precalentado fresco a cada pozo usando una pipeta de 1 ml. No agregue CCM al lado apical de la plaquita.
- Cubrir las placas con tapas y colocarlas en una incubadora de cultivo celular (37oC, 5 % CO2) durante 24 horas antes de su uso posterior.
3. Exposición a controles positivos seleccionados (estímulos conocidos para inducir la respuesta proinflamatoria)
NOTA: La exposición de los modelos de cocultura a un estímulo proinflamatorio conocido endotoxina lipopolysacárido (LPS)7 y al factor de necrosis tumoral de citoquina proinflamatoria (TNF-)7 se utiliza para ilustrar la capacidad de respuesta del modelo. Además, la exposición a un detergente (Triton X-100) se utiliza para confirmar la sensibilidad de un ensayo de lactato deshidrogenasa (LDH).
- Preparar las soluciones de control positivas: LPS stock (1 mg/ml en agua destilada), caldo de TNF-a (100 g/ml en agua destilada) y Triton-X 100 (2% [v/v] en PBS).
- Tras la incubación de 24 horas del modelo de cocultura en condiciones ALI, aspirar y desechar el sobrenadante del compartimiento basal. Usando pinzas esterilizadas, levante las plaquitas individuales de los pozos y la pipeta 0.6 mL de CCM precalentado fresco en cada pozo.
- Preparar soluciones de trabajo de controles positivos individuales diluyendo las existencias en CCM en tubos de centrífuga cónica de la siguiente manera: 1 g/ml de LPS, TNF de 1 g/ml y 0,2% de Tritón-X 100. Los volúmenes corresponden al número de plaquitas probadas (en este caso, 100 l/inserción). Mezclar bien las soluciones pipeteando hacia arriba y hacia abajo 3x.
- Aplicar 100 l de cada solución de control positivo pipeteando lentamente en la pared del inserto de cultivo celular. Cubrir la placa del pozo con una tapa y colocarla en la incubadora de cultivo celular (37oC, 5% CO2)durante 24 h. Tras la incubación, aspirar y desechar el líquido en el lado apical de la plaquita sosteniendo plaquitas individuales con pinzas.
- Recoger el MCP en los compartimentos basales y almacenar a 1) 4 oC para un análisis posterior de LDH, denotando citotoxicidad mediada por ruptura de la membrana celular, y / o 2) almacenar a -80 oC para el análisis posterior de la liberación de proteínas a través de ensayo inmunoabsorbente ligado a enzimas (ELISA). Ejecute los ensayos de acuerdo con las recomendaciones del proveedor del kit.
- Tras la eliminación del MCP, lave las plaquitas con PBS 3x y fije las celdas en los insertos de cultivo celular en el paraformaldehído 4% [p/v] (en PBS, 15 min a temperatura ambiente) asegurándose de que ambos lados estén bien cubiertos con solución PFA. Posteriormente lavar 3x con PBS para eliminar la PFA. Almacene las muestras sumergidas en PBS a 4 oC para una mayor inmunosuchación (se ha descrito previamente un ejemplo de este método17).
Resultados
Los modelos de cocultura pulmonar humana, compuestos por células epiteliales alveolares y células inmunitarias, se ensamblaron a partir de MDDC frescos o congelados y progenitores DE MDM (aquí, monocitos humanos derivados de la sangre periférica). Como se presenta en la Figura 1,las células A549 se sembraron 3 días después de la primera sección que implica el aislamiento/descongelación de monocitos. Después de 6 días de diferenciación, los MDM diferenciados aparecieron en forma redonda, mientras que los MDDC formaron una forma más alargada con protuberancias observables. También aparecieron como aglomerados, especialmente cuando se diferenciaban de los monocitos frescos(Figura 2, Figura 3). Las células epiteliales formaron una capa celular densa de células después de 3 días de crecimiento en inserciones de membrana(Figura 4), cuando se ensamblaron las coculturas. Después de 24 horas de montaje y otras 24 horas de ser sometidos a condiciones de ALI, las coculturas fueron preparadas para exposiciones.
La capacidad de respuesta de los modelos de cultivo celular 3D se investigó tras la exposición a estímulos proinflamatorios conocidos utilizando un enfoque pseudo-ALI, como se describió anteriormente29. Los estímulos proinflamatorios, LPS y TNF-o, se añadieron en volúmenes bajos (100 l) sobre la superficie apical del modelo celular expuesto por aire. Paralelamente, la ausencia de ruptura de membrana como medida de citotoxicidad se evaluó mediante un ensayo de LDH. Se observó un aumento significativo en la liberación de LDH en el CCM del compartimiento basal al exponerse al control positivo de la rotura de la membrana, un detergente Triton-X 100 (Figura 5). Estos resultados demostraron la capacidad de respuesta del modelo a una sustancia citotóxica, mientras que no se observó ningún aumento en la liberación de LDH tras la estimulación apical con TNF-o LPS.
Una posible razón para los diferentes valores medidos de LDH en las muestras ensambladas con PMM frescos o previamente congelados se puede atribuir al almacenamiento de muestras. Las muestras de PPM frescos se almacenaron durante más tiempo a -80 oC; por lo tanto, la actividad de la enzima LDH puede disminuir. En particular, LDH es estable por sólo hasta 4 días en CCM; por lo tanto, se recomienda realizar el ensayo a más tardar 2 días después de recoger los sobrenadantes. Alternativamente, es posible congelar los sobrenadantes directamente después de la recolección. Sin embargo, es importante considerar que la congelación puede disminuir la actividad enzimática de LDH.
La secreción de mediadores proinflamatorios (aquí, TNF- e interleukins 6 [IL-6] y 8 [IL-8]) en el MCP basal se cuantificó a través de ELISA. Estadísticamente significativas (p < 0.05, ANOVA unidireccional) en la liberación de IL-6 e IL-8 se observaron en muestras tratadas con LPS y TNF en comparación con las células no tratadas respectivas, así como en los modelos de cultivo celular ensamblados a partir de cualquiera de las fuentes de PBM (Figura 6). Aunque las concentraciones (pg/ml) de todas las citoquinas probadas en el MCP basal fueron mayores en las cocultivos compuestas de PBM fresco, las diferencias entre los dos cocultivos y monocultivos no fueron estadísticamente significativas (p > 0.05) (Figura 6). Para confirmar el valor añadido de los modelos de cocultura con respecto a un cultivo celular epitelial 2D, los monocultivos A549 también fueron expuestos a LPS o TNF- . Como era de esperar, el lanzamiento de todos los mediadores investigados de monocultivos A549 fue menor en comparación con ambos modelos de cocultura; aunque, la diferencia entre ellos no fue estadísticamente significativa (p > 0.05, ANOVA unidireccional).
La morfología celular de la barrera del tejido epitelial alveolar humano 3D se evaluó mediante microscopía de escaneo láser confocal (LSM). Para visualizar la composición de cada modelo, los macrófagos dentro de los modelos de cocultura (MDM) se teñiron con el marcador de macrófago maduro 25F9. Los MDDC se mancharon con CD83, que es un marcador importante para las células dendríticas activadas30. En cuanto a la morfología celular, no se observó ninguna diferencia entre los modelos de cocultura que utilizan MDM y MDDC de PBM frescos en comparación con los que utilizan PPM descongelados. En las coculturas expuestas a LPS y TNF, ambas compuestas de células inmunitarias frescas y congeladas, se observó una capa epitelial interrumpida en imágenes LSM, lo que no fue el caso en células no tratadas(Figura 7, Figura 8).
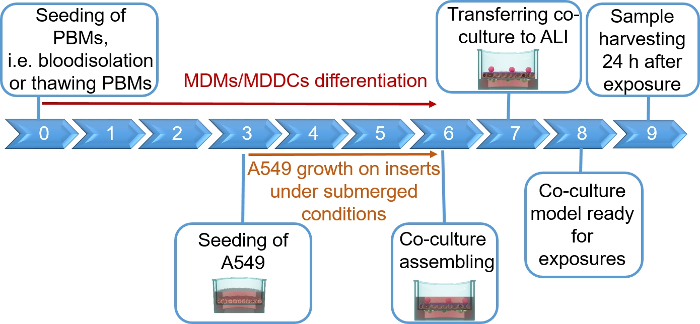
Figura 1: Línea de tiempo esquemática del protocolo. Presentación del modelo de cocultura 3D preparación, montaje y aplicación (exposición a una sustancia probada). ALI - interfaz aire-líquido, MDDC - células dendríticas derivadas de monocitos, MDM - macrófagos derivados de monocitos, PBM - monocitos de sangre periférica. Haga clic aquí para ver una versión más grande de esta figura.
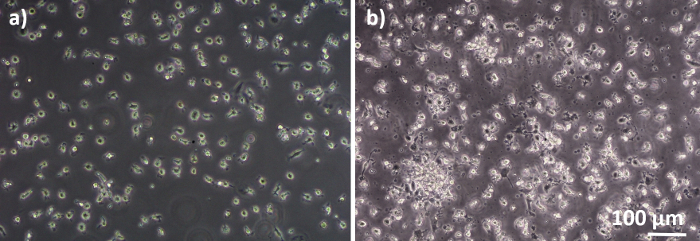
Figura 2: Los MDM y los MDDC se diferencian de los PDM frescos. Imagen de microscopía de contraste de fase de MDM diferenciados (A) y(B) MDDC de PBM frescos (6 días después del aislamiento celular). Los MDM tienen forma redonda, mientras que los MDDC se observan a menudo como aglomerados. Haga clic aquí para ver una versión más grande de esta figura.
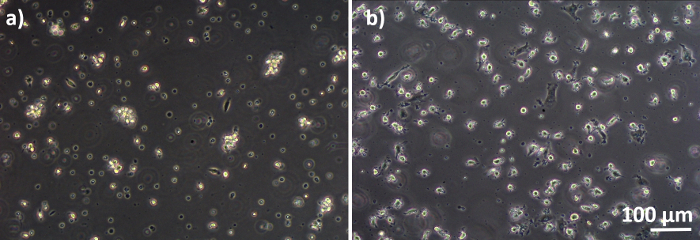
Figura 3: LOS MDM y los MDDC se diferencian de los PBM congelados. Imagen de microscopía de contraste de fase de MDM diferenciados (A) y(B) DE PBM descongelados (6 días después de la descongelación). Los MDM son de forma redonda, pero se pueden observar algunas células alargadas. Los MDDC también aparecen de forma redonda con protuberancias. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Crecimiento de células epiteliales en inserciones de membrana. Imagen de microscopía de contraste de fase del confluente A549 creciendo en un inserto de membrana 4 días después de la siembra, formando una densa capa de células. Haga clic aquí para ver una versión más grande de esta figura.
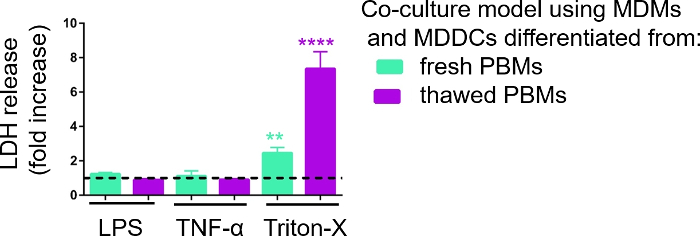
Figura 5: Resultados de citotoxicidad investigados mediante un ensayo basado en ruptura de membrana (LDH). Los datos se presentan como un aumento de pliegue sobre las celdas no tratadas (media SD, n a 3, el asterisco denota un aumento estadísticamente significativo en comparación con las celdas no tratadas, **p < 0.01, ****p < 0.0001). En los modelos verdes se representan los MDM y los MDDC de PBM frescos, y en los modelos morados ensamblados a partir de PBM descongelados. Haga clic aquí para ver una versión más grande de esta figura.
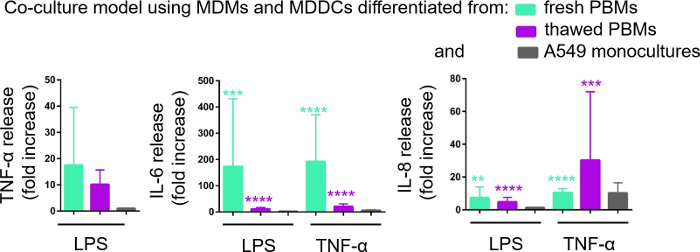
Figura 6: Reacciones proinflamatorias en los cocultivos y monocultivos. Los mediadores proinflamatorios (TNF-o, IL-6 e IL-8) se liberan en las coculturas tras el desafío de 24 horas con LPS o TNF-o. Los datos se presentan en relación con las células no tratadas (media SD, n a 3, **p < 0,01, ***p < 0,001, ****p < 0.0001). En los modelos verdes se representan los MDM y los MDDC de PBM frescos, y en los modelos morados ensamblados a partir de PBM descongelados. El gris representa los monocultivos A549. Haga clic aquí para ver una versión más grande de esta figura.
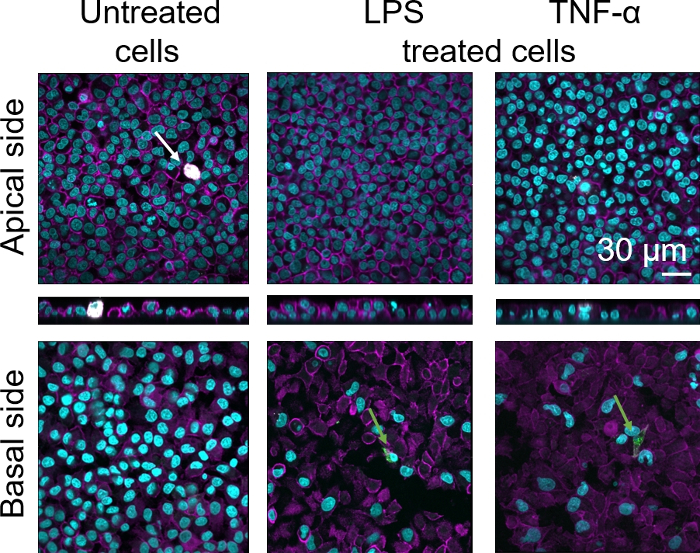
Figura 7: Morfología de cocultivos compuesta de células inmunitarias frescas. Imágenes LSM de lados apical y basal del modelo de cocultura con proyecciones xz de lados apicales del modelo utilizando MDMs y MDDCs de PBM frescos. La flecha blanca denota MDM, mientras que la flecha verde denota MDDC. Haga clic aquí para ver una versión más grande de esta figura.
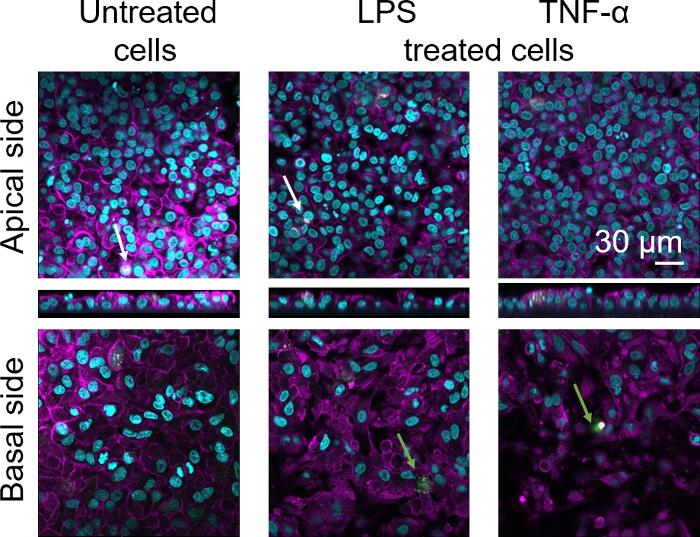
Figura 8: Morfología de cocultivos compuesta de células inmunitarias congeladas. Imágenes LSM del lado apical del modelo de cocultura con las proyecciones xz correspondientes, y el lado basal del modelo usando MDMs y MDDCs de PBM descongelados. Cian representa núcleos (DAPI), magenta representa citoesqueleto (rhodamine-phalloidin), blanco representa MDM (25F9) y verdes representan MDDC (CD 83). La flecha blanca denota MDM, mientras que la flecha verde denota MDDC. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La producción emergente de materiales novedosos, incluidos productos químicos y medicamentos, aumenta gradualmente la necesidad de modelos predictivos in vitro. Para cumplir con los tres principios de sustitución, reducción y refinamiento de las pruebas con animales32,los modelos de células in vitro se han convertido en potentes herramientas relativas al aspecto de sustitución y reducción para elucidar de mecanismos de acción de un medicamento o material8,,9,,10,,11. Aquí se presenta un protocolo detallado de montaje del modelo multicelular utilizando células inmunitarias que están recién aisladas o descongeladas de monocitos previamente congelados. También se describe el cultivo del modelo en ALI. Por último, el protocolo ilustra un ejemplo de exposición a estímulos proinflamatorios y compara la respuesta de los dos modelos que contienen monocitos frescos o congelados.
Se han realizado diversos estudios para confirmar y justificar el valor añadido de la mayor complejidad de los modelos cultivados y expuestos en condiciones de ALI en comparación con la exposición sumergida convencional7,,22,,31. La observación de la respuesta proinflamatoria superior en cocultivos en comparación con los monocultivos de células epiteliales confirma un estudio previo. El estudio utilizó el modelo de cocultura presentado (estimulado con LPS) y mostró una mayor respuesta a los niveles de expresión génica de TNF e IL1B en comparación con el modelo7equivalente al monocultivo A549. Por otro lado, ambos modelos mostraron variaciones más altas dentro de los valores medidos de liberación de mediadores proinflamatorios en comparación con los monocultivos A549. Esto puede explicarse por el uso de células inmunitarias de diferentes donantes (capas de buffy) dentro de repeticiones biológicas (es decir, una repetición, un donante), como se muestra anteriormente7. Si se desea, las variaciones entre las réplicas se pueden superar 1) utilizando PPM descongelados del mismo donante o 2) agrupando PMM de diferentes donantes antes de congelar las células, luego el uso posterior del mismo grupo en cada repetición. También se recomienda incluir más repeticiones biológicas.
La técnica de congelación celular se puede considerar como un paso crítico; sin embargo, es un procedimiento de laboratorio común para preservar las células para el análisis fenotípico y funcional. Diversos estudios han demostrado que la calidad de los PPM congelados es vital para su supervivencia, y una técnica de congelación adecuada es clave para el éxito de ensayos posteriores con las mismas células28,,32. La modificación del protocolo se puede realizar congelando los PPM, lo que proporciona flexibilidad en la configuración experimental, ya que la disponibilidad de capas de buffy suele ser limitada. Otra ventaja de usar PRM congelados (en varios viales) sobre los recién aislados es que se pueden utilizar en experimentos posteriores incluso después de 1 año. Esto disminuye la posible cuestión de la variabilidad de donante a donante si se trata de un parámetro deseado o necesario en una experimental.
Los resultados de una comparación interlaborativa realizada después de hasta 13 meses muestran que los PPM, cuando se almacenan adecuadamente en un tanque de nitrógeno líquido, se pueden utilizar durante un largo período sin ningún efecto sobre la viabilidad celular o la recuperación celular33. Los tiempos de almacenamiento más largos (más de 1 año) pueden ser posibles tras una validación cuidadosa de la viabilidad de la célula y la capacidad de respuesta de las células antes de realizar un experimento. Además, la temperatura en el tanque de nitrógeno líquido debe permanecer estable en todo momento. El principal factor que afectaba a la viabilidad de los PPM crioconservados se encontró que era la concentración de DMSO, con una concentración óptima del 10%-20 % (v/v)28. Para minimizar los efectos potencialmente nocivos de la congelación, a menudo se añaden al medio de congelación diferentes fuentes de proteínas, FBS o BSA (con una amplia gama de concentración de 40% hasta 100 %34)al medio de congelación como componentes protectores naturales que pueden aumentar la supervivencia celular.
Debido al alto potencial citotóxico de DMSO, se recomienda primero dispersar los PBM en FBS, luego agregar DMSO a los PBM ya dispersos en FBS. En particular, aunque mayores concentraciones de FBS (>40%) no mostraron ninguna mejora en la viabilidad celular, al mismo tiempo, no causaron daño a las células28. Sin embargo, los monocitos de congelación es un posible enfoque para superar problemas de disponibilidad limitada de capas de buffy. Sin embargo, si se desea el uso de MDDC y MDM de PMM frescos, las células inmunitarias se pueden diferenciar y utilizar de 5 a 8 días después del aislamiento7,16,17,35,36,37. Si la planificación experimental lo permite, se recomienda al menos 6 días de diferenciación tanto en MDDC como en MDM. Sin embargo, la coherencia entre las diferentes repeticiones en el mismo experimento, junto con las inspecciones rutinarias de sus expresiones de marcadores de superficie específicas, son cruciales. La capacidad de respuesta a un estímulo proinflamatorio, como el LPS, después del tiempo de diferenciación también debe comprobarse regularmente.
Muchas investigaciones utilizando la línea celular A549 se han realizado en ALI, ya sea como monocultivo o combinado con otros tipos de células (macrofagos, células dendríticas o fibroblastos) en el modelo de cocultura 3D,22,24,,29,,38. Utilizando este modelo de cocultura 3D, se han investigado la citotoxicidad, el estrés oxidativo o los efectos proinflamatorios de (nano-)materiales durante hasta 72 h1,17,21,24,29. El parecido del modelo con el tejido in vivo ha sido investigado previamente sobre la base de imágenes láser confocales del modelo16. Al ensamblar el modelo, es importante considerar tanto la proliferación celular (que puede afectar a A549 en el modelo presentado aquí) como el rendimiento de las células inmunitarias primarias (no proliferantes) (aquí, MDDC y MDMs). También es importante considerar que no todos los monocitos positivos CD14 se diferencian en MDDC y MDM, y que las células pueden estar presentes en formularios adjuntos y suspendidos. Según la naturaleza del conjunto de cocultura (aquí, ambos tipos de células necesitan adherirse a la capa epitelial existente), se recomienda utilizar solo las submodas adherentes de ambos tipos de células inmunitarias. Además, los análisis rutinarios de monocitos, la capacidad de respuesta de los monocultivos MDDC y MDM a LPS, y la expresión de marcadores de superficie específicos (CD14, CD163, CD86, CD93 o CD206, datos no mostrados) han sugerido que 6 y 7 días de diferenciación son los puntos de tiempo óptimos.
Aunque un número realista de células epiteliales alveolares en los pulmones humanos corresponde a 160.000 células/cm2, el número de células A549 contadas en el modelo es de 1.000.000 de células/cm2 después de 9 días cultivados en el inserto16,,18. Por lo tanto, es necesario tener en cuenta las limitaciones de este modelo in vitro. En primer lugar, la densidad de las células epiteliales se estableció en función de su capacidad para formar una capa confluente en la membrana en crecimiento. También es importante mencionar que el A549 representa una célula epitelial tipo II con una forma cuboidal, contrariamente a las células epiteliales tipo I, que son planas y extendidas. Por otro lado, el número requerido de células inmunitarias se estableció sobre la base de la literatura y se presentó en este protocolo como número de célula/área de superficie39,40,41. La densidad celular de los MDDC en el rango de 400 células/mm2 (4 células/cm2)16 es comparable a la densidad de celdas en estado estacionario de 500–750 células/mm2 (5- 7 células/cm2) notificadas en estudios in vivo39. La densidad de los MDM en este modelo está dentro del mismo rango de situación in vivo en la región alveolar humana40.
Se observó tinción de marcadores de macrófagos maduros (25F9) tanto en el lado apical (donde están presentes los MDM) como en el lado basal (es decir, en el sitio de las células dendríticas). La translocación de las células inmunitarias a través de la membrana inserta poros es posible y también se ha observado utilizando este modelo16,lo que puede explicar las diferencias observadas en las intensidades de tinción. Sin embargo, otra posible explicación es que el marcador de macrófago maduro también se puede expresar en células dendríticas, pero la expresión es altamente específica del donante42. Además, la intensidad de la expresión 25F9 es mucho mayor en los MDM(Figura 7, Figura 8). Ambos estímulos proinflamatorios (LPS y TNF-o) afectaron la integridad de la barrera epitelial pulmonar en ambas coculturas(Figura 7, Figura 8). Esto se esperaba sobre la base de publicaciones anteriores43,44 que muestran que las citoquinas proinflamatorias y los productos bacterianos alteran la integridad de las barreras epiteliales.
El modelo multicelular 3D del epitelio alveolar humano, establecido y caracterizado anteriormente17,ha servido como una herramienta poderosa y útil para evaluar las respuestas biológicas (es decir, reacciones proinflamatorias agudas, respuesta al estrés oxidativo, distribución de partículas y comunicación celular) in vitro21,24,25,45. Los resultados confirman la responsabilidad de los modelos de cocultura a estímulos proinflamatorios (aquí, LPS y TNF-o). La respuesta aumentó ligeramente cuando se utilizaron células inmunitarias a partir de PMM frescos; sin embargo, no hubo diferencia estadísticamente significativa entre las coculturas que utilizan PBM frescos frente a descongelados. Además, las reacciones proinflamatorias de ambos modelos de cocultura fueron superiores a las de los monocultivos de células epiteliales cultivados bajo las mismas condiciones (ALI). En resumen, el protocolo describe el montaje de un modelo de cocultura de tejido epitelial alveolar humano 3D utilizando PPM frescos o descongelados para diferenciar en MDM y MDDC. Se ha demostrado que ambos modelos son altamente sensibles a los estímulos proinflamatorios; por lo tanto, pueden servir como herramientas poderosas para las evaluaciones de peligro potencial y toxicidad.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean dar las gracias al Dr. Miguel Spuch-Calvar por el plan de cocultura de la Figura 3 y a la Dra. Bedia Begum Karakocak por su lectura crítica. Este estudio fue apoyado por el proyecto PATROLS, el Programa de Investigación e Innovación Horizonte 2020 de la Unión Europea en virtud del acuerdo de subvención no 760813 y por la Fundación Adolphe Merkle. B.D. agradece la fundación Peter und Traudl Engelhorn por el apoyo financiero.
Materiales
| Name | Company | Catalog Number | Comments |
| Benchmark microplate reader | does not have to be specific, for example BioRad, Cressier, Switzerland | ||
| Cell culture Incubator | does not have to be specific | ||
| Cell freezing container (for example Mr. Frosty) | does not have to be specific | ||
| Centrifuge | does not have to be specific | ||
| Confocal laser scanning microscope | does not have to be specific, for example | Zeiss LSM 710 meta | |
| Heamatocytometer, or automatic cell counter | does not have to be specific | ||
| Laminar bio-safety hood class II | does not have to be specific | ||
| MultiStand Macs (Macs Cell Separator) | Miltenyi, Germany | 130-042-303 | |
| pH meter | does not have to be specific | ||
| Phase contrast inverted light microscope | does not have to be specific | ||
| Pipette boy, pipettors (different volumes) | do not have to be specific | ||
| Scissors | do not have to be specific | ||
| Vacuum pump | does not have to be specific | ||
| Water bath | does not have to be specific | ||
| Disposable small equipment/glassware | Catalogue Number | ||
| 15 mL and 50 mL conical centrifuge tubes | does not have to be specific | ||
| 6- and 12-well cell culture plates, flat bottom, low evaporation lid, sterile | Falcon, Switzerland | 353046 and 353043 | |
| Cell culture inserts, transparent PET membrane, 12-well, 3 μm pore size | Falcon, Switzerland | 353181 | |
| Cell scrapper | does not have to be specific, for example VWR, Switzerland | 353085 | |
| Cryovials | do not have to be specific | ||
| Glass autoclaved Petri Dishes | do not have to be specific | ||
| LS Columns | Miltenyi, Germany | 130-042-401 | |
| Sterile filtration cup for vacuum filtration, 0.2 μm pore size | does not have to be specific, for example VWR, Switzerland | 10040-446 | |
| Sterile Lab Bottle compatible with Filtration cup (min. 100 mL) | does not have to be specific | ||
| Sterile pipettes | do not have to be specific | ||
| Chemicals | |||
| Bovine serum albumine (BSA) | Sigma-Aldrich, Switzerland | A7030-100g | |
| CD14+ MicroBeads human - magnetic beads | Miltenyi, Germany | 130-097-052 | |
| Deattachnig agent Trypsin-EDTA, 0.05%, phenol red | Gibco, Switzerland | 25300054 | |
| Density gradient medium Lymphoprep | Alere Technologies AS, Norway | 1114547 | |
| Dimethyl Sulfoxide (DMSO) | Sigma Aldrich, Switzerland | D2438 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich, Switzerland | E6758-100g | |
| Fetal bovine serum (heat inactivated) | Gibco, Switzerland | 10270-106 | |
| Human granulocyte-macrophage colony-stimulating factor (GM-CSF), premium grade | Miltenyi, Germany | 130-093-864 | |
| Human Interleukin 4 (IL-4), premium grade | Miltenyi, Germany | 130-095-373 | |
| Human macrophage colony-stimulating factor (M-CSF), premium grade | Miltenyi, Germany | 130-096-485 | |
| L-glutamine | Gibco, Switzerland | 25030-024 | |
| Lipopolysaccharid (LPS) from Escherichia coli | Sigma-Aldrich, Switzerland | 4524-5mg | |
| Paraformaldehyde (PFA) | Sigma-Aldrich, Switzerland | 158127 | |
| Penicilin-Streptomycin | Gibco, Switzerland | 15140-122 | |
| Phosphate Buffer Saline (PBS) | Gibco, Switzerland | 10010-015 | |
| Roswell Park Memorial Institute-1640 Medium (RPMI) | Gibco, Switzerland | 42401-018 | |
| Triton X-100 | Sigma-Aldrich, Switzerland | T8787 | |
| Trypan blue solution (0.4%) | Sigma Aldrich, Switzerland | ||
| Tumor necrosis factor alpha (TNF-α) | Immunotools | 11343015 | |
| Assays used for cytotoxicity, (pro-)inflammatory response | |||
| Cytotoxicity Detection Kit (LDH) | Roche, Switzerland | 11644793001 | |
| Human IL-6 DuoSet ELISA | R&D, Biotechne, Switzerland | DY206 | |
| Human IL-8/CXCL8 DuoSet ELISA | R&D, Biotechne, Switzerland | DY208 | |
| Immunostaining | |||
| 4′,6-diamidino-2-phenylindole (DAPI), concentration 2 μg/mL | Sigma-Aldrich, Switzerland | 10236276001 | |
| Goat anti-mouse IgG (H+L) Alexa Fluor 647 conjugated, concentration 20 μg/mL | Abcam, UK | ab150115 | |
| Goat anti-rabbit IgG antibody (H+L) Dylight 488 conjugated, concentration 10 μg/mL | Agrisera, Sweden | AS09 633 | |
| Mature Macrophage Marker Monoclonal Antibody, concentration 50 μg/mL | eBioScience, Thermo Fischer, Switzerland | 14-0115-82 | |
| Phalloidin rhodamine, concentration 0.264 µM | Molecular Probes, Life Technologies, Switzerland | R415 | |
| Recombinant Anti-CD83 antibody, 1:50 dillution | Abcam, UK | ab244204 |
Referencias
- Rothen-Rutishauser, B., Blank, F., Mühlfeld, C., Gehr, P. In vitro models of the human epithelial airway barrier to study the toxic potential of particulate matter. Expert Opinion on Drug Metabolism and Toxicology. 4 (8), 1075-1089 (2008).
- Giard, D., et al. In vitro cultivation of human tumors: establishment of cell lines derived from a series of solid tumors. Journal of National Cancer Institute. 51 (5), 1417-1423 (1973).
- Ochs, M., Weibel, E. R., Grippi, M. A. Ch. 2: Functional Design of the Human Lung for Gas Exchange . Fishman's Pulmonary Diseases and Disorders, 5e. , (2008).
- Foster, K. A., Oster, C. G., Mayer, M. M., Avery, M. L., Audus, K. L. Characterization of the A549 Cell Line as a Type II Pulmonary Epithelial Cell Model for Drug Metabolism. Experimental Cell Research. 243 (2), 359-366 (1998).
- Guo, X. Y., Lu, M., Chen, X. Q., He, F. D., Li, A. Correlation study of biological characteristics of non-small cell lung cancer A549 cells after transfecting plasmid by microbubble ultrasound contrast agent. Asian Pacific Journal of Tropical Medicine. 9 (6), 582-586 (2016).
- Cooper, J. R., et al. Long Term Culture of the A549 Cancer Cell Line Promotes Multilamellar Body Formation and Differentiation towards an Alveolar Type II Pneumocyte Phenotype. PLoS ONE. 11 (10), 0164438 (2016).
- Bisig, C., Voss, C., Petri-Fink, A., Rothen-Rutishauser, B. The crux of positive controls - Proinflammatory responses in lung cell models. Toxicology In Vitro. 54, 189-193 (2019).
- Rothen-Rutishauser, B., et al. A newly developed in vitro model of the human epithelial airway barrier to study the toxic potential of nanoparticles. ALTEX. 25, (2008).
- Braakhuis, H. M., et al. Progress and future of in vitro models to study translocation of nanoparticles. Archives of Toxicology. 89 (9), 1469-1495 (2015).
- Thai, P., Chen, Y., Dolganov, G., Wu, R. Differential regulation of MUC5AC/Muc5ac and hCLCA-1/mGob-5 expression in airway epithelium. American Journal of Respiratory Cell and Molecular Biology. 33 (6), 523-530 (2005).
- Wu, J., et al. Characterization of air-liquid interface culture of A549 alveolar epithelial cells. Brazilian Journal of Medical and Biological Research. 51 (2), 6950 (2017).
- Shapiro, D. I., Nardone, L. L., Rooney, S. A., Motoyama, E. K., Munoz, J. L. Phospholipid biosynthesis and secretion by a cell line (A549) which resembles type II aleveolar epithelial cells. Biochimica and Biophysica Acta. 530 (2), 197-207 (1978).
- Balis, J., Bumgarner, S. D., Paciga, J. E., Paterson, J. F., Shelley, S. A. Synthesis of lung surfactant-associated glycoproteins by A549 cells: description of an in vitro model for human type II cell dysfunction. Experimental Lung Research. 6 (3-4), 197-213 (1984).
- Schurch, S., Gehr, P., Im Hof, V., Geiser, M., Green, F. Surfactant displaces particles toward the epithelium in airways and alveoli. Respiration Physiology. 80 (1), 17-32 (1990).
- Gehr, P., Schurch, S., Berthiaume, Y., Hof, V. I., Geiser, M. Particle Retention in Airways by Surfactant. Journal of Aerosol Medicine. 3 (1), 27-43 (2009).
- Blank, F., Rothen-Rutishauser, B., Gehr, P. Dendritic Cells and Macrophages Form a Transepithelial Network against Foreign Particulate Antigens. American Journal of Respiratory Cell and Molecular Biology. 36 (6), (2007).
- Rothen-Rutishauser, B. M., Kiama, S. G., Gehr, P. A three-dimensional cellular model of the human respiratory tract to study the interaction with particles. American Journal of Respiratory Cell and Molecular Biology. 32, (2005).
- Blank, F., Rothen-Rutishauser, B. M., Schurch, S., Gehr, P. An optimized in vitro model of the respiratory tract wall to study particle cell interactions. Journal of Aerosol Medicine. 19, (2006).
- Jardine, L., et al. Lipopolysaccharide inhalation recruits monocytes and dendritic cell subsets to the alveolar airspace. Nature Communications. 10 (1), 1999 (2019).
- Kopf, M., Schneider, C., Nobs, S. P. The development and function of lung-resident macrophages and dendritic cells. Nature Immunology. 16 (1), 36-44 (2015).
- Chortarea, S., et al. Repeated exposure to carbon nanotube-based aerosols does not affect the functional properties of a 3D human epithelial airway model. Nanotoxicology. 9 (8), 983-993 (2015).
- Hilton, G., Barosova, H., Petri-Fink, A., Rothen-Rutishauser, B., Bereman, M. Leveraging proteomics to compare submerged versus air-liquid interface carbon nanotube exposure to a 3D lung cell model. Toxicology In Vitro. 54, 58-66 (2019).
- Brandenberger, C., et al. Effects and uptake of gold nanoparticles deposited at the air-liquid interface of a human epithelial airway model. Toxicology and Applied Pharmacology. 242, (2010).
- Drasler, B., et al. Single exposure to aerosolized graphene oxide and graphene nanoplatelets did not initiate an acute biological response in a 3D human lung model. Carbon. 137, 125-135 (2018).
- Durantie, E., et al. Carbon nanodots: Opportunities and limitations to study their biodistribution at the human lung epithelial tissue barrier. Biointerphases. 13, (2018).
- Brandenberger, C., et al. Quantitative evaluation of cellular uptake and trafficking of plain and polyethylene glycol-coated gold nanoparticles. Small. 6 (15), 1669-1678 (2010).
- Tomašek, I., et al. Combined exposure of diesel exhaust particles and respirable Soufrière Hills volcanic ash causes a (pro-)inflammatory response in an in vitro multicellular epithelial tissue barrier model. Particle and Fibre Toxicology. 13 (1), 67 (2016).
- Nazarpour, R., et al. Optimization of Human Peripheral Blood Mononuclear Cells (PBMCs) Cryopreservation. International Journal of Molecular and Cellular Medicine. 1 (2), 88-93 (2012).
- Endes, C., et al. An in vitro testing strategy towards mimicking the inhalation of high aspect ratio nanoparticles. Particle and Fibre Toxicology. 11 (1), (2014).
- Ju, X., et al. The Analysis of CD83 Expression on Human Immune Cells Identifies a Unique CD83+-Activated T Cell Population. Journal of Immunology. 197 (12), 4613-4625 (2016).
- Lenz, A. G., et al. Inflammatory and Oxidative Stress Responses of an Alveolar Epithelial Cell Line to Airborne Zinc Oxide Nanoparticles at the Air-Liquid Interface: A Comparison with Conventional, Submerged Cell-Culture Conditions. BioMed Research International. , 12 (2013).
- Germann, A., Schulz, J. C., Kemp-Kamke, B., Zimmermann, H., von Briesen, H. Standardized serum-free cryomedia maintain peripheral blood mononuclear cell viability, recovery, and antigen-specific T-cell response compared to fetal calf serum-based medium. Biopreservation and Biobanking. 9 (3), 229-236 (2011).
- Weinberg, A., et al. Optimization and Limitations of Use of Cryopreserved Peripheral Blood Mononuclear Cells for Functional and Phenotypic T-Cell Characterization. Clinical and Vaccine Immunology. 16 (8), 1176 (2009).
- Freshney, R. I., Freshney, R. I. . Culture of animal cells: a manual of basic technique. , 321-334 (2005).
- Lehmann, A. B. C., Blank, F., Gehr, P., Rothen-Rutishauser, B., Yarmush, M. L., Langer, R. S. . Alternatives to animal testing. , 239-260 (2010).
- Steiner, S., et al. Reduction in (pro-)inflammatory responses of lung cells exposed in to diesel exhaust treated with a non-catalyzed diesel particle filter. Atmospheric Environment. 81, 117-124 (2013).
- Martinez, F. O., Gordon, S., Locati, M., Mantovani, A. Transcriptional Profiling of the Human Monocyte-to-Macrophage Differentiation and Polarization: New Molecules and Patterns of Gene Expression. The Journal of Immunology. 177 (10), 7303 (2006).
- Chortarea, S., et al. Profibrotic activity of multi-walled carbon nanotubes upon prolonged exposures in different human lung cell types. Applied In Vitro Toxicology. 5 (1), (2019).
- Holt, P. G. Pulmonary Dendritic Cells in Local Immunity to Inert and Pathogenic Antigens in the Respiratory Tract. Proceedings of the American Thoracic Society. 2 (2), 116-120 (2005).
- Pinkerton, K. E., Gehr, P., Castañeda, A., Crapo, J. D., Parent, R. A. . Comparative Biology of the Normal Lung (Second Edition). , 105-117 (2015).
- Crapo, J., Barry, B., Gehr, P., Bachofen, M., Weibel, E. R. Cell number and cell characteristics of the normal human lung. American Review of Respiratory Disease. 126 (2), 332-337 (1982).
- Maniecki, M. B., Møller, H. J., Moestrup, S. K., Møller, B. K. CD163 positive subsets of blood dendritic cells: The scavenging macrophage receptors CD163 and CD91 are coexpressed on human dendritic cells and monocytes. Immunobiology. 211 (6), 407-417 (2006).
- Chignard, M., Balloy, V. Neutrophil recruitment and increased permeability during acute lung injury induced by lipopolysaccharide. American Journal of Physiology-Lung Cellular and Molecular Physiology. 279 (6), 1083-1090 (2000).
- Coyne, C. B., et al. Regulation of Airway Tight Junctions by Proinflammatory Cytokines. Molecular Biology of the Cell. 13 (9), 3218-3234 (2002).
- Durantie, E., et al. Biodistribution of single and aggregated gold nanoparticles exposed to the human lung epithelial tissue barrier at the air-liquid interface. Particle and Fibre Toxicology. 14 (49), (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados