Method Article
危険評価のための上皮細胞と原発性免疫細胞からなる多細胞ヒト歯槽モデル
要約
ここでは、原発性ヒト単球単球単球の分離に関するプロトコルと、マクロファージおよび樹状細胞への分化、および上皮細胞を有する多細胞ヒト肺モデルへの組み立てのためのプロトコルを提示する。免疫細胞からなる共培養物の生物学的応答は、単球または解凍された単球から分離し、炎症促進性刺激に曝露した際に、比較される。
要約
ヒト肺胞細胞共培養モデルは、肺胞上皮II型細胞と2種類の免疫細胞(すなわちヒト単球由来マクロファージ[MDMs]および樹状細胞[MDMs])からなる肺胞上皮組織障壁のシミュレーションのためにここに記載されている。多細胞モデルを組み立てるためのプロトコルが提供される。歯槽上皮細胞(A549細胞株)は、2室のウェル内の透過性インサート上の水没条件下で増殖し、分化され、その後、分化されたMDMsおよびMDDCと組み合わされる。最後に、細胞は数日間空気液体界面に露出される。ヒトの原発性免疫細胞はヒトのバフィーコートから分離する必要があるので、新鮮な単球または解凍された単球から分化した免疫細胞を比較して、実験ニーズに基づいて方法を調整する。この3次元モデルは、単球由来の新しい細胞または解凍された単球由来免疫細胞を有する肺胞細胞で構成され、未治療細胞と比較して炎症促進性刺激(リポ多糖および腫瘍壊死因子α)への曝露時にサイトカイン(インターロイキン6および8)放出の統計的に有意な増加を示す。一方、コカルチャーにおいて観察されるサイトカイン放出との間に統計的に有意な差はない。これは、提示されたモデルが、新鮮または解凍された末梢血単球(PBM)と区別されるMDMおよびMDDCの存在下で炎症誘発刺激に反応することを示す。このように、エアロゾル化薬やナノ材料を含む、さまざまな物質に対する急性生物学的反応の調査のための強力なツールです。
概要
in vitro肺細胞培養は、エアロゾル1の危険性を評価するために、費用対効果の高い、堅牢で、適切に制御されたプラットフォームを提供します。ヒト肺胞性肺胞性肺球のモデル細胞系として、肺腺癌から単離された上皮A549細胞株がしばしば2を用いる。,これらの細胞は、歯槽領域3からの扁平上皮細胞を表し、危険および毒性評価,1、4、5、6、7、8、9、104,5,6,7に広く使用されている肺細胞株である。9,1018A549細胞株は、肺胞上皮II型細胞の関連特徴を有し、例えば、密に詰まったリン脂質3を含む特徴的な単層体の存在などである。
細胞が空気・液体界面(ALI)で培養されると、界面活性剤が空気露出上皮細胞の有端側に放出され、表面張力が11、12、13に減少することが示されている。,12,13この特徴は、ナノ物質的な呼吸ハザードおよび毒性調査において特に重要である。いったん吸入したナノ材料/毒性物質が肺胞領域に沈着すると、それらは最初に肺界面活性剤と相互作用し、水性低相に力を湿させることによって、肺細胞との相互作用が14,15,15に起こる。A549細胞は単層(ALIで栽培すると後で多層に成長する可能性がある)を形成し、界面活性剤を生成するが、欠点は、それらの不十分な接合点形成であり、その結果、過上皮電気抵抗値が低いが、細胞間(ナノ)粒子転位1616、17、1817,18に対する機能的障壁を示す。
肺には、細胞細胞の接触や細胞間シグナル伝達を通じて直接伝達する貪食および専門の抗原提示細胞(マクロファージおよび樹状細胞)を含む様々な免疫細胞集団があり、恒常性を制御および維持する。マクロファージおよび樹状細胞は、適応免疫応答19の重要な自然免疫エフェクターおよびイニシエーターである。上皮の内部または下に存在する樹状細胞は、上皮を横切って内腔に突出物を形成し、抗原を捕捉することができる。肺胞マクロファージは上皮の上端表面に位置し、センチネル細胞として作用し、細菌、ウイルスおよび真菌感染症だけでなく、異物に対する最初の細胞防御を表す。これらの表現型可塑性は、そのような刺激に応答して炎症反応を迅速に誘導し、抗炎症(すなわち、阻害性)反応を引き起こすに移行することを可能にする。
ヒト肺胞上皮組織のバリアを模擬するために、我々は、アペカル側と基底側に、それぞれ17の上にヒト単球由来マクロファージ(MDM)および樹状細胞(MDDC)を補ったA549細胞を用いた三重共培養モデルを確立した。ALIでのこのモデルの栽培は、以前に報告されています16,でも 72 時間のポスト露光21.カーボンナノチューブ曝露に対する急性免疫応答は、水没条件22と比較してALIに曝露された細胞培養において有意に増強された。培養した共培養モデルは、ALIで異なる物質に曝露され、これまで、酸化亜鉛への曝露時に細胞毒性、酸化ストレスおよび炎症反応を調査するために使用されてきたが、23のグラフェン関連材料24、金ナノ粒子25、26、,26カーボンナノチューブ21、火山灰およびディーゼル排気粒子27。
さらに、ヒト肺モデルにおける免疫エフェクター細胞としてのマクロファージおよび樹状細胞の重要な役割が確認された。特に、モデルにおける炎症反応の増加は、単一培養系7と比較して免疫細胞の存在下でのみ観察された。原発単球由来免疫細胞を使用することの潜在的な欠点は、PBMの限られたアクセシビリティならびにドナー間の変動である。これらの潜在的な欠点の解決策として、ここで提示される、細胞培養モデルアセンブリのための新たに単離されたPBM28 の凍結保存を導入するプロトコルである。本研究の目的は、ヒトバフィーコートからのPBMの分離を含む3Dヒト肺胞上皮組織モデルアセンブリを実証することである。炎症促進性刺激に対する応答性は、新鮮なPBMと区別されるか、凍結/解凍されたPBMと区別されるMDMおよびMDDCで構成されるモデルと比較される。
未検査のヒト血液サンプルを使用するには、HIV(ヒト免疫不全ウイルス)、B型肝炎、C型肝炎などの感染症の潜在的な伝染を防ぐために、特定のケアが必要です。したがって、手袋、ガウン、マスク、目の保護などの個人的な保護対策の使用は非常に重要であり、良い実験室の実践原則に従う必要があります。これらの保護は、潜在的に感染性の液体に皮膚や粘膜を暴露するリスクを低減します。さらに、バフィーコートやPBMの取り扱いに関わる人には、B型肝炎ウイルスに対するワクチン接種が必須であり、抗体B型肝炎の血中抗体レベルは100 IU/Lを超える必要があります(国固有の立法要件に対処する必要があります)。さらに、すべての作業は、バイオセーフティレベル2の研究所で行う必要があります(国固有の立法要件に対処する必要があります)。実験室環境での作業や、廃棄物の取り扱いを含む哺乳類細胞培養の取り扱いに関する標準的な健康および安全上の注意は、プロトコル全体を実施する際に採用されるべきである。
プロトコル
ヒトの血液から分離された原発単球を含む研究は、アドルフ・メルクル研究所の連邦公衆衛生局(参照番号611-1、メルドゥンA110635/2)の委員会によって承認されました。
1. 末梢血単球(PBM)をヒトバフィーコートから分離
注:次のセクションでは、スイスのベルンにあるスイス輸血センターから購入したバフィーコートの50 mL袋から免疫細胞を単離する方法について説明します。
- 試薬の調製
- バフィーコートあたり100 mLの磁気分離バッファーを準備する:0.5%[w/v]牛血清アルブミン(BSA;リン酸緩衝生理食塩分[PBS])を2 mMエチレンアミンテトラ酢酸(EDTA)で、pH = 7.2、0.22 μmの細孔サイズの無菌フィルターに調整します。手順を通して4°Cに保ちます。
- 細胞培養培地(CCM):RPMI 1640に10%[v/v]ウシ胎児血清(FBS)、1%[v/v]L-グルタミン(ここでは2mM L-グルタミン)、1%[v/v]ペニシリン-ストレプトマイシン(ここでは100単位/mLペミシンおよび100μCg/μcm)を使用します。
注: 各試薬の必要量は、次の手順でシードされるセルの数によって異なります。
- PBM の分離
注:すべてのガラスおよびプラスチック製品は、使用前に滅菌する必要があります。安全上の理由から、ガラス製品による傷害のリスクを低減するために、人間の血液サンプルを取り扱う際には、プラスチック製品の使用をお勧めします。- はさみを使用して、バフィーコートを含むバッグのホースエンドを切り開きます。
- 袋のダクトを通して袋の中身を2つの円錐形遠心分離器50 mLチューブ(〜25 mLずつ)に直接注いで、バフィーコートを配ります。
- PBSをチューブに軽く注ぐか、ピペットを50 mLの体積に達します。チューブを3倍に軽く逆さまにして内容物を混ぜます。
- 各新鮮なチューブで混合物の25 mLをピペット処理することにより、4つの新しい50 mL円錐遠心管にバフィーコート-PBS混合物を分割します。
- 10 mL血清学的ピペットを使用して、バフィーコート-PBS混合物の下に13mLの密度勾配培地をゆっくりと置きます。充填されたピペットをピペットホルダーから取り外し、すぐにピペットの上部開口部を親指で差し込み、密度勾配媒体がバフコート-PBS混合物に漏れるのを防ぎます。
注:親指で上の開口部を保持し、密度勾配媒体がゆっくりとバフィーコート-PBS混合物の下に流れるように円錐遠心管の底に充填されたピペットを置き、ピペットの中に約1 mLの密度勾配媒体を残します。 - バフィーコート-PBS混合物を含む他の3つのチューブでステップ1.2.5を繰り返します。
- 遠心分離機は、混合物を含む4本のチューブすべてを1,000xgでx g20分間、遅いブレーキモードで25°Cで行います。遠心分離のために保護蓋付きホルダーを使用してください。
- 各チューブの蓋を開け、血清ピペットを用いてプラズマと血小板を含む上層を取り除き、バイオハザード液体廃液容器に入れます。
- 血漿と密度勾配媒体層の間に白っぽい濁った小分画(厚さ約2〜3mm)として現れる末梢血単核細胞層を収集するために血清学的ピペットを使用する。ペレットは、下部に赤血球が含まれています。最下層を形成する赤血球の転移を避けてください。4本のチューブすべてに対してこれを繰り返します。
注:末梢血単核細胞はPBMとリンパ球で構成されています。PBMは、磁気CD14+分離中に後でリンパ球から分離されます。 - 末梢血単核細胞を4本のチューブから2つの50 mLチューブにプールします。
- 2本のチューブをPBSで50mLまで満たし、蓋をします。
- バイオハザード液体廃容器内の元の4つのチューブから残った赤血球およびプラズマを捨てます。
- 2本のチューブを500x g で8分間、通常の遠心分離機速度で18~20°Cの遠心分離機を使用します。
- 遠心分離後、血清ピペットで上清を取り出し、バイオハザード廃液容器に捨てます。
- 血清ピペットを用いて5mLのPBSで細胞を再懸濁する。
- 細胞懸濁液を1本の50 mL円錐遠心管に溜め、PBSで50mLに充填します。
- 細胞懸濁液の5 μLを使用して、トリパンブルー(45 μL)排除法を使用してセルカウンターで細胞をカウントします。
- トリパンブルーPBMs溶液のピペット10 μLをセルカウンターチャンバに入れ、標準のカウントプロトコルに従ってセル数をカウントします。数式 1 を使用して、セルの合計数である CTを計算します。
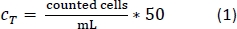
- 細胞を数えた後、ステップ1.2.13で行われたように50mLチューブを遠心分離する。
- CD14 ポジティブセレクション
- 各チューブの蓋をそっと開け、ペレットを邪魔することなく血清ピペットを使用して上清を取り除き、廃棄します。
- 磁気分離バッファーの計算量 (式 2) を加え (ここでは、合計 1 x 107 セル あたりバッファーの 80 μL) を加え、溶液を上下にピペット処理して細胞ペレットを再中断します。
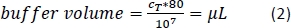
- 式3(ここでは、1 x 107 セルあたり10 μL)を使用して、対応するCD14+磁気ビーズの体積を計算し、適切な体積をピペットします。
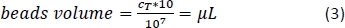
- 上下にピペットを入れ、蓋を閉めて、4°Cで15分間インキュベートします。
- インキュベーション時に、チューブを最大50 mLまで磁気分離バッファーで満たします。
- ステップ 1.2.13 で行われた遠心分離機。
- 細胞ペレットを乱すことなく血清ピペットを使用して上清を吸引し、廃棄する。
- ピペットの磁気分離バッファーの量(式 4;ここでは、1 x 108 セルあたりバッファーの 500 μL)、上下 3x ピペットで穏やかに混合します。
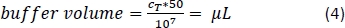
- 殺菌剤でスプレーして拭き取り、磁気分離ステーションを消毒します。磁気分離のための列と一緒に層流フードに置きます。
- 磁気分離カラムを磁界に置き、空の50 mL円錐形遠心管をカラムの下に置き、洗浄細胞とラベルなし細胞を回収します(すなわち、廃棄物)。
- 3 mLの磁気分離バッファーをカラムにピペット処理して、磁気分離カラムをリンスします。手順を通してカラムを乾燥させないでください。
- 15 mL円錐形遠心分離チューブとピペット1 mLの磁気分離バッファーを準備します。
- 磁気分離カラムにセル懸濁液(ステップ1.3.8で用意)を適用します。フィルターの下の50 mL円錐形遠心分離管で、通過したラベルのない細胞を収集します。
注: 列がブロックされないように、列あたり 2 x 109 個のセルを超えないようにしてください。 - カラムリザーバーが空になると(すなわち、細胞がカラムを通過した場合)、血清学的ピペットを使用して3mLの磁気分離バッファーを適用し、カラムを通過させます。この3倍を繰り返します。
- 磁気分離器から磁気分離カラムを取り出し、手で軽く引っ張り、あらかじめパイプした1mLの磁気分離バッファー(ステップ1.3.12で作成)を含む15 mLチューブに入れます。
- 5 mLの磁気分離バッファーをカラムに加え、プランジャーをしっかりと柱に押し込んで磁気標識されたセルを洗い流します。
- MDMおよびMDDC分化のための試薬調製
- ステップ 1.2.17 で行われた trypan blue 除外方法を使用してセル カウンターを持つセルをカウントします。
- さらに、1 x 106 セル/mL のセル密度に対応する CCM の体積(ステップ 1.5.1)、または FBS の 0.9 mL あたり 6 x 106 セルのセル密度に対応する FBS の体積 (ステップ 1.6.3) の場合は、CCM または FBS の必要なボリュームを計算します。
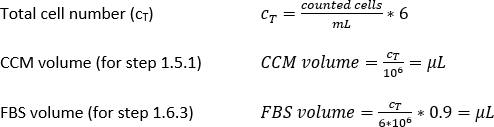
- 蓋を閉じ、チューブを遠心分離機に入れ、遠心分離機をステップ1.2.13で行います。細胞ペレットを乱さずに上清を取り除き、廃棄します。細胞の播種の場合はステップ 1.5 に進み、セル凍結の場合はステップ 1.6 に進みます。
- MM および MDDc への PBM シードと分化
- ステップ1.4.2で計算されたCCMの体積の細胞ペレットを再懸濁し(ここでは、1 x 106 細胞/mLの最終濃度)を3倍上下にピペット処理して下りる。
- ピペットは、血清ピペットを使用して、別々の円錐型遠心管内のMDMおよびMDDCに分化することを意図した細胞の数を示す。
- ピペットはPBMでCCMに因子を分化し、上下にピペットを入れることによってよく混ぜます。差別化要因は次のように適用されます。
- MDDCの場合:最終濃度は10 ng/mLインターロイキン-4(IL-4)および10ng/mL顆粒球マクロファージコロニー刺激因子(GM-CSF)である。
- MDMsの場合:10 ng/mLマクロファージコロニー刺激因子(M-CSF)の最終濃度。
- CCMの細胞懸濁液を6ウェルプレートに加えて、ウェルあたり3mLの懸濁液を分配して(3 x 106 細胞/ウェル、すなわち1 x 106 細胞/mLに相当する)。
- 6ウェルプレートを細胞培養インキュベーター(37°C、5%CO2)に2入れ、CCMをリフレッシュせずに6日間分化させます。
注:差別化は、適切な技術を使用して差別化効率が決定される場合(説明のセクションを参照)、バフィーコートと実験的セットアップの局所的な可用性に応じて5〜8日の範囲です。
- PBM凍結
- 細胞ペレットを凍結保護媒体(ここでは、FBSおよびジメチルスルホキシド[DMSO;細胞傷害性])の比で再懸濁し、プリウォームFBSの体積をピペット化して9:1(v/v)の比率で行う。これは、最終的な細胞濃度が6 x 106 セル/mLに相当し、さらに10%のDMSO(v/v)を追加することを考慮した。
- 層流フードのクライオビアルの所望の数をマークします(すなわち、日付、分離コード、およびセルの数を記録します)。
- ピュアFBSにおける細胞懸濁液のピペット0.9mL(ここでは、FBSの0.9 mLで6 x 106 細胞)を各cryovialにする。その後、DMSOのピペット0.1mLをゆっくりと、3倍上下にクライオビシャルを回して懸濁液をよく混ぜます。
- 凍結を細胞凍結容器に移し、すぐに-80°Cに24時間セットします。
- 24時間後、-80°Cの冷凍庫と容器から凍結を取り出し、細胞貯蔵に適した液体窒素タンクに入れます。
- MMSとMDDCへのPBMの解凍と差別化
- 必要な試薬をすべて水浴で37°C(〜20~30分)に温めます。
- 解凍した細胞の数に対応する6ウェルプレートの適切な数を準備します(ここでは、1.8 x 107細胞あたり1プレート、すなわち3クリボシャル)。無菌条件下で各ウェルにCCMのピペット2 mL。プレートをインキュベーター(5%CO2、37°C)に15分間置き、pHを平衡化させます。2
- 液体窒素タンクから凍結した細胞で必要な量の凍結を取り、37°Cの水浴(1〜2分)で静かに渦巻き、細胞懸濁液の均一な解凍を確実にします。
- 水浴から凍結を取り除き、殺菌剤で除染し、薬剤が蓋およびOリングと相互作用しないことを保証する。
注: ここでは、すべての手順は無菌条件下で完了する必要があります。 - 解凍するクライオビシャルの数に対応する15 mL円錐遠心管の適切な数を準備します(ここでは、6 x 106 細胞/チューブ)。各チューブにプリウォームCCMのピペット9 mL。
- ピペットは、クリオビシャルの内容物をCCMを含むチューブにゆっくりと(滴下)する。蓋を閉め、チューブごとに繰り返し、遠心分離機を200 x g で通常の遠心分離機の速度で5分間繰り返します。
- ペレットを邪魔することなく上清を捨てます。
- 血清学的ピペット(3 x 106 細胞/mLに対応する細胞密度)を使用して上下にピペット処理することにより、各チューブ(1つの凍結細胞からの細胞を含む)を2mLの前温めCCMで再懸濁します。
- 各チューブから、再懸濁した細胞を2つのウェル(ウェルあたり1mL)にピペット化し、以前に調製したCCMの2mLを含む6ウェルプレートの2つのウェル(1mL)を3 x 106 細胞/ウェル(1 x 106 細胞/mLの最終濃度に対応)の細胞密度に達する。他のすべてのチューブに対してこれを繰り返します。
- セクション 1.5.3 で説明されているように、差別化を進めます。
- 6ウェルプレートを細胞培養インキュベーター(37°C、5%CO2)に2入れ、CCMをリフレッシュせずに6日間分化させます。
ヒト肺胞上皮組織の三重細胞共培養モデル
注:このセクションでは、12ウェルプレート挿入に対応するボリュームとセル番号について説明します。図 1 は、モデル アセンブリの計画タイムラインを要約したものです。
- 上皮細胞(A549細胞株)播種
- サプライヤー(ATTC)が提供する勧告に従って上皮細胞を培養する。簡単に言えば、CCMの細胞を80%の細胞合流度(週に約2倍から3倍)で培養する。
注:サブカルチャーA549は、5〜25の通路範囲でA549細胞を使用して、コカルチャーモデル組成の前に少なくとも4つの通路のための。 - ピペット1.5mLの前温めCCMを12ウェルプレートに(ウェルの数は所望のモデル数に相当します)。
- 滅菌されたピンセットを使用して、個々の12ウェル細胞培養インサートを12ウェルプレートのウェルに入れる。
- サブ栽培プロトコルに従ってフラスコから細胞を取り外す(すなわち、剥離剤を使用して、ステップ1.2.13で行われたように遠心分離によって薬剤を取り除く)。A549の最終的な細胞濃度に対応する適切な量のCCMで再中断する(ここでは、50 x 104 細胞/mL;挿入1回あたり0.5mLの細胞懸濁液、すなわち25 x 104 細胞/挿入、すなわち27.8 x 104 細胞/cm2の播種密度に相当する)。
- 1 mL ピペットを用いて挿入液の補助側に細胞懸濁液のピペット 0.5 mL(すなわち、25 x 104 細胞/挿入) を使用して挿入する。
- 蓋でプレートを覆い、細胞培養インキュベーター(37°C、5%CO2)に42日間置きます。
注:位相コントラスト顕微鏡でA549細胞の合流を定期的に確認してください。
- サプライヤー(ATTC)が提供する勧告に従って上皮細胞を培養する。簡単に言えば、CCMの細胞を80%の細胞合流度(週に約2倍から3倍)で培養する。
- MDDC シード処理
- MDDCを含む6つのウェルプレートに未接続の細胞を有するCCMを吸引する。
- 各井戸に新鮮な温もりCCMの1 mLを追加します。
- セルスクレーパーを使用し、各ウェルから付着したMDDCを取り外し(擦り付け)、既存の1mLのCCM 3xでウェルを静かに洗い、1つの円錐形遠心管に組み合わせます。
- セルの懸濁液10 μLと10 μLのトリパンブルー溶液を使用したトリパンブルー排除法を使用して、セルカウンターを持つセルをカウントします。
- ステップ1.2.13で行ったように細胞懸濁液を遠心分離する。
- 再中断に必要な CCM ボリュームを計算します (式 5)。
必要な MDDC 密度 = 42 x 104セル/mL;各インサートは、7 x 104セル/cm2のシードセル密度に対応する6.3 x 104セルを必要とします(ここでは、ステップ2.2.10で0.9 cm2に150 μLを加えました)。
セル再懸濁液の CCM ボリューム (Vm;方程式5):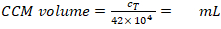
- そっと吸引し、挿入部にA549を成長させる12ウェルプレートの上部チャンバーからCCMを捨てます。
- A549細胞を付けたインサートを、滅菌されたピンセットを使用して滅菌ペトリ皿の逆さまの位置に置きます。PBSで円錐形遠心管(50 mL)を準備し、セルスクレーパーをプレモイステンプします。
- 挿入物の基底面(すなわち、逆さまの位置の上の部分)からA549細胞を削り取り、挿入物の細孔を通して成長する必要があります。
注:個々のサンプルを掻き取る間にPBS(チューブで準備)でスクレーパーをすすいで、手順全体を通して濡らしてください。 - 遠心分離(ステップ2.2.5)に際し、吸引し、上清を捨て、計算された量のCCM(ステップ2.2.6)とピペット3倍のピペットを再分散させる。
- 各インサートの上に細胞懸濁液のピペット150 μLは、挿入物の基底面全体が液体で均等に覆われ、気泡を含まないようにします。
- 蓋をして、70分間細胞培養インキュベーターに入れます。細胞培養プレート(インサートが最初に置かれている場所)からCCMを吸引し、バイオハザード液体廃棄物に廃棄し、各ウェルに新鮮なCCMのピペット1.5mLを入れ。蓋をしてプレートをセルインキュベーターに入れます(37°C、5%CO2)。2
注:細胞の乾燥を避けるために、上記の期間を超えないでください。 - インキュベーション後、各インサートを滅菌されたピンセットで慎重に保持し、CCMを含むプレートに通常の位置に置きます。蓋でプレートを覆い、細胞インキュベーター(37°C、5%CO2)に戻2します。
- マクロファージ (MDM) シーディング
- 事前分化されたMDMを含む6つのウェルプレートを取り、細胞インキュベーターから層流フードに置きます。
- 6つのウェルプレートで成長した未接続のMDMでCCMを吸引し、各ウェルに新鮮な前温めたCCMのピペット1mLを捨てます。
- セルスクレーパーを使用して、個々のウェルから付着したMDMを静かに取り除きます(MDDCのステップ2.2.3で行われているように)。
- ピペット10 μLのトリパンブルーをウェルまたはチューブに入れ、MDMサスペンションの10 μLを加えて、1:1(v/v)の最終希釈を達成します。適切なカウント プロトコルを使用して、Mdm の数をカウントします。
- ステップ1.2.13で行ったように細胞懸濁液を遠心分離する。
- 必要な体積を計算します(方程式6):
必要な MDM 密度 = CCM の 2.5 x 104セル/mL (ここでは、各挿入には 0.5 mL CCM の 1.25 x 104 セルが必要です。4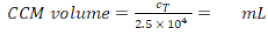 (6)
(6) - 遠心分離の際、吸引し上清を捨て、計算された量のCCM(ステップ2.3.6)でMDMペレットを再分散し、ピペットを上下3倍にする。
- 1 mL ピペットを使用して A549 および MDDC (上皮細胞に直接ない) で挿入する細胞の壁に MDM 懸濁液の0.5 mL(ステップ2.3.7で調製)を慎重に。蓋をしたプレートをカバーし、細胞培養インキュベーター(37°C、5%CO2)を24時間置きます。2
- 共培養モデルを空気液体インタフェース(ALI)に移行
- 細胞培養インキュベーターで組み立てられたモデルの24時間(±2 h)のインキュベーション期間の終わりに、細胞培養インサートの補助的および基底部分の両方からCCMを吸引し、廃棄します。
- 滅菌されたピンセットを使用して、1 mLピペットを使用して各ウェルに新鮮な前温めたCCMの井戸とピペット0.6 mLから個々のインサートを持ち上げます。挿入の補助側に CCM を追加しないでください。
- 蓋をしたプレートをカバーし、細胞培養インキュベーター(37°C、5%CO2)に24時間前に使用してください。2
3. 選択した陽性コントロールへの暴露(炎症促進反応を誘発するための既知の刺激)
注:共培養モデルを既知の炎症促進刺激因子内脂肪多糖(LPS)7および炎症性サイトカイン腫瘍壊死因子α(TNF-α)7に曝露してモデルの応答性を示す。7 7さらに、洗浄剤(Triton X-100)への暴露は、乳酸デヒドロゲナーゼ(LDH)アッセイの感度を確認するために使用される。
- 正の対照溶液を準備する:LPSストック(蒸留水中の1mg /mL)、TNF-αストック(蒸留水中の100 μg/mL)およびトリトンX 100(PBSでは2%[v/v])。
- ALI条件での共培養モデルの24時間の培養の際に、吸引し、基底コンパートメントから上清を捨てる。滅菌されたピンセットを使用して、各井戸に新鮮な前温化CCMの井戸とピペット0.6 mLから個々のインサートを持ち上げます。
- CCMの在庫を円錐遠心管に希釈して、個々の正のコントロールの作業ソリューションを準備します: 1 μg/mL LPS、1 μg/mL TNF-α、および0.2%Triton-X 100。ボリュームは、テスト済み挿入数に対応しています(ここでは、100 μL/インサート)。3倍上下にピペットを入れるだけで、溶液をよく混ぜます。
- 細胞培養インサートの壁面にゆっくりとピペットを塗布することにより、各陽性対照溶液の100 μLを塗布します。ウェルプレートを蓋で覆い、細胞培養インキュベーター(37°C、5%CO2)に224時間置きます。インキュベーションの際、ピンセットを使用して個々のインサートを保持することにより、吸引し、挿入物の補助側で液体を捨てます。
- 基底コンパートメントにCCMを収集し、さらにLDH分析のために1)4°Cで保存し、細胞膜破裂媒介性細胞傷害性を示し、および/または2)-80°Cで保存して、酵素結合免疫吸着測定法(ELISA)を介したタンパク質放出をさらに分析します。キットサプライヤーの推奨事項に従ってアッセイを実行します。
- CCMを取り外した際に、挿入物をPBS 3xで洗浄し、細胞培養インサート上の細胞を4%[w/v]パラホルムアルデヒド(PBSでは室温で15分)に固定し、両方の挿入側がPFA溶液で十分に覆われていることを確認します。その後、3倍のPBSを洗浄してPFAを除去します。さらに免疫染色のためにPBSに沈んだサンプルを4°Cで保存する(この方法の一例は、前述17)。
結果
肺胞上皮細胞と免疫細胞で構成されるヒト肺共培養モデルは、新鮮または凍結したMDDCおよびMDMs前駆体(ここでは、ヒト末梢血由来単球)から組み立てられた。図1に示すように、A549細胞は単球単球の単離/解凍を含む最初のセクションの3日後に播種した。6日間の分化後、分化したMDMは丸型に見え、MDDCは観察可能な突起でより細長い形状を形成した。また、特に新鮮な単球と区別された場合には、凝集体として現れました(図2、図3)。上皮細胞は、細胞の密な細胞層を形成し、膜インサート上で3日間増殖した後(図4)、共培養を組み立てたとき。24時間の組み立て後、さらに24時間のALI条件を受けた後、コカルチャーを曝露のために調製した。
3D細胞培養モデルの応答性を、前述の29に記載した擬似ALIアプローチを用いて既知の炎症誘発刺激に曝露した際に調査した。炎症促進刺激を、LPSおよびTNF-αは、空気露出細胞モデルの有端表面に少量(100μL)で添加した。並行して、細胞毒性の尺度としての膜破裂の欠如をLDHアッセイを介して評価した。基底コンパートメントのCCMにおけるLDH放出の有意な増加は、膜破裂に対する陽性制御への暴露時に観察された、洗浄剤Triton-X 100(図5)。これらの結果は、細胞毒性物質に対するモデルの応答性を証明したのに対し、TNF-αまたはLPSによる有端刺激ではLDH放出の増加は認められなかった。
新鮮なまたは以前に凍結したPBMを組み立てたサンプル中のLDHの異なる測定値の考えられる理由は、サンプルストレージに起因する可能性があります。新鮮なPBMからのサンプルは-80 °Cで長期間保存されました。したがって、LDH酵素の活性が低下する可能性があります。特に、LDH は CCM で 4 日間までだけ安定しています。したがって、上清を収集した後、最新の2日間のアッセイを行うことを推奨します。あるいは、コレクション後直ぐに上清を凍結することができる。しかし、凍結はLDHの酵素活性を低下させることができることを考慮することが重要である。
この基底CCMへの炎症促進メディエーター(ここでは、TNF-αおよびインターロイキン6[IL-6]および8[IL-8])の分泌は、ELISAを介して定量した。LPS-およびTNF-α-α処理サンプルの両方で、IL-6およびIL-8の放出における統計的に有意な(p<0.05、一方向ANOVA)の増加は、それぞれの未処理細胞と比較して、またPBM源から組み立てられた細胞培養モデルにおいて観察された(図6)。基礎CCM中の全ての試験サイトカインの濃度(pg/mL)は、新鮮なPBMで構成される共同培養において高かったが、2つの共同培養と単一培養の間の差は統計的に有意ではなかった(p> 0.05) (図6)。2D上皮細胞培養に関するコカルチャーモデルの付加価値を確認するために、A549単一培養もLPSまたはTNF-αに曝露した。予想通り、A549単一培養物からの調査されたメディエーターのリリースは、両方の共同培養モデルに比べて低かった。しかし、両者の差は統計的に有意ではなかった(p > 0.05、一方向の分散分析)。
3Dヒト肺胞上皮組織バリアの細胞形態は、共焦点レーザー走査顕微鏡(LSM)を介して評価した。各モデルの組成を可視化するために、コカルチャーモデル(MDM)内のマクロファージを成熟マクロファージマーカー25F9で染色した。MDDCはCD83で染色され、これは活性化樹状細胞30の重要なマーカーである。細胞形態に関しては、解凍されたPBMを使用する場合と比較して、新鮮なPBMからMDMとMDDCを使用するコカルチャーモデルの間に違いは認められなかった。LPS-およびTNF-α-暴露された共培養物では、いずれも新鮮な免疫細胞と凍結免疫細胞から構成され、LSM画像中の破壊された上皮層が観察されたが、未治療細胞には当てはまらなかった(図7、図8)。
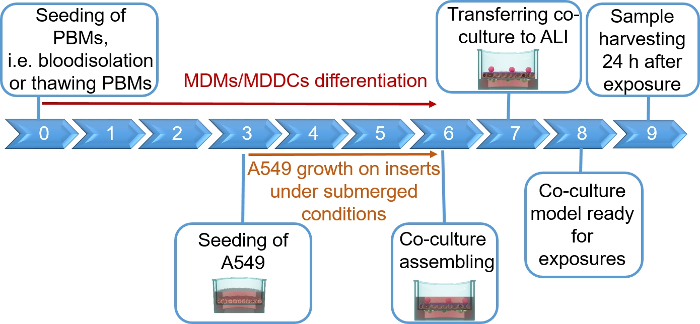
図1:プロトコルの概略タイムライン3D共培養モデルの調製、組み立て、および適用(試験物質への暴露)の提示。ALI=空気液体界面、MDDc=単球由来樹状細胞、MDMs=単球由来マクロファージ、PBMs=末梢血単球。 この図の大きなバージョンを表示するには、ここをクリックしてください。
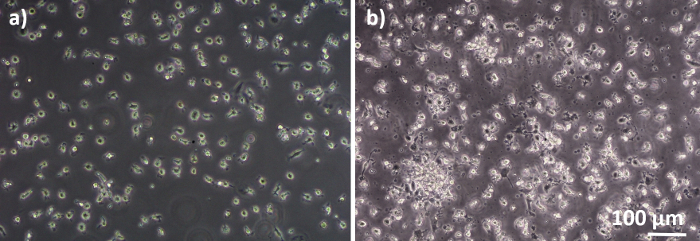
図 2: MDM と MDDC は、新鮮な PBM と区別されています。新鮮なPBMからの差別化(A)MMSおよび(B)MDDCの位相対視画像(細胞分離の6日後)。MDMは丸型であり、MDDCは凝集体として観察されることが多い。 この図の大きなバージョンを表示するには、ここをクリックしてください。
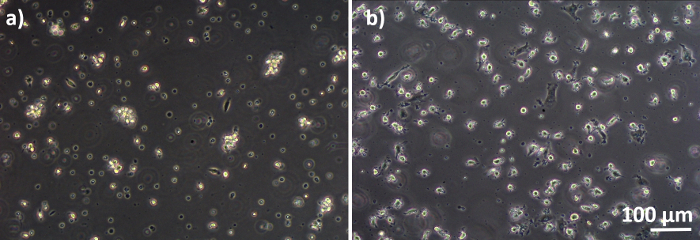
図 3: 冷凍 PBM と区別された MMS と MDDC分離された(A)MMSおよび(B)MDDCの相コントラストB顕微鏡画像(解凍後6日間)MMSは丸型ですが、一部の細長い細胞が観察される可能性があります。MDDCはまた、突起で丸い形で表示されます。この図の大きなバージョンを表示するには、ここをクリックしてください。

図4:上皮細胞は膜挿入物上で増殖する。播種の4日後に膜挿入物上に成長するコンフルエントA549の位相対照顕微鏡画像は、細胞の密な層を形成する。 この図の大きなバージョンを表示するには、ここをクリックしてください。
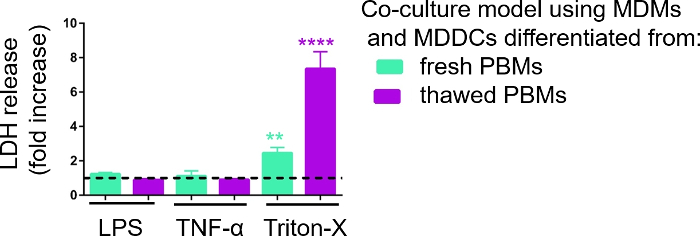
図5:膜破裂ベース(LDH)アッセイを介して調査した細胞傷害性の結果。データは、未処理の細胞に対する倍率増加として提示されます(平均±SD、n = 3、アスタリスクは未治療セルと比較して統計的に有意な増加を示し、**p< 0.01、****p < 0.0001)。緑色のモデルでは、新鮮なPBMからMDMとMDDCが表現され、解凍されたPBMから組み立てられた紫色のモデルで表現されます。 この図の大きなバージョンを表示するには、ここをクリックしてください。
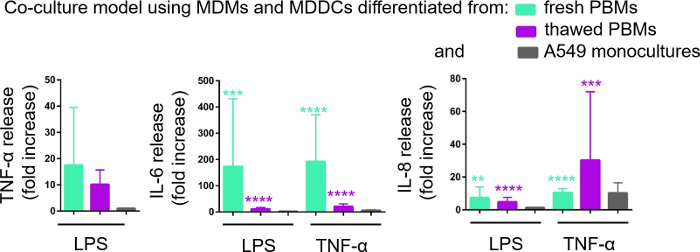
図6:共培養および単一培養における炎症反応を示す。24時間にコカルチャーにおける炎症促進メディエーター(TNF-α、IL-6、およびIL-8)放出はLPSまたはTNF-αに挑戦する。データは、未処理のセルに対して相対的に表示されます (平均 ± SD, n = 3, **p < 0.01, ***p < 0.001, ****p < 0.0001)。緑色のモデルでは、新鮮なPBMからMDMとMDDCが表現され、解凍されたPBMから組み立てられた紫色のモデルで表現されます。グレーはA549の単一文化を表します。 この図の大きなバージョンを表示するには、ここをクリックしてください。
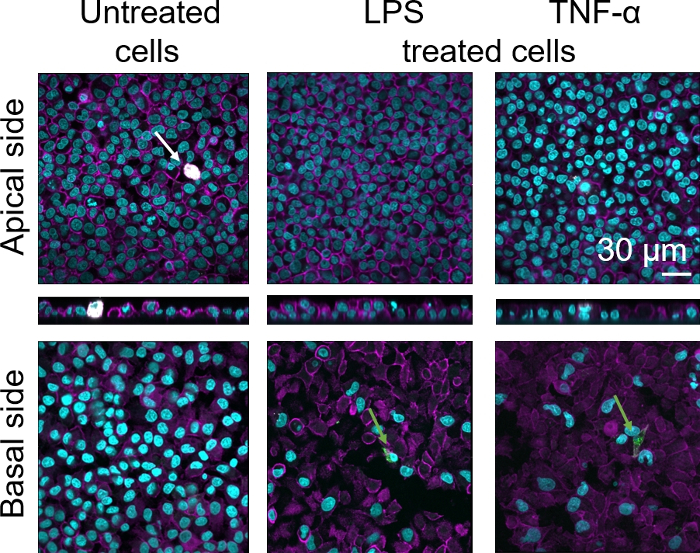
図7:新鮮な免疫細胞からなる共同培養物の形態新鮮なPBMからMDMとMDDCを使用したモデルのアピカル側と核側面を持つ共培養モデルの補助的および基底面のLSM画像は、シアンは核(DAPI)を表し、マゼンタは細胞骨格(ローダミン-ファロイジン)を表し、白はMDMs(25F9)を表し、緑色はMDDCs(CD83)を表す。白い矢印は MDM を示し、緑の矢印は MDDC を示します。 この図の大きなバージョンを表示するには、ここをクリックしてください。
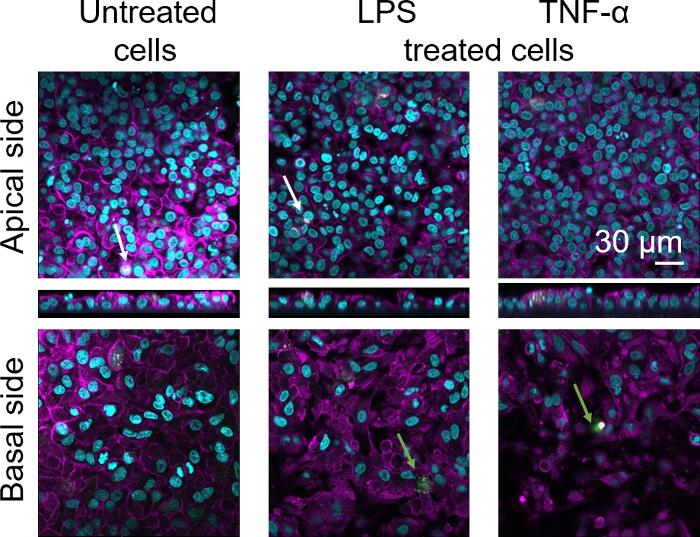
図8:凍結免疫細胞からなる共同培養物の形態対応するxz投影を有する共培養モデルの元素側のLSM画像、および解凍されたPBMからMDMおよびMDDCを用いたモデルの基底側のLSM画像は核(DAPI)を表し、マゼンタは細胞骨格(ローダミン-ファロイジン)を表し、白はMDMs(CD83)を表す。白い矢印は MDM を示し、緑の矢印は MDDC を示します。 この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
化学物質や医薬品を含む新しい材料の新しい生産は、徐々にインビトロモデルの予測の必要性を高めます。動物実験32の置換、縮小、および精製の3つの原則に準拠するために、インビトロ細胞モデルは、薬物または材料の作用8、9、10、119,の薬剤または材料のメカニズムを解明するための置換および8還元態様に関する強力なツールとなっている。10,11ここで提示される、新たに単離された、または以前に凍結した単球から解凍された免疫細胞を使用して多細胞モデルを組み立てる詳細なプロトコルです。また、ALIでのモデルの栽培についても説明します。最後に、プロトコルは、炎症誘発性刺激への暴露の例を示し、新鮮または凍結した単球のいずれかを含む2つのモデルの応答を比較する。
従来の水没露光7、22、31と比較して、ALI条件下で成長し、露出したモデルの高められた複雑さの7,付加価値を確認し、31正当化するために様々な研究が行われている。上皮細胞の単一培養と比較して、共培養における高い炎症反応の観察は、以前の研究を確認する。本研究では、提示された共培養モデル(LPSで刺激)を用い、A549単一培養等価モデル7と比較してTNFおよびIL1Bの遺伝子発現レベルにおいて高い応答を示した。一方、両モデルは、A549単一培養物と比較して、測定された炎症促進メディエーター放出値内でより高い変動を示した。これは、生物学的反復(すなわち、1つの繰り返し、1つのドナー)内の異なるドナー(バフィーコート)からの免疫細胞の使用によって説明することができる、7を既に示した。必要に応じて、反復の変動は、1)同じドナーからの解凍PBMまたは2)細胞を凍結する前に異なるドナーからのPBMをプールし、その後、各繰り返しで同じプールを使用することによって克服することができる。より多くの生物学的繰り返しを含めることも推奨されます。
細胞凍結技術は重要なステップと考えることができます。しかし、それは、細胞を保存するための一般的な実験室の手順である。様々な研究は、凍結PBMの品質がその生存に不可欠であることを実証しており、適切な凍結技術は、同じ細胞28、32,32を有するその後のアッセイの成功の鍵である。プロトコルの改変は、通常、バフィーコートの利用可能性が限られているため、実験セットアップの柔軟性を提供するPBMを凍結することによって行うことができる。新たに分離されたPBMよりも冷凍PBM(いくつかのバイアル)を使用するもう一つの利点は、1年後でもその後の実験で使用できることです。これは、実験で必要なパラメータまたは必要なパラメータである場合、ドナー間変動の潜在的な問題を減少させる。
最大13ヶ月後に行われたラボ間比較の結果は、PBMが、液体窒素タンクに適切に貯蔵された場合、細胞生存率または細胞回収33に影響を及ぼすことなく長期間にわたって使用できることを示している。実験を行う前に細胞の生存率と細胞の応答性を慎重に検証すれば、より長い保管時間(1年以上)が可能になる可能性があります。また、液体窒素タンク内の温度は常に安定している必要があります。凍結保存されたPBMの生存率に影響を与える主な要因は、DMSO濃度であり、最適濃度は10%〜20%(v/v)28であることがわかった。28凍結の潜在的に有害な影響を最小限に抑えるために、タンパク質、FBSまたはBSAの異なる供給源(40%から100%34まで幅広い濃度)が、細胞生存率を高めることができる自然な保護成分として凍結培地に添加されることが多い。
DMSO の細胞毒性の高いポテンシャルが高いため、まず FBS に PBM を分散し、FBS にすでに分散している PBM に DMSO を追加することをお勧めします。特に、FBS濃度は高いが(>40%)細胞生存率の改善を示さなかったが、同時に、細胞28に害を及ぼさなかった。それにもかかわらず、単球を凍結することは、限られたバフィーコートの可用性の問題を克服するための可能なアプローチである。しかし、新鮮なPBMからMDDcとMDMを使用することが望ましい場合、免疫細胞は分離し、分離後5〜8日後に7、16、17、35、36、37を使用することができる。,16,17,35,36,37実験計画が許すなら、MDDCとMDMの両方で少なくとも6日間の分化が推奨される。しかし、同じ実験における異なる繰り返しの間の一貫性は、特定の表面マーカー表現の定期的な検査と共に、非常に重要です。分化時間後のLPSなどの炎症促進刺激に対する応答性も定期的にチェックする必要があります。
A549細胞株を用いた多くの調査は、ALIにおいて、単培養として、または他の細胞タイプ(マクロファージ、樹状細胞、または線維芽細胞)と組み合わせて、3Dコカルチャーモデル2222、24、29、3824,29,38に対して行われている。この3D共培養モデルを用いて、細胞毒性、酸化ストレス、または(ナノ)材料の炎症効果(ナノ)の炎症効果が、最大72h1、17、21、24、29まで調べられている。1,17,21,24,29このモデルは生体内組織に類似しており、モデル16の共焦点レーザー走査イメージングに基づいて以前に調べられていた。モデルを組み立てる際には、細胞増殖(ここで示すモデルではA549に影響を与える可能性があります)と、プライマリ(増殖しない)免疫細胞(ここではMDDCおよびMDM)の性能の両方を考慮することが重要です。また、すべてのCD14陽性単球がMDDCとMDMに分化するわけではないこと、および細胞が付着した形態と浮遊形態の両方に存在することができることを考慮することも重要である。コカルチャーアセンブリの性質に基づいて(ここでは、両方の細胞タイプが既存の上皮層に付着する必要がある)、両方の免疫細胞タイプの接着サブ集団のみを使用することが推奨される。さらに、単球、MDDCおよびMDM単一培養のLPSへの応答性、および特定表面マーカー(CD14、CD163、CD86、CD93、またはCD206、図示しない)の発現のルーチン分析は、6日および7日間の分化が最適な時点であることを示唆している。
ヒト肺の肺胞上皮細胞の現実的な数は〜160,000細胞/cm2に相当するが、モデル内で数えられるA549細胞の数は、挿入部16,18,18で培養した9日後に〜1,000,000細胞/cm2である。したがって、このインビトロモデルの限界を考慮する必要があります。まず、上皮細胞の密度は、成長膜上にコンフルエント層を形成する能力に基づいて確立された。また、A549は、平らで広がった上皮I型細胞とは対照的に、立方体型の上皮II型細胞を表していることも言及することが重要である。一方、免疫細胞の必要数は文献に基づいて確立され、このプロトコルでは細胞数/表面積39、40、4140,41として提示された。39400細胞/mm2(4細胞/cm2)16の範囲2のMDDCの細胞密度2は、16生体内研究39から報告された500〜750細胞/mm2(5〜72細胞/cm2)の定常状態の細胞密度に匹敵する。このモデルにおけるMDMの密度は、ヒト肺胞領域40におけるインビボ状況の同じ範囲内にある。
成熟したマクロファージマーカー染色(25F9)は、補助側(MMSが存在する場所)と基底側(すなわち樹状細胞の部位)の両方で観察された。膜挿入孔を介した免疫細胞の転位が可能であり、またこのモデル16を用いて観察されており、これは染色強度の観察された違いを説明する可能性がある。しかし、もう一つの考えられる説明は、成熟したマクロファージマーカーも樹状細胞上で発現することができるが、その発現はドナー特異的な42である。また、25F9発現の強度は、MDMにおいてはるかに高い(図7、図8)。両方の炎症促進刺激(LPSおよびTNF-α)は、両方のコ培養において肺上皮バリアの完全性に影響を及した(図7、図8)。これは、炎症性サイトカインおよび細菌製品が上皮障壁の完全性を破壊することを示す以前の出版物43、44に基づいて予想された。43,
ヒト肺胞上皮の3D多細胞モデルは、以前17個の確立および特徴付け、生体応答(すなわち、急性炎症反応、酸化ストレス応答、粒子分布、および細胞伝達)の生体内応答を評価するための強力で有用なツールとして役立21,24,25,っている。結果は、共培養モデルの炎症促進性刺激(ここではLPSおよびTNF-α)の責任を確認する。新鮮なPBMからの免疫細胞を使用する場合、応答はわずかに増加しました;しかし、新鮮なPBMと解凍されたPBMを使用するコカルチャーの間には統計的に有意な差はなかった。さらに、両コカルチャーモデルの炎症反応は、同じ(ALI)条件下で培養した上皮細胞単一培養の反応よりも高かった。要約すると、このプロトコルは、MDMおよびMDDACへの分化のために新鮮または解凍されたPBMのいずれかを使用して、3Dヒト肺胞上皮組織共培養モデルの組み立てを記述する。両方のモデルは炎症促進刺激に対して非常に反応性が高い。したがって、潜在的な危険および毒性評価のための強力なツールとして役立ちます。
開示事項
著者らは開示するものは何もない。
謝辞
著者らは、図3のコカルチャースキームに対するミゲル・スプック=カルバー博士と、批判的な読書に対するベディア・ベグム・カラコカク博士に感謝したいと考えています。この研究は、PATROLSプロジェクト、欧州連合(EU)のHorizon 2020研究イノベーションプログラム、補助金契約No 760813、アドルフ・メルクル財団によって支援されました。B.D.は、ピーター・ウント・トラウドル・エンゲルホルン財団に資金援助を感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Benchmark microplate reader | does not have to be specific, for example BioRad, Cressier, Switzerland | ||
| Cell culture Incubator | does not have to be specific | ||
| Cell freezing container (for example Mr. Frosty) | does not have to be specific | ||
| Centrifuge | does not have to be specific | ||
| Confocal laser scanning microscope | does not have to be specific, for example | Zeiss LSM 710 meta | |
| Heamatocytometer, or automatic cell counter | does not have to be specific | ||
| Laminar bio-safety hood class II | does not have to be specific | ||
| MultiStand Macs (Macs Cell Separator) | Miltenyi, Germany | 130-042-303 | |
| pH meter | does not have to be specific | ||
| Phase contrast inverted light microscope | does not have to be specific | ||
| Pipette boy, pipettors (different volumes) | do not have to be specific | ||
| Scissors | do not have to be specific | ||
| Vacuum pump | does not have to be specific | ||
| Water bath | does not have to be specific | ||
| Disposable small equipment/glassware | Catalogue Number | ||
| 15 mL and 50 mL conical centrifuge tubes | does not have to be specific | ||
| 6- and 12-well cell culture plates, flat bottom, low evaporation lid, sterile | Falcon, Switzerland | 353046 and 353043 | |
| Cell culture inserts, transparent PET membrane, 12-well, 3 μm pore size | Falcon, Switzerland | 353181 | |
| Cell scrapper | does not have to be specific, for example VWR, Switzerland | 353085 | |
| Cryovials | do not have to be specific | ||
| Glass autoclaved Petri Dishes | do not have to be specific | ||
| LS Columns | Miltenyi, Germany | 130-042-401 | |
| Sterile filtration cup for vacuum filtration, 0.2 μm pore size | does not have to be specific, for example VWR, Switzerland | 10040-446 | |
| Sterile Lab Bottle compatible with Filtration cup (min. 100 mL) | does not have to be specific | ||
| Sterile pipettes | do not have to be specific | ||
| Chemicals | |||
| Bovine serum albumine (BSA) | Sigma-Aldrich, Switzerland | A7030-100g | |
| CD14+ MicroBeads human - magnetic beads | Miltenyi, Germany | 130-097-052 | |
| Deattachnig agent Trypsin-EDTA, 0.05%, phenol red | Gibco, Switzerland | 25300054 | |
| Density gradient medium Lymphoprep | Alere Technologies AS, Norway | 1114547 | |
| Dimethyl Sulfoxide (DMSO) | Sigma Aldrich, Switzerland | D2438 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich, Switzerland | E6758-100g | |
| Fetal bovine serum (heat inactivated) | Gibco, Switzerland | 10270-106 | |
| Human granulocyte-macrophage colony-stimulating factor (GM-CSF), premium grade | Miltenyi, Germany | 130-093-864 | |
| Human Interleukin 4 (IL-4), premium grade | Miltenyi, Germany | 130-095-373 | |
| Human macrophage colony-stimulating factor (M-CSF), premium grade | Miltenyi, Germany | 130-096-485 | |
| L-glutamine | Gibco, Switzerland | 25030-024 | |
| Lipopolysaccharid (LPS) from Escherichia coli | Sigma-Aldrich, Switzerland | 4524-5mg | |
| Paraformaldehyde (PFA) | Sigma-Aldrich, Switzerland | 158127 | |
| Penicilin-Streptomycin | Gibco, Switzerland | 15140-122 | |
| Phosphate Buffer Saline (PBS) | Gibco, Switzerland | 10010-015 | |
| Roswell Park Memorial Institute-1640 Medium (RPMI) | Gibco, Switzerland | 42401-018 | |
| Triton X-100 | Sigma-Aldrich, Switzerland | T8787 | |
| Trypan blue solution (0.4%) | Sigma Aldrich, Switzerland | ||
| Tumor necrosis factor alpha (TNF-α) | Immunotools | 11343015 | |
| Assays used for cytotoxicity, (pro-)inflammatory response | |||
| Cytotoxicity Detection Kit (LDH) | Roche, Switzerland | 11644793001 | |
| Human IL-6 DuoSet ELISA | R&D, Biotechne, Switzerland | DY206 | |
| Human IL-8/CXCL8 DuoSet ELISA | R&D, Biotechne, Switzerland | DY208 | |
| Immunostaining | |||
| 4′,6-diamidino-2-phenylindole (DAPI), concentration 2 μg/mL | Sigma-Aldrich, Switzerland | 10236276001 | |
| Goat anti-mouse IgG (H+L) Alexa Fluor 647 conjugated, concentration 20 μg/mL | Abcam, UK | ab150115 | |
| Goat anti-rabbit IgG antibody (H+L) Dylight 488 conjugated, concentration 10 μg/mL | Agrisera, Sweden | AS09 633 | |
| Mature Macrophage Marker Monoclonal Antibody, concentration 50 μg/mL | eBioScience, Thermo Fischer, Switzerland | 14-0115-82 | |
| Phalloidin rhodamine, concentration 0.264 µM | Molecular Probes, Life Technologies, Switzerland | R415 | |
| Recombinant Anti-CD83 antibody, 1:50 dillution | Abcam, UK | ab244204 |
参考文献
- Rothen-Rutishauser, B., Blank, F., Mühlfeld, C., Gehr, P. In vitro models of the human epithelial airway barrier to study the toxic potential of particulate matter. Expert Opinion on Drug Metabolism and Toxicology. 4 (8), 1075-1089 (2008).
- Giard, D., et al. In vitro cultivation of human tumors: establishment of cell lines derived from a series of solid tumors. Journal of National Cancer Institute. 51 (5), 1417-1423 (1973).
- Ochs, M., Weibel, E. R., Grippi, M. A. Ch. 2: Functional Design of the Human Lung for Gas Exchange . Fishman's Pulmonary Diseases and Disorders, 5e. , (2008).
- Foster, K. A., Oster, C. G., Mayer, M. M., Avery, M. L., Audus, K. L. Characterization of the A549 Cell Line as a Type II Pulmonary Epithelial Cell Model for Drug Metabolism. Experimental Cell Research. 243 (2), 359-366 (1998).
- Guo, X. Y., Lu, M., Chen, X. Q., He, F. D., Li, A. Correlation study of biological characteristics of non-small cell lung cancer A549 cells after transfecting plasmid by microbubble ultrasound contrast agent. Asian Pacific Journal of Tropical Medicine. 9 (6), 582-586 (2016).
- Cooper, J. R., et al. Long Term Culture of the A549 Cancer Cell Line Promotes Multilamellar Body Formation and Differentiation towards an Alveolar Type II Pneumocyte Phenotype. PLoS ONE. 11 (10), 0164438 (2016).
- Bisig, C., Voss, C., Petri-Fink, A., Rothen-Rutishauser, B. The crux of positive controls - Proinflammatory responses in lung cell models. Toxicology In Vitro. 54, 189-193 (2019).
- Rothen-Rutishauser, B., et al. A newly developed in vitro model of the human epithelial airway barrier to study the toxic potential of nanoparticles. ALTEX. 25, (2008).
- Braakhuis, H. M., et al. Progress and future of in vitro models to study translocation of nanoparticles. Archives of Toxicology. 89 (9), 1469-1495 (2015).
- Thai, P., Chen, Y., Dolganov, G., Wu, R. Differential regulation of MUC5AC/Muc5ac and hCLCA-1/mGob-5 expression in airway epithelium. American Journal of Respiratory Cell and Molecular Biology. 33 (6), 523-530 (2005).
- Wu, J., et al. Characterization of air-liquid interface culture of A549 alveolar epithelial cells. Brazilian Journal of Medical and Biological Research. 51 (2), 6950 (2017).
- Shapiro, D. I., Nardone, L. L., Rooney, S. A., Motoyama, E. K., Munoz, J. L. Phospholipid biosynthesis and secretion by a cell line (A549) which resembles type II aleveolar epithelial cells. Biochimica and Biophysica Acta. 530 (2), 197-207 (1978).
- Balis, J., Bumgarner, S. D., Paciga, J. E., Paterson, J. F., Shelley, S. A. Synthesis of lung surfactant-associated glycoproteins by A549 cells: description of an in vitro model for human type II cell dysfunction. Experimental Lung Research. 6 (3-4), 197-213 (1984).
- Schurch, S., Gehr, P., Im Hof, V., Geiser, M., Green, F. Surfactant displaces particles toward the epithelium in airways and alveoli. Respiration Physiology. 80 (1), 17-32 (1990).
- Gehr, P., Schurch, S., Berthiaume, Y., Hof, V. I., Geiser, M. Particle Retention in Airways by Surfactant. Journal of Aerosol Medicine. 3 (1), 27-43 (2009).
- Blank, F., Rothen-Rutishauser, B., Gehr, P. Dendritic Cells and Macrophages Form a Transepithelial Network against Foreign Particulate Antigens. American Journal of Respiratory Cell and Molecular Biology. 36 (6), (2007).
- Rothen-Rutishauser, B. M., Kiama, S. G., Gehr, P. A three-dimensional cellular model of the human respiratory tract to study the interaction with particles. American Journal of Respiratory Cell and Molecular Biology. 32, (2005).
- Blank, F., Rothen-Rutishauser, B. M., Schurch, S., Gehr, P. An optimized in vitro model of the respiratory tract wall to study particle cell interactions. Journal of Aerosol Medicine. 19, (2006).
- Jardine, L., et al. Lipopolysaccharide inhalation recruits monocytes and dendritic cell subsets to the alveolar airspace. Nature Communications. 10 (1), 1999 (2019).
- Kopf, M., Schneider, C., Nobs, S. P. The development and function of lung-resident macrophages and dendritic cells. Nature Immunology. 16 (1), 36-44 (2015).
- Chortarea, S., et al. Repeated exposure to carbon nanotube-based aerosols does not affect the functional properties of a 3D human epithelial airway model. Nanotoxicology. 9 (8), 983-993 (2015).
- Hilton, G., Barosova, H., Petri-Fink, A., Rothen-Rutishauser, B., Bereman, M. Leveraging proteomics to compare submerged versus air-liquid interface carbon nanotube exposure to a 3D lung cell model. Toxicology In Vitro. 54, 58-66 (2019).
- Brandenberger, C., et al. Effects and uptake of gold nanoparticles deposited at the air-liquid interface of a human epithelial airway model. Toxicology and Applied Pharmacology. 242, (2010).
- Drasler, B., et al. Single exposure to aerosolized graphene oxide and graphene nanoplatelets did not initiate an acute biological response in a 3D human lung model. Carbon. 137, 125-135 (2018).
- Durantie, E., et al. Carbon nanodots: Opportunities and limitations to study their biodistribution at the human lung epithelial tissue barrier. Biointerphases. 13, (2018).
- Brandenberger, C., et al. Quantitative evaluation of cellular uptake and trafficking of plain and polyethylene glycol-coated gold nanoparticles. Small. 6 (15), 1669-1678 (2010).
- Tomašek, I., et al. Combined exposure of diesel exhaust particles and respirable Soufrière Hills volcanic ash causes a (pro-)inflammatory response in an in vitro multicellular epithelial tissue barrier model. Particle and Fibre Toxicology. 13 (1), 67 (2016).
- Nazarpour, R., et al. Optimization of Human Peripheral Blood Mononuclear Cells (PBMCs) Cryopreservation. International Journal of Molecular and Cellular Medicine. 1 (2), 88-93 (2012).
- Endes, C., et al. An in vitro testing strategy towards mimicking the inhalation of high aspect ratio nanoparticles. Particle and Fibre Toxicology. 11 (1), (2014).
- Ju, X., et al. The Analysis of CD83 Expression on Human Immune Cells Identifies a Unique CD83+-Activated T Cell Population. Journal of Immunology. 197 (12), 4613-4625 (2016).
- Lenz, A. G., et al. Inflammatory and Oxidative Stress Responses of an Alveolar Epithelial Cell Line to Airborne Zinc Oxide Nanoparticles at the Air-Liquid Interface: A Comparison with Conventional, Submerged Cell-Culture Conditions. BioMed Research International. , 12 (2013).
- Germann, A., Schulz, J. C., Kemp-Kamke, B., Zimmermann, H., von Briesen, H. Standardized serum-free cryomedia maintain peripheral blood mononuclear cell viability, recovery, and antigen-specific T-cell response compared to fetal calf serum-based medium. Biopreservation and Biobanking. 9 (3), 229-236 (2011).
- Weinberg, A., et al. Optimization and Limitations of Use of Cryopreserved Peripheral Blood Mononuclear Cells for Functional and Phenotypic T-Cell Characterization. Clinical and Vaccine Immunology. 16 (8), 1176 (2009).
- Freshney, R. I., Freshney, R. I. . Culture of animal cells: a manual of basic technique. , 321-334 (2005).
- Lehmann, A. B. C., Blank, F., Gehr, P., Rothen-Rutishauser, B., Yarmush, M. L., Langer, R. S. . Alternatives to animal testing. , 239-260 (2010).
- Steiner, S., et al. Reduction in (pro-)inflammatory responses of lung cells exposed in to diesel exhaust treated with a non-catalyzed diesel particle filter. Atmospheric Environment. 81, 117-124 (2013).
- Martinez, F. O., Gordon, S., Locati, M., Mantovani, A. Transcriptional Profiling of the Human Monocyte-to-Macrophage Differentiation and Polarization: New Molecules and Patterns of Gene Expression. The Journal of Immunology. 177 (10), 7303 (2006).
- Chortarea, S., et al. Profibrotic activity of multi-walled carbon nanotubes upon prolonged exposures in different human lung cell types. Applied In Vitro Toxicology. 5 (1), (2019).
- Holt, P. G. Pulmonary Dendritic Cells in Local Immunity to Inert and Pathogenic Antigens in the Respiratory Tract. Proceedings of the American Thoracic Society. 2 (2), 116-120 (2005).
- Pinkerton, K. E., Gehr, P., Castañeda, A., Crapo, J. D., Parent, R. A. . Comparative Biology of the Normal Lung (Second Edition). , 105-117 (2015).
- Crapo, J., Barry, B., Gehr, P., Bachofen, M., Weibel, E. R. Cell number and cell characteristics of the normal human lung. American Review of Respiratory Disease. 126 (2), 332-337 (1982).
- Maniecki, M. B., Møller, H. J., Moestrup, S. K., Møller, B. K. CD163 positive subsets of blood dendritic cells: The scavenging macrophage receptors CD163 and CD91 are coexpressed on human dendritic cells and monocytes. Immunobiology. 211 (6), 407-417 (2006).
- Chignard, M., Balloy, V. Neutrophil recruitment and increased permeability during acute lung injury induced by lipopolysaccharide. American Journal of Physiology-Lung Cellular and Molecular Physiology. 279 (6), 1083-1090 (2000).
- Coyne, C. B., et al. Regulation of Airway Tight Junctions by Proinflammatory Cytokines. Molecular Biology of the Cell. 13 (9), 3218-3234 (2002).
- Durantie, E., et al. Biodistribution of single and aggregated gold nanoparticles exposed to the human lung epithelial tissue barrier at the air-liquid interface. Particle and Fibre Toxicology. 14 (49), (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved