Method Article
فك رموز الآثار الهيكلية لتفعيل الطفرات الجسدية EGFR مع محاكاة الديناميات الجزيئية
In This Article
Summary
والهدف من هذا البروتوكول هو استخدام محاكاة الديناميات الجزيئية لدراسة التغيرات الهيكلية الديناميكية التي تحدث نتيجة لتنشيط الطفرات من بروتين كيناز EGFR.
Abstract
وقد تم الإبلاغ عن العديد من الطفرات الجسدية التي تحدث في مستقبلات عامل النمو البشرة (EGFR) الأسرة (ErbB) من كينازات مستقبلات التيروزين (RTK) من مرضى السرطان، على الرغم من أن عدد قليل نسبيا قد تم اختبارها وتبين أن يسبب تغييرات وظيفية في ErbBs. يتم اضميم مستقبلات ErbB وتنشيطها على ملزمة ليغاند، والتغيرات التشكلية الديناميكية للمستقبلات هي متأصلة لاستقراء إشارات المصب. بالنسبة لطفرات اثنين أظهرت تجريبيا لتغيير الدالة EGFR، A702V و746ELREA750 الطفرة حذف، ونحن توضيح في البروتوكول التالي كيف الديناميات الجزيئية (MD) المحاكاة يمكن التحقيق في (1) الاستقرار التشكل من بنية كيناز تيروسين متحولة بالمقارنة مع البرية من نوع EGFR؛ (2) العواقب الهيكلية والتحولات التشكلية وعلاقتها بالتغيرات الوظيفية الملحوظة؛ (3) آثار الطفرات على قوة ATP ملزمة وكذلك للربط بين المجالات كيناز في خافتر غير المتماثلة المنشطة؛ و (4) آثار الطفرات على التفاعلات الرئيسية داخل موقع الربط EGFR المرتبطة الانزيم المنشط. ويوفر البروتوكول إجراء تفصيليا خطوة بخطوة، فضلا عن التوجيه الذي يمكن أن يكون أكثر فائدة عموما للتحقيق في هياكل البروتين باستخدام المحاكاة MD كوسيلة للتحقيق في الديناميات الهيكلية والعلاقة مع وظيفة البيولوجية.
Introduction
مستقبلات عامل نمو البشرة البشرية (EGFR) الأسرة (ErbB) من مستقبلات التيروزين كيناز (RTKs) ويشمل أربعة أعضاء - EGFR /ErbB1/HER1, ErbB2/HER2, ErbB3/HER3 وErbB4/HER4. مستقبلات ErbB تنظيم العمليات الخلوية الأساسية مثل نمو الخلايا والانتشار, التمايز, الهجرة والبقاء على قيد الحياة1,2, وبالتالي قوية بروتو-oncogenes. وقد ارتبط نشاط شاذ من مستقبلات ErbB، وخاصة EGFR و ErbB2، في كثير من الأحيان مع سرطانات الإنسان مما يجعل مستقبلات ErbB الأهداف الرئيسية لعلاجات السرطان2،3.
وقد تم الإبلاغ عن العديد من التعديلات الجسدية للجينات ERBB من الأورام الخبيثة البشرية3,4,5. أفضل الأمثلة المميزة تشمل المتكررة، وتفعيل الطفرات نقطة والحذف قصيرة في الإطار في مجال كيناز EGFR في سرطان الرئة غير صغير الخلية (NSCLC). هذه الطفرات EGFR تمثل الدوافع الرئيسية لنمو السرطان، والتنبؤ حساسية لEGFR استهداف أدوية السرطان6،7،8. ومع ذلك ، في معظم أنواع السرطان ، تحدث الطفرات الجسدية في EGFR خارج هذه "النقاط الساخنة" المتكررة ويتم توزيعها على مدى 1210 بقايا كاملة من المستقبلات. في الواقع، تم العثور على معظم المخلفات على طول التسلسل الرئيسي EGFR أن تحور في سرطان الإنسان9. ومع ذلك، وبصرف النظر عن النقاط الساخنة القليلة، لا تزال الأهمية الوظيفية للغالبية العظمى من الطفرات EGFR المرتبطة بالسرطان غير معروفة.
يتكون الهيكل الأحادي من ErbBs من مجال كبير من الهياكل الأمينية خارج الخلية ، يليه حلزون واحد عبر الmembrane يؤدي إلى مجال كيناز التيروزين داخل الخلايا ومنطقة ذيل C الطرفية التي تحتوي على مواقع الإرساء لبروتينات الإشارات داخل الخلايا. Ligand ملزمة يؤدي إلى تغيير جذري في التشكل في المجال خارج الخلية، مما يسهل تشكيل الخافتات مستقبلات من خلال فضح الأسلحة dimerization التي تتقاطع بشكل متناظر مع بعضها البعض والتفاعل مع الأسطح العطرية / رهاب الماء. بناء على مستقبلات تشكيل الخافتة مجالات التيروزين كيناز تأتي في اتصال غير متماثل (الشكل 1) ، مما أدى إلى تنشيط kinases التي phosphorylate ذيول C - المحطة الطرفية من مونومرات المستقبلات ، وبعد ذلك في تنشيط الإشارات المصب10،11.
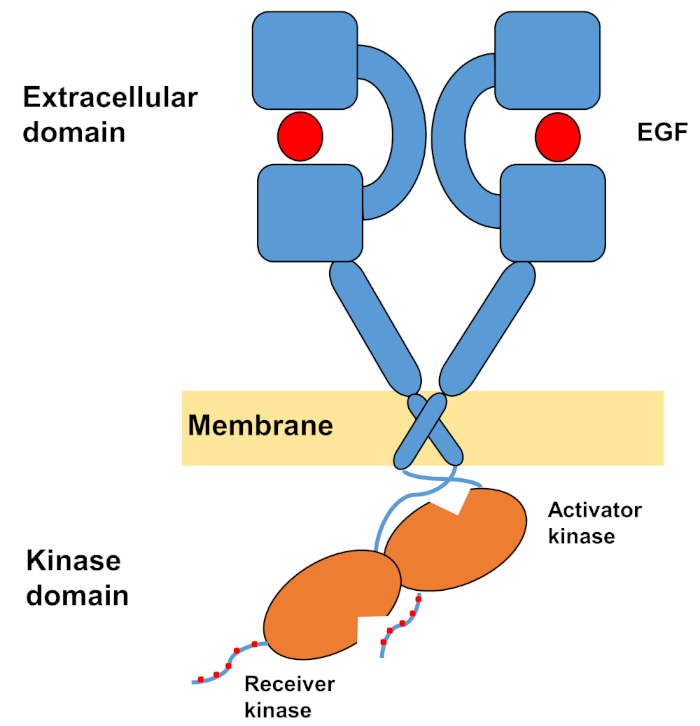
الشكل 1: هيكل خافر EGFR. EGFR يخف عندما المجالات خارج الخلية ربط عامل النمو (EGF، عامل نمو البشرة). ثم يتم تنشيط مجال كيناز المتلقي من خلال التفاعل غير المتماثل مع المجال kinase المنشط، وذيول C الطرفية هي autophosphorylated في بقايا التيروسين (معدلة من تاميرات وآخرون12). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
بسبب إعادة ترتيب الهيكلية الديناميكية التي تحدث خلال 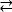 التحولات dimer مونومر، جنبا إلى جنب مع تنشيط كيناز التي ترتبط مع تشكيل خافض غير متماثل، يمكن أن الطفرات على طول كامل هيكل مستقبلات يحتمل أن يكون لها تأثير على وظيفة مستقبلات. هنا نحن وصف العديد من الأمثلة من دراساتنا السابقة التي النمذجة من الطفرة والتصور كانت كافية لشرح عواقب وظيفة.
التحولات dimer مونومر، جنبا إلى جنب مع تنشيط كيناز التي ترتبط مع تشكيل خافض غير متماثل، يمكن أن الطفرات على طول كامل هيكل مستقبلات يحتمل أن يكون لها تأثير على وظيفة مستقبلات. هنا نحن وصف العديد من الأمثلة من دراساتنا السابقة التي النمذجة من الطفرة والتصور كانت كافية لشرح عواقب وظيفة.
مثال 1: واحد ذكرت الطفرة، D595V في ErbB413، أدى إلى زيادة ErbB4 14 dimerization وفسفورية14. وكان التصور من موقع الطفرة عاملا حاسما في فهم الآثار الوظيفية الملاحظة: D595V وقعت في تقاطع متناظرة من الأسلحة dimeric من ectodomain (الشكل 2أ). الأسلحة هي إلى حد كبير العطرية ومهعور، واستبدال حمض الأسبارتيك القطبية من قبل فالين من المتوقع أن تزيد التفاعلات "لزجة" رهاب الماء، وتحقيق الاستقرار في الديم وبالتالي زيادة طول الوقت عندما يحدث الفوسفور14. كانت مفاجأة في البداية للعثور على الأسبارتات في كل ذراع ، ولكن في الماضي قد يفكر المرء في ذلك كآلية توقيت للنشاط ، حيث تقلل سلاسل جانبية الحمض القطبي من تقارب وعمر الظلم السليم وبالتالي الحد من الفوسفور بوساطة كيناز والإشارة. استبدال بالفالين ثم إزالة هذه الضمانة عن طريق مزيد من الاستقرار ErbB4 ديمر.
الشكل 2: موقع طفرة تنشيط ErbB4 والطفرات التي تنتج كيناز الميت ErbB4. (أ)D595 (تفعيل الطفرة D595V) يقع على الأسلحة ديميريك العطرية / المائية من نموذج ErbB4 ectodomain; السلاح ربط على نمو عامل ملزمة; (تظهر المخلفات القريبة على أنها عصي). (B) في ErbB4، G802 (تعطيل G802dup طفرة) يساعد على تشكيل جيب الربط حول حلقة عدنين من ATP والحافز D861 (تعطيل D861Y الطفرة) يربط كل من Mg2 + (غير مبين) ومجموعة γ الفوسفات من ATP. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
مثال 2: يمكن للمرء أن يتوقع أن الطفرات الجسدية التي تستهدف موقع ربط ATP للمجال كيناز من شأنه أن يغير أو يلغي النشاط الأنزيمي مما يؤدي إلى ضعف أو مستقبلات كيناز الميت غير قادرة على الإشارة. من تسع طفرات المبلغ عنها من المرضى الذين يعانون من الثدي, المعدة, القولون والمستقيم, أو NSCLC15,وكان اثنين من الطفرات التسع عند اختبارها تقلص كبير نشاط الفوسفور16: G802dup (G → GG) وD861Y. تم العثور على كل من الطفرات الجسدية المعطلة داخل موقع ربط ATP لهيكل نطاق التيروزين كيناز (الشكل 2B):2 2 B : 2 252 مرنة ، مكررة ، من شأنها أن تغير موقع حلقة عدنين وحمض الأسبارتيك الصغيرة التي تم استبدالها التيروزين الضخمة بالقرب من الفوسفات الطرفي سيمنع فعلياً Mg2 +- ATP من الربط. ومع ذلك، منذ ErbB4 يمكن أن تشكل heterodimer مع ErbB2 -- ErbB2 لا يربط عامل النمو ويعتمد على اقتران مع ErbB الذي يفعل من أجل heterodimerize -- ErbB2 (نشط) -ErbB4 (kinase-dead) من شأنه أن يحفز انتشار الخلايا عبر مسار إشارة Erk/Akt بعد الخلايا لن تفرق بسبب kinase-dead ErbB4 وعدم وجود STAT5 تفعيل المسار16.
في دراسات أحدث، أصبح من الواضح أن الحركات الديناميكية لـ ErbBs كانت ذات صلة بفهم تأثيرات بعض المسوخ على وظيفة ErbB، وخاصة الطفرات التي تحدث داخل نطاق التيروزين كيناز. يتألف نطاق التيروزين كيناز من فص N (أساسا β- أوراق) و C-الفص (إلى حد كبير ألفا الهليلية)، والتي تفصلها الموقع الحفاز حيث يربط ATP. يتضمن الفص N-17 و P-loop الحلزوني αC، في حين أن التنشيط (A-loop) والحلقات الحفازة موجودة في الفصC-17و18و19. كشفت الهياكل الكريستالية من المجال كيناز التيروزين اثنين من التشكلات غير النشطة، وغالبية الهياكل لديها الدولة غير نشط SRC مثل. في التشكل النشط ، يتم توجيه التشكل الحفاز لنقاط A-loop نحو موقع ربط ATP واللولب αC نحو جيب ربط ATP ("αC-in" التشكل) ، مما يشكل تفاعلًا قويًا للغلوتامات - الlysine ion-pair.
ولأن ErbBs ومجال كيناز المكون هما كيانان شديدي الدينامية، وخاصة في الحالات التي يرجح أن تكون آثار الطفرات على الوظيفة والنشاط البيولوجي مرتبطة ارتباطاً وثيقاً بالولايات التشكية للـ ErbBs، فمن المهم تقييم الطفرات فيما يتعلق بنطاق التغيرات الديناميكية التي قد تواجهها. توفر الهياكل البلورية بالأشعة السينية لـ ErbBs لقطات ثابتة للهيكل ثلاثي الأبعاد، والتي قد تكون أو لا تكون ذات صلة بفهم العواقب الديناميكية للطفرة. من أجل التحقيق في مجموعة من التغيرات الديناميكية المقابلة ل "المشهد الطاقة" المتاحة لهيكل ثلاثي الأبعاد (3D) ، وتستخدم على نطاق واسع ديناميات الجزيئية (MD) المحاكاة20. في حالة الطفرات التي من شأنها أن تؤدي إلى تغييرات التشكل المحلية داخل مجال كيناز التيروزين أو تثبيت مجمع، قد تكون المحاكاة على ترتيب 100 ن س كافية. ومع ذلك ، فإن التغيرات التكونية على نطاق أوسع (على سبيل المثال ، الانتقالات بين التشكلات النشطة وغير النشطة لمجال كيناز) تتطلب وقت محاكاة أطول - حسب ترتيب ميكروثانية21.
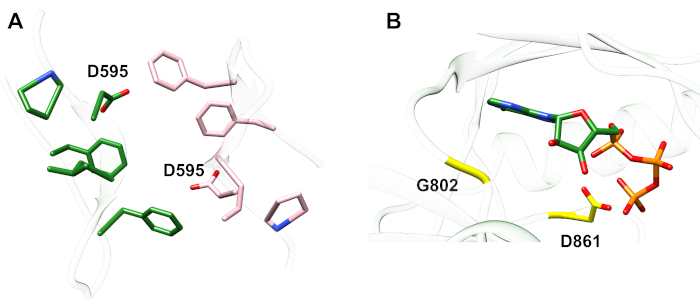
فيما يتعلق بالبروتوكول الموضح أدناه، فإننا ننظر في حدوث طفرات تنشيطية ضمن نطاق التيروزين كيناز(الشكل 3). وتقع كل من الطفرات داخل نطاق كيناز في المواقع التي تشهد تغيرات التشكل المحلية التي تملي ما إذا كان كيناز نشطة أم لا، وبالتالي تم تطبيق المحاكاة MD في كلتا الحالتين. في الحالة الأولى ، ونحن ننظر في التغييرات التي تؤثر بشكل مباشر على موقع ربط ATP والآلات الحفازة من نطاق كيناز المتلقي EGFR ، على وجه التحديد دراسة عواقب الطفرة حذف exon 19 التي تورطت على نطاق واسع في NSCLC4،7. طفرة Δ746ELREA750، مما يقلل من طول حلقة β3-αC التي تسبق الحلزون αC - الحلزون الذي يتحرك نحو الموقع الملزم / النشط على تنشيط كيناز ويشارك في تشكيل التفاعل الكهروستاتيكي الحرج بين E762 من الحلزون وK745 عن طريق وضع الليسين للتفاعل مع ATP - يهيئ المجال للتنشيط12. في الحالة الثانية، ونحن نعتبر طفرة A702V من EGFR، أظهرت أن رواية اكتساب من وظيفة تفعيل طفرة كشفت عن منصة iScream9 والتي تم تحديدها في المريض NSCLC22. Alanine-702 على مجال كيناز المتلقي يقع على juxtamembrane الجزء B في واجهة المتلقي والمجالات kinase المنشط ، التي لا تتناظر في هذا kinase dimer والتغيرات التشكلية كيناز مطلوبة لتفعيل9.
الشكل 3: خافة نطاق كيناز غير المتماثلة من EGFR. وسوف تكون هناك طفرة A702V في واجهة حاسمة من مجالات كيناز المنشط والمتلقي، المتاخمة للهلواز αC وعلى مقربة من isoleucine 941 من كيناز المنشط. التغيرات التكتّنية الناجمة عن تشكيل الخافت غير المتماثل يؤدي إلى تنشيط كيناز. وتسبق حلقة β3-αC التي تحتوي على تسلسل ELREA الحلزوني αC مباشرةً؛ أثناء التنشيط، يتحرك الحلزون αC إلى الداخل نحو موقع ربط ATP. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
ملاحظة: تتم مناقشة الخطوات التفصيلية التي تم اتخاذها لدراسة تأثيرات ΔELREA و A702V الطفرة على هيكل EGFR باستخدام المحاكاة MD كما يلي:
1. إعداد الهيكل
ملاحظة: من أجل دراسة الآثار الهيكلية لطفرة ΔELREA، أشكال من نوع البرية ومتحولة من apo النشطة، ATP ملزمة النشطة وapo غير نشط EGFR هياكل مونومر يتم إعداد على النحو التالي.
- فتح برنامج التصور Chimera23 (https://www.cgl.ucsf.edu/chimera/) لإعداد البرية من نوع APO نشط EGFR كيناز الهيكل. في القائمة ملف انقر فوق الخيار إحضار بواسطة معرف وحدد بنك بيانات البروتين (PDB24) قاعدة البيانات وحدد رمز PDB 2GS225 (2.8 Å القرار). وPDB هو مستودع للهياكل ثلاثية الأبعاد التي تحل بواسطة تقنيات تجريبية مختلفة، بما في ذلك التصوير البلوري بالأشعة السينية، والتحليل الطيفي بالرنين المغناطيسي النووي، والمجهر الإلكترونات المبردة والانعراج النيوتروني.
- بناء العناصر الهيكلية المفقودة من 2GS2 عن طريق اتخاذ هذه القطاعات من هياكل EGFR PDB 1M1426 (2.6 Å) و 3W2S27 (1.9 Å). للقيام بذلك، افتح 1M14 و 3W2S ثم فرضها على 2GS2 باستخدام خيار MatchMaker في قائمة المقارنة بينة → الأدوات.
- احصد الأجزاء التي سيتم إضافتها من 1M14 و 3W2S. حدد الذرات الطرفية للبقايا قبل الثغرات في 2GS2 والذرات التي ستضاف من 1M14 و 3W2S (للحصول على معلومات مفصلة عن الأجزاء المضافة، انظر الجدول 1). على سطر الأوامر نوع السندات sel وضرب أدخل. هذه البنية هي بنية القالب.
- استخدم بنية القالب من الخطوة 1.2 لإنشاء نموذج 000 000 000 000 متحولة حذف المجال kinase EGFR. إنتاج تسلسل تنسيق FASTA من EGFR ΔELREA عن طريق حفظ تسلسل هيكل القالب(المفضلة → تسلسل → ملف → حفظ باسم) ثم حذف تسلسل ELREA في بقايا أرقام 746-750.
- افتح تسلسل ΔELREA EGFR في كيميرا ومحاذاته مع تسلسل هيكل قالب 2GS2 باستخدام قائمة التسلسل. في إطار المحاذاة حدد خيار بنية → Modeller (علم homology)28.
- على الإطار المنبثقة تحديد بنية 2GS2 مركب كقالب وتسلسل متحولة كما الاستعلام إلى أن يكون على غرار. ثم اضغط موافق. حدد نموذج متحول بين النماذج الناتجة، استناداً إلى نقاط zDOPE (عادةً أدنى الدرجات) والفحص البصري.
- لإعداد الهيكل كيناز من نوع EGFR البرية من نوع ATP، استخدم بنية PDB2ITX 29 (2.98 Å) كهيكل رئيسي. بناء الأجزاء المفقودة (راجع الجدول 1) باستخدام الهياكل 2GS625 (2.6 Å) و 3W2S التالية الإجراء في الخطوة 1.2. تحويل ANP ligand في الهيكل الناتج إلى ATP عن طريق فتح ملف PDB في محرر النص وتغيير ذرة النيتروجين N3B من ANP إلى ذرة الأكسجين.
- فتح البنية في الخطوة 1.4 في Chimera كما هو مذكور في الخطوة 1.1. إضافة أيون المغنيسيوم إلى هذا الهيكل من هيكل PDB2ITN 29 (2.47 Å) من أجل تحقيق وضع مماثل لمجم2 + أيون.
- مع الهيكل الناتج عن الخطوة 1.5، نموذج نموذج متحولة ΔELREA بعد الخطوة 1.3.
| Apo EGFR النشطة | Apo غير نشط EGFR | EGFR النشطة المنضمة إلى ATP | |
| الهيكل الرئيسي | 2GS2 | 2GS7 | 2ITX |
| الهياكل المستخدمة لبناء الحلقات المفقودة | 1M14 (723-725) | 3W2S (958-984) | 2GS6 (862-865) |
| 3W2S (967-981) | 4HJO (848-850) | 3W2S (990-1001) |
الجدول 1: الهياكل المستخدمة في بناء نماذج مركبة من هياكل نشطة من نوع apo، أو غير نشطة، أو هياكل نشطة منضمة إلى ATP. تم بناء المناطق المفقودة (مجموعة الأحماض الأمينية بين قوسين) في الهيكل الرئيسي من الهياكل المذكورة.
- لإعداد بنية اpo غير النشطة EGFR kinase، فتح بنية PDB 2GS725 (2.6 Å) كما هو الحال في الخطوة 1.1 وحذف رابطة ملزمة والمياه البلورية. إضافة الأجزاء المفقودة في 2GS7 (راجع الجدول 1) من الهياكل 3W2S و 4HJO30 (2.75 Å) باستخدام الإجراء في الخطوة 1.2. بناء على هيكل EGFR غير نشط النهائي، إعداد نموذج متحولة باستخدام الإجراء في الخطوة 1.3.
ملاحظة: بالنسبة لدراسة الطفرة A702V، تتم دراسة بنية الخافتة غير المتماثلة EGFR كما يقع الطفرة في الجزء juxtamembrane B من مجال كيناز الذي يشكل جزءا كبيرا من واجهة الخافتة. يتم إعداد هياكل EGFR المتحولة من النوع البري و A702V على النحو التالي: - تم بناء هيكل الخافتة من نوع البرية من بنية PDB 2GS2، والتي يتم عرضها في البداية في شكل أحادية اللون. للتحويل إلى التجميع البيولوجي الذي يحتوي على kinases المنشط والمتلقي في الترتيب غير المتماثلة، افتح 2GS2 في Chimera كما في (1.1) وإجراء حسابات التماثل عن طريق النقر فوق الأدوات → بنية أعلى ترتيب → قائمة خلية الوحدة. حدد بنية 2GS2 وأدخل إنشاء نسخ. وأخيراً، حدد وحفظ خافس واحد غير متماثل من نسخ متعددة من الخافت الناتجة عن عمليات التماثل.
- باستخدام بنية EGFR غير المتماثلة من النوع البري من الخطوة 1.8 ، قم ببناء متحولة A702V عن طريق استبدال alanine 702 مع valine باستخدام أدوات → تحرير الهيكل → Rotamers الخيار في كيميرا.
ملاحظة: يتم إعداد ستة أحادية اللون واثنين من هياكل ديومير لـ ΔELREA و A702V على التوالي. تتم معالجة كل هيكل في وقت لاحق لمحاكاة باستخدام معالج إعداد البروتين في برنامجمايسترو 31 ويتم إجراء المحاكاة MD مع برنامج العنبر32. - فتح البنية في Maestro باستخدام خيار بنية استيراد → ملف. ثم انقر على زر معالج إعداد البروتين وحدد ما يلي: إضافة ذرات الهيدروجين، وبناء ذرات سلسلة جانبية مفقودة، وتحديد حالات البروتون من المخلفات المؤينة في 7.0 درجة الهيدروجين باستخدام بروبكا، وتحسين التوجه من الهليون، الجلوتامين وبقايا الهستيدين للارتباط الهيدروجين، وأخيرا تقليل الهيكل.
2. إعداد النظام
- افتح برنامج القفزة المضمنة في حزمة البرامج Amber. استيراد ff14SB قوة الحقل33 (مصدر leaprc.protein.ff14SB) وجزيئات المياه TIP3P34 (مصدر leaprc.water.tip3p). لأنظمة ATP-ملزمة أيضا استيراد المعلمات ل ATP35 (loadamberparams frcmod.phosphate، loadamberprep ATP.prep). ثم، تحميل الهيكل (mol = loadpdb structure.pdb).
- تحل الهيكل في مربع ثماني مع جزيئات الماء TIP3P صريحة التي تمتد 10 Å في جميع الاتجاهات من ذرات السطح من البروتين(solvateoct مول TIP3PBOX 10.0).
- تحقق من نظام البناء (فحص مول) وتحييدها عن طريق إضافة الأيونات اللازمة (addions mol Na + 0). ل MODEL بشكل كاف نظم الجزيئات الحيوية، إضافة إضافية نا+/ Cl- ذرات إلى مربع محاكاة لتحقيق تركيز الملح النظام إلى 0.15 M(addions mol Na + X، addions مول Cl-X)،حيث يتم استبدال X نتيجة: التركيز الملح المطلوب * عدد جزيئات الماء * حجم لكل جزيء الماء * عدد Avogadro.
- توليد وحفظ الطبولوجيا وتنسيق الملفات للنظام، والتي هي بمثابة مدخلات لمحاكاة الإنتاج اللاحقة (saveamberparm mol X.prmtop X.inpcrd).
3. محاكاة الديناميات الجزيئية
- باستخدام العنبر، تخضع في البداية نظام المحاكاة لدورة 5000 من انحدار حاد وأدنى مستويات الطاقة المتدرجة إلى أدنى حد للتحايل على التكوينات غير المواتية. تنفيذ التقليل في خطوات متعددة، وخفض تدريجيا ضبط النفس المطبق على ذرات مذاب من 25 كالوريمول -1 Å-2 إلى 0 كالوري مول-1 Å-2.
- في ملف الإدخال التخريب، min.in، اضبط متغير maxcyc لدورة التخريب الكلية (maxcyc = 5000) و ncyc لتحديد عدد الدورات لخوارزمية الهبوط الحادة. استخدام متغير restraint_wt لتطبيق قوة ضبط النفس على ذرات المذابة التي تحددها المعلمة restraintmask. ثم قم بتشغيل التصغير كما يلي:
$AMBERHOME/bin/sander -O-i min.in -o min.out-p X.prmtop-c X.inpcrd-r min.rst -ref X.inpcrd
ملاحظة: قد تختلف المعلمات الاستراتيجية الفعلية المستخدمة وفقًا لتفضيلات الشخص. ويمكن الاطلاع على التفاصيل والتوجيه من دليل العنبر وموقع الويب (https://ambermd.org/index.php)
- في ملف الإدخال التخريب، min.in، اضبط متغير maxcyc لدورة التخريب الكلية (maxcyc = 5000) و ncyc لتحديد عدد الدورات لخوارزمية الهبوط الحادة. استخدام متغير restraint_wt لتطبيق قوة ضبط النفس على ذرات المذابة التي تحددها المعلمة restraintmask. ثم قم بتشغيل التصغير كما يلي:
- سخني النظام لـ 100 ps من 0 K إلى 300 K وضع 10 كيلو كالوري مول-1 Å-2 ضبط النفس على ذرات المذاب. للقيام بذلك، تعيين tempi = 0.0، temp0 = 300.0، dt = 0.002 ps، nstlim = 50000 و restraint_wt = 10 في ملف الإدخال heat.in. تنفيذ التدفئة مع الأمر التالي:
$AMBERHOME / بن / ساندر - O -i heat.in -o heat.out -p X.prmtop -c min.rst -r heat.rst -x heat.mdcrd -ref min.rst - ( 1) توازن النظام لـ 900 ps في إطار مجموعة من مجموعات معاهدة عدم الانتشار؛ عدد ثابت من الذرات، ودرجة الحرارة (temp0 = 300.0) والضغط (ntp = 1)، السيطرة عليه مع طريقة بيرندسن (ntt = 1). تعيين 9 Å قطع المسافة (قطع = 9.0) للتفاعلات الكهربائية الساكنة طويلة المدى. خفض تدريجيا ضبط النفس ذرة المذاب إلى 0.1 كالوريمول -1 Å-2 (restraint_wt = 0.1). تشغيل ملف إدخال الإكواز equil.in الذي يصف المعلمات أعلاه كما يلي:
$AMBERHOME/bin/sander-O-i-i equil.in -o equil.out -p X.prmtop-c heat.rst-r equil.rst -x equil.mdcrd -ref heat.rst - الانتهاء من التوازن مع محاكاة 5 ns غير المقيدة (مجموعة dt = 0.002 ps، ntslim = 2500000).
$AMBERHOME/bin/sander-O-i equil_final.in -o equil_final.out -p X.prmtop-c equil.rst-r equil_final.rst-x equil_final.mdcrd -ref equil.rst - تأكد من أن النظام قد توازن من خلال دراسة قيم درجة الحرارة والضغط والكثافة والطاقة.
$AMBERHOME/bin/process_mdout.perl heat.out equil.out equil_final.out
xmgrace ملخص. درجة الحرارة/ الكثافة/ETOT/EPTOT/EKTOT - تنفيذ محاكاة الإنتاج ل100 نس (مجموعة dt = 0.002 ps، ntslim = 500000000 في prod.in)وحفظ التشكلات كل 10 ps (ntwx = 50000).
$AMBERHOME/bin/sander-O-i-i prod.in -o prod.out -p X.prmtop-c equil_final.rst-r prod.rst-x prod.mdrcd -ref equil_final.rst
4- التحليل
- الفحص البصري
- تصور التشكلات عينات خلال محاكاة الأنواع البرية و متحولة EGFR كيناز عن طريق فتح ملفات طبولوجيا العنبر X.prmtop والملفات المسار prod.mdcrd المقابلة في VMD36. باستخدام تمثيلات بنية ثانوية مريحة، وتحليل الديناميات الهيكلية الشاملة للبروتينات من المسار المسجل. عرض تفاعلات محددة بين الذرات / المخلفات ذات الاهتمام، مثل جسر الملح K745 - E762 الأساسي بشكل حفّاز.
- بدلا من ذلك، حفظ التشكلات متعددة عينات خلال محاكاة في شكل PDB وفتحها باستخدام برنامج الكيميرا. فرض الهياكل على البنية الأولية أو الوسيطة باستخدام خيار MatchMaker. عرض البنية الأولية/الوسيطة في صلب وبقية الهياكل المحاذية باللون الأبيض الباهت. ويسمح هذا النهج للمرء أن يتصور الحركات الهيكلية المسجلة بمزيد من الوضوح.
ملاحظة: يمكن العثور على اقتراحات للتمثيل الفعال وتجهيز الفرق التكتيفية من MDS في ملفين وآخرون37.
- تحليل RMSD و RMSF
- حساب الانحراف التربيعي لجذور الوسط (RMSD) وتقلبات الجذر -المتوسط المربع (RMSF) مع برنامج Cpptraj 38 لتحليل الاستقرار العالمي للبروتينات ودراسة مرونة الوحدات الهيكلية المختلفة. في rmsd.in وملفات الإدخال rmsf.in، تشير إلى ذرات العمود الفقري (لRMSD) و Cα (لRMSF) من الهيكل الأولي كمرجع لتركيب RMS. في rmsd/rmsf.in الملفات استيراد ملفات طبولوجيا العنبر (parm X.promtop) والملفات المسار المقابلة (trajin prod.mdcrd). ثم قم بتشغيل الأمر Cpptraj -i rmsd/rmsf.in. رسم بيانات الإخراج للتحليل.
- وبدلاً من ذلك، قم بمحاذاة مجموعات التشكلات اللونية اللون لكل بقايا استناداً إلى ذرة Cα RMSD. للقيام بذلك، افتح التشكلات في Chimera ومحاذاتها مع خيار الخاطبة.
- انتقل إلى أدوات → تصوير → العرض حسب السمة. حدد بقايا المجموعة التكتّنية وCα RMSD كخصائص وانقر فوق موافق. ثم سيتم تلوين أثر سلسلة من التشكلات من الأزرق → الأبيض → الأحمر، على التوالي تعكس مناطق الاستقرار الهيكلي عالية ومتوسطة ومنخفضة.
- تحليل سندات الهيدروجين
- تحليل التفاعل السندات الهيدروجين بين ATP والبرية من نوع / ΔELREA EGFRs. إعداد برنامج نصي Cpptraj، hbond.in، لتنفيذ هذه المهمة. تعريف رابطة الهيدروجين مع مسافة المانح- قبول أقل من أو يساوي 3.5 Å وزاوية السندات أكبر من أو يساوي 135°. حدد التحليل فقط للسندات الهيدروجين بين الجزيئات مع متغير nointramol أي السندات الهيدروجين بين ATP وEGFR(hbond All nointramol dist 3.5 خارج nhb.agr avgout avghb.dat). تشغيل البرنامج النصي كما Cpptraj -i hbond.in.
- استخدم هذا السيناريو لتقييم التفاعلات داخل الجزيئات، على سبيل المثال بين المخلفات K745 و E762، والتي تعتبر بقايا رئيسية لنشاط غويناز EGFR. للقيام بذلك، حدد K745 باعتباره مانح سندات الهيدروجين وE762 كمقبل السندات الهيدروجين في hbond.in وتشغيل السيناريو وفقا لذلك.
- رصد المسافة بين الذرات
- قياس المسافة بين K745 و E762 من خلال فتح مسارات من نوع البرية و ΔELREA apo EGFRs في VMD. حدد Cδ من Glu762 ونيوزيلندا من Lys745 عن طريق النقر على تسمية → الماوس → السندات. مراقبة المسافة أثناء المحاكاة عن طريق رسم رسم بياني مع تسميات → الرسومات → السندات → الرسم البياني.
- حسابات الطاقة الحرة
- لحساب الطاقات الحرة الربط المقدر بين ATP والبرية من نوع / ΔELREREA EGFRs، وبين kinases المنشط والمتلقي من البرية من نوع / A702V EGFRs، واستخدام الميكانيكا الجزيئية تعميم مساحة سطح المولد (MM-GBSA) وحدة39 المتاحة في حزمة AMBER. تعيين ATP كما ligand وEGFR كما مستقبلات في دراسة ΔELREA. في دراسة A702V، حدد كيناز المتلقي كالليغاند وكيناز المنشط كمستقبل.
- أولا إعداد ligand، مستقبلات و ligand مستقبلات الملفات PDB معقدة بشكل منفصل في برنامج قفزة وضع قيمة PBRadii لmbondi2. لملفات PDB حفظ طبولوجيا الكهرمان مرحلة الغاز (.prmtop) وتنسيق (.inpcrd) الملفات.
- ثم، في ملف الإدخال mmgbsa، mmgbsa.in، تعيين igb = 2، saltcon = 0.1. تنفيذ حسابات الطاقة الملزمة باستخدام مسارات المحاكاة، والملفات الكهرمانية مستقبلات / يغاند أعدت والمعلمات في mmgbsa.in مع MMPBSA.py النصي المتاحة في العنبر على النحو التالي:
$AMBERHOME/bin/mMPBSA.py -O-i mmgbsa.in -o mmgbsa.dat -sp X.prmtop-cp complex.prmtop-rp receptor.prmtop-lp ligand.prmtop-y prod.mdcrd-eo output.csv - تحليل بيانات الإخراج، output.csv،عن طريق رسم الرسوم البيانية.
النتائج
تم استخدام البروتوكول الموصوف لدراسة الآثار الهيكلية لطفرات ΔELREA و A702V على بنية KINASE EGFR. وكان أحد تطبيقات البروتوكول هو التحقيق في أثر الطفرات على الاستقرار الهيكلي/التكتكيني المحلي عن طريق حساب قيم RMSD وRMSF من محاكاة MD. وبما أن الطفرة A702V تقع في الجزء juxtamemمبران B، فإن نظام RMSD لهذا الجزء من كيناز المتلقي بالنسبة لبنية البداية تم حسابه لكل من الأنواع البرية وEGFRs A702V. وكشفت النتيجة (الشكل 4أ)أن الجزء juxtramembrane B من متحولة قد زادت الاستقرار التشكل خلال محاكاة 100 ن س (متوسط RMSD 0.7 Å - 9 فاصل ثقة (CI) 0.009 مقارنةً بمجال كيناز EGFR من النوع البري (متوسط RMSD 1.1 Å - 95% CI 0.01). هذا هو على الأرجح نتيجة للتفاعلات hydrophobic أكثر إحكاما في واجهة الديم بسبب استبدال ألانين 702 (سلسلة جانبية مجموعة الميثيل) إلى بقايا أكبر رهاب الماء، فالين (سلسلة جانبية مجموعة isopropyl)، مما يؤدي إلى زيادة التفاعلات hydrophobic من V702 على نطاق كيناز المتلقي مع إيسولوسين 941 من المجال المنشط كيناز.
تقع طفرة ΔELREA في حلقة β3-αC، بجوار الحلزون αC الحرج وظيفياً؛ إن التشكل الحلزوني αC هو المفتاح للتحولات بين الدول النشطة وغير النشطة من كيناز EGFR. تم تقييم الاستقرار التشكلي لللولب αC في الحالة النشطة من خلال فحص RMSF على ذرات Cα من المخلفات داخل الحلزون أثناء محاكاة MD (الشكل 4B):بشكل عام ، هناك تقلبات أقل في المتحول (متوسط RMSF 1.1 Å - 95٪ CI 0.4) بالمقارنة مع النوع البري (متوسط RMSF 1.5 Å - 95٪ CI 0.57)؛ مع أعلى فرق في التقلبات المسجلة لمخلفات محطة N. التشكلات العينة على التوالي superposed على هيكل متوسط من المجال كيناز من نوع البرية والمجال كيناز ΔELREA دعم أيضا هذه النتائج(الشكل 4ج):كل من من نوع البرية والمجالات كيناسي ΔELREA لها استقرار مماثل عموما للتشكلات فائقة باستثناء حلقة β3-αC و αC he التي هي بوضوح أكثر استقرارا في EGFR ΔELREA. وتشير هذه النتائج إلى أن حذف تسلسل ELREA يقيد حركة الحلزون αC الدولة النشطة، وبالتالي تقييد وبالتالي تثبيت التشكل النشط. وعلاوة على ذلك، بما أن الحلزون αC يشكل جزءًا من واجهة الخافتة غير المتماثلة، فإن القيود على الحلزون αC في المتحولة من المرجح جدًا أن تعمل على تثبيت الخافق غير المتماثل، مما يطيل مدة الحالة المنشطة.
تطبيق آخر للبروتوكول هو التحقيق في سلوك التفاعلات الرئيسية داخل وداخل الجزيئات التي تحدث أثناء المحاكاة. وهكذا ، فإن التفاعل بين K745 و E762 ، وهو أمر أساسي للنشاط الأنزيمي EGFR ، تم تحليل كل من الشكل النشط من النوع البري و ΔELREA EGFR kinase من خلال قياس نسبة شغل السندات الهيدروجينية التي تشكلت بين الذرات القطبية من السلسلة الجانبية للمخلفات اثنين خلال المحاكاة MD(الشكل 5A):تم تشكيل هذا التفاعل الكهربائي الرئيسي في كثير من الأحيان في مجال كيناز ΔELREA بالمقارنة مع مجال كيناز من النوع البري ، بسبب الحلزون الأكثر استقرارًا الذي يستوعب E762. تم تقييم التفاعلات بين Mg2+- ATP والمجالات من نوع البرية و ΔELREA EGFR kinase(الشكل 5B)خلال المحاكاة(الشكل 5C):كان عدد روابط الهيدروجين أكبر بالنسبة لـ 1 3 - 300-2003 (متوسط القيمة 4.0 - 95 في المائة CI 0.03) مقارنة بـ EGFR من النوع البري (متوسط القيمة 3.2 - 95 في المائة CI 0.04). وكشف المزيد من التحليل للسندات الهيدروجين أن K745 يتفاعل بشكل أكثر تواترا مع مجموعات الفوسفات من ATP في ΔELREA EGFR، الذي يرتبط التفاعل K745-E762 أكثر استقرارا لاحظت في محاكاة المجال ΔELREA متحولة EGFR kinase.
إن محاكاة MD كما هو موضح في البروتوكول مفيدة أيضاً في تقييم الطاقة الحرة النسبية للربط لتفاعلات البروتين البروتين والبروتين ligand. الطاقات الملزمة بين مجالات كيناز المنشط والمتلقي من الأنواع البرية وEGFRs A702V ، وبين ATP والمجالات من النوع البري و ΔELREA متحولة EGFR kinase ، تم حسابها من الميكانيكا الجزيئية المعممة الحسابات مساحة سطح المولد (MMGBSA)(الشكل 6A):أنتجت متحولة A702V انخفاض متوسط قيمةالربط ΔG (متوسطربط ΔG = -76 كالوري / مول - 00 CI 0.47% تمثل تفاعلات أكثر ملاءمة، على النقيض من نطاق EGFR من النوع البري (متوسطربط ΔG = -61 سعرة حرارية/مول - 95% CI 0.61). هذه الملاحظة متسقة مع الجزء juxtamembrane B أكثر استقرارا وأكثر إحكاما واجهة خافت بسبب زيادة التفاعلات المائية لوحظت لـ A702V EGFR كيناز المجال. في حالة ربط ATP إلى المجالات البرية من نوع و ΔELREA EGFR kinase(الشكل 6B)، الحسابات MMGBSA التنبؤ أقوى ربط ATP مع متحولة ΔELREA (متوسطربط ΔG -57 سعرة حرارية/مول - 95% CI 0.43) بالمقارنة مع 0.33 من نوع البرية (متوسطربط ΔG -48 كيلو كالوري/مول - 95% CI 0.33). وتتماشى هذه النتيجة مع العدد الأكبر من روابط الهيدروجين المسجلة بين ATP و ΔELREA EGFR(الشكل 5C)بالمقارنة مع المجال البري من النوع.
ويمكن استخدام البروتوكول أيضاً لدراسة التغيرات التكهنية التي لوحظت أثناء المحاكاة. في الدراسة الحالية، تمت دراسة آثار طفرة ΔELREA على التشكل غير النشط EGFR عن طريق الفحص البصري وتراكب التشكلات العينات من المحاكاة. وكشف التحليل عن حركة داخلية للزلاز αC في مجال ΔELREA EGFR kinase (الشكل 7A)، وهو تغيير هيكلي متوقع أثناء الانتقال إلى الحالة النشطة. وعلى النقيض من ذلك، حافظ الحلزون αC من نوع البرية غير النشط EGFR على التشكل الأولي(الشكل 7B). وهكذا، فإن المحاكاة MD دعم الاقتراح بأن الطفرة الحذف، أظهرت تجريبيا لزيادة النشاط كيناز40،41، يعزز التحول التشكلي من كيناز غير نشط نحو الدولة النشطة.
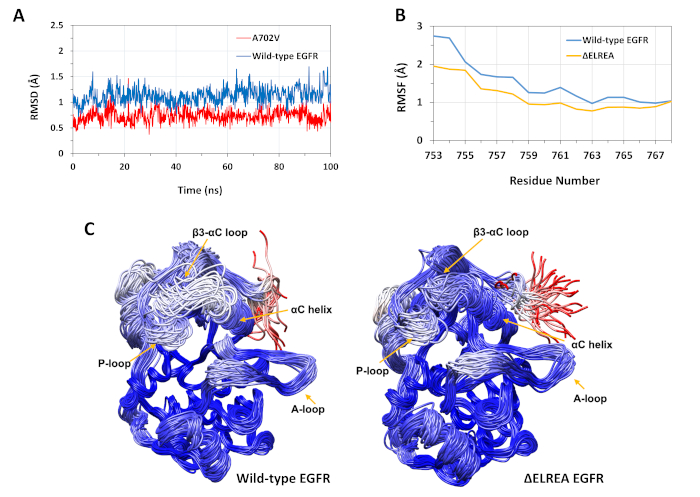
الشكل 4: استقرار التشكل من النوع البري والمتحول في نطاق KINASe EGFR النشط أثناء محاكاة MD. (A) RMSD (الذرات العمود الفقري) على الجزء juxtamembrane B من نوع البرية (الأزرق) وA702V (الأحمر) المتلقي كيناز المجال. (B) RMSF (ذرات Cα) على بقايا الحلزون αC: من النوع البري (الأزرق) و ΔELREA (الذهب). (C) superposed عينات التشكلات من نوع البرية (يسار) و ΔELREA (يمين) EGFR كيناز المجال ؛ سلسلة آثار ملونة على أساس RMSD (Cα الذرات) من كل بقايا فيما يتعلق هيكل الوسيط. لون يتراوح من الأزرق إلى الأبيض إلى الأحمر، تمثل مناطق عالية إلى منخفضة الاستقرار التشكل. لاحظ أن المناطق "الحرة" ن الطرفية من مجال كيناز معزولة، والأحمر الملون، لن يحمل هذا المستوى من التنقل في هيكل EGFR سليمة. الأرقام المقتبسة من Chakroborty et al.9 (الشكل 4A المستنسخة بإذن من مجلة الكيمياء البيولوجية)وTamirat et al.12. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
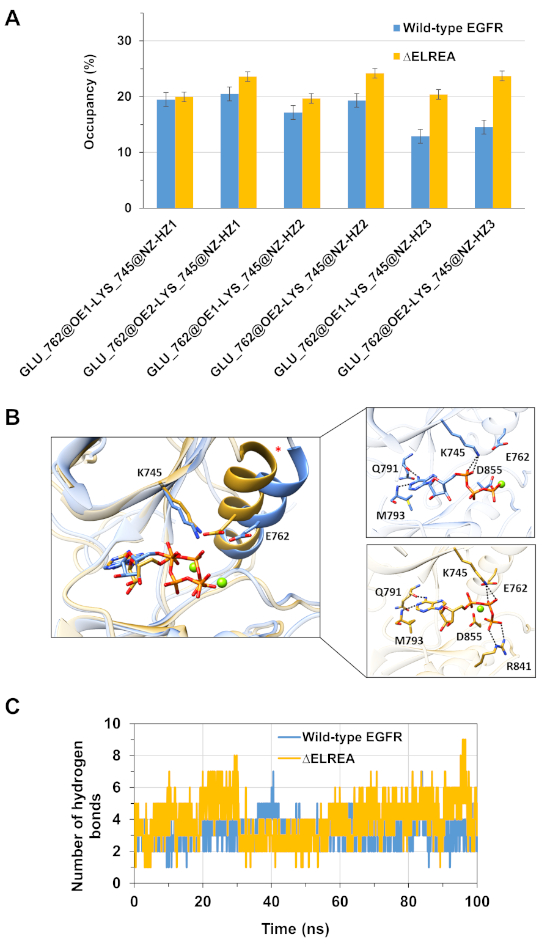
الشكل 5: الميزات الرئيسية التي شوهدت في كيناز المتلقي النشط أثناء محاكاة MD: جسر الملح K745-E762، الحلزون αC والتفاعلات مع ATP. (أ)النسبة المئوية لشغل التفاعل K745-E762 أثناء محاكاة المجالات البرية (الأزرق) و ΔELREA (الذهب) EGFR kinase. (ب) بقايا من نوع البرية و ΔELREA متحولة التفاعل مع ATP (العصي). إحداثيات Mg2+ (الأخضر) مع ATP و D855. (C) عدد الروابط الهيدروجينية التي شكلتها ATP مع كل من أنواع البرية والمجالات ΔELREA EGFR كيناز خلال المحاكاة MD. الرقم من تاميرات وآخرون12. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
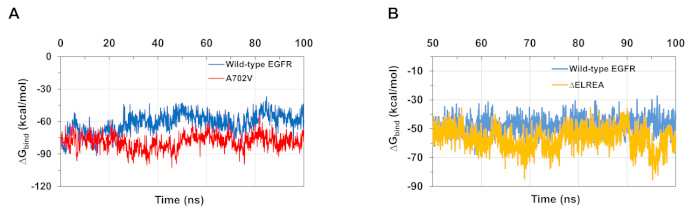
الشكل 6: يتم ملاحظة الطاقات الحرة النسبية الدنيا للربط في نطاقات كيناز المتحولة أثناء عمليات المحاكاة. (أ)الطاقات الملزمة محسوبة للتفاعل بين مجالات كيناز المنشط والمتلقي من النوع البري (الأزرق) و A702V (الأحمر) EGFRs. (B) ΔGربط ATP إلى البرية من نوع (الأزرق) و ΔELREA (الذهب) مجالات كيناز EGFR. الأرقام المقتبسة من Chakroborty et al.9 (الشكل 6A المستنسخة بإذن من مجلة الكيمياء البيولوجية)وTamirat et al.12. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
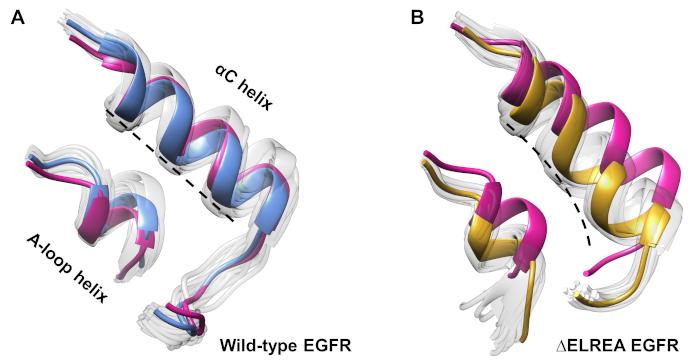
الشكل 7: التشكلات الفائقة من المجال البري من النوع و ΔELREA غير نشط EGFR kinase. تركيب الحلزون αC و A-حلقة الحلزون من (أ) من النوع البري (متوسط الهيكل باللون الأزرق) و (B) ΔELREA EGFRs (الذهب). التشكلات العينات الأخرى، بيضاء باهتة؛ الهياكل الأولية قبل المحاكاة MD، وردي. الرقم من تاميرات وآخرون12. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
ويركز البروتوكول الموصوف في هذه الدراسة على استخدام محاكاة الديناميات الجزيئية للتحقيق في التعديلات الهيكلية المحلية والعالمية التي تنشأ عن تفعيل الطفرات الجسدية في نطاق KINASe EGFR. على الرغم من أن هياكل الكريستال بالأشعة السينية من نوع البرية وEGFRs متحولة توفر رؤية هيكلية لا تقدر بثمن، فإنها تصور واحد أو عدد قليل من التمثيلات الثابتة. ومع ذلك، المتأصلة في الوظيفة البيولوجية من ErbBs هي التحولات اللازمة بين كيناز التيروزين الأنزيمية غير النشطة والنشطة، استدعاء التغيرات الديناميكية في كل من البنية والتفاعلات داخل الجزيئات بين مونومرات كيناز. وهكذا أجريت عمليات محاكاة MD لسبر الطبيعة الديناميكية لمجال EGFR التيروزين كيناز، بما في ذلك الهيكل البري، وطفرة حذف ΔELREA المقدمة، وطفرة A702V. وقد نجحت هذه المحاكاة في توضيح الدور المحتمل لهذه الطفرات في الهياكل وكيف أن آثارها على تكوين نطاق التيروزين كيناز ستؤدي إلى الزيادات التي لوحظت تجريبيا في نشاط كيناز EGFR.
ومن الخطوات الحاسمة في هذا البروتوكول استخدام هيكل ذي صلة لتقييم أثر الطفرة. طريقة واحدة لتحديد بنية إدخال المحاكاة ذات الصلة هو تصور موقع الطفرة في بنية 3D ثابتة ودراسة تأثيرها المحتمل فيما يتعلق بالأحماض الأمينية المجاورة والوحدات الهيكلية. في هذه الدراسة، على سبيل المثال، منذ أن تم وضع A702V EGFR طفرة في الجزء juxtamembrane B التي تشكل واجهة الديم غير المتماثلة، واستخدام هيكل أكثر خافض للمحاكاة بدلا من مونومر أمر بالغ الأهمية. استخدام بنية أحادية االمسخ قد تعرض الجزء من التجاور B من كيناز المتلقي للمذيبات، وحرمانه من تفاعلات الاستقرار، وتعزيزها من قبل طفرة إلى بقايا أكبر ماء وتفاعلات مع isoleucine 941 من بقايا C-الفص من كيناز المنشط. وعلاوة على ذلك، تجدر الإشارة إلى أن الهيكل ثلاثي الأبعاد الذي تمثله الإحداثيات في ملف PDB لا يتوافق بالضرورة مع الهيكل البيولوجي ذو الصلة الذي ينبغي استخدامه للدراسة. على سبيل المثال، مع بنية ErbB4، رمز PDB 3BCE، إحداثيات PDB تتوافق مع تقليم، ولكن هذا يرجع إلى اتصالات الكريستال (يتم مشاهدة بعض الاتصالات بين مونومر عند تصور هذا الهيكل). ويمكن استخدام المصفوفات داخل ملف PDB (على سبيل المثال، داخل كيميرا) لإعادة بناء الهياكل ذات الصلة بالبلورية، والتي يمكن تصورها لتحديد السلاسل التي تتوافق مع البنية ثلاثية الأبعاد ذات الصلة بيولوجيا كما ورد في المنشور الأصلي42. وثمة خطوة أساسية أخرى للبروتوكول هي إعداد هيكل مدخلات المحاكاة بشكل صحيح، مثل بناء الأحماض الأمينية المفقودة في مناطق مختلفة من الحلقات، وخصوصاً عندما تقع في المنطقة المجاورة للطفرة. وعلى الرغم من وجود العديد من هياكل EGFR البرية في PDB، لا يتوفر سوى عدد محدود من هياكل EGFR المتحولة. وبالتالي، فإن الهياكل المتحولة تحتاج أيضا إلى أن تكون على غرار؛ لطفرة واحدة بقايا مثل A702V، تم استخدام كيميرا لتحور المخلفات؛ في حين، لطفرة الحذف ΔELREA، تم استخدام Modeller.
يمكن تعديل المعلمات المختلفة المستخدمة في ملفات الإدخال المحاكاة - على سبيل المثال ، عدد دورات التخريب ، تسخين النظام إلى درجة الحرارة المطلوبة في خطوة واحدة أو بدلاً من ذلك التسخين ببطء من خلال عدة درجات حرارة وسيطة ، والفترة الزمنية للتكرار ومحاكاة الإنتاج - استنادًا إلى جزيء الدراسة ، والهدف من العمل وتفضيلات المرء الخاصة. أثناء تنفيذ المحاكاة MD ، من الشائع أيضًا أن تصادف أخطاء يمكن أن تنشأ من ملفات الإدخال أو المشكلات المتعلقة ببرنامج المحاكاة المستخدم أو حتى خطأ المستخدم. ومن ثم، من المهم جداً فهم مصدر الأخطاء عن طريق فحص بعناية أي رسائل خطأ. معظم برامج المحاكاة لديها قائمة بريدية حيث يمكن للمستخدمين طرح أسئلة لمطوري البرامج والمستخدمين الآخرين التي يمكن من خلالها حل معظم المشاكل. وبالإضافة إلى ذلك، توفر أدلة المستعملين مساعدة كبيرة لفهم تفاصيل بروتوكول المحاكاة، بما في ذلك الافتراضات والقيود. على الرغم من أن المحاكاة MD هي أداة مهمة لاستكشاف الخصائص الديناميكية للجزيئات ، تذكر أن النتائج الحسابية تحتاج إلى تقييم دقيق بالاقتران مع مصادر أخرى للمعلومات لتقييم صلاحيتها. كلما كان ذلك ممكنا، والعمل جنبا إلى جنب مع الباحثين الخبراء في البروتينات قيد الدراسة، وخاصة عند إجراء دراسات تجريبية المختبرات الرطب ذات الصلة، والتي تعمل على توفير نتائج للتفسير الهيكلي، فضلا عن اقتراح التجارب التي يمكن إجراؤها على أساس الملاحظات الهيكلية لاختبار الفرضيات.
في هذه الدراسة، كان البروتوكول فعالاً في دراسة التأثيرات الهيكلية الديناميكية لطفرات ΔELREA و A702V على هياكل هندسة الـ EGFR kinase. وكشفت المحاكاة أن ΔELREA يقيد الحلزون αC الأساسية وظيفيا ويعزز التحول التشكلي من كيناز غير نشط إلى كيناز نشط استقرت. ويدعم بشكل مستقل نتائج المحاكاة من قبل بيانات استجابة المخدرات التي أظهرت آثار مثبطات كيناز التيروزين على خطوط خلايا سرطان الرئة وجود طفرة الحذف ΔELREA والبرية من نوع EGFR، حيث تم الإبلاغ عن تثبيط أكبر من قبل الأدوية الاعتراف التشكل كيناز النشط ل ΔELREA من لـ البرية من النوع EGFR12. مع طفرة A702V، تشير المحاكاة MD، بالمقارنة مع نوع البرية، وزيادة استقرار واجهة كيناز المنشط المتلقي، فضلا عن تقارب أعلى من المنشط وكيناز المتلقي لبعضها البعض، ودعم معا الحفاظ على التشكل المنشط من kinase EGFR. ومن شأن طفرة A702V، الموجودة على الجزء juxtamembrane B من كيناز المتلقي، أن تزيد التفاعلات الرهابي مع كيناز المنشط، وتعمل لإطالة مدة الدولة المنشطة. تدعم طفرة A702V بقاء الخلية في غياب عامل النمو وتم تحديدها في فحص في المختبر لطفرات EGFR9.
Disclosures
ليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
يتم تمويل هذا البحث من خلال منح إلى M.S.J من أكاديمية فنلندا (308317، 320005)، مؤسسة سيغريد جوسيليوس وصندوق تور التذكاري، جو وبينتي بورغ التذكارية، وإلى ك. إ. من أكاديمية فنلندا (274728، 316796)، ومؤسسة السرطان في فنلندا، ومستشفى جامعة توركو المركزي. تم تمويل M.Z.T. من قبل شبكة الدكتوراه Åbo Akademi في علم الأحياء المعلوماتي والإنشائي. ونشكر مركز تكنولوجيا المعلومات التابع لمجلس الأمن للعلوم على موارد الحوسبة والدكتورة جوكا ليهتونن على دعم تكنولوجيا المعلومات في إطار شبكة المعلوماتية الحيوية في فنلندا؛ وBiocenter فنلندا البنية التحتية البنية التحتية البيولوجيا الهيكلية.
Materials
| Name | Company | Catalog Number | Comments |
| Amber software | University of California, San Francisco | Version 2018 | Executable |
| Chimera program | Resource for Biocomputing, Visualization, and Informatics at the University of California, San Francisco | Version 1.13.1 | Executable |
| EGFR struture files | The Protein Data Bank | 3D coordinates of EGFR structures | |
| Maestro | Schrödinger LLC | Version 2018-3 | Executable |
| Modeller program | The Andrej Šali Lab, Departments of Biopharmaceutical Sciences and Pharmaceutical Chemistry, University of California San Francisco | Included in the Chimera program | |
| VMD software | Theoretical and Computational Biophysics Group, University of Illinois at Urbana-Champaign | Version 1.9.3 | Executable |
References
- Yarden, Y., Sliwkowski, M. X. Untangling the ErbB signalling network. Nature Reviews Molecular Cell Biology. 2, 127-137 (2001).
- Lemmon, M. A., Schlessinger, J., Ferguson, K. M. The EGFR family: not so prototypical receptor tyrosine kinases. Cold Spring Harbor Perspectives in Biology. 6, a020768 (2014).
- Arteaga, C. L., Engelman, J. A. ERBB receptors: From oncogene discovery to basic science to mechanism-based cancer therapeutics. Cancer Cell. 2, 282-303 (2014).
- Mishra, R., Hanker, A. B., Garrett, J. T. Genomic alterations of ERBB receptors in cancer: Clinical implications. Oncotarget. 8, 114371-114392 (2017).
- . cBioPortal for Cancer Genomics Available from: https://www.cbioportal.org (2020)
- Lynch, T. J., et al. Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib. New England Journal of Medicine. 350 (21), 2129-2139 (2004).
- Paez, J. G., et al. EGFR mutations in lung cancer: correlation with clinical response to gefitinib therapy. Science. 304 (5676), 1497-1500 (2004).
- Pao, W., et al. EGF receptor gene mutations are common in lung cancers from "never smokers" and are associated with sensitivity of tumors to gefitinib and erlotinib. Proceedings of the National Academy of Sciences U.S.A. 101 (36), 13306-13311 (2004).
- Chakroborty, D., et al. Unbiased in vitro screen for activating EGFR mutations. Journal of Biological Chemistry. 294 (24), 9377-9389 (2019).
- Leahy, D. J. Structure and Function of the Epidermal Growth Factor (EGF/ErbB) Family of Receptors. Advances in Protein Chemistry. 68, 1-27 (2004).
- Roskoski, R. ErbB/HER protein-tyrosine kinases: Structures and small molecule inhibitors. Pharmacological Research. 87, 42-59 (2014).
- Tamirat, M. Z., Koivu, M., Elenius, K., Johnson, M. S. Structural characterization of EGFR exon 19 deletion mutation using molecular dynamics simulation. PLoS ONE. 14 (9), e0222814 (2019).
- Ding, L., et al. Somatic mutations affect key pathways in lung adenocarcinoma. Nature. 455, 1069-1075 (2008).
- Kurppa, K. J., Denessiouk, K., Johnson, M. S., Elenius, K. Activating somatic ERBB4 mutations in non small-cell lung cancer. Oncogene. 35 (10), 1283-1291 (2016).
- Soung, Y. H., et al. Somatic mutations of the ERBB4 kinase domain in human cancers. International Journal of Cancer. 118, 1426-1429 (2006).
- Tvorogov, D., et al. Somatic mutations of ERBB4: selective loss-of-function phenotype affecting signal transduction pathways in cancer. Journal of Biological Chemistry. 284, 5582-5591 (2009).
- Hubbard, S. R., Till, J. H. Protein tyrosine kinase structure and function. Annual Review of Biochemistry. 69 (1), 373-398 (2000).
- Huse, M., Kuriyan, J. The conformational plasticity of protein kinases. Cell. 109 (3), 275-282 (2002).
- Jura, N., et al. Catalytic control in the EGF receptor and its connection to general kinase regulatory mechanisms. Molecular Cell. 42, 9-22 (2011).
- Karplus, M., Kuriyan, M., J, Molecular dynamics and protein function. Proceedings of the National Academy of Sciences U.S.A. 102 (19), 6679-6685 (2005).
- Shan, Y., Arkhipov, A., Kim, E. T., Pan, A. C., Shaw, D. E. Transitions to catalytically inactive conformations in EGFR kinase. Proceedings of the National Academy of Sciences U.S.A. 110 (18), 7270-7275 (2013).
- Reckamp, K. L., et al. A phase I trial to determine the optimal biological dose of celecoxib when combined with erlotinib in advanced non-small cell lung cancer. Clinical Cancer Research. 12 (11 Pt 1), 3381-3388 (2006).
- Pettersen, E. F., et al. UCSF Chimera-a visualization system for exploratory research and analysis. Journal of Computational Chemistry. 25 (13), 1605-1612 (2004).
- Berman, H. M., et al. The Protein Data Bank. Nucleic Acids Research. 28 (1), 235-242 (2000).
- Zhang, X., Gureasko, J., Shen, K., Cole, P. A., Kuriyan, J. An Allosteric Mechanism for Activation of the Kinase Domain of Epidermal Growth Factor Receptor. Cell. 125 (6), 1137-1149 (2006).
- Stamos, J., Sliwkowski, M. X., Eigenbrot, C. Structure of the epidermal growth factor receptor kinase domain alone and in complex with a 4-anilinoquinazoline inhibitor. Journal of Biological Chemistry. 277 (48), 46265-46272 (2002).
- Sogabe, S., et al. Structure-Based Approach for the Discovery of Pyrrolo[3,2-d]pyrimidine-Based EGFR T790M/L858R Mutant Inhibitors. ACS Medicinal Chemistry Letters. 4 (2), 201-205 (2013).
- Sali, A., Blundell, T. L. Comparative protein modelling by satisfaction of spatial restraints. Journal of Molecular Biology. 234 (3), 779-815 (1993).
- Yun, C. H., et al. Structures of lung cancer-derived EGFR mutants and inhibitor complexes: mechanism of activation and insights into differential inhibitor sensitivity. Cancer Cell. 11 (3), 217-227 (2007).
- Park, J. H., Liu, Y., Lemmon, M. A., Radhakrishnan, R. Erlotinib binds both inactive and active conformations of the EGFR tyrosine kinase domain. Biochemical Journal. 448 (3), 417-423 (2012).
- . Release 2018-3: Maestro Available from: https://www.schrodinger.com/maestro (2018)
- Case, D. A., et al. . AMBER 2018. , (2018).
- Maier, J. A., Martinez, C., Kasavajhala, K., Wickstrom, L., Hauser, K. E., Simmerling, C. ff14SB: Improving the Accuracy of Protein Side Chain and Backbone Parameters from ff99SB. Journal of Chemical Theory and Computation. 11 (8), 3696-3713 (2015).
- Jorgensen, W. L., Chandrasekhar, J., Madura, J. D., Impey, R. W., Klein, M. L. Comparison of simple potential functions for simulating liquid water. Journal of Chemical Physics. 79 (2), 926-935 (1983).
- Meagher, K. L., Redman, L. T., Carlson, H. A. Development of polyphosphate parameters for use with the AMBER force field. Journal of Computational Chemistry. 24 (9), 1016-1025 (2003).
- Humphrey, W., Dalke, A., Schulten, K. VMD: Visual molecular dynamics. Journal of Molecular Graphics. 14 (1), 33-38 (1996).
- Melvin, R. L., Salsbury, F. R. Visualizing ensembles in structural biology. Journal of Molecular Graphics and Modelling. 67, 44-53 (2016).
- Roe, D. R., Cheatham, T. E. PTRAJ and CPPTRAJ: Software for processing and analysis of molecular dynamics trajectory data. Journal of Chemical Theory and Computation. 9 (7), 3084-3095 (2013).
- Miller, B. R., et al. MMPBSA.py: An Efficient Program for End-State Free Energy Calculations. Journal of Chemical Theory and Computation. 8 (9), 3314-3321 (2012).
- Guha, U., et al. Comparisons of tyrosine phosphorylated proteins in cells expressing lung cancer-specific alleles of EGFR and KRAS. Proceedings of the National Academy of Sciences U.S.A. 105 (37), 14112-14117 (2008).
- Furuyama, K., et al. Sensitivity and kinase activity of epidermal growth factor receptor (EGFR) exon 19 and others to EGFR-tyrosine kinase inhibitors. Cancer Science. 104 (5), 584-589 (2013).
- Qiu, C., et al. Mechanism of Activation and Inhibition of the HER4/ErbB4 Kinase. Structure. 6 (3), 460-467 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved