Method Article
الثقافة و المقايسة من السكان على نطاق واسع Caenorhabditis النخبوية المختلطة
In This Article
Summary
لاستخدام الإليغانات Caenorhabditis (C. elegans)في أبحاث omics ، هناك حاجة إلى طريقة لتوليد مجموعات كبيرة من الديدان حيث يمكن قياس عينة واحدة عبر منصات للتحليلات المقارنة. هنا، يتم تقديم طريقة لثقافة السكان C. elegans على لوحات الثقافة على نطاق واسع (LSCPs) وتوثيق النمو السكاني.
Abstract
Caenorhabditis elegans (C. elegans)كان ولا يزال كائنا حيا نموذجيا قيما لدراسة البيولوجيا التنموية والشيخوخة والبيولوجيا العصبية وعلم الوراثة. مجموعة كبيرة من العمل على C. elegans يجعلها مرشحا مثاليا للاندماج في عدد كبير من السكان، والدراسات الحيوانية الكاملة لتشريح المكونات البيولوجية المعقدة وعلاقاتها مع كائن حي آخر. من أجل استخدام C. elegans في البحوث التعاونية - omics ، هناك حاجة إلى طريقة لتوليد مجموعات كبيرة من الحيوانات حيث يمكن تقسيم عينة واحدة واقتسامها عبر منصات متنوعة للتحليلات المقارنة.
هنا، يتم تقديم طريقة لثقافة وجمع وفيرة مختلطة المرحلة C. elegans السكان على لوحة ثقافة واسعة النطاق (LSCP) والبيانات الظاهرية اللاحقة. هذا خط أنابيب تسفر عن أعداد كافية من الحيوانات لجمع البيانات الظاهري والسكان، جنبا إلى جنب مع أي بيانات اللازمة للتجارب -omics (أي الجينوم، transcriptomics، البروتيوميات، وeabolomics). وبالإضافة إلى ذلك، تتطلب طريقة LSCP الحد الأدنى من التلاعب بالحيوانات نفسها، ووقت إعداد أقل للمستخدم، وتوفر رقابة بيئية مشددة، وتضمن أن التعامل مع كل عينة متسق طوال الدراسة من أجل الاستنساخ بشكل عام. وأخيرا، يتم عرض طرق لتوثيق حجم السكان وتوزيع السكان لمراحل حياة C. elegans في LSCP معين.
Introduction
C. elegans هو النيماتودا الصغيرة التي تعيش بحرية التي توجد في جميع أنحاء العالم في مجموعة متنوعة من الموائل الطبيعية1. سهولة نسبية للنمو، وسرعة جيل الوقت، ونظام التكاثر، والجسم شفافة تجعل من كائن حي نموذج قوي التي تمت دراستها على نطاق واسع في علم الأحياء التنموية، والشيخوخة، وعلم الأعصاب، وعلم الوراثة2،3. العمل الوفير على C. elegans يجعلها مرشحا رئيسيا لاستخدامها في دراسات الاقتصاد الاقتصادي لربط الأنماط الظاهرية بشكل شامل مع المكونات البيولوجية المعقدة وعلاقاتها في كائن حي معين.
لاستخدام C. elegans في البحوث التعاونية -omics، هناك حاجة إلى طريقة لتوليد مجموعات كبيرة من الحيوانات المختلطة المراحل حيث يمكن تقسيم عينة واحدة واستخدامها عبر منصات وأدوات متنوعة للتحليلات المقارنة. يتطلب إنشاء خط أنابيب لتوليد مثل هذه العينة وعيا شديدا بالنظام الغذائي والبيئة والإجهاد والهيكل السكاني ومناولة العينات وجمعها. ولذلك، من الأهمية بمكان أن تدمج ظروف الاستزراع القياسية والتكرارية في خطوط أنابيب واسعة النطاق. في أبحاث C. elegans ، يتم استخدام طريقتين تقليديتين استزراع الديدان - أطباق أغار بيتري والثقافة السائلة4.
تاريخيا، عندما تكون هناك حاجة إلى كميات كبيرة من elegans C. ، فإنها تزرع في الثقافة السائلة4. تتطلب الخطوات التي ينطوي عليها توليد عدد كبير من الديدان في الثقافة السائلة خطوات مناولة متعددة غالبا ما تشمل مزامنة التبييض لتمزق البشرة البالغة المرقة ، وإطلاق الأجنة لتحقيق حجم السكان المطلوب. ومع ذلك، عند استخدام تزامن التبييض، يعتمد النمو السكاني على بدء حجم التعداد، وبالتالي، يؤثر على النمو اللاحق وأعداد السكان. وبالإضافة إلى ذلك، سلالات C. elegans تختلف في حساسية كتي، والتعرض الوقت، والاستجابة الإجهاد لمزامنة التبييض مما يجعل من الصعب على المقايسة العديد من السلالات في وقت5،6،7،8،9.
بالإضافة إلى ذلك، يتطلب نمو الدودة في زراعة السائل بضع خطوات نقل كما ينصح في كثير من الأحيان لزراعة جيل واحد فقط من الديدان قبل الحصاد لأن الاكتظاظ يمكن أن يحدث بسهولة إذا نمت لأجيال متعددة ويؤدي إلى تشكيل dauer على الرغم من وجود الغذاء10. يحدث تشكيل Dauer من خلال جزيئات الإشارات الصغيرة مثل أسكاروسيدات ، التي غالبا ما يشار إليها باسم "dauer pheromones"11،12،13،14، يتم إطلاقها في الوسائط السائلة وتأثير نمو السكان. وعلاوة على ذلك، يؤدي تزايد أعداد الديدان الكبيرة في الاستزراع السائل إلى تراكم البكتيريا الزائدة في الثقافة، مما يخلق صعوبات عندما تكون هناك حاجة إلى عينة نظيفة لإجراء فحوصات فينوتيبيك المصب. وأخيرا، عندما تصبح ملوثة ثقافة السائل، فمن الصعب الحفاظ على الجراثيم الفطرية أو الخلايا البكتيرية تنتشر بسهولة في جميع أنحاء وسائل الإعلام15.
الطريقة التقليدية الأخرى لزراعة C. elegans على أطباق أغار بيتري. أطباق بيتري المتاحة تجاريا تسمح للمرء أن ينمو بسهولة أجيال متعددة من الديدان المختلطة المراحل دون الآثار السريعة للاكتظاظ وتشكيل dauer عالية كما رأينا في الثقافات السائلة. ومع ذلك ، فإن عيب نمو الدودة على أطباق أجار بيتري التقليدية هو أن أكبر طبق بيتري متاح تجاريا لا ينتج مجموعات كبيرة من الديدان لدراسة -omics دون إضافة في خطوة مزامنة التبييض. وباختصار ، فإن زراعة مجموعات مختلطة من المراحل من C. elegans على أطباق أغار بيتري هي أكثر ملاءمة لجمع بيانات -omics ، لكننا كنا بحاجة إلى طريقة لتوليد أحجام سكانية كبيرة جدا دون زراعة السائل.
هنا، نقدم طريقة للثقافة وجمع مجموعات كبيرة من المراحل المختلطة C. elegans على لوحات ثقافة واسعة النطاق (LSCP). جمع العينات من خلال هذا خط أنابيب تسفر عن عينة كافية لجمع البيانات الظاهري والسكان، جنبا إلى جنب مع أي بيانات اللازمة للتجارب -omics(أي،علم الجينوم، transcriptomics، البروتيوميات، وeabolomics). وبالإضافة إلى ذلك، تتطلب طريقة LSCP الحد الأدنى من التلاعب بالحيوانات، ووقت إعداد أقل للمستخدم، وتوفر رقابة بيئية مشددة، وتضمن أن التعامل مع كل عينة متسق طوال الدراسة من أجل الاستنساخ بشكل عام.
Protocol
1. تعقيم LSCP والمعدات
- إعداد LSCPs الزجاج عن طريق غسل اليدين، تليها غسل الصحون، والاستعباد التلقائي اللاحقة لضمان الأواني الزجاجية خالية من الملوثات قبل بدء التجربة. تخزين LSCPs autoclaved في مكان جاف نظيف حتى قيد الاستخدام.
ملاحظة: تأكد من أن LSCPs هي غسالة صحون وآمنة الأوتوكلاف. تأكد من أن أغطية LSCP آمنة لغسالة الصحون. - إعداد أغطية LSCP عن طريق غسل اليدين تليها غسل الصحون. تخزين أغطية LSCP في سلة نظيفة حتى الحاجة.
- في اليوم الذي يتم فيه إعداد Nematode Growth Media Agarose (NGMA) ، امسح أغطية LSCP بمحلول تبييض بنسبة 10٪ مرتين ، يليه الإيثانول بنسبة 70٪. مرة واحدة مسحت أسفل مع 10٪ التبييض والإيثانول 70٪، والحفاظ على أغطية LSCP في سلة نظيفة في غطاء محرك السيارة تدفق صفح حيث سيتم إعداد NGMA.
2. إعداد نمو النيماتودا وسائل الإعلام agarose (NGMA)
- إعداد NGMA عن طريق الجمع بين الكواشف التالية في قارورة Erlenmeyer 2 l autoclaved مع شريط اثارة على لوحة اثارة: 2.5 غرام بيبتون، 3 غرام NaCl، 7 غ agarose، 10 غرام أجار، و 975 مل ماء معقم16. تأكد من أن الحجم الإجمالي يساوي 1 L. الشريط غطاء احباط إلى القارورة.
ملاحظة: سوف تسفر خطوات التحضير ل NGMA كما هو موضح هنا عن مواد كافية ل 2.5 LSCPs. يمكن تصميم البروتوكول لحجم دفعة LSCP المطلوبة في تجربة معينة. - الأوتوكلاف على دورة السائل في 121 درجة مئوية و 21 مساء لمدة 45 دقيقة.
- بدوره على حمام المياه وتعيين إلى 50 درجة مئوية. أحضر NGMA المكواة إلى حمام الماء لتبرد إلى 50 درجة مئوية.
- جلب 2 L قارورة Erlenmeyer من NGMA في غطاء محرك السيارة أو تنظيف الفضاء وتعيين على لوحة ضجة. استخدم مقياس الحرارة لتتبع درجة حرارة NGMA.
- بعد أن وصلت درجة حرارة NGMA إلى 50 درجة مئوية، أضف ما يلي بالترتيب المدرج مع ماصة معقمة يمكن التخلص منها داخل غطاء محرك السيارة أو مساحة نظيفة: 25 مل من 1 M KH2PO4 (K phosphate buffer)، 1 مل من الكوليسترول (5 ملغم/مل في الإيثانول)، 1 مل من 1 م كاكل2, 1 مل من 1 م مغسو4, 1 مل من النيستاتين (10mg/mL), و 1 مل من الستربتومايسين (100 ملغم/ مل)16.
- صب 400 مل من NGMA في LSCP الزجاج العقيم، ما يقرب من 1.3 سم عميق، تسمح لLSCP لترسيخ على سطح مستو في غطاء محرك السيارة ووضع غطاء احباط autoclaved مرة أخرى على LSCP.
- بمجرد تعيين أجار، وإزالة احباط، ووضع غطاء نظيف الهواء ضيق على LSCP والانتقال إلى 4 درجة مئوية للتخزين. تخزين NGMA في LSCPs في 4 درجة مئوية حتى قيد الاستخدام والاستخدام في غضون 5 أيام.
3. توليد E. كولاي الغذاء لNGMA على LSCP
- لتوليد مصدر غذائي مستقر، قم بتوليد دفعات من HT115 (DE3) E. coli باستخدام مفهوم متوسط دفعة صغيرة تتسق مع نظرية الحد المركزي17. يخزن عند -80 درجة مئوية. عند الحاجة سحب E. كولاي الأسهم البكتيرية (ق) من -80 درجة مئوية لإذابة18.
ملاحظة: في هذا البروتوكول، نمت المخزونات البكتيرية الإشريكية القولونية في مفاعل حيوي. في نهاية نمو الثقافة، تم تخفيف الثقافة 1:50، وكان OD600 المقاس 0.4. وهكذا، كان للثقافة OD600 فعالة من 20. وكانت البكتيريا بيليه، وزنها، وإعادة إنفاقها في المتوسط K بتركيز 0.5 غرام / مل (الوزن الرطب)، ونقلها إلى 2 مل aliquots، والمجمدة19.
4. الحديقة البكتيرية على NGMA
- جلب LSCPs NGMA من 4 درجة مئوية إلى درجة حرارة الغرفة (RT) لعدة ساعات قبل نشر العشب البكتيري للسماح لLSCP بأكمله للوصول إلى RT.
- سحب الأسهم البكتيرية E. القولونية اللازمة (ق) من -80 درجة مئوية لإذابة18.
- تمييع E. كولاي الأسهم البكتيرية (ق) مع 2 مل من العقيمة K-المتوسطة لتحقيق 0.5 غرام كولاي في 4 مل لكل LSCP NGMA. ماصة بعناية 4 مل من الإشريكية القولونية في منتصف LSCP NGMA.
- استخدم جهاز نشر معقم لنشر البكتيريا في مستطيل يترك حوالي 3.8 سم من الغرفة حول حواف NGMA E. coli مجانا.
- اترك NGMA LSCP مع الإشريكية القولونية في غطاء محرك السيارة مع المروحة لمدة ساعة واحدة لضمان جفاف تعليق الإشريكية القولونية بالكامل.
- مرة واحدة في الحديقة البكتيرية الجافة، ودفع الغطاء على بإحكام وتخزينها في 4 درجة مئوية حتى تستخدم.
5. قطعة الديدان للحد من التوتر وتقلب العمر عبر العينات
- الديدان المتتالية من مخزون دودة المجمدة إلى لوحة 6 سم المصنف حديثا4. هذه اللوحة ستكون بمثابة لوحة "قطعة رئيسية".
ملاحظة: Chunking هو الأسلوب الأمثل لنقل الديدان من سلالة homozygous20. إذا كان سلالة heterozygous أو يحتاج إلى الحفاظ عليها عن طريق الانتقاء والتزاوج، chunking ليس من المستحسن. قد تحتاج إلى تحسين تكرار chunking اعتمادا على الأنماط الجينية دودة المستخدمة، ودرجة الحرارة المختارة للنمو، والخطوات المصب. - بعد لوحة قطعة رئيسية مليئة البالغين gravid صحية (حوالي 3 أيام) مع الكثير من العشب كولاي لا تزال موجودة، اتبع المبادئ التوجيهية القياسية C. elegans قطع كما هو موضح في WormBook لإنتاج أربعة لوحات قطعة مجموع4.
- تخزين جميع لوحات قطعة في درجة حرارة التحكم (CT) غرفة في 20 درجة مئوية ما لم ينص على خلاف ذلك للنمو.
ملاحظة: إذا لم يكن لدى مستخدمي هذا البروتوكول إمكانية الوصول إلى غرفة التصوير المقطعي كما هو موضح هنا، فمن المستحسن استخدام إما حاضنة صغيرة حيث يمكن التحكم في درجة الحرارة أو غرفة معينة حيث يمكن التحكم في الظروف البيئية قدر الإمكان. إذا لم يتوفر أي من هذه الخيارات البديلة، لاحظ أن التباين في نمو العينة قد يكون أكبر. - مرة واحدة لوحظ العديد من البالغين gravid في لوحة قطعة4، انتقل إلى الخطوة 6.
6. بقعة التبييض ينجذب البالغين على LSCP
ملاحظة: تستخدم تقنية التبييض هذه للقضاء على معظم الملوثات وحل قطعة الهرمافروديت التي تطلق الأجنة من الدودة البالغة. محلول التبييض سوف نقع في NGMA قبل تفقيس الأجنة.
- جلب LSCPs إلى RT لعدة ساعات قبل بقعة الديدان التبييض.
- إعداد نسبة 7:2:1 من ddH2O : التبييض : 5 M NaOH. جعل هذا الحل القلوية هيبوكلوريت الطازجة قبل الاستخدام.
ملاحظة: استخدم نفس المخزون من التبييض وNaOH طوال مدة تجربة معينة لتجنب تأثير دفعة التبييض. وكان التبييض المستخدمة في هذا البروتوكول 5-10٪ هيبوكلوريت الصوديوم. - ضوء الموقد بونسن ولهب اختيار دودة قبل المتابعة. مغرفة جديدة E. القولونية على اختيار عقيمة من حافة الحديقة البكتيرية على LSCP.
- اختيار شخص بالغ واحد gravid من لوحة قطعة4 لتبييض بقعة.
- ماصة 5 ميكرولتر من محلول الهيبوكلوريت القلوية في زاوية واحدة من LSCP بعيدا عن العشب كولاي E.
- ضع الشخص البالغ الرابيد الانتقاء في محلول هيبوكلوريت قلوي سعة 5 ميكرولتر. اضغط على النيماتودا للمساعدة في تعطيل كتل والإفراج عن البيض.
- كرر الخطوات 6.4 - 6.6 لما مجموعه 4x ووضع 5 البالغين gravid بالتساوي حول العشب كولاي. اختيار جميع البالغين 5 gravid من نفس لوحةقطعة 4 لضمان ما يقرب من الأفراد isogenic وراثيا تضاف إلى عينة معينة.
- ضع الغطاء مرة أخرى على LSCP.
- كرر الخطوات لكافة LSCPs.
7. نمو دودة في درجة الحرارة التي تسيطر عليها (CT) غرفة
- بعد التبييض الموضعي، ضع الغطاء بإحكام على LSCP وضع في غرفة CT تعيين إلى 20 درجة مئوية مع تدفق الهواء المستمر و12L:12D photoperiod (12 ساعة ضوء والظلام 12 ساعة).
- لاحظ الوقت والمكان الذي تم فيه وضع العينة في غرفة التصوير المقطعي.
ملاحظة: يجب أن يكون موضع داخل الغرفة دائما موثقة لتسجيل أي اختلافات بيئية التي يمكن أن تواجه العينات أثناء النمو. بمجرد أن تكون العينة في غرفة التصوير المقطعي ، يجب أن تبقى في المكان المخصص لها دون إزعاج. لا تفتح غطاء LSCP في غرفة التصوير المقطعي لتقليل فرصة التلوث. - خذ LSCP إلى المجهر ، خارج غرفة التصوير المقطعي ، لمراقبة النمو السكاني والكثافة السكانية.
ملاحظة: كل سلالة C. elegans وعينة سوف تختلف في نموها، لذلك رصد العينات عن كثب. في حين أنه من المستحسن عدم الإخلال بنمو LSCP أثناء وجوده في غرفة التصوير المقطعي ، تم نقل LSCPs من غرفة التصوير المقطعي وتم فتح الأغطية كل يومين لمراقبة نمو العينة. أخذ الأغطية مختومة قبالة LSCPs كل 2 أيام يسمح أيضا لO2 لتدفق في LSCP. - قبل الحصاد ضمان أن LSCP أصبحت مليئة بمجموعة كبيرة من الديدان. استخدم المعايير التالية لتحديد ما إذا كان LSCP جاهزة تجميعها.
- تأكد من أن LSCP مليء بالديدان البالغة المرقة.
- تأكد من أن اللوحة تحتوي على حجم سكاني كبير (أي تغطية الديدان لكامل سطح أجار).
- تأكد من أن لوحة ليس لديها العديد من البيض على سطح أجار (أي، يجب أن يكون الحد الأقصى لعدد الديدان فقست).
- تأكد من أن اللوحة لديها الحد الأدنى من أي كولاي اليسار، مشيرا إلى أن الديدان سوف تجويع وتوليد يرقات dauer إذا تركت على لوحة لمدة يومين إضافيين.
ملاحظة: على الرغم من أن معظم LSCPs مستعدة للحصاد بين 10 إلى 20 يوما، اعتمادا على سلالة وعينة، تحقق من كل LSCP في كثير من الأحيان عند إنشاء هذا البروتوكول لتحديد أوقات الحصاد العادية.
- قفازات نظيفة ومنطقة مع الإيثانول 70٪ بين معالجة LSCPs لتجنب التلوث المتبادل بين السلالات.
8. حصاد عينة LSCP
- قم بتشغيل جهاز الطرد المركزي والسماح له بالتبريد إلى 4 درجات مئوية قبل أخذ عينات الحصاد.
- إعداد ثلاثة أنابيب مخروطية 50 مل مع 50 مل من محلول M9 لكل LSCP ليتم حصادها.
- تسمية واحد 15 مل أنبوب مخروطي لكل LSCP.
ملاحظة: يتم تنفيذ جميع خطوات الطرد المركزي في الأنبوب المخروطي سعة 15 مل، لأن الديدان تميل إلى البيليه بشكل جيد في هذه الأنابيب. - صب 50 مل من محلول M9 (من أنبوب مخروطي واحد 50 مل في الخطوة 8.2) على سطح LSCP ودوامة حولها لضمان أن M9 يغطي سطح NGMA بأكمله.
- بينما M9 يجلس على سطح LSCP، رئيس ماصة المصلية العقيمة مع M9.
ملاحظة: عن طريق فتيلة ماصة المصلية العقيمة مع M9 وهذا يضمن أن أقل الديدان التمسك داخل ماصة بلاستيكية، ومنع فقدان العينة. - إمالة LSCP حتى M9 population worm تجمع في زاوية واحدة من LSCP.
ملاحظة: سيتم الإشارة إلى خليط من M9 الحل والديدان من LSCP باسم "تعليق الفيروس المتنقل" في خطوات المتلقين للمعلومات. - باستخدام ماصة المصلية تستعد مع ماصة أوتوماتيكية، تعليق دودة ماصة ومكان في أنبوب مخروطي 50 مل الأصلي. مرة واحدة يتم جمع 50 مل من تعليق دودة، وضع أنبوب مخروطي على الروك لتعطيل كتل البكتيريا والحطام.
- كرر الخطوات 8.4 - 8.7 جمع 150 مل من تعليق الدودة لكل LSCP.
- نقل 15 مل من تعليق دودة, من واحد من ثلاثة أنابيب مخروطية 50 مل, عن طريق صب في أنبوب مخروطي المسمى 15 مل جانبا في الخطوة 8.3. الطرد المركزي الأنبوب المخروطي سعة 15 مل عند 884 × ز لمدة دقيقة واحدة عند 4 درجات مئوية. فإن غالبية الديدان بيليه في الجزء السفلي من الأنبوب.
- يستنشق قبالة supernatant ضمان عدم ازعاج بيليه دودة.
- استمر في إضافة ما يقرب من 13 مل من تعليق الدودة إلى نفس الأنبوب المخروطي سعة 15 مل الذي يكرر الخطوتين 8.9 و8.10 حتى يتم استهلاك جميع تعليق الدودة الذي يبلغ 150 مل. عكس الأنبوب وتعكير صفو بيليه بين أجهزة الطرد المركزي لغسل واستنشق قبالة أكبر قدر ممكن من البكتيريا والحطام.
ملاحظة: في هذه الخطوة، يتم تكثيف محتويات جميع الأنابيب المخروطية الثلاثة سعة 50 مل في أنبوب واحد سعة 15 مل. - إضافة 10 مل من M9 نظيفة إلى أنبوب مخروطي 15 مل وتهيج بيليه دودة عن طريق عكس. الطرد المركزي الأنبوب المخروطي سعة 15 مل عند 884 × ز لمدة دقيقة واحدة عند 4 درجات مئوية. يستنشق قبالة supernatant ضمان عدم ازعاج بيليه دودة. كرر مرتين.
ملاحظة: إذا كان هناك كمية كبيرة من الحطام أو البكتيريا في العينة، كرر الخطوة 8.12 حتى تكون العينة نظيفة. - بمجرد تنظيف العينة، أضف ddH2O إلى بيليه الدودة لما مجموعه 10 مل من ddH2O والديدان. حرض بيليه الدودة عن طريق عكس. التحرك بسرعة إلى الخطوة 9.1، كما يجب أن تبقى الديدان في DDH2O لمدة 5 دقائق أو أقل لتجنب الإجهاد التناضحي.
ملاحظة: تعليق الكريات دودة في DDH2O هو المذيب المفضل لخطوات المصب-omics. يمكن تعليق الديدان في مذيبات أو مخازن مؤقتة أخرى إذا كانت متوافقة مع سير عمل تجريبي معين.
9. تقدير حجم السكان
ملاحظة: الانتقال من خلال الخطوات 9.1 - 9.7 بسرعة. ويشار إلى خليط DDH2O والديدان من الخطوة 8.13 باسم "عينة الدودة" في الخطوات اللاحقة.
- قبل ماصة عينة دودة، تلميح ماصة رئيس لاستخدامها مع M9 لتجنب الديدان الشائكة إلى داخل ماصة بلاستيكية منع فقدان العينة والحد من الاختلاف العد.
- خذ 100 ميكرولتر aliquot من عينة دودة وتمييعه إلى 900 ميكرولتر من M9. تخلط جيدا وجعل تخفيف المسلسل (1:10، 1:100، 1:1000). كرر هذه الخطوة مرتين لتحقيق ما مجموعه ثلاث مجموعات من التكرارات aliquot.
ملاحظة: يمكن أن يسبب الديدان Pipetting تباين عالية في تعداد السكان عينة. تأكد من أن عينة الفيروس المتنقل متجانسة قبل أن pipetting aliquot المطلوب. - تعيين أنبوب مخروطي 15 مل على الروك لمواصلة نقل الثقافة في حين يتم احتساب aliquots.
- تأكد من أن عينة الدودة مختلطة ومتجانسة بشكل جيد. ماصة 5 ميكرولتر من عينة دودة 1:10 ، والاستغناء عنها على شريحة المجهر ، وعدد الديدان. إذا كان هذا العدد أقل من حوالي 50 دودة، ثم عد أيضا تخفيف 1:100 و 1:1000. إذا كان أكثر من 50، انتقل إلى التخفيف التسلسلي التالي.
ملاحظة: إذا كان لا يمكن حساب عدد كبير جدا من worms بدقة، استخدم المخفف التسلسلي التالي لحساب بدلا من ذلك. - عد كل تكرار aliquot من كل تخفيف 3x. في نهاية العد، بالنسبة لمعظم الثقافات، سيتم توثيق 9 أعداد إجمالية(أي،3 إجمالي عدد لكل تكرار aliquot).
- متوسط عدد التخفيف لتحديد حجم السكان المقدر لعينة الدودة. ستحدد هذه التهم التخفيف حجم عينة دودة اللازمة لإنشاء حجم aliquot المطلوب لخطوات -omics.
ملاحظة: في هذه التجربة، تم إنشاء aliquots من حوالي 200،000 الديدان المختلطة المرحلة. وبالإضافة إلى ذلك، خصص واحد من aliquot من حوالي 50،000 الديدان المختلطة المرحلة لفرز في مقياس الخلايا تدفق الجسيمات الكبيرة (وصفها في الخطوة 10). - بمجرد تقسيم عينة الدودة إلى aliquots المناسبة ، تجميد الفلاش في النيتروجين السائل وتخزين العينة عند -80 درجة مئوية.
ملاحظة: لا تجميد aliquot مخصصة لقياس الخلايا تدفق الجسيمات الكبيرة.
10. (اختياري) إعداد عينة لقياس الخلايا تدفق الجسيمات الكبيرة
ملاحظة: الخطوات 10 و11 و12 هي الطريقة المفضلة للمؤلفين لتسجيل نمو العينة(أيحجم السكان وتوزيع السكان لمراحل دورة حياة C. elegans) وتحديد نجاح الثقافة. يمكن لمستخدمي هذا البروتوكول استبدال الخطوات الاختيارية 10 و11 و12 بمقاييسهم الخاصة لنجاح النمو. الخطوات 10 و 11 و 12 موضحة هنا لسببين; أولا، بحيث يمكن للمستخدمين الذين لديهم معدات المستخدمة في الخطوات 10 و 11 و 12 تكرار هذه الخطوات والثانية لإظهار التحقق من صحة أسلوب النمو هذا. الخطوة 9 أعلاه يوفر تقدير جيد من العدد الإجمالي للديدان لتحديد أحجام aliquot، والخطوة 10 هو مقياس أكثر كمية لتقدير عدد وتوزيع السكان من الديدان في عينة معينة.
- جلب aliquot من حوالي 50،000 الديدان المختلطة المرحلة (جانبا في الخطوة 9.6) تصل إلى 10 مل الحجم الإجمالي في محلول M9.
- جعل الحل يتكون من 1 ملغم / مل من كولاي و1:50 تخفيف 0.5 ميكروسفيرات الفلورسنت الأحمر19.
- إضافة 200 ميكرولتر من هذا الحل إلى 10 مل من الديدان المختلطة المرحلة في M9 واحتضان بينما هزاز لمدة 20 دقيقة.
- بعد 20 دقيقة، طارد مركزي أنبوب مخروطي 15 مل في 884 x g لمدة دقيقة واحدة في 4 درجة مئوية.
- يستنشق قبالة supernatant ضمان عدم ازعاج بيليه دودة.
- غسل بيليه دودة مرتين مع محلول M9 للقضاء على البكتيريا الزائدة وmicrospheres الفلورسنت الأحمر.
- إضافة 5 مل من M9 إلى بيليه دودة وضمان أن بيليه تبدو نظيفة. إذا كانت بيليه نظيفة، إضافة 5 مل من M9 مع 50 mM الصوديوم azide على حد سواء لتصويب وقتل الديدان لعد دقيق وتحجيم21.
- توثيق الوقت والتاريخ عندما يتم إضافة azide الصوديوم إلى عينة.
- وضع العينة جانبا على الروك حتى الحاجة إلى قياس الخلايا تدفق الجسيمات الكبيرة.
ملاحظة: من المعروف أن أزيد الصوديوم يؤثر على فسيولوجيا النيماتودا(أيطول الجسم والتمثيل الغذائي والتولير الحراري). لذلك ، من المهم ملاحظة الوقت الذي تتعرض فيه الديدان لأزايد الصوديوم لأن العديد من هذه التأثيرات الفسيولوجية تحدث في غضون دقائق22. بسبب الآثار الفسيولوجية المعروفة لأزايد الصوديوم على الديدان ، سيؤثر هذا العلاج على جودة الصورة في المصب ويجب النظر فيه.
11. (اختياري) توثيق توزيع السكان وإعداد لوحة 384 جيدا للتصوير
ملاحظة: الخطوة 11 يستخدم مقياس الخلايا تدفق جسيم كبير (LPFC). يتم افتراض المعرفة الأساسية ل LPFC في هذا البروتوكول. ويمكن استبدال طرق أخرى لتوثيق نمو العينات وتوزيعها السكاني. الخطوات الموثقة هنا للمستخدمين الذين يخططون لاستخدام LPFC في خط أنابيب23.
- قم بتشغيل LPFC وتنظيفه وتدرئه، واسمح لأشعة الليزر بالتدفئة لمدة ساعة واحدة قبل فرز العينات.
- بعد أن تدفأ الليزر، افتح ملف تعريف"الرسم البياني"ونطاقه إلى وقت الطيران (TOF) لعام 2050.
- إضافة منطقة شريط إلى"المدرج التكراري"تمتد نطاق TOF من 100. تغطي منطقة البار الأولى TOF من 50-150.
- متابعة إنشاء عشرين شريط المناطق كل تمتد نطاق TOF من 100. وتمتد مناطق البار هذه على نطاق TOF بأكمله من 50 إلى 2050. انظر الجدول التكميلي 1 للاطلاع على المناطق المسورة بالضبط لاستخدامها عبر توزيع TOF.
- حفظ هذا الرسم البياني إعداد ك "تجربة" لاستخدامها في تشغيل LPFC المستقبلية.
- حدد لوحة معايرة 384 جيدا أو معايرة الصك إلى لوحة 384 جيدا للاستغناء عن الكائنات في.
- مرة واحدة في قالب لوحة معايرة 384 جيدا، تعيين قالب للاستغناء عن 20 الكائنات مسور في أربعة آبار (أربع نسخ متماثلة التقنية من كل منطقة مسور) لكل من المناطق شريط 20 التي تم إنشاؤها خلال الخطوات 11.3-4. انظر الجدول التكميلي 2 للحصول على مثال تخطيط كيفية الاستغناء عن الديدان في لوحة 384 جيدا.
- نقل عينة من الخطوة 10.9 إلى أنبوب مخروطي 50 مل وإضافة M9 حل إضافي لتحقيق ما يقرب من 40 مل الحجم الإجمالي.
- ابدأ تلقائيا في فرز العينة حسب المعلمات المحددة في الخطوة 11.7 مع تحريك العينة باستمرار لمنع التسوية والاستغناء عن الكائنات في نفس الوقت من العينة في لوحة 384-well معايرة.
ملاحظة: تأكد من أن معدل تدفق LPFC يعمل بين 15-20 كائنا في الثانية وتحديد أية مضاعف ليتم فرزها. - مرة واحدة وقد تم فرز عينة كاملة والحد الأقصى لعدد من المناطق المسور قد تم الاستغناء عنها في لوحة 384 جيدا، واتخاذ العينة قبالة LPFC وأداة نظيفة.
ملاحظة: عند الوصول إلى مناطق TOF أكبر، قد يصبح من الصعب الاستمرار في ملء لوحة 384-well بسبب انخفاض عدد الأحداث في منطقة TOF تلك. ملء أكبر عدد ممكن من المناطق المسورة للحصول على أفضل فكرة عن المكان الذي تقع فيه مراحل حياة C. elegans ضمن توزيع LPFC قبل نفاد العينة. - ضع فيلم ختم على قمة لوحة 384 جيدا حتى يتم تصويره.
ملاحظة: لوحة الصورة في أسرع وقت ممكن بعد الفرز لأنه يتم التعامل مع عينات azide الصوديوم22. ويمكن رؤية الفلورسنت الأحمر في ملفات البيانات LPFC التي تم جمعها(أي PH الأحمر البيانات في ملف نص الإخراج) على أساس مستوى الفلورسنت الأحمر المنبعث في كل كائن فرز للمساعدة في تحديد الكائنات التي هي على قيد الحياة الديدان، والديدان الميتة، dauers، أو غير المرغوب فيه24.
12. (اختياري) لوحة التصوير 384 جيدا
ملاحظة: الخطوة 12 يستخدم المجهر confocal دقيقة القراءة لوحة. ويفترض في هذا البروتوكول المعرفة الأساسية لمجهر الكونفوجكال الصغير. ويمكن استبدال طرق أخرى لتوثيق نمو العينات وتوزيعها السكاني.
- باستخدام المجهر الكونفوجكال الصغير لقراءة اللوحات مع عدسة 20x.
- فتح"الهدف والكاميرا"علامة التبويب وتعيين إلى "10x خطة ApoLambda" واسطة.
- فتح"الكاميرا Binning"علامة التبويب وتعيين إلى "2".
- فتح"مواقع لزيارة على لوحة"علامة التبويب وتعيين إلى "4" مواقع لكل بئر و "تتداخل المواقع 10٪" لغرزة في وقت لاحق معا الصور.
- فتح "الطول الموجي" علامة التبويب وتعيين إلى "برايتفيلد 1".
- فتح "إضاءة" علامة التبويب وتعيين إلى "ضوء المنقولة، عينة مشرقة".
- ضع لوحة 384 جيدا في المجهر وتعيين"Z المكدس"إلى "حساب الإزاحة" والعثور على المستوى البؤري المناسب للعينات في لوحة 384 جيدا.
- تشغيل لوحة 384 جيدا على المجهر confocal الصغيرة جمع أربع صور لكل بئر.
- المونتاج الصور الأربع معا لخلق صورة واحدة لكل بئر.
النتائج
وينتج عن نمو السيليغانات C. باستخدام طريقة LSCP ما متوسطه حوالي 2.4 مليون دودة مختلطة المراحل لكل عينة على مدى 12.2 يوما. نمو elegans جيم باستخدام طريقة LSCP تمكن المستخدمين لتوليد مجموعات كبيرة مختلطة المرحلة من elegans جيم مع القليل من التعامل مع والتلاعب من الحيوانات ، وهو مثالي لدراسات واسعة النطاق - omics (الشكل 1). بمجرد أن يصبح LSCP مليئا بالديدان البالغة ، ويصل إلى حجم سكاني كبير ، ولديه الحد الأدنى من البكتيريا المتبقية ، يمكن للمستخدمين حصاد وتقدير حجم السكان. ويمكن لهذه النقطة أيضا أن تكون بمثابة مراقبة للجودة من خلال تقييم ما إذا كان السكان كافية لاستخدامها في خط أنابيب -omics (الشكل 2). تعتمد ديناميكيات السكان على السلالة نفسها ، وسلوك السلالة(أي، تميل سلالات التجشؤ إلى انخفاض انتعاش الدودة) ، ونجاح النمو(أيالتلوث). تم اختبار طريقة LSCP على 15 سلالة من اليجانات C. تحتوي على خليط من المسوخ مركز علم الوراثة Caenorhabditis (CGC) وCaenorhabditis elegans موارد التنوع الطبيعي البرية (CeNDR)سلالات 25. ويرد وصف الأنماط الجينية للسلالات في الجدول التكميلي 3.
وأسفرت طريقة LSCP عن أحجام سكانية تتراوح بين 500 94 و 000 290 9 نسمة تقريبا. وكان متوسط حجم السكان ضمن سلالة مرجعية، PD1074، وعبر سلالات ما يقرب من 2.4 مليون الديدان(الشكل 3). لم توجد فروق كبيرة في أحجام السكان المقدرة بين سلالات اليجانات C. elegans على مدى متوسط 12.2 يوم نمو LSCP (الشكل 4). استغرق PD1074 LSCPs ما بين 10 - 14 يوما للنمو إلى كامل مختلطة المرحلة السكانية. كان متوسط وقت النمو عبر PD1074 10 أيام. نمت السلالة أبطأ نموا لمدة أقصاها 20 يوما، ونما سلالة الأسرع نموا لمدة لا تقل عن 10 أيام(الشكل 4).
ولذلك، باستخدام هذه الطريقة LSCP، يمكن للمستخدمين بسهولة دمج سلالات جديدة من الاهتمام في دراسة مع معرفة قليلة من توقيت التنمية والخبرة الخلفية. لاحظ أن السلالات والأنماط الظاهرية التي يجب الحفاظ عليها عن طريق الانتقاء ، أو عيوب البراز ، أو هي heterozygous ، أو لديها عيوب نمو قد لا تعمل بشكل جيد في خط الأنابيب هذا.
يسمح قياس تدفق الجسيمات الكبيرة وتصوير العينات للمستخدمين بتوثيق توزيع السكان. ويمكن استخدام مجموعة واسعة من المنصات لقياس النمو السكاني الناجح.
بالنسبة لقياسات omics القابلة للتكرار ، من المهم تنمية ثقافات متسقة. مقاييس قابلية إعادة إنتاج الثقافة هي عدد من الديدان وتوزيع حجم ثابت لسلالة معينة. نعرض توزيع العينة للسلالة المرجعية ، PD1074 - وهو متغير من سلالة N2 Bristol الأصلية ، باستخدام صور مجهر LPFC23و26 و micro confocal كوكلاء لنجاح النمو. كما تم قياس الديدان من المرحلة L1 من خلال الكبار gravid على توزيع LPFC (الشكل 5)، والتصوير اللاحق (الشكل 6)، والاختلاف في توزيع السكان عبر العينات (الشكل 7)، يمكننا أن نرى أن هذا خط أنابيب ولدت مجموعة مختلطة من المراحل من C. elegans.
لإلقاء نظرة فاحصة على التوزيع السكاني لعيناتنا المختلطة ، نظرنا إلى توزيع 35 PD1074 LSCPs من خلال النظر في نسبة الديدان التي تقع داخل كل منطقة عبر كامل وقت الرحلة(أيطول الجسم) التوزيع(الشكل 7A ، B).
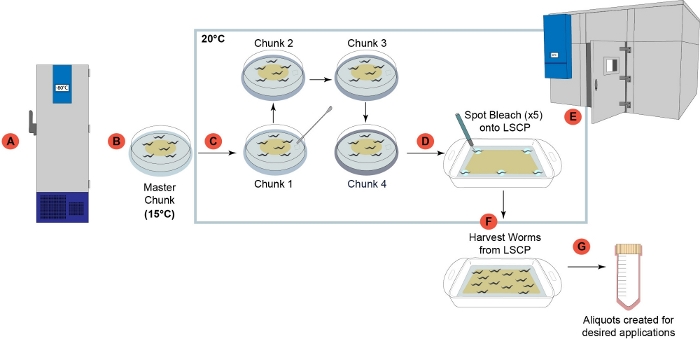
الشكل 1: نظرة عامة على خط أنابيب نمو دودة LSCP. (أ)بمجرد استلامها في المختبر، تم إعداد جميع السلالات وتجميدها للتخزين على المدى الطويل عند -80 درجة مئوية2. (ب)تم إعداد لوحة "قطعة رئيسية" من مخزون الدودة المجمدة وتخزينها في 15 درجة مئوية لاستخدامها لمدة لا تزيد عن شهر واحد. (ج)مرت كل عينة من خلال أربع خطوات متتالية قطع للحد من الإجهاد الأجيال قبل أن تنمو على LSCP. (D) تم اختيار 5 بالغين gravid الفردية من لوحة "قطعة 4" 6 سم في الخطوة (D) وبقعة ابيض على خمس مناطق معينة من LSCP. (ه) تم وضع LSCP في غرفة درجة حرارة خاضعة للرقابة ونمت في 20 درجة مئوية حتى LSCP كان مليئا الديدان الكبار، وصلت إلى حجم السكان كبيرة، وكان الحد الأدنى من البكتيريا اليسار. (واو)تم حصاد مجموعة الديدان وجمعها لخطوات المصب. (G) تم إنشاء Aliquots من LSCP وكانت فلاش المجمدة للتطبيقات المصب المطلوب. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
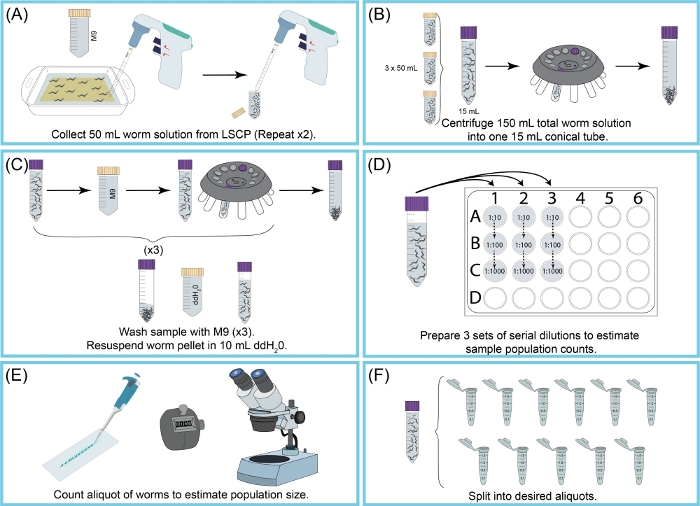
الشكل 2: نظرة عامة على حصاد ال LSCP وتقدير حجم السكان. (أ)استخدمت 50 مل من M9 لغسل الديدان من سطح NGMA. تم إدخال تعليق الدودة في أنبوب مخروطي سعة 50 مل. تكررت الخطوة (أ) مرتين. (ب) 15 مل من تعليق دودة سكب في أنبوب مخروطي 15 مل جديدة. الديدان كانت ت حبيبات بواسطة الطرد المركزي. تم يستنشق M9 + الحطام قبالة دون بيليه دودة مزعجة. تكررت الخطوة (ب) حتى تم جمع جميع 150 مل من تعليق الدودة. (ج)تم غسل بيليه الدودة والطرد المركزي ثلاث مرات مع M9 للقضاء على الحطام المتبقي. وبمجرد تنظيف العينة، أعيد إنفاق بيليه الدودة في 10 مل من ddH2O. (D) تم إنشاء تخفيف تسلسلي للعينة لتقدير حجم مجموعة الديدان. تم استخدام عامل (عوامل) التخفيف التي سمحت بالديدان ليتم عدها بدقة. تغير عامل (عوامل) التخفيف المستخدمة اعتمادا على حجم السكان من LSCP. (ه)وبمجرد اختيار عامل (ق) تخفيف، تم الأنابيب جميع الديدان من جميع التكرارات aliquot الثلاثة من هذا التخفيف على شريحة نظيفة والديدان تحت المجهر تشريح. (F)تم تقسيم العينة إلى aliquots الحجم المناسب. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
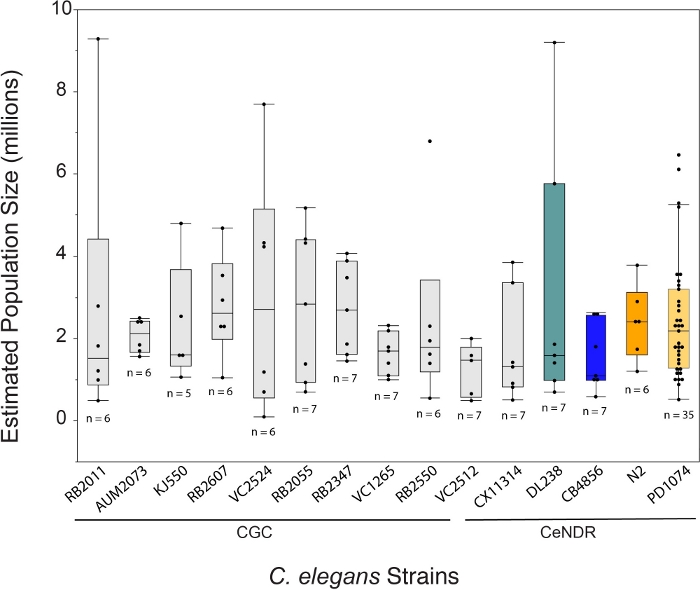
الشكل 3: تولد طريقة LSCP بمعدل سكاني يبلغ 2.4 مليون دودة مختلطة المراحل. ويسفر البرنامج عن أحجام سكانية في أصغر نمو سكاني يبلغ حوالي 500 94 نسمة، وفي أكبر نمو سكاني يبلغ نحو 000 290 9 نسمة. وكان متوسط حجم السكان في جميع السلالات 2.4 مليون دودة. الحانات تحت C. elegans أسماء سلالة تشير إلى ما إذا كانت سلالة متحولة CGC أو عزل CeNDR الطبيعية. يتم عرض حجم عينة LSCP لكل سلالة. أجريت مقارنات لجميع الأزواج باستخدام اختبار HSD من Tukey. ولم تلاحظ فروق كبيرة بين الأحجام السكانية المقدرة عبر سلالات اليغانات (F(108 14) = 0.7، ص = 0.77). تشير الأشرطة الملونة إلى شاشات الألوان القياسية لتمثيل سلالة C. elegans. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
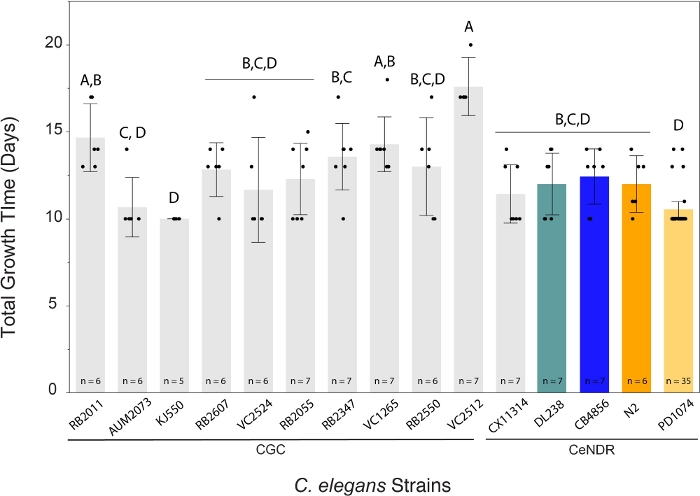
الشكل 4: ولدت طريقة LSCP مجموعات كبيرة من الديدان المختلطة في 10 - 20 يوما. نمت A C. elegans LSCP حتى كانت العينة مليئة بالديدان البالغة ، ووصلت إلى حجم سكاني كبير ، وكان لديها الحد الأدنى من العشب البكتيري المتبقي. استغرق LSCPs ما بين 10-20 يوما للنمو إلى مجموعة كاملة من المراحل المختلطة ، اعتمادا على الإجهاد. وكان متوسط وقت النمو عبر السلالات 12.2 يوما. يتم عرض حجم عينة LSCP لكل سلالة. تم إنشاء كل شريط خطأ باستخدام انحراف معياري واحد عن الوسط. مستويات غير متصلة بنفس الحرف مختلفة بشكل ملحوظ. مقارنات لجميع الأزواج باستخدام اختبار HSD من Tukey. تم العثور على فرق كبير في مقدار وقت النمو على LSCP اللازمة عبر سلالات C. elegans (F(14,108) = 8.8، ص < 0.0001*). تشير الأشرطة الملونة إلى شاشات الألوان القياسية لتمثيل سلالة C. elegans. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
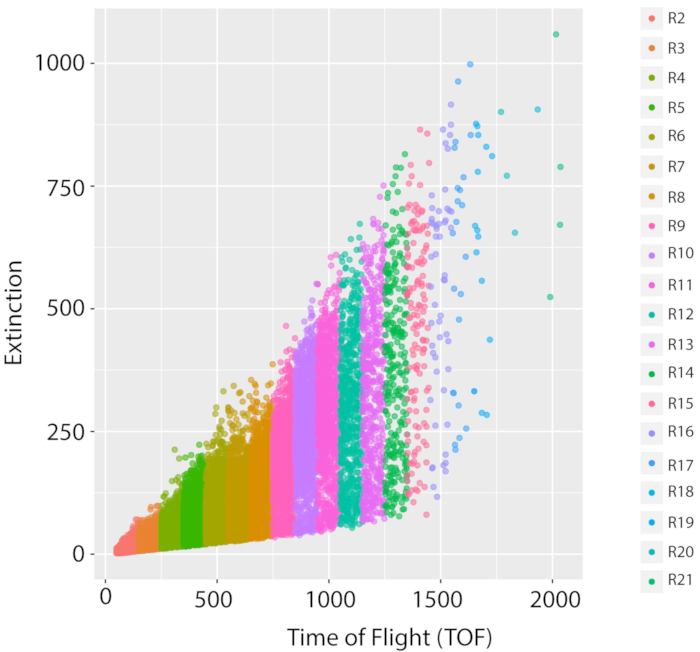
الشكل 5: قياس السكان والنمو المختلط للسلالة المرجعية البرية، PD1074. توزيع LPFC ممثل واحد نمو LSCP من سلالة مرجعية من النوع البري، وهو البديل من سلالة بريستول N2 الأصلي، (PD1074) وثائق توزيع الحجم والحدث من السكان في مرحلة مختلطة. يعرض المحور س طول (وقت الطيران، TOF) من الديدان فرزها. يعرض المحور ص الكثافة البصرية (الانقراض البصري، EXT) من الديدان فرزها. كل نقطة بيانات هو دودة التي تم توثيقها في العينة. يتم عرض كل منطقة TOF التي تم استخدامها لتحليل الصور بلون مختلف. تم إنشاء عشرين منطقة TOF (R2 - R21) تتراوح بين TOF من 50 إلى 2050. ويمكن الاطلاع على تفاصيل كل منطقة من مناطق التكميلية في الجدول 1. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
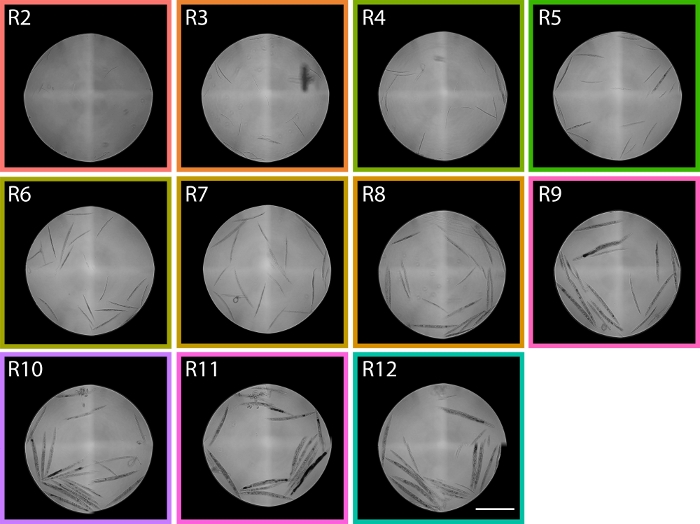
الشكل 6: تظهر صور الديدان التي تم فرزها من مناطق TOF التي تتراوح بين R2 - R12 توزيع LPFC PD1074. في المنطقة R2 ، يمكن تحديد ديدان L1 وفي المنطقة يتم تحديد البالغين الذين يغلب عليهم الجاذبية R9 ، والتي تمتد على النقيضين اليرقات التنموية مما يعطينا مناطق تقريبية ضمن توزيع مقياس التدفق الخلوي حيث من المتوقع مراحل في التوزيع. يمثل شريط المقياس 1 مم. تم التقاط صور تمثيلية من توزيع LPFC المعروض في الشكل 5، وتتوافق المربعات الملونة مع مناطق من الشكل 5. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
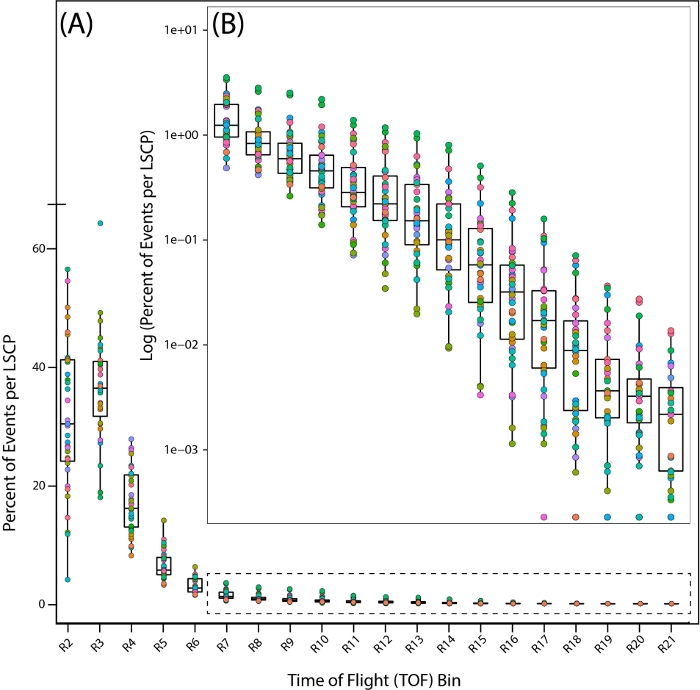
الشكل 7: التوزيع السكاني عبر مناطق وقت الطيران (TOF) في السلالة المرجعية البرية، PD1074. توزيع الديدان عبر منطقة TOF بأكملها تبين المناطق التي تم العثور فيها على الديدان. يتم تمثيل كل PD1074 LSCP كلون فردي. (أ) يعرض المحور x مناطق TOF العشرين (R2 – R21) التي تمت ملاحظتها وإحصاءها ل LSCP، مع عرض توزيع الحجم بالكامل. يظهر المحور ص النسبة المئوية للديدان من LSCP معينة التي كان حجم الجسم التي سقطت في منطقة TOF معينة. (ب)نظرا لأن جزءا صغيرا من مجموعة الديدان يقع بين مناطق R7-R21، فقد تم أخذ سجل النسبة المئوية للديدان التي تقع داخل كل منطقة لعرض التوزيع السكاني. يعرض المحور x مناطق التواف R7-R21. يعرض المحور ص سجل النسبة المئوية من الديدان من LSCP معين الذي كان حجم الجسم الذي سقط في منطقة TOF معينة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي 1: متوسط درجة الحرارة اليومية (°C) لظروف النمو التي تم بموجبها زراعة LSCP والتعامل معها. تم توثيق درجات الحرارة المبلغ عنها لغرفة درجة الحرارة الخاضعة للرقابة (CT) وجمعها على مدار فترة الستة أشهر من نمو العينة وجمعها. يتم الإبلاغ عن متوسط درجة الحرارة اليومية هنا. لم تلاحظ اختلافات كبيرة بين درجة الحرارة التي نما فيها LCSP خلال مدة المشروع (F(5,24) = 2.59، p = 0.0524). وقد امتد الفرق في درجة الحرارة بأكمله إلى ما لا يزيد عن 0.003 درجة مئوية طوال فترة الستة أشهر من نمو العينة وتوليدها. يرجى الضغط هنا لتحميل هذا الرقم.
الجدول التكميلي 1: المناطق المسورة TOF المستخدمة لفرز الديدان إلى لوحات 384 بئر للتصوير. تم إنشاء المناطق Binned لتمتد TOF من 100 في جميع أنحاء توزيع TOF من 50-2050. يمكن تغيير المناطق المسورة وتحسينها لتناسب احتياجاتك. يتم عرض كل منطقة TOF التي تم استخدامها لتحليل الصور بلون مختلف. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول التكميلي 2: قالب لوحة 384 جيدا من مناطق TOF وتكرار التخطيط. تم فرز كل عينة إلى لوحة من 384 بئرا للتصوير. تم إنشاء أربع نسخ متماثلة لكل منطقة محددة للفرز. يمكن تغيير المناطق المسورة وتحسينها لتناسب احتياجاتك. راجع الجدول التكميلي 1 لمناطق محددة مسور تم إنشاؤها واستخدامها في هذا البروتوكول. يتم عرض كل منطقة TOF التي تم استخدامها لتحليل الصور بلون مختلف. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول التكميلي 3: تحتوي سلالات اليغانات C. المستخدمة في هذا البروتوكول على خليط من سلالات CGC و CeNDR. ويرد وصف للسلالة والنمط الجيني ومصدر السلالة والتفاصيل في هذا الجدول. الرجاء الضغط هنا لتحميل هذا الجدول.
Discussion
ويمكن استخدام مجموعة متنوعة من السفن باعتبارها LSCP. في هذا البروتوكول، تم استخدام طبق خبز زجاجي قياسي. 11- وكان لمركبات LSPCs المستخدمة أبعاد خارجية تبلغ 35.56 × 20.32 سم وأبعاد داخلية تبلغ 27.94 × 17.78 سم وعمق 4.45 سم تقريبا، وتحتوي على غطاء مجهز. وهكذا ، تم تحسين كمية البكتيريا المستخدمة هنا لLSCP مع الأبعاد المذكورة أعلاه لتسفر عن عدد كبير من الديدان المختلطة المرحلة. يمكن تعديل حجم البكتيريا وتركيزها لتناسب الاحتياجات التجريبية.
التلوث عن طريق العفن والفطريات ، أو غيرها من المصادر البكتيرية يمكن أن تحدث في أي خطوة في طريقة LSCP ، لذلك التعامل مع العينات بعناية. قبل البدء في أي خطوة في البروتوكول، تأكد من تنظيف مساحة العمل بالإيثانول بنسبة 70٪ والتبييض بنسبة 10٪. إذا كان متوفرا، عالج المناطق المستخدمة بضوء الأشعة فوق البنفسجية لمدة 30 دقيقة ثم قم بتشغيل فلتر هواء HEPA لمدة 30 دقيقة قبل البدء في كل خطوة.
من خلال زراعة LSCP في وضع خاضع للرقابة(أي، في غرفة CT المحددة عند 20 درجة مئوية) ، يمكن للمستخدم تتبع نمو العينة بسهولة أكبر وتوثيق التلوث المحتمل. إذا أصبح سطح LSCP ملوثا، فإما قطع التلوث عندما يكون ذلك ممكنا والسماح للعينة بالاستمرار في النمو أو التخلص من العينة إذا لم يكن من الممكن السيطرة على التلوث. ومن الضروري التصدي للتلوث بسرعة للحد من النمو غير المرغوب فيه وضمان عدم تفوقه على الديدان في زيادة الموارد.
والمقصود من هذه الطريقة لأولئك الذين يرغبون في زراعة واسعة النطاق مختلطة السكان الثقافات من C. elegans. على الرغم من أنه قد يكون من الممكن زراعة مجموعات متزامنة من الديدان على LSCP كما فعلت على أطباق بيتري المتاحة تجاريا وفي الثقافة السائلة ، لم يختبر المؤلفون هذا الخيار. بالإضافة إلى ذلك، إذا كان المستخدمون يرغبون في زراعة أكثر من 2.4 مليون دودة تقريبا في المتوسط في عينة معينة، يوصى باستخدام طريقة مختلفة4. ويعتمد نجاح النمو على الضغط الذي يجري تجهيزه في خط الأنابيب. تمكن المؤلفون من زيادة أعداد ما يقرب من 2.4 مليون دودة بنجاح في خمس نسخ بيولوجية على الأقل من 15 سلالة من سلالات اليجان ، مما يشير إلى أن الطريقة قوية.
قبل بدء التجربة لاحظ أن عمر وصحة دودة معينة يمكن أن تؤثر على البراز ووقت النمو السكاني اللاحق. تأكد من الحفاظ على الديدان في ظروف صحية مع الحد الأدنى من الإجهاد قبل استخدامها في خط الأنابيب هذا. ومن المفترض أن عينات المخزون قد تم إنشاؤها وتجميدها والاحتفاظ بها عند -80 درجة مئوية للحد من الانجراف الوراثي مع مرور الوقت.
اعتمادا على احتياجات تجربة معينة ، يمكن تغيير عدد البالغين الذين يبدأون في LSCP. تغيير عدد البالغين الذين يبدأون gravid على LSCP سيغير معدل النمو وبالتالي الوقت للحصاد. وتستخدم خمسة البالغين gravid لزرع كل LSCP للأسباب التالية: (1) وهناك حاجة إلى طريقة بسيطة وسريعة وفعالة لزرع العديد من سلالات C. elegans على LSCPs في وقت واحد و (2) للحد من الاختلافات العمرية بين البالغين gravid اختار التي يمكن أن تؤدي إلى عدم التجانس النمو.
هذه الطريقة تسمح للمستخدم لحصاد أعداد كبيرة من الديدان مع جميع مراحل دورة الحياة الحالية. مع الأساليب الحالية المتاحة ، وجمع عينات واسعة النطاق من elegans جيم يتطلب تزامن التبييض للحصول على عدد من الديدان المطلوبة للعمل المصب. وبالنظر إلى هذا النهج، يمكن للمرء الآن أن ينمو أكبر عدد ممكن من الديدان في السابق في المخمرات أو الثقافات السائلة على نطاق واسع دون الصعوبات المرتبطة بمزامنة التبييض وخطوات المناولة المتعددة. بروتوكولنا يسمح لأحد لاستهداف سلالات من الاهتمام بكفاءة، واستخدام الحد الأدنى من وقت المناولة في زراعة العينة نفسها، وعزل مراحل من الديدان أو السكان حسب الحاجة في خطوط أنابيب المصب.
تم استخدام LPFC كأداة لتوثيق توزيع السكان وحجمها في LSCP معين. يستخدم LPFC هو نظام تدفق مستمر يقوم بتحليل الديدان وفرزها وتوزيعها استنادا إلى حجمها (TOF) والكثافة البصرية. كما دودة معينة يمر عبر خلية التدفق، وكاشف فقدان الضوء المحوري يلتقط كمية ضوء إشارة سدت بواسطة ليزر حالة 488 نانومتر الصلبة لطول الوقت الذي يستغرقه دودة لتمرير من خلال، وإعطاء المستخدم TOF والكثافة البصرية للدودة. ويمكن أيضا استخدام بصريات وأجهزة الكشف عن جمع الفلورسينس لزيادة حساسية الفلورسينس وجمعها على كل عينة. سوف تختلف معلمات جمع LPFC استنادا إلى الأداة. يمكن للمستخدمين استخدام مجموعة متنوعة من الأنظمة الأساسية لالتقاط حجم الفيروس المتنقل ولا تقتصر على استخدام هذا البروتوكول إذا لم يتوفر LPFC.
يستخدم المؤلفون عينات نمت في الطريقة الموصوفة هنا لتحديد الأيض غير معروف في سلالات مختلفة من C. elegans عبر الكروماتوغرافيا السائلة – قياس الطيف الكتلي, التحليل الطيفي NMR, وتسلسل الحمض النووي الريبي. يخطط المؤلفون لمواصلة استخدام هذه الطريقة لنمو العينات في خط الأنابيب هذا مع مجموعة متنوعة من سلالات C. elegans حيث يمكن معالجة سلالات جديدة من الاهتمام بسهولة باستخدام خط الأنابيب هذا.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
نشكر أعضاء مختبر أديسون على المناقشات المفيدة والتعليقات على هذه المخطوطة. على وجه الخصوص، ب.M غارسيا. تم توفير بعض السلالات من قبل CGC ، التي يمولها مكتب NIH لبرامج البنية التحتية للأبحاث (P40 OD010440) ، وCeNDR ، التي تمولها NSF Living Collections CSBR 1930382. تم دعم هذا العمل بمنحة من المعاهد القومية للصحة (U2CES030167).
Materials
| Name | Company | Catalog Number | Comments |
| 10 mL Sterile Serological Pipettes | VWR | 89130-898 | |
| 10 ul pipette tips | VWR | 89079-438 | |
| 100 ul pipette tips | VWR | 89079-442 | |
| 1000 mL Graduated Cylinder | VWR | 10124-380 | |
| 1000 ul pipette tips | VWR | 89079-488 | |
| 15 mL conical tubes | VWR | 89039-668 | |
| 190 Proof Ethanol | VWR | 89125-166 | |
| 2 L Wide Neck Erlenmeyer Flask | VWR | 75804-654 | |
| 50 mL conical tubes | VWR | 75874-294 | |
| Agar | Sigma | 05040-100G | |
| Agarose | Sigma | A9539-500G | |
| BVC Control G Fluid Aspiration System | Vacuubrand | ||
| Calcium Chloride | Sigma | 449709-10G | |
| Cholesterol | Sigma | C3045-25G | |
| Clorox Bleach | VWR | 89414-502 | |
| Conviron Control Temperature Room | Conviron | https://www.conviron.com/environmental-rooms | |
| Corning Low Volume 384 Well Black with Clear Flat Bottom Polystyrene TC-Treated Microplate | VWR | 89089-866 | |
| Fisher Scientific Accuspin 3R | Fisher | ||
| Flat-Bottom 24-Well Plate | VWR | 29443-952 | |
| Honeywell True HEPA Purifier 465 sq ft. | Home Depot | 204390560 | |
| HT115 E. coli (DE3) | CGC | HT115(DE3) | https://cgc.umn.edu/strain/HT115(DE3) |
| Kimwipes | VWR | 470224-038 | |
| Large Scale Culture Plate (LSCP) | Pyrex | 1090948 | Pyrex 2-quart Glass Baking Dish with Red Lid |
| Magnesium Sulfate | Sigma | C86677-25G | |
| MgSO4 | VWR | 97062-998 | |
| Microscope Plain Slides | VWR | 16004-422 | |
| Millipore Filter | Millipore | 1.11727.2500 | |
| Molecular Devices ImageXpress | Molecular Devices | Model Number:IXMConfocal | https://www.moleculardevices.com/products/cellular-imaging-systems/high-content-imaging/imagexpress-micro-confocal#gref , Authors used MetaXpress Software Version 6.5.4.532 |
| Nystatin (10mg/mL) | Sigma | N6261-25MU | |
| Peptone | Sigma | P7750-100G | |
| Petri Dishes (6 cm) | VWR | 25384-092 | |
| Pipette Controller | VWR | 613-4180 | |
| Potassium Chloride | Fisher | P217-3 | |
| Potassium Phosphate Monobasic | VWR | 0781-500G | |
| Potasssium Hydroxide | Fisher | P250-500 | |
| Red Fluroscent Microspheres | Polysciences | 19507-5 | |
| Sodium Chloride | Sigma | 746398-500G | |
| Sodium Hydroxide | Fisher | 111357 | |
| Sodium Phosphate Dibasic Anhydrous | Fisher | BP332-500 | |
| Standard Gilson Pipette Set | Gilson | FA10002M, FA10004M, FA10006M | |
| Streptomycin (100mg/mL) | Sigma | S6501-25G | |
| Union Biometrica COPAS BioSorter | Union Biometrica | https://www.unionbio.com/biosorter/ , authors used: Flow Pilot software version 1.6.1.3. |
References
- Félix, M. A., Braendle, C. The natural history of Caenorhabditis elegans. Current Biology. 20 (22), 965-969 (2010).
- Corsi, A. K. A Transparent window into biology: A primer on Caenorhabditis elegans. WormBook. , 1-31 (2015).
- Brenner, S. The genetics of behaviour. British Medical Bulletin. 29 (3), 269-271 (1973).
- Stiernagle, T. Maintenance of C. elegans. WormBook: The Online Review of C. elegans Biology. , (2006).
- Xiong, H., Pears, C., Woollard, A. An enhanced C. elegans based platform for toxicity assessment. Scientific Reports. 7 (1), 9839 (2017).
- Loer, C. M., et al. Cuticle integrity and biogenic amine synthesis in Caenorhabditis elegans require the cofactor tetrahydrobiopterin (BH4). Genetics. 200 (1), 237-253 (2015).
- Li, Y., Paik, Y. K. A potential role for fatty acid biosynthesis genes during molting and cuticle formation in Caenorhabditis elegans. BMB Reports. 44 (4), 285-290 (2011).
- Meli, V. S., Osuna, B., Ruvkun, G., Frand, A. R. MLT-10 Defines a Family of DUF644 and Proline-rich Repeat Proteins Involved in the Molting Cycle of Caenorhabditis elegans. Molecular Biology of the Cell. 21 (10), 1648-1661 (2010).
- Fritz, J. A., Behm, C. A. CUTI-1: A novel tetraspan protein involved in C. elegans CUTicle formation and epithelial integrity. PloS One. 4 (4), 5117 (2009).
- Golden, J., Riddle, D. A pheromone influences larval development in the nematode Caenorhabditis elegans. Science. 218 (4572), 578-580 (1982).
- Jeong, P. Y., et al. Chemical structure and biological activity of the Caenorhabditis elegans dauer-inducing pheromone. Nature. 433 (7025), 541-545 (2005).
- Srinivasan, J., et al. A blend of small molecules regulates both mating and development in Caenorhabditis elegans. Nature. 454 (7208), 1115-1118 (2008).
- Kaplan, F., et al. Ascaroside Expression in Caenorhabditis elegans Is Strongly Dependent on Diet and Developmental Stage. PLoS One. 6 (3), 17804 (2011).
- Golden, J., Riddle, D. A pheromone influences larval development in the nematode Caenorhabditis elegans. Science. 218 (4572), 578-580 (1982).
- Çelen, &. #. 3. 0. 4. ;., Doh, J. H., Sabanayagam, C. R. Effects of liquid cultivation on gene expression and phenotype of C. elegans. BMC Genomics. 19 (1), 562 (2018).
- Andersen, E. C., Bloom, J. S., Gerke, J. P., Kruglyak, L. A Variant in the Neuropeptide Receptor npr-1 is a Major Determinant of Caenorhabditis elegans Growth and Physiology. PLoS Genetics. 10 (2), 1004156 (2014).
- Rosenblatt, M. A central limit theorem and a strong mixing condition. Proceedings of the National Academy of Sciences. 42 (1), 43-47 (1956).
- Boyd, W. A., Smith, M. V., Freedman, J. H. Caenorhabditis elegans as a model in developmental toxicology. Methods in Molecular Biology. 889, 15-24 (2012).
- Nika, L., Gibson, T., Konkus, R., Karp, X. Fluorescent Beads Are a Versatile Tool for Staging Caenorhabditis elegans in Different Life Histories. Genes, Genomes, Genetics. 6 (7), 1923-1933 (2016).
- Denver, D. R., Morris, K., Streelman, J. T., Kim, S. K., Lynch, M., Thomas, W. K. The transcriptional consequences of mutation and natural selection in Caenorhabditis elegans. Nature Genetics. 37 (5), 544-548 (2005).
- Massie, M. R., Lapoczka, E. M., Boggs, K. D., Stine, K. E., White, G. E. Exposure to the metabolic inhibitor sodium azide induces stress protein expression and thermotolerance in the nematode Caenorhabditis elegans. Cell Stress & Chaperones. 8 (1), 1-7 (2003).
- Kevin, S., Pulak, R., Strange, K. Techniques for Analysis, Sorting, and Dispensing of C. elegans on the COPAS Flow-Sorting System. C. elegans. Methods in Molecular Biology. 351, 275-286 (2006).
- Lee, D., et al. Selection and gene flow shape niche-associated variation in pheromone response. Nature Ecology & Evolution. 3 (10), 1455-1463 (2019).
- Cook, D. E., Zdraljevic, S., Roberts, J. P., Andersen, E. C. CeNDR, the Caenorhabditis elegans natural diversity resource. Nucleic Acids Research. 45, 650-657 (2016).
- Nika, L., Gibson, T., Konkus, R., Karp, X. Fluorescent Beads Are a Versatile Tool for Staging Caenorhabditis elegans in Different Life Histories. Genes, Genomes, Genetics. 6 (7), 1923-1933 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved