Method Article
大规模混合阶段 卡诺哈布迪蒂斯电子 人种群的文化和分析
摘要
要在经济学研究中使用卡诺哈布迪炎(C.elegans),需要一种方法来生成大量蠕虫,其中单个样本可以在平台上测量以进行比较分析。在这里,提出了一种在大型文化板块(LSCPs)上培养C.elegans种群并记录人口增长的方法。
摘要
卡诺哈布迪炎(C.elegans)一直是并仍然是研究发育生物学、衰老、神经生物学和遗传学的宝贵模型有机体。大量关于C.elegans的研究使得它成为融入大量全动物研究以解剖复杂的生物成分及其与另一个生物体关系的理想候选者。为了在协作-经济学研究中使用C.elegans,需要一种方法来生成大量动物,其中单个样本可以在不同的平台上进行分解和检测,以便进行比较分析。
在这里,介绍了一种在大型文化板块(LSCP)上培养和收集大量混合阶段 C.elegans 种群的方法,以及随后的表型数据。这条管道产生足够的动物来收集表型和种群数据,以及-经济学实验(即基因组学、转录学、蛋白质组学和代谢学)所需的任何数据。此外,LSCP 方法要求对动物本身进行最少的操作,减少用户准备时间,提供严格的环境控制,并确保在整个研究过程中对每个样本的处理保持一致,以便全面可重复性。最后,介绍了在给定的LSCP中记录 C.elegans 生命阶段的人口规模和人口分布的方法。
引言
C. elegans是一种小型自由生存线虫,在世界各地各种自然栖息地被发现。其相对容易生长、快速生成时间、生殖系统和透明的身体使其成为在发育生物学、衰老学、神经生物学和遗传学2、3中被广泛研究的强大模型生物体。大量关于C.elegans的研究使得利用-经济学研究将表型与复杂的生物成分及其在给定生物体中的关系全面联系起来成为最佳候选者。
为了在协作-经济学研究中使用C.elegans,需要一种方法来产生大量的动物混合阶段种群,其中一个样本可以拆分,并跨不同的平台和仪器用于比较分析。创建生成此类样本的管道需要敏锐地了解饮食、环境、压力、人口结构以及样本处理和收集。因此,必须将标准和可重复的栽培条件纳入大型管道。在C.elegans的研究中,两种传统方法被用来培养蠕虫——阿加·佩特里菜肴和液体培养4。
从历史上看,当需要大量的C.elegan时,它们生长在液体培养中。在液体培养中产生大量蠕虫的步骤需要多个处理步骤,通常包括漂白剂同步破裂的成年角质层,释放胚胎以达到所需的种群大小。然而,当使用漂白剂同步时,人口增长取决于开始人口普查的规模,因此影响随后的增长和人口数量。此外,C. elegans菌株的皮质敏感性、暴露时间和对漂白剂同步的压力反应也各不相同,因此很难在5、6、7、8、9时检测许多菌株。
此外,液体培养中的蠕虫生长需要几个转移步骤,因为通常建议在收获前只生长一代蠕虫,因为如果生长多代,很容易出现过度拥挤,并导致尽管存在食物10的dauer形成。道尔的形成通过小信号分子(如通常被称为"dauer信息素")发生,11、12、13、14,被释放到液体介质中,影响人口的增长。此外,液体培养中大量蠕虫种群的增加会导致培养物中细菌积累过多,当下游表型检测需要清洁样本时,会产生困难。最后,当液体培养物被污染时,由于真菌孢子或细菌细胞很容易分散在媒体15中,因此更难维持。
种植 C.elegans 的另一种传统方法是在阿加·佩特里菜肴上。市售的Petry菜肴可以很容易地生长多代混合阶段蠕虫,而不会像液体培养物中那样,出现过度拥挤和高道尔形成的快速影响。然而,在传统的琼脂培养皿上,蠕虫生长的一个缺点是,最大的市售Petry菜不会产生大量的蠕虫种群进行-经济学研究,而不添加漂白剂同步步骤。总之,在阿加·佩特里菜肴上培养 C.elegans 的混合阶段种群更适合收集-经济学数据,但我们需要一种方法来产生非常大的人口规模,而无需液体培养。
在这里,我们提出了一种在大型文化板块(LSCP)上培养和收集大型混合阶段C.elegans种群的方法。通过这条管道收集样本可以产生足够的样本来收集表型和种群数据,以及-经济学实验(即基因组学、转录学、蛋白质组学和代谢学)所需的任何数据。此外,LSCP 方法要求对动物进行最少的操作,减少用户准备时间,提供严格的环境控制,并确保在整个研究过程中对每个样本的处理保持一致,以便整体可重复性。
研究方案
1. 消毒 LSCP 和设备
- 通过洗手、洗碗和随后的自动乳化来准备玻璃 LSCP,以确保玻璃器皿在开始实验前没有污染物。将自动切割的 LSCP 存放在干燥的地方,直到使用。
注意:确保 LSCP 是洗碗机和高压灭菌器的安全。确保 LSCP 盖子安全。 - 通过洗手和洗碗来准备 LSCP 盖子。将 LSCP 盖子存放在干净的垃圾箱中,直到需要为止。
- 在线虫生长介质 Agarose (NGMA) 准备的当天,用 10% 漂白液两次擦拭 LSCP 盖,然后是 70% 乙醇。一旦用10%的漂白剂和70%的乙醇擦掉,将LSCP盖子放在层压流罩的清洁箱中,准备NGMA。
2. 准备线虫生长介质阿加罗斯 (NGMA)
- 准备NGMA通过结合以下试剂到一个自动切割2 L Erlenmeyer烧瓶与搅拌板上的搅拌棒:2.5克多肽,3克纳克,7克阿加罗斯,10克阿加,和975毫升无菌水16。确保总体积等于 1 L. 将铝箔帽贴在烧瓶上。
注:此处所述NGMA的准备步骤将为2.5 LSCP提供足够的材料。该协议可根据给定实验中所需的 LSCP 批次大小进行定制。 - 在液体循环中自动编织,在 121 °C 和 21 p.s.s.i. 45 分钟。
- 打开水浴,设置为50°C。 将高压NGMA带到水浴池,冷却至50°C。
- 将 2 L Erlenmeyer NGMA 烧瓶放入引擎盖或清洁空间,并放在搅拌盘上。使用温度计跟踪 NGMA 温度。
- NGMA 达到 50 °C 后, 在发动机罩内使用无菌一次性移液器或清洁空间的顺序中添加以下几点:25 mL 1 M KH2PO4( 磷酸盐缓冲液)、1 mL 胆固醇(乙醇中 5 毫克/mL)、1 mL 1 M 卡2, 1 mL 的 1 MgSO4, 1 mL 的尼他汀 (10mg/mL) 和 1 mL 的链霉素 (100 毫克/mL)16.
- 将 400 毫升 NGMA 倒入约 1.3 厘米深的无菌玻璃 LSCP 中,使 LSCP 能够凝固在发动机罩的平面上,并将自动切割的铝箔盖放回 LSCP 上。
- 设置 agar 后,取出铝箔,并将干净的气密盖放在 LSCP 上,并移动到 4 °C 进行存储。将NGMA存储在 LSCP 中,在 4 °C 下,直到在 5 天内使用和使用。
3. 在 LSCP 上为 NGMA 生成 大肠杆菌 食物
- 为了产生稳定的食物来源,使用符合中央限量定理17的小批量平均概念生成批次的HT115(DE3)大肠杆菌。存储在 -80 °C。 当需要拉大肠杆菌库存(s)从-80°C解冻18。
注:在本协议中,大肠杆菌种群生长在生物反应器中。在文化增长结束时,文化被稀释了1:50,测得的OD600为0.4。因此,该文化有有效的OD600的20。细菌在K介质中被喷出、称重和再喷出,浓度为0.5克/mL(湿重),转移到2毫升的铝报价中,并冷冻19。
4. NGMA 上的细菌草坪
- 将 NGMA LSCP 从 4 °C 中引入室温 (RT) 几个小时,然后再将细菌草坪铺开,使整个 LSCP 能够到达 RT。
- 从-80 °C拉出所需的 大肠杆菌 库存到解冻18。
- 稀释 大肠杆菌 库存(s)与2毫升的无菌K-中等,以达到0.5克 大肠杆菌 在4毫升每NGMA LSCP。在NGMA LSCP中间小心地移液4毫升 大肠杆菌 。
- 使用无菌传播器将细菌传播到长方形中,在NGMA 大肠杆菌 边缘周围留下约3.8厘米的空间。
- 将NGMA LSCP与 大肠杆菌 一起放在发动机罩上,风扇打开1小时,以确保 大肠杆菌 悬架完全干燥。
- 一旦细菌草坪干燥,将盖子紧紧地推上,并储存在4°C,直到使用。
5. 块蠕虫,以减少不同样本的压力和年龄变化
- 从冷冻蠕虫股票到新播种的6厘米板4的条纹蠕虫。此板将用作"主块"板。
注意:块状是从同源菌株20转移蠕虫的最佳方法。如果应变是异质的,或者需要通过采摘和交配来维持,则不建议进行分块。根据使用的蠕虫基因型、为生长选择的温度和下游步骤,可能需要优化分块频率。 - 主块板充满健康的大肠杆菌成人(约3天),并有足够的大肠杆菌草坪仍然存在后,按照标准C.elegans分块指南,如蠕虫书所述,产生四个总块板4。
- 除非指定用于生长,否则所有块板存放在受控温度 (CT) 室中,温度为 20 °C。
注意:如果此协议的用户无法访问此处描述的 CT 室,则建议使用可控制温度的小型孵化器或可尽可能控制环境条件的指定房间。如果这两种替代选项都没有,请注意样本增长的变化可能更大。 - 一旦观察到许多贪图成人在第4 块板,移动到步骤6。
6. 斑点漂白青金成人到 Lscp
注意:这种漂白技术用于根除大多数污染物和溶解从成年蠕虫中释放胚胎的草本植物的角质层。漂白液将在胚胎孵化前浸泡到NGMA中。
- 在发现漂白蠕虫之前, 将 Lsp 带到 Rt 几个小时。
- 准备 7:2:1 的比例 ddH2O : 漂白剂 : 5 M NaOH.使这种碱性次氯酸盐溶液在使用前新鲜。
注意:在给定实验期间使用相同库存的漂白剂和 NaOH,以避免漂白剂批次影响。本协议中使用的漂白剂为5-10%次氯酸钠。 - 点燃一个邦森燃烧器,在继续之前点燃蠕虫采摘。从 LSCP 的细菌草坪边缘将新鲜大 肠杆菌 铲入无菌采摘物上。
- 从第 4 块板中挑选一个单一的 gravid 成人进行点漂白。
- 碱性次氯酸盐溶液的 Pipette 5μL 进入 LSCP 的一角,远离 大肠杆菌 草坪。
- 将采摘的格拉维德成人放入 5 μL 碱性次氯酸盐溶液中。点击线虫,帮助扰乱皮质层并释放卵子。
- 重复步骤6.4-6.6共4倍,并放置5个gravid成人均匀地围绕 大肠杆菌 草坪。从同一块 板中挑选所有 5 个贪图成人,以确保几乎基因同源个体被添加到给定样本中。
- 将盖子放回 LSCP 上。
- 重复所有 LSCP 的步骤。
7. 控制温度 (CT) 室中的蠕虫生长
- 点漂白后,将盖子紧紧放在 LSCP 上,放在 CT 室中,设置为 20 °C,气流恒定,12L:12D 光片(12 h 光和 12 h 黑暗)。
- 注意样品放在CT室的时间和位置。
注意:应始终记录房间内的位置,以记录样品在生长过程中可能遇到的任何环境差异。样品一旦进入CT室,应不受干扰地留在指定位置。不要打开 CT 室 LSCP 的盖子,以减少污染的机会。 - 将 LSCP 带到 CT 室外的显微镜,观察人口增长和密度。
注意:每个 C. elegans 菌株和样品的生长情况会有所不同,因此密切监测样品。虽然建议在 CT 室期间不要干扰 LSCP 的生长,但 LSCP 被运出 CT 室,每 2 天打开一次盖子,以监测样本增长。每 2 天取下 LSCP 的密封盖子还允许 O2 流入 LSCP。 - 在收获之前,确保LSCP已经变得充满大量的蠕虫。使用以下标准来决定是否准备收集 LSCP。
- 确保 LSCP 充满青蚕成人蠕虫。
- 确保板包含大量种群大小 (即 蠕虫覆盖整个 agar 表面)。
- 确保板面上没有很多鸡蛋(即应孵化的最大蠕虫数量)。
- 确保板有极小到没有 大肠杆菌 左,表明蠕虫将饿死,并产生道尔幼虫,如果留在盘子上额外的两天。
注:虽然大多数 LSCP 都准备在 10 到 20 天内收获,但根据菌株和样品,在制定此协议以确定正常收获时间时,会经常检查每个 LSCP。
- 处理 LSCP 之间使用 70% 乙醇的清洁手套和面积,以避免菌株之间的交叉污染。
8. 采集 LSCP 样本
- 打开,让离心机冷却到4°C之前收获样品。
- 准备三个 50 mL 圆锥管,每个 LSCP 的 M9 溶液为 50 mL,以便收获。
- 每个 LSCP 标记一个 15 mL 圆锥形管。
注意:所有离心步骤均在 15 mL 圆锥管中执行,因为蠕虫往往在这些管中颗粒良好。 - 将 50 毫升 M9 溶液(从步骤 8.2 中的一根 50 mL 圆锥形管)倒入 LSCP 表面并旋转,以确保 M9 覆盖整个 NGMA 表面。
- 当 M9 位于 LSCP 表面时,用 M9 充值无菌血清学移液器。
注意:通过用M9启动无菌血清移液器,可以确保更少的蠕虫粘附在塑料移液器内部,防止样品丢失。 - 倾斜 LSCP,使 M9 和蠕虫群聚集在 LSCP 的一个角落。
注:LSCP 的 M9 溶液和蠕虫的混合物将称为下游步骤中的"蠕虫悬架"。 - 使用带自动移液器的引信血清管,将移液器蠕虫悬架放入原来的 50 mL 锥形管中。收集50mL的蠕虫悬架后,将圆锥管放在摇动器上,以破坏细菌团块和碎屑。
- 重复步骤 8.4 - 8.7 收集每个 LSCP 150 mL 的蠕虫悬架。
- 通过倒入步骤 8.3 中预留的标记 15 mL 圆锥管,从三个 50 mL 圆锥管之一转移 15 mL 的蠕虫悬架。离心机15 mL圆锥管在884 x g 1分钟在4°C。 大多数蠕虫会在管子底部颗粒。
- 吸气超自然,确保不打扰蠕虫颗粒。
- 继续将大约 13 mL 的蠕虫悬架添加到相同的 15 mL 锥形管中,重复步骤 8.9 和 8.10,直到消耗所有 150 mL 的蠕虫悬架。倒置管子,在离心机之间搅动颗粒,以尽可能多地清洗和吸气细菌和碎屑。
注:在此步骤中,所有三个 50 mL 圆锥管的内容都浓缩在一个 15 mL 管中。 - 将 10 mL 的清洁 M9 添加到 15 mL 锥形管中,并通过倒置搅拌蠕虫颗粒。离心机15 mL圆锥管在884 x g 1分钟在4°C。 吸气超自然,确保不打扰蠕虫颗粒。重复两次。
注意:如果样品中含有大量碎屑或细菌,请重复步骤 8.12,直到样品清洁。 - 样品清洁后,将ddH2O添加到蠕虫颗粒中,共10毫升ddH2O和蠕虫。通过倒置来搅拌蠕虫颗粒。快速进入步骤 9.1,因为蠕虫必须在 ddH2O 中停留 5 分钟或更短,以避免渗透应激。
注意:在ddH2O中悬浮蠕虫颗粒是下游-微观步骤的首选溶剂。蠕虫可以悬挂在其他溶剂或缓冲器中,如果它们与给定的实验工作流兼容。
9. 估计人口规模
注意:快速通过步骤9.1-9.7。步骤 8.13 中的 ddH2O 和蠕虫的混合物在随后的步骤中称为"蠕虫样本"。
- 在管道处理蠕虫样本之前,与 M9 一起使用优质移液器尖端,以避免蠕虫粘附在塑料移液器内部,防止样品丢失并减少计数变化。
- 取一个100μL的蠕虫样本,稀释成900μL的M9。混合好,进行连续稀释(1:10,1:100,1:1000)。重复此步骤两次,以实现总共三套阿里报价复制。
注意:管道蠕虫可导致样本数量的高变异性。在管道化所需的音素之前,确保蠕虫样本是同质的。 - 将 15 mL 圆锥管设置在摇动器上,以在计算阿里报价时继续移动文化。
- 确保蠕虫样本混合良好且均匀。1:10 蠕虫样本中的 Pipette 5 μL,将其分配到显微镜幻灯片上,并计算蠕虫的数量。如果此数字小于大约 50 蠕虫,则也计算 1:100 和 1:1000 稀释。如果超过 50,则移动到下一个序列稀释。
注意:如果无法准确计算过多蠕虫,请使用下一个序列稀释来计数。 - 计算每个稀释的每个音标复制3倍。在计数结束时,对于大多数文化,将记录 9 个总计数(即每个阿里报价复制的 3 个总计数)。
- 平均稀释计数,以确定蠕虫样本的估计种群大小。这些稀释计数将决定为 -omics 步骤创建所需的阿里报价大小所需的蠕虫样本量。
注:在这个实验中,产生了大约200,000个混合阶段蠕虫的引号。此外,还预留了约50,000个混合阶段蠕虫的一个单数,用于在大粒子流细胞仪中排序(在第10步中描述)。 - 一旦蠕虫样本被分割成适当的元素,在液氮中闪光冻结,并将样品储存在-80°C。
注意:不要冻结用于大粒子流动细胞测量的单体报价。
10. (可选) 大粒子流细胞测量准备样本
注:步骤10、11和12是作者记录样本增长(即C.elegans生命周期阶段的人口规模和人口分布)并确定文化成功的首选方法。此协议的用户可以用自己的增长成功指标替换可选步骤 10、11 和 12。第 10、11 和 12 步在这里描述有两个原因:首先,拥有步骤 10、11 和 12 中使用的设备的用户可以复制这些步骤:其次,显示此增长方法的验证。以上步骤 9 提供了对蠕虫总数的良好估计,以确定阿里报价大小,第 10 步是一个更量化的指标,以估计特定样本中蠕虫的数量和种群分布。
- 在 M9 解决方案中,将大约 50,000 个混合阶段蠕虫(在第 9.6 步中预留)的音量调高至 10 mL。
- 制作由1毫克/mL 大肠杆菌 和1:50稀释0.5μM红色荧光微球19组成的溶液。
- 在 M9 中的 10 mL 混合阶段蠕虫中加入 200 μL 的此解决方案,并在摇动 20 分钟时孵化。
- 20分钟后,离心机在884 x g 的15mL圆锥管在4°C下1分钟。
- 吸气超自然,确保不打扰蠕虫颗粒。
- 用M9溶液清洗蠕虫颗粒两次,以消除多余的细菌和红色荧光微球。
- 在蠕虫颗粒中加入 5 mL 的 M9,并确保颗粒看起来干净。如果颗粒是干净的,添加5mL的M9与50m钠阿齐德既拉直和杀死蠕虫的准确计数和大小21。
- 记录在样品中加入阿齐德钠的时间和日期。
- 将样品放在摇动器上,直到需要大粒子流细胞测量。
注意:已知阿齐德钠会影响线虫生理(即体长、新陈代谢和热耐受性)。因此,必须注意蠕虫接触钠阿齐德的时间,因为许多这些生理影响发生在几分钟22。由于已知的阿齐德钠对蠕虫的生理影响,这种治疗将影响下游图像质量,应予以考虑。
11. (可选) 记录人口分布和准备 384 井板进行成像
注:第 11 步使用大粒子流细胞仪 (LPFC)。本协议假定了LPFC的基本知识。可以替代其他方法记录样本的增长和人口分布。此处记录的步骤是针对计划在其管道中使用 LPFC23的用户。
- 打开,清洁和充血LPFC,并允许激光加热1小时之前排序样品。
- 激光加热后,打开"直方图"轮廓,并扩展到2050年的飞行时间(TOF)。
- 将条形区域添加到"直方图"中,范围为 100。第一个酒吧区域覆盖 50-150 的 TOF。
- 继续创建 20 个条形区域,每个区域涵盖 100 个 TOF 范围。这些酒吧区域将涵盖整个 TOF 范围从 50 - 2050。有关跨 TOF 分布使用的确切封闭区域,请参阅补充表 1。
- 保存此直方图设置为"实验",以在未来的LPFC运行中使用。
- 选择校准的 384 井板或校准仪器到 384 井板,以分配对象进入。
- 一旦进入校准的 384 井板模板,设置模板,将 20 个门控对象分配到四个井中(每个门控区域的四个技术复制品),用于步骤 11.3-4 期间创建的 20 个条形区域中的每一个。请参阅 补充表 2, 例如如何将蠕虫分配到 384 井板中的布局。
- 将样品从步骤 10.9 转移到 50 mL 圆锥管中,并添加额外的 M9 解决方案,以实现约 40 mL 的总体积。
- 开始根据步骤 11.7 设置的参数自动排序样品,同时连续搅拌样品以防止沉降,同时将样品中的对象分配到校准的 384 井板中。
注意:确保LPFC的流量在每秒15-20个对象之间运行,并且指定没有要排序的双倍。 - 一旦对整个样品进行分类,并将最大数量的门控区域分配到 384 井板中,将样品从 LPFC 和清洁仪器中取出。
注意:当到达较大的 TOF 区域时,由于 TOF 区域的事件计数较低,继续填充 384 井板可能会变得具有挑战性。填写尽可能多的封闭区域,以便在样本用完之前,更好地了解 C. elegans 生命阶段在 LPFC 分布中的位置。 - 将密封膜放在 384 井板的顶部,直到成像。
注:图像板在分类后尽快进行排序,因为样品用22钠处理。根据每个排序对象发射的红色荧光水平,可以在收集的LPFC数据文件(即输出文本文件中的PH红色数据)中看到红色荧光微球,以帮助识别哪些物体是活蠕虫、死蠕虫、dauers或垃圾24。
12. (可选) 成像 384 井板
注:第12步使用板读微孔显微镜。本协议假定了微型共焦显微镜的基本知识。可以替代其他方法记录样本的增长和人口分布。
- 使用带 20 倍镜头的板读微孔显微镜。
- 打开"目标和相机"选项卡,并设置为"10倍计划阿波兰巴达"模式。
- 打开"相机绑定"选项卡并设置为"2"。
- 打开"板上访问网站"选项卡,并设置为"每井4个"站点和"重叠站点 10%",以便以后拼接图像。
- 打开"波长"选项卡,并设置为"光明场1"。
- 打开"照明"选项卡,设置为"传输光,亮样"。
- 将384井板放在显微镜中,将"Z堆栈"设置为"计算偏移",并找到384井板样品的适当焦距平面。
- 运行微孔显微镜上的 384 井板,每口井收集四张图像。
- 蒙太奇将四个图像拼凑在一起,每口井创建一个图像。
结果
使用 LSCP 方法生长的C. elegans在 12.2 天内平均每个样本产生大约 240 万种混合阶段蠕虫。使用 LSCP 方法的C. elegans的生长使用户能够生成大量C. elegans的混合阶段种群,而很少处理和操纵动物,这是大规模经济学研究的理想选择(图 1)。一旦 LSCP 变得充满成人蠕虫,达到大种群规模,并且细菌数量极少,用户就可以收获和估计种群规模。这一点还可以通过评估人口是否足以用于-omics管道(图2)作为质量控制。人口动态取决于菌株本身、菌株的行为(即挖洞菌株往往具有较低的蠕虫恢复率)和生长成功(即污染)。LSCP方法在15株含有卡诺哈布迪炎遗传学中心(CGC)突变体和卡诺哈布迪蒂斯埃莱甘斯自然多样性资源(CeNDR)野生菌株25的混合物的C.elegans上进行了测试。应变基因型在补充表 3中描述。
LSCP方法产生的人口规模从大约94 500人增加到9 290 000人。参考菌株PD1074和跨菌株的平均种群规模约为240万蠕虫(图3)。在平均12.2 LSCP生长日(图4)的过程中,C.elegans菌株之间的估计种群数量没有显著差异。PD1074 LSCP花了10-14天的时间才增长到一个完整的混合阶段人口。整个PD1074的平均增长时间为10天。生长最慢的菌株最多生长20天,增长最快的菌株最多生长10天(图4)。
因此,使用这种 LSCP 方法,用户可以轻松地将新的兴趣菌株集成到对开发时机和背景专业知识知之甚少的研究中。请注意,必须通过采摘来维持的菌株和表型,有生育缺陷,是异质的,或有生长缺陷,可能不能很好地工作在这个管道中。
大粒子流细胞测量和样品成像允许用户记录人口分布。 各种平台可用于衡量成功的人口增长。
对于可重复的-经济学测量,重要的是要发展一致的文化。培养可重复性的指标是蠕虫的数量和给定菌株的一致大小分布。我们展示了参考菌株 PD1074 的样本分布 - 原始 N2 布里斯托尔菌株的变种,使用 LPFC23、26和微共焦显微镜图像作为生长成功的代理。由于蠕虫是从L1阶段通过500万成年人在LPFC分布(图5),随后的成像(图6)和在样本(图7)的人口分布的变化,我们可以看到,这条管道产生了C.elegans的混合阶段种群。
为了仔细观察混合阶段样本的人口分布情况,我们通过查看整个飞行时间 (TOF) (即身体长度) 分布中每个区域中蠕虫百分比(图 7A,B)来观察 35 PD1074 LSCP 的分布情况。
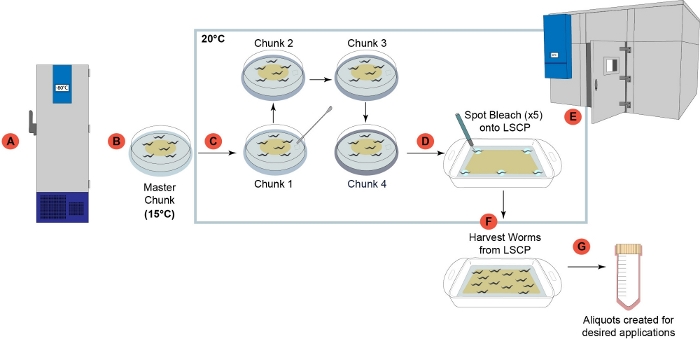
图1:LSCP蠕虫生长管道概述。(A) 一旦在实验室收到,所有菌株都准备和冷冻,长期储存在-80°C2。(B) 从冷冻蠕虫库存中准备了一块"主块"板,储存在15°C,使用时间不超过一个月。(C) 每个样本在 LSCP 上生长之前,连续经历了四个分块步骤,以减轻代压。( D ) 从步骤(D)中的"块 4" 6 厘米板中挑选 5 个单独的格拉维德成人,并在 LSCP 的 5 个给定区域进行漂白。(E) LSCP 被放置在控制温度室中,生长在 20 °C,直到 LSCP 充满成人蠕虫,达到大种群规模,细菌数量最少。(F) 虫群被收获并收集到下游步骤。(G) 阿里报价是从 LSCP 创建的,并用于下游所需的应用被冻结。 请单击此处查看此图的较大版本。
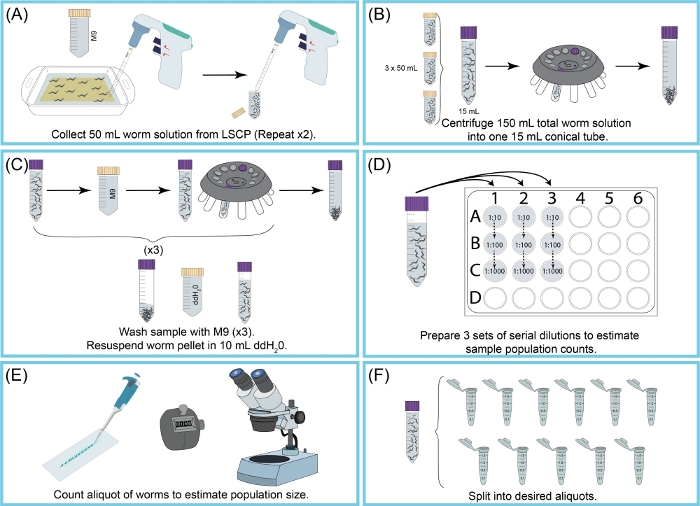
图2:LSCP收获和估计人口规模概述。(A) 50 mL 的 M9 用于从 NGMA 表面清洗蠕虫。蠕虫悬架被管道放入50mL圆锥管中。步骤 (A) 重复了两次。(B) 15 mL 的蠕虫悬架被倒入新的 15 mL 圆锥管中。蠕虫被离心机撬动。M9+碎片在没有干扰蠕虫颗粒的情况下被吸走。步骤 (B) 重复,直到收集所有 150 mL 的蠕虫悬架。(C) 用M9清洗和离心三次,以消除残留的碎片。样品清洁后,蠕虫颗粒在 ddH2O(D)的 10 毫升中重新喷出,并创建样本的连续稀释以估计蠕虫种群大小。使用了稀释因子,使蠕虫能够准确计数。使用的稀释因子根据 LSCP 的人口大小而变化。(E) 一旦选择稀释因子,稀释的所有三种稀释复制品的所有蠕虫都被吹到干净的滑梯上,蠕虫在解剖显微镜下计数。(F) 样本被分成适当大小的别名。 请单击此处查看此图的较大版本。
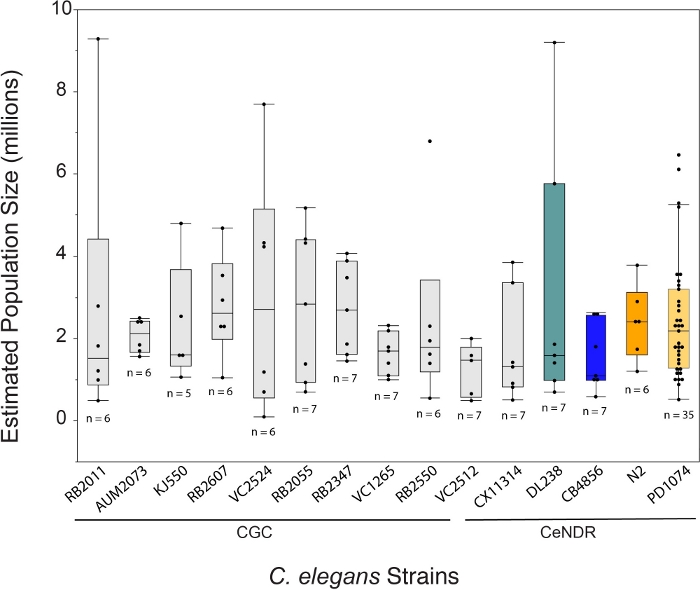
图3:LSCP方法平均产生240万混合阶段蠕虫。LSCP 的人口规模最小,约为 94,500 人,人口增长率最大,约为 9,290,000 人。所有菌株的平均种群规模为240万蠕虫。C. elegans菌株名称下方的条形表示菌株是 CGC 突变体还是 CeNDR 自然分离物。显示每个菌株的 LSCP 样本大小。使用 Tukey 的 HSD 测试对所有对进行了比较。C. elegans菌株(F (14,108) = 0.7,p = 0.77)的估计种群大小之间没有显著差异。 彩色条表示各自C. elegans应变表示的标准颜色显示。请单击此处查看此图的较大版本。
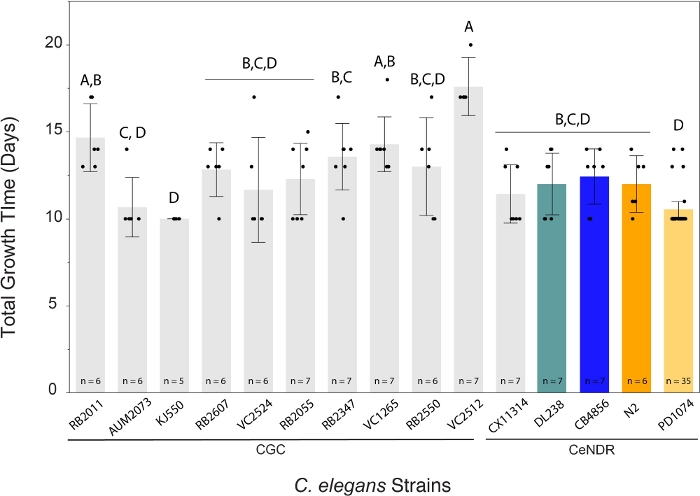
图4:LSCP方法在10-20天内产生大量蠕虫混合阶段种群。给定的C. elegans LSCP 生长,直到样本中充满成人蠕虫,达到大种群规模,并且留下的细菌草坪最少。LSCP需要10-20天的时间才能增长到完全的混合阶段人口,这取决于压力。整个菌株的平均生长时间为12.2天。显示每个菌株的 LSCP 样本大小。每个错误栏都是使用 1 个标准偏差构建的。同一字母未连接的水平明显不同。使用图基 HSD 测试对所有对进行比较。C. elegans菌株 (F (14,108) = 8.8,p < 0.0001*)所需的 LSCP 生长时间存在显著差异。 彩色条表示各自C. elegans应变表示的标准颜色显示。请单击此处查看此图的较大版本。
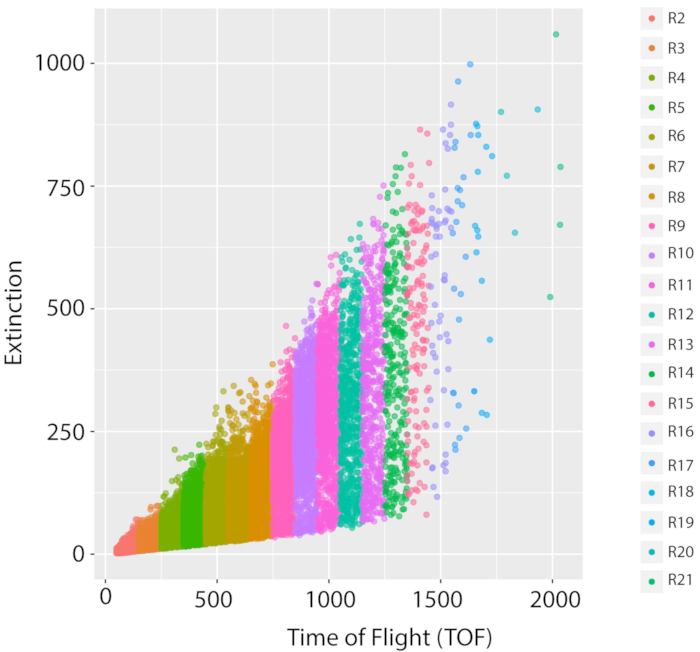
图5:野生型参考菌株PD1074的混合种群和生长测量。野生型参考菌株(原始 N2 布里斯托尔菌株的变种)的一种 LSCP 增长具有代表性的 LPFC 分布,记录了混合阶段种群的大小分布和事件计数。x 轴显示排序蠕虫的长度(飞行时间、TOF)。y 轴显示已排序蠕虫的光学密度(光学灭亡、EXT)。每个数据点都是样本中记录的蠕虫。用于图像分析的每个 TOF 区域都以不同的颜色显示。创建了20个托福区域(R2–R21),从50到2050年不等。每个 TOF 区域的详细信息可在补充表 1 中找到。 请单击此处查看此图的较大版本。
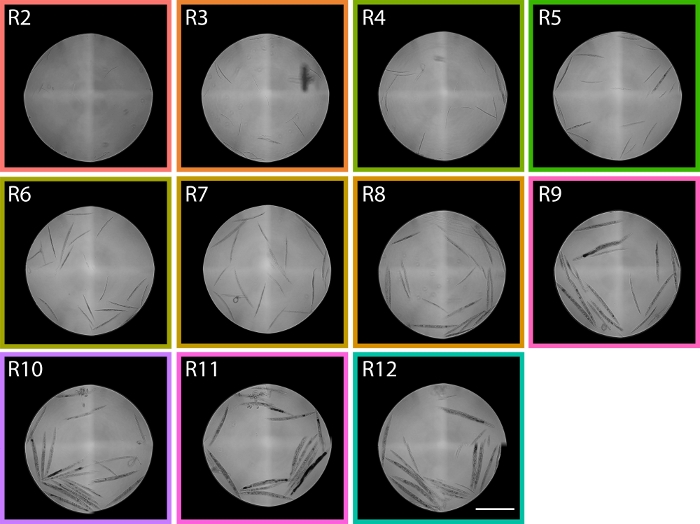
图6:从R2-R12等 TOF区域排序的蠕虫图像显示了PD1074 LPFC分布。在区域 R2 中,可以识别 L1 蠕虫,在区域 R9 中,主要识别成年虫,跨越两个发育幼虫极端,使我们在流细胞仪分布中大致区域,即分布中预计阶段。比例栏表示 1 mm。代表性图像取自 图5中显示的LPFC分布,彩色框与 图5中的区域相对应。 请单击此处查看此图的较大版本。
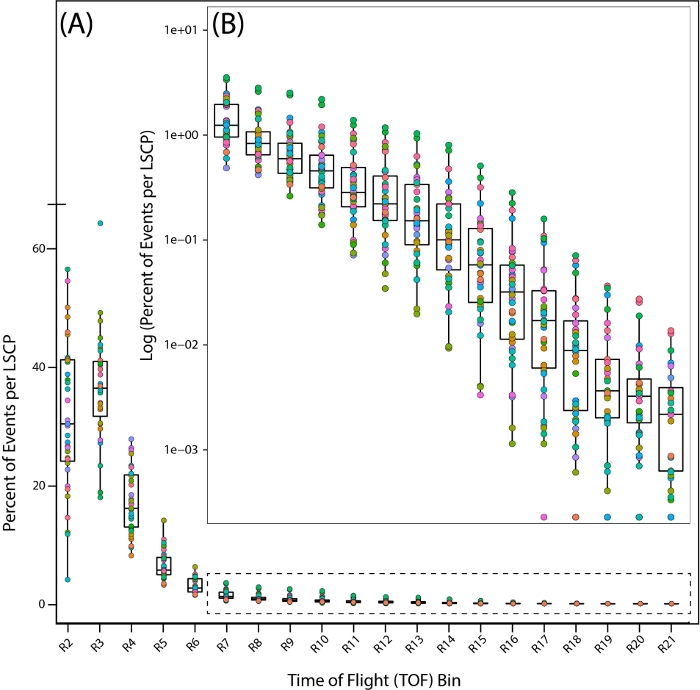
图7:野生型参考菌株PD1074中飞行时间(TOF)区域的人口分布。蠕虫在整个 TOF 区域的分布显示发现蠕虫的区域。每个 PD1074 LSCP 都表示为单个颜色。(A) x 轴显示观察到并计算 LSCP 的 20 个 TOF 区域 (R2 – R21),显示整个大小分布。y 轴显示来自特定 LSCP 的蠕虫百分比,该蠕虫的体型属于给定的 TOF 区域。(B) 由于蠕虫种群的一小部分落在R7-R21区域之间,因此需要记录每个区域内蠕虫的百分比,以显示种群分布。x 轴显示 R7-R21 TOF 区域。y 轴显示特定 LSCP 中蠕虫百分比的日志,该蠕虫的体型属于给定 TOF 区域。 请单击此处查看此图的较大版本。
补充图1:生长和处理 LSCP 的生长条件的平均日温度 (°C)。报告的受控温度 (CT) 室的温度记录并在整个样品生长和收集的六个月跨度内收集。这里报告了日平均气温。在项目期间LCSP增长的温度(F(5,24) = 2.59,p = 0.0524)之间未发现显著差异。 在整个样品生长和生成的六个月持续时间内,整个温差不超过 0.003 °C。请单击此处下载此图。
补充表1:用于将蠕虫分类到384井板进行成像的 TOF 封闭区域。 从50-2050年起,在整个 TOF 分布中,创建了 100 个绑定区域。门控区域可以更改和优化,以满足您的需求。用于图像分析的每个 TOF 区域都以不同的颜色显示。 请单击此处下载此表。
补充表2:TOF区域的384井板模板和复制布局。 每个样本被分类成384井板进行成像。为选择排序的每个区域创建了四个复制品。门控区域可以更改和优化,以满足您的需求。有关在此协议中创建和使用的特定门控区域,请参阅补充表 1。用于图像分析的每个 TOF 区域都以不同的颜色显示。 请单击此处下载此表。
补充表3:本协议中使用的 C.elegans 菌株含有CGC和CeNDR菌株的混合物。 此表中描述了应变、基因型、应变源和详细信息。 请单击此处下载此表。
讨论
各种船只可用作 LSCP。在此协议中,使用了标准玻璃烤盘。使用的 LSC 的外部尺寸为 35.56 x 20.32 厘米,内部尺寸为 27.94 x 17.78 厘米,深约 4.45 厘米,并配有合适的盖子。因此,这里使用的细菌量已优化为具有上述尺寸的 LSCP,以产生大量混合阶段蠕虫。细菌体积和浓度可以调整,以满足实验需要。
霉菌、真菌或其他细菌源的污染可能发生在 LSCP 方法的任何步骤中,因此要小心处理样品。在开始协议的任何步骤之前,请确保用 70% 乙醇和 10% 漂白剂清洁工作空间。如有,请用紫外线处理使用区域 30 分钟,并在开始每个步骤前 30 分钟打开 HEPA 空气过滤器。
通过在受控设置(即在 20 °C 的 CT 室中)中增长 LSCP,用户可以更轻松地跟踪样本的增长并记录潜在的污染。如果 LSCP 表面受到污染,请尽可能消除污染,如果污染无法控制,则让样品继续生长或丢弃样品。必须迅速解决污染问题,以减少不必要的增长,并确保它不会在资源方面胜过蠕虫。
这种方法是为那些谁想要发展大规模的混合人口文化 的C.elegans。虽然有可能像在市售的培养皿和液体培养物上那样,在LSCP上增加同步的蠕虫种群,但作者尚未测试这一选项。此外,如果用户希望在给定样本中平均生长超过 240 万蠕虫,则建议采用其他方法4。增长的成功取决于正在处理的压力。作者成功地在至少5个 15C.elegans 菌株的生物复制品中培育出大约240万只蠕虫,表明该方法是强大的。
在开始实验之前,需要注意的是,特定蠕虫的年龄和健康会影响体型和随后的人口增长时间。确保蠕虫在使用此管道之前保持健康,应力最小。假设库存样本已被创建、冷冻并保存在 -80 °C,以减少遗传漂移。
根据给定实验的需要,LSCP 上的开始受试成人的数量可以更改。改变LSCP上开始育成的成年人的数量将改变增长率,从而改变收获的时间。五个贪图的成年人被用来播种每个LSCP的原因如下:(1) 一种简单,快速和有效的方法,种子许多 C.elegans 菌株到LSCP一次是必要的:(2)以减少年龄差异的草根成人选择,可能导致生长异质性。
这种方法允许用户收获大量具有所有生命周期阶段的蠕虫。根据现有方法,收集大规模 C.elegans 样本需要漂白剂同步,以获得下游工作所需的蠕虫数量。鉴于这种方法,人们现在可以在发酵器或大型液体培养物中尽可能多地生长蠕虫,而不会遇到与漂白剂同步和多个处理步骤相关的困难。我们的协议允许人们有效地瞄准利益菌株,在生长样品本身时使用最少的处理时间,并根据下游管道中需要隔离蠕虫或种群的阶段。
利用LPFC作为工具,记录特定LSCP中的人口分布和规模。使用的LPFC是一个连续流动系统,根据蠕虫的大小(TOF)和光学密度分析、分类和分配蠕虫。当给定蠕虫穿过流动细胞时,轴向光损失探测器捕获了被 488 nm 固态激光阻断的信号光量,以延长蠕虫通过的时间长度,从而使用户获得蠕虫的 TOF 和光学密度。荧光收集光学和探测器还可用于最大限度地提高每个样品的荧光灵敏度和收集量。LPFC 收集参数将因仪器而异。用户可以使用各种平台来捕获蠕虫大小,如果 LPFC 不可用,则不限于使用此协议。
作者使用此处描述的方法中生长的样本,通过液相色谱学 -质谱学、NMR光谱学和RNA测序,识别各种 丙烯 酸盐菌株中的未知代谢物。作者计划继续使用这种方法在这条管道中用各种 C.elegans 菌株生长样品,因为新的感兴趣菌株可以很容易地使用这条管道进行处理。
披露声明
作者没有什么可透露的。
致谢
我们感谢爱迪生实验室的成员对这份手稿的有益讨论和反馈;特别是B.M加西亚一些菌株由国家卫生研究院研究基础设施项目办公室(P40 OD010440)和CENDR提供,后者由NSF生活收藏CSBR 1930382资助。这项工作得到了国家卫生研究院(U2CES030167)的资助。
材料
| Name | Company | Catalog Number | Comments |
| 10 mL Sterile Serological Pipettes | VWR | 89130-898 | |
| 10 ul pipette tips | VWR | 89079-438 | |
| 100 ul pipette tips | VWR | 89079-442 | |
| 1000 mL Graduated Cylinder | VWR | 10124-380 | |
| 1000 ul pipette tips | VWR | 89079-488 | |
| 15 mL conical tubes | VWR | 89039-668 | |
| 190 Proof Ethanol | VWR | 89125-166 | |
| 2 L Wide Neck Erlenmeyer Flask | VWR | 75804-654 | |
| 50 mL conical tubes | VWR | 75874-294 | |
| Agar | Sigma | 05040-100G | |
| Agarose | Sigma | A9539-500G | |
| BVC Control G Fluid Aspiration System | Vacuubrand | ||
| Calcium Chloride | Sigma | 449709-10G | |
| Cholesterol | Sigma | C3045-25G | |
| Clorox Bleach | VWR | 89414-502 | |
| Conviron Control Temperature Room | Conviron | https://www.conviron.com/environmental-rooms | |
| Corning Low Volume 384 Well Black with Clear Flat Bottom Polystyrene TC-Treated Microplate | VWR | 89089-866 | |
| Fisher Scientific Accuspin 3R | Fisher | ||
| Flat-Bottom 24-Well Plate | VWR | 29443-952 | |
| Honeywell True HEPA Purifier 465 sq ft. | Home Depot | 204390560 | |
| HT115 E. coli (DE3) | CGC | HT115(DE3) | https://cgc.umn.edu/strain/HT115(DE3) |
| Kimwipes | VWR | 470224-038 | |
| Large Scale Culture Plate (LSCP) | Pyrex | 1090948 | Pyrex 2-quart Glass Baking Dish with Red Lid |
| Magnesium Sulfate | Sigma | C86677-25G | |
| MgSO4 | VWR | 97062-998 | |
| Microscope Plain Slides | VWR | 16004-422 | |
| Millipore Filter | Millipore | 1.11727.2500 | |
| Molecular Devices ImageXpress | Molecular Devices | Model Number:IXMConfocal | https://www.moleculardevices.com/products/cellular-imaging-systems/high-content-imaging/imagexpress-micro-confocal#gref , Authors used MetaXpress Software Version 6.5.4.532 |
| Nystatin (10mg/mL) | Sigma | N6261-25MU | |
| Peptone | Sigma | P7750-100G | |
| Petri Dishes (6 cm) | VWR | 25384-092 | |
| Pipette Controller | VWR | 613-4180 | |
| Potassium Chloride | Fisher | P217-3 | |
| Potassium Phosphate Monobasic | VWR | 0781-500G | |
| Potasssium Hydroxide | Fisher | P250-500 | |
| Red Fluroscent Microspheres | Polysciences | 19507-5 | |
| Sodium Chloride | Sigma | 746398-500G | |
| Sodium Hydroxide | Fisher | 111357 | |
| Sodium Phosphate Dibasic Anhydrous | Fisher | BP332-500 | |
| Standard Gilson Pipette Set | Gilson | FA10002M, FA10004M, FA10006M | |
| Streptomycin (100mg/mL) | Sigma | S6501-25G | |
| Union Biometrica COPAS BioSorter | Union Biometrica | https://www.unionbio.com/biosorter/ , authors used: Flow Pilot software version 1.6.1.3. |
参考文献
- Félix, M. A., Braendle, C. The natural history of Caenorhabditis elegans. Current Biology. 20 (22), 965-969 (2010).
- Corsi, A. K. A Transparent window into biology: A primer on Caenorhabditis elegans. WormBook. , 1-31 (2015).
- Brenner, S. The genetics of behaviour. British Medical Bulletin. 29 (3), 269-271 (1973).
- Stiernagle, T. Maintenance of C. elegans. WormBook: The Online Review of C. elegans Biology. , https://www.ncbi.nlm.nih.gov/books/NBK19649/ (2006).
- Xiong, H., Pears, C., Woollard, A. An enhanced C. elegans based platform for toxicity assessment. Scientific Reports. 7 (1), 9839(2017).
- Loer, C. M., et al. Cuticle integrity and biogenic amine synthesis in Caenorhabditis elegans require the cofactor tetrahydrobiopterin (BH4). Genetics. 200 (1), 237-253 (2015).
- Li, Y., Paik, Y. K. A potential role for fatty acid biosynthesis genes during molting and cuticle formation in Caenorhabditis elegans. BMB Reports. 44 (4), 285-290 (2011).
- Meli, V. S., Osuna, B., Ruvkun, G., Frand, A. R. MLT-10 Defines a Family of DUF644 and Proline-rich Repeat Proteins Involved in the Molting Cycle of Caenorhabditis elegans. Molecular Biology of the Cell. 21 (10), 1648-1661 (2010).
- Fritz, J. A., Behm, C. A. CUTI-1: A novel tetraspan protein involved in C. elegans CUTicle formation and epithelial integrity. PloS One. 4 (4), 5117(2009).
- Golden, J., Riddle, D. A pheromone influences larval development in the nematode Caenorhabditis elegans. Science. 218 (4572), 578-580 (1982).
- Jeong, P. Y., et al. Chemical structure and biological activity of the Caenorhabditis elegans dauer-inducing pheromone. Nature. 433 (7025), 541-545 (2005).
- Srinivasan, J., et al. A blend of small molecules regulates both mating and development in Caenorhabditis elegans. Nature. 454 (7208), 1115-1118 (2008).
- Kaplan, F., et al. Ascaroside Expression in Caenorhabditis elegans Is Strongly Dependent on Diet and Developmental Stage. PLoS One. 6 (3), 17804(2011).
- Golden, J., Riddle, D. A pheromone influences larval development in the nematode Caenorhabditis elegans. Science. 218 (4572), 578-580 (1982).
- Çelen, İ, Doh, J. H., Sabanayagam, C. R. Effects of liquid cultivation on gene expression and phenotype of C. elegans. BMC Genomics. 19 (1), 562(2018).
- Andersen, E. C., Bloom, J. S., Gerke, J. P., Kruglyak, L. A Variant in the Neuropeptide Receptor npr-1 is a Major Determinant of Caenorhabditis elegans Growth and Physiology. PLoS Genetics. 10 (2), 1004156(2014).
- Rosenblatt, M. A central limit theorem and a strong mixing condition. Proceedings of the National Academy of Sciences. 42 (1), 43-47 (1956).
- Boyd, W. A., Smith, M. V., Freedman, J. H. Caenorhabditis elegans as a model in developmental toxicology. Methods in Molecular Biology. 889, 15-24 (2012).
- Nika, L., Gibson, T., Konkus, R., Karp, X. Fluorescent Beads Are a Versatile Tool for Staging Caenorhabditis elegans in Different Life Histories. Genes, Genomes, Genetics. 6 (7), 1923-1933 (2016).
- Stiernagle, T. Maintenance of C. elegans. , Available from: http://www.wormbook.org/chapters/www_strainmaintain/strainmaintain.html (2020).
- Denver, D. R., Morris, K., Streelman, J. T., Kim, S. K., Lynch, M., Thomas, W. K. The transcriptional consequences of mutation and natural selection in Caenorhabditis elegans. Nature Genetics. 37 (5), 544-548 (2005).
- Massie, M. R., Lapoczka, E. M., Boggs, K. D., Stine, K. E., White, G. E. Exposure to the metabolic inhibitor sodium azide induces stress protein expression and thermotolerance in the nematode Caenorhabditis elegans. Cell Stress & Chaperones. 8 (1), 1-7 (2003).
- Kevin, S., Pulak, R. Techniques for Analysis, Sorting, and Dispensing of C. elegans on the COPAS Flow-Sorting System. C. elegans. Methods in Molecular Biology. Strange, K. 351, Humana Press. 275-286 (2006).
- Lee, D., et al. Selection and gene flow shape niche-associated variation in pheromone response. Nature Ecology & Evolution. 3 (10), 1455-1463 (2019).
- Cook, D. E., Zdraljevic, S., Roberts, J. P., Andersen, E. C. CeNDR, the Caenorhabditis elegans natural diversity resource. Nucleic Acids Research. 45, 650-657 (2016).
- Nika, L., Gibson, T., Konkus, R., Karp, X. Fluorescent Beads Are a Versatile Tool for Staging Caenorhabditis elegans in Different Life Histories. Genes, Genomes, Genetics. 6 (7), 1923-1933 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。