Method Article
תרבות ו Assay של בקנה מידה גדול מעורב שלב Caenorhabditis אוכלוסיות אלגנים
In This Article
Summary
כדי להשתמש ב- Caenorhabditis elegans (C. elegans) במחקר omics, יש צורך בשיטה כדי ליצור אוכלוסיות גדולות של תולעים שבהן ניתן למדוד מדגם יחיד על פני פלטפורמות לניתוחים השוואתיים. כאן מוצגת שיטה לתרבות C. elegans אוכלוסיות על לוחות תרבות בקנה מידה גדול (LSCPs) ולתעד את גידול האוכלוסייה.
Abstract
Caenorhabditis elegans (C. elegans) היה ונשאר אורגניזם מודל בעל ערך ללמוד ביולוגיה התפתחותית, הזדקנות, נוירוביולוגיה, וגנטיקה. גוף העבודה הגדול על C. elegans הופך אותו למועמד אידיאלי להשתלב באוכלוסיה גדולה, מחקרים בבעלי חיים שלמים כדי לנתח את המרכיבים הביולוגיים המורכבים ואת היחסים שלהם עם אורגניזם אחר. על מנת להשתמש C. elegans במחקר שיתוף פעולה -omics, שיטה נדרשת כדי ליצור אוכלוסיות גדולות של בעלי חיים שבו מדגם אחד ניתן לפצל ו assayed על פני פלטפורמות מגוונות לניתוחים השוואתיים.
כאן, שיטה לתרבות ולאסוף אוכלוסיית C. elegans מעורבת בשפע על צלחת תרבות בקנה מידה גדול (LSCP) ונתונים פנוטיפיים הבאים מוצגים. צינור זה מניב מספר מספיק של בעלי חיים כדי לאסוף נתונים פנוטיפיים ואוכלוסייה, יחד עם כל הנתונים הדרושים לניסויים -omics (כלומר, גנומיקה, transcriptomics, פרוטאומיקה, ו metabolomics). בנוסף, שיטת LSCP דורשת מניפולציה מינימלית לבעלי החיים עצמם, פחות זמן הכנה למשתמש, מספקת בקרה סביבתית הדוקה, ומבטיחה כי הטיפול בכל מדגם עקבי לאורך כל המחקר לשחזור כולל. לבסוף, מוצגות שיטות לתיעוד גודל האוכלוסייה והתפלגות האוכלוסין של שלבי החיים של C. elegans ב- LSCP נתון.
Introduction
C. elegans הוא נמטודה קטנה וחיה חופשית שנמצאת ברחבי העולם במגוון בתי גידול טבעיים1. קלות הצמיחה היחסית שלה, זמן הייצור המהיר, מערכת הרבייה והגוף השקוף הופכים אותה לאורגניזם מודל רב עוצמה שנחקר רבות בביולוגיה התפתחותית, הזדקנות, נוירוביולוגיה וגנטיקה2,3. העבודה השופעת על C. elegans הופכת אותו למועמד עיקרי להשתמש במחקרים -omics לקשר באופן מקיף פנוטיפים עם רכיבים ביולוגיים מורכבים ואת מערכות היחסים שלהם באורגניזם נתון.
כדי להשתמש ב- C. elegans במחקר שיתופי-omics, יש צורך בשיטה כדי ליצור אוכלוסיות מעורבות גדולות של בעלי חיים שבהן ניתן לפצל מדגם יחיד ולהשתמש בו בפלטפורמות ובכלים מגוונים לניתוחים השוואתיים. יצירת צינור כדי ליצור מדגם כזה דורש מודעות חדה של דיאטה, סביבה, מתח, מבנה האוכלוסייה, טיפול מדגם ואיסוף. לכן, חיוני לשלב תנאי פולחן סטנדרטיים וניתן לשחזור בצינורות בקנה מידה גדול. במחקר C. elegans, שתי שיטות מסורתיות משמשות תולעי תרבות - מנות אגר פטרי ותרבות נוזלית4.
מבחינה היסטורית, כאשר יש צורך בכמויות גדולות של C. elegans, הם גדלים בתרבות נוזלית4. השלבים הכרוכים ביצירת אוכלוסייה גדולה של תולעים בתרבות הנוזלית דורשים צעדי טיפול מרובים הכוללים לעתים קרובות סנכרון אקונומיקה לקרע קוטיקלים למבוגרים, שחרור עוברים כדי להשיג את גודל האוכלוסייה הרצוי. עם זאת, כאשר נעשה שימוש בסנכרון אקונומיקה, גידול האוכלוסייה תלוי בגודל מפקד האוכלוסין ההתחלתי, ולכן משפיע על הגידול הבא ועל מספרי האוכלוסייה. בנוסף, זני C. elegans משתנים ברגישותם לקוטיקלים, זמן החשיפה ותגובת הלחץ לסנכרון אקונומיקה ומקשה על בדיקת זנים רבים בכל פעם5,6,7,8,9.
בנוסף, צמיחת תולעים בתרבות הנוזלית דורשת כמה שלבי העברה שכן לעתים קרובות מומלץ לגדל רק דור אחד של תולעים לפני הקציר כי צפיפות יכולה להתרחש בקלות אם גדל במשך דורות רבים ולהוביל היווצרות דאור למרות נוכחותו של מזון10. היווצרות דאואר מתרחשת באמצעות מולקולות איתות קטנות כגון ascarosides, המכונה לעתים קרובות "dauer פרומונים"11,12,13,14, משתחררים לתוך התקשורת הנוזלית להשפיע על הגידול של האוכלוסייה. יתר על כן, גידול אוכלוסיות תולעים גדולות בתרבות הנוזלית מוביל להצטברות חיידקים עודפת בתרבות, ויוצר קשיים כאשר יש צורך במדגם נקי למטעני פנוטיפים במורד הזרם. לבסוף, כאשר תרבות נוזלית הופכת מזוהמת, קשה יותר לשמור כמו נבגים פטרייתיים או תאים חיידקיים מפוזרים בקלות ברחבי התקשורת15.
השיטה המסורתית האחרת של גידול C. elegans היא על מנות אגר פטרי. מנות פטרי הזמינות מסחרית מאפשרות לגדל בקלות דורות רבים של תולעים מעורבות ללא ההשפעות המהירות של צפיפות יתר ויצירת דאואר גבוהה כפי שניתן לראות בתרבויות נוזליות. עם זאת, חיסרון לגידול תולעים על מנות אגר פטרי מסורתיות הוא כי צלחת פטרי זמינה מסחרית הגדולה ביותר אינה מניבה אוכלוסיות תולעים גדולות למחקר -omics מבלי להוסיף בשלב סנכרון אקונומיקה. לסיכום, יצירת אוכלוסיות מעורבות של C. elegans על מנות אגר פטרי מתאימה יותר לאיסוף נתוני אומיקים, אך דרשנו שיטה ליצירת גדלי אוכלוסייה גדולים מאוד ללא פולחן נוזלי.
כאן, אנו מציגים שיטה לתרבות ולאסוף אוכלוסיות גדולות מעורב שלב C. elegans על צלחות תרבות בקנה מידה גדול (LSCP). איסוף דגימות דרך צינור זה מניב מספיק מדגם כדי לאסוף נתונים פנוטיפיים ואוכלוסייה, יחד עם כל הנתונים הדרושים לניסויים -omics (כלומר,גנומיקה, תעתיקים, פרוטאומיקה, ו metabolomics). בנוסף, שיטת LSCP דורשת מניפולציה מינימלית של בעלי החיים, פחות זמן הכנה למשתמש, מספקת בקרה סביבתית הדוקה, ומבטיחה כי הטיפול בכל מדגם עקבי לאורך כל המחקר לשחזור הכולל.
Protocol
1. לעקר LSCP וציוד
- הכן LSCPs זכוכית על ידי שטיפת ידיים, ואחריו שטיפת כלים, ו autoclaving הבאים כדי להבטיח כלי זכוכית הוא ללא מזהמים לפני תחילת הניסוי. יש לאחסן LSCPs אוטומטיים במיקום יבש ונקי עד לשימוש.
הערה: ודא שרכיבי LSCP הם מדיח כלים ובטוחים למובלעות אוטומטיות. ודאו שמכסי LSCP בטוחים למדיח כלים. - הכן מכסי LSCP על ידי שטיפת ידיים ואחריו שטיפת כלים. אחסן מכסי LSCP בסל נקי עד לצורך.
- ביום Nematode צמיחה מדיה Agarose (NGMA) הוא prepped, לנגב מכסי LSCP עם 10% פתרון אקונומיקה פעמיים, ואחריו 70% אתנול. לאחר ניגוב עם 10% אקונומיקה ו 70% אתנול, לשמור על מכסי LSCP בסל נקי במכסה המנוע זרימה למינאר שבו NGMA יהיה מוכן.
2. הכן אגרוז מדיה צמיחה נמטודה (NGMA)
- הכן NGMA על ידי שילוב של ריאגנטים הבאים לתוך בקבוקון autoclaved 2 L Erlenmeyer עם בר ערבוב על צלחת ערבוב: 2.5 גרם פפטון, 3 גרם NaCl, 7 גרם agarose, 10 גרם אגר, ו 975 מ"ל מים סטריליים16. ודא שהנפח הכולל שווה ל- 1 L. קלטת כובע נייר כסף לבקבוק.
הערה: שלבי ההכנה עבור NGMA כמתואר כאן יניבו מספיק חומר עבור 2.5 LSCPs. ניתן להתאים את הפרוטוקול לגודל האצווה הדרוש של LSCP בניסוי נתון. - אוטוקלאב על מחזור נוזלי ב 121 מעלות צלזיוס ו 21 p.s.i. במשך 45 דקות.
- הפעל את אמבט המים והגדיר ל 50 מעלות צלזיוס. מביאים את ה-NGMA האוטומטי לאמבט המים כדי להתקרר ל-50 מעלות צלזיוס.
- מביאים 2 L בקבוקון Erlenmeyer של NGMA לתוך מכסה המנוע או שטח ניקה להגדיר על צלחת ערבוב. השתמש במדחום כדי לעקוב אחר טמפרטורת NGMA.
- לאחר NGMA הגיע 50 °C (69 °F), להוסיף את הדברים הבאים בסדר המפורטים עם פיפטה חד פעמית סטרילית בתוך מכסה המנוע או שטח ניקה: 25 מ"ל של 1 M KH2PO4 (מאגר פוספט K), 1 מ"ל של כולסטרול (5mg / mL באתנול), 1 מ '1 M CaCl2, 1 מ"ל של 1 M MgSO4, 1 מ"ל של נייסטטין (10 מ"ג / מ"ל), ו 1 מ"ל של סטרפטומיצין (100 מ"ג / מ"ל)16.
- יוצקים 400 מ"ל של NGMA לתוך LSCP זכוכית סטרילית, כ 1.3 ס"מ עמוק, לאפשר LSCP להתמצק על משטח שטוח במכסה המנוע ומניחים את מכסה רדיד autoclaved בחזרה על LSCP.
- לאחר agar מוגדר, להסיר את רדיד אלומיניום, ומניחים מכסה אוויר נקי הדוק על LSCP ולעבור 4 מעלות צלזיוס לאחסון. יש לאחסן NGMA ב-LSCPs ב-4°C עד לשימוש תוך 5 ימים.
3. צור מזון E. coli עבור NGMA על LSCP
- כדי ליצור מקור מזון יציב, ליצור אצוות של HT115 (DE3) E. coli באמצעות אצווה קטנה ממוצע מושג עולה בקנה אחד עם משפט הגבול המרכזי17. יש לאחסן ב-80°C. בעת הצורך למשוך E. coli מניות חיידקים מ -80 מעלות צלזיוס כדי להפשיר18.
הערה: בפרוטוקול זה, מניות חיידקי E. coli גדלו בביוריאקטור. בסוף הצמיחה התרבותית, התרבות הייתה מדוללת 1:50, ואת ODנמדד 600 היה 0.4. לכן, לתרבות היה OD יעיל600 מתוך 20. חיידקים היו pelleted, שקל, resuspended ב K בינוני בריכוז של 0.5 גרם / מ"ל (משקל רטוב), הועבר לתוך 2 aliquots מ"ל, ו קפוא19.
4. מדשאה חיידקית על NGMA
- הבא LSCPs NGMA מתוך 4 °C (70 °F) לטמפרטורת החדר (RT) במשך כמה שעות לפני הפצת הדשא חיידקי כדי לאפשר LSCP כולו להגיע RT.
- לשלוף את המניות חיידקי E. coli צורך מ -80 מעלות צלזיוס כדי להפשיר18.
- לדלל E. coli מניות חיידקים עם 2 מ"ל של K-בינוני סטרילי כדי להשיג 0.5 גרם E. coli ב 4 מ"ל לכל LSCP NGMA. בזהירות פיפטה 4 מ"ל של E. coli באמצע LSCP NGMA.
- השתמש מפזר סטרילי להפיץ חיידקים לתוך מלבן משאיר כ 3.8 ס"מ של מקום סביב הקצוות של NGMA E. coli חינם.
- השאירו את ה-NGMA LSCP עם E. coli במכסה המנוע עם המאוורר למשך שעה כדי להבטיח שהשעיית ה-E. coli תתייבש לחלוטין.
- לאחר הדשא חיידקי יבש, לדחוף את המכסה על בחוזקה ולאחסן ב 4 מעלות צלזיוס עד לשימוש.
5. נתח תולעים כדי להפחית מתח ושונות גיל על פני דגימות
- תולעים פס ממלאי תולעת קפוא לצלחת 6 ס"מ זרעים לאחרונה4. צלחת זו תשמש צלחת "נתח הורים".
הערה: קיבוץ הוא שיטה אופטימלית להעברת תולעים מזן הומוזיגי20. אם זן הוא heterozygous או צריך להיות מתוחזק על ידי קטיף והזדווגות, קיבוץ לא מומלץ. ייתכן שיהיה צורך למטב את תדירות הקיבוץ בהתאם לגנוטיפים של התולעת שבהם נעשה שימוש, לטמפרטורה שנבחרה לצמיחה ולשלבים במורד הזרם. - לאחר צלחת נתח הורים מלא מבוגרים gravid בריא (כ 3 ימים) עם שפע של מדשאת E. coli עדיין נוכח, בצע את ההנחיות סטנדרטיות C. elegans קיבוץ כמתואר WormBook לייצר ארבע צלחות נתח הכולל4.
- יש לאחסן את כל לוחות הנתחים בטמפרטורה מבוקרת (CT) בטמפרטורה של 20°C, אלא אם צוין אחרת לצמיחה.
הערה: אם למשתמשים בפרוטוקול זה אין גישה לחדר CT כמתואר כאן מומלץ להשתמש באינקובטור קטן שבו ניתן לשלוט בטמפרטורה או בחדר ייעודי שבו ניתן לשלוט בתנאי הסביבה ככל האפשר. אם אף אחת מהאפשרויות החלופיות הללו אינה זמינה, שים לב ששינוי בצמיחת המדגם עשוי להיות גדול יותר. - לאחר מבוגרים gravid רבים נצפו בצלחת נתח4, לעבור לשלב 6.
6. הלבנת ספוט מבוגרים מגרדים על LSCP
הערה: טכניקת הלבנה זו משמשת למיגור רוב המזהמים ולהמיס את הקוטיקולה של הרמפרודיטים המשחררים עוברים מהתולעת הבוגרת. תמיסת האקונומיקה תספוג לתוך ה-NGMA לפני שהעוברים יבקעו.
- הביאו את ה-LSCPs ל-RT מספר שעות לפני ההלבנה.
- הכן יחס 7:2:1 של ddH2O : אקונומיקה : 5 M NaOH. הפוך פתרון היפוכלוריט אלקליין זה טרי ממש לפני השימוש.
הערה: השתמש באותו מלאי של אקונומיקה ו NaOH לאורך כל משך הניסוי נתון כדי למנוע השפעות אצווה אקונומיקה. אקונומיקה בשימוש בפרוטוקול זה היה 5-10% hypochlorite נתרן. - הדליקו מבער בונזן והבעירו בחר תולעת לפני שתמשיך. סקופ טרי E. coli על לבחור סטרילי מקצה המדשאה החיידקית על LSCP.
- בחרו מבוגר אחד מצלחת הנתחהרביעית להלבנת כתמים.
- פיפטה 5 μL של פתרון היפוכלוריט אלקליין לפינה אחת של LSCP הרחק מדשאת E. coli.
- מניחים את המבוגר gravid הרים לתוך פתרון היפוכלוריט אלקליין 5 μL. הקש על nematode כדי לעזור לשבש את הקוטיקל ולשחרר ביצים.
- חזור על שלבים 6.4 - 6.6 עבור סך של 4x ומניחים 5 מבוגרים gravid באופן שווה סביב מדשאת E. coli. בחרו את כל 5 המבוגרים המחוספים מאותה צלחת נתח4 כדי להבטיח שאנשים כמעט גנטית יתווספו לדגימה נתונה.
- הנח את המכסה בחזרה על LSCP.
- חזור על שלבים עבור כל ה- LSCPs.
7. צמיחת תולעת בטמפרטורה מבוקרת (CT) חדר
- לאחר הלבנת נקודה, מניחים את המכסה בחוזקה על LSCP ומניחים בחדר CT מוגדר 20 מעלות צלזיוס עם זרימת אוויר קבועה ו photoperiod 12L:12D (12 שעות אור וחושך 12 שעות).
- שים לב לזמן ולמיקום שבהם המדגם הוצב בחדר CT.
הערה: יש לתעד תמיד את המיקום בתוך החדר כדי לתעד את כל ההבדלים הסביבתיים שדגימות שעלולות להיתקל בהן בעת הגידול. ברגע שהדגימה נמצאת בחדר CT, היא צריכה להישאר במקום שהוקצה לה באין מפריע. אין לפתוח את המכסה של LSCP בחדר CT כדי להקטין את הסיכוי לזיהום. - קח את LSCP למיקרוסקופ, מחוץ לחדר CT, כדי לבחון את גידול האוכלוסייה וצפיפות.
הערה: כל זן מדגם C. elegans ישתנה בצמיחה שלה, כך לפקח על דגימות מקרוב. אמנם מומלץ לא להפריע לצמיחה של LSCP בעוד בחדר CT, LSCPs הועברו מחדר CT ומכסים נפתחו כל 2 ימים כדי לפקח על צמיחת המדגם. לוקח את העפעפיים אטומים את LSCPs כל 2 ימים גם מאפשר O2 לזרום לתוך LSCP. - לפני הקציר להבטיח כי LSCP הפך מלא של אוכלוסייה גדולה של תולעים. השתמש בקריטריונים הבאים כדי להחליט אם LSCP מוכן לאיסוף.
- ודא שה-LSCP מלא בתולעים בוגרות.
- ודא שהצלחת מכילה גודל אוכלוסייה גדול (כלומר, תולעים מכסות את כל פני השטח של האגר).
- ודא כי הצלחת אין ביצים רבות על פני השטח של אגר(כלומר,המספר המרבי של תולעים צריך לבקוע).
- ודא כי הצלחת יש מינימלי עד לא E. coli עזב, המציין כי התולעים יגוועו ברעב וליצור זחלים דאור אם נשאר על הצלחת במשך יומיים נוספים.
הערה: למרות שרוב LSCPs מוכנים לקצור בין 10 ל 20 ימים, בהתאם למתח ודגימה, לבדוק כל LSCP לעתים קרובות עם הקמת פרוטוקול זה כדי לקבוע את זמני הקציר הרגילים.
- כפפות נקיות ואזור עם 70% אתנול בין טיפול LSCPs כדי למנוע זיהום צולב בין זנים.
8. קצירת מדגם LSCP
- הפעל ולאפשר צנטריפוגה להתקרר ל 4 מעלות צלזיוס לפני קצירת דגימות.
- הכן שלושה צינורות חרוט 50 מ"ל עם 50 מ"ל של פתרון M9 לכל LSCP להיות שנקטפו.
- תווית אחת 15 מ"ל צינור חרוט לכל LSCP.
הערה: כל שלבי הצנטריפוגה מבוצעים בצינור חרוט 15 מ"ל, כי תולעים נוטות גלולה היטב בצינורות אלה. - יוצקים 50 מ"ל של פתרון M9 (מצינור חרוט אחד של 50 מ"ל בשלב 8.2) על פני השטח של LSCP ומסתחררים סביב כדי להבטיח ש- M9 יכסה את כל משטח ה- NGMA.
- בעוד M9 יושב על פני השטח LSCP, ראש פיפטה סרולוגית סטרילית עם M9.
הערה: על ידי priming פיפטה סרולוגית סטרילית עם M9 זה מבטיח כי פחות תולעים מקל לחלק הפנימי של פיפטה פלסטיק, מניעת אובדן מדגם. - הטה את LSCP כך M9 ואוכלוסיית התולעת לאסוף בפינה אחת של LSCP.
הערה: התערובת של פתרון M9 ותולעים מן LSCP ייקרא "השעיית תולעת" בשלבים במורד הזרם. - באמצעות פיפטה סרולוגית מוכנה עם פילטר אוטומטי, השעיית תולעת פיפטה ומניחים בצינור החרוט המקורי של 50 מ"ל. לאחר איסוף 50 מ"ל של השעיית תולעת, מניחים את הצינור החרוט על נדנדה כדי לשבש גושי חיידקים ופסולת.
- חזור על שלבים 8.4 - 8.7 איסוף 150 מ"ל של השעיית תולעת לכל LSCP.
- העבר 15 מ"ל של השעיית תולעת, מאחד משלושת צינורות חרוט 50 מ"ל, על ידי שפיכה לתוך צינור חרוט 15 מ"ל שכותרתו בצד בשלב 8.3. צנטריפוגה הצינור חרוט 15 מ"ל ב 884 x גרם במשך 1 דקות ב 4 מעלות צלזיוס. רוב התולעים יהיה גלולה בתחתית הצינור.
- לשאוף את supernatant להבטיח לא להפריע גלולת התולעת.
- המשך להוסיף כ 13 מ"ל של השעיית תולעת לאותו צינור חרוט 15 מ"ל חוזר על שלבים 8.9 ו 8.10 עד כל 150 מ"ל של השעיית תולעת נצרכים. להפוך את הצינור ולהפריע גלולה בין צנטריפוגות לשטוף ולשאוף את חיידקים ופסולת רבים ככל האפשר.
הערה: בשלב זה, התוכן מכל שלושת צינורות חרוט 50 מ"ל מרוכזים בצינור יחיד 15 מ"ל. - הוסף 10 מ"ל של M9 נקי לצינור חרוט 15 מ"ל ולהתסיס את גלולת התולעת על ידי היפוך. צנטריפוגה הצינור חרוט 15 מ"ל ב 884 x גרם במשך 1 דקות ב 4 מעלות צלזיוס. לשאוף את supernatant להבטיח לא להפריע גלולת התולעת. חזור על הפעולה פעמיים.
הערה: אם יש כמות גדולה של פסולת או חיידקים במדגם, לחזור על שלב 8.12 עד המדגם נקי. - לאחר המדגם נקי, להוסיף ddH2O גלולה תולעת עבור סך של 10 מ"ל של ddH2O ותולעים. להתסיס את גלולת התולעת על ידי היפוך. לעבור במהירות לשלב 9.1, כמו תולעים חייב להישאר ddH2O במשך 5 דקות או פחות, כדי למנוע מתח אוסמוטי.
הערה: השעיית כדורי תולעת ב- ddH2O הוא הממס המועדף עבור צעדים במורד הזרם -omics. תולעים יכולות להיות מושעות בממסים או מאגרים אחרים אם הם תואמים לזרימת עבודה ניסיונית נתונה.
9. הערכת גודל האוכלוסייה
הערה: עבור בין שלבים 9.1 – 9.7 במהירות. התערובת של ddH2O ותולעים משלב 8.13 מכונה "דגימת תולעת" בשלבים הבאים.
- לפני pipetting מדגם התולעת, קצה פיפטה הממשלה לשמש עם M9, כדי למנוע תולעים נדבק לחלק הפנימי של פיפטה פלסטיק מניעת אובדן מדגם והפחתת וריאציה ספירה.
- קח 100 μL aliquot של דגימת תולעת לדלל אותו לתוך 900 μL של M9. מערבבים היטב ולעשות דילול סדרתי (1:10, 1:100, 1:1000). חזור על שלב זה פעמיים כדי להשיג סך של שלוש קבוצות של עותקים משוכפלים aliquot.
הערה: צנרת תולעים עלולה לגרום לשונות גבוהה בספירת האוכלוסיה לדוגמה. ודא כי דגימת התולעת היא הומוגנית לפני pipetting aliquot הרצוי. - הגדר את הצינור חרוט 15 מ"ל על נדנדה להמשיך לנוע תרבות בעוד aliquots נספרים.
- ודאו שדגימת התולעת מעורבת היטב והומוגנית. פיפטה 5 μL מדגימת תולעת 1:10, לוותר עליו על שקופית מיקרוסקופיה, ולספור את מספר התולעים. אם מספר זה הוא פחות מ 50 תולעים, אז גם לספור את 1:100 ו 1:1000 דילול. אם זה יותר מ 50, לעבור לדילול סדרתי הבא.
הערה: אם לא ניתן לספור תולעים רבות מדי במדויק, השתמש במקום זאת בדילול הטורי הבא לספירה. - לספור כל שכפול aliquot של כל דילול 3x. בסוף הספירה, עבור רוב התרבויות, יתועדו 9 ספירות כוללות (כלומר,3 ספירות כוללות עבור כל משכפל aliquot).
- ממוצע ספירת הדילול כדי לקבוע את גודל האוכלוסיה המשוער של דגימת התולעת. ספירות דילול אלה יקבעו את נפח דגימת התולעת הדרושה ליצירת גודל aliquot הרצוי עבור -omics שלבים.
הערה: בניסוי זה נוצרו אלציטוטים של כ-200,000 תולעים מעורבות. בנוסף, אליקוט אחד של כ-50,000 תולעים מעורבות הוקצה למיון בציטומטר זרימת חלקיקים גדול (המתואר בשלב 10). - לאחר דגימת התולעת פוצלה aliquots המתאים, פלאש להקפיא חנקן נוזלי ולאחסן את המדגם ב -80 מעלות צלזיוס.
הערה: אין להקפיא את aliquot המיועד ציטומטריה זרימת חלקיקים גדולים.
10. (אופציונלי) דגימת הכנה לציטומטריה של זרימת חלקיקים גדולה
הערה: שלבים 10, 11 ו- 12 הם השיטה המועדפת על המחברים לתעד גידול מדגם (כלומר,גודל האוכלוסייה והתפלגות האוכלוסייה של שלבי מחזור החיים של C. elegans) ולקבוע הצלחה של תרבות. משתמשים בפרוטוקול זה יכולים להחליף שלבים 10, 11 ו- 12 אופציונליים במדדי הצלחה משלהם. שלבים 10, 11 ו-12 מתוארים כאן משתי סיבות; תחילה, כך שמשתמשים שיש להם ציוד בשימוש בשלבים 10, 11 ו- 12 יכולים לשכפל שלבים אלה ושנית, כדי להציג אימות של שיטת צמיחה זו. שלב 9 לעיל מספק הערכה טובה של המספר הכולל של תולעים כדי לקבוע גדלי aliquot, שלב 10 הוא מדד כמותי יותר כדי להעריך את מספר והתפלגות האוכלוסייה של תולעים במדגם נתון.
- להביא את aliquot של כ 50,000 תולעים מעורבת שלב (להפריש בשלב 9.6) עד 10 מ"ל נפח כולל בתמיסת M9.
- הפוך פתרון המורכב 1 מ"ג / מ"ל של E. coli ודילול 1:50 של 0.5 מיקרוספרות פלואורסצנטיות אדומות μM19.
- הוסף 200 μL של פתרון זה 10 מ"ל של תולעים מעורב שלב M9 ו דגירה תוך נדנדה במשך 20 דקות.
- לאחר 20 דקות, צנטריפוגה צינור חרוט 15 מ"ל ב 884 x g במשך 1 דקות ב 4 מעלות צלזיוס.
- לשאוף את supernatant להבטיח לא להפריע גלולת התולעת.
- לשטוף את גלולת התולעת פעמיים עם פתרון M9 כדי לחסל חיידקים עודפים מיקרוספרות פלואורסצנטיות אדומות.
- הוסף 5 מ"ל של M9 לכדור התולעת ולהבטיח כי גלולה נראה נקי. אם גלולה נקייה, להוסיף 5 מ"ל של M9 עם 50 mM נתרן אזיד הן ליישר ולהרוג את התולעים לספירה מדויקת גודל21.
- מסמך שעה ותאריך שבו נתרן אזיד מתווסף לדגימה.
- מניחים את המדגם בצד על נדנדה עד הצורך עבור cytometry זרימת חלקיקים גדולים.
הערה: נתרן אזיד ידוע כמשפיע על הפיזיולוגיה הנמטודית(כלומר,אורך הגוף, חילוף החומרים והתרמוטולנטיות). לכן, זה קריטי לציין את הזמן תולעים נחשפים נתרן אזיד כמו רבים של השפעות פיזיולוגיות אלה לקרות בתוך דקות22. בשל ההשפעות הפיזיולוגיות הידועות של נתרן אזיד על תולעים, טיפול זה ישפיע על איכות התמונה במורד הזרם ויש לקחת בחשבון.
11. (אופציונלי) תיעוד התפלגות אוכלוסייה והכנת צלחת של 384 באר להדמיה
הערה: שלב 11 משתמש בציטומטר זרימת חלקיקים גדול (LPFC). ידע בסיסי של LPFC הוא הניח בפרוטוקול זה. ניתן להחליף שיטות אחרות כדי לתעד את הגידול והתפלגות האוכלוסייה של דגימות. השלבים המתועדים כאן מיועדים למשתמשים המתכננים להשתמש ב- LPFC בצינור23שלהם .
- הפעל, נקה וערך את ה- LPFC ואפשר ללייזרים להתחמם במשך שעה לפני מיון הדגימות.
- לאחר שהלייזר התחמם, פתח את הפרופיל "היסטוגרמה" ואת קנה המידה לזמן טיסה (TOF) של 2050.
- הוסף אזור מייצגי אחסון ל "היסטוגרמה" המשתרע על-פני טווח TOF של 100. אזור הבר הראשון מכסה TOF של 50-150.
- המשך ליצור עשרים אזורי מייצגי אחסון (Bar) שכל אחד מהם משתרע על-פני טווח TOF של 100. אזורי בר אלה ישתרעו על פני כל טווח TOF בין 50 - 2050. ראה טבלה משלימה 1 לקבלת האזורים המגודרים המדויקים בהם יש להשתמש בהתפלגות TOF.
- שמור היסטוגרמה זו מוגדרת כ "ניסוי" לשימוש בהפעלות LPFC עתידיות.
- בחר צלחת מכוילת של 384 באר או כייל את המכשיר ללוח של 384 באר כדי לחלק לתוכו חפצים.
- פעם אחת בתבנית הלוח המכוילת של 384 באר, הגדר תבנית כדי לחלק 20 אובייקטים מגודרים לארבע בארות (ארבעה שכפולים טכניים של כל אזור מגודר) עבור כל אחד מ- 20 אזורי מייצגי המידה שנוצרו במהלך שלבים 11.3-4. ראה טבלה משלימה 2 לקבלת פריסה לדוגמה של איך לוותר על תולעים לתוך צלחת 384-well.
- העבר דגימה משלב 10.9 לתוך צינור חרוט 50 מ"ל ולהוסיף פתרון M9 נוסף כדי להשיג כ 40 מ"ל נפח כולל.
- התחל למיין אוטומטית את המדגם לפי הפרמטרים שנקבעו בשלב 11.7 תוך ערבוב רציף של המדגם כדי למנוע התיישבות ובמקביל לחלק אובייקטים מהמדגם ללוח 384-well המכויל.
הערה: ודא שקצב הזרימה של ה- LPFC פועל בין 15-20 אובייקטים לשניה וציין שאין זוגות למיון. - לאחר המדגם כולו כבר ממוין ואת המספר המרבי של אזורים מגודרים חולקו לתוך צלחת 384-well, לקחת את המדגם את LPFC ומכשיר נקי.
הערה: כאשר אזורי TOF גדולים יותר הם הגיעו, זה עשוי להיות מאתגר להמשיך למלא את צלחת 384-well בשל ספירות אירועים נמוכות באזור TOF זה. מלא כמה שיותר מהאזורים המגודרים כדי לקבל את הרעיון הטוב ביותר היכן שלבי החיים של C. elegans נמצאים בהפצת LPFC לפני שנגמרה הדגימה. - מניחים סרט איטום על גבי צלחת 384-באר עד לצילום.
הערה: צלחת תמונה מהר ככל האפשר לאחר מיון כי דגימות מטופלים עם נתרן אזיד22. מיקרוספרות פלואורסצנטיות אדומות ניתן לראות בקבצי הנתונים שנאספו LPFC(כלומר PH נתונים אדומים בקובץ טקסט פלט) בהתבסס על רמת הפלואורסצנטיות האדומה הנפלטת בכל אובייקט ממוין כדי לסייע בזיהוי אילו אובייקטים הם תולעים חיות, תולעים מתות, dauers, או זבל24.
12. (אופציונלי) הדמיה צלחת 384-באר
הערה: שלב 12 משתמש במיקרוסקופ מיקרו-קונפוקאלי לקריאת צלחות. ידע בסיסי במיקרוסקופ מיקרו-קונפוקאלי נמצא בפרוטוקול זה. ניתן להחליף שיטות אחרות כדי לתעד את הגידול והתפלגות האוכלוסייה של דגימות.
- שימוש במיקרוסקופ מיקרו-קונפוקאלי לקריאת צלחות עם עדשה 20x.
- פתח את הכרטיסייה "מטרה ומצלמה" והגדר למצב "10x תוכנית ApoLambda".
- פתח את הכרטיסיה "איתור מצלמה" והגדר את "2".
- פתח את הכרטיסייה "אתרים לבקר בצלחת" והגדר "4" אתרים לכל באר ו "חופפים אתרים 10%" כדי לתפור תמונות מאוחר יותר יחד.
- פתח את הכרטיסייה "אורך גל" והגדר את "Brightfield 1".
- פתח אתהכרטיסיה" תאורה " והגדר כ "מדגם בהיר בהיר " .
- מניחים את הלוחית 384-באר במיקרוסקופ ולהגדיר את "מחסנית Z" כדי "לחשב היסט" ולמצוא את מישור המוקד הנכון עבור הדגימות בלוח 384-באר.
- הפעל את הלוח 384-באר על מיקרוסקופ מיקרו confocal איסוף ארבע תמונות לכל באר.
- מונטאז' ארבע התמונות יחד כדי ליצור תמונה אחת לכל טוב.
תוצאות
צמיחה של C. elegans בשיטת LSCP מניבה בממוצע כ 2.4 מיליון תולעים בשלב מעורב לכל מדגם על פני 12.2 ימים. הצמיחה של C. elegans בשיטת LSCP מאפשרת למשתמשים ליצור אוכלוסיות מעורבות גדולות של C. elegans עם טיפול ומניפולציה מועטים של בעלי החיים, שהוא אידיאלי למחקרים בקנה מידה גדול -omics (איור 1). לאחר LSCP הפך מלא תולעים בוגרים, הגיע לגודל אוכלוסייה גדול, ויש לו חיידקים מינימליים עזבו, משתמשים יכולים לקצור ולהעריך את גודל האוכלוסייה. נקודה זו יכולה לשמש גם כבקרת איכות על-ידי הערכת האם האוכלוסייה מספיקה לשימוש בצינור -omics (איור 2). הדינמיקה של האוכלוסייה תלויה במתח עצמו, בהתנהגות המתח (כלומר,זנים מתחפרים נוטים להיות בעלי התאוששות תולעת נמוכה יותר), ובהצלחה בצמיחה (כלומר,זיהום). שיטת LSCP נבדקה על 15 זנים של C. elegans המכיל תערובת של מוטציות מרכז גנטיקה Caenorhabditis (CGC) ו Caenorhabditis elegans משאב גיוון טבעי (CeNDR) זנים פראיים25. גנוטיפים זן מתוארים בטבלה משלימה 3.
שיטת LSCP הניבה גדלי אוכלוסייה מכ-94,500 ל-9,290,000. גודל האוכלוסייה הממוצע בזן הייחוס, PD1074, ועל פני זנים היה כ-2.4 מיליון תולעים (איור 3). לא נמצאו הבדלים משמעותיים בגדלים המשוערים של האוכלוסייה בין זני C. elegans במהלך 12.2 ימי גידול LSCP בממוצע (איור 4). PD1074 LSCPs לקח בין 10 - 14 ימים לגדול לאוכלוסייה מעורבת מלאה בשלבים. זמן הצמיחה הממוצע על פני PD1074 היה 10 ימים. הזן הגדל האיטי ביותר גדל במשך 20 יום לכל היותר, והזן הגדל במהירות הגבוהה ביותר גדל למשך 10 ימים לפחות (איור 4).
לכן, באמצעות שיטת LSCP זו, משתמשים יכולים בקלות לשלב זנים חדשים של עניין לתוך מחקר עם ידע מועט של תזמון התפתחותי ומומחיות ברקע. שים לב כי זנים ופנוטיפים שיש לשמור על ידי קטיף, יש פגמים בהיתכנות, הם heterozygous, או יש פגמים בצמיחה לא יכול לעבוד טוב בצינור זה.
ציטומטריה של זרימת חלקיקים גדולה והדמיה של דגימות מאפשרת למשתמשים לתעד התפלגות אוכלוסין. ניתן להשתמש במגוון רחב של פלטפורמות למדידת גידול אוכלוסין מוצלח.
למדידות הניתנות לשחזור - אומיקים, חשוב לגדל תרבויות עקביות. המדדים של יכולת הרבייה של התרבות הם מספר התולעים והתפלגות גודל עקבית עבור זן נתון. אנו מראים את התפלגות המדגם עבור זן הייחוס, PD1074 – גרסה של זן N2 בריסטול המקורי, באמצעות תמונות מיקרוסקופ LPFC23,26 ומיקרו confocal כמו שליחים להצלחת הצמיחה. כאשר תולעים נמדדו משלב L1 דרך מבוגרים מסורבלים בהתפלגות LPFC (איור 5), ההדמיה העוקבת (איור 6), והשונות בהתפלגות האוכלוסייה על פני דגימות (איור 7), אנו יכולים לראות שהצינור הזה יצר אוכלוסייה מעורבת של C. elegans.
כדי לבחון מקרוב את התפלגות האוכלוסין של הדגימות המעורבות שלנו, בחנו את ההתפלגות של 35 PD1074 LSCPs על ידי התבוננות באחוז התולעים הנופלות בתוך כל אזור לאורך כל התפלגות זמן הטיסה (TOF)(כלומר,אורך הגוף)(איור 7A,B).
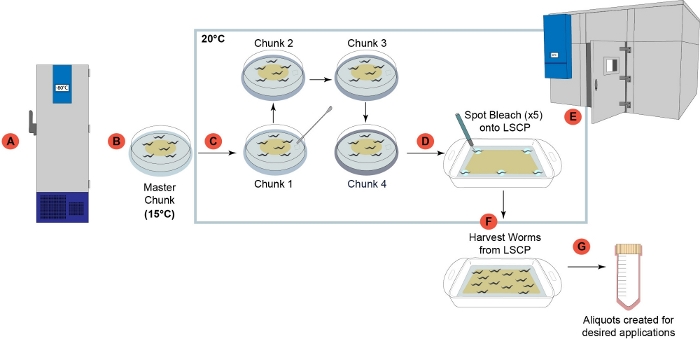
איור 1: מבט כולל על צינור הצמיחה של תולעת LSCP. (A)לאחר שהתקבל במעבדה, כל הזנים הוכנו וקפאו לאחסון לטווח ארוך ב -80 מעלות צלזיוס2. צלחת"נתח ראשי" הוכנה ממלאי תולעת קפואה ואחסנה ב-15 מעלות צלזיוס לשימוש לא יותר מחודש. (C)כל מדגם עבר ארבעה שלבי קיבוץ רצופים כדי להפחית את הלחץ הדורי לפני שגדל על LSCP. (D)5 מבוגרים גראביד בודדים נבחרו מתוך "נתח 4" 6 ס"מ צלחת צעד (D) ו נקודה מולבן על חמישה אזורים נתון של LSCP. LSCPהוצב בחדר טמפרטורה מבוקר וגדל ב 20 °C (70 °F) עד LSCP היה מלא תולעים בוגרים, הגיע לגודל אוכלוסייה גדולה, היו חיידקים מינימליים עזבו. (ו)אוכלוסיית התולעים נקצרה ונאספה למדרגות במורד הזרם. (G)Aliquots נוצרו מן LSCP היו פלאש קפוא עבור יישומים הרצוי במורד הזרם הרצוי. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
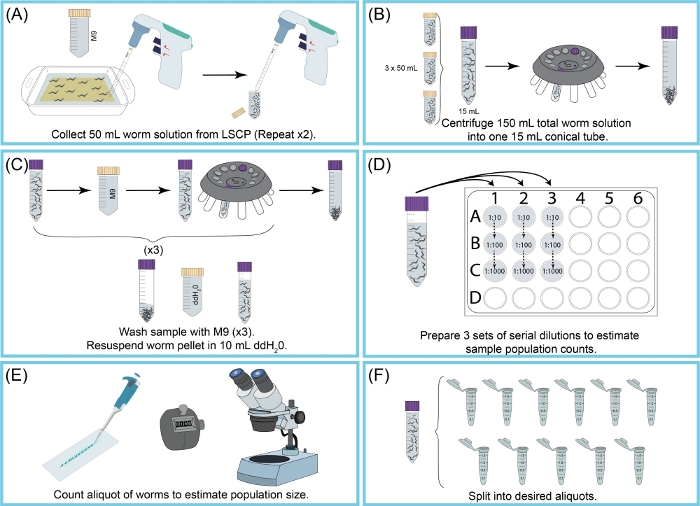
איור 2: מבט כולל על קצירת LSCP והערכת גודל האוכלוסייה. 50מ"ל של M9 שימשו לשטיפת תולעים מפני השטח של NGMA. השעיית תולעת הוכנסה לצינור חרוט של 50 מ"ל. שלב (א)) חזר על עצמו פעמיים. (B)15 מ"ל של השעיית תולעת נשפך לתוך צינור חרוט חדש 15 מ"ל. תולעים נטרפו על ידי צנטריפוגות. M9 + פסולת היו שאיפה את מבלי להפריע גלולה תולעת. שלב (B) חזר על עצמו עד שנאספו כל 150 מ"ל של השעיית תולעת. גלולתהתולעת נשטפה וצנטריפוגה שלוש פעמים עם M9 כדי לחסל את הפסולת שנותרה. לאחר שהדגימה הייתה נקייה, גלולת התולעת נעשה שימוש חוזר ב 10 מ"ל של ddH2O. (D) דילול סדרתי של המדגם נוצר כדי להעריך את גודל אוכלוסיית התולעת. נעשה שימוש מדויק במקדם הדילול שאיפשר לספור תולעים במדויק. גורמי הדילול בהם נעשה שימוש השתנו בהתאם לגודל האוכלוסיה של ה- LSCP. (ה)לאחר שנבחרו גורמי הדילול, כל התולעים מכל שלושת השכפולים של הדילול הועברו למגלשה נקייה ותולעים נספרו תחת מיקרוסקופ מנתח. (ו)המדגם חולק ל aliquots בגודל המתאים. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
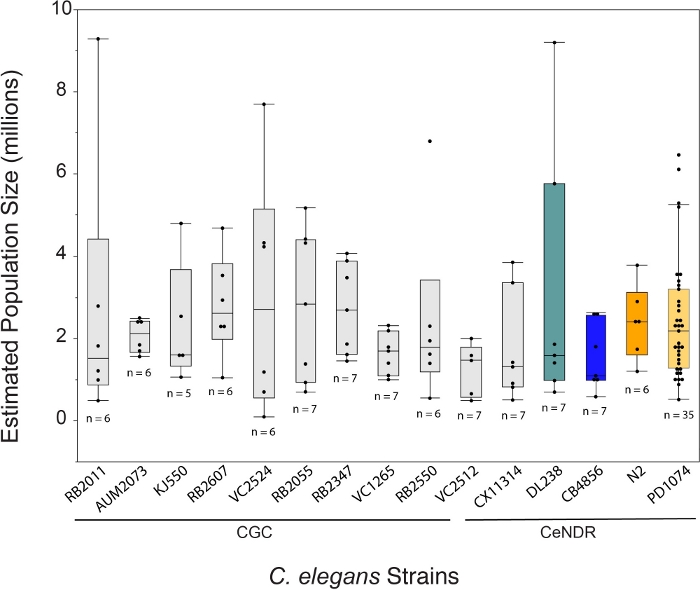
איור 3: שיטת LSCP יצרה בממוצע אוכלוסייה של 2.4 מיליון תולעים מעורבות. LSCP מניב גדלי אוכלוסייה באוכלוסייה הקטנה ביותר גדל בסביבות 94,500 ובגידול האוכלוסייה הגדול ביותר בסביבות 9,290,000. גודל האוכלוסייה הממוצע בכל הזנים היה 2.4 מיליון תולעים. פסים מתחת לשמות הזנים C. elegans מציינים אם זן הוא מוטציה CGC או בידוד טבעי CeNDR. גודל דגימת LSCP מוצג עבור כל זן. בוצעו השוואות עבור כל הזוגות באמצעות בדיקת HSD של Tukey. לא נצפו הבדלים משמעותיים בין גודל האוכלוסייה המשוער על פני זני C. elegans (F(14,108) = 0.7, p = 0.77). פסים צבעוניים מציינים צגי צבע סטנדרטיים לייצוג זן C. elegans בהתאמה. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
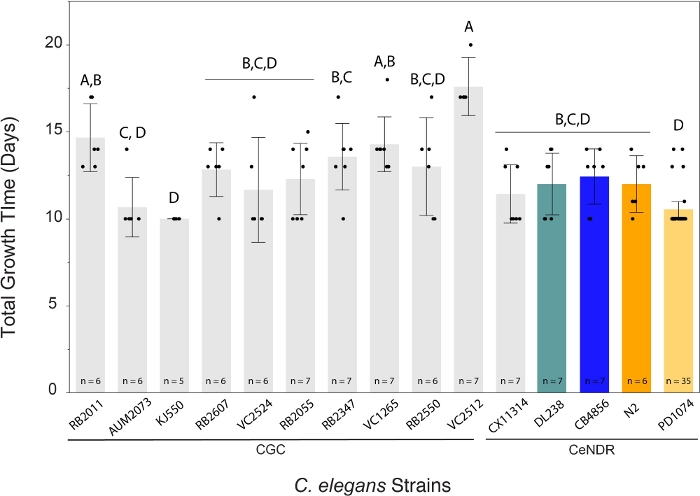
איור 4: שיטת LSCP יצרה אוכלוסיות מעורבות גדולות של תולעים ב-10 עד 20 יום. נתון C. elegans LSCP גדל עד המדגם היה מלא תולעים בוגרות, הגיע לגודל אוכלוסייה גדול, והיה מדשאה חיידקית מינימלית עזב. LSCPs לקח בין 10 – 20 ימים לגדול לאוכלוסייה מעורבת מלאה בשלבים, בהתאם למתח. זמן הצמיחה הממוצע על פני הזנים היה 12.2 ימים. גודל דגימת LSCP מוצג עבור כל זן. כל קו שגיאה נבנה באמצעות סטיית תקן אחת מהתו הממוצע. רמות שאינן מחוברות באמצעות אותה אות שונות באופן משמעותי. השוואות לכל הזוגות באמצעות בדיקת HSD של Tukey. הבדל משמעותי נמצא בכמות זמן הצמיחה על LSCP הדרוש על פני זני C. elegans (F(14,108) = 8.8, p < 0.0001 *). פסים צבעוניים מציינים צגי צבע סטנדרטיים לייצוג זן C. elegans בהתאמה. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
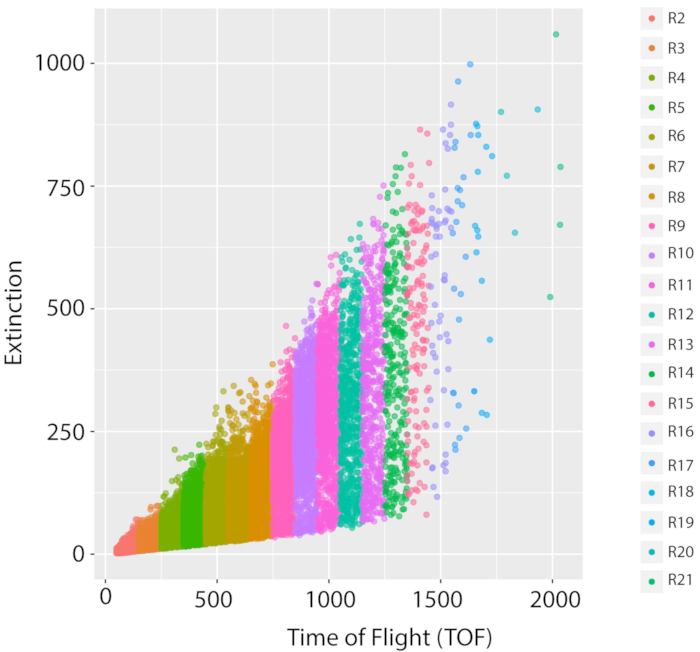
איור 5: מדידת אוכלוסייה מעורבת וצמיחה של זן הייחוס מסוג בר, PD1074. התפלגות LPFC מייצגת של צמיחת LSCP אחת של זן הייחוס מסוג פראי, גרסה של זן N2 בריסטול המקורי, (PD1074) מתעדת את התפלגות הגודל וספירת האירועים של אוכלוסייה מעורבת. ציר ה- x מציג את האורך (זמן טיסה, TOF) של התולעים הממוינות. ציר y מציג את הצפיפות האופטית (הכחדה אופטית, EXT) של התולעים הממוינות. כל נקודת נתונים היא תולעת שתועדה במדגם. כל אזור TOF ששימש לניתוח תמונה מוצג בצבע שונה. עשרים אזורי TOF נוצרו (R2 – R21) החל TOF של 50 עד 2050. פרטים על כל אזור TOF ניתן למצוא בטבלה משלימה 1. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
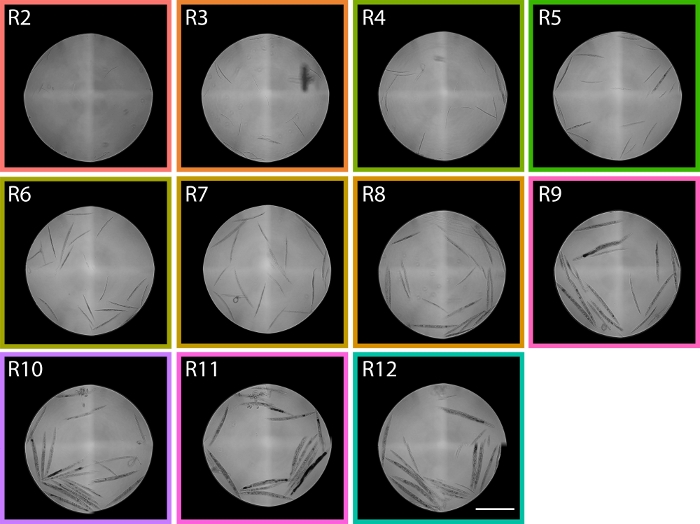
איור 6: תמונות של תולעים ממוינות מאזורי TOF החל מ- R2 – R12 מציגות את התפלגות ה- PD1074 LPFC. באזור R2, תולעי L1 ניתן לזהות ובאזור R9 בעיקר מבוגרים gravid מזוהים, פורש את שני קיצוניים זחל התפתחותי נותן לנו אזורים משוער בתוך התפלגות ציטומטר זרימה של איפה השלבים צפויים בהתפלגות. סרגל קנה המידה מייצג 1 מ"מ. תמונות מייצגות צולמו מהתפלגות LPFC המוצגת באיור 5, והתיבות הצבעוניות תואמות לאזורים מאיור 5. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
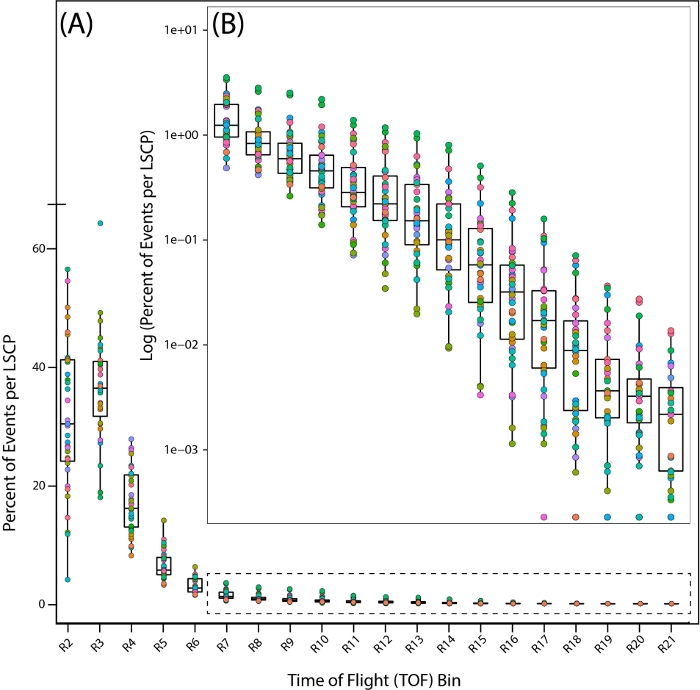
איור 7: התפלגות אוכלוסין לאורך זמן הטיסה (TOF) באזורים בזן הייחוס מסוג בר, PD1074. התפלגות התולעים בכל אזור TOF המציגה את האזורים שבהם נמצאו תולעים. כל PD1074 LSCP מיוצג כצבע בודד. (A) ציר ה- x מציג את עשרים אזורי TOF (R2 - R21) שנצפו ונספרו עבור LSCP, ומציגים את התפלגות הגודל כולה. ציר y מראה את אחוז התולעים מ LSCP נתון שהיה לו גודל גוף שנפל לאזור TOF נתון. (B) כאשר חלק קטן יותר מאוכלוסיית התולעים נופל בין אזורי R7-R21, יומן הרישום של אחוז התולעים שנפלו בתוך כל אזור נלקח כדי להציג את התפלגות האוכלוסייה. ציר ה- x מציג את אזורי ה- TOF R7-R21. ציר y מציג את יומן הרישום של אחוז התולעים מ- LSCP נתון בעל גודל גוף שנפל לאזור TOF נתון. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
איור משלים 1: טמפרטורה יומית ממוצעת (°C) של תנאי גדילה שבהם LSCP גדל וטופל. הטמפרטורות המדווחות של חדר הטמפרטורה המבוקרת (CT) תועדו ונאספו לאורך שישה חודשים של צמיחה ואיסוף מדגם. הטמפרטורה היומית הממוצעת מדווחת כאן. לא נצפו הבדלים משמעותיים בין הטמפרטורה שבה גדל ה- LCSP במהלך הפרויקט (F(5,24) = 2.59, p = 0.0524). הפרש הטמפרטורה כולו השתרע על פני לא יותר מ 0.003 °C (6 °F) לאורך שישה חודשים של צמיחה מדגם ויצירת. אנא לחץ כאן כדי להוריד נתון זה.
טבלה משלימה 1: אזורים מגודרים TOF המשמשים למיון תולעים ללוחות 384 באר להדמיה. אזורים מאוחסנים נוצרו כדי להשתרע על פני TOF של 100 על פני כל התפלגות TOF מ 50 - 2050. ניתן לשנות אזורים מגודרים ולמטב אותם כך שיתאימו לצרכים שלך. כל אזור TOF ששימש לניתוח תמונה מוצג בצבע שונה. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה משלימה 2: תבנית צלחת של 384 באר של אזורי TOF ופריסת שכפול. כל דגימה מוינתה ללוח של 384 באר להדמיה. ארבעה שכפולים נוצרו עבור כל אזור שנבחר למיון. ניתן לשנות אזורים מגודרים ולמטב אותם כך שיתאימו לצרכים שלך. ראה טבלה משלימה 1 לקבלת אזורים מגודרים ספציפיים שנוצרו ושימשו בפרוטוקול זה. כל אזור TOF ששימש לניתוח תמונה מוצג בצבע שונה. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה משלימה 3: C. זני אלגנס המשמשים בפרוטוקול זה מכילים תערובת של זנים CGC ו- CeNDR. הזן, הגנוטיפ, מקור המתח והפרטים מתוארים בטבלה זו. אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
מגוון רחב של כלי יכול לשמש LSCP. בפרוטוקול זה נעשה שימוש בתבנית אפייה סטנדרטית מזכוכית. LSPCs בשימוש היו הממדים החיצוניים של 35.56 x 20.32 ס"מ, מידות פנימיות של 27.94 x 17.78 ס"מ, וכ 4.45 ס"מ עמוק והגיע עם מכסה מצויד. לכן, כמות החיידקים המשמשים כאן כבר אופטימיזציה עבור LSCP עם הממדים לעיל כדי להניב אוכלוסייה גדולה של תולעים מעורב שלב. ניתן להתאים נפח וריכוז חיידקיים כך שיתאימו לצרכים הניסיוניים.
זיהום על ידי עובש, פטריות, או מקורות חיידקיים אחרים יכולים להתרחש בכל שלב בשיטת LSCP, כך לטפל דגימות בזהירות. לפני תחילת כל שלב בפרוטוקול, ודא כי מרחב העבודה מנוקה עם 70% אתנול ו 10% אקונומיקה. אם זמין, לטפל באזורים משומשים עם אור UV במשך 30 דקות ולהדליק מסנן אוויר HEPA 30 דקות לפני תחילת כל שלב.
על ידי הגדלת LSCP בסביבה מבוקרת (כלומר,בחדר CT להגדיר ב 20 מעלות צלזיוס), המשתמש יכול בקלות רבה יותר לעקוב אחר הצמיחה של המדגם ולתעד זיהום פוטנציאלי. אם פני השטח של LSCP הופך מזוהם, או לחתוך את הזיהום כאשר הדבר אפשרי ולתת את המדגם להמשיך לגדול או להשליך את המדגם אם הזיהום אינו ניתן לשלוט. זה הכרחי כדי לטפל בזיהום במהירות כדי להפחית את הצמיחה לא רצויים כדי להבטיח שזה לא עולה תולעים עבור משאבים.
שיטה זו מיועדת למי שרוצה לגדל תרבויות אוכלוסייה מעורבת בקנה מידה גדול של C. elegans. למרות שזה עשוי להיות אפשרי לגדול אוכלוסיות מסונכרנות של תולעים על LSCP כפי שנעשה על מנות פטרי זמין מסחרית ובתרבות נוזלית, המחברים לא בדקו אפשרות זו. בנוסף, אם משתמשים רוצים לגדול יותר מ 2.4 מיליון תולעים בממוצע במדגם נתון, שיטה אחרת מומלץ4. הצלחת הצמיחה תלויה במתח המעובד בצנרת. המחברים הצליחו לגדל בהצלחה אוכלוסיות של כ -2.4 מיליון תולעים בלפחות חמישה משכפלים ביולוגיים של 15 זני אלגנס C. elegans, המציין כי השיטה היא חזקה.
לפני תחילת הניסוי לציין כי הגיל והבריאות של תולעת נתון יכול להשפיע על פוריות וזמן גידול האוכלוסייה הבאים. ודא כי תולעים נשמרים בתנאים בריאים עם מתח מינימלי לפני השימוש בצינור זה. ההנחה היא כי דגימות מלאי נוצרו, הוקפאו, ונשמרו ב -80 מעלות צלזיוס כדי להפחית את הסחף הגנטי לאורך זמן.
בהתאם לצרכים של ניסוי נתון, ניתן לשנות את מספר המבוגרים המתחילים ב- LSCP. שינוי מספר המבוגרים המתחילים ב- LSCP ישנה את קצב הגדילה ובכך הגיע הזמן לקצור. חמישה מבוגרים מסורבים משמשים לזרע כל LSCP מהסיבות הבאות: (1) דרך פשוטה, מהירה ויעילה לזרוע זנים רבים של C. elegans על LSCPs בבת אחת היה צורך ו (2) כדי להפחית את פערי הגילאים בין המבוגרים gravid הרים שיכול להוביל הטרוגניות הצמיחה.
שיטה זו מאפשרת למשתמש לקצור אוכלוסיות גדולות של תולעים עם כל שלבי מחזור החיים הנוכחיים. עם השיטות הנוכחיות הזמינות, איסוף דגימות בקנה מידה גדול של C. elegans דורש סנכרון אקונומיקה כדי להשיג את מספר התולעים הרצוי לעבודה במורד הזרם. בהתחשב בגישה זו, ניתן כעת לגדל תולעים רבות ככל האפשר בתסיסה או בתרבויות נוזליות בקנה מידה גדול ללא הקשיים הקשורים לסנכרון אקונומיקה ושלבי טיפול מרובים. הפרוטוקול שלנו מאפשר למקד זנים של עניין ביעילות, להשתמש בזמן טיפול מינימלי בגידול המדגם עצמו, ולבודד שלבים של תולעים או האוכלוסייה לפי הצורך בצינורות במורד הזרם.
LPFC שימש ככלי לתיעוד התפלגות האוכלוסיה וגודלה ב- LSCP נתון. ה- LPFC המשמשת היא מערכת זרימה רציפה המנתחת, ממיינת ומחלקת תולעים בהתבסס על גודלן (TOF) וצפיפותן האופטית. כאשר תולעת נתונה עוברת דרך תא הזרימה, גלאי אובדן האור הצירי לוכד את כמות אור האות החסום על ידי לייזר מצב מוצק של 488 ננומטר למשך הזמן שלוקח לתולעת לעבור, מה שמעניק למשתמש את ה- TOF ואת הצפיפות האופטית של התולעת. ניתן גם להשתמש באיסוף פלואורסצנטיות של אופטיקה וגלאים כדי למקסם את הרגישות לפלואורסצנטיות ולאיסוף על כל דגימה. פרמטרי אוסף LPFC ישתנו בהתאם למכשיר. משתמשים יכולים להשתמש במגוון פלטפורמות כדי ללכוד גודל תולעת ואינם מוגבלים לשימוש בפרוטוקול זה אם LPFC אינו זמין.
המחברים משתמשים בדגימות הגדלות בשיטה המתוארת כאן כדי לזהות מטבוליטים לא ידועים בזנים שונים של C. elegans באמצעות כרומטוגרפיה נוזלית – ספקטרומטריית מסה, ספקטרוסקופיית NMR, רצף RNA. המחברים מתכננים להמשיך להשתמש בשיטה זו לצמיחה של דגימות בצינור זה עם מגוון של C. elegans זנים כמו זנים חדשים של עניין ניתן לעבד בקלות באמצעות צינור זה.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים לחברי מעבדת אדיסון על דיונים מועילים ומשוב על כתב יד זה; במיוחד, בי.M גרסיה. זנים מסוימים סופקו על ידי CGC, אשר ממומן על ידי משרד NIH של תוכניות תשתית מחקר (P40 OD010440), ו CeNDR, אשר ממומן על ידי NSF Living אוספים CSBR 1930382. עבודה זו נתמכה על ידי מענק מה-NIH (U2CES030167).
Materials
| Name | Company | Catalog Number | Comments |
| 10 mL Sterile Serological Pipettes | VWR | 89130-898 | |
| 10 ul pipette tips | VWR | 89079-438 | |
| 100 ul pipette tips | VWR | 89079-442 | |
| 1000 mL Graduated Cylinder | VWR | 10124-380 | |
| 1000 ul pipette tips | VWR | 89079-488 | |
| 15 mL conical tubes | VWR | 89039-668 | |
| 190 Proof Ethanol | VWR | 89125-166 | |
| 2 L Wide Neck Erlenmeyer Flask | VWR | 75804-654 | |
| 50 mL conical tubes | VWR | 75874-294 | |
| Agar | Sigma | 05040-100G | |
| Agarose | Sigma | A9539-500G | |
| BVC Control G Fluid Aspiration System | Vacuubrand | ||
| Calcium Chloride | Sigma | 449709-10G | |
| Cholesterol | Sigma | C3045-25G | |
| Clorox Bleach | VWR | 89414-502 | |
| Conviron Control Temperature Room | Conviron | https://www.conviron.com/environmental-rooms | |
| Corning Low Volume 384 Well Black with Clear Flat Bottom Polystyrene TC-Treated Microplate | VWR | 89089-866 | |
| Fisher Scientific Accuspin 3R | Fisher | ||
| Flat-Bottom 24-Well Plate | VWR | 29443-952 | |
| Honeywell True HEPA Purifier 465 sq ft. | Home Depot | 204390560 | |
| HT115 E. coli (DE3) | CGC | HT115(DE3) | https://cgc.umn.edu/strain/HT115(DE3) |
| Kimwipes | VWR | 470224-038 | |
| Large Scale Culture Plate (LSCP) | Pyrex | 1090948 | Pyrex 2-quart Glass Baking Dish with Red Lid |
| Magnesium Sulfate | Sigma | C86677-25G | |
| MgSO4 | VWR | 97062-998 | |
| Microscope Plain Slides | VWR | 16004-422 | |
| Millipore Filter | Millipore | 1.11727.2500 | |
| Molecular Devices ImageXpress | Molecular Devices | Model Number:IXMConfocal | https://www.moleculardevices.com/products/cellular-imaging-systems/high-content-imaging/imagexpress-micro-confocal#gref , Authors used MetaXpress Software Version 6.5.4.532 |
| Nystatin (10mg/mL) | Sigma | N6261-25MU | |
| Peptone | Sigma | P7750-100G | |
| Petri Dishes (6 cm) | VWR | 25384-092 | |
| Pipette Controller | VWR | 613-4180 | |
| Potassium Chloride | Fisher | P217-3 | |
| Potassium Phosphate Monobasic | VWR | 0781-500G | |
| Potasssium Hydroxide | Fisher | P250-500 | |
| Red Fluroscent Microspheres | Polysciences | 19507-5 | |
| Sodium Chloride | Sigma | 746398-500G | |
| Sodium Hydroxide | Fisher | 111357 | |
| Sodium Phosphate Dibasic Anhydrous | Fisher | BP332-500 | |
| Standard Gilson Pipette Set | Gilson | FA10002M, FA10004M, FA10006M | |
| Streptomycin (100mg/mL) | Sigma | S6501-25G | |
| Union Biometrica COPAS BioSorter | Union Biometrica | https://www.unionbio.com/biosorter/ , authors used: Flow Pilot software version 1.6.1.3. |
References
- Félix, M. A., Braendle, C. The natural history of Caenorhabditis elegans. Current Biology. 20 (22), 965-969 (2010).
- Corsi, A. K. A Transparent window into biology: A primer on Caenorhabditis elegans. WormBook. , 1-31 (2015).
- Brenner, S. The genetics of behaviour. British Medical Bulletin. 29 (3), 269-271 (1973).
- Stiernagle, T. Maintenance of C. elegans. WormBook: The Online Review of C. elegans Biology. , (2006).
- Xiong, H., Pears, C., Woollard, A. An enhanced C. elegans based platform for toxicity assessment. Scientific Reports. 7 (1), 9839 (2017).
- Loer, C. M., et al. Cuticle integrity and biogenic amine synthesis in Caenorhabditis elegans require the cofactor tetrahydrobiopterin (BH4). Genetics. 200 (1), 237-253 (2015).
- Li, Y., Paik, Y. K. A potential role for fatty acid biosynthesis genes during molting and cuticle formation in Caenorhabditis elegans. BMB Reports. 44 (4), 285-290 (2011).
- Meli, V. S., Osuna, B., Ruvkun, G., Frand, A. R. MLT-10 Defines a Family of DUF644 and Proline-rich Repeat Proteins Involved in the Molting Cycle of Caenorhabditis elegans. Molecular Biology of the Cell. 21 (10), 1648-1661 (2010).
- Fritz, J. A., Behm, C. A. CUTI-1: A novel tetraspan protein involved in C. elegans CUTicle formation and epithelial integrity. PloS One. 4 (4), 5117 (2009).
- Golden, J., Riddle, D. A pheromone influences larval development in the nematode Caenorhabditis elegans. Science. 218 (4572), 578-580 (1982).
- Jeong, P. Y., et al. Chemical structure and biological activity of the Caenorhabditis elegans dauer-inducing pheromone. Nature. 433 (7025), 541-545 (2005).
- Srinivasan, J., et al. A blend of small molecules regulates both mating and development in Caenorhabditis elegans. Nature. 454 (7208), 1115-1118 (2008).
- Kaplan, F., et al. Ascaroside Expression in Caenorhabditis elegans Is Strongly Dependent on Diet and Developmental Stage. PLoS One. 6 (3), 17804 (2011).
- Golden, J., Riddle, D. A pheromone influences larval development in the nematode Caenorhabditis elegans. Science. 218 (4572), 578-580 (1982).
- Çelen, &. #. 3. 0. 4. ;., Doh, J. H., Sabanayagam, C. R. Effects of liquid cultivation on gene expression and phenotype of C. elegans. BMC Genomics. 19 (1), 562 (2018).
- Andersen, E. C., Bloom, J. S., Gerke, J. P., Kruglyak, L. A Variant in the Neuropeptide Receptor npr-1 is a Major Determinant of Caenorhabditis elegans Growth and Physiology. PLoS Genetics. 10 (2), 1004156 (2014).
- Rosenblatt, M. A central limit theorem and a strong mixing condition. Proceedings of the National Academy of Sciences. 42 (1), 43-47 (1956).
- Boyd, W. A., Smith, M. V., Freedman, J. H. Caenorhabditis elegans as a model in developmental toxicology. Methods in Molecular Biology. 889, 15-24 (2012).
- Nika, L., Gibson, T., Konkus, R., Karp, X. Fluorescent Beads Are a Versatile Tool for Staging Caenorhabditis elegans in Different Life Histories. Genes, Genomes, Genetics. 6 (7), 1923-1933 (2016).
- Denver, D. R., Morris, K., Streelman, J. T., Kim, S. K., Lynch, M., Thomas, W. K. The transcriptional consequences of mutation and natural selection in Caenorhabditis elegans. Nature Genetics. 37 (5), 544-548 (2005).
- Massie, M. R., Lapoczka, E. M., Boggs, K. D., Stine, K. E., White, G. E. Exposure to the metabolic inhibitor sodium azide induces stress protein expression and thermotolerance in the nematode Caenorhabditis elegans. Cell Stress & Chaperones. 8 (1), 1-7 (2003).
- Kevin, S., Pulak, R., Strange, K. Techniques for Analysis, Sorting, and Dispensing of C. elegans on the COPAS Flow-Sorting System. C. elegans. Methods in Molecular Biology. 351, 275-286 (2006).
- Lee, D., et al. Selection and gene flow shape niche-associated variation in pheromone response. Nature Ecology & Evolution. 3 (10), 1455-1463 (2019).
- Cook, D. E., Zdraljevic, S., Roberts, J. P., Andersen, E. C. CeNDR, the Caenorhabditis elegans natural diversity resource. Nucleic Acids Research. 45, 650-657 (2016).
- Nika, L., Gibson, T., Konkus, R., Karp, X. Fluorescent Beads Are a Versatile Tool for Staging Caenorhabditis elegans in Different Life Histories. Genes, Genomes, Genetics. 6 (7), 1923-1933 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved