Method Article
Büyük Ölçekli Karma Aşama Caenorhabditis Elegans Popülasyonlarının Kültürü ve Tahlilleri
Bu Makalede
Özet
Omiks araştırmalarında Caenorhabditis elegans (C. elegans)kullanmak için, karşılaştırmalı analizler için platformlar arasında tek bir numunenin ölçülebileceği büyük solucan popülasyonları oluşturmak için bir yönteme ihtiyaç vardır. Burada, C. elegans popülasyonlarını büyük ölçekli kültür plakalarında (LSCP' ler) kültüre ve nüfus artışını belgelemek için bir yöntem sunulmuştur.
Özet
Caenorhabditis elegans (C. elegans) gelişim biyolojisi, yaşlanma, nörobiyoloji ve genetiği incelemek için değerli bir model organizma olmuştur ve olmaya devam etmektedir. C. elegans üzerindeki büyük çalışma gövdesi, karmaşık biyolojik bileşenleri ve başka bir organizmayla ilişkilerini parçalamak için büyük popülasyonlu, tam hayvan çalışmalarına entegre olmak için ideal bir adaydır. C. elegans'ı işbirlikçi -omiks araştırmalarında kullanmak için, karşılaştırmalı analizler için tek bir örneğin çeşitli platformlarda bölünebileceği ve tahlil edilebileceği büyük hayvan popülasyonları oluşturmak için bir yönteme ihtiyaç vardır.
Burada, büyük ölçekli bir kültür plakasında (LSCP) bol miktarda karışık aşama C. elegans popülasyonu ve sonraki fenotipik verileri kültürlemek ve toplamak için bir yöntem sunulmuştur. Bu boru hattı, -omics deneyleri (genomik, transkriptomik, proteomik ve metabolomik) için gerekli tüm verilerle birlikte fenotipik ve popülasyon verilerini toplamak için yeterli sayıda hayvan verir. Buna ek olarak, LSCP yöntemi hayvanların kendileri için minimum manipülasyon gerektirir, daha az kullanıcı hazırlama süresi sağlar, sıkı çevresel kontrol sağlar ve genel tekrarlanabilirlik için her numunenin işlenmesinin çalışma boyunca tutarlı olmasını sağlar. Son olarak, belirli bir LSCP'de C. elegans yaşam evrelerinin nüfus büyüklüğünü ve nüfus dağılımını belgeleme yöntemleri sunulmuştur.
Giriş
C. elegans, dünya çapında çeşitli doğal yaşam alanlarında bulunan küçük bir serbest yaşayan nematoddur1. Göreceli büyüme kolaylığı, hızlı üretim süresi, üreme sistemi ve şeffaf vücudu, onu gelişim biyolojisi, yaşlanma, nörobiyoloji ve genetik alanında yaygın olarak incelenmiş güçlü bir model organizma haline getirir2,3. C. elegans üzerindeki bol çalışma, fenotipleri karmaşık biyolojik bileşenlerle ve belirli bir organizmadaki ilişkileriyle kapsamlı bir şekilde ilişkilendirmek için -omics çalışmalarında kullanmayı birincil aday haline getirir.
C. elegans'ı işbirlikçi -omiks araştırmalarında kullanmak için, tek bir örneğin bölünebileceği ve karşılaştırmalı analizler için çeşitli platformlar ve araçlar arasında kullanılabileceği büyük karma aşama hayvan popülasyonları oluşturmak için bir yönteme ihtiyaç vardır. Böyle bir örnek oluşturmak için bir boru hattı oluşturmak diyet, çevre, stres, nüfus yapısı ve numune işleme ve toplama konusunda keskin bir farkındalık gerektirir. Bu nedenle, standart ve tekrarlanabilir kült oluşturma koşullarının büyük ölçekli boru hatlarına entegre edilmiş olması çok önemlidir. C. elegans araştırmasında, solucanları kültüre etmek için iki geleneksel yöntem kullanılır - agar Petri yemekleri ve sıvı kültürü4.
Tarihsel olarak, büyük miktarlarda C. elegans gerektiğinde, sıvı kültüründe yetiştirilirler4. Sıvı kültüründe büyük bir solucan popülasyonu oluşturmada yer alan adımlar, genellikle gravid yetişkin manikürlerini yırtmak için beyazlatma senkronizasyonunu içeren ve istenen popülasyon büyüklüğüne ulaşmak için embriyoları serbest bırakan birden fazla işleme adımı gerektirir. Bununla birlikte, çamaşır suyu senkronizasyonu kullanıldığında, nüfus artışı nüfus sayımı büyüklüğüne bağlıdır ve bu nedenle sonraki büyüme ve nüfus sayılarını etkiler. Ek olarak, C. elegans suşları tiksel hassasiyetlerinde, maruz kalma sürelerinde ve çamaşır suyu senkronizasyonu için stres tepkilerinde değişiklik gösterir, bu da birçok suşu aynı anda test etmeyi zorlaştırır5,6,7,8,9.
Ek olarak, sıvı kültüründe solucan büyümesi birkaç transfer adımı gerektirir, çünkü hasattan önce sadece bir nesil solucan yetiştirilmesi önerilir, çünkü aşırı kalabalık birden fazla nesil için yetiştirilirse kolayca oluşabilir ve yiyeceklerin varlığına rağmen lahana oluşumuna yol açabilir10. Dauer oluşumu, genellikle "dauer feromonları" olarak adlandırılan ascarosides gibi küçük sinyal molekülleri yoluyla meydana gelir11,12,13,14, sıvı ortama salınır ve popülasyonun büyümesini etkiler. Ayrıca, sıvı kültüründe büyüyen büyük solucan popülasyonları, kültürde aşırı bakteri birikimine yol açarak, aşağı akış fenotipik tahliller için temiz bir örneğe ihtiyaç duyulduğunda zorluklar yaratır. Son olarak, bir sıvı kültürü kirlendiğinde, mantar sporları veya bakteri hücreleri medya boyunca kolayca dağıldığı için bakımı daha zordur15.
C. elegans yetiştirmenin diğer geleneksel yöntemi agar Petri tabaklarıdır. Piyasada bulunan Petri yemekleri, sıvı kültürlerinde görüldüğü gibi aşırı kalabalık ve yüksek lahana turşusu oluşumunun hızlı etkileri olmadan birden fazla nesil karışık aşama solucanı kolayca yetiştirmeye izin verir. Bununla birlikte, geleneksel agar Petri yemeklerinde solucan büyümesinin bir dezavantajı, piyasada bulunan en büyük Petri kabının, bir ağartıcı senkronizasyon adımı eklemeden bir -omics çalışması için büyük solucan popülasyonları sağlamamasıdır. Özetle, C. elegans'ın karışık aşama popülasyonlarını agar Petri tabaklarında kültleme yapmak - omics verilerini toplamak için daha uygundur, ancak sıvı kültleme olmadan çok büyük nüfus boyutları oluşturmak için bir yönteme ihtiyacımız vardı.
Burada, büyük ölçekli kültür plakalarında (LSCP) büyük karışık aşama C. elegans popülasyonlarını kültüre ve toplamaya yönelik bir yöntem sunuyoruz. Bu işlem hattı aracılığıyla numune toplamak, fenotipik ve popülasyon verilerini toplamak için yeterli örnek ve -omics deneyleri için gerekli tüm verileri(örneğin,genomik, transkriptomik, proteomik ve metabolomik) verir. Buna ek olarak, LSCP yöntemi hayvanların minimum manipülasyonu, daha az kullanıcı hazırlık süresi gerektirir, sıkı çevresel kontrol sağlar ve her numunenin işlenmesinin genel tekrarlanabilirlik için çalışma boyunca tutarlı olmasını sağlar.
Protokol
1. LSCP ve ekipmanı sterilize edin
- Deneye başlamadan önce cam eşyaların kirletici içermemesini sağlamak için el yıkama, ardından bulaşık yıkama ve ardından otoklavlama ile cam LSCP'leri hazırlayın. Otomatik kapatılmış LSCP'leri kullanıma gelene kadar temiz ve kuru bir yerde saklayın.
NOT: LSCP'lerin bulaşık makinesi ve otoklav güvenli olduğundan emin olun. LSCP kapaklarının bulaşık makinesinde güvenli olduğundan emin olun. - LSCP kapaklarını el yıkama ve ardından bulaşık yıkama ile hazırlayın. LSCP kapaklarını ihtiyaç duyulana kadar temiz bir depo kutusunda saklayın.
- Nematod Growth Media Agarose'un (NGMA) hazır olduğu gün, LSCP kapaklarını iki kez% 10 çamaşır suyu çözeltisi ve ardından% 70 etanol ile silin. %10 çamaşır suyu ve %70 etanol ile silindikten sonra, LSCP kapaklarını NGMA'nın hazırlanacağı laminer akış başlığındaki temiz bir kutuda tutun.
2. Nematod büyüme ortamı agarose (NGMA) hazırlayın
- Aşağıdaki reaktifleri bir karıştırma plakasında karıştırma çubuğu ile otoklavlanmış 2 L Erlenmeyer şişesinde birleştirerek NGMA'yı hazırlayın: 2,5 g pepton, 3 g NaCl, 7 g agarose, 10 g agar ve 975 mL steril su16. Toplam hacmin 1 L'ye eşit olduğundan emin olun, bir folyo kapağı şişeye bantlayın.
NOT: Burada açıklandığı gibi NGMA için hazırlık adımları 2,5 LSCP için yeterli malzeme sağlayacaktır. Protokol, belirli bir denemede gerekli LSCP toplu iş boyutuna uyarlanabilir. - 45 dakika boyunca 121 °C ve 21 p.s.i.'de sıvı döngüsünde otoklav.
- Su banyoyu açın ve 50 °C'ye ayarlayın. Otoklavlı NGMA'yı 50 °C'ye kadar soğuması için su banyosuna getirin.
- Kaputa veya temizlenmiş alana 2 L Erlenmeyer NGMA şişesi getirin ve bir karıştırma plakasına ayarlayın. NGMA sıcaklığını izlemek için bir termometre kullanın.
- NGMA 50 °C'ye ulaştıktan sonra, kaputun içinde steril bir tek kullanımlık pipet veya temizlenmiş alan ile listelenen sırayla aşağıdakileri ekleyin: 25 mL 1 M KH2PO4 (K fosfat tamponu), 1 mL kolesterol (etanolde 5mg / mL), 1 mL 1 M CaCl2, 1 mL 1 M MgSO4,1 mL nystatin (10mg / mL) ve 1 mL streptomisisinin (100 mg / mL)16.
- Yaklaşık 1,3 cm derinliğinde steril bir cam LSCP'ye 400 mL NGMA dökün, LSCP'nin kaputtaki düz yüzeyde katılaşmasını ve otomatik kapatılmış folyo kapağı LSCP'ye geri yerleştirmesini sağlar.
- Agar ayarlandıktan sonra folyoyu çıkarın ve LSCP'ye temiz bir hava geçirmez kapak yerleştirin ve depolama için 4 °C'ye geçin. NGMA'yı 5 gün içinde kullanıma ve kullanıma kadar 4 °C'de LSCP'lerde saklayın.
3. LSCP'de NGMA için E. coli gıda üretin
- Kararlı bir gıda kaynağı oluşturmak için, merkezi sınır teoremi17ile tutarlı küçük bir toplu ortalama konsepti kullanarak HT115 (DE3) E. coli partileri oluşturun. -80 °C'de saklayın. Gerektiğinde E. coli bakteri stoklarını -80 °C'den18çözün.
NOT: Bu protokolde E. coli bakteri stokları biyoreaktörde yetiştirilmiştür. Kültür büyümesinin sonunda, kültür 1:50'de seyreltildi ve ölçülen OD600 0.4 idi. Böylece, kültür20'nin 600'ü etkili bir OD'ye sahipti. Bakteriler 0,5 g/mL (ıslak ağırlık) konsantrasyonda K ortamında peletlendi, tartıldı ve yeniden depolandı, 2 mL aliquots'a aktarıldı ve19donduruldu.
4. NGMA üzerinde bakteri çimi
- Tüm LSCP'nin RT'ye ulaşmasını sağlamak için bakteri çimlerini yaymadan önce NGMA LSCP'lerini 4 °C'den oda sıcaklığına (RT) birkaç saat boyunca getirin.
- Gerekli E. coli bakteri stoklarını -80 °C'den çözün18'eçekin.
- NGMA LSCP başına 4 mL'de 0,5 g E. coli elde etmek için E. coli bakteri stoklarını 2 mL steril K-medium ile seyreltin. NGMA LSCP'nin ortasında dikkatlice pipet 4 mL E. coli.
- Bakterileri bir dikdörtgene yaymak için steril bir serpme kullanın ve NGMA E. coli'nin kenarlarında yaklaşık 3,8 cm yer bırakın.
- NGMA LSCP'yi, E. coli süspansiyonunun tamamen kurumasını sağlamak için fanı 1 saat boyunca kaputta E. coli ile bırakın.
- Bakteri çimleri kuruduktan sonra, kapağı sıkıca bastırın ve kullanılana kadar 4 °C'de saklayın.
5. Numuneler arasında stresi ve yaş değişkenliğini azaltmak için solucanları parçala
- Solucanları donmuş bir solucan stoğundan yeni tohumlanmış 6 cmplakaya kadar çizgi 4. Bu plaka "ana öbek" plakası olarak hizmet edecektir.
NOT: Öbekleme, solucanları homozigöz bir suştan aktarmak için en uygun yöntemdir20. Bir suş heterozipözse veya toplama ve çiftleşme ile sürdürülmesi gerekiyorsa, öbekleme tavsiye edilmez. Öbekleme sıklığının, kullanılan solucan genotiplerine, büyüme için seçilen sıcaklığa ve aşağı akış adımlarına bağlı olarak optimize edilmesi gerekebilir. - Ana öbek plakası sağlıklı gravid yetişkinlerle (yaklaşık 3 gün) dolduktan sonra, bol miktarda E. coli çimi hala mevcut, dört toplam öbek plakası üretmek için WormBook'ta açıklandığı gibi standart C. elegans öbekleme yönergelerini izleyin4.
- Büyüme için aksi belirtilmedikçe, tüm öbek plakalarını 20 °C'de kontrollü bir sıcaklık (CT) odasında saklayın.
NOT: Bu protokolün kullanıcıları burada açıklandığı gibi bir CT odasına erişemezse, sıcaklığın kontrol edilebildiği küçük bir inkübatör veya çevresel koşulların mümkün olduğunca kontrol edilebileceği belirlenmiş bir oda kullanılması önerilir. Bu alternatif seçeneklerden hiçbiri mevcut değilse, örnek büyümedeki varyasyonun daha büyük olabileceğini unutmayın. - 4. öbek plakasında birçok gravid yetişkin gözlendikten sonra, Adım6'ya geçin.
6. LSCP üzerine gravid yetişkinleri lekeleyin
NOT: Bu ağartma tekniği, çoğu kirleticiyi yok etmek ve yetişkin solucandan embriyoları serbest bırakan hermafroditlerin kütikülünü çözmek için kullanılır. Çamaşır suyu çözeltisi embriyolar yumurtadan çıkmadan önce NGMA'ya batırılır.
- LSCP'leri, ağartma solucanlarını tespit etmeden önce birkaç saatliğine RT'ye getirin.
- 7:2:1 ddH2O oranı hazırlayın: çamaşır suyu : 5 M NaOH. Bu alkali hipoklorit çözeltiyi kullanmadan hemen önce taze hale getirin.
NOT: Çamaşır suyu toplu etkilerini önlemek için belirli bir deney süresince aynı çamaşır suyu ve NaOH stoğunu kullanın. Bu protokolde kullanılan çamaşır suyu % 5-10 sodyum hipoklorit idi. - Devam etmeden önce bir Bunsen brülörü yakın ve bir solucan topuz alev alın. LSCP'deki bakteri çimlerinin kenarından steril bir kazma üzerine taze E. coli kepçe.
- Spot ağartma için4.
- Alkali hipoklorit çözeltisinin pipeti 5 μL, LSCP'nin E. coli çimlerinden uzakta bir köşesine.
- Toplanan gravid yetişkini 5 μL alkalin hipoklorit çözeltisine yerleştirin. Manikür bozmaya ve yumurtaları serbest bırakmaya yardımcı olmak için nematoda dokunun.
- Toplam 4x için 6.4 - 6.6 adımlarını tekrarlayın ve 5 gravid yetişkini E. coli çimlerinin etrafına eşit şekilde yerleştirin. Neredeyse genetik olarak izojenik bireylerin belirli bir örneğe eklenmesini sağlamak için aynı4.
- Kapağı tekrar LSCP'nin üzerine yerleştirin.
- Tüm LSCP'ler için adımları yineleyin.
7. Kontrollü sıcaklık (BT) odasında solucan büyümesi
- Nokta ağartma işlemine devam ettikten sonra, kapağı LSCP'ye sıkıca yerleştirin ve ct odasına sabit hava akışı ve 12L:12D fotoperiyod (12 saat ışık ve 12 saat karanlık) ile 20 °C'ye ayarlayın.
- Örneğin CT odasına yerleştiği saate ve konuma dikkat edin.
NOT: Oda içindeki konum, numunelerin büyürken karşılaşabileceği çevresel farklılıkları kaydetmek için her zaman belgelenmelidir. Örnek CT odasına girdikten sonra, atanmış yerinde bozulmadan kalmalıdır. Bulaşma olasılığını azaltmak için CT odasında LSCP'nin kapağını açmayın. - LSCP'yi ct odasının dışında bir mikroskopa götürerek nüfus artışını ve yoğunluğunu gözlemleyin.
NOT: Her C. elegans suşu ve numunesi büyümesinde değişiklik gösterir, bu nedenle numuneleri yakından izleyin. BT odasındayken LSCP'nin büyümesini bozmamanız önerilirken, LSCP'ler CT odasından taşındı ve örnek büyümesini izlemek için her 2 günde bir kapaklar açıldı. Kapalı kapakların her 2 günde bir LSCP'lerden alınması, O2'nin LSCP'ye akmasını da sağlar. - Hasat etmeden önce LSCP'nin büyük bir solucan popülasyonu ile dolu olduğundan emin olun. LSCP'nin toplanmaya hazır olup olmadığına karar vermek için aşağıdaki ölçütleri kullanın.
- LSCP'nin gravid yetişkin solucanlarla dolu olduğundan emin olun.
- Plakanın büyük bir popülasyon boyutu içerdiğinden emin olun (yani, solucanlar agarın tüm yüzeyini kaplar).
- Plakanın agar yüzeyinde çok fazla yumurta olmadığından emin olun(yani,maksimum solucan sayısı yumurtadan çıkmış olmalıdır).
- Plakanın en az veya hiç E. coli kalmadığından emin olun, bu da solucanların açlıktan öleceğini ve iki gün daha tabakta bırakılırsa lahana larvaları üreteceğini gösterir.
NOT: Çoğu LSCP 10 ila 20 gün arasında hasat yapmaya hazır olsa da, gerinim ve örneğe bağlı olarak, normal hasat sürelerini belirlemek için bu protokolü oluşturduktan sonra her LSCP'yi sık sık kontrol edin.
- Suşlar arasında çapraz kontaminasyonu önlemek için eldivenleri ve LSCP'leri kullanma arasında % 70 etanol içeren alanı temizleyin.
8. LSCP örneğinin toplanması
- Numuneleri hasat etmeden önce santrifüjün 4 °C'ye kadar soğumasını bekleyin.
- Hasat edilecek LSCP başına 50 mL M9 çözeltisi ile üç adet 50 mL konik boru hazırlayın.
- LSCP başına bir adet 15 mL konik tüpü etiketle.
NOT: Tüm santrifüjleme adımları 15 mL konik tüpte gerçekleştirilir, çünkü solucanlar bu tüplerde iyi peletleme eğilimindedir. - LSCP yüzeyine 50 mL M9 çözeltisi (Adım 8.2'deki bir 50 mL konik tüpten) dökün ve M9'un tüm NGMA yüzeyini kapladığından emin olmak için etrafında dönün.
- M9 LSCP yüzeyinde otururken, M9 ile steril bir serolojik pipet astarlayın.
NOT: Steril serolojik pipetleri M9 ile primleyerek, plastik pipet içine daha az solucan yapışmasını sağlayarak numune kaybını önler. - LSCP'yi eğin, böylece M9 ve solucan popülasyonu LSCP'nin bir köşesinde toplanır.
NOT: LSCP'den M9 çözeltisi ve solucanların karışımı, aşağı akış adımlarında "solucan süspansiyonu" olarak adlandırılacaktır. - Otomatik pipettörlü astarlı serolojik pipet kullanarak pipet solucanı süspansiyonu ve orijinal 50 mL konik tüpe yerleştirin. 50 mL solucan süspansiyonu toplandıktan sonra, bakteri kümelerini ve döküntülerini bozmak için konik tüpü bir rocker üzerine yerleştirin.
- LSCP başına 150 mL solucan süspansiyonu toplama 8.4 - 8.7 adımlarını yineleyin.
- 8.3 adımında kenara ayrılmış etiketli 15 mL konik tüpe dökülerek, üç 50 mL konik tüpten birinden 15 mL solucan süspansiyonu aktarın. 15 mL konik tüpü 884 x g'da 4 °C'de 1 dakika santrifüj edin. Solucanların çoğu tüpün dibinde peletlenecektir.
- Solucan peletini rahatsız etmemeyi sağlamak için süpernatantı aspire edin.
- 150 mL solucan süspansiyonunun tamamı tüketilene kadar aynı 15 mL konik tüp tekrarlayan adımlar 8.9 ve 8.10'a yaklaşık 13 mL solucan süspansiyonu eklemeye devam edin. Tüpü ters çevirin ve mümkün olduğunca çok bakteri ve döküntü yıkamak ve aspire etmek için santrifüjler arasındaki peleni rahatsız edin.
NOT: Bu adımda, üç 50 mL konik tüpün içeriği tek bir 15 mL tüpte yoğunlaştırılmıştır. - 15 mL konik tüpe 10 mL temiz M9 ekleyin ve solucan peletini ters çevirerek ajite edin. 15 mL konik tüpü 884 x g'da 4 °C'de 1 dakika santrifüj edin. Solucan peletini rahatsız etmemeyi sağlamak için süpernatantı aspire edin. İki kez tekrarlayın.
NOT: Numunede çok miktarda döküntü veya bakteri varsa, numune temizleninceye kadar 8.12 adımını tekrarlayın. - Numune temizlendikten sonra, toplam 10 mL ddH2O ve solucan için solucan peletine ddH2O ekleyin. Solucan peletini ters çevirerek ajite edin. Solucanların ozmotik stresi önlemek için 5 dakika veya daha az bir süre ddH2O'da kalması gerektiğinden, 9.1 adımına hızla geçin.
NOT: DDH2O'da solucan peletlerinin askıya alınmasının aşağı akış -omics adımları için tercih edilen çözücü olduğudur. Solucanlar, belirli bir deneysel iş akışıyla uyumluysa, diğer çözücülerde veya arabelleklerde askıya alınabilir.
9. Nüfus büyüklüğünü tahmin edin
NOT: Adım 9.1 – 9.7 arasında hızla ilerleyin. Adım8.13'tenddH 2 O ve solucanların karışımı, sonraki adımlarda "solucan örneği" olarak adlandırılır.
- Solucan örneğini pipetlemeden önce, plastik pipet içine yapışan solucanların numune kaybını önlemesini ve sayım varyasyonunu azaltmasını önlemek için M9 ile kullanılacak prime pipet ucu.
- 100 μL solucan örneği alın ve 900 μL M9'a seyreltin. İyice karıştırın ve seri seyreltme yapın (1:10, 1:100, 1:1000). Toplam üç aliquot çoğaltma kümesi elde etmek için bu adımı iki kez yineleyin.
NOT: Pipetleme solucanları örnek popülasyon sayılarında yüksek değişkenliğe neden olabilir. İstenen aliquot pipetlemeden önce solucan örneğinin homojen olduğundan emin olun. - Aliquots sayılırken hareketli kültüre devam etmek için bir rocker üzerindeki 15 mL konik tüpü ayarlayın.
- Solucan örneğinin iyi karışık ve homojen olduğundan emin olun. Pipet 5 μL 1:10 solucan örneğinden, bir mikroskopi slaydına dağıtın ve solucan sayısını sayın. Bu sayı yaklaşık 50 solucandan azsa, 1:100 ve 1:1000 seyreltmelerini de sayın. 50'den fazlaysa, bir sonraki seri seyreltmeye geçin.
NOT: Çok fazla solucan doğru bir şekilde sayılamıyorsa, bunun yerine saymak için bir sonraki seri seyreltmeyi kullanın. - Her seyreltmenin her aliquot çoğaltmayı 3x sayın. Sayımın sonunda, çoğu kültür için 9 toplam sayım belgelenecektir(yani,her aliquot çoğaltması için 3 toplam sayım).
- Solucan örneğinin tahmini popülasyon boyutunu belirlemek için seyreltme sayılarının ortalamasını alır. Bu seyreltme sayımları, -omics adımları için istenen aliquot boyutunu oluşturmak için gereken solucan örneğinin hacmini belirleyecektir.
NOT: Bu deneyde yaklaşık 200.000 karışık evre solucandan aliquots oluşturulmuştır. Buna ek olarak, yaklaşık 50.000 karışık aşamalı solucandan oluşan bir aliquot, büyük bir parçacık akış sitometresinde (Adım 10'da açıklanmıştır) sıralamak için ayrılmıştır. - Solucan örneği uygun aliquotlara bölündükten sonra, sıvı nitrojende flaş dondurun ve numuneyi -80 °C'de saklayın.
NOT: Büyük parçacık akış sitometrisi için tasarlanan aliquot'ı dondurmayın.
10. (İsteğe bağlı) Büyük parçacık akış sitometrisi için hazırlık örneği
NOT: 10, 11 ve 12 numaralı adımlar, yazarların örnek büyümeyi kaydetmek(yani, C. elegans yaşam döngüsü aşamalarının nüfus büyüklüğü ve nüfus dağılımı) kaydetmek ve bir kültürün başarısını belirlemek için tercih ettikleri yöntemdir. Bu protokolün kullanıcıları isteğe bağlı Adım 10, 11 ve 12'yi kendi büyüme başarısı ölçümleriyle değiştirebilir. Adım 10, 11 ve 12 burada iki nedenden dolayı açıklanmıştır; ilk olarak, Adım 10, 11 ve 12'de kullanılan donanıma sahip kullanıcılar, bu büyüme yönteminin doğrulanmasını göstermek için bu adımları ve ikinci adımları çoğaltabilir. Yukarıdaki 9. adım, aliquot boyutlarını belirlemek için toplam solucan sayısının iyi bir tahminini sağlar ve adım 10, belirli bir örnekteki solucanların sayısını ve popülasyon dağılımını tahmin etmek için daha nicel bir metriktir.
- M9 çözümünde yaklaşık 50.000 karışık aşamalı solucanın (Adım 9.6'da bir kenara bırakılarak) toplam hacmini 10 mL'ye kadar getirin.
- 1 mg/mL E. coli ve 0,5 μM kırmızı floresan mikroküreci19seyreltme 1:50 seyreltme oluşan bir çözelti yapın.
- M9'daki 10 mL karışık aşama solucanlara bu çözeltinin 200 μL'sini ekleyin ve 20 dakika sallanırken kuluçkaya yaslanın.
- 20 dakika sonra, 15 mL konik tüpü 884 x g'da 4 °C'de 1 dakika santrifüj edin.
- Solucan peletini rahatsız etmemeyi sağlamak için süpernatantı aspire edin.
- Solucan peletini M9 çözeltisi ile iki kez yıkayarak fazla bakterileri ve kırmızı floresan mikrokürecikleri ortadan kaldırın.
- Solucan peletin içine 5 mL M9 ekleyin ve peletin temiz göründüğünden emin olun. Pelet temizse, doğru sayım ve boyutlandırma için solucanları hem düzeltmek hem de öldürmek için 50 mM sodyum azit ile 5 mL M9 ekleyin21.
- Sodyum azid numuneye eklendiğinde belge saati ve tarihi.
- Numuneyi büyük parçacık akış sitometrisi için gerekli olana kadar rocker'da bir kenara koyun.
NOT: Sodyum azitin nematod fizyolojisini(yanivücut uzunluğu, metabolizma ve termotoleransı) etkilediği bilinmektedir. Bu nedenle, solucanların sodyum azide maruz kaldığı zamanı not etmek önemlidir, çünkü bu fizyolojik etkilerin çoğu birkaç dakika içinde gerçekleşir22. Sodyum azitin solucanlar üzerindeki bilinen fizyolojik etkileri nedeniyle, bu tedavi aşağı akış görüntü kalitesini etkileyecektir ve göz önünde bulundurulmalıdır.
11. (İsteğe bağlı) Nüfus dağılımının belgelenerek görüntüleme için 384 kuyu plakasının hazır
NOT: Adım 11 büyük bir parçacık akış sitometresi (LPFC) kullanır. Bu protokolde bir LPFC'nin temel bilgisi varsayılır. Örneklerin büyümesini ve nüfus dağılımını belge etmek için diğer yöntemler ikame edilebilir. Burada belgelenen adımlar, işlem hattı23'te bir LPFC kullanmayı planlayan kullanıcılar içindir.
- LPFC'yi açın, temizleyin ve astarlayın ve numuneleri sıralamadan önce lazerlerin 1 saat ısınmasına izin verin.
- Lazer ısındıktan sonra , "Histogram" profilini açın ve 2050 uçuş zamanına (TOF) ölçeklendirin.
- 100 TOF aralığını kapsayan "Histogram" a bir çubuk bölge ekleyin. İlk bar bölgesi 50-150 TOF'u kapsar.
- Her biri 100 TOF aralığına yayılan yirmi çubuk bölge oluşturmaya devam edin. Bu çubuk bölgeler 50 – 2050 yılları arasında tüm TOF aralığına yayılacak. TOF dağıtımında kullanılacak tam geçişli bölgeler için Tamamlayıcı Tablo 1'e bakın.
- Gelecekteki LPFC çalıştırmalarında kullanmak üzere bu Histogram'ı "Deneme" olarak kaydedin.
- Nesneleri dağıtmak için kalibre edilmiş 384 kuyu plakası veya 384 kuyu plakasına kalibre edilmiş bir cihaz seçin.
- Kalibre edilmiş 384 kuyulu plaka şablonuna girdikten sonra, Adım 11.3-4 sırasında oluşturulan 20 çubuk bölgesinin her biri için 20 kapılı nesneyi dört kuyuya (her kapılı bölgenin dört teknik çoğaltması) dağıtacak şablonu ayarlayın. Solucanların 384 kuyu plakasına nasıl dağıtılacağına ilişkin örnek bir düzen için Ek Tablo 2'ye bakın.
- Numuneyi adım 10,9'dan 50 mL konik tüpe aktarın ve yaklaşık 40 mL toplam hacim elde etmek için ek M9 çözeltisi ekleyin.
- Numuneyi 11,7 adımda ayarlanan parametrelere göre otomatik olarak sıralamaya başlayın ve numuneden kalibre edilmiş 384 kuyu plakasına nesnelerin yerleştirilmesini ve aynı anda dağıtılmasını önlemek için numuneyi sürekli karıştırın.
NOT: LPFC'nin akış hızının saniyede 15-20 nesne arasında çalıştığından emin olun ve sıralanacak çiftler belirtmeyin. - Numunenin tamamı sıralandıktan ve maksimum kapılı bölge sayısı 384 kuyu plakasına dağıtıldıktan sonra, numuneyi LPFC'den çıkarın ve cihazı temizleyin.
NOT: Daha büyük TOF bölgelerine ulaşıldığında, bu TOF bölgesindeki düşük olay sayısı nedeniyle 384 kuyu plakasını doldurmaya devam etmek zorlaşabilir. C. elegans yaşam aşamalarının numune tükenmeden önce LPFC dağılımına nerede düştüğü hakkında en iyi fikri almak için kapılı bölgelerin mümkün olduğunca çoğunu doldurun. - Görüntülenene kadar 384 kuyu plakasının üzerine bir sızdırmazlık filmi yerleştirin.
NOT: Numuneler sodyum azit22ile tedavi edildiklerinden, sıralamadan sonra görüntü plakası mümkün olduğunca çabuk. Kırmızı floresan mikroküreciler, hangi nesnelerin canlı solucanlar, ölü solucanlar, dauers veya önemsiz24olduğunu belirlemeye yardımcı olmak için her sıralanmış nesnede yayılan kırmızı floresan düzeyine bağlı olarak toplanan LPFC veri dosyalarında(çıktı metin dosyasındaki PH Kırmızı verileri) görülebilir.
12. (İsteğe bağlı) Görüntüleme 384 kuyu plakası
NOT: Adım 12, plaka okuma mikro konfokal mikroskobu kullanır. Bu protokolde mikro konfokal mikroskop hakkında temel bilgiler varsayılıyor. Örneklerin büyümesini ve nüfus dağılımını belge etmek için diğer yöntemler ikame edilebilir.
- 20x lensli bir plaka okuma mikro konfokal mikroskobu kullanarak.
- "Amaç ve Kamera" sekmesini açın ve "10x Plan ApoLambda" moduna ayarlayın.
- "Kamera Binning" sekmesini açın ve "2" olarak ayarlayın.
- "Plakada Ziyaret Etmek İçin Siteler" sekmesini açın ve daha sonra görüntüleri bir araya getirmek için " Kuyu başına4" site ve "sitelere % 10 örtüşme" olarak ayarlayın.
- "Wavelength" sekmesini açın ve "Brightfield 1" olarak ayarlayın.
- "Aydınlatma" sekmesini açın ve "İletilen ışık, parlak örnek" olarak ayarlayın.
- 384 kuyu plakasını mikroskopa yerleştirin ve "Z Yığınını"Ofset Hesapla" olarak ayarlayın ve 384 kuyu plakasındaki numuneler için uygun odak düzlemini bulun.
- Kuyu başına dört görüntü toplayan mikro konfokal mikroskopta 384 kuyu plakasını çalıştırın.
- Kuyu başına bir görüntü oluşturmak için dört görüntüyü birlikte montajlayın.
Sonuçlar
C. eleganların LSCP yöntemini kullanarak büyümesi, 12,2 gün boyunca örnek başına ortalama 2,4 milyon karma aşama solucanı verir. LSCP yöntemini kullanan C. eleganların büyümesi, kullanıcıların hayvanların çok az elleçlenerek ve manipülasyonuyla büyük karma aşama C. elegan popülasyonları oluşturmalarını sağlar, bu da büyük ölçekli -omik çalışmaları için idealdir (Şekil 1). Bir LSCP yetişkin solucanlarla dolduğunda, büyük bir nüfus büyüklüğüne ulaştığında ve minimum bakteri kaldıktan sonra, kullanıcılar popülasyon boyutunu hasat edebilir ve tahmin edebilir. Bu nokta, popülasyonun bir -omics işlem hattında kullanmak için yeterli olup olmadığını değerlendirerek bir kalite kontrolü görevi de yapabilir (Şekil 2). Nüfus dinamikleri, türün kendisine, suşun davranışına(yani,yuvalama suşlarının daha düşük solucan iyileşmesine sahip olma eğiliminde olduğu) ve büyüme başarısına (yani kirlenmeye)bağlıdır. LSCP yöntemi, Caenorhabditis Genetics Center (CGC) mutantları ve Caenorhabditis elegans Natural Diversity Resource (CeNDR) vahşi suşlarının bir karışımını içeren15C. elegans suşu üzerinde test edildi 25 . Gerinim genotipleri Ek Tablo 3'te açıklanmıştır.
LSCP yöntemi yaklaşık 94.500 ila 9.290.000 arasında nüfus büyüklüğü sağladı. Referans suşu, PD1074 ve suşlar arasındaki ortalama popülasyon büyüklüğü yaklaşık 2,4 milyon solucandı(Şekil 3). Ortalama 12,2 LSCP büyüme günü boyunca C. elegans suşları arasında tahmini nüfus büyüklüklerinde anlamlı bir fark bulunmadı (Şekil 4). PD1074 LSCP'lerin tam karma aşama popülasyona çıkması 10 - 14 gün arasında sürdü. PD1074 genelinde ortalama büyüme süresi 10 gündü. En yavaş büyüyen suş en fazla 20 gün, en hızlı büyüyen suş ise en az 10 gün büyüdü(Şekil 4).
Bu nedenle, bu LSCP yöntemini kullanarak, kullanıcılar yeni ilgi alanlarını gelişimsel zamanlama ve arka plan uzmanlığı hakkında çok az bilgiye sahip bir çalışmaya kolayca entegre edebilir. Toplama ile sürdürülmesi gereken, doğurganlık kusurları olan, heterozipöz olan veya büyüme kusurları olan suşların ve fenotiplerin bu işlem hattında iyi çalışmayabileceğini unutmayın.
Büyük parçacık akış sitometrisi ve örneklerin görüntülenmesi, kullanıcıların nüfus dağılımını belgelemelerini sağlar. Başarılı nüfus artışını ölçmek için çok çeşitli platformlar kullanılabilir.
Tekrarlanabilir -omik ölçümleri için tutarlı kültürler yetiştirmek önemlidir. Kültürün tekrarlanabilirlik ölçümleri solucan sayısı ve belirli bir suş için tutarlı bir boyut dağılımıdır. LPFC 23 ,26 ve mikro konfokal mikroskop görüntülerini büyüme başarısı için proxy olarak kullanarak orijinalN2Bristol suşunun bir çeşidiolanPD1074 referans suşu için örnek dağılımını gösteriyoruz. Solucanlar LPFC dağılımında L1 aşamasından gravid yetişkine kadar ölçüldüğünden (Şekil 5), sonraki görüntüleme (Şekil 6) ve örnekler arasındaki popülasyon dağılımındaki varyasyon (Şekil 7), bu boru hattının karışık aşama C. eleganspopülasyonu oluşturduğunu görebiliriz.
Karma aşama örneklerimizin nüfus dağılımına daha yakından bakmak için, tüm Uçuş Süresi (TOF)(yanivücut uzunluğu) dağılımı boyunca her bölgeye giren solucanların yüzdesine bakarak 35 PD1074 LSCP'nin dağılımına baktık (Şekil 7A,B).
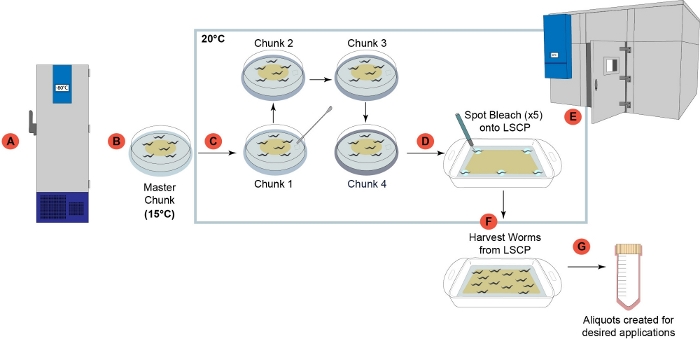
Şekil 1: LSCP solucan büyüme ardışık düzenine genel bakış. (A) Laboratuvarda alındıktan sonra, tüm suşlar hazırlandı ve -80 °C2'deuzun süreli depolama için donduruldu. (B) Dondurulmuş bir solucan stoğundan bir "ana öbek" plakası hazırlandı ve bir aydan uzun süre kullanılmamak üzere 15 °C'de saklandı. (C) Her örnek, LSCP'de büyümeden önce nesil stresini azaltmak için art arda dört öbekleme adımından geçti. ( D ) Adım(D)'deki "öbek 4" 6 cm plakadan 5 bireysel gravid yetişkin seçildi ve LSCP'nin beş belirli alanında ağartıldı. (E) LSCP Kontrollü Sıcaklık odasına yerleştirildi ve LSCP yetişkin solucanlarla dolu olana, büyük bir nüfus büyüklüğüne ulaşana ve minimum bakteri kalana kadar 20 ° C'de yetiştirildi. (F) Solucan popülasyonu hasat edildi ve aşağı akış adımları için toplandı. (G) Aliquots LSCP'den oluşturuldu ve aşağı akış istenen uygulamalar için flaş donduruldu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
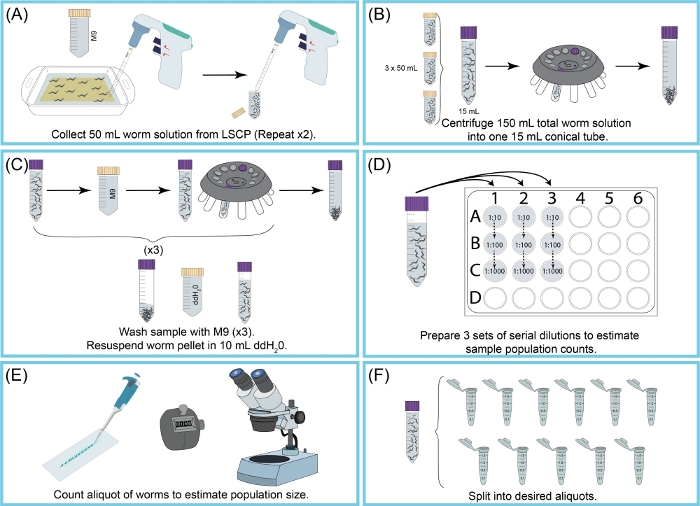
Şekil 2: LSCP hasadına ve nüfus büyüklüğünü tahmin etmeye genel bakış. (A) 50 mL M9, solucanları NGMA yüzeyinden yıkamak için kullanıldı. Solucan süspansiyonu 50 mL konik bir tüpe pipetlendi. Adım (A) iki kez tekrarlandı. (B) 15 mL solucan süspansiyonu yeni bir 15 mL konik tüpe döküldü. Solucanlar santrifüjle topaklandı. M9 + enkaz rahatsız edici solucan pelet olmadan aspire edildi. Adım (B), 150 mL solucan süspansiyonunun tamamı toplanana kadar tekrarlandı. (C) Solucan peleti, kalan kalıntıları ortadan kaldırmak için M9 ile üç kez yıkandı ve santrifüjlendi. Örnek temizlendikten sonra, solucan peleti 10 mL ddH2O. (D) olarak yeniden yaratıldı Solucan popülasyon boyutunu tahmin etmek için numunenin seri seyreltilmesi oluşturuldu. Solucanların doğru sayılmasına izin veren seyreltme faktörleri kullanılmıştır. Kullanılan seyreltme faktörleri LSCP'nin popülasyon büyüklüğüne bağlı olarak değişti. (E) Seyreltme faktörleri seçildikten sonra, bu seyreltmenin üç aliquot tekrarından tüm solucanlar temiz bir slayta pipetlendi ve solucanlar bir diseksiyon mikroskobu altında sayıldı. (F) Örnek uygun büyüklükte aliquotlara bölündü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
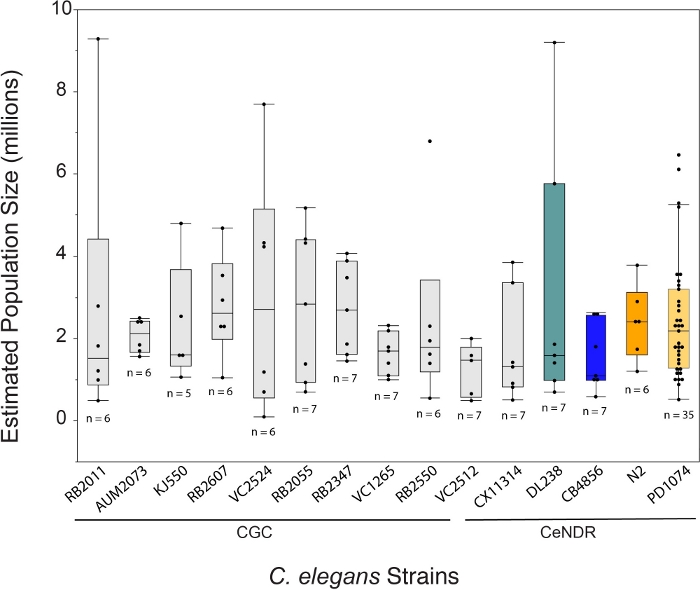
Şekil 3: Ortalama 2,4 milyon karma evre solucan popülasyonunda oluşturulan LSCP yöntemi. LSCP, en küçük nüfus artışlarında yaklaşık 94.500 ve en büyük nüfus artışlarında yaklaşık 9.290.000 nüfus büyüklüğüne sahiptir. Tüm suşlarda ortalama nüfus büyüklüğü 2,4 milyon solucandı. C. elegans strain adlarının altındaki çubuklar, bir suşunun CGC mutant mı yoksa CeNDR doğal izole mi olduğunu gösterir. Her gerinim için LSCP örnek boyutu görüntülenir. Tukey'in HSD Testi kullanılarak tüm çiftler için karşılaştırmalar yapıldı. C. elegans suşları (F(14.108) = 0.7, p = 0.77) genelinde tahmini nüfus büyüklükleri arasında anlamlı bir fark gözlenmedi. Renkli çubuklar, ilgili C. elegans gerinim gösterimi için standart renkli ekranları gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
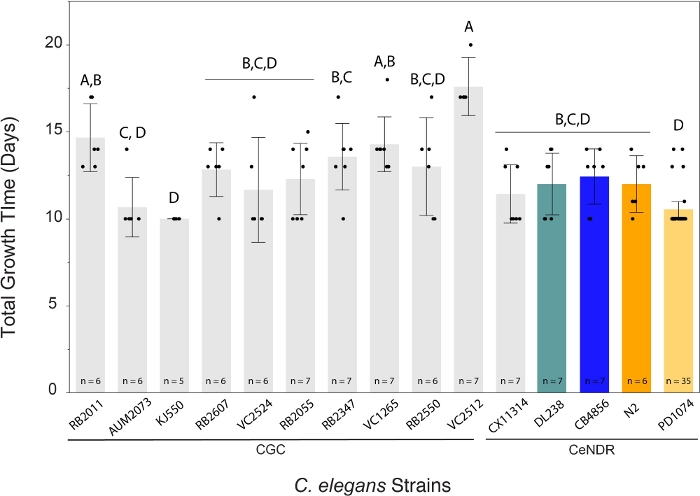
Şekil 4: LSCP yöntemi 10 - 20 gün içinde büyük karma aşama solucan popülasyonları oluşturdu. Belirli bir C. elegans LSCP, örnek yetişkin solucanlarla dolu olana, büyük bir nüfus büyüklüğüne ulaşana ve minimum bakteri çimi kalana kadar büyüdü. LSCP'lerin zorlanmaya bağlı olarak tam bir karma aşama popülasyona büyümesi 10 ila 20 gün sürdü. Suşlar boyunca ortalama büyüme süresi 12.2 gün idi. Her gerinim için LSCP örnek boyutu görüntülenir. Her hata çubuğu ortalamadan 1 standart sapma kullanılarak oluşturulmuş. Aynı harfle bağlanmayan düzeyler önemli ölçüde farklıdır. Tukey'in HSD Testini kullanan tüm çiftler için karşılaştırmalar. C. elegans suşlarında (F(14.108) = 8.8, s < 0.0001*) LSCP'de ihtiyaç duyulan büyüme süresi miktarında önemli bir fark bulunmuştur. Renkli çubuklar, ilgili C. elegans gerinim gösterimi için standart renkli ekranları gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
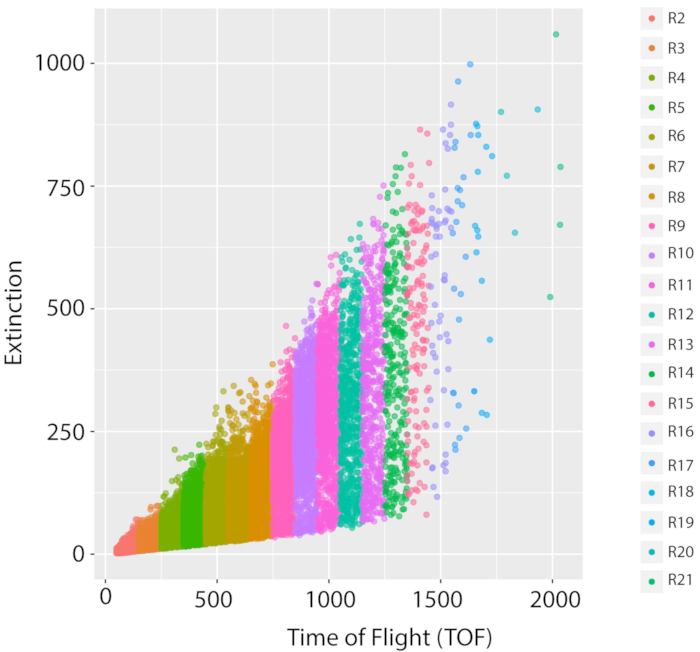
Şekil 5: Vahşi tip referans suşunun karışık popülasyonu ve büyüme ölçümü, PD1074. Orijinal N2 Bristol suşunun bir varyantı olan vahşi tip referans suşunun bir LSCP büyümesinin temsili LPFC dağılımı (PD1074), karma aşama popülasyonunun boyut dağılımını ve olay sayılarını belgelemektedir. X ekseni, sıralanan solucanların uzunluğunu (Uçuş Süresi, TOF) görüntüler. y ekseni, sıralanmış solucanların optik yoğunluğunu (optik yok olma, EXT) görüntüler. Her veri noktası, örnekte belgelenmiş bir solucandır. Görüntü analizi için kullanılan her TOF bölgesi farklı bir renkte görüntülenir. 50 ila 2050 tof arasında değişen yirmi TOF bölgesi (R2 – R21) oluşturuldu. Her TOF bölgesiyle ilgili ayrıntılar Ek Tablo 1'de bulunabilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
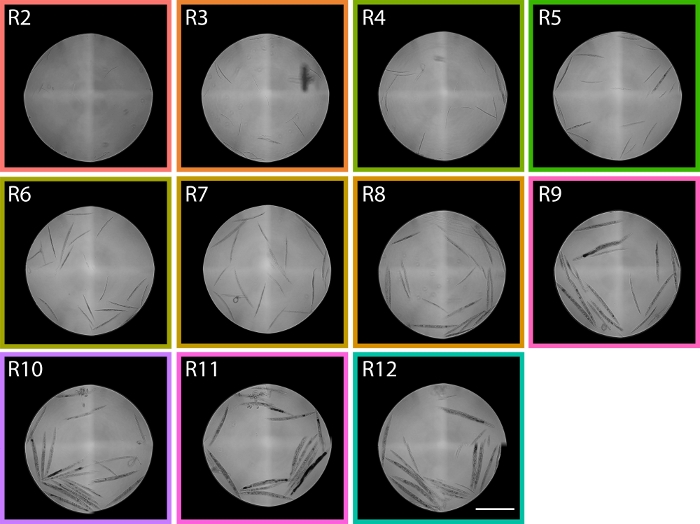
Şekil 6: R2 – R12 arasında değişen TOF bölgelerinden sıralanmış solucanların görüntüleri PD1074 LPFC dağılımını gösterir. R2 bölgesinde, L1 solucanları tanımlanabilir ve bölgede R9 ağırlıklı olarak gravid yetişkinler tanımlanır, bu da bize dağıtımda aşamaların beklendiği akış sitometresi dağılımı içinde yaklaşık bölgeler veren iki gelişimsel larva uçlarını kapsar. Ölçek çubuğu 1 mm'dir. Şekil 5'tegörüntülenen LPFC dağıtımından temsili görüntüler alınmıştır ve renkli kutular Şekil 5'tekibölgelere karşılık gelir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
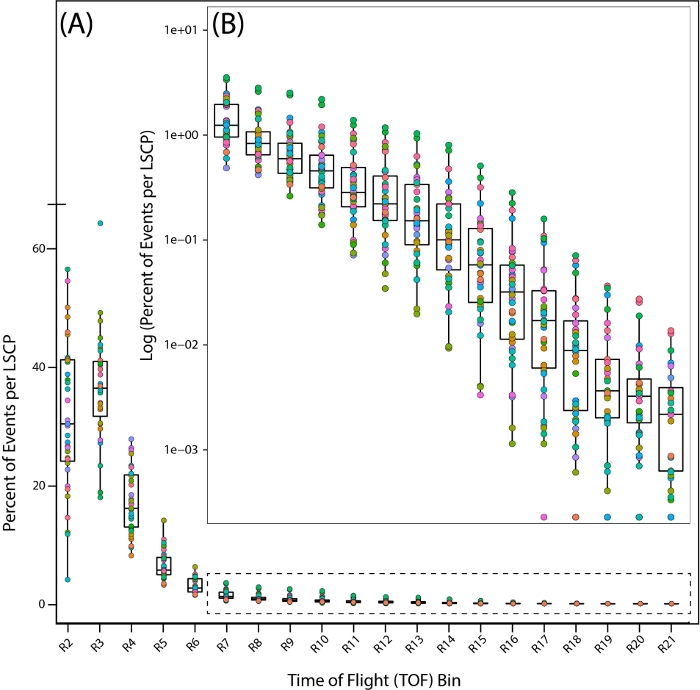
Şekil 7: Vahşi tip referans türü PD1074'teki uçuş zamanı (TOF) bölgeleri arasındaki nüfus dağılımı. Solucanların bulunduğu bölgeleri gösteren tüm TOF bölgesine solucanların dağılımı. Her PD1074 LSCP ayrı bir renk olarak temsil edilir. (A) X ekseni, LSCP için gözlemlenen ve sayılan yirmi TOF bölgesini (R2 – R21) gösterir ve tüm boyut dağılımını görüntüler. y ekseni, belirli bir TOF bölgesine düşen bir gövde boyutuna sahip belirli bir LSCP'den solucanların yüzdesini gösterir. (B) Solucan popülasyonunun daha küçük bir kısmı R7-R21 bölgeleri arasına düştüğü için, nüfus dağılımını görüntülemek için her bölgeye düşen solucanların yüzdesinin günlüğü alınmıştır. X ekseni R7-R21 TOF bölgelerini görüntüler. y ekseni, belirli bir TOF bölgesine düşen bir gövde boyutuna sahip belirli bir LSCP'den solucanların yüzdesinin günlüğünü görüntüler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: LSCP'nin yetiştirildiği ve işlenildiği büyüme koşullarının ortalama günlük sıcaklığı (°C). Kontrollü Sıcaklık (BT) odasının bildirilen sıcaklıkları, altı aylık numune büyüme ve toplama süresi boyunca belgelendi ve toplandı. Ortalama günlük sıcaklık burada bildirilmektedir. Proje süresince LCSP'nin büyüdüğü sıcaklık arasında anlamlı bir fark gözlenmedi (F(5,24) = 2,59, p = 0,0524). Tüm sıcaklık farkı, altı aylık numune büyüme ve üretim süresi boyunca 0,003 °C'den fazla değildi. Bu rakamı indirmek için lütfen tıklayınız.
Ek Tablo 1: Solucanları görüntüleme için 384 kuyu plakasına sıralamak için kullanılan TOF kapılı bölgeler. Binned bölgeleri, 50 - 2050 yılları arasında tüm TOF dağıtımı boyunca 100'lük bir TOF'a yayılmak üzere oluşturulmuştur. Kapılı bölgeler ihtiyaçlarınıza göre değiştirilebilir ve optimize edilebilir. Görüntü analizi için kullanılan her TOF bölgesi farklı bir renkte görüntülenir. Bu tabloyu indirmek için lütfen tıklayınız.
Tamamlayıcı Tablo 2: TOF bölgelerinin 384 kuyu plaka şablonu ve çoğaltma düzeni. Her örnek görüntüleme için 384 kuyu plakasına göre sıralandı. Sıralama için seçilen her bölge için dört çoğaltma oluşturuldu. Kapılı bölgeler ihtiyaçlarınıza göre değiştirilebilir ve optimize edilebilir. Bu iletişim kuralında oluşturulan ve kullanılan belirli geçişli bölgeler için Tamamlayıcı Tablo 1'e bakın. Görüntü analizi için kullanılan her TOF bölgesi farklı bir renkte görüntülenir. Bu tabloyu indirmek için lütfen tıklayınız.
Ek Tablo 3: Bu protokolde kullanılan C. elegans suşları CGC ve CeNDR suşlarının bir karışımını içerir. Gerinim, genotip, gerinim kaynağı ve ayrıntılar bu tabloda açıklanmıştır. Bu tabloyu indirmek için lütfen tıklayınız.
Tartışmalar
LSCP olarak çeşitli gemiler kullanılabilir. Bu protokolde standart bir cam fırın kabı kullanılmıştır. Kullanılan LSPC'ler 35,56 x 20,32 cm dış boyutlara, 27,94 x 17,78 cm iç boyutlara ve yaklaşık 4,45 cm derine sahipti ve takılı bir kapakla birlikte geldi. Böylece, burada kullanılan bakteri miktarı, büyük bir karma aşama solucan popülasyonu elde etmek için yukarıdaki boyutlara sahip bir LSCP için optimize edilmiştir. Bakteri hacmi ve konsantrasyonu deneysel ihtiyaçlara uyacak şekilde ayarlanabilir.
Küf, mantar veya diğer bakteri kaynakları tarafından kontaminasyon LSCP yönteminin herhangi bir adımında ortaya çıkabilir, bu nedenle numuneleri dikkatli bir şekilde kullanın. Protokolde herhangi bir adıma başlamadan önce, çalışma alanının% 70 etanol ve% 10 çamaşır suyu ile temizlendiğini sağlayın. Varsa, kullanılmış alanları 30 dakika boyunca UV ışığıyla tedavi edin ve her adımı başlatmadan önce 30 dakika önce hepa hava filtresini açın.
LSCP'yi kontrollü bir ortamda(yani20 °C'de ayarlanmış bir CT odasında) büyüterek, kullanıcı numunenin büyümesini daha kolay takip edebilir ve olası kontaminasyonu belgeleyebilir. LSCP'nin yüzeyi kirlenirse, mümkün olduğunda kontaminasyonu kesin ve kontaminasyonun kontrol edilmesi mümkün değilse numunenin büyümeye devam etmesine veya atılmasına izin verin. İstenmeyen büyümeyi azaltmak ve kaynaklar için solucanları geride kalmadığından emin olmak için kontaminasyonu hızlı bir şekilde ele almak zorunludur.
Bu yöntem, C. elegans'ınbüyük ölçekli karma nüfus kültürlerini büyütmek isteyenler içindir. LSCP'de, ticari olarak mevcut Petri yemeklerinde ve sıvı kültüründe olduğu gibi senkronize solucan popülasyonlarını büyütmek mümkün olsa da, yazarlar bu seçeneği test etmemişlerdir. Ayrıca, kullanıcılar belirli bir örnekte ortalama olarak yaklaşık 2,4 milyondan fazla solucan yetiştirmek istiyorlarsa, farklı bir yöntem önerilir4. Büyüme başarısı, boru hattında işlenen zorlanmaya bağlıdır. Yazarlar, yöntemin sağlam olduğunu gösteren 15 C. elegans suşunun en az beş biyolojik çoğaltmasında yaklaşık 2,4 milyon solucan popülasyonunu başarıyla büyütebildiler.
Deneye başlamadan önce, belirli bir solucanın yaşının ve sağlığının doğurganlığı ve sonraki nüfus artış süresini etkileyebileceğini unutmayın. Solucanların bu işlem hattında kullanılmadan önce en az stresle sağlıklı koşullarda muhafaza edildiklerinden emin olun. Zaman içinde genetik sürüklenmeyi azaltmak için stok örneklerinin oluşturulduğu, dondurulduğu ve -80 °C'de tutulduğu varsayılıyor.
Belirli bir deneyin ihtiyaçlarına bağlı olarak, LSCP'de gravid yetişkinlerin başlangıç sayısı değiştirilebilir. LSCP'deki başlangıç gravid yetişkinlerinin sayısını değiştirmek, büyüme hızını ve dolayısıyla hasat süresini değiştirecektir. Aşağıdaki nedenlerden dolayı her LSCP'nin tohumunu almak için beş gravid yetişkin kullanılır: (1) Birçok C. elegans suşunu LSCP'lere aynı anda tohumlamak için basit, hızlı ve verimli bir yol gerekiyordu ve (2) büyüme heterojenliğine yol açabilecek gravid yetişkinler arasındaki yaş farklarını azaltmak için.
Bu yöntem, kullanıcının tüm yaşam döngüsü aşamaları mevcut olan büyük solucan popülasyonlarını toplamasını sağlar. Mevcut yöntemlerle, büyük ölçekli C. elegans örneklerinin toplanması, aşağı akış çalışması için istenen solucan sayısını elde etmek için ağartıcı senkronizasyonu gerektirir. Bu yaklaşım göz önüne alındığında, artık çamaşır suyu senkronizasyonu ve çoklu elleçleme adımlarıyla ilgili zorluklar olmadan fermentörlerde veya büyük ölçekli sıvı kültürlerinde mümkün olduğunca çok solucan yetiştirilebilir. Protokolümüz, ilgi suşlarını verimli bir şekilde hedeflemeye, numunenin kendisini büyütmede minimum işlem süresini kullanmaya ve solucanların veya popülasyonun aşamalarını aşağı akış boru hatlarında gerektiği gibi izole etmeye izin verir.
LPFC, belirli bir LSCP'deki nüfus dağılımını ve boyutunu belgeleme aracı olarak kullanılmıştır. Kullanılan LPFC, solucanları boyutlarına (TOF) ve optik yoğunluğa göre analiz eden, sıralayan ve dağıtan sürekli bir akış sistemidir. Belirli bir solucan akış hücresinden geçerken, eksenel ışık kaybı dedektörü, bir solucanın geçmesi için gereken süre boyunca 488 nm-solid durum lazeri tarafından engellenen sinyal ışığı miktarını yakalar ve kullanıcıya solucanın TOF'sini ve optik yoğunluğunu verir. Floresan toplama optikleri ve dedektörleri, her numunede floresan hassasiyetini ve koleksiyonunu en üst düzeye çıkarmak için de kullanılabilir. LPFC toplama parametreleri enstrümana göre değişir. Kullanıcılar solucan boyutunu yakalamak için çeşitli platformlar kullanabilir ve bir LPFC yoksa bu protokolü kullanmakla sınırlı değildir.
Yazarlar, Sıvı Kromatografi – Kütle Spektrometresi, NMR spektroskopisi ve RNA dizilimi yoluyla C. elegans'ın çeşitli suşlarındaki bilinmeyen metabolitleri tanımlamak için burada açıklanan yöntemde yetiştirilen örnekleri kullanmaktadır. Yazarlar, bu boru hattı kullanılarak kolayca yeni ilgi suşları işlenebildiğinden, bu boru hattındaki örneklerin çeşitli C. elegans suşlarıyla büyümesi için bu yöntemi kullanmaya devam etmeyi planlıyorlar.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Edison Lab üyelerine bu makale hakkında yararlı tartışmalar ve geri bildirimler için teşekkür ederiz; Özellikle, B.M Garcia. Bazı suşlar NIH Araştırma Altyapı Programları Ofisi (P40 OD010440) tarafından finanse edilen CGC ve NSF Living Collections CSBR 1930382 tarafından finanse edilen CeNDR tarafından sağlanmıştır. Bu çalışma NIH'den (U2CES030167) bir hibe ile desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10 mL Sterile Serological Pipettes | VWR | 89130-898 | |
| 10 ul pipette tips | VWR | 89079-438 | |
| 100 ul pipette tips | VWR | 89079-442 | |
| 1000 mL Graduated Cylinder | VWR | 10124-380 | |
| 1000 ul pipette tips | VWR | 89079-488 | |
| 15 mL conical tubes | VWR | 89039-668 | |
| 190 Proof Ethanol | VWR | 89125-166 | |
| 2 L Wide Neck Erlenmeyer Flask | VWR | 75804-654 | |
| 50 mL conical tubes | VWR | 75874-294 | |
| Agar | Sigma | 05040-100G | |
| Agarose | Sigma | A9539-500G | |
| BVC Control G Fluid Aspiration System | Vacuubrand | ||
| Calcium Chloride | Sigma | 449709-10G | |
| Cholesterol | Sigma | C3045-25G | |
| Clorox Bleach | VWR | 89414-502 | |
| Conviron Control Temperature Room | Conviron | https://www.conviron.com/environmental-rooms | |
| Corning Low Volume 384 Well Black with Clear Flat Bottom Polystyrene TC-Treated Microplate | VWR | 89089-866 | |
| Fisher Scientific Accuspin 3R | Fisher | ||
| Flat-Bottom 24-Well Plate | VWR | 29443-952 | |
| Honeywell True HEPA Purifier 465 sq ft. | Home Depot | 204390560 | |
| HT115 E. coli (DE3) | CGC | HT115(DE3) | https://cgc.umn.edu/strain/HT115(DE3) |
| Kimwipes | VWR | 470224-038 | |
| Large Scale Culture Plate (LSCP) | Pyrex | 1090948 | Pyrex 2-quart Glass Baking Dish with Red Lid |
| Magnesium Sulfate | Sigma | C86677-25G | |
| MgSO4 | VWR | 97062-998 | |
| Microscope Plain Slides | VWR | 16004-422 | |
| Millipore Filter | Millipore | 1.11727.2500 | |
| Molecular Devices ImageXpress | Molecular Devices | Model Number:IXMConfocal | https://www.moleculardevices.com/products/cellular-imaging-systems/high-content-imaging/imagexpress-micro-confocal#gref , Authors used MetaXpress Software Version 6.5.4.532 |
| Nystatin (10mg/mL) | Sigma | N6261-25MU | |
| Peptone | Sigma | P7750-100G | |
| Petri Dishes (6 cm) | VWR | 25384-092 | |
| Pipette Controller | VWR | 613-4180 | |
| Potassium Chloride | Fisher | P217-3 | |
| Potassium Phosphate Monobasic | VWR | 0781-500G | |
| Potasssium Hydroxide | Fisher | P250-500 | |
| Red Fluroscent Microspheres | Polysciences | 19507-5 | |
| Sodium Chloride | Sigma | 746398-500G | |
| Sodium Hydroxide | Fisher | 111357 | |
| Sodium Phosphate Dibasic Anhydrous | Fisher | BP332-500 | |
| Standard Gilson Pipette Set | Gilson | FA10002M, FA10004M, FA10006M | |
| Streptomycin (100mg/mL) | Sigma | S6501-25G | |
| Union Biometrica COPAS BioSorter | Union Biometrica | https://www.unionbio.com/biosorter/ , authors used: Flow Pilot software version 1.6.1.3. |
Referanslar
- Félix, M. A., Braendle, C. The natural history of Caenorhabditis elegans. Current Biology. 20 (22), 965-969 (2010).
- Corsi, A. K. A Transparent window into biology: A primer on Caenorhabditis elegans. WormBook. , 1-31 (2015).
- Brenner, S. The genetics of behaviour. British Medical Bulletin. 29 (3), 269-271 (1973).
- Stiernagle, T. Maintenance of C. elegans. WormBook: The Online Review of C. elegans Biology. , (2006).
- Xiong, H., Pears, C., Woollard, A. An enhanced C. elegans based platform for toxicity assessment. Scientific Reports. 7 (1), 9839 (2017).
- Loer, C. M., et al. Cuticle integrity and biogenic amine synthesis in Caenorhabditis elegans require the cofactor tetrahydrobiopterin (BH4). Genetics. 200 (1), 237-253 (2015).
- Li, Y., Paik, Y. K. A potential role for fatty acid biosynthesis genes during molting and cuticle formation in Caenorhabditis elegans. BMB Reports. 44 (4), 285-290 (2011).
- Meli, V. S., Osuna, B., Ruvkun, G., Frand, A. R. MLT-10 Defines a Family of DUF644 and Proline-rich Repeat Proteins Involved in the Molting Cycle of Caenorhabditis elegans. Molecular Biology of the Cell. 21 (10), 1648-1661 (2010).
- Fritz, J. A., Behm, C. A. CUTI-1: A novel tetraspan protein involved in C. elegans CUTicle formation and epithelial integrity. PloS One. 4 (4), 5117 (2009).
- Golden, J., Riddle, D. A pheromone influences larval development in the nematode Caenorhabditis elegans. Science. 218 (4572), 578-580 (1982).
- Jeong, P. Y., et al. Chemical structure and biological activity of the Caenorhabditis elegans dauer-inducing pheromone. Nature. 433 (7025), 541-545 (2005).
- Srinivasan, J., et al. A blend of small molecules regulates both mating and development in Caenorhabditis elegans. Nature. 454 (7208), 1115-1118 (2008).
- Kaplan, F., et al. Ascaroside Expression in Caenorhabditis elegans Is Strongly Dependent on Diet and Developmental Stage. PLoS One. 6 (3), 17804 (2011).
- Golden, J., Riddle, D. A pheromone influences larval development in the nematode Caenorhabditis elegans. Science. 218 (4572), 578-580 (1982).
- Çelen, &. #. 3. 0. 4. ;., Doh, J. H., Sabanayagam, C. R. Effects of liquid cultivation on gene expression and phenotype of C. elegans. BMC Genomics. 19 (1), 562 (2018).
- Andersen, E. C., Bloom, J. S., Gerke, J. P., Kruglyak, L. A Variant in the Neuropeptide Receptor npr-1 is a Major Determinant of Caenorhabditis elegans Growth and Physiology. PLoS Genetics. 10 (2), 1004156 (2014).
- Rosenblatt, M. A central limit theorem and a strong mixing condition. Proceedings of the National Academy of Sciences. 42 (1), 43-47 (1956).
- Boyd, W. A., Smith, M. V., Freedman, J. H. Caenorhabditis elegans as a model in developmental toxicology. Methods in Molecular Biology. 889, 15-24 (2012).
- Nika, L., Gibson, T., Konkus, R., Karp, X. Fluorescent Beads Are a Versatile Tool for Staging Caenorhabditis elegans in Different Life Histories. Genes, Genomes, Genetics. 6 (7), 1923-1933 (2016).
- Denver, D. R., Morris, K., Streelman, J. T., Kim, S. K., Lynch, M., Thomas, W. K. The transcriptional consequences of mutation and natural selection in Caenorhabditis elegans. Nature Genetics. 37 (5), 544-548 (2005).
- Massie, M. R., Lapoczka, E. M., Boggs, K. D., Stine, K. E., White, G. E. Exposure to the metabolic inhibitor sodium azide induces stress protein expression and thermotolerance in the nematode Caenorhabditis elegans. Cell Stress & Chaperones. 8 (1), 1-7 (2003).
- Kevin, S., Pulak, R., Strange, K. Techniques for Analysis, Sorting, and Dispensing of C. elegans on the COPAS Flow-Sorting System. C. elegans. Methods in Molecular Biology. 351, 275-286 (2006).
- Lee, D., et al. Selection and gene flow shape niche-associated variation in pheromone response. Nature Ecology & Evolution. 3 (10), 1455-1463 (2019).
- Cook, D. E., Zdraljevic, S., Roberts, J. P., Andersen, E. C. CeNDR, the Caenorhabditis elegans natural diversity resource. Nucleic Acids Research. 45, 650-657 (2016).
- Nika, L., Gibson, T., Konkus, R., Karp, X. Fluorescent Beads Are a Versatile Tool for Staging Caenorhabditis elegans in Different Life Histories. Genes, Genomes, Genetics. 6 (7), 1923-1933 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır